Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Évaluation préalable pour le Défi concernant
l'isoprène
Numéro de registre du Chemical Abstracts Service
78-79-5
Environnement Canada
Santé Canada
Novembre 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Valeurs estimées de la limite supérieure de l'absorption quotidienne d'isoprène par la population générale du Canada (µg/kg p.c./j pour divers groupes d'âge)
- Annexe 2 : Résumé des renseignements concernant les effets de l'isoprène sur la santé
Synopsis
En application de l'article 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)], les ministres de l'Environnement et de la Santé ont effectué une évaluation préalable de l'isoprène, dont le numéro de registre du Chemical Abstracts Service (CAS) est le 78-79-5. Une priorité élevée a été accordée à la prise de mesures à l'égard de cette substance lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi lancé par les ministres, car on considère qu'elle présente le plus fort risque d'exposition (PFRE) pour les particuliers au Canada et elle a été classée par d'autres organismes sur la base de ses effets cancérogènes et mutagènes. Comme l'isoprène ne satisfaisait pas aux critères de la persistance, de la bioaccumulation et de la toxicité intrinsèque pour les organismes aquatiques, la présente évaluation est surtout axée sur les aspects relatifs à la santé humaine.
Selon les renseignements déclarés conformément à l'article 71 de la LCPE (1999), la quantité totale d'isoprène fabriquée au Canada en 2006 était supérieure à 10 000 000 kg et la quantité totale importée se situait entre 1 000 000 et 10 000 000 kg. Cette substance est surtout utilisée comme monomère de départ dans la fabrication du polyisoprène, du caoutchouc butyle et du caoutchouc styrène-isoprène-styrène (SIS). Le polyisoprène est à son tour utilisé dans la fabrication de pneus et une grande variété de produits comprenant des résines de peinture, des chaussures, des adhésifs et des biens modelés. Le caoutchouc butyle sert surtout à la fabrication de chambres à air et le caoutchouc SIS est employé dans la fabrication d'adhésifs sensibles à la pression. Isoprène est également utilisé dans la composition des agents améliorant la viscosité de l'huile moteur.et dans la production agrochimique et pharmaceutique ainsi que dans d'autres substances.
L'isoprène est rejeté dans l'environnement par des sources naturelles et anthropiques et la principale voie d'exposition de la population générale à cette substance est sans doute par inhalation de l'air ambiant et intérieur. Le dégagement d'isoprène gazeux à partir de produits de consommation fabriqués en polyisoprène pourrait aussi contribuer aux concentrations de cette substance notées dans l'air intérieur.
En se fondant principalement sur des évaluations reposant sur le poids de la preuve réalisées par plusieurs organismes nationaux et internationaux, il appert que la cancérogénicité est un effet critique pour la caractérisation du risque pour la santé humaine, cette conclusion reposant sur l'observation de tumeurs dans de nombreux organes du rat et de la souris. L'isoprène s'est aussi avéré génotoxique au cours de plusieurs essais in vivo. Par conséquent, et même si le mode d'action n'a pas été complètement élucidé, on ne peut exclure la possibilité que les tumeurs observées chez les animaux de laboratoire résultent d'une interaction directe avec le matériel génétique.
En raison de la cancérogénicité, pour laquelle il peut exister une probabilité d'effet nocif à tout niveau d'exposition, et du manque de fiabilité possible de la marge entre les concentrations d'isoprène dans l'air intérieur et les concentrations associées à des effets autres que le cancer du thymus, observés lors d'une étude de toxicité subchronique, l'isoprène est considéré comme une substance pouvant pénétrer dans l'environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaines.
D'après le faible risque écologique que présente l'isoprène, il est proposé de conclure que cette substance ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie. L'isoprène n'est pas persistant dans l'air, l'eau, le sol et les sédiments et n'est pas bioaccumulable au sens des critères énoncés dans le Règlement sur la persistance et la bioaccumulation.
De plus, des activités de recherche et de surveillance viendront, s'il y a lieu, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable et, le cas échéant, l'efficacité des possibles mesures de contrôle définies à l'étape de la gestion des risques.
D'après les renseignements disponibles, l'isoprène répond à au moins un des critères énoncés à l'article 64 de la Loi canadienne sur la protection de l'environnement (1999).
Introduction
La Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l'Environnement et de la Santé de procéder à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi pour déterminer si ces substances présentent ou pourraient présenter un risque pour l'environnement ou la santé humaine. Selon les résultats de cette évaluation, les ministres peuvent décider de ne rien faire à l'égard de la substance, l'inscrire sur la Liste des substances d'intérêt prioritaire en vue d'une évaluation plus détaillée, recommander son inscription sur la Liste des substances toxiques de l'annexe 1 de la Loi et, s'il y a lieu, la quasi-élimination de ses rejets dans l'environnement.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque (Ti) pour les organismes aquatiques, et que l'on croit être commercialisées;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine à la lumière de leur classement par d'autres organismes nationaux ou internationaux quant à la cancérogénicité, à la génotoxicité ou à la toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada, 2006), dans lequel ils ont mis au défi l'industrie et les autres intervenants intéressés de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer comparativement les meilleures pratiques de gestion des risques et de gérance des produits pour ces substances jugées hautement prioritaires.
L'isoprène (1,3-butadiène, 2-méthyle) est une substance dont l'évaluation des risques pour la santé humaine a été jugée hautement prioritaire, car on considère qu'il présente un REI et il a été classé par d'autres organismes sur la base de sa cancérogénicité et de sa génotoxicité. Le volet du Défi portant sur l'isoprène a été lancé au moyen d'un avis paru dans la Gazette du Canada le 12 mai 2007 (Canada 2007). En même temps a été publié le profil de cette substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. De nouveaux renseignements sur la substance ont été communiqués en réponse au Défi.
Même si l'évaluation des risques que présente l'isoprène pour la santé humaine est jugée hautement prioritaire, cette substance ne répond pas aux critères relatifs à la persistance, au potentiel de bioaccumulation ou à la toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l'accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques au sens de l'article 64 de la Loi :
64. [...] est toxique toute substance qui pénètre ou peut pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions de nature à :
a) avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique;
b) mettre en danger l'environnement essentiel pour la vie;
c) constituer un danger au Canada pour la vie ou la santé humaines.
Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente ébauche d'évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations et l'exposition, y compris ceux fournis dans le cadre du Défi. Les données pertinentes pour l'évaluation préalable de l'isoprène ont été relevées dans des publications originales, des rapports de synthèse et d'évaluation, des rapports de recherche de parties intéressées et d'autres documents consultés lors de recherches documentaires menées récemment, jusqu'en février 2008 (effets sur la santé humaine). Les études importantes ont fait l'objet d'une évaluation critique; les résultats de la modélisation ont pu être utilisés dans la formulation des conclusions. L'évaluation des risques pour la santé humaine comprend l'examen de données pertinentes pour l'évaluation de l'exposition (non professionnelle) de la population dans son ensemble ainsi que de l'information sur les dangers pour la santé (surtout fondée sur des évaluations réalisées par d'autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions reposent sur la nature de l'effet critique retenu ou sur l'écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets, cela dans le contexte d'une évaluation préalable. L'évaluation préalable réalisée dans le cadre du Défi ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s'agit plutôt d'un sommaire des éléments d'information les plus importants pour appuyer la conclusion proposée.
La présente ébauche d'évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement Canada et intègre les résultats d'autres programmes exécutés par ces ministères. Cette évaluation préalable a fait l'objet d'une consultation indépendante par des pairs. Des commentaires sur les parties techniques touchant la santé humaine ont été formulés par des experts scientifiques choisis et dirigés par le Toxicology Excellence for Risk Assessment (TERA), notamment John Christopher (California Department of Toxic Substances Control), Michael Jayjock (The LifeLine Group) et Wendy Heiger-Bernays (The Science Collaborative and Boston University). Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable. De plus, une version provisoire de la présente évaluation préalable a fait l'objet d'une consultation publique de 60 jours.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Identité de la substance
Aux fins du présent rapport, la substance est appelée isoprène.
| Numéro de registre du Chemical Abstracts Service (N° CAS) | 78-79-5 |
| Nom dans la LIS | isoprène |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | 1,3-butadiene, 2-methyl- (TSCA, ENCS, AICS, SWISS, PICCS, ASIA-PAC, NZIoC) isoprène (EINECS) isoprene (PICCS) 2-methyl-1,3-butadiene (ECL) BUTA-1,3-DIENE, 2-METHYL- (PICCS) |
| Autres noms | ß-methylbivinyl 2-methylbutadiene 3-methyl-1,3-butadiene isopentadiene |
| Groupe chimique (Groupe de la LIS) | produits chimiques organiques |
| Formule chimique | C5 H8 |
| Structure chimique | 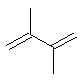 |
| Simplified Molecular Input Line Entry (SMILES) | C(C=C)(C)=C |
| Masse moléculaire | 68,12 g/mole |
[1] National Chemical Inventories (NCI), 2007 : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique); ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); NZloC (inventaire des substances chimiques de la Nouvelle-Zélande); SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis).
Propriétés physiques et chimiques
Un résumé des principales propriétés physiques et chimiques de l'isoprène est présenté dans le tableau 2. À la température ambiante, l'isoprène est un liquide transparent incolore. Il est inflammable, fortement réactif et peut se polymériser de façon explosive s'il est chauffé.
| Propriété | Valeur | Appréciation | Référence |
|---|---|---|---|
| Point de fusion (°C) | -145,9 | HSDB, 2008 | |
| Point d'ébullition (°C) | 34,1 | HSDB, 2008 | |
| Masse volumique (g/mL à 20 °C) | 0,68 | Merck, 1996 | |
| Pression de vapeur (Pa) | 73 327[1] | très élevée | HSDB, 2008 |
| Constante de la loi de Henry (atm·m3/mole) | 0,077 | très élevée | HSDB, 2008 |
| Solubilité dans l'eau (mg/L) | 642 | modérée | HSDB, 2008 |
| Log Koe (coefficient de partage octanol/eau) [sans dimension] | 2,42 | faible | HSDB, 2008 |
| Log Kco (coefficient de partage carbone organique/eau) [sans dimension] | 2,69 | modéré | HSDB, 2008 |
[1] Convertie à partir de 550 mm Hg.
Sources
L'isoprène est un composé organique volatil biogène naturellement rejeté dans l'atmosphère par diverses espèces végétales, dont des arbres (Zimmer et al., 2000). Les plantes d'intérieur pourraient aussi être une source d'exposition, mais aucune donnée pertinente n'a été relevée à cet égard. De l'isoprène est aussi formé de façon endogène chez les humains et il constitue généralement le principal hydrocarbure présent dans l'haleine (Gelmont et al., 1981). La fabrication du caoutchouc synthétique et d'autres élastomères donne lieu à des rejets anthropiques de cette substance (Lewis, 1997). L'abrasion du caoutchouc peut aussi être à l'origine du rejet d'isoprène dans l'environnement (Graedel, 1986).
La transformation du bois en pâte et la combustion du pétrole, du bois dans les poêles et les foyers ou d'autres produits de la biomasse sont d'autres sources de rejets d'isoprène. On en retrouve aussi dans l'essence, la fumée de cigarette et les gaz d'échappement des turbines et des automobiles (HSDB, 2008).
Selon les renseignements fournis conformément à l'avis relatif à l'isoprène émis en vertu de l'article 71 de la LCPE (1999), des entreprises canadiennes ont déclaré avoir fabriqué cette substance en une quantité supérieure à 10 000 000 kg et en avoir importé une quantité se situant entre 1 000 000 et 10 000 000 kg pendant l'année civile 2006 (Canada, 2007b). Toutefois, plus de 10 000 000 de kg ont été exportés au cours de la même année civile (Environnement Canada, 2007a).
Utilisations
Le polyisoprène est à son tour utilisé dans la fabrication de pneus et d'une grande variété de produits comprenant des équipements médicaux, des jouets, des semelles de chaussures, des pellicules et des fils élastiques pour les textiles et les balles de golf, des adhésifs, des peintures et des revêtements, tandis que le caoutchouc butyle sert surtout à la fabrication de chambres à air et le caoutchouc styrène-isoprène-styrène est employé dans la fabrication d'adhésifs sensibles à la pression (Environnement Canada 2007a; IARC 1999; OCDE 2005). L'isoprène est également utilisé dans la composition des agents améliorant la viscosité de l'huile à moteur et dans la production agrochimique et pharmaceutique ainsi que dans d'autres substances (Shell 2008). L'isoprène peut aussi servir à la préparation d'améliorateurs de viscosité et à la production de produits agrochimiques et pharmaceutiques ou d'autres produits chimiques (Shell, 2008).
Au Canada, on trouve un grand nombre de produits cosmétiques à base de polyisoprène ou de divers copolymères (p. ex. styrène/isoprène, isoprène/pentadiène), mais il n'existe pas de renseignements sur la teneur en isoprène n'ayant pas réagi dans ces produits (selon le courriel de la Direction générale des cosmétiques, daté du 9 juin 2008). Le caoutchouc butyle est également utilisé pour les joints d'étanchéité des boîtes de conserve, les anneaux d'étanchéité des bouchons des bouteilles, les revêtements de pellicules de plastique, et le scellement de joints de sertis supérieurs dans l'industrie de l'emballage, conformément aux bonnes pratiques de fabrication (BPF) où tout contact avec les aliments est imprévu (selon un courriel de la Direction générale des produits de santé et des aliments, daté du 15 février 2008).
Rejets dans l'environnement
L'isoprène est une substance qui existe à l'état naturel et qui est continuellement rejetée dans l'atmosphère par les cultures agricoles, les arbres et d'autres végétaux. Il constitue aussi l'élément structurel de base d'un grand nombre de produits naturels, notamment les terpènes et les vitamines A et K (CIRC, 1994). Les rejets mondiaux totaux d'isoprène estimés se situent entre 1,75 et 5,03 × 1011 kg de C par an, ce qui correspond à une proportion de 44 à 51 p. 100 environ des rejets mondiaux totaux de composés organiques volatils de sources naturelles (Guenther et al., 1995).
Les rejets anthropiques d'isoprène résultant de la production d'éthylène par craquage du naphte et d'autres activités industrielles comportant son utilisation (p. ex., la fabrication du polyisoprène) sont très inférieurs aux rejets naturels. Selon l'Inventaire national des rejets de polluants (INRP), les rejets atmosphériques d'isoprène des installations industrielles au Canada sont passés de 54 900 kg, en 2000, à 14 500 kg, en 2006. Aucun rejet dans l'eau ou le sol n'a été déclaré (INRP, 2006). Les renseignements recueillis récemment à la suite d'un avis concernant l'isoprène publié en vertu de l'article 71 de la LCPE (1999) indiquent que cette substance a été rejetée dans l'air en une quantité supérieure à 10 000 kg en 2006 (Environnement Canada, 2007a).
Devenir dans l'environnement
À cause de sa pression de vapeur très élevée (73 327 Pa) et de son faible point d'ébullition, 34°C, l'isoprène ne devrait exister que sous forme gazeuse dans l'atmosphère où il devrait être dégradé par réaction avec des radicaux hydroxyles d'origine photochimique, des molécules d'ozone et des radicaux nitrates. Les demi-vies estimées pour les réactions atmosphériques avec les radicaux hydroxyles et les molécules d'ozone sont de 4 et de 19 heures, respectivement (HSDB, 2007).
S'il était rejeté dans l'eau, l'isoprène devrait se volatiliser à partir de la surface d'après la constante de la loi de Henry très élevée. Ses demi-vies par volatilisation ont été estimées respectivement à une et 78 heures par modélisation d'un cours d'eau et d'un lac (HSDB, 2007). S'il était rejeté dans le sol, l'isoprène devrait être modérément mobile d'après son log Kco estimé à 2,69. La volatilisation à partir des surfaces de sol humides devrait constituer un important processus de son devenir d'après la constante estimée de la loi de Henry de 0,077 atm·m3/mole. Selon la valeur estimée du Kco, l'isoprène ne devrait pas s'adsorber sur les matières en suspension et les sédiments (HSDB, 2008).
Persistance et potentiel de bioaccumulation
Persistance dans l'environnement
Une fois rejeté dans l'environnement, l'isoprène devrait se dégrader de façon appréciable dans tous les milieux. Les demi-vies expérimentales de 0,11 jour pour la photodégradation et de 0,8 jour pour la réaction avec l'ozone atmosphérique (Atkinson, 1989) montrent que cette substance se dégrade relativement rapidement et qu'elle ne satisfait donc pas au critère de la persistance dans l'air (demi-vie ≥ 2 jours) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000a).
Une méthode du poids de la preuve fondée sur des relations quantitatives structure-activité (RQSA) [Environnement Canada, 2007b] a été utilisée pour prévoir sa persistance dans l'eau (tableau 3). On peut conclure, sur la base des demi-vies prévues et de la valeur de la biodégradation dans l'eau, que l'isoprène n'est pas persistant dans l'eau (demi-vie ≥ 182 jours). La valeur prévue de la demi-vie pour la biodégradation dans l'eau, de 15 jours, a été utilisée pour prévoir la demi-vie de la substance dans le sol et les sédiments à l'aide des facteurs d'extrapolation de Boethling (t1/2 eau : t1/2 sol : t1/2 sédiments = 1 : 1 : 4) [Boethlinget al., 1995]. Ces valeurs permettent de conclure que cette substance ne satisfait pas aux critères de la persistance dans l'eau et le sol (demi-vie ≥ 182 jours) et les sédiments (demi-vie ≥ 365 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000a).
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre de dégradation | Référence |
|---|---|---|---|---|
| Eau | biodégradation | 15 | demi-vie, jours | BIOWIN, 2000, Ultimate survey |
| Eau | biodégradation | 0,67 | probabilité | BIOWIN, 2000, MITI Non-linear Probability |
| Eau | biodégradation | 0,54 | probabilité | BIOWIN, 2000, MITI Linear Probability |
| Eau | hydrolyse | s.o.[1] | demi-vie, jours | HYDROWIN, 2000 |
[1] Une vitesse d'hydrolyse ne pouvant être estimée pour ce type de composé, l'hydrolyse n'a pas été prise en compte pour la détermination de la persistance de la substance.
Potentiel de bioaccumulation
Les log Koe expérimentaux et modélisés de 2,42 et 2,58, respectivement, indiquent que le potentiel de bioaccumulation de l'isoprène est sans doute relativement faible. Les valeurs expérimentales de la bioconcentration (FBC) chez le poisson se situent entre 9,5 et 12,9 L/kg (MITI, 1992) et les valeurs modélisées de la bioaccumulation et de la bioconcentration se situent entre 6,3 et 117 L/kg (tableau 4). L'isoprène ne satisfait donc pas au critère de la bioaccumulation (FBC ou FBA ≥ 5 000) du Règlement sur la persistance et la bioaccumulation (Canada, 2000a).
| Organisme d'essai | Paramètre | Valeur [L/kg (poids humide)] | Référence |
|---|---|---|---|
| Poisson | FBA[1] | 6,3 | Gobas BAF T2MTL (Arnot et Gobas, 2003) |
| Poisson | FBC[2] | 5,9 | Gobas BCF T2LTL (Arnot et Gobas, 2003) |
| Poisson | FBC | 117 | OASIS Forecast, 2005 |
| Poisson | FBC | 14,6 | BCFWIN, 2000 |
[1] Facteur de bioaccumulation
[2] Facteur de bioconcentration
Potentiel d'effets nocifs sur l'environnement
Tel qu'indiqué précédemment, l'isoprène ne satisfait pas au critère de la persistance dans l'air, l'eau, le sol et les sédiments ni au critère du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000a).
Les données écotoxicologiques obtenues de façon expérimentale (base de données ECOTOX) indiquent que l'isoprène n'a pas d'effets nocifs significatifs chez les organismes aquatiques quand il est présent en faibles concentrations. Chez quatre espèces de poisson, la CL50 aiguë se situe dans la fourchette de 42,54 à 240 mg/L.
L'INRP signale que les rejets atmosphériques d'isoprène des installations industrielles du Canada ont diminué pour passer de 54 900 kg, en 2000, à 14 500 kg, en 2006. Aucun rejet dans l'eau ou le sol n'a été déclaré (INRP, 2006). Selon des renseignements recueillis récemment à la suite d'un avis publié en vertu de l'article 71 de la LCPE (1999)[Environnement Canada, 2007a], des entreprises ont déclaré avoir rejeté de l'isoprène dans l'air, et seulement dans ce milieu, en une quantité supérieure à 10 000 kg en 2006. La quantité et la nature des rejets font qu'il est peu probable qu'ils soient à l'origine d'une exposition appréciable des organismes présents dans l'environnement.
Selon les renseignements disponibles, on peut conclure qu'il est peu probable que l'isoprène ait des effets écologiques nocifs au Canada.
Potentiel d'effets nocifs sur la santé humaine
Évaluation de l'exposition
L'annexe 1 présente, pour chaque groupe d'âge de la population générale du Canada, les limites supérieures estimées de l'absorption de l'isoprène déterminées à partir des concentrations maximales de la substance mesurées dans l'air intérieur et extérieur, et des données pour un type de boisson. Ces limites supérieures estimées de l'absorption varient entre 5,6 μg/kg p.c./j (poids corporel par jour) [personnes âgées de 60 ans et plus] et 16,8 μg/kg p.c./j (enfants de 0,5 à 4 ans). Selon ces estimations, l'air intérieur constitue la plus importante source d'exposition à l'isoprène dans l'environnement chez tous les groupes d'âge de la population générale du Canada, et représente 95 p. 100 environ de l'exposition totale. L'air ambiant est la deuxième source d'exposition en importance et il existait peu de données sur les boissons permettant d'estimer l'absorption à partir des aliments. Aucune donnée sur les concentrations d'isoprène dans l'eau potable et le sol n'a été relevée; la contribution de ces milieux devrait toutefois être négligeable en comparaison de la contribution de l'air, d'après l'information sur les propriétés physiques et chimiques, les utilisations et les rejets de la substance.
L'isoprène est le principal hydrocarbure insaturé présent dans la fumée de cigarette secondaire et une production moyenne de 3 100 μg par cigarette a été mesurée au cours d'un essai en enceinte (Lofroth et al., 1989). Santé Canada a effectué un suivi de la fumée du tabac provenant des cigarettes vendues au Canada depuis 30 ans. D'après ce programme de surveillance, les données des émissions des cigarettes vendues au Canada en 2004 faisaient état de niveaux d'isoprène allant de 30 à 397 μg/cigarette dans la fumée principale des cigarettes canadiennes évaluée selon les conditions des normes ISO et de niveaux allant de 395 à 864 μg/cigarette dans des conditions modifiées d'utilisation de tabac. De plus, les niveaux d'isoprène trouvés dans la fumée secondaire étaient situés entre 90 et 3194 μg/cigarette (tel que mentionnés dans un courriel du Direction de la lutte au tabagisme, le 29 juillet 2008).On a signalé dans une autre étude que l'isoprène constituait 16,7 p. 100 des hydrocarbures C2-C8 présents dans l'air d'un café enfumé de la Suède (Barrefors et Petersson, 1993). En outre, au cours d'une étude de surveillance réalisée dans des habitations et des lieux de travail de la région de Philadelphie (Pennsylvanie), on a mesuré des concentrations moyennes d'isoprène dans des échantillons d'air individuels variant de 4,65 µg/m3, dans des habitations de non-fumeurs, à 18,2 µg/m3, dans celles où se trouvaient des fumeurs, et de 5,29 µg/m3, dans des lieux de travail sans fumeurs, à 22,8 µg/m3, dans des lieux de travail où se trouvaient des fumeurs. Cette augmentation d'un facteur d'environ quatre entre les milieux sans fumeurs et ceux avec fumeurs était très significative (Heavner et al., 1996). L'usage du tabac devrait donc être la principale source d'isoprène dans l'air des maisons ou d'autres lieux où se trouvent des fumeurs.
Les produits de consommation contenant un polymère dérivé du polyisoprène, comme les résines de peintures, les chaussures, les adhésifs, les objets moulés et les améliorateurs de viscosité des huiles moteur, peuvent contenir des concentrations résiduelles d'isoprène n'ayant pas réagi et ainsi contribuer aux concentrations de cette substance dans l'air intérieur, tout en étant une source d'exposition pour le consommateur. Ainsi, 17 des 19 échantillons de polyisoprène analysés pour la présence de résidus du monomère ne présentaient aucune concentration décelable d'isoprène (limite de détection de 0,02 ppm), et la concentration notée dans les deux autres échantillons se situait entre 0,02 et 0,04 ppm (OCDE, 2005). Aucune tentative n'a été faite en vue de quantifier l'exposition inhérente à cette source, en raison de l'absence de données adéquates pour produire une estimation de l'exposition (p. ex., débit de rejet du monomère du polyisoprène n'ayant pas réagi). Toutefois, compte tenu des niveaux très bas qui ont été observés, le dégagement d'isoprène gazeux à partir de produits de consommation fabriqués en polyisoprène pourrait aussi contribuer légèrement aux concentrations de cette substance notées dans l'air intérieur. En outre, étant donné la pression de vapeur très élevée de l'isoprène et son faible log Koe, tout rejet à partir de ces produits devrait se répartir directement dans l'air et l'absorption par la peau devrait être négligeable.
L'isoprène est produit de façon endogène par le corps humain, peut-être sous la forme d'un sous-produit de la biosynthèse de l'isoprénoïde ou d'un produit de dégradation final de cette substance. L'isoprène représente de 30 à 70 p. 100 de la quantité totale des hydrocarbures exhalés et la quantité ainsi exhalée est estimée entre 2 et 4 mg par jour. Cette valeur ne semble pas varier en fonction de l'âge, du sexe, de l'origine ethnique, du régime alimentaire, du mode de vie ou de l'état de jeûne (Gelmont et al. ,1981). Il a aussi été signalé, par extrapolation de données obtenues chez la souris et le rat, que la quantité moyenne d'isoprène produite de façon endogène dans l'organisme variait entre 264 et 332 pmole/mL de tissu (Hartmann, 1994). Plusieurs autres études présentent des concentrations d'isoprène endogène chez les humains, notamment une gamme de concentrations allant de 15 à 70 nmole/L (1,0 - 4,8 µg/L) dans le sang (Cailleux et al., 1992) et un taux de production de 0,15 µmole/kg/h (environ 17 mg/jour chez un adulte de 70 kg) [Taalman, 1996]. Il a été clairement montré au cours d'une autre étude que les concentrations d'isoprène dans des salles de classe étaient de beaucoup supérieures après la présence des enfants et les auteurs en ont conclu que cette substance pouvait servir d'indice mesurable des contaminants d'origine humaine (Cailleux et al., 1993). Ainsi, la production endogène d'isoprène pourrait contribuer aux concentrations de la substance observées dans l'air intérieur. Cependant, il a été signalé que bien que l'isoprène soit formé de façon endogène, 90 p. 100 de la quantité formée était métabolisée et seulement 10 p. 100 environ était exhalée sans modification (Filser et al., 1996). Phillips et al. (1994) ont signalé que les concentrations d'isoprène étaient supérieures dans l'air alvéolaire que dans l'air inspiré, ce qui pourrait indiquer une origine exogène où la substance est absorbée et catabolisée in vivo ou excrétée par une voie autre que les poumons.
Le niveau de confiance accordé à la limite supérieure de l'estimation de l'absorption d'isoprène à partir des milieux naturels est jugé élevé, car des données de surveillance canadiennes récentes étaient disponibles pour le milieu d'exposition le plus pertinent (air intérieur et ambiant). On ne disposait d'aucune donnée sur l'eau potable et le sol et, mis à part des données limitées sur les aliments, on ne croit pas que ces milieux soient des sources d'exposition importantes.
Évaluation des effets sur la santé
Un aperçu des renseignements toxicologiques sur l'isoprène est présenté dans l'annexe 2.
Sur la base d'études portant sur des animaux de laboratoire, l'isoprène a été classé par le Centre international de recherche sur le cancer (CIRC) dans le groupe 2B (peut-être cancérogènes pour l'homme) [CIRC, 1999] et par la Commission européenne dans la catégorie 2 (substances devant être assimilées à des substances cancérogènes pour l'homme) (ESIS [date inconnue]; Commission européenne, 2004). Le National Toxicology Program (NTP) des États-Unis a classé l'isoprène comme une substance que l'on peut raisonnablement présumer cancérogène pour les humains (NTP, 2004). Ces classifications reposent sur une incidence accrue d'effets néoplasiques dans de nombreux organes tant chez des souris que chez des rats exposés à l'isoprène par inhalation, tel que cela est décrit plus bas.
Au cours d'un essai par période d'exposition suivie d'une période de non-exposition, des souris mâles B6C3F 1 ont été exposées par inhalation pendant 26 semaines à des concentrations d'isoprène pouvant atteindre 19 530 mg/m3 et ensuite observées pendant 26 autres semaines. On a noté une incidence accrue de tumeurs dans divers tissus, notamment des adénomes ou des carcinomes alvéolaires ou bronchiolaires, des adénomes de la glande de Harder, des adénomes ou des carcinomes hépatocellulaires et des papillomes ou des carcinomes pavimenteux du pré-estomac (NTP, 1995; Melnick et al., 1994). Dans une autre étude sur les souris B6C3F 1, des mâles ont été exposés par inhalation pendant 20, 40 ou 80 semaines à des concentrations d'isoprène pouvant atteindre 6 138 mg/m3 et observées jusqu'à la semaine 96 ou 104, et des femelles ont été exposées par inhalation pendant 80 semaines à des concentrations pouvant atteindre 195 mg/m3 et observées jusqu'à la semaine 104. Les souris mâles présentaient une incidence accrue significative des tumeurs du poumon, du foie et de la glande de Harder ainsi que des sarcomes histiocytiques. On a aussi observé des incidences accrues, mais non significatives, d'hémangiosarcomes du coeur et de la rate chez les mâles. Une incidence accrue (significative) des adénomes de la glande de Harder et de l'hypophyse a été notée chez les souris femelles exposées à la concentration la plus élevée (Placke et al., 1996).
Des rats F344/N mâles et femelles ont été exposés pendant 104 semaines à des concentrations d'isoprène pouvant atteindre 19 530 mg/m3. On a noté une incidence accrue de fibroadénomes mammaires chez les deux sexes ainsi que des adénomes ou des carcinomes du tubule rénal et des adénomes des cellules interstitielles du testicule chez les mâles (NTP, 1999a). Une légère augmentation de l'incidence a aussi été notée pour les adénomes des cellules interstitielles du testicule chez des rats mâles F344/N exposés par inhalation à des concentrations d'isoprène pouvant atteindre 19 530 mg/m3; la période d'exposition de 26 semaines était suivie d'une période de non-exposition (d'observation) de 26 semaines (Melnick et al., 1994, 1996; NTP, 1995). Un groupe de travail du CIRC a noté que l'incidence spontanée de ce type de tumeurs était élevée dans les études d'une durée de deux ans et que les périodes utilisées étaient insuffisantes pour évaluer le potentiel cancérogène (NTP, 1994a; CIRC, 1994); il importe toutefois de signaler que l'incidence était accrue après seulement 26 semaines d'exposition.
La Commission européenne a aussi classé l'isoprène dans la catégorie 3 (substances préoccupantes pour l'homme en raison d'effets mutagènes possibles; risque possible d'effets irréversibles) pour ses effets mutagènes (ESIS [date inconnue]; Commission européenne, 2004). L'isoprène s'est avéré génotoxique au cours d'essais in vivo, car des résultats positifs ont été obtenus pour les échanges de chromatides surs et l'induction de micronoyaux dans des cellules de la moelle osseuse de souris exposées par inhalation (CIRC, 1999). Des résultats négatifs ont cependant été obtenus au cours de certains essais réalisés in vitro, notamment au cours d'essais portant sur les mutations chez les bactéries et sur les échanges de chromatides surs ou les aberrations chromosomiques dans des cellules ovariennes de hamsters chinois (CIRC, 1999). Un résultat positif a été obtenu au cours d'un essai in vitro Comet portant sur des cellules sanguines (Fabiani et al., 2007). Selon le CIRC (1994), l'activité génotoxique de l'isoprène in vivo pourrait être attribuée à un de ses métabolites, le 2-méthyl-1,2,3,4-diépoxybutane.
Bien qu'une analyse approfondie du mode d'action possible de l'isoprène dans l'induction de tumeurs déborde le cadre de la présente évaluation préalable, le NTP a émis l'hypothèse de l'action de métabolites alkylants réactifs de l'isoprène, mais a ajouté que d'autres mécanismes devraient aussi être examinés (NTP, 1999b).
L'exposition à l'isoprène par inhalation, la voie d'exposition prédominante pour la population générale, a aussi entraîné divers effets autres que le cancer chez des animaux de laboratoire, souvent à la plus faible concentration utilisée. L'hyperplasie a été notée dans des organes où des tumeurs ont aussi été décelées (poumon, pré-estomac, rein et testicule). La plus faible concentration minimale avec effet observé (CMEO) pour l'exposition à l'isoprène est de 11 mg/m3 et correspond à une augmentation de l'activité proliférative du thymus chez des rats Wistar exposés pendant une période de quatre mois, suivie d'une période d'observation d'un mois (Mamedov, 1979). À une plus forte concentration, divers effets, comme des variations de la masse du thymus, de l'indice mitotique et de la cellularité du thymus, se sont avérés réversibles pendant l'exposition ou la période de rétablissement; toutefois, à la plus faible concentration, la prolifération accrue dans le thymus a été observée durant la période de rétablissement. De même, une CMEO à court terme de 98 mg/m3 a induit une augmentation de l'activité proliférative dans le thymus chez des rats mâles Wistar exposés pendant 30 jours (Mamedov, 1979). Comme dans le cas de l'étude de toxicité subchronique, on a observé des modifications réversibles dans le thymus et la rate et les proliférations sont demeurées jusqu'à la fin de l'étude. Bien que ces deux études soient limitées en raison du nombre d'organes et de systèmes biologiques examinés, d'autres études comportant des analyses macroscopiques et histopathologiques plus détaillées ont aussi permis l'observation d'effets sur le thymus (variation de la masse et atrophie) et la rate (variation de la masse) de rats et de souris exposés à des concentrations plus élevées d'isoprène pendant 2, 13 ou 26 semaines (NTP, 1995). Une fibrose splénique a aussi été observée chez des rats exposés pendant 105 semaines à 1 953 mg/m3 ou plus (NTP, 1999a). La deuxième plus faible CMEO de 28 mg/m3environ a été notée pour une réduction non significative de la masse ovarienne chez des souris femelles exposées pendant 80 semaines à une concentration pouvant atteindre 195 mg/m3 (Placke et al., 1996). (Il est à souligner que l'atrophie ovarienne a été induite à de faibles concentrations chez des souris exposées à du 1,3-butadiène, un analogue structurel de l'isoprène [NTP, 1984, 1993; Bevan et al., 1996].) D'autres effets sur l'appareil reproductif femelle, notamment un allongement du cycle oestrien et une diminution de la masse de l'utérus gravide, ont été notés chez des souris femelles exposées à des concentrations plus élevées, mais pendant des périodes plus courtes (Melnick et al., 1994; NTP, 1995).
Le niveau de confiance à l'égard des renseignements toxicologiques sur les animaux de laboratoire est jugé de modéré à élevé, car des données ont été obtenues pour la toxicité aiguë, les doses répétées, la toxicité pour la reproduction et le développement, la cancérogénicité et la génotoxicité. Le niveau de détail indiqué pour certaines des études à doses répétées est cependant limité et on ne disposait pas de données épidémiologiques suffisantes chez l'humain. Il demeure aussi des incertitudes quant au mode d'induction des tumeurs.
Caractérisation du risque pour la santé humaine
À la lumière principalement des évaluations de plusieurs organismes internationaux et nationaux réalisées selon la méthode du poids de la preuve (CIRC, 1999; NTP, 2004; NTP, 1999b; Commission européenne 2004), la cancérogénicité constitue un effet critique pour la caractérisation du risque que présente l'isoprène pour la santé humaine. Au cours d'essais de toxicité chronique, l'isoprène a constamment provoqué l'apparition de tumeurs dans plusieurs organes chez des souris et des rats. Il s'est aussi avéré génotoxique au cours d'essais in vivochez la souris. Ainsi, cela indique que l'on ne peut exclure l'existence d'un mode d'induction de tumeurs par interaction directe avec le matériel génétique. On ne dispose pas de données épidémiologiques appropriées à une évaluation, mais l'isoprène est un analogue structural du 1,3-butadiène qui a été associé au cancer du système lymphohématopoïétique chez des travailleurs exposés.
En ce qui concerne les effets critiques autres que le cancer dans le contexte d'une évaluation préalable, la comparaison de la concentration la plus faible ayant un effet par inhalation (11 mg/m3 ou 11 000 µg/m3), choisie de façon prudente à partir d'une étude de la toxicité subchronique, avec la concentration la plus élevée signalée pour l'air intérieur au Canada en 2006 (30,5 µg/m3), qui est la principale source d'exposition à l'isoprène de la population générale, donne une marge d'exposition de 360 environ. La comparaison de cette concentration ayant un effet avec la concentration la plus élevée signalée pour l'air ambiant dans une zone urbaine canadienne (9,48 µg/m3) donne une marge d'exposition de 1 160 environ. Bien que l'on sache que la production endogène et les sources naturelles d'isoprène contribuent à l'exposition générale en s'ajoutant aux sources anthropiques, il est impossible de préciser les apports relatifs de chacune de ces sources dans le cadre d'une évaluation préalable. En outre, les données indiquent que l'usage de la cigarette résulte en des concentrations d'isoprène plus élevées dans l'air intérieur de sorte que la marge d'exposition pourrait être inférieure dans les habitations des fumeurs. Il apparaît donc, à la lumière des incertitudes des bases de données, y compris les données concernant le mode d'induction des tumeurs, que ces marges d'exposition pourraient ne pas protéger adéquatement la santé humaine.
Incertitudes de l'évaluation des risques pour la santé humaine
Cette évaluation préalable de l'isoprène ne tient pas compte de la variabilité au sein de la population générale ou des écarts entre les humains et les animaux de laboratoire en ce qui a trait à l'induction des effets, notamment à cause du manque d'études épidémiologiques pertinentes. Par ailleurs, et en dépit de légers écarts quantitatifs, les voies métaboliques de l'isoprène sont qualitativement semblables chez les animaux de laboratoire et les humains (Gervasi et Longo, 1990; Csanady et Filser, 2001; Peter et al., 1987). De plus, les données disponibles indiquent un profil d'effets sur la santé semblable à celui du 1,3-butadiène, qui a été associé au cancer chez les humains. L'isoprène provoque l'apparition de tumeurs dans plusieurs organes chez de nombreuses espèces d'animaux de laboratoire, mais le mécanisme d'induction n'a pas été clairement défini. Il existe cependant certains indices montrant que les métabolites de la substance pourraient jouer un rôle, peut-être par interaction avec le matériel génétique. Il est aussi à noter que l'étude critique des effets autres que le cancer a été limitée par l'éventail des organes et des systèmes biologiques examinés.
Il demeure d'importantes incertitudes en ce qui a trait à l'apport relatif des sources biogènes d'isoprène, comme les arbres et d'autres végétaux, et à la production endogène de cette substance chez les humains. Bien qu'il soit impossible de préciser l'apport relatif des sources exogènes et endogènes d'isoprène atteignant les tissus cibles, l'exposition à des sources exogènes de cette substance a provoqué l'apparition de tumeurs chez des rongeurs, qui produisent aussi de l'isoprène de façon endogène. Il existe cependant un écart considérable entre les taux signalés de production endogène chez différentes espèces. La comparaison quantitative de la cinétique et de la dynamique de l'isoprène chez les humains et les animaux de laboratoire permettrait de préciser les écarts de vulnérabilité aux sources externes en ce qui a trait au pouvoir d'induction de tumeurs, mais de telles analyses débordent le cadre de la présente évaluation préalable.
En outre, l'apport des rejets provenant de produits de consommation, fabriqués à partir de polyisoprène, de caoutchouc butyle et de caoutchouc SIS, à l'exposition de la population à l'isoprène demeure inconnu. Cet apport devrait cependant être négligeable en comparaison de celui des autres sources anthropiques ou naturelles.
Conclusion
D'après les renseignements disponibles, on conclut que l'isoprène ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ni à mettre en danger l'environnement essentiel pour la vie. En outre, l'isoprène ne satisfait pas aux critères de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000a).
Compte tenu de la cancérogénicité de l'isoprène, pour lequel il pourrait exister une possibilité d'effets nocifs à tout niveau d'exposition, et de l'inadéquation possible des marges entre l'exposition estimée à partir des produits et du niveau critique pour les effets non cancérogènes, il est conclu que l'isoprène est une substance qui peut pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger pour la vie ou la santé humaines au Canada.
Il est par conséquent conclu que l'isoprène ne répond pas aux critères des paragraphes 64a et 64b de la LCPE (1999), mais qu'il répond aux critères du paragraphe 64c de la LCPE (1999).
Références
Arnot J.A., et F.A.P.C. Gobas. 2003. A Generic QSAR for Assessing the Bioaccumulation Potential of Organic Chemicals in Aquatic Food Webs. QSAR Comb Sci 22(3): 337-345.
Atkinson R. 1989. Kinetics and mechanisms of the gas phase reactions of the hydroxyl radical with organic compounds. J Phys Chem Ref Data. Monograph No. 1.
Barrefors G. et G. Petersson. 1993 Assessment of ambient volatile hydrocarbons from tobacco smoke and from vehicle emissions. J. Chromatog. 643: 71-76.
Bayer A.G. (Institute fur Toxikologie). 1972. Isopren - Akute Toxizitatsuntersuchungen. Rapport inédit n° 3733. [cité dans BG Chemie, 2000].
[BG Chemie] Berufsgenossenschaft der chemischen industrie (DE). Toxicological evaluation: Isoprene CAS No. 78-79-5 [Internet]. 2000. Heidelberg: Berufsgenossenschaft der chemischen industrie. Rapport n o 105. [cité le 12 mars 2007].
Bevan C., J.C. Stadler, G.S. Elliott, S.R. Frame, J.K. Baldwin, H.-W. Leung, E. Moran et A.S. Panepinto. 1996. Subchronic toxicity of 4-vinylcyclohexene in rats and mice by inhalation exposure. Fundam Appl Toxicol 32: 1-10. [cité dans Canada, 2000b].
[BCFWIN] BioConcentration Factor Program for Windows [Estimation Model]. 2000. Version 2.15. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [cité le 30 avril 2007]. Exposure Assessment Tools and Models.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2000. Version 4.02. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. Exposure Assessment Tools and Models.
Bohmann, J.J. 1984. Bestimmung und alterungsverhalten des bieres. Monatsschridft fur Brauwissenschaft. Heft 10: 436-441.
Boethling R.S., P.H. Howard, J.A. Beauman et M.E. Larosche. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere. 30 (4), 741-752.
Bond J.A., W.E. Bechtold, L.S. Birnbaum, A.R. Dahl, M.A. Medinsky, J.D. Sun et R.F. Henderson. 1991. Disposition of inhaled isoprene in B6C3F1 mice. Toxicol Appl Pharmacol 107(3):494-503. [cité dans BG Chemie, 2000; CIRC, 1999].
Cailleux A., M. Cogny et P. Allain. 1992. Blood Isoprene Concentrations in Humans and in Some Animal Species, Biochem. Med. Metab. Biol. 47: 157-160.
Cailleux A., A. Turcant, A. Premel-Cabic et P. Allain. 1993. Volatile organic compounds in indoor air and in expired air as markers of activities. Chromatographia: 37, 1/2: 57-59.
Canada. 1999. Loi canadienne sur la protection de l'environnement, (1999). L.C., 1999, c. 33. Gazette du Canada, Partie III, vol. 22, n° 3. (consulté le 3 août 2007).
Canada. 2000a. Loi canadienne sur la protection de l'environnement : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, 23 mars 2000, SOR/2000-107. Gazette du Canada, Partie II, vol. 134, n° 7.
Canada. 2000b. 1,3-Butadiène. Ottawa (Ont.) : Environnement Canada; Santé Canada. (Rapport d'évaluation - Liste des substances d'intérêt prioritaire.)
Canada, ministère de l'Environnement et ministère de la Santé. 2006. Loi canadienne sur la protection de l'environnement (1999). Avis d'intention d'élaborer et de mettre en uvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, n° 49.
Canada, Ministère de l'Environnement. 2007. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le groupe 2 du Défi. Gazette du Canada, Partie I, vol. 140, n° 9.
[CE] Commission européenne. 2004. Isoprène (stabilisé). Directive de la Commission 2004/73/CE du 29 avril 2004. Annexe 1B. Journal officiel de l'Union européenne 16.6.2004. L216:27. Commission européenne. 29e ATP.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1994. Some industrial chemicals. Isoprene.IARC Monogr. Eval. Carcinog. Risks. Hum. 60: 215-32.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1999. Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide. Isoprene. IARC Monogr. Eval. Carcinog. Risks Hum. 71(3): 1015-25.
Csanady G.A., et J.G. Filser. 2001. Toxicokinetics of inhaled and endogenous isoprene in mice, rats and humans. Chem. Biol. Ineract. 135-136: 679-685.
Dahl A.R., L.S. Birnbaum, J.A. Bond, P.G. Gervasi et R.F. Henderson. 1987. The fate of isoprene inhaled by rats: comparison to butadiene. Toxicol.Appl. Pharmacol. 89: 237-248. [cité dans BG Chemie, 2000; CIRC, 1994].
de Meester C., M. Mercier et F. Poncelet. 1981. Mutagenic activity of butadiene, hexachlorobutadiene and isoprene. In: Gut I, Cikrt M, Plaa GL, eds. Industrial and Environmental Xenobiotics. Berlin: Springer, p. 195-203. [cité dans CIRC, 1999; OCDE, 2005 (dossier)].
Del Monte M., L. Citti et P.G. Gervasi. 1985. Isoprene metabolism by liver microsomal monooxygenases. Xenobiotica 15: 591-597. [cité dans BG Chemie, 2000].
Doerr, J.K., S.B. Hooser, B.J. Smith et I.G. Sipes. 1995. Ovarian toxicity of 4-vinylcyclohexene and related olefins in B6C3F1 mice: role of diepoxides. Chem Res Toxicol 8: 963-969. [cité dans CIRC, 1999].
Environnement Canada, 2006. Données inédites de Tom Dann, Division de la mesure des émissions, Centre des technologies environnementales, chemin River, Ottawa, Ont.
Environnement Canada. 2007a. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le groupe 2 du Défi, 1999, Article 71 : Avis concernant certaines substances du groupe 2 du Défi. Préparé par : Environnement Canada, Programme des substances existantes.
Environnement Canada. (2007b). QSARs: Reviewed Draft Working Document, Science Resource Technical Series, Guidance for Conducting Ecological Assessments under CEPA 1999. Division des substances existantes, Environnement Canada, Gatineau (QC). Document provisoire interne disponible sur demande.
[ESIS] European Chemical Substances Information System [base de données sur Internet]. [date inconnue]. Version 5. European Chemicals Bureau. [Cité le 7 janvier 2008].
Fabiani R., P. Rosignoli, A. De Bartolomeo, R. Fuccelli et G. Morozzi. 2007. DNA-damaging ability of isoprene and isoprene mono-epoxide (EPOX I) in human cells evaluated with the comet assay. Mutat Res. 629: 7-13.
Faustov A.S. 1972. Toxic and hygiene characteristics of the gas factor in the production of certain types of general purpose synthetic rubber. Trud. Voron Med. Inst. 87: 10-16. [cité dans BG Chemie, 2000].
Faustov A.S., et N.V. Lobeeva. 1970. Action of some chemical substances on the protein content of serum and bone marrow.Chem. Abstr. 73: Abstr 118648c. [cité dans BG Chemie, 2000].
Filser J.G., G.A. Csanady, B. Denk, M. Hartmann, A. Kauffmann, W. Kessler, P.E. Kreuzer, C. Putz, J.H. Shen et P. Stei. 1996. Toxicokinetics of isoprene in rodents and humans.Toxicology 113: 278-287.
Gage J.C. 1970. The subacute inhalation toxicity of 109 industrial chemicals. Br. J. Ind. Med. 27: 1-18. [cité dans BG Chemie, 2000].
Galloway S., M. Armstrong, C. Reuben, S. Colman, B. Brown, C. Cannon, A. Bloom, F. Nakamura, M. Ahmed, S. Duk et autres. 1987. Chromosome aberrations and sister chromatid exchanges in Chinese hamster ovary cells: evaluations of 108 chemicals. Environ. Mol. Mutagen. 10: 1-175. [cité dans OCDE, 2005].
Gelmont D., R.A. Stein et J.F. Mead . 1981 Isoprene - The Main Hydrocarbon in Human Breath. Biochem. Biophys. Res. Commun. 99(4): 1456-1650.
Gervasi P.G. et V. Longo. 1990. Metabolism and mutagenicity of isoprene. Environ. Health Perspect. 86: 85-87.
Gostinskii V.D. 1965. Toxicity of isoprene and maximal safe concentration of the vapor in air. Fed. Proc. Transl. Suppl. 24(6):1123-6. [cité dans OCDE, 2005; BG Chemie, 2000].
Graedel T.E. 1986. Atmospheric Chemical Compounds.Orlando, FL : Academic Press p. 145 [cité dans HSDB, 2008]
Guenther A., C. Hewitt, D. Erickson, R. Fall, C. Geron, T. Graedel, P. Harley et al., 1995. A Global Model of Natural Volatile Organic Compound Emissions. J. Geophys. Res. 100: 8873-8892.
Hartmann, M. 1994. Pharmakokinetik und endogene production von isoprene beim menschen. GSF Report 21/94. [cité dans BG Chemie, 2000].
Heavner D.L., W.T. Morgan et M.W. Ogden. 1996. Determination of volatile organic compounds and respirable suspended particulate matter in New Jersey and Pennsylvania homes and workplaces.Environ. Int. 22(2): 159-183.
[HSDB] Hazardous Substances Data Bank [base de données sur Internet]. 1983 -. Bethesda (MD) : National Library of Medicine (US). [cité le 3 janvier 2008].
Huntingdon Life Sciences. 2003. Ames assay. Huntingdon Life Sciences Ltd., Cambridgeshire, Angleterre. [cité dans OCDE, 2005 sous Huntingdon Life Sciences, 2003a].
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [Estimation Model]. 2000. Version 1.67. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation [cité le 30 avril 2007]. Exposure Assessment Tools and Models.
[INRP] Inventaire national des rejets de polluants [base de données sur Internet]. 2006. Gatineau (Qc) : Environnement Canada. [cité en janvier 2008].
Kimmerle, G. et B. Solmecke. 1972. Isopren-Akute Toxizit, tsuntersuchungen.: Bayer AG. unveroffentlichter Bericht Nr. 3373. [cité dans OCDE, 2005].
Korbakova, A.I. et V.I. Fedorova. 1964. Zur toxikologie von isopren. Toksikol. Novykk. Prom. Khim. Veschesto.6:18-29. [Traduction allemande du russe; cité dans BG Chemie, 2000].
Kushi, A., D. Yoshida et S. Mizusaki. 1985. Mutagenicity of gaseous nitrogen oxides and olefins on Salmonella TA 102 and TA 104. Mutat. Res. 147: 263-264. [cité dans OCDE, 2005 (dossier)].
Lanxess 2005. Product Specification Sheet for Lanxess Butyl 101-3.
Lewis, R.J. Sr. 1997. Hawley's Condensed Chemical Dictionary. 13th ed. NY, NY : Van Nostrand Reinhold Co., p. 631 [cité dans HSDB, 2008]
Lofroth, G., R.M. Burton, L. Forehand, S.K. Hammond, R.L. Seila, R.B. Zweidinger et J. Lewtas. 1989. Characterization of Environmental Tobacco Smoke, Environ. Sc.i Technol.23: 610-614.
Madhusree, B., S. Goto, T. Ohkubo, H. Tian, F. Ando, M. Fukuhara, M. Tohkin et I. Watanabe I. 2002. Mutagenicity testing of 1,3-butadiene, 1,4-pentadiene-3-ol, isoprene, 2,4-hexadiene,cis - and trans -piperlylene. J. Health Sci. 48(1):73-8.
Mamedov, A.M. 1979. [Lymphoid tissue reaction and several integral indices following isoprene inhalation]. Gig. Tr. Prof. Zabol. (6):35-7.
Mast, T.J., J.J. Evanoff, K.H. Stoney, R.B. Westerberg et R.L. Rommereim. 1989. Inhalation Developmental Toxicology Studies: Teratology Study of Isoprene in Mice and Rats: Final Report.Govt. Rep. Announce. Index. Issue 14:255. [Résumé n o 9393174; cité dans CIRC, 1994].
Mast, T.J., R.L. Rommereim, R.J. Weigel, K.H. Stoney, B.A. Schwetz et R.E. Morrissey. 1990. Inhalation developmental toxicity of isoprene in mice and rats. Toxicologist 10(1):42. [Résumé n o 165; cité dans CIRC, 1994].
Melnick, R.L., J.H. Roycroft, B.J. Chou, H.A. Ragan et R.A. Miller. 1990. Inhalation toxicology of isoprene in F344 rats and B6C3F1 mice following two-week exposure. Environ. Health Perspect. 86: 93-98. [cité dans CIRC, 1999; OCDE, 2005].
Melnick, R.L., R.C. Sills, J.H. Roycroft, B.J. Chou, H.A. Ragan et R.A. Miller. 1994. Isoprene, an endogenous hydrocarbon and industrial chemical, induces multiple organ neoplasia in rodents after 26 weeks of inhalation exposure. Cancer Res54(20):5333-9. [cité dans OCDE, 2005; BG Chemie, 2000; CIRC, 1999; NTP, 1999b].
Melnick, R.L., R.C. Sills, J.H. Roycroft, B.J. Chou, H.A. Ragan et R.A. Miller. 1996. Inhalation toxicity and carcinogenicity of isoprene in rats and mice: comparisons with 1,3-butadiene.Toxicology 113(1-3): 247-52. [cité dans CIRC, 1999; OCDE, 2005; BG Chemie, 2000].
The Merck Index. 1996. An Encyclopedia of Chemicals, Drugs, and Biologicals. Whitehouse Station (NJ): Merck and Co., Inc., p. 887
Mortelmans, K., S. Haworth, T. Lawlor, W. Speck, B. Tainer et E. Zeiger. 1986. Salmonella mutagenicity tests: II: Results from the testing of 270 chemicals. Environ. Mutagen. 8(Suppl 7): 1-119. [cité dans CIRC, 1999; OCDE, 2005].
[MITI] Ministry of International Trade & Industry (Jpn). 1992. Biodegradation and Bioaccumulation Data of Existing Chemicals Based on the CSCL Japan. Chemical Products Safety Division Basic Industries Bureau, Ministry of International Trade & Industry, Edited by Chemicals Inspection & Testing Institute, Japon.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2007. Issue 1. Columbus (Ohio): American Chemical Society, Chemical Abstracts Service. [Cité en octobre 2007]. National Chemical Inventory (NCI) System Requirements.
[NTP] National Toxicology Program (US). 1984. NTP technical report on the toxicology and carcinogenesis studies of 1,3-butadiene (CAS No. 106-99-0) in B6C3F1 mice (inhalation studies). Research Triangle Park (NC): U.S. Department of Health and Human Services, National Toxicology Program. Report No.: Technical Report No. 288. [cité dans Canada, 2000b].
[NTP] National Toxicology Program (US). 1989. Inhalation developmental toxicology studies: teratology study of isoprene in mice and rats. Research Triangle Park (NC): U.S. Department of Health and Human Services, National Toxicology Program. Report No.: TER88045, NTIS#DE89008095. [cité dans OCDE, 2005].
[NTP] National Toxicology Program (US). 1993. NTP technical report on the toxicology and carcinogenesis studies of 1,3-butadiene (CAS No. 106-99-0) in B6C3F1 mice (inhalation studies). Research Triangle Park (NC): U.S. Department of Health and Human Services, National Toxicology Program. Technical Report No. 434 [cité dans Canada, 2000b].
[NTP] National Toxicology Program (US). 1994a. NTP technical report on toxicity studies of isoprene (CAS No. 78-79-5); administered by inhalation to F344/N rats and B6C3F1 mice (NIH Publication 94-3354). Research Triangle Park (NC): U.S. Department of Health and Human Services, National Toxicology Program. [cité dans CIRC, 1994, sous US National Toxicology Program, 1994; ébauche de NTP, 1995].
[NTP] National Toxiciology Program (US). 1994b. Intraperitoneal administration of isoprene to B6C3F1 mice and urinary metabolites of isoprene in F-344 rats and B6C3F1 mice. [étude inédite citée dans BG Chemie, 2000].
[NTP] National Toxicology Program (US). 1995. NTP technical report on toxicity studies of isoprene (CAS No. 78-79-5) administered by inhalation to F344/N rats and B6C3F1 mice. NIH Publication No. 95-3354[Internet]. Research Triangle Park (NC): U.S. Department of Health and Human Services, National Toxicology Program. Report No.: Toxicity Report Series Number 31.
[NTP] National Toxicology Program (US). 1999a. NTP technical report on toxicology and carcinogenesis studies of isoprene (CAS No. 78-79-5) in F344/N rats (Inhalation studies) [Internet]. Research Triangle Park (NC): U.S. Department of Health and Human Services, National Toxicology Program. Report No.: NTP TR 486.
[NTP] National Toxicology Program (US). 1999b. NTP report on carcinogens background document for isoprene [Internet]. Research Triangle Park (NC): U.S. Department of Health and Human Services, National Toxicology Program. [cité le 10 janvier 2008].
[NTP] National Toxicology Program (US). 2004. Substance profiles: isoprene CAS No. 78-79-5 [Internet]. Research Triangle Park (NC): U.S. Department of Health and Human Services, National Toxicology Program [dernière mise à jour de la page le 26 août 2005; cité le 3 avril 2007].
[OASIS Forecast] Optimized Approach based on Structural Indices Set [Internet]. 2005. Version 1.20 Bourgas (BG) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. OASIS Software.
[OCDE] Organisation de coopération et de développement économiques. 2005. Isoprene CAS No. 78-79-5 [Internet]. Publications du Programme des Nations Unies pour l' environnement (PNUE). [cité le 21 mars 2007].
Peter H., H.J. Wiegand, H.M. Bolt, H. Greim, G. Walter, M. Berg et J.G. Filser. 1987. Pharmacokinetics of isoprene in mice and rats. Toxicol. Lett. 36: 9-14.
Phillips M., J. Greenberg et J. Awad. 1994. Metabolic and environmental origins of volatile organic compounds in breath.J. Clin. Pathol., 47: 1052-1053.
Placke M.E., L. Griffis, M. Bird, J. Bus et R.L. Persing RL, Cox LA Jr. 1996. Chronic inhalation oncogenicity study of isoprene in B6C3F1 mice. Toxicology 113(1-3):253-62.
Repina E.F. 1988. Untersuchung der selektiven gonadotoxischen Aktivität von isoprene und piperylen im akuten versuch. Gig Proizv Okruzh Sredy, Okhrana Zdorov'ya Rab v Neftegazodobyv i Neftekhim, Prom-sit M: 96-99. [traduction allemande du russe; cité dans BG Chemie, 2000].
Rhone-Poulenc, Inc. 1971. Initial submission : acute inhalation toxicity of isoprene, isoprene hydrochloride and allyl chloride in rats (page couverture datée : 09/04/92. Présentée (1992) à la U.S. Environmental Protection Agency (microfiche n o OTS 0555961; document n o 88-920010693).
Rohr A.C., C.K. Wilkins, P.A. Clausen, M. Hammer, G.D. Nielsen, P. Wolkoff et J.D. Spengler. 2002. Upper airway and pulmonary effects of oxidation products of (+)-alpha-pinene, d-limonene, and isoprene in BALB/c mice. Inhal. Toxicol.14(7):663-84.
Samedov I.G., A.M. Mamedov, L.N. Mamedova et I.A. Bekesev. 1978. Immunologische indices als mögliche kriterien zur bewertung der einwirkung von chemischen faktorn mit geringer intensität auf den organismus. Azerb Med Zh 55: 58-61 [traduit du russe vers l'allemand; cité dans BG Chemie, 2000].
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Santé Canada, Direction de l'hygiène du milieu, Ottawa (Ontario).
Santé Canada. 2008. Windsor Ontario Exposure Assessment Study 2005, 2006: VOC Sampling Data Summary (Draft). Section des carburants et de la qualité de l'air, Division des effets de l'air sur la santé.
[SBSC] Ministère de la Santé nationale et du Bien-être social (CA). 1990. L'allaitement maternel au Canada : pratiques et tendances actuelles. Ottawa (ON) : Ministère de la Santé nationale et du Bien-être social. NHW Cat. No. H39-199/1990E. [Cité dans Santé Canada 1998]
[Shell] Shell Chemical Company. Product Overview [Internet]. Shell Chemical Company [cité en janvier 2008].
Shugaev B.B. 1969. Concentrations of hydrocarbons in tissues as a measure of toxicity. Arch. Environ. Health18(6):878-82. [cité dans BG Chemie, 2000; OCDE SIDS, 2005].
Sun J.D., A.R. Dahl, J.A. Bond, L.S. Birnbaum et R.F. Henderson. 1989. Characterization of haemoglobin adduct formation in mice and rats after administration of [14C]butadiene or [14C]isoprene.Toxicol. Appl. Pharmacol. 100: 86-95. [cité dans CIRC, 1999; BG Chemie, 2000].
Taalman, R. 1996. Isoprene: background and issues.Toxicology 113: 242-246.
Tareke E., B.T. Golding, R.D. Small et M. Tornqvist. 1998. Haemoglobin adducts from isoprene and isoprene monoepoxides.Xenobiotica 28(7): 663-72.
Tice R.R., R. Boucher, C.A.Luke, D.E. Paquette, R.L. Melnick et M.D. Shelby. 1988. Chloroprene and isoprene: cytogenetic studies in mice. Mutagenesis 3: 141-146. [cité dans CIRC, 1999].
Tsutsumi S., T. Yamaguchi, S. Komatsu et S. Tamura. 1969. On the teratogenic effects of vitamin A-like substances. Proc. Congenital Anomalies Res. Assoc., Ann. Rep. No. 9: 27 [cité dans BG Chemie, 2000; OCDE, 2005 (dossier)].
Von Oettingen W.F. 1940. Toxicity and portenial dangers of aliphatic and aromatic hydrocarbons. Publ. Health Bull. No. 255: 26-28. [cité dans BG Chemie, 2000].
Wilkins C.K., P.A. Clausen, P. Wolkoff, S.T. Larsen, M. Hammer, K. Larsen, V. Hansen et G.D. Nielsen. 2001. Formation of strong airway irritants in mixtures of isoprene/ozone and isoprene/ozone/nitrogen dioxide. Environ. Health Perspect. 109(9): 937-941.
Zimmer W., N. Bruggemann, S. Emeis, C. Giersch, A. Lehning, R. Steinbrecher et J.P. Schnitzler. 2000. Process-based modelling of Isoprene emission by oak leaves. Plant Cell Environ.23: 585-595.
Annexe 1 : Valeurs estimées de la limite supérieure de l'absorption quotidienne d'isoprène par la population générale du Canada (µg/kg p.c./j pour divers groupes d'âge)
| Voie d'exposition | 0-6 mois[1], [2], [3] | 0,5-4 ans[4] | 5-11 ans[5] | 12-19 ans[6] | 20-59 ans[7] | 60 + ans[8] | ||
|---|---|---|---|---|---|---|---|---|
| nourri au lait maternel | nourri à la préparation pour nourrissons | non nourri à la préparation pour nourrissons | ||||||
| Air ambiant[9] | 0,33 | 0,71 | 0,55 | 0,32 | 0,27 | 0,24 | ||
| Air intérieur[10] | 7,5 | 16,0 | 12,5 | 7,1 | 6,1 | 5,30 | ||
| Eau potable[11] | n.d.[12] | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| Nourriture et boissons[13] | n.d. | n.d. | n.d. | 0,03 | 0,06 | 0,04 | ||
| Sol[14] | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | ||
| Absorption totale | 7,8 | 7,8 | 7,8 | 16,8 | 13,1 | 7,5 | 6,4 | 5,6 |
[1] Aucune donnée mesurée sur la concentration d'isoprène dans le lait maternel n'a été relevée.
[2] Valeurs présumées : poids corporel de 7,5 kg, inhalation de 2,1 m 3 d'air par jour, ingestion de 0,8 L d'eau (nourri à la préparation pour nourrissons) ou de 0,3 L (non nourri à la préparation pour nourrissons) ou de 0,74 L de lait maternel par jour, et ingestion de 30 mg de sol par jour (Santé Canada, 1998). Il est présumé que les nourrissons alimentés au lait maternel ou à la préparation ne consomment aucune autre nourriture.
[3] L'absorption à partir de l'eau est synonyme de l'absorption à partir de la nourriture pour les nourrissons exclusivement alimentés à la préparation. La concentration d'isoprène dans l'eau utilisée pour reconstituer la préparation pour nourrissons est fondée sur les données disponibles pour l'eau. Aucune donnée sur les concentrations d'isoprène dans la préparation pour nourrissons au Canada n'a été relevée. De façon générale, 50 % des nourrissons reçoivent des aliments solides à quatre mois et 90 % à six mois (SBES, 1990 [cité dans Santé Canada, 1998]).
[4] Valeurs présumées : poids corporel de 15,5 kg, inhalation de 9,3 m 3 d'air par jour et ingestion de 0,7 litre d'eau et de 100 mg de sol par jour (Santé Canada, 1998).
[5] Valeurs présumées : poids corporel de 31,0 kg, inhalation de 14,5 m 3 d'air par jour et ingestion de 1,1 litre d'eau et de 65 mg de sol par jour (Santé Canada, 1998).
[6] Valeurs présumées : poids corporel de 59,4 kg, inhalation de 15,8 m 3 d'air par jour et ingestion de 1,2 litre d'eau et de 30 mg de sol par jour (Santé Canada, 1998).
[7] Valeurs présumées : poids corporel de 70,9 kg, inhalation de 16,2 m 3 d'air par jour et ingestion de 1,5 litre d'eau et de 30 mg de sol par jour (Santé Canada, 1998).
[8] Valeurs présumées : poids corporel de 72,0 kg, inhalation de 14,3 m 3 d'air par jour et ingestion de 1,6 litre d'eau et de 30 mg de sol par jour (Santé Canada, 1998).
[9] La concentration la plus élevée d'isoprène (9,48 µg/m3) déterminée à partir d'échantillons d'air ambiant prélevés dans 15 lieux au Canada (Environnement Canada, 2006) a été utilisée pour calculer la limite supérieure estimée de l'exposition. Il est présumé que les Canadiens passent trois heures à l'extérieur chaque jour (Santé Canada, 1998). Les données critiques ont été tirées d'un ensemble de données d'études canadiennes sur l'air ambiant (Santé Canada, 2008).
[10] La concentration la plus élevée d'isoprène (30,5 µg/m3) déterminée à partir d'échantillons d'air intérieur prélevés dans des habitations de non-fumeurs choisies au hasard à Windsor, en Ontario, a été utilisée pour le calcul de la limite supérieure estimée de l'exposition (Santé Canada, 2008). Il est présumé que les Canadiens passent 21 heures à l'intérieur chaque jour (Santé Canada, 1998).
[11] Aucune donnée sur les concentrations d'isoprène dans l'eau du robinet au Canada, ou ailleurs, n'a été relevée.
[12] n.d. = non disponible
[13] Les seules données disponibles sur les concentrations d'isoprène dans les aliments et les boissons proviennent d'une étude réalisée en Allemagne montrant que la bière en contenait 4 μg/kg (Bohmann, 1984). Cette valeur a servi à calculer l'ingestion de l'isoprène contenu dans les aliments et les boissons parmi les groupes d'âges pertinents (12 à 19 ans, 20 à 59 ans, 60 ans et plus). Toutefois, l'isoprène peut être utilisé pour fabriquer du copolymère d'isobutylène-isoprène (caoutchouc butyle) qui sert de base à la gomme à mâcher; il est donc possible que des quantités résiduelles de monomères soient ingérées en mâchant de la gomme. Même si le taux maximum admissible d'isoprène dans du copolymère est de 10 ppm (Lanxess, 2005), les enquêtes menées récemment par l'industrie n'ont pas permis de relever la présence d'isoprène ou d'isobutylène dans les échantillons de base de gomme à mâcher ou dans la gomme prête à mâcher en appliquant une limite de détection de 1 ppm. La non-détection est possiblement due au fait que les monomères de la gomme n'ayant pas réagi se volatilisent au moment du brassage de la base de la gomme et de la fabrication de la gomme prête à mâcher (selon le courriel de la Direction générale des produits de santé et des aliments, daté du 20 juin 2008). La contribution de l'ingestion globale d'isoprène à partir de cette source potentielle est donc négligeable.
[14] Aucune donnée sur les concentrations d'isoprène dans le sol au Canada, ou ailleurs, n'a été relevée.
Annexe 2 : Résumé des renseignements concernant les effets de l'isoprène sur la santé
| Paramètre | Concentrations ou doses minimales avec effet[a] - Résultats |
|---|---|
| Toxicité aiguë | Plus faible DL50 par voie orale = 2 043-2 210 mg/kg chez le rat (Kimmerle et Solmecke, 1972) Autres études : non disponibles Plus faible CL50 par inhalation = 139 000 mg/m3 chez des souris mâles (Gostinskii, 1965) Autres études : Shugaev, 1969; Mamedov, 1979; Korbakova et Fedorova, 1964; CL50 exprimée sous la forme de « supérieure à » : Kimmerle et Solmecke, 1972; Bayer, 1972; Rhone-Poulenc Inc., 1971 Plus faible CME(N)O par inhalation = 20 ppm ou 46 mg/m3 chez des souris B6C3F 1 après une exposition de 6 heures pour la recherche d'effets respiratoires, comme une réduction de la fréquence de la respiration (0, 46, 460, 4 600 mg/m3) [Bond et al., 1991] Autres études : Mamedov, 1979; Korbakova et Fedorova, 1964; Von Oettingen, 1940; Gostinskii, 1965; Rohr et al., 2002; Wilkins et al., 2001; Dahl et al., 1987 Plus faible DL50 par voie cutanée> 681 mg/kg de poids corporel (p.c.) chez le rat (Bayer, 1972). Autres études : Kimmerle et Solmecke, 1972 |
| Toxicité à court terme par doses répétées | Plus faible DMEO par voie orale = non disponible Plus faible DSEO par voie orale = 200 mg/kg p.c. chez des rats mâles ne donnant lieu à aucun effet observé. La dose de départ de 200 mg/kg p.c. a été augmentée par un facteur de 1,5 au cours des 4 jours suivants. Les animaux ont été observés pendant 7 jours de plus (Bayer, 1972) Autres études : Del Monte et al., 1985 Plus faible CMEO par inhalation = 0,098 mg/L ou 98 mg/m3 (plus faible concentration utilisée) chez le rat pour des effets sur le thymus (accroissement de l'indice mitotique) après une exposition par inhalation (0, 98, 1 016 mg/m3 à raison de 4 heures/jour pendant 30 jours) [Mamedov, 1979]. Autres études : DMEO = 438 ppm b ou 1 220 mg/m3(plus faible concentration utilisée) pour la formation de lésions dans le foie et le pré-estomac; changements hématologiques et modification de la masse des organes (foie, thymus) chez des souris exposées à une concentration pouvant atteindre 19 530 mg/m3 à raison de 6 heures/jour et 5 jours/semaine pendant 2 semaines (Melnick et al., 1990; NTP, 1995); Von Oettingen, 1940; Melnick et al., 1990; NTP, 1995; Gage, 1970; Bayer, 1972 |
| Toxicité subchronique | Plus faible CMEO par inhalation = 0,0108 mg/L ou 11 mg/m3 (plus faible concentration utilisée) chez des rats Wistar exposés à une concentration pouvant atteindre 116 mg/m3 pendant 4 mois pour des effets dans le thymus (prolifération accrue) après un mois de rétablissement (0, 11, 116 mg/m3 à raison de 4 heures par jour pendant 4 mois) [Mamedov, 1979]. Autres études : DMEO = 70 ppm b ou 195 mg/m3(plus faible concentration utilisée) chez des souris B6C3F 1 pour une dégénérescence de la moelle épinière après 26 semaines d'exposition (et 26 semaines de rétablissement) par inhalation à des concentrations pouvant atteindre 19 530 mg/m3 (0, 195, 614, 1 953, 6 138, 19 530 mg/m3 à raison de 6 heures/jour, 5 jours/semaine pendant 26 semaines, suivies de 26 semaines d'observation); observation de variations de paramètres hématologiques, de la force musculaire, de la masse des organes (foie, rate, cerveau) et de caractéristiques histologiques (lésions du pré-estomac, du foie, de la glande de Harder, des poumons et des voies nasales) aux concentrations d'exposition les plus élevé (Melnick et al., 1994, 1996; NTP, 1995) |
| Toxicité chronique / cancérogénicité | Plus faible CMEO par inhalation = 70 ppm[b] ou 195 mg/m3pour une légère métaplasie significative de l'épithélium olfactif chez des souris femelles exposées pendant 80 semaines à une concentration pouvant atteindre 195 mg/m3. Le protocole d'exposition utilisé pour les souris mâles et le mode de présentation des résultats rendent difficile le choix d'une valeur donnant lieu à un effet pour les souris mâles dans cette étude (Placke et al., 1996); de même, la CMEO = 70 ppm ou 195 mg/m3 pour la dégénérescence de la moelle épinière chez des souris exposées pendant 26 semaines et observées jusqu'à la semaine 52 (NTP, 1995; Melnick et al., 1994). Selon le NTP, une DSENO n'a pu être déterminée pour la dégénérescence de la moelle épinière (NTP, 1995). Autres études : (NTP, 1999a) Essais chez la souris : Des souris mâles B6C3F1 ont été exposées à 0, 10, 70, 140, 280, 700 ou 2 200 ppm (0, 28, 195, 391, 781, 1 953 ou 6 138 mg/m3) par inhalation à raison de 4 ou 8 heures/jour et 5 jours/semaine pendant 20, 40 ou 80 semaines. Des souris femelles B6C3F1 ont été exposées à 0, 10 ou 70 ppm (0, 28, 195 mg/m3) pendant 80 semaines. L'observation a été poursuivie jusqu'à la semaine 96 ou 104. Les souris mâles présentaient une augmentation significative de l'incidence des adénomes ou des carcinomes alvéolaires ou bronchiolaires (à 1 953 mg/m3 et plus), des adénomes et des carcinomes hépatocellulaires ou des adénomes de la glande de Harder (à 391 mg/m3 et plus) et des sarcomes histiocytiques du rein, du poumon, des nodules lymphatiques, de la moelle osseuse et de la rate (à 391 mg/m3 et plus). L'hyperplasie des alvéoles et du pré-estomac a été notée aux concentrations plus élevées (non précisées). Des augmentations non significatives de l'incidence d'hémangiosarcomes du coeur et de la rate ont été observées. Les souris femelles présentaient une incidence significativement accrue des adénomes de la glande de Harder (0, 28, 195 mg/m3 : 2/49, 3/49, 8/49) et des adénomes de l'hypophyse (0, 28, 195 mg/m3 : 1/49, 6/46, 9/49) à 195 mg/m3. Une métaplasie des fosses nasales a été notée chez les mâles à 391 mg/m3 et chez les femelles à 195 mg/m3. La prolifération des cellules hématopoïétiques de la rate et l'hyperplasie myéloïde de la moelle osseuse étaient légèrement accrues chez tous les groupes exposés (degré de signification non précisé). Le protocole d'exposition utilisé pour les souris mâles et le mode de présentation des résultats rendent difficile le choix d'une valeur donnant lieu à un effet pour les souris mâles exposées à des concentrations pouvant atteindre 6 138 mg/m3pendant 20, 40 et 80 semaines (Placke et al., 1996). Essais chez le rat : Des groupes de rats F344/N mâles ont été exposés par inhalation à des concentrations d'isoprène de 0, 70, 220, 700, 2 200 ou 7 000 ppm (0, 195, 614, 1 953, 6 138 ou 19 530 mg/m3) à raison de 6 heures/jour et 5 jours/semaine pendant 26 semaines et ont fait l'objet d'une observation pendant 26 autres semaines; 10 rats exposés à la concentration la plus élevée ont été sacrifiés à la fin de la période d'exposition. On a noté une augmentation (légèrement plus élevée mais non significative) de l'incidence des adénomes des cellules interstitielles du testicule chez les mâles (0, 195, 614, 1 953, 6 138, 19 530 mg/m3 : 3/30, 3/30, 4/30, 7/30, 8/29, 9/30). L'hyperplasie des cellules interstitielles du testicule a été notée chez les rats mâles examinés à la fin de la période d'exposition (Melnick et al., 1994, 1996; NTP, 1995). Un groupe de travail du Centre international de recherche sur le cancer a noté que l'incidence spontanée de ce type de tumeurs était élevée dans les études d'une durée de deux ans et que cette durée était insuffisante pour une évaluation du cancer (CIRC, 1994). Il a également été mentionné que l'étude de 26 semaines portant sur des rats F344/N ne permettait pas de tirer de conclusion quant à l'activité cancérogène (NTP, 1999a). |
| Toxicité pour la reproduction | Aucune étude portant sur l'isoprène n'était conçue spécifiquement pour l'examen des paramètres ayant trait à la reproduction. Plus faible CMEO par inhalation = 10 ppm ou 28 mg/m3 (plus faible concentration utilisée) chez des souris femelles B6C3F1 pour des effets sur les ovaires (réduction de la masse non significative) observés après 80 semaines d'exposition à une concentration pouvant atteindre 195 mg/m3 (Placke et al., 1996). [Note : Aucune donnée n'a été fournie sur l'incidence de l'effet.] Autres études : Repina, 1988; Melnick et al., 1994; NTP, 1995. Doerr et al. (1995) ont montré que l'injection intrapéritonéale a produit des effets sur les follicules ovariens de souris. |
| Toxicité pour le développement | Plus faible CMEO par inhalation (ftus) =280 ppm ou 781 mg/m3 (plus faible concentration utilisée) chez des souris Swiss pour une masse ftale réduite des jeunes femelles dont les mères avaient été exposées à des concentrations d'isoprène pouvant atteindre 19 530 mg/m3 à raison de 6 heures/jour et 7 jours/semaine au cours des jours de gestation 6 à 17 (Mastet al., 1989, 1990; NTP, 1995; NTP, 1989). [Selon le NTP, une CSENO n'a pas été obtenue pour la toxicité pour le développement (NTP, 1995).] Plus faible CMEO par inhalation (mères) =7 000 ppm ou 19 530 mg/m3 chez des souris Swiss pour une réduction significative de la masse utérine et de la masse corporelle des mères (Mast et al., 1989, 1990; NTP, 1989; NTP, 1995) Autres études : Mast et al., 1989, 1990; NTP, 1989; NTP, 1995 Plus faible DMEO par voie orale = 1 895 mg/kg de poids corporel car aucun effet toxique pour l'embryon ou de tératogénicité n'a été observé après traitement de rates Wistar pendant les jours de gestation 9 à 12; une légère réduction de l'ossification des sternèbres et de l'os occipital a été notée chez les ftus (Tsutsumi et al., 1969). |
| Génotoxicité et paramètres connexes : in vivo | Aberrations chromosomiques : Essai des micronoyaux : Échange de chromatides surs : Liaison covalente/formation d'adduits : |
| Génotoxicité et paramètres connexes : in vitro | Aberrations chromosomiques Mutagénicité Essai Comet Échange de chromatides surs |
[a] DL50 = dose létale médiane; CL50 = concentration létale médiane; DME(N)O = dose minimale avec effet (nocif) observé; CME(N)O = concentration minimale avec effet (nocif) observé; DSE(N)O = dose sans effet (nocif) observé; CSE(N)O = concentration sans effet (nocif) observé.
[b] Facteur de conversion : 1 ppm = 2,79 mg/m3 à 25 °C (CIRC, 1999).
- Date de modification :