Guide technique pour l'étude de suivi des effets sur l’environnement des mines de métaux
Introduction
Objet du guide
(PDF; 587 Mo)
En 1996, Environnement Canada a entrepris une évaluation des effets de l’exploitation minière sur le milieu aquatique au Canada (AQUAMIN, 19961), qui a fourni des recommandations relativement à l'examen et aux modifications du Règlement sur les effluents liquides des mines de métaux (actuellement intitulé Règlement sur les effluents des mines de métaux [REMM]) et à l’élaboration d’un programme national de suivi des effets sur l'environnement pour les mines de métaux. Le REMM, en vertu de la Loi sur les pêches, oblige les mines de métaux à mener des études de suivi des effets sur l'environnement comme condition régissant l’autorisation de rejeter un effluent (REMM, partie 2, article 7). L'étude de suivi des effets sur l'environnement (ESEE) est un outil scientifique de mesure du rendement qui permet d'évaluer la pertinence du règlement. Bien que le présent document d'orientation ne soit pas un document juridique, il vise à fournir une orientation aux mines leur permettant de respecter les exigences applicables à l'ESEE et de mener des études à cet égard. Pour ce qui est des exigences réglementaires applicables à l'ESEE, veuillez vous reporter à l'article 7, annexe 5 du REMM. Le présent document d'orientation remplace la version publiée en 2002.
1. AQUAMIN. 1996. Évaluation des effets de l’exploitation minière sur le milieu aquatique au Canada. Environnement Canada – rapport disponible sur demande par courriel à EEM-ESEE@ec.gc.ca
Retournez à la table des matières
Liste des acronymes
AAS : spectrométrie d'absorption atomique
ACLAE : Association canadienne des laboratoires d'analyse environnementale
ACR : approche des conditions de référence
AES : spectrométrie à électrons Auger
ANCOVA : analyse de la covariance
ANOVA : analyse de la variance
APHA : American Public Health Association
AQ/CQ : assurance de la qualité/contrôle de la qualité
AQUAMIN : Évaluation des effets de l’exploitation minière sur le milieu aquatique au Canada
ASPT : Average Score Per Taxon (score moyen par taxon)
ASTM : American Society for Testing and Materials
ATA : Atelier sur la toxicité aquatique
ATK : azote total Kjeldahl
AVS : sulfures volatiles
AWWA : American Water Works Association
BACI : avant-après–contrôle-impact (before/after-control/impact)
BAR : BAR Environmental Inc.
B-C Index : indice de Bray-Curtis
BEAK : Beak International Inc.
BMWP : biological monitoring working party (groupe de travail sur la surveillance biologique)
BPL : bonnes pratiques de laboratoire
CALA : Canadian Association for Laboratory Accreditation (Association canadienne pour la reconnaissance officielle des laboratoires)
CBR : critical body residues (résidus corporels critiques)
CCME : Conseil canadien des ministres de l'environnement
CE25 : concentration effective 25 %
CE50 : concentration effective 50 %
CETTP : Complex Effluent Toxicity Testing Program
CFG : chromatographie de filtration de gel
CG : chromatographie en phase gazeuse
C-I : contrôle-impact
CI25 : concentration inhibitrice 25 %
CI50 : concentration inhibitrice 50 %
C-IM : contrôle-impact multiple
CIRC : Centre international de recherche sur le cancer
CL50 : concentration létale 50 %
CLHP : chromatographie liquide à haute performance
CLP : comité de liaison avec le public
COD : carbone organique dissous
COSEPAC : Comité sur la situation des espèces en péril au Canada
COT : carbone organique total
CP : champ proche
CPUE : captures par unité d'effort
CRSNG : Conseil de recherches en sciences naturelles et en génie
CVAAS : spectrométrie d'absorption atomique à vapeur froide
CVAFS : spectrométrie de fluorescence atomique à vapeur froide
CVE : composante valorisée de l'écosystème
d.l. : degrés de liberté
DDW : eau doublement distillée
DGT : gradient de diffusion en couche mince
DI : diamètre intérieur
EBRN : Étude sur les bassins des rivières du Nord
EC : Environnement Canada
EDA : analyses dirigées par les bioessais
EDTA : acide éthylènediaminetétracétique
EFPP : effluent d'une fabrique de pâtes et papiers
EGU : effluent d'égouts urbains
ELAP : Environmental Laboratory Approval Program
ELS : extraction liquide-solide
EMM : effluent d'une mine de métaux
EP : élément de preuve
EQM : erreur quadratique moyenne
ESEE : étude de suivi des effets sur l'environnement
ESG : ESG International Inc.
ET : écart-type
exp. : exposition
exp. éloi. : zone exposée éloignée
FAG : flux alcalin global
GFAAS : spectrophotométrie d'absorption atomique en four de graphite
GIME : mini-électrode intégrée dans le gel
GM : gradient multiple
GPS : Système mondial de localisation
GR : gradient radial
GS : gradient simple
HALW : eau de laboratoire à dureté ajustée
HFPLM : perméation liquide par membrane à fibres creuses
ICP-AES : spectrométrie d'émission atomique
ICP-MS : spectrométrie de masse à source à plasma inductif
IGS : indice gonadosomatique
IHS : indice hépatosomatique
IMW : Initiative minière de Whitehorse
INAA : analyse par activation neutronique instrumentale
INRS : Institut national de la recherche scientifique
IRST : Initiative de recherche sur les substances toxiques
ISM : indice somatique mantélique
ISO/CEI : Organisation internationale de normalisation/Commission électrotechnique internationale
JA : jeunes de l'année
L.D. : limite de détection
LB : ligand biotique
LDM : limite de détection de la méthode
LIA : limite inférieure d’avertissement
LIC : limite inférieure de contrôle
LPL : niveau pratique le plus bas
LSA : limite supérieure d’avertissement
LSC : limite supérieure de contrôle
MDDEP : ministère du Développement durable, de l’Environnement et des Parcs du Québec
MEB : microscopie électronique à balayage
MEO : ministère de l'Environnement de l'Ontario
MES : métaux extraits simultanément
MG-CI25 : moyenne géométrique de la CI25
MLB : modèle du ligand biotique
MON : matière organique naturelle
MRE : matériau de référence étalon
MRX : microanalyse aux rayons X
MT : métallothionéine
NABS : North American Benthological Society
NAMC : North American Metals Council
OCDE : Organisation de coopération et de développement économiques
OFM : oxygénase à fonction mixte
OMS : Organisation mondiale de la Santé
OQD : objectifs de qualité des données
PAF : Plan d'action du Fraser
PHAE : poids humide de l'animal entier
PRF : point de rejet final
Programme AETE : Programme d'évaluation des techniques de mesure d'impact en milieu aquatique
R2 : coefficient de variation
RCBA : Réseau canadien de biosurveillance aquatique
RDC : recherche des causes
RDS : recherche de solutions
réf. : référence
REFPP : Règlement sur les effluents des fabriques de pâtes et papiers
REMM : Règlement sur les effluents des mines de métaux
RQE : recommandations pour la qualité de l'eau
SC : sommes des carrés
SCE : seuil critique d'effet
SETAC : Society of Environmental Toxicology and Chemistry
SGIL : système de gestion de l'information des laboratoires
SHC : saumure hautement concentrée
SIMS : spectrométrie de masse à émission ionique secondaire
SITDR : Système informatique de transmission de données réglementaires
SM : spectrométrie de masse
SOP : procédure normalisée d'exploitation
SPE : Service de la protection de l'environnement d'Environnement Canada
TIE : évaluation de données sur la toxicité
TIE : évaluation de la réduction de la toxicité
TL25 : temps létal 25 %
TL50 : temps létal 50 %
TQS : triade sur la qualité des sédiments
TRT : taux de rejet toxique
UE : Union européenne
USEPA : Environmental Protection Agency des États-Unis
UV : ultraviolet
V : variance
WEF : Water Environment Federation
XAFS : spectrométrie à fluorescence X
XPS : spectroscopie de photoélectrons XPS
XRF : fluorescence X
Retournez à la table des matières
Table des matières
Chapitre 3 : Effets sur le poisson et les ressources halieutiques
Chapitre 4 : Effets sur l’habitat du poisson : étude de la communauté d'invertébrés benthiques
Chapitre 5 : Caractérisation de l’effluent et suivi de la qualité de l’eau
Chapitre 6 : Essais de toxicité sublétale
Chapitre 7 : Suivi des sédiments
Chapitre 8 : évaluation et interprétation des données
Chapitre 9 : Autres méthodes de suivi
Chapitre 10 : Gestion de l'information et rapports d'interprétation
Chapitre 11 : Participation du public aux ESEE des mines des métaux
Chapitre 12 : Recherche des causes
Chapitre 13 : Rapport sur les données historiques
Avertissement
Le présent document vise à fournir une orientation aux mines sur la façon de répondre aux exigences réglementaires de l'étude de suivi des effets sur l'environnement dans le cadre du Règlement sur les effluents des mines de métaux. Il ne s'agit pas d'une interprétation juridique du Règlement. Pour ce qui est du Règlement, veuillez le consulter ici.
Remerciements
Le Bureau national des études de suivi des effets sur l'environnement souhaite remercier les nombreuses personnes qui ont contribué à la mise à jour du présent document d'orientation technique. Son contenu a été sensiblement amélioré grâce à la contribution des membres de l’Équipe nationale des études de suivi des effets sur l’environnement et du Comité scientifique. La qualité du document a été nettement améliorée grâce au travail de l’équipe de révision d’Environnement Canada et des membres du Bureau national des études de suivi des effets sur l’environnement.
Retournez à la table des matières
Chapitre 1
1. Aperçu du Programme d'études de suivi des effets sur l'environnement des mines de métaux
1.2 Règlement sur les effluents des mines de métaux
1.3 Description des études de suivi des effets sur l'environnement
- 1.3.1 Études de suivi de l'effluent et de la qualité de l'eau
- 1.3.2 Études de suivi biologique
1.4 Étapes de déroulement et de compte rendu d'une étude de suivi des effets sur l'environnement
- 1.4.1 Déroulement de la caractérisation de l'effluent, des essais de toxicité sublétale et de la surveillance de la qualité de l'eau et présentation des résultats
- 1.4.2 Présentation du plan d'étude
- 1.4.3 Déroulement de l'étude de suivi biologique
- 1.4.4 Déroulement de l'évaluation des données
- 1.4.5 Présentation du rapport d'interprétation
- 1.6.1 Seuils critiques d'effet
- 1.6.2 Ampleur des effets confirmés
- 1.6.3 Processus de décision relatif au Programme d’études de suivi des effets sur l'environnement des mines de métaux
Liste des tableaux
- Tableau 1-1 : Indicateurs d'effet et critères d'effet pour le suivi de la population de poissons
- Tableau 1-2 : Indicateurs d'effet et critères d'effet pour le suivi de la communauté d'invertébrés benthiques
- Tableau 1-3 : Seuils critiques d'effet pour le Programme d’études de suivi des effets sur l'environnement des mines de métaux
- Tableau 1-4 : Évaluation de l'ampleur des effets confirmés dans deux phases d'étude consécutives
Liste des figures
1. Aperçu du Programme d'études de suivi des effets sur l'environnement des mines de métaux
1.1 Objet du guide
En 1996, Environnement Canada a entrepris une évaluation des effets de l’exploitation minière sur le milieu aquatique au Canada (AQUAMIN, 19961), qui a fourni des recommandations relativement à l'examen et aux modifications du Règlement sur les effluents liquides des mines de métaux (actuellement intitulé Règlement sur les effluents des mines de métaux [REMM]) et à l’élaboration d’un programme national de suivi des effets sur l'environnement pour les mines de métaux. Le REMM, en vertu de la Loi sur les pêches, oblige les mines de métaux à mener des études de suivi des effets sur l'environnement comme condition régissant l’autorisation de rejeter un effluent (REMM, partie 2, article 7). L'étude de suivi des effets sur l'environnement (ESEE) est un outil scientifique de mesure du rendement qui permet d'évaluer la pertinence du règlement. Bien que le présent document d'orientation ne soit pas un document juridique, il vise à fournir une orientation aux mines leur permettant de respecter les exigences applicables à l'ESEE et de mener des études à cet égard. Pour ce qui est des exigences réglementaires applicables à l'ESEE, veuillez vous reporter à l'article 7, annexe 5 du REMM, qui se trouve sur le site Web. Le présent document d'orientation remplace la version publiée en 2002.
Il est prescrit, dans le REMM, que des ESEE soient réalisées selon des méthodes documentées et validées, et que leurs résultats soient évalués et présentés conformément aux normes généralement reconnues régissant les bonnes pratiques scientifiques (REMM, partie 2, paragraphe 7(3)). Les méthodes recommandées dans le présent document d'orientation s'appuient sur les normes généralement reconnues régissant les bonnes pratiques scientifiques et elles tiennent compte des améliorations découlant de l'expérience acquise dans l'exécution du programme, des recommandations de groupes de travail multidisciplinaires et des initiatives de recherche externes pour répondre aux besoins relatifs aux ESEE. De même, l'Équipe d'examen de l’ESEE des mines de métaux, qui comprenait un groupe d'experts du gouvernement, de l'industrie et des groupes environnementaux et autochtones, a été mise sur pied par Environnement Canada dans le but d'examiner les expériences et les résultats du Programme d'ESEE à partir de la première phase d'ESEE des mines de métaux et de fournir des recommandations à l'intention d'Environnement Canada visant à améliorer le programme. Le rapport final, intitulé Rapport de l’Équipe d’examen de l’Étude de suivi des effets sur l’environnement des mines de métaux (août 2007), est disponible sur le site Web de l’ESEE : www.ec.gc.ca/eem. Ce document reflète également les changements relatifs aux exigences applicables à l’ESEE établis par les modifications apportées en 2006 et en 2012 au REMM.
Il est important de faire remarquer que les méthodes présentées dans ce document d'orientation ne constituent pas une liste exhaustive des moyens possibles de mener une ESEE. Il est tenu pour acquis que chaque directeur d'étude possède les connaissances nécessaires pour appliquer ces recommandations en s'appuyant sur les normes généralement reconnues régissant les bonnes pratiques scientifiques, et qu'il doit être capable de déterminer les conditions particulières justifiant la modification des plans d'étude génériques tout en assurant le respect des exigences réglementaires. Pour consulter l'analyse scientifique sur des principes scientifiques éprouvés, consultez le chapitre 12 sur la recherche des causes. On encourage les mines à communiquer avec les coordonnateurs régionaux2 des ESEE d'Environnement Canada pour les questions relatives à l'ESEE.
Ce premier chapitre fournit un aperçu du Programme d'ESEE des mines de métaux, y compris un arbre décisionnel pour aider les mines à choisir le cheminement approprié, selon leur propre situation, au fur et à mesure de leur avancement dans le Programme d'ESEE. Des renseignements et des documents supplémentaires sont disponibles sur le site Web de l'ESEE.
1.2 Règlement sur les effluents des mines de métaux
Le REMM autorise les mines à rejeter leurs effluents si leur pH est compris dans un intervalle défini, si les concentrations de substances nocives indiquées dans le REMM contenues dans les effluents ne dépassent pas les limites autorisées, et s'il est prouvé que les effluents n'entraînent pas la mort (létalité aigüe) de la truite arc-en-ciel. Ces limites de rejet ont été établies comme normes nationales minimum en s'appuyant sur les technologies les plus rentables au moment de la promulgation du REMM. Afin de déterminer la pertinence de la réglementation sur les effluents visant à protéger le milieu aquatique, le REMM inclut les exigences applicables à l'ESEE pour évaluer les effets potentiels des effluents sur les poissons, sur leur habitat et sur l'exploitation des ressources halieutiques.
Le Règlement modifiant le Règlement sur les effluents des mines de métaux a été publié dans la Partie II de la Gazette du Canada, en octobre 2006. Le but de ces modifications était de clarifier les exigences réglementaires en traitant les questions liées à l’interprétation et à la clarté du texte réglementaire, qui sont survenues lors de la mise en œuvre du règlement. Des modifications supplémentaires ont également été apportées ultérieurement à plusieurs reprises; toutefois, celles-ci ne concernent pas les exigences applicables à l'ESEE.
D'autres modifications au REMM ont été publiées dans la Partie II de la Gazette du Canada, en février 2012. Les changements suivants ont été apportés afin d'améliorer les dispositions relatives à l'ESEE du REMM :
- La définition d'un « effet sur les tissus de poissons » a été modifiée afin d'être conforme aux lignes directrices de Santé Canada sur la consommation de poissons et pour préciser que la concentration totale en mercure contenue dans les tissus de poissons de la zone exposée doit être statistiquement différente de celle contenue dans les tissus de poissons de la zone de référence et plus élevée que cette dernière;
- ajout de « sélénium » et « conductivité électrique » à la liste des paramètres requis pour la caractérisation de l'effluent et la surveillance de la qualité de l'eau;
- exemption pour les mines, autres que les mines d'uranium, du suivi du radium 226 dans le cadre de la surveillance de la qualité de l'eau, si les résultats de dix essais consécutifs montrent que les concentrations de radium 226 sont inférieures à 10 % de la concentration moyenne mensuelle autorisée (voir le paragraphe 13(2) du règlement);
- modification des délais de présentation des rapports d’interprétation pour les mines qui ont des effets sur la population de poissons, sur les tissus de poissons et sur la communauté d'invertébrés benthiques, de 24 à 36 mois;
- modification des délais de présentation des rapports d’interprétation pour l'ampleur et la portée géographique des effets et pour la recherche des causes des effets, de 24 à 36 mois;
- changements mineurs de formulation afin d'assurer la cohérence de l'annexe 5.
1.3 Description des études de suivi des effets sur l'environnement
Les études de suivi des effets sur l'environnement (ESEE) sont planifiées pour détecter et mesurer les changements dans les écosystèmes aquatiques (c'est-à-dire, les milieux récepteurs). Le Programme d'ESEE pour les mines de métaux est un système itératif comportant des phases de suivi et d'interprétation, qui sert à déterminer l'efficacité des mesures de gestion environnementale par l'évaluation des effets des effluents sur les poissons, sur leur habitat et sur l'exploitation des ressources halieutiques par les humains.
L'ESEE va au-delà d'une simple mesure au point de rejet des concentrations de produits chimiques dans les effluents et vise à examiner directement l'efficacité des mesures de protection de l'environnement dans les écosystèmes aquatiques. Les effets à long terme sont évalués au cours de phases cycliques de suivi et d'interprétation qui sont planifiées pour examiner les impacts sur les mêmes paramètres aux mêmes emplacements. De cette manière, on obtient à la fois une caractérisation spatiale et temporelle des effets possibles pour évaluer les changements survenus dans les milieux récepteurs.
Les ESEE consistent en ce qui suit :
- des études de suivi de l'effluent et de la qualité de l'eau comprenant une caractérisation de l'effluent, des essais de toxicité sublétale et un suivi de la qualité de l'eau (REMM, annexe 5, partie 1);
- des études de suivi biologique dans le milieu aquatique récepteur pour déterminer si l'effluent de la mine a un effet sur les poissons, sur leur habitat ou sur l'exploitation des ressources halieutiques (REMM, annexe 5, partie 2).
1.3.1 Études de suivi de l'effluent et de la qualité de l'eau
1.3.1.1 Caractérisation de l’effluent
La caractérisation de l'effluent s’effectue par l'analyse d’un échantillon d’effluent et par l'enregistrement de sa dureté, de sa conductivité électrique, de son alcalinité et des concentrations d’aluminium, de cadmium, de fer, de molybdène, de sélénium, d’ammoniac et de nitrate (REMM, annexe 5, paragraphe 4(1)). La concentration de mercure contenue dans l'effluent est également analysée et enregistrée, mais son analyse et son enregistrement peuvent être interrompus si sa concentration est inférieure à 0,10 µg/L dans 12 échantillons consécutifs (REMM, annexe 5, paragraphe 4(3)). Des directives concernant la caractérisation de l'effluent sont incluses au chapitre 5. D'autres paramètres pertinents pour l'ESEE sont également analysés dans le cadre de l'annexe 4 du REMM, soit: l'arsenic, le cuivre, le cyanure, le plomb, le nickel, le zinc, les matières solides totales en suspension et le radium 226.
1.3.1.2 Essais de toxicité sublétale
Les essais de toxicité sublétale sont menés sur l'effluent au point de rejet final de la mine ayant le plus grand risque de répercussions néfastes sur l’environnement (REMM, annexe 5, paragraphe 5(2)). Ces essais permettent de surveiller la qualité de l'effluent en mesurant les paramètres de survie, de croissance et/ou de reproduction des organismes marins ou d'eau douce dans un milieu de laboratoire contrôlé. Lorsque l'effluent est rejeté dans l’eau de mer ou l’eau d’estuaire, les essais de toxicité sublétale sont menés sur une espèce de poisson, une espèce d’invertébré et une espèce d’algue. Lorsque l'effluent est rejeté dans l'eau douce, les essais de toxicité sublétale sont menés sur une espèce de poisson, une espèce d’invertébré, une espèce de plante et une espèce d’algue (REMM, annexe 5, paragraphe 5(1)). Des directives permettant de déterminer le point de rejet final approprié pour l'échantillonnage peuvent être consultées au chapitre 2. Des lignes directrices concernant les essais de toxicité sublétale sont incluses au chapitre 6.
1.3.1.3 Suivi de la qualité de l'eau
Des échantillons pour le suivi de la qualité de l'eau sont prélevés dans la zone exposée autour du point d'entrée de l'effluent dans l'eau à chaque point de rejet final et dans les zones de référence connexes ainsi que dans les zones d'échantillonnage sélectionnées dans le cadre de l'étude de suivi biologique (REMM, annexe 5, paragraphe 7(1)). La température de l'eau et les concentrations d'oxygène dissous sont enregistrées pour tous les échantillons. Comme pour la caractérisation de l'effluent, les concentrations d’aluminium, de cadmium, de fer, de molybdène, de sélénium, d’ammoniac et de nitrate sont mesurées et enregistrées lors du suivi de la qualité de l’eau. La concentration de mercure dans les échantillons de suivi de la qualité de l'eau est également analysée et enregistrée si cela est requis pour la caractérisation de l'effluent (REMM, annexe 5, paragraphe 4(3)). Lorsque l'effluent est rejeté dans l'eau douce, son pH, sa dureté, sa conductivité électrique et son alcalinité sont enregistrés. Lorsque l'effluent est rejeté dans l’eau d’estuaire, son pH, sa dureté, sa conductivité électrique, son alcalinité et sa salinité sont enregistrés. Lorsque l'effluent est rejeté dans l’eau de mer, sa salinité est enregistrée. Les concentrations des substances nocives énumérées à l'annexe 4 sont également enregistrées : l'arsenic, le cuivre, le cyanure (s'ils sont utilisés comme réactif de procédé), le plomb, le nickel, le zinc, les matières solides totales en suspension et le radium 226 (à moins que les conditions énoncées au paragraphe 13(2) du règlement soient respectées) (REMM, annexe 5, paragraphe 7(1)d)). Des directives concernant la surveillance de la qualité de l'eau peuvent être consultées au chapitre 5.
1.3.2 Études de suivi biologique
Les études de suivi biologique sont menées selon des phases de 36 ou 72 mois. Les exigences de chaque étude dépendent des résultats des études menées lors des phases précédentes. Les études de suivi biologique pour évaluer les effets sont décrites dans la section 1.3.2.3 et les études de suivi biologique pour examiner les effets sont décrites dans la section 1.3.2.4.
Pour évaluer les effets, les études de suivi biologique sont menées sur trois volets (REMM, annexe 5, article 9) :
- une étude sur la population de poissons pour évaluer les effets sur la santé des poissons;
- une étude sur la communauté d'invertébrés benthiques pour évaluer l'habitat des poissons ou l'alimentation des poissons;
- une étude sur la concentration de mercure dans les tissus de poissons pour évaluer l’exploitabilité des ressources halieutiques par les humains, en matière de consommation de poissons.
Pour examiner les effets, les études de suivi biologique sont menées dans le but de :
- évaluer l'ampleur et la portée géographique des effets;
- déterminer les causes des effets.
1.3.2.1 Détermination et confirmation des effets
Les études concernant la population de poissons, les tissus de poissons et la communauté d'invertébrés benthiques sont menées à la fois dans une zone exposée et dans une zone de référence. La zone exposée désigne les eaux où vivent des poissons et l’habitat du poisson qui sont exposés à un effluent,et la zone de référence s’entend des eaux où vivent des poissons et où se trouve un habitat du poissons, qui ne sont pas exposées à un effluent et qui présentent, dans la mesure du possible, les caractéristiques les plus semblables à celles de la zone exposée (REMM, annexe 5, article 1).
Le REMM définit les effets sur la population de poissons, sur les tissus de poissons ainsi que sur la communauté d'invertébrés benthiques (REMM, annexe 5, article 1) et il prescrit en outre l’évaluation des données requise pour des indicateurs précis (REMM, annexe 5, article 16). Un « effet » sur la population de poissons ou sur la communauté d'invertébrés benthiques est défini comme une différence statistique entre les données collectées dans la zone exposée et celles collectées dans la zone de référence ou entre les données collectées dans les zones d'échantillonnage d'une zone exposée présentant un gradient décroissant de concentrations d’un effluent à des distances de plus en plus importantes du point de rejet de l'effluent. Un effet sur les tissus de poissons fait référence à des concentrations totales de mercure supérieures à 0,5 microgrammes par gramme (µg/g), poids humide, dans les tissus des poissons échantillonnés dans la zone exposée et statistiquement différentes et plus élevées que les concentrations totales de mercure contenues dans les tissus des poissons échantillonnés dans la zone de référence. Le chapitre 8 apporte des renseignements sur la réalisation d'analyses statistiques à partir des données de l'ESEE.
Les données collectées sur des critères d'effet précis (Tableaux 1-1 et 1-2) sont évaluées pour déterminer s'il y a une différence statistique afin d’établir s’il y a des effets sur les indicateurs. Pour confirmer que les effets observés ne sont pas des phénomènes parasites (ou dus à des facteurs de confusion) et qu'ils sont bel et bien dus aux mines, les études de suivi biologique pour évaluer les effets sont répétées au cours d'une phase ultérieure de trois ans. Si on observe le même type d'effet (même critère dans la même direction à partir du point zéro par rapport aux niveaux de référence) sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques dans deux phases consécutives d'étude, cet effet est considéré comme confirmé (REMM, annexe 5, article 19). La confirmation d'un effet relativement aux critères pour le poisson ne se limite pas nécessairement aux poissons d'une même espèce et du même sexe, à moins que les conditions propres à un emplacement justifient une approche différente.
Lorsque des effets sont confirmés pour un ou plusieurs volets (la population de poissons, les tissus de poissons, la communauté d'invertébrés benthiques), la mine doit examiner ces effets au cours de phases ultérieures (section 1.3.2.3). Tous les effets confirmés doivent faire l'objet d'une étude. Si aucun effet n'est confirmé pour les trois volets, la fréquence du suivi biologique peut être allégée (REMM, annexe 5, alinéa 22(2)b)).
Il peut être difficile d'attribuer la cause d'un effet à l'effluent d'une mine dans certaines circonstances. Environnement Canada recommande, dans le cas où une première étude détermine un effet qui ne peut être attribué avec certitude à l'effluent d'une mine, que la deuxième étude visant à confirmer cet effet soit planifiée de telle manière à maximiser le degré de confiance quant à savoir si l'effet est dû ou non à l'effluent d'une mine. Des ajustements possibles du plan d'étude pour éliminer les facteurs de confusion sont décrits dans d'autres chapitres; il pourrait s'agir, entre autres, d'accroître les efforts d'échantillonnage à la fois dans la zone de référence et dans la zone exposée, d'agrandir ou de modifier les zones d'échantillonnage ou d’utiliser d’autres types de méthodes de suivi portant, par exemple, sur les mésocosmes ou sur les bivalves en cage.
1.3.2.2 Données historiques
Il se peut que les mines aient déjà effectué des études de suivi biologique avant de devenir assujetties au REMM. Ces études peuvent être utilisées dans le cadre du Programme d'ESEE si elles permettent de déterminer si l'effluent avait un effet sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques. Toutefois, si l'exploitation minière ou les conditions environnementales ont changé ou si un événement pouvant modifier les effets biologiques s'est produit après la réalisation des études de suivi antérieures, alors les données historiques devraient être utilisées avec prudence pour interpréter les effets observés à l'heure actuelle. Les résultats des études de suivi biologique antérieures doivent être soumis à l'agent d'autorisation3 accompagnés d'un rapport contenant les données scientifiques appuyant les résultats, au plus tard douze mois après la date où la mine est devenue assujettie au Règlement (REMM, annexe 5, alinéa 14b)). Se reporter aux sections 1.4.2 et 1.4.5 pour ce qui est des exigences relatives aux délais de présentation du plan d'étude et des rapports d’interprétation pour les mines ayant recours aux données historiques. De plus amples détails sur les données historiques sont fournis au chapitre 13.
1.3.2.3 Études de suivi biologique pour évaluer les effets
Pour évaluer les effets, les études de suivi biologique sont menées sur les trois volets : la population de poissons, les tissus de poissons (concentration de mercure) et la communauté d'invertébrés benthiques.
1.3.2.3.1 Suivi de la population de poissons
Un suivi de la population de poissons (chapitre 3) permet de mesurer des indicateurs de la santé de la population de poissons dans la zone exposée et dans la zone de référence, ou le long d'un gradient d'exposition, afin de déterminer si l'effluent de la mine a un effet sur les poissons. Un suivi de la population de poissons est nécessaire si la concentration de l'effluent dans la zone exposée est supérieure à 1 % en deçà 250 mètres du point de rejet final (REMM, annexe 5, alinéa 9b)).
Le REMM définit les indicateurs d'effet pour le suivi de la population de poissons comme étant la croissance des poissons, leur reproduction, leur condition et leur survie (REMM, annexe 5, alinéa 16a)(i)). Lors du suivi standard de la population de poissons adultes, il est recommandé de prélever des mâles et des femelles adultes de deux espèces sentinelles. Les données obtenues sur les critères d'effet précis présentés dans le tableau 1-1 sont évaluées pour déterminer s'il y a une différence statistique en ce qui concerne les indicateurs d'effet.
| Indicateurs d'effet | Critères d'effet |
|---|---|
| Croissance (consommation d'énergie) | Taille selon l'âge (poids corporel en fonction de l'âge) |
| Reproduction (consommation d'énergie) | Taille relative des gonades (poids des gonades par rapport au poids corporel) |
| Condition (emmagasinage d'énergie) | Condition physique (poids corporel par rapport à la longueur) Taille relative du foie (poids du foie par rapport au poids corporel) |
| Survie | Âge |
Bien qu'il soit recommandé de toujours mener un suivi standard de la population de poissons, d'autres plans d'étude et méthodes modifiées comme une étude non létale des poissons (chapitre 3) ou des méthodes de rechange (chapitre 9) peuvent être envisagés dans les cas où le suivi standard ne serait ni efficace ni pratique.
1.3.2.3.2 Suivi de la communauté d'invertébrés benthiques
Les mines doivent mener un suivi de la communauté d'invertébrés benthiques (chapitre 4) pour déterminer si leurs effluents ont un effet sur l'habitat du poisson. Des invertébrés benthiques sont prélevés pour déterminer s'il y a des différences entre les indicateurs d'effet dans la zone exposée et dans la zone de référence ou le long d'un gradient de concentration de l'effluent. Les données obtenues sur les critères d'effet précis présentés dans le tableau 1-2 sont évaluées pour déterminer s'il y a une différence statistique en ce qui concerne les indicateurs d'effet (annexe 5, sous-alinéa 16a)(iii)). Consultez le chapitre 4 pour obtenir les définitions des critères pour la communauté d'invertébrés benthiques et des renseignements supplémentaires à leur sujet.
| Indicateurs d'effet | Critères d'effet |
|---|---|
| Densité totale des invertébrés benthiques | Nombre d'animaux par surface unitaire |
| Indice de régularité | Indice de régularité de Simpson |
| Richesse des taxons | Nombre de taxons |
| Indice de similarité | Indice de Bray-Curtis |
Si les plans d'étude proposés au chapitre 4 ne sont ni efficaces ni pratiques, une méthode de suivi de rechange peut être envisagée (chapitre 9).
1.3.2.3.3 Suivi des tissus de poissons
Un suivi des tissus de poissons (chapitre 3, section 3.11) est mené pour évaluer si le mercure provenant des effluents des mines a un effet sur l'exploitation des ressources halieutiques. Un suivi des tissus de poissons est nécessaire si, au cours de la caractérisation de l'effluent, la concentration totale de mercure dans l'effluent est supérieure ou égale à 0,10 µg/L (REMM, annexe 5, alinéa 9c)).
1.3.2.4 Études de suivi biologique pour examiner les effets
Pour examiner les effets, les mines doivent évaluer l'ampleur et la portée géographique de tous les effets confirmés et chercher à établir leurs causes.
1.3.2.4.1 Ampleur et portée géographique
Lorsque les résultats des deux études de suivi biologique précédentes indiquent le même type d'effet (même critère dans la même direction à partir du point zéro) sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques, une évaluation de l'ampleur et de la portée géographique de l'effet est requise (REMM, annexe 5, alinéa 9(1)d)). L'ampleur et la portée géographique doivent être évaluées pour tous les effets confirmés. L'évaluation de l'ampleur et de la portée géographique pourrait exiger des mesures de suivi supplémentaires afin d'étendre la zone d'échantillonnage plus en aval, ou elle pourrait être fondée sur des renseignements déjà existants dans des études précédentes. Des directives concernant les études sur l'ampleur et la portée géographique peuvent être consultées aux chapitres 2, 4 et 7.
1.3.2.4.2 Recherche des causes
Si les résultats de la dernière étude de suivi biologique indiquent l'ampleur et la portée géographique d'un effet sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques, il faut entreprendre une étude de recherche des causes (REMM, annexe 5, paragraphe 19(2)). Le but d'une étude de recherche des causes est de déterminer la cause de chaque effet confirmé. Des lignes directrices sur les études de recherche des causes sont incluses au chapitre 12.
1.4 Étapes de déroulement et de compte rendu d'une étude de suivi des effets sur l'environnement
Le déroulement et le compte rendu d'une ESEE, conformément au REMM comprennent les étapes clés suivantes :
- le déroulement de la caractérisation de l'effluent, des essais de toxicité sublétale et de la surveillance de la qualité de l'eau et la présentation des résultats;
- la présentation du plan d'étude;
- le déroulement de l'étude de suivi biologique;
- le déroulement de l'évaluation des données;
- la présentation du rapport d'interprétation.
1.4.1 Déroulement de la caractérisation de l'effluent, des essais de toxicité sublétale et de la surveillance de la qualité de l'eau et présentation des résultats
La caractérisation de l'effluent est effectuée quatre fois par année civile et à au moins un mois d’intervalle, la première caractérisation se faisant au plus tard six mois suivant la date à laquelle la mine devient assujettie au REMM (annexe 5, paragraphe 4(2)). La caractérisation de l'effluent est effectuée sur une portion aliquote de l’échantillon d’effluent prélevé pour l'analyse des substances nocives en application de l'annexe 4 du présent règlement. Reportez-vous au chapitre 5 pour obtenir de plus amples renseignements sur la caractérisation de l'effluent.
Les essais de toxicité sublétale sont effectués deux fois par année civile pendant trois ans, et une fois par année après la troisième année. Les essais de toxicité sublétale sont effectués sur une portion aliquote de l’échantillon d’effluent prélevé pour l'analyse des substances nocives en application de l'annexe 4 du présent règlement. Les premiers essais doivent être menés au plus tard six mois suivant la date à laquelle la mine devient assujettie au présent règlement (REMM, annexe 5, paragraphe 6(1)). Les essais de toxicité sublétale peuvent être effectués une fois par année civile si les résultats de six essais de toxicité sublétale effectués après le 31 décembre 1997 sur une espèce de poisson, une espèce d’invertébré et une espèce de plante aquatique ou d’algue sont présentés à l’agent d’autorisation au plus tard six mois suivant la date à laquelle la mine devient assujettie au présent règlement (REMM, annexe 5, paragraphe 6(2)). Reportez-vous au chapitre 6 pour obtenir de plus amples renseignements sur les essais de toxicité sublétale.
La surveillance de la qualité de l'eau est effectuée au plus tard six mois suivant la date à laquelle la mine devient assujettie au présent règlement, quatre fois par année civile et à au moins un mois d’intervalle sur les échantillons d’eau prélevés lorsque la mine rejette l’effluent. La surveillance de la qualité de l'eau est également effectuée sur les échantillons d’eau prélevés en même temps que les études de suivi biologique (REMM, annexe 5, paragraphe 7(2)). Reportez-vous au chapitre 5 pour obtenir de plus amples renseignements sur la surveillance de la qualité de l'eau.
Un rapport annuel sur les études de suivi de l’effluent et de la qualité de l’eau effectuées au cours d’une année civile est présenté à l’agent d’autorisation au plus tard le 31 mars de l'année suivante (REMM, annexe 5, article 8). Il est possible de répondre à la plupart des exigences annuelles de présentation des études de suivi de l’effluent et de la qualité de l’eau en soumettant les résultats des données électroniquement à Environnement Canada au moyen du « Système informatique de transmission de données réglementaires » (SITDR) accessible depuis le site Web suivant : https://www.riss-sitdr.ec.gc.ca/riss/Global/Index.aspx. Pour les exigences de présentation qui ne sont pas étayées par le SITDR, une copie papier doit être présentée à Environnement Canada au plus tard le 31 mars de l'année suivante. Ces exigences comprennent les méthodes utilisées pour effectuer la caractérisation de l'effluent, les essais de toxicité sublétale et la surveillance de la qualité de l'eau, ainsi que les mesures d'assurance et de contrôle de la qualité prises et les données relatives à la mise en œuvre de ces mesures.
1.4.2 Présentation du plan d'étude
Le plan d'étude contient une description du déroulement de l'étude de suivi biologique afin de répondre aux exigences réglementaires (REMM, annexe 5, articles 10 et 19). Le présent document d'orientation se veut un point de départ pour les plans d'étude et permet une certaine souplesse dans la conception des études afin de tenir compte des besoins propres à un site. Plusieurs exemples de plans d'étude sont présentés au chapitre 4 (voir également les chapitres 2, 3, 9 et 12 pour obtenir des renseignements sur les plans d'étude). Lorsque plusieurs mines rejettent leurs effluents dans le même bassin versant, on encourage les études de suivi des effets sur l’environnement conjointes, lorsque cela est possible.
Le premier plan d'étude est présenté au plus tard 12 mois suivant la date à laquelle la mine devient assujettie au présent règlement (REMM, annexe 5, alinéa 14a)) ou au plus tard 24 mois suivant la date à laquelle la mine devient assujettie au REMM pour les mines présentant des données historiques (REMM, annexe 5, alinéa 14b)). Le plan d'étude pour la première et deuxième étude de suivi biologique ou pour toute étude de suivi biologique subséquente est présenté à l’agent d’autorisation au moins six mois avant le début de l’étude (REMM, annexe 5, paragraphes 15(1) et 19(1)). Lorsque le propriétaire ou l’exploitant d’une mine a présenté un avis de fermeture de sa mine, le plan d’étude final est présenté au plus tard six mois suivant la date de présentation de l’avis informant de l'intention de la faire reconnaître comme une mine fermée reconnue (REMM, paragraphe 23(1)).
Une mine pourrait mener différents types d'études en même temps, telles qu'une étude standard sur la population de poissons et une étude sur l'ampleur et la portée géographique pour la communauté d'invertébrés benthiques. Le plan d'étude décrirait alors le déroulement de ces deux études.
Les renseignements présentés dans le plan d'étude varient en fonction du type d'étude de suivi biologique à mener.
1.4.2.1 Plan d'une étude de suivi biologique pour évaluer les effets
Lorsque les effets n'ont pas été évalués ou confirmés, lorsque le dernier rapport d'interprétation indique la cause de l'effet ou lorsque les deux derniers rapports d'interprétation indiquent l'absence d'effet, les plans des études de suivi biologique doivent inclure ce qui suit (REMM, annexe 5, article 11; lignes directrices du chapitre 2) :
- une caractérisation du site décrivant la façon dont l’effluent se mélange dans la zone exposée, y compris une estimation de la concentration de l’effluent à 250 mètres du point de rejet final;
- une description des habitats dans les zones exposées et les zones de référence;
- le type de procédé de production utilisé et les pratiques de protection de l’environnement appliquées à la mine;
- un sommaire des exigences législatives fédérales, provinciales ou autres visant la mine et portant sur le suivi de l’effluent et de l’environnement;
- une description des facteurs anthropiques, naturels ou autres non liés à l’effluent étudié, mais dont on peut raisonnablement s’attendre à ce qu’ils contribuent à tout effet observé.
Les plans des études comprennent également les motifs scientifiques justifiant le choix des espèces de poissons, des zones d'échantillonnage, de la taille des échantillons, des périodes d'échantillonnage et des méthodes sur le terrain et en laboratoire ainsi que la méthode choisie pour déterminer si l'effluent a un effet sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques. Les plans des études doivent également comporter une description des mesures d'assurance et de contrôle de la qualité qui seront prises pour garantir la validité des données recueillies de même qu'un résumé des résultats des études de suivi biologique antérieures.
Les données historiques, lorsque disponibles, peuvent fournir des renseignements utiles pour la caractérisation du site et faciliter l'élaboration des plans des études de suivi des effets sur l'environnement, en utilisant les leçons apprises lors des études de suivi précédentes. Si des données historiques sont présentées, le premier plan d'étude doit inclure un résumé des résultats des études de suivi biologique menées avant que la mine ne devienne assujettie au règlement.
1.4.2.2 Plan d'une étude de suivi biologique pour examiner les effets
Si les résultats des deux études précédentes indiquent le même type d'effet (même critère dans la même direction à partir du point zéro par rapport aux niveaux de référence) sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques, le plan d’étude doit comprendre, en plus de l'information détaillée à la section 1.4.2.1, la description d’une ou de plusieurs zones d’échantillonnage supplémentaires dans la zone exposée qui doivent être utilisées pour évaluer l'ampleur et la portée géographique de l'effet (REMM, annexe 5, alinéa 19(1)d)).
Si les résultats de la dernière étude de suivi biologique indiquent l'ampleur et la portée géographique d'un effet, le plan d'étude doit comprendre la description détaillée des études sur le terrain et en laboratoire qui seront effectuées pour déterminer la cause de l'effet (REMM, annexe 5, paragraphe 19(2)).
1.4.3 Déroulement de l'étude de suivi biologique
L'étude de suivi biologique est menée conformément au plan d'étude présenté. Si pour des circonstances imprévues, le propriétaire ou l'exploitant de la mine ne peut pas suivre le plan d'étude, celui-ci doit aviser sans délai l'agent d'autorisation des circonstances l'obligeant à s'écarter du plan d'étude et des modalités modifiées de déroulement de l'étude (REMM, annexe 5, paragraphes 15(2) et 24(2)). On recommande au personnel ou aux experts-conseils en environnement de la mine d'informer également le coordonnateur régional des études de suivi des effets sur l’environnement d’Environnement Canada de tout écart par rapport au plan d'étude.
1.4.4 Déroulement de l'évaluation des données
Une fois l'étude sur le terrain terminée, une évaluation et une interprétation des données sont menées afin de déterminer si l'effluent de la mine a un ou plusieurs effets (REMM, annexe 5, article 16). L'évaluation et l'interprétation des données déterminent également les exigences futures en matière de suivi. Les analyses réalisées afin de déterminer s'il y a des effets sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques sont décrites au chapitre 8. L'évaluation des données pour les mines qui ont des effets confirmés donne lieu à une détermination de l’ampleur et de la portée géographique des effets et à une évaluation des causes de ces effets confirmés. Des lignes directrices sur les études de recherche des causes sont incluses au chapitre 12.
1.4.5 Présentation du rapport d'interprétation
Le premier rapport d'interprétation est présenté soit au plus tard 30 mois après la date à laquelle la mine devient assujettie au règlement soit au plus tard quarante-deux mois après la date à laquelle elle devient assujettie au Règlement, si la mine a soumis un rapport présentant des données de suivi biologique historiques (REMM, annexe 5, article 18).
Les rapports d'interprétation subséquents sont présentés 36 ou 72 mois après la date limite de présentation du dernier rapport d'interprétation, selon les résultats du rapport d'interprétation précédent.
Les données à l'appui de l'étude de suivi biologique sont présentées à Environnement Canada sous forme électronique selon le modèle fourni sur le site Web de l'ESEE (se reporter au chapitre 10 pour obtenir de plus amples renseignements).
Le Règlement sur les effluents des mines de métaux contient un aperçu des renseignements qui doivent figurer dans un rapport d'interprétation pour une étude de suivi biologique (REMM, annexe 5, articles 17, 21 et 25). Le chapitre 10 comprend une description plus détaillée des rapports d'interprétation. Une brève description des différents types de rapports d'interprétation est présentée ci-dessous.
1.4.5.1 Rapport d'interprétation des études de suivi biologique pour évaluer les effets
Un rapport d'interprétation des études de suivi biologique pour évaluer les effets contient, entre autres éléments, les résultats des études de suivi, les données brutes, les résultats des évaluations des données et l'indication de tout effet.
1.4.5.2 Rapport d'interprétation des études de suivi biologique pour examiner les effets
Si l'ampleur et la portée géographique d'un effet confirmé sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques ne sont pas connues, alors le rapport d'interprétation doit comprendre, entre autres éléments, les résultats d'une étude sur l'ampleur et la portée géographique. Si l’ampleur et la portée géographique de l’effet confirmé sont connues, mais que la cause de l'effet ne l'est pas, le rapport d'interprétation doit inclure une description de la cause de l'effet. Le rapport d'interprétation de RDC présente les résultats de l'étude et l'énoncé définissant la cause de l'effet sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques. Si la cause de l'effet n'a pas été déterminée, le rapport d'interprétation doit comprendre une explication de ce fait et une description des mesures qui devront être prises lors de la prochaine étude afin d'en déterminer la cause.
1.5 Mines fermées reconnues
Le propriétaire ou l’exploitant d’une mine qui a cessé de fonctionner, et qui a l'intention de la faire reconnaître comme une mine fermée reconnue, doit en aviser l’agent d’autorisation par écrit et doit maintenir la mine, durant une période continue de trois ans commençant à la date de réception de l’avis, à un taux de production inférieur à 10 % de sa capacité nominale. Une dernière étude de suivi biologique doit être menée durant cette période de trois ans (REMM, article 32). La version finale du plan d'étude doit être présentée à l'agent d'autorisation au plus tard six mois après la remise de l'avis de fermeture (REMM, annexe 5, article 23). La mine s'appuiera pour cette dernière phase de suivi sur les résultats de l'étude de suivi biologique antérieure. Le rapport d’interprétation final doit être présenté à l'agent d'autorisation au plus tard 36 mois suivant la date de remise de l’avis de fermeture de la mine (REMM, annexe 5, article 26). Les exigences relatives à la caractérisation de l'effluent, aux essais de toxicité sublétale et à la surveillance de la qualité de l'eau continuent de s'appliquer jusqu’à ce que la mine soit reconnue comme une mine fermée.
1.6 Détermination d'un cheminement dans le Programme d’études de suivi des effets sur l'environnement des mines de métaux
Le Programme d’ESEE pour les mines de métaux comporte des activités de suivi pour évaluer les effets, examiner les effets confirmés (ampleur et portée géographique et recherche des causes) et réévaluer les effets. Lorsqu’un effet est confirmé (c.-à-d. un même type d'effet dans deux études consécutives), la mine doit déterminer l'ampleur et la portée géographique de l'effet (REMM, annexe 5, alinéa 19(1)d)), puis examiner la cause de l'effet (REMM, annexe 5, paragraphe 19(2)).
1.6.1 Seuils critiques d'effet
Un seuil critique d'effet (SCE) constitue un seuil au-delà duquel un effet peut indiquer un risque plus élevé pour l'environnement. L'Équipe d'examen de l'ESEE des mines de métaux a recommandé que des seuils critiques d'effet soient établis pour chacun des critères d'effet de l'ESEE des mines de métaux à la suite de la deuxième évaluation nationale des données de l'ESEE des mines de métaux (Équipe d'examen de l'ESEE des mines de métaux, 2007).
Des seuils critiques d'effet pour les critères relatifs à la population de poissons et à la communauté d'invertébrés benthiques ont d'abord été élaborés pour le Programme d'ESEE dans le secteur des pâtes et papiers après que les données de cette étude aient révélé que la plupart des fabriques avaient observé un effet en ce qui a trait à au moins un des indicateurs d'effet. Une fois validés, ces seuils critiques d'effet ont été adoptés aux fins d'utilisation dans le Programme d'ESEE des mines de métaux (tableau 1-3).
| Critères d'effet pour le poisson | Seuil critique d’effet1 | Critères d'effet pour le benthos | Seuil critique d’effet1 |
|---|---|---|---|
| Poids selon l'âge2 | ± 25 % | Densité | ± 2 ET |
| Taille relative des gonades | ± 25 % | Indice de régularité de Simpson | ± 2 ET |
| Taille relative du foie | ± 25 % | Richesse des taxons | ± 2 ET |
| Condition | ± 10 % | Indice de Bray-Curtis | + 2 ET |
| Âge2 | ± 25 % |
1. Les différences relatives aux critères d'effet pour la population de poissons sont exprimées sous forme de pourcentage (%) d'écart par rapport à la moyenne de référence, alors que les différences relatives aux critères d'effet pour la communauté d'invertébrés benthiques sont exprimées sous forme de multiple de l'écart-type dans la zone de référence.
2. Les problèmes liés à la détermination de l'âge de certaines espèces de poissons doivent être examinés avant que les effets sur le poids selon l'âge et l'âge soient utilisés pour choisir un cheminement dans le Programme d'ESEE. Consultez le chapitre 3 pour obtenir des recommandations sur la détermination de l'âge.
1.6.2 Ampleur des effets confirmés
L'ampleur de chaque effet observé sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques peut être évaluée de manière plus poussée pour déterminer si l'ampleur d'un effet confirmé se situe à une valeur supérieure ou inférieure au seuil critique d'effet. Le tableau 1-4 décrit comment les effets confirmés dans deux études consécutives doivent être regroupés afin de déterminer si les effets confirmés se situent à une valeur supérieure ou inférieure au seuil critique d'effet.
| Effets confirmés à une valeur supérieure ou égale au seuil critique d'effet | Effets confirmés à une valeur inférieure au seuil critique d'effet |
|---|---|
| Les mêmes effets ont été observés à une valeur supérieure ou égale au seuil critique d’effet dans deux phases d'étude consécutives. | Les mêmes effets ont été observés à une valeur inférieure au seuil critique d’effet dans deux phases d'étude consécutives. |
| Les mêmes effets ont été observés dans deux phases d'étude consécutives, avec des effets à une valeur supérieure ou égale au seuil critique d’effet dans une phase et à une valeur inférieure au seuil critique d’effet dans l'autre phase. | Les mêmes effets ont été observés dans deux phases d'étude consécutives, avec des effets à une valeur supérieure ou égale au seuil critique d’effet dans une phase et à une valeur inférieure au seuil critique d’effet dans l'autre phase, si des renseignements pouvant expliquer le changement des effets observés sont fournis (p. ex. une amélioration du traitement de l'effluent). |
1.6.3 Processus de décision relatif au Programme d’études de suivi des effets sur l'environnement des mines de métaux
La figure 1-1 est un arbre décisionnel permettant aux mines de définir un cheminement approprié dans le Programme d’ESEE, compte tenu de leur propre situation. Les seuils critiques d'effet sont appliqués aux résultats de l'ESEE pour aider les mines à déterminer le niveau d'effort requis pour examiner les effets confirmés. La structure de l'arbre décisionnel s'appuie sur les exigences réglementaires du REMM, les dernières connaissances scientifiques et l'expérience et les connaissances acquises lors de la mise en œuvre du Programme d'ESEE.
Les connaissances propres au site ainsi que les données relatives à l'effluent et à la qualité de l’eau doivent être prises en considération avant de déterminer le cheminement d'une mine dans le Programme d'ESEE. Les effets confirmés pour les critères d'appui sont utilisés dans le cadre des évaluations propres au site pour appuyer les décisions relatives au cheminement à suivre (voir les chapitres 3 et 4 pour obtenir des renseignements sur les critères d'appui).
Les mines sont tenues de continuer à mener un suivi de l'effluent et de la qualité de l'eau et à présenter les résultats dans les délais prescrits par le REMM et tel que cela est indiqué à la section 1.4.1 du présent chapitre. Cette exigence est indépendante de l'échéance relative au déroulement des études de suivi biologique et à la présentation des rapports d’interprétation.
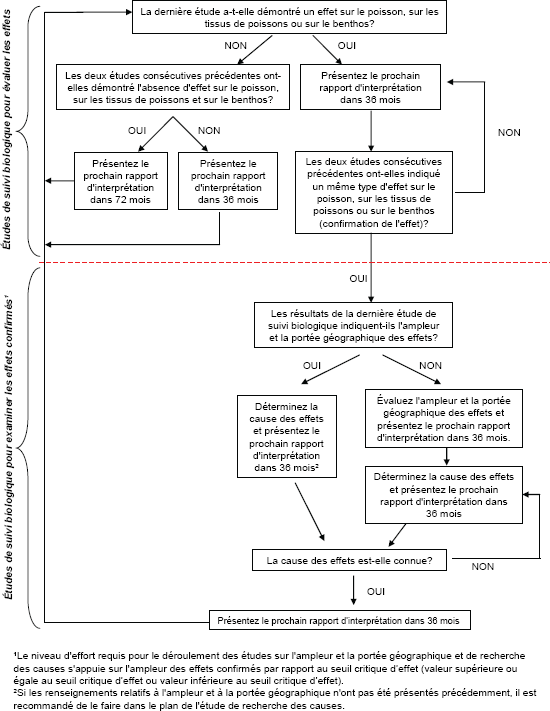
Figure 1-1 : Arbre décisionnel pour le Programme d’études de suivi des effets sur l'environnement des mines de métaux
Vous trouverez des informations détaillées ci-dessous.
La figure 1-1 est un diagramme illustrant le processus de décision à travers les différentes phases de suivi et l’échéancier des soumissions des rapports d’interprétation. La partie supérieure de l’arbre décisionnel comprend les études de suivi biologique pour évaluer les effets alors que la partie inférieure comprend les études de suivi biologique pour investiguer les effets confirmés. Selon la réponse aux questions dans le schéma, des flèches indiquent la prochaine question à poser. La suite de questions varie en fonction des réponses données aux questions précédentes.
1.6.3.1 Évaluer les effets
Le rapport d'interprétation de la deuxième étude de suivi biologique et de toutes les études de suivi biologique subséquentes est remis au plus tard 36 mois après la date d'échéance de présentation de l'étude de suivi biologique précédente, dans le cadre des scénarios suivants :
Aucun effet n'a été observé
- Les résultats d'une seule étude indiquent l'absence d'effet sur la population de poissons, sur les tissus de poissons et sur la communauté d'invertébrés benthiques (REMM, annexe 5, paragraphe 22(1)).
Des effets ont été observés
- Les résultats d'une seule étude indiquent un effet sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques (REMM, annexe 5, paragraphe 22(1)).
- Les résultats d'une seule étude indiquent un effet sur la population de poissons, sur les tissus de poissons et sur la communauté d'invertébrés benthiques (REMM, annexe 5, alinéa 22(2)a)).
Le rapport d'interprétation est présenté au plus tard soixante-douze mois après la date d'échéance de présentation du rapport d'interprétation de l'étude précédente, dans le cadre du scénario suivant :
Aucun effet n'a été confirmé
- Les résultats des deux dernières études de suivi biologique consécutives indiquent l'absence d'effet sur la population de poissons, sur les tissus de poissons et sur la communauté d'invertébrés benthiques (REMM, annexe 5, alinéa 22(2)b)).
Dans le but de déterminer le délai de présentation des rapports d’interprétation, si une étude sur la population de poissons n'est pas requise en raison de la concentration de l'effluent dans la zone exposée, conformément à l'annexe 5, alinéa 9b), alors on considère que l’effluent n'a aucun effet sur la population de poissons. De la même manière, si une étude sur les tissus de poissons n'est pas nécessaire en raison de la concentration de mercure dans l'effluent, conformément à l'annexe 5, alinéa 9c), alors on considère que l’effluent n'a aucun effet sur les tissus de poissons.
1.6.3.2 Examiner les effets confirmés
Si les résultats des deux dernières études de suivi biologique consécutives indiquent le même type d'effet (même critère dans la même direction à partir du point zéro par rapport aux niveaux de référence) sur la population de poissons, sur les tissus de poissons ou sur la communauté d'invertébrés benthiques, et si l'ampleur ou la portée géographique de l’effet ou la cause de l'effet n'est pas connue, alors le rapport d'interprétation est présenté au plus tard 36 mois après la date d'échéance de présentation du rapport d'interprétation de l'étude précédente (REMM, annexe 5, alinéa 22(2)c)).
1.6.3.2.1 Niveau d'effort requis pour examiner les effets
Les mines sont tenues d'examiner tous les effets confirmés. Les paragraphes qui suivent fournissent des recommandations quant à la façon d'examiner les effets confirmés selon l'ampleur des effets (valeur inférieure ou supérieure au seuil critique d’effet).
Effets confirmés d'une ampleur supérieure ou égale au seuil critique d'effet
Les mines qui ont des effets confirmés d'une ampleur supérieure ou égale au seuil critique d'effet (tableau 1-4) effectuent une étude sur le terrain pour évaluer l'ampleur et la portée géographique des effets et présentent le prochain rapport d'interprétation dans 36 mois. Par la suite, la mine mène des études sur le terrain ou en laboratoire pour déterminer les causes des effets et présente le rapport d'interprétation de recherche des causes dans une autre période de 36 mois. Si l’ampleur et la portée géographique de l’effet ont déjà été établies, la mine peut passer directement à la détermination des causes des effets. Dans ce cas, la mine pourrait faire état de l'ampleur et de la portée géographique des effets dans le plan de l'étude de recherche des causes.
Effets confirmés d'une ampleur inférieure au seuil critique d'effet
Si un effet confirmé a une ampleur inférieure au seuil critique d'effet, il n'est pas prévu que des effets plus importants soient observés au-delà du point de rejet final. La mine pourrait donc évaluer l'ampleur et la portée géographique d'un effet confirmé à une valeur inférieure au seuil critique d'effet en fournissant une justification scientifique solide à partir des résultats et des autres renseignements existants contenus dans les études, puis passer directement à la détermination des causes des effets. Dans ce cas, si la mine utilise les renseignements existants pour déterminer l'ampleur et la portée géographique des effets, il est recommandé que ces renseignements soient inclus dans le plan de l'étude de recherche des causes et que le prochain rapport d'interprétation soit présenté dans 36 mois. Les causes de l'effet ont pu être déterminées par la réalisation d'études sur le terrain et/ou en laboratoire, ou par l'examen et la présentation de preuves solides à partir des données existantes, seules ou associées à de nouvelles données et/ou à une analyse documentaire.
Une fois que les causes des effets ont été déterminées, le prochain rapport d'interprétation est présenté trente-six mois après la date d'échéance de présentation du dernier rapport d'interprétation. Dans ce cas, le plan d'étude doit décrire les études de suivi biologique pour évaluer les effets (voir la section 1.4.2.1).
1.6.3.3 Calendrier des études visant à évaluer les effets et l'ampleur et la portée géographique et des études visant à examiner les causes
Il existe différentes étapes pour l'évaluation et l'examen des effets (Figure 1-1). Dans de nombreux cas, le processus d'évaluation des effets et le processus d'examen des effets peuvent ne pas progresser en même temps pour les différents volets (la population de poissons, les tissus de poissons et la communauté d'invertébrés benthiques). Une fois qu'un effet a été confirmé, les mines sont tenues d'évaluer l'ampleur et la portée géographique de l’effet et de déterminer la cause de l'effet. Il est nécessaire de mener des études sur l'ampleur et la portée géographique et des études de recherche des causes pour tous les effets confirmés.
Dans le cadre d'une étude visant à évaluer l'ampleur et la portée géographique d'un effet observé pour un volet d'étude (la population de poissons, les tissus de poissons et la communauté d'invertébrés benthiques), les mines sont également tenues de continuer à surveiller les volets d'étude pour lesquels aucun effet n'a été observé ni confirmé précédemment. Par conséquent, une mine peut mener une étude afin de confirmer la présence ou l'absence d'effet pour un volet d'étude tout en effectuant une étude visant à déterminer l'ampleur et la portée géographique d'un effet à l'égard d'un autre volet.
Dans le cadre d'une étude de recherche des causes pour un effet confirmé pour un volet d'étude (la population de poissons, les tissus de poissons et la communauté d'invertébrés benthiques), les mines ne sont pas tenues de mener des études simultanées sur des volets pour lesquels aucun effet n'a été confirmé. Lorsque des effets sont confirmés pour plus d'un volet d'étude ou pour plus d’un critère au sein d'un volet, alors il est nécessaire de déterminer l'ensemble des causes des effets confirmés au cours de la prochaine phase ou, si ce n'est pas possible, dans les plus brefs délais au cours des phases ultérieures.
1.7 Références
Équipe d'examen de l'ESEE des mines de métaux. 2007. Rapport de l'Équipe d'examen de l'ESEE des mines de métaux. Gatineau (Québec) : Bureau national des études de suivi des effets sur l'environnement, Environnement Canada.
Figures et tableaux
Le tableau 1-1 présente les indicateurs d’effets et les critères d’effets dans une étude de la population de poissons. Les indicateurs d’effets comprennent la croissance, la reproduction, la condition et la survie. Les critères d’effets comprennent la taille selon l’âge, la taille relative des gonades, la condition, la taille relative du foie et l’âge. Les données obtenues sur les critères d’effets particuliers sont évaluées pour déterminer s’il y a une différence statistique en ce qui concerne les indicateurs d’effets.
Le tableau 1-2 présente les indicateurs d’effets et les critères d’effets dans une étude de la communauté d’invertébrés benthiques. Les indicateurs d’effets comportent la densité totale des invertébrés benthiques, l’indice de régularité, la richesse des taxons et l’indice de similarité. Les critères d’effets comprennent le nombre d’animaux par zone unitaire, l’indice de régularité de Simpson, le nombre de taxons et l’indice de Bray-Curtis. Les données obtenues sur les critères d’effets particuliers sont évaluées pour déterminer s’il y a une différence statistique en ce qui concerne les indicateurs d’effets.
Le tableau 1-3 décrit les seuils critiques d’effets pour le Programme d’études de suivi des effets sur l’environnement des mines de métaux. Les critères d’effets pour le poisson et les critères d’effets pour le benthos sont alignés sur leurs seuils critiques d’effets respectifs. Les critères d’effets pour le poisson comprennent le poids selon l’âge, la taille relative des gonades, la taille relative du foie, la condition et l’âge. Les critères d’effets pour le benthos comprennent la densité, l’indice de régularité de Simpson, la richesse des taxons et l’indice de Bray-Curtis.
Le tableau 1-4 présente une évaluation de l’ampleur des effets confirmés dans deux phases d’étude consécutives. Le tableau indique comment les effets confirmés dans deux phases consécutives sont groupés. Les effets confirmés sont séparés en deux catégories : les effets dont la valeur est égale ou supérieure au seuil critique d’effet et les effets dont la valeur est inférieure au seuil critique d’effet.
1. AQUAMIN. 1996. Évaluation des effets de l’exploitation minière sur le milieu aquatique au Canada. Environnement Canada.
2. Les coordonnées des coordonnateurs régionaux des ESEE sont disponibles sur le site Web de l'ESEE.
3. L'agent d'autorisation pour chaque province est indiqué à l'annexe 1 du REMM. Les coordonnées des agents d'autorisation sont disponibles sur le site Web de l'ESEE.
Retournez à la table des matières
Chapitre 2
2. Plan d’étude, caractérisation du site et programme général d’assurance et de contrôle de la qualité
2.2 Plan d’étude et caractérisation du site
- 2.2.1 Caractérisation du site
- 2.2.1.1 Délimitation des panaches
- 2.2.1.2 Mesures visant à établir la composition de l’effluent
- 2.2.1.3 Cartographie et classification des habitats
- 2.2.1.4 Inventaire des ressources aquatiques
- 2.2.1.5 Système de classification pour la sélection des zones de référence
- 2.2.1.6 Cadre pour les cours d’eau
- 2.2.1.7 Cadre pour les lacs
- 2.2.1.8 Utilisation des données de toxicité sublétale pour la caractérisation des sites
- 2.2.1.9 Caractéristiques des environnements miniers
- 2.2.2 Zones d’exposition et de référence
- 2.2.3 Indication de l’emplacement des stations
- 2.2.4 Facteurs de confusion
- 2.2.5 Affluents et autres sources de rejet ponctuelles et diffuses
- 2.2.6 Variations de l’environnement et de l’habitat naturels
- 2.2.7 Dommages antérieurs
2.3 Programme général d’assurance et de contrôle de la qualité et modes opératoires normalisés
Tableau
2. Plan d’étude, caractérisation du site et programme général d’assurance et de contrôle de la qualité
2.1 Aperçu
Le présent chapitre contient de l’information sur le plan d’étude, la caractérisation du site et l’assurance de la qualité et le contrôle de la qualité (AQ/CQ) du Programme d’études de suivi des effets sur l’environnement (ESEE) pour les mines de métaux. Les exigences relatives au plan d’étude et à la caractérisation du site sont présentées dans le Règlement sur les effluents des mines de métaux (REMM) (annexe 5, articles 10 à 14) et dans le chapitre 1. Ces renseignements comprennent le calendrier des ESEE(première étude, étude visant à confirmer l’absence ou la présence d’effet, ampleur et portée géographique, recherche des causes et étude finale avant la fermeture d’une mine), le contenu des rapports sur les plans d’étude et les dates de présentation. Des renseignements additionnels sur les méthodes recommandées pour le plan d’étude des poissons, des tissus de poissons et des invertébrés benthiques et sur des méthodes de rechange sont fournis dans les chapitres pertinents. En outre, chaque chapitre contient de l’information plus détaillée sur l’AQ/CQ.
2.2 Plan d’étude et caractérisation du site
L’objectif d’un plan d’étude est de décrire le déroulement de l’étude de suivi biologique (étude de la population de poissons, analyse des tissus de poissons et étude de la communauté d’invertébrés benthiques).
Le plan d’étude doit comprendre les éléments suivants (annexe 5, articles 10 à 14 du REMM) :
- un sommaire des études de suivi biologique précédentes et des suivis de l’effluent et de la qualité de l’eau;
- des renseignements sur la caractérisation du site, y compris les résultats des études de délimitation du panache;
- les objectifs du programme de suivi sur le terrain, y compris l’approche globale et la justification du suivi biologique, qui peuvent être fondés sur les résultats de suivis antérieurs;
- les critères régissant la conception des analyses statistiques, hypothèses, méthodes statistiques et données requises;
- une description de la façon dont les études de suivi biologique seront effectuées afin de déterminer s’il y a des effets, en tenant compte des facteurs de confusion;
- les plans d’échantillonnage sur le terrain, y compris les paramètres mesurés ainsi que la méthode, la période et la zone d’échantillonnage, l’emplacement des zones de référence et des zones exposées, ainsi que les motifs pour le choix du point de rejet;
- les mesures d’AQ/CQqui seront prises pour valider les données;
- le calendrier des travaux de suivi sur le terrain et de la présentation du rapport d’interprétation.
2.2.1 Caractérisation du site
Chaque plan d’ESEE doit inclure des renseignements sur la caractérisation du site (annexe 5, alinéa 10a) du REMM). Les exigences concernant la caractérisation du site sont décrites à l’annexe 5, article 11 du REMM. Le tableau 2-1 résume les renseignements relatifs à la caractérisation du site qui doivent figurer dans le premier plan d’étude. Dans les études de suivi subséquentes, les données relatives à la caractérisation du site peuvent être résumées, mais tout nouveau renseignement (p. ex., taux de production) devrait être décrit en détail. Dans la plupart des cas, les exploitants de mines pourront obtenir la plupart des données sur la caractérisation du site en consultant les évaluations antérieures et les études historiques. S’il manque de l’information essentielle à la conception de l’ESEE, la collecte d’autres données sur le terrain pourrait s’avérer nécessaire afin de fournir un cadre adéquat pour le premier plan d’ESEE, en particulier en ce qui a trait à l’hydrologie et aux ressources aquatiques.
Les informations de la caractérisation du site peuvent servir à identifier les sites d’échantillonnage potentiels avec des habitats similaires dans la zone de référence et la zone exposée et à obtenir des renseignements sur d’autres points de rejet et d’éventuels facteurs de confusion qui pourraient brouiller l’interprétation des données obtenues dans ces zones. La section 2.2.1.9 contient des informations sur les caractéristiques environnementales uniques aux sites miniers qui devraient être prises en considération au cours de la caractérisation d’un site.
Lorsqu’il n’existe pas suffisamment de données historiques sur l’effluent d’une mine pour déterminer l’emplacement de la zone de référence et de la zone exposée, un échantillonnage exploratoire peut se révéler utile. Cet échantillonnage peut aussi servir à déterminer les caractéristiques des habitats pour permettre un choix efficace des stations d’échantillonnage.
Une équipe de terrain expérimentée devrait être en mesure d’évaluer l’étendue approximative du profil de diffusion d’un effluent d’après les mesures des traceurs de la qualité de l’eau (p. ex., la conductance spécifique) ou les résultats d’une étude préliminaire avec des colorants. Il lui est souvent possible de déterminer l’emplacement probable des zones de sédimentation en s’appuyant sur l’observation du débit et de la configuration des courants dans le milieu récepteur. Il est donc habituellement possible de choisir des stations d’échantillonnage de l’eau et de sédiments appropriées sur le terrain et de compléter un échantillonnage exploratoire du milieu récepteur en même temps que sont effectués les études de panache et des zones de sédimentation et les inventaires de ressources et d’habitat essentiels au cours d’une seule campagne.
La plupart des informations recueillies durant la caractérisation du site peuvent être reportées sur une carte. Les cartes devraient être d’une échelle suffisante (p. ex., 1:5000) pour montrer avec la précision requise les caractéristiques de la zone d’étude. L’échelle employée devrait être indiquée sur toutes les cartes utilisées. La superficie de la zone d’étude à cartographier devrait être déterminée en fonction des caractéristiques de la zone et devrait inclure le point de rejet ainsi que la zone exposée et la zone de référence.
Les exigences relatives à la caractérisation du site dans le plan d’étude d’ESEE sont énoncées dans le REMM. Les renseignements suivants constituent d’autres renseignements pertinents qui devraient être communiqués lors de la caractérisation du site (en plus des renseignements présentés dans le tableau 2‑1) :
une énumération des principaux réactifs chimiques utilisés dans le processus global de production depuis le 1er janvier 1996. Les mines sont encouragées à préciser les quantités de réactifs qu’elles utilisent actuellement. Cette liste devrait inclure les types de réactifs suivants :
- activateurs
- floculants
- régulateurs de pH
- déprimants
- moussants
- collecteurs
une liste de tous les points de rejet d’effluent dans la zone exposée; cette liste devrait préciser toutes les sources connues de rejet dans l’environnement aquatique, y compris celles régies par le REMM, ainsi que toute autre source (p. ex., sources diffuses) susceptible d’avoir un effet sur l’environnement aquatique;
des informations sur les conditions climatiques locales, en particulier les régimes saisonniers des précipitations.
| Type d’information | Renseignements recommandés (Lorsque cela est possible, certains renseignements peuvent être présentés sous forme de cartes.) |
|---|---|
| Caractéristiques générales |
|
| Hydrologie |
|
| Influences anthropiques |
|
| Caractéristiques des ressources aquatiques |
|
| Systèmes et pratiques de protection de l’environnement |
|
2.2.1.1 Délimitation des panaches
La caractérisation du site doit comporter une description de la façon dont l’effluent se mélange dans la zone exposée, y compris une estimation de la concentration de l’effluent à 250 m de chacun des points de rejet final (annexe 5, alinéa 11a) du REMM). Pour les études de suivi biologique subséquentes, le plan doit comporter un sommaire des renseignements sur la caractérisation du site ainsi qu’une description détaillée des modifications apportées depuis la présentation de la dernière étude de suivi biologique, le cas échéant (annexe 5, alinéa 19(1)a)du REMM). La description devrait également fournir une indication du débit relatif de l’effluent et du cours d’eau récepteur, ainsi que les variations saisonnières des débits. Ces données fourniront une indication du taux de dilution. La description devrait aussi indiquer la densité de l’effluent et préciser dans quelle strate de la colonne d’eau l’effluent risque de séjourner avant de se mélanger complètement dans le plan d’eau récepteur. Cette estimation peut être établie à partir de mesures directes prises sur le terrain ou à l’aide de techniques de modélisation. Des précisions sur les mesures qui peuvent être prises sur le terrain sont fournies dans la présente section; toutefois, il est recommandé de valider les résultats de la modélisation par des mesures sur le terrain.
Une étude sur la population des poissons est effectuée dans le cas où la concentration de l’effluent dans la zone exposée est supérieure à 1 % à moins de 250 m du point de rejet final (annexe 5, alinéa 9b) du REMM). Si une telle étude n’est pas requise parce que la concentration de l’effluent est inférieure à 1 %, il est recommandé d’appliquer des méthodes plus rigoureuses de délimitation du panache pour documenter les concentrations de l’effluent dans la zone exposée.
La description de la façon dont l’effluent se mélange dans la zone exposée devrait comporter les éléments suivants :
- une description de l’endroit où se trouve l’effluent dans la zone exposée avant de se mélanger aux eaux réceptrices;
- une estimation de l’endroit dans la zone exposée où l’effluent commence à se mélanger aux eaux réceptrices et de l’endroit où le mélange est total;
- une estimation du rapport de dilution de l’effluent à divers points en aval du point de rejet de l’effluent;
- un inventaire des sources importantes de dilution autres que les eaux réceptrices principales (p. ex., tributaires ou autres cours d’eau);
- et comment tout cela peut varier selon les marées et les saisons.
Pour des directives exhaustives sur la délimitation des panaches, il est possible de se procurer, sur demande, le Guide technique révisé pour la réalisation d’études de délimitation du panache des effluents (Environnement Canada, 2003), sur le site Web de l’ESEE(http://www.ec.gc.ca/esee-eem/default.asp?lang=Fr&n=A2CA9EEF-1). Ce guide a été élaboré pour le Programme d’ESEE des fabriques de pâtes et papiers, mais il peut également s’appliquer au Programme d’ESEE des mines de métaux. D’autres renseignements sur la délimitation du panache des effluents des mines de métaux sont fournis dans les paragraphes qui suivent.
2.2.1.2 Mesures visant à établir la composition de l’effluent
Mesures de conductivité
Si la conductivité de l’effluent est constante durant la période de l’étude, la mesure de la conductivité peut aider à délimiter le panache de l’effluent dans la zone exposée. Les résultats peuvent être évalués de façon semi-quantitative, ou convertis en concentrations relatives d’effluent comprises entre 1 (effluent) et 0 (concentrations naturelles) à l’aide de la formule suivante :
Cr = (Ca – Cb)/(Ce – Cb)
où :
La concentration relative est une expression du rapport de dilution. Les mesures de la température devraient être prises concurremment à celles de la conductivité, puisque la conductivité s’élève d’environ 2 % pour chaque hausse de température de 1 °C. De plus amples renseignements sur divers aspects théoriques de la délimitation du panache de l’effluent par l’étude de la conductivité sont présentés dans certains documents de référence (p. ex., Fischer et al., 1979; Freeze et Cherry, 1979).
Bien que les mesures de la conductivité puissent fournir des estimations valables et peu coûteuses de l’emplacement de l’effluent dans l’environnement récepteur, la variabilité naturelle de la conductivité dans les eaux de surface peut compliquer le repérage des limites du panache. Une telle variabilité peut être observée tant dans les mesures prises en profondeur qu’en surface. La présence de nombreux affluents ou plans d’eau récepteurs peut amplifier le problème.
Traçage à l’aide de métaux présents dans l’effluent
Il est également possible de situer de façon approximative le panache de l’effluent dans la zone exposée, en utilisant un paramètre de référence présent dans cet effluent et en suivant son devenir dans le temps et l’espace en mesurant ses concentrations dans des échantillons d’eau prélevés à des endroits précis. La sélection d’un tel traceur doit être fondée sur sa stabilité et sa constance de concentration, ainsi que sur sa représentativité et la facilité avec laquelle il peut être mesuré. Comme le paramètre choisi doit être une substance persistante, les métaux comme le cuivre ou le nickel peuvent être utilisés comme traceur « naturel ». Le sulfate est souvent un bon traceur d’effluents des mines de métaux usuels, en particulier dans les dépôts massifs de sulfures.
Il convient de rappeler que le paramètre de l’effluent choisi aux fins du traçage peut être présent en concentrations comparables (même ordre de grandeur) dans les eaux réceptrices. Le cas échéant, il faudrait éviter d’y avoir recours pour mesurer la dilution de l’effluent. D’autres paramètres propres à l’effluent peuvent être présents, mais en concentrations si faibles qu’ils sont difficiles à détecter. Plusieurs paramètres peuvent être présents en concentrations significativement plus élevées, faisant d’eux des traceurs parfaits pour la mesure de la dilution de l’effluent. Toutefois, en raison des complications engendrées notamment par les coûts des analyses, l’instabilité de la substance, des difficultés dans la prise de mesures ou le manque d’appareils de mesure adéquats in situ, ces paramètres ne s’avèrent pas toujours être des traceurs « naturels » appropriés. Par conséquent, le potentiel des métaux présents dans l’effluent à servir de traceurs pour délimiter le panache devrait être évalué au cas par cas.
2.2.1.3 Cartographie et classification des habitats
Certains aspects de la cartographie et de la classification des habitats ainsi que de l’inventaire des ressources aquatiques font partie de la caractérisation du site. Toutefois, dans de nombreux cas, une cartographie plus détaillée des habitats peut faciliter l’identification des types d’habitats présents dans les zones d’exposition et de référence. La présente section fournit des directives pour la cartographie et la classification des habitats.
La méthode recommandée pour tracer une carte des habitats est de classifier ces habitats. Le cadre général recommandé pour la classification des caractéristiques aquatiques est le système de classification élaboré par le Fish and Wildlife Service (FWS) des États-Unis, appelé « Classification of Wetlands and Deepwater Habitats of the United States » (Cowardin et al., 1979; Busch et Sly, 1992). Ce système permet de classifier un large éventail d’habitats continentaux, aquatiques et semi‑aquatiques. Cowardin et al. (1979) donnent également des conseils sur la description des habitats côtiers et estuariens.
Frith et al. (1993), Booth et al. (1996), Robinson et Levings (1995), Hay et al. (1996) et Robinson et al. (1996) ont décrit des systèmes de classification des habitats littoraux jusqu’aux zones côtières profondes. La classification des habitats estuariens a été revue par Matthews (1993), Scott et Jones (1995), Finlayson et van der Valk (1995) et Levings et Thom (1994). Aux États-Unis, le système le plus utilisé est celui de Cowardin et al. (1979) et de Cowardin and Golet (1995), avec des ajouts proposés par d’autres auteurs.
Une liste d’exemples de conditions environnementales propres aux divers habitats est fournie ci-après :
Cours d’eau : Il est recommandé de veiller à ce que les descriptions d’habitats fluviaux comprennent des renseignements sur le gradient d’altitude; l’emplacement des barrages, des chutes et des autres obstacles à la migration du poisson; le débit annuel moyen et la gamme de ses variations; les caractéristiques générales des substrats de chaque cours d’eau (préférablement présentées sous forme de graphique indiquant le profil selon un gradient). Les apports d’aval et d’amont (p. ex., eaux pluviales, trop‑plein d’égouts, effluents d’autres sites industriels) devraient être cartographiés et décrits.
Lacs : Les caractéristiques importantes des habitats lacustres comprennent la bathymétrie, l’emplacement des principaux tributaires et exutoires ainsi que les conditions générales d’oxygénation et de température (p. ex., stratification thermique, épuisement de l’oxygène en profondeur).
Rivages côtiers : Les paramètres de cartographie additionnels suivants sont recommandés pour les rivages (marins, Grands Lacs); ils incluent les isobathes, les caractéristiques des substrats côtiers, la configuration du rivage et l’emplacement des affluents, d’autres sources de rejet et d’activités.
Estuaires : Les estuaires sont le mieux décrits par leurs gradients généraux de salinité, leurs débits, la bathymétrie et les caractéristiques générales de leur substrat. Une description des cycles de marée est recommandée pour tous les habitats marins ou estuariens. La plupart des caractéristiques susmentionnées peuvent être extraites de cartes maritimes ou topographiques et de publications gouvernementales sur les marées et les débits des cours d’eau enregistrés; elles peuvent être obtenues aussi au moyen d’entrevues auprès de fonctionnaires locaux et de personnes informées.
Milieux humides naturels : Un milieu humide désigne un sol qui est saturé d’eau suffisamment longtemps pour favoriser l’apparition de processus humides ou aquatiques, comme dans le cas des sols mal drainés, des hydrophytes et de divers types d’activités biologiques qui sont adaptées à un milieu humide (Équipe d’examen de l’ESEE des mines de métaux, 2007). Les milieux humides comprennent les tourbières ombrotrophes ou minérotrophes, les marais, les marécages et les eaux peu profondes (habituellement d’une profondeur de deux mètres ou moins) (Équipe d’examen de l’ESEE des mines de métaux, 2007). Durant l’examen du Programme d’ESEE des mines de métaux (2007), l’Équipe d’examen a recommandé d’éviter d’utiliser des milieux humides naturels pour les ESEE. Dans le cas où l’effluent terminal d’une mine de métaux s’écoule dans un milieu humide naturel, les ESEEdevraient être menées en aval du milieu humide en question s’il est impossible de le faire en amont. Cette recommandation est conforme à la Politique fédérale sur la conservation des terres humides, qui peut être consultée ici.
Il est recommandé de décrire les substrats benthiques. Il existe d’autres guides pertinents sur l’évaluation des habitats aquatiques, tels ceux publiés par Pêches et Océans Canada et le ministère de l’Environnement et des Parcs de la Colombie-Britannique (1987), Orth (1989), le ministère des Richesses naturelles de l’Ontario (1989), Plafkin et al. (1989) et Pêches et Océans Canada (1990).
Les zones de sédimentation dans la zone exposée devraient être identifiées et indiquées sur la carte des habitats. Toute caractéristique des sédiments (caractéristiques chimiques, toxicité) devrait être mentionnée. Les zones de sédimentation se forment aux endroits où le courant ralentit, ce qui permet le dépôt des particules. La sédimentation des particules les plus fines se produit dans les zones où le courant est le plus lent. Les données historiques sur les contaminants ou la communauté d’invertébrés benthiques peuvent guider la sélection des stations d’échantillonnage à l’intérieur d’un site de sédimentation de la zone exposée. Pour comparer les communautés d’invertébrés benthiques résidantes, il est recommandé de choisir des sites de dépôt de sédiments semblables (mais non contaminés) dans la zone de référence. Dans les cas où il y a un historique de contamination dont la source diffère de celle de la mine, deux zones de référence peuvent s’avérer utiles, l’une comportant des sédiments contaminés, et l’autre, sans sédiments contaminés.
2.2.1.4 Inventaire des ressources aquatiques
Un inventaire des ressources aquatiques inclut l’identification des poissons, des mollusques et des crustacés résidants et de passage faisant l’objet d’une pêche commerciale et non commerciale (pêche sportive, y compris les poissons ensemencés, et pêche de subsistance) au moment où l’inventaire est réalisé. Il faut accorder une attention particulière aux espèces de poissons dont les populations sont suffisamment nombreuses pour être considérées comme des espèces sentinelles et noter l’utilisation de la zone exposée par les poissons (p. ex., frayère, nourricerie). En outre, il convient également de documenter la présence de toutes les espèces rares, en voie de disparition ou menacées qui ont été désignées par un organisme fédéral, provincial ou territorial. Le site Web (www.cosepac.gc.ca) du Comité sur la situation des espèces en péril au Canada (COSEPAC), les biologistes des pêches des organismes de réglementation et des musées fédéraux, provinciaux et territoriaux, les agents de conservation locaux et des membres de collectivités locales (pêcheurs, autochtones et groupes d’intérêt public) constituent d’autres sources d’information.
Le succès éventuel de tout programme sur le terrain est d’autant plus grand que la zone d’étude est bien connue. Il est recommandé de réaliser des travaux sur le terrain afin de vérifier les données historiques, si ces renseignements ne sont pas exhaustifs ou récents.
Les poissons ensemencés ne conviennent guère aux ESEE, car il s’agit surtout de poissons de pêche sportive, et ils ne constituent pas des espèces indicatrices appropriées, puisque leur croissance et leur reproduction peuvent dépendre de la méthode et de la période d’ensemencement et d’élevage. De plus, le succès de reproduction des poissons ensemencés est généralement faible, de sorte que cet indicateur d’effet clé ne peut être évalué.
2.2.1.5 Système de classification pour la sélection des zones de référence
Étant donné que les caractéristiques des zones de référence varient selon le paysage, des méthodes de classification ont été développées pour les zones terrestres où s’écoulent des cours d’eau et où se trouvent des lacs dans le but de prévoir les associations biotiques en milieu aquatique (Corkum, 1989, 1992; Hughes, 1995; Maxwell et al., 1995; Omernik, 1995). Un système de classification est une façon de simplifier les méthodes d’échantillonnage et les stratégies de gestion en fournissant une représentation organisée d’un paysage variable (Conquest et al., 1994). Ce système, qu’on suppose hiérarchique, présente l’avantage de permettre la distinction entre les caractéristiques du paysage à différentes échelles de résolution (Conquest et al., 1994). Le système de classification (avec modifications) est basé sur un système mis au point par le Service des forêts du ministère de l’Agriculture des États‑Unis (Maxwell et al., 1995). Le système de classification hiérarchique se veut un guide a priori de sélection des zones d’échantillonnage.
Répartition des zones de référence et des zones exposées selon l’habitat
Les points suivants devraient être considérés durant la sélection des zones et/ou des stations de référence et d’exposition.
Cours d’eau
- La taille du bassin versant choisi dépend de l’ordre du cours d’eau. Par exemple, si une mine est située sur les rives d’un cours d’eau de deuxième ordre, le bassin versant s’arrête à l’endroit où le cours d’eau devient un cours d’eau de troisième ordre (à la jonction de deux cours d’eau de deuxième ordre).
- S’il n’existe aucune source ou facteur de confusion en amont, les zones de référence peuvent être choisies dans le même bassin versant, en amont de la mine.
- Si des facteurs de confusion, comme des sources diffuses ou ponctuelles, ont été détectés en amont de l’effluent, la ou les zones de référence doivent être choisies dans un bassin versant adjacent présentant des habitats comparables (figure 4-4).
- Si la perturbation physique de la vallée fluviale est liée à l’exploitation de la mine, les effets de l’effluent peuvent être difficiles à distinguer de ceux de la perturbation. Par conséquent, les zones de référence choisies devraient dans la mesure du possible être sous l’influence d’une perturbation physique comparable.
- La zone exposée et la zone de référence devraient avoir les caractéristiques suivantes en commun : écorégion, superficie du bassin versant, ordre du cours d’eau, largeur de débordement, gradient de pente, caractéristiques du lit, types d’habitat, profondeur de l’eau, vitesse du courant, composition du substrat, végétation des rives, structure des rives, utilisation des terres, etc.
Lacs
- Dans le cas des lacs qui reçoivent l’effluent d’une seule mine et où il n’y a pas de source diffuse de pollution, il faudrait déterminer la sphère d’influence de l’effluent. Cela est particulièrement important pour les lacs où l’écoulement de l’effluent n’est pas unidirectionnel.
- Si des études de traçage et des études précédentes indiquent que les effets de l’effluent sont localisés et restreints, il convient de choisir la ou les zones de référence dans le lac où la mine rejette son effluent. Ces zones devraient se trouver dans des baies ou bassins séparés, mais comparables, du lac.
- Si les études effectuées à l’aide de traceurs révèlent que l’effluent se disperse dans tout le lac, il convient de choisir la ou les zones de référence dans les lacs présentant des caractéristiques semblables les plus proches dans le même bassin versant ou un bassin adjacent.
- Si d’autres sources diffuses ou ponctuelles existent ailleurs dans le lac, il convient de choisir la ou les zones de référence dans le lac présentant des caractéristiques semblables les plus proches dans le même bassin versant ou un bassin adjacent.
- Si l’effluent est associé à une perturbation physique dans la région, la présence de cette perturbation peut compliquer l’évaluation des effets de l’effluent. Dans la mesure du possible, il convient alors de choisir des zones de référence présentant des caractéristiques physiques similaires.
- La zone exposée et la zone de référence devraient avoir les caractéristiques suivantes en commun : écorégion, origine géologique, superficie du bassin versant, morphométrie, pente du littoral, types d’habitat, composition du substrat, végétation des rives, structure des rives et utilisation des terres, etc.
Milieux marins
- La zone de référence devrait être comprise dans le même plan d’eau que la zone exposée et être soumise aux mêmes régimes de courant hydrographique et de marée que cette dernière. En d’autres mots, elle devrait être le plus près possible de la zone exposée. Les communautés d’invertébrés benthiques des milieux marins sont beaucoup plus riches en espèces que celles des écosystèmes d’eau douce. Elles présentent des rapports trophiques plus complexes, une gamme faunistique beaucoup plus large et des stratégies reproductives plus diversifiées. En raison de cette complexité et des nombreuses interactions des espèces d’invertébrés benthiques des milieux marins, de faibles variations des conditions physiques ou chimiques peuvent modifier profondément la faune benthique dans son ensemble. Si on ajoute à cette différence l’effet d’une variation croissante de la colonisation larvaire aléatoire en fonction de la distance géographique (« dérive » géographique dans la structure de la communauté) et les barrières physiques d’un milieu côtier complexe, il est très rare qu’on puisse trouver des communautés d’invertébrés semblables d’une baie ou d’un fjord à l’autre, et il est très difficile de prédire la structure particulière d’une communauté benthique à partir de facteurs liés aux sédiments (pour une analyse récente des interactions des invertébrés marins et des sédiments, voir Snelgrove et Butman, 1994). Pour être en mesure de conclure avec un niveau de confiance raisonnable à l’existence d’un degré de similitude suffisant entre les communautés benthiques « naturelles » d’une zone côtière donnée et celles de la zone voisine, il devrait exister entre les deux un échange d’eau suffisant. Cette situation est plus probable dans les zones côtières ouvertes que dans les baies et les fjords isolés.
- Les zones de référence qui ne sont pas comprises dans le même plan d’eau ou régime hydrographique risquent de ne pouvoir servir qu’à une comparaison sommaire de caractéristiques telles que les variations de l’abondance et de la richesse spécifique. Si les conditions d’habitat sont suffisamment semblables à celles de la zone exposée, il sera également possible de comparer des facteurs biotiques agissant à plus grande échelle, comme la présence de taxons caractéristiques présentant une longévité plus longue et vivant à des profondeurs ou sur des supports déterminés, appelés « communautés parallèles » (Thorson, 1957).
- La zone de référence devrait présenter un fort degré de similitude avec la zone exposée pour ce qui est du type d’habitat, de la structure du littoral (escarpé, montagneux, delta, marais, etc.), de la topographie du fond (seuil, banc de sable, exposition aux influences océaniques, etc.), du type de substrat (taille des particules, classement granulométrique, chimie naturelle), de la profondeur, des régimes de courant, des propriétés physiques de l’eau, des régimes de nutriants, des sources et des caractéristiques de drainage.
- Certains aspects particuliers doivent être pris en compte pour déterminer si les zones de référence conviennent aux mines en milieux marins et estuariens. De nombreux facteurs physiques, dont la salinité (y compris les apports saisonniers d’eau douce), les marées (et les courants de marée) et les sulfures présents dans les sédiments, contribuent à rendre les milieux estuariens ou marins plus complexes que les milieux d’eau douce. L’érosion par la glace et l’accumulation de glace, le gel, la stagnation de la colonne d’eau provoquée par l’élévation du ruissellement d’eau douce en été, la remise en suspension des matières particulaires par le gel en surface en hiver, la présence de digues ou d’estacades, les taux exceptionnels d’envasement causés par l’exploitation forestière et les inondations périodiques, sont au nombre des autres facteurs physiques importants qui doivent également être pris en compte.
- Outre les caractéristiques importantes susmentionnées, les éléments suivants doivent être similaires entre les zones de référence et les zones exposées :
- Zones intertidales : pente du littoral, exposition aux vagues, éclairage et exposition aux marées, végétation du littoral, organismes incrustés (une partie de ces organismes peuvent toutefois faire partie des taxons benthiques dont on cherche à évaluer les réponses à l’effluent de la mine).
- Zones subtidales : stabilité saisonnière de la colonne d’eau et appauvrissement en oxygène au fond de l’eau (stagnation).
Écorégions
La première étape de la sélection des zones de référence consiste à déterminer les attributs terrestres (écorégions) ayant des caractéristiques semblables. On entend par écorégion la partie d’une écoprovince présentant des réponses écologiques distinctes au climat, révélées par la végétation, les sols, l’eau et la faune (Wiken, 1986; Wickware et Rubec, 1989). On peut consulter des cartes des écorégions du Canada sur le site Web suivant.
Bassins versants et échelles géographiques
Les bassins versants ont des limites bien déterminées. Un bassin versant est défini comme l’ensemble des pentes inclinées vers un même cours d’eau et y déversant leurs eaux de ruissellement. Bien qu’il se produise des échanges entre les biotes de divers bassins, l’évolution géoclimatique des grands bassins (échelle de 1:2 000 000) crée des obstacles à la dispersion, à savoir les lignes de partage des eaux et le climat (Maxwell et al., 1995). Il est essentiel d’établir l’échelle géographique convenant à la conception de l’étude. Dans le cas des études synoptiques de grande échelle visant à établir des relations entre les caractéristiques des paysages et les biotes aquatiques, l’échelle cartographique adoptée pour les bassins hydrographiques est de 1:250 000 (Corkum, 1989, 1992, 1996; Reynoldson et Rosenberg, 1996). Ces bassins sont ensuite subdivisés en sous‑bassins de plus en plus petits.
Les interactions des zones terrestres et des zones aquatiques quant au transport des sédiments et des nutriants à partir des terres et de sources en amont doivent faire partie intégrante de l’élaboration de modèles prévisionnels établissant un lien entre les variables environnementales et les biotes qui leur sont associés. Les bassins versants peuvent être compris dans une écorégion ou ils peuvent traverser des écorégions différentes. La faune aquatique est plus uniforme dans les bassins versants faisant partie de la même écorégion que dans ceux qui se trouvent dans différentes écorégions (Corkum, 1992; Hughes et al., 1994).
Utilisation des terres et zones tampons de végétation
Bien que les écorégions soient définies en fonction du climat et de la végétation naturelle, cette dernière est perturbée par les activités humaines. Le type d’utilisation des terres est un moyen simple de mesurer les perturbations subies par un bassin. S’il s’est produit des changements dans l’utilisation des terres (p. ex., défrichage à des fins agricoles, exploitation forestière ou incendie), la communauté biotique des eaux réceptrices réagira à ces changements (Corkum, 1992, 1996). Il faut donc sélectionner des zones où les modes d’utilisation des terres sont comparables.
Dans toutes les zones d’échantillonnage, il faudrait noter la largeur et le type des bandes tampons de végétation bordant les cours d’eau et les lacs. Dans les zones de référence où la perturbation due aux activités humaines est inévitable, les zones tampons atténuent les fluctuations de température en produisant de l’ombre (Budd et al., 1987), éliminent ou réduisent le transport des sédiments par ruissellement (Young et al., 1980) et régularisent l’entrée des nutriants et des métaux dans les plans d’eau (Peterjohn et Correll, 1984).
2.2.1.6 Cadre pour les cours d’eau
La conception des échantillonnages dans les cours d’eau offre un cadre permettant de caractériser les habitats à différentes échelles (Meador et al., 1993). Ce cadre repose sur l’organisation des cours d’eau dans l’espace hiérarchique et sur leur évolution dans le temps (Frissell et al., 1986). Le système fluvial comprend plusieurs niveaux hiérarchiques ou emboîtés : bassin versant ou de drainage, segment de vallée, tronçon de cours d’eau et unité de chenal (Conquest et al., 1994).
Segments de vallée et ordre des cours d’eau
Les segments de vallée sont des parties des bassins versants qui ont des propriétés géomorphologiques et des caractéristiques quant au transport hydrologique qui les distinguent des autres segments (Cupp, 1989). Montgomery et Buffington (1993) ont établi trois types de segments de vallée : le segment colluvial (avec ou sans canaux), le segment alluvial et la roche en place. Les segments de vallée peuvent être le siège de dépôts colluviaux (sédiments et matières organiques accumulés à la faveur de glissements de terrain) ou alluviaux (sédiments transportés par l’écoulement des eaux). Le troisième type de segment de vallée comporte peu de sol et est dominé par la roche en place.
On distingue les segments de vallée les uns des autres selon six critères (Conquest et al., 1994) :
- l’ordre des cours d’eau (la position dans le réseau hydrographique);
- l’inclinaison des pentes de la vallée;
- le rapport entre la largeur du fond de la vallée et la largeur du chenal des cours d’eau;
- la pente des chenaux;
- les dépôts superficiels géomorphologiques dans les corridors riverains;
- la configuration des chenaux.
On attribue un ordre hydrographique à chaque segment de chenal (Strahler, 1957) en fonction d’une échelle particulière de carte ou de photographie aérienne (p. ex., 1:250 000) (Newbury et Gaboury, 1993).
Tronçons de cours d’eau
Les tronçons de cours d’eau consistent en associations homogènes de caractéristiques topographiques et d’unités géomorphologiques des chenaux (Bisson et Montgomery, 1996). Ils peuvent servir à prévoir la réaction locale des cours d’eau à des perturbations (Montgomey et Buffington, 1993) et ils sont utiles pour l’évaluation de la qualité des habitats, de la productivité aquatique, de la distribution des poissons et de l’état de santé des cours d’eau (Maxwell et al., 1995). Leur classification est effectuée à des échelles cartographiques allant de 1:12 000 à 1:24 000. Les critères de classification des tronçons de cours d’eau sont les suivants :
- configuration des chenaux;
- encaissement des chenaux;
- largeur des chenaux;
- rayon hydraulique;
- superficie du bassin;
- nature des matériaux du lit des chenaux;
- pente du cours d’eau;
- forme du lit;
- végétation riveraine.
Des approches plus simples ont été adoptées pour l’identification des tronçons de cours d’eau. Par exemple, un chenal rectiligne possède un lit ondulé et se distingue par l’alternance de seuils et de bassins à des intervalles de cinq à sept fois la largeur du chenal (Leopold et al., 1964; Leopold, 1994). Selon Newbury (1984), la longueur d’un tronçon de cours d’eau équivaut à six fois la largeur du chenal.
Unité de chenal
Les unités de chenal sont des subdivisions de tronçons de cours d’eau où les microhabitats sont uniformes quant à la profondeur et au débit et qui servent à déterminer les facteurs qui limitent les populations d’invertébrés et de poissons à l’intérieur d’un tronçon. Hawkins et al. (1993) ont proposé un système à trois niveaux dans lequel le premier niveau distingue les seuils des bassins. Le deuxième niveau identifie les seuils à écoulement turbulent et non turbulent et distingue les bassins formés par affouillement des bassins formés par un barrage. Ces derniers retiennent davantage de sédiments et de débris organiques et ont une plus grande couverture que les bassins formés par affouillement. Le troisième niveau distingue les microhabitats en fonction des processus et de la structure hydrauliques. En général, les chenaux n’ont pas plus de 10 m de longueur et ne peuvent pas être cartographiés à une échelle convenant à la gestion des terres.
Critères de subdivision des seuils :
- gradient ou profil de la surface de l’eau;
- pourcentage d’écoulement torrentiel;
- rugosité du lit;
- vitesse moyenne du courant;
- développement de paliers.
Critères de subdivision des bassins :
- position (dans le chenal principal du cours d’eau ou à l’extérieur);
- profils longitudinaux et transversaux de profondeur;
- caractéristiques du substrat;
- contraintes favorisant la formation de bassins.
2.2.1.7 Cadre pour les lacs
L’origine géologique, l’hydrologie et la morphométrie des lacs, déterminées à l’aide de cartes et de photographies aériennes, sont d’importants moyens de reconnaître les interactions des sédiments et de l’eau et d’évaluer la productivité des lacs (Wetzel, 1975). Bien qu’on puisse prévoir la stratification thermique à partir des caractéristiques morphologiques, des vérifications sur le terrain demeurent nécessaires. L’échelle utilisée pour l’étude des lacs est généralement de 1:24 000 ou de 1:63 000 (Maxwell et al., 1995).
Origine, emplacement et liens hydrologiques
Les lacs de référence et les lacs exposés devraient être comparables en ce qui concerne l’origine, l’emplacement et les liens hydrologiques. La géologie des lacs influe sur les caractéristiques physiques, chimiques et biologiques des plans d’eau. Par exemple, Hutchinson (1957) a dénombré 11 types de processus géomorphologiques : tectonique, volcanique, glissements de terrain, activité glaciaire, solution, fluviatile, éolien, riverains, accumulation de matières organiques, barrages d’origine anthropique et naturelle, impact de météorites. La géologie de surface et l’emplacement (altitude, latitude et longitude) influent sur la chimie et les régimes thermiques des lacs (Winter, 1977). Ces variables, qui sont prises en compte par les cartes, permettent de prévoir la composition biologique et la productivité des lacs (Dolman, 1990; Winter et Woo, 1990). Les liens hydrologiques, c’est-à-dire les liens entre un lac et les eaux superficielles ou souterraines, permettent d’obtenir des données de prévision sur le biote des lacs (Maxwell et al., 1995). Maxwell et al. (1995) décrivent trois types de liens hydrologiques : liens fluviaux (tributaire et/ou exutoire ou non connectés), liens avec les eaux souterraines (gains, pertes, équilibre ou absence de réalimentation) et régime d’accumulation des eaux (permanent ou intermittent).
Morphométrie
Les données sur la morphométrie des lacs servent depuis longtemps à prévoir les productions de poissons (Ryder, 1965; Kerr et Ryder, 1988) et à déterminer la diversité des espèces (Eadie et Keast, 1984; Marshall et Ryan, 1987). Avec l’exception de la profondeur (et du volume), d’autres caractéristiques peuvent être fournies par les cartes. Les graphiques hypsométriques (profondeur-superficie cumulatives ou profondeur-volume cumulatifs) sont utiles pour comparer les formes des bassins lacustres et prévoir les superficies ou les volumes à des fins de régularisation du niveau de l’eau des réservoirs. Parmi les paramètres morphologiques courants des lacs, on retrouve la superficie, le volume, la profondeur moyenne et maximale, l’aménagement des rives et le temps de séjour hydraulique.
État trophique
De nombreux systèmes de classification de lacs sont fondés sur une mesure de productivité (lacs oligotrophes, mésotrophes et eutrophes). Les lacs dystrophes, qui constituent un quatrième type, correspondent à des lacs recevant de grandes quantités de matières organiques provenant de sources extérieures. Ils sont fortement colorés, et c’est pour cette raison qu’ils sont connus comme lacs à eau brune. Les lacs dystrophes ont une faible productivité, et certains limnologues les considèrent comme une sous-classe des lacs oligotrophes. Les variables suivantes servent à décrire l’état trophique des lacs :
- oxygène dissous;
- mélange thermique (stratification des lacs);
- phosphore total;
- phosphore réactif soluble;
- azote total;
- nitrites + nitrates;
- ammonium;
- chlorophylle a;
- transparence;
- matières organiques.
Zones
Les lacs sont divisés en zones : la zone d’eau libre, appelée pélagique, la zone littorale, peuplée de plantes autotrophes, et un milieu benthique plus profond dépourvu de végétation, la zone profonde. Les zones de référence et d’exposition devraient toujours être situées dans la même zone.
2.2.1.8 Utilisation des données de toxicité sublétale pour la caractérisation des sites
Comme des données historiques de toxicité sublétale pour une partie ou la totalité des essais requis (voir le chapitre 6) ont été produites pour des effluents rejetés par un certain nombre de mines dans diverses régions du Canada, l’exploitant d’une mine pourrait juger pertinent d’utiliser ces informations durant la caractérisation du site, pour les motifs suivants :
- Aider à la sélection des zones d’échantillonnage des poissons ou des communautés d’invertébrés benthiques. Si l’exploitant ne dispose d’aucune donnée de terrain historique sur les populations de poissons, leurs sources de nourriture ou leurs habitats dans la zone exposée, il peut utiliser les données historiques de toxicité sublétale de l’effluent (si elles sont de qualité satisfaisante) pour estimer la zone d’influence potentielle en vue de sélectionner les zones d’échantillonnage aux fins de l’étude des populations de poissons ou de la communauté d’invertébrés benthiques dans le cadre de la première étude de suivi (c.-à-d. pour estimer l’ampleur de la réponse dans la zone la plus exposée à l’effluent). De plus amples renseignements sur la façon d’estimer la portée géographique d’une réponse à la toxicité sublétale sont présentés au chapitre 6.
- Aider à la comparaison des sources de rejet d’effluents. Si des effluents sont rejetés à plusieurs endroits sur un site minier, l’un des essais de toxicité sublétale recommandés peut être utilisé pour déterminer le degré de toxicité sublétale attribuable aux différentes sources de rejet d’effluents (voir le chapitre 6).
2.2.1.9 Caractéristiques des environnements miniers
De nombreuses mines et activités minières partagent certaines caractéristiques environnementales communes. Ces caractéristiques sont brièvement présentées dans les sections qui suivent.
Proximité des eaux d’amont : De nombreux sites miniers sont situés à proximité des eaux d’amont de cours d’eau. Dans certains cas, l’effluent peut contribuer de façon significative au débit du cours d’eau en aval du point de rejet. La contribution de l’effluent au débit du cours d’eau influe sur la façon de caractériser la zone exposée. Du fait de leur taille, de leur gradient ou de leur débit intermittent, les cours d’eau d’amont constituent souvent des habitats peu propices pour les poissons. Par conséquent, les effluents miniers sont souvent rejetés dans des eaux réceptrices n’abritant aucune population de poissons, ou n’abritant que des populations peu nombreuses, quoique les effluents dilués finissent généralement par atteindre des habitats de poissons. Néanmoins, certaines espèces de poissons utilisent souvent les eaux d’amont qui leur sont accessibles à un stade quelconque de leur cycle vital, comme lors de la fraie; cette information devrait être prise en considération au moment de la conception d’une ESEE. Les mines auront peut-être à se déplacer progressivement en aval jusqu’à ce qu’elles atteignent un secteur dont le nombre et la variété d’espèces de poissons soient appropriés; cependant, les mines devraient d’abord évaluer les populations de poissons dans le milieu récepteur immédiat.
Qualité et volume des effluents : La qualité et la quantité des effluents miniers sont sous l’influence de plusieurs facteurs, dont la nature du minerai et de la roche hôte, les procédés de traitement du minerai, les méthodes de traitement des effluents ainsi que le climat et l’hydrologie propre au site. Les taux de rejet d’effluents varieront tant en volume qu’en durée, dépendamment des caractéristiques du site. Au Canada, certaines mines tiennent compte des saisons pour le rejet de leurs effluents. La dégradation naturelle de certaines substances, comme le cyanure et l’ammoniac, est réduite par temps froid, ce qui peut rendre difficile le respect des limites de rejet. Pour ces motifs, les eaux usées sont souvent rejetées au printemps et à l’été. Elles peuvent également l’être au début du printemps afin de permettre la libération des grandes quantités d’eau provenant de la fonte des neiges qui se sont accumulées pendant les mois d’hiver.
La présence de poissons dans le milieu récepteur initial peut également influer sur le volume d’effluents rejetés. Par exemple, la nécessité de protéger les poissons qui passent l’hiver dans des bassins, lorsque le débit naturel des cours d’eau est minimal, peut inciter une mine à réduire ses rejets dans la zone exposée. D’autres mines minimisent leurs rejets à la fin de l’été, lorsque le débit est faible et que les poissons s’apprêtent à frayer. À l’inverse, certaines mines peuvent accroître leurs rejets au printemps, profitant du fait que les débits sont élevés pour évacuer une partie de leurs réserves d’eau. Toutefois, ce ne sont pas toutes les mines qui disposent de réservoirs d’une capacité assez grande pour leur permettre d’optimiser le rejet de leurs effluents.
Comme les corps minéralisés diffèrent les uns des autres, chaque effluent possède des caractéristiques propres. Chaque minerai est différent, non seulement d’une mine à l’autre, mais aussi à l’intérieur d’une même exploitation. Un corps minéralisé peut contenir des concentrations variables de certains minéraux. En outre, si la durée de vie d’une mine peut être brève, l’usine située sur le site minier peut traiter du minerai provenant de plusieurs mines. Pratiquement toutes les mines évacuent dans leurs effluents un assemblage particulier de substances préoccupantes influant sur les caractéristiques du site sur le plan de la biodisponibilité et de la dureté de l’eau. Toutefois, du fait des similarités qui caractérisent les procédés d’exploitation utilisés par les mines d’une région donnée, la réalisation d’un plan d’ESEEapplicable à l’échelle régionale peut permettre l’optimisation des ressources.
Les mines incorporent diverses méthodes de traitement des effluents (p. ex., ajout de chaux, bassins de décantation, usines de traitement d’eau) dans leurs procédés, et le type et l’efficacité de chacune de ces méthodes influeront sur la qualité de l’effluent qu’elles rejettent dans l’environnement. Le temps de séjour dans les bassins de décantation peut avoir des répercussions sur la composition de l’effluent. À titre d’exemple, la dégradation du cyanure et le dépôt des matières particulaires sont fonction du temps. Un temps de séjour suffisamment long peut ainsi modifier les concentrations dans l’effluent.
Géologie locale : L’emplacement de la mine est déterminé par la géologie régionale et l’endroit exact où se trouvent les gisements de minerai. La minéralisation locale autour des gisements de minerai influe sur les concentrations naturelles de métaux dans les cours d’eau. Par conséquent, ces concentrations sont souvent plus élevées dans les cours d’eau situés près des sites miniers; il faudrait donc en tenir compte dans le choix des zones de référence, afin d’optimiser la comparaison des données avec celles de la zone exposée.
Biodisponibilité desmétaux : La biodisponibilité des métaux est un élément important à prendre en considération lorsqu’on évalue les effets des effluents miniers dans le cadre du Programme d’ESEE, car les chercheurs continuent d’identifier des facteurs modificateurs qui peuvent influer sur cette biodisponibilité. Par exemple, on peut atténuer les effets des métaux solubles sur le biote au cours du traitement des effluents (p. ex., par l’ajout de chaux pour précipiter les métaux). De plus, les effets des effluents miniers et des sédiments associés sur le milieu aquatique peuvent varier tout au long de la durée de vie de la mine en fonction des variations de la biodisponibilité de certains paramètres.
2.2.2 Zones d’exposition et de référence
Une zone est définie qualitativement pour les besoins de l’échantillonnage et se rapporte à l’échelle géographique appropriée contenant un ou plusieurs sites d’échantillonnage appelés « stations ». Une station est un site d’échantillonnage fixe qui peut être reconnu, défini quantitativement (p. ex., latitude et longitude), et où l’on peut procéder à plusieurs échantillonnages. Dans le Programme d’ESEE, la zone d’étude globale est divisée en zones de référence et en zones exposées pour le plan axé sur le contrôle et l’impact ou, à l’intérieur d’une zone exposée où la concentration de l’effluent diminue graduellement, pour le plan par gradients. Dans le REMM, la zone exposée est définie comme étant « les eaux où vivent des poissons et l’habitat du poisson qui sont exposés à un effluent », et la zone de référence est définie comme étant « les eaux où vivent des poissons et où se trouve un habitat du poisson, qui ne sont pas exposées à un effluent et qui présentent, dans la mesure du possible, les caractéristiques les plus semblables à celles de la zone exposée » (annexe 5, article 1 du REMM).
2.2.2.1 Sélection du point de rejet final aux fins du suivi
Lorsque la mine a plus d’un point de rejet final, il est recommandé de faire l’échantillonnage dans une zone exposée où l’effluent présente le plus grand risque d’effets négatifs sur le milieu récepteur. La charge de substances nocives dans l’effluent, la façon dont l’effluent se mélange dans la zone exposée et la sensibilité du milieu récepteur devraient être prises en compte dans le choix du point de rejet final qui servira au suivi biologique.
2.2.2.2 Choix des zones exposées et des zones de référence
Le choix des zones d’échantillonnage est l’un des éléments les plus critiques du plan d’étude et devrait être effectué minutieusement pour maximiser la qualité de l’information fournie par l’étude. Le plan d’étude dépend du site, et divers exemples de plans d’étude sont fournis au chapitre 4. Toutefois, le présent guide n’empêche nullement l’exploitant de proposer d’autres plans d’étude appropriés au site.
2.2.2.2.1 Zones exposées
Le prélèvement d’échantillons dans la zone exposée devrait être fait près du point de rejet de l’effluent où l’on présume que des effets se feront sentir. De préférence, les zones d’échantillonnage renfermeront un habitat approprié pour la communauté d’invertébrés benthiques et les populations d’espèces de poissons choisies. Le plan d’étude devrait également tenir compte de l’utilisation de la zone exposée par les poissons (p. ex., frayère, nourricerie). La détermination de la zone exposée et des caractéristiques des habitats qu’elle renferme devrait précéder le choix des zones de référence, car les caractéristiques physiques et chimiques de ces dernières devront autant que possible correspondre à celles de la zone exposée (avant qu’elles ne changent après le rejet de l’effluent).
La zone exposée peut renfermer un certain nombre de milieux récepteurs (p. ex., différents ordres de cours d’eau, lacs ou marais, milieux estuariens à marins, ou milieux intertidaux à infralittoraux) et divers types d’habitats. Dans la plupart des cas, les limites de la zone exposée sont déterminées par la zone de mélange de l’effluent. La zone exposée peut comporter une zone fortement exposée à l’effluent et une zone peu exposée à l’effluent, zones que l’on qualifie souvent de « rapprochées » ou d’« éloignées ». On peut utiliser d’autres zones d’échantillonnage dans la zone exposée durant le suivi visant à évaluer l’ampleur et la portée géographique des effets, ou durant le suivi périodique pour mieux étudier ou déterminer les besoins propres au site. Les zones les plus exposées à l’effluent (zones rapprochées) se trouvent à l’extérieur de la zone initiale de rejet (décrite ci‑dessous) et sont plus fortement exposées à l’effluent que les zones éloignées. La zone initiale de rejet est la zone où la vitesse d’écoulement de l’effluent dépasse celle des eaux réceptrices et où l’effluent flotte. Elle est souvent caractérisée par une turbulence apparente et ne s’étend généralement pas sur plus de 5 à 50 m en aval de l’émissaire. Au moins une des stations dans les zones les plus exposées à l’effluent (zones rapprochées) devrait être située le plus près possible du point de rejet, mais à l’extérieur de la zone initiale du rejet. Aux fins des études sur l’ampleur et la portée géographique, la zone exposée doit s’étendre le long du gradient de concentration de l’effluent pour inclure des zones peu exposées (zones éloignées). La zone exposée s’étend géographiquement jusqu’au point où les conditions de référence sont rétablies (la zone exposée et la zone de référence ont été définies plus haut). Il est recommandé de délimiter les zones peu exposées à l’effluent à proximité de la limite de la zone de mélange de l’effluent. De multiples stations d’échantillonnage dans chacune des zones délimitées devraient être utilisées pour déterminer les variations spatiales. Dans un plan d’étude par gradient, il n’y a pas de zone de référence telle quelle, mais les variables de réponse sont évaluées le long du gradient d’exposition.
En pratique, il y aura probablement presque toujours une ou plusieurs zones peu exposées à l’effluent (zones éloignées) pour les échantillonnages autres que ceux du poisson (p. ex., eau, sédiments, benthos). Le choix de l’emplacement des zones peu exposées à l’effluent (zones éloignées) doit être fait de telle sorte que chaque zone comporte un degré différent d’exposition à l’effluent. Toutes les zones exposées devraient être situées, si possible, de façon à éviter ou à réduire au minimum l’exposition à des rejets ne provenant pas de la mine.
2.2.2.2.2 Zones de référence
Les zones de référence ne présentent pas nécessairement les mêmes caractéristiques qu’elles avaient avant l’arrivée des premiers colons européens. Toutefois, les impacts anthropiques non liés à l’exploitation de la mine doivent être similaires à ceux observés dans les zones exposées (Simon, 1991; Omernik, 1995). Si possible, la zone de référence devrait être située dans le même plan d’eau que le point de rejet de l’effluent, mais en amont de ce point ou hors de la zone d’influence de l’effluent. Elle devrait également présenter des caractéristiques physiques et biologiques appropriées et se trouver hors de la zone d’influence de la mine ou d’autres facteurs confusionnels. Lorsqu’une mine est située en bordure d’un plan d’eau (p. ex., présence de barrages et de réservoirs en amont), la zone de référence devrait être située dans un plan d’eau adjacent présentant des caractéristiques similaires ou dans un affluent non exposé du plan d’eau récepteur. Il est également possible de prélever des échantillons dans plusieurs zones exposées situées à une distance croissante du point de rejet, selon un gradient d’exposition (plan par gradients). Au besoin, plus d’une zone de référence peut être utilisée. Au cours de l’étude sur l’ampleur et la portée géographique, il sera peut-être nécessaire de prélever des échantillons dans plusieurs zones de référence si divers types d’habitat sont échantillonnés dans la zone exposée. L’application d’une approche plus régionale prévoyant, par exemple, l’échantillonnage de plusieurs cours d’eau non exposés dans la région (c.-à-d. une approche fondée sur les conditions de référence) peut également être envisagée, en particulier pour les études des communautés d’invertébrés benthiques.
S’il existe des données de suivi historiques, la mine devrait envisager d’utiliser les mêmes zones d’échantillonnage à la condition que celles-ci satisfassent aux exigences du Programme d’ESEE. Ainsi, les données recueillies dans le cadre du Programme d’ESEEpourront être comparées aux données historiques.
Les données de référence (recueillies avant le début du rejet de l’effluent) et l’utilisation de zones de référence multiples peuvent faciliter l’interprétation des données. Il est possible d’utiliser les données historiques comme fondement pour déterminer les effets, mais ces données devraient être traitées comme des données additionnelles aux données de la mine. En effet, le plan d’étude devrait toujours comprendre l’échantillonnage de zones de référence et exposées (ou suivre un plan par gradients). De cette façon, les mêmes conditions de base seront utilisées, et les changements observés ne seront pas attribués indûment à l’effluent minier, parce que des changements dans les paramètres peuvent être dus à des modifications des conditions environnementales (p. ex., inondations ou variations des températures annuelles). Une zone de référence devrait être utilisée de façon à permettre de caractériser les changements causés par l’activité de la mine par rapport à ceux qui ne le sont pas. Les praticiens peuvent également profiter de l’évaluation environnementale des nouveaux projets pour fournir des renseignements supplémentaires au Programme d’ESEE(Kilgour et al., 2007).
Lorsque c’est possible, les zones d’échantillonnage retenues pour différents volets (poissons, communautés d’invertébrés benthiques, qualité de l’eau) devraient être les mêmes. Les caractéristiques des espèces de poissons choisies (p. ex., mobilité, utilisation de l’habitat) et les différents types d’équipement d’échantillonnage peuvent parfois compliquer la situation. Dans certains cas, les zones de référence pour l’échantillonnage des invertébrés benthiques peuvent se trouver directement en amont de la zone exposée, ce qui n’est pas nécessairement le cas pour l’échantillonnage des poissons (en raison de leur mobilité). En outre, les exploitants de mines sont invités à mener l’étude des communautés d’invertébrés benthiques et l’étude des poissons, si cela peut se justifier sur le plan biologique (p. ex., si le moment idéal pour prélever des échantillons en vue d’évaluer les effets sur la reproduction des poissons coïncide avec le moment approprié pour prélever des échantillons en vue d’étudier les communautés benthiques – voir le chapitre 3pour de plus amples renseignements sur la période de reproduction des poissons). Lorsque plusieurs mines sont très rapprochées et qu’elles rejettent leurs effluents dans le même bassin versant, la conduite d’ESEEconjointes est préconisée. Lorsque des études conjointes sont proposées, les zones d’échantillonnage peuvent être partagées.
La comparaison des données recueillies dans les zones de référence et dans les zones exposées peut permettre de déceler les impacts sur la vie aquatique (Yoder, 1991), de déterminer quels sont les agents stressants (Hughes et al., 1994), d’observer les tendances temporelles et spatiales (Yoder, 1989) et de fournir aux organismes gouvernementaux des données sur les ressources en eau (OEPA, 1990). Les zones « les moins touchées » diffèrent d’une région à l’autre. En revanche, il peut être impossible de trouver une zone de référence dans les régions extrêmement perturbées. Dans ce cas, il faudrait prévoir dans le plan d’étude que les zones de référence peu perturbées seront situées dans des bassins versants comparables, à l’intérieur de la même écorégion (Hughes et al., 1994).
Dans le cas des mines en milieu côtier, il n’existe habituellement pas de zones strictement « d’amont » où l’on peut prélever des échantillons de référence, vu la variabilité de la direction des courants sous l’effet des marées. Dans le cas des usines situées sur le bord d’un estuaire, les zones d’amont peuvent être trop différentes sur les plans physique et biotique de la zone exposée pour permettre de prélever des échantillons de référence valables. Dès lors, en général, la zone de référence se trouve au moins périodiquement en aval du point de rejet de l’effluent. Il est donc important de connaître la configuration des courants dans la région pour déterminer si une zone de référence potentielle est bien « à l’extérieur » de la zone touchée par l’effluent de la mine.
Par ailleurs, le fait de choisir une zone de référence à l’étape initiale ne signifie pas qu’il faut forcément la choisir de nouveau pour les étapes à venir.
Dans son choix des zones d’échantillonnage, la mine devrait tenir compte :
- de l’emplacement des zones d’échantillonnage dans les études précédentes;
- de l’emplacement des facteurs de confusion;
- de la superficie des zones requise pour permettre le prélèvement du nombre d’échantillons nécessaires;
- du type d’habitat;
- de l’accessibilité du site;
- de tout autre facteur susceptible d’influer sur la mobilité des poissons.
En général, les deux zones d’échantillonnage devraient :
- être aussi semblables que possible, à l’exception de l’exposition à l’effluent. Les deux zones ne seront vraisemblablement pas identiques, mais on présume que les différences liées aux caractéristiques naturelles (p. ex., profondeur, substrat, débit, qualité de l’eau) (autres que les facteurs connexes à la mine) seront minimales par rapport à l’effet potentiel associé à la présence de l’effluent. Si tel n’est pas le cas, cela devrait devenir apparent, et des modifications devraient être apportées au plan d’étude pour les étapes subséquentes;
- être situées aussi près que possible l’une de l’autre (mais assez éloignées pour qu’il soit certain que les poissons de la zone de référence ne sont pas exposés à l’effluent);
- être accessibles et permettre le prélèvement des échantillons en toute sécurité durant la saison la plus appropriée (c.-à-d. lorsque des mesures de croissance, de reproduction, de l’état de santé et de survie des poissons peuvent être prises);
- être décrites de la façon la plus détaillée possible, en incluant la latitude et la longitude et une description écrite (caractéristiques physiques, chimiques et biologiques de l’habitat, incluant des mesures de la température, de la profondeur et du débit).
Pour une étude axée sur le contrôle et l’impact, il faudrait échantillonner au moins une zone de référence et une zone exposée au cours de la première ESEE et des ESEEsubséquentes (études visant à confirmer l’absence ou la présence d’effet et études sur l’ampleur et la portée géographique). L’utilisation de zones de référence multiples assure une plus grande puissance statistique pour détecter toute différence significative entre une zone de référence et une zone exposée (Foran et Ferenc, 1999). Elle permet également d’avoir une idée des variations entre les zones de référence (Munkittrick et al., 2000). Les mesures prises dans une zone exposée qui se situent à l’extérieur de la plage de valeurs observées à un certain nombre de zones de référence ont plus vraisemblablement une pertinence sur le plan écologique (Munkittrick et al., 2000). L’échantillonnage de zones de référence multiples devrait également être préféré à l’augmentation de la taille des d’échantillons (p. ex., le nombre de poissons) dans une seule zone (Environnement Canada, 1997).
Quand cela est possible, le choix de sites semblables présente des avantages, car les données recueillies peuvent aider à l’interprétation des réponses. Toutefois, il se peut que les zones d’échantillonnage optimales des communautés benthiques ne conviennent guère à l’étude des poissons en raison des caractéristiques des espèces de poissons visées, de la mobilité des poissons, des différences d’habitat et du type d’équipement d’échantillonnage requis. Dans de nombreux cas, les zones d’échantillonnage pourront être les mêmes, mais il ne s’agit pas d’un critère suffisant en soi pour orienter le choix de la zone d’échantillonnage des poissons.
2.2.3 Indication de l’emplacement des stations
Dans le rapport d’interprétation, la latitude et la longitude des zones d’échantillonnage seront exprimées en degrés, minutes et secondes et la description des zones d’échantillonnage permettra de reconnaître leur emplacement (annexe 5, alinéa 17b) du REMM). Il y a diverses façons d’obtenir la longitude et la latitude. Des systèmes de positionnement global (GPS) sont couramment employés pour déterminer l’emplacement des stations sur le terrain, et il est recommandé de s’en servir à cette fin. Dans certains cas, les coordonnées exprimées en fonction de la distance franchie sur le cours d’eau (p. ex., kilomètres de cours d’eau) sont utiles. L’exactitude recommandée du positionnement devrait être déterminée en fonction de chaque emplacement. Dans certains cas, en présence de multiples émissaires, les usines peuvent choisir de collaborer pour leurs études.
Des stations peuvent être ajoutées pour obtenir une meilleure représentation des configurations spatiales à l’intérieur d’une zone très étendue de dilution de l’effluent, par exemple, à un emplacement avec transects (droit, central, gauche), dans des zones d’échantillonnage fortement exposées à l’effluent (rapprochées) et peu exposées à l’effluent (éloignées), ainsi que dans des zones d’échantillonnage de référence.
2.2.4 Facteurs de confusion
Les facteurs de confusion peuvent fausser l’interprétation des résultats du suivi biologique. Si les zones d’échantillonnage sont assez semblables, alors les effets de ces facteurs pourraient être considérés comme négligeables. Cependant, lorsqu'il y a des différences significatives d’une zone d'échantillonnage à une autre, le plan d’étude peut devenir embrouillé. Dans ce cas, il peut être difficile de différencier les effets de l’effluent de l’usine de ceux du ou des facteurs de confusion sur les variables. Par exemple, si le genre d'habitat (p. ex., un bassin) en aval de la mine est différent de l’habitat situé en amont (p. ex., un seuil), alors les effets de la différence d'habitat sur les variables engendreraient de la confusion au sujet des effets associés à l’effluent de la mine, car tant l’effluent que le genre d'habitat peuvent induire des différences dans les variables observées en aval et en amont de l’émissaire de l’effluent.
L’intégration de zones de référence multiples dans le plan d’étude peut aider à prévenir l’influence des facteurs de confusion à caractère spatial, et les mines sont encouragées à adopter cette stratégie. Diverses considérations liées à la conception permettant de détecter les perturbations anthropiques ont été présentées dans la documentation (voir Green, 1993, et les références citées par cet auteur; Underwood, 1994, 1997). Ici encore, les mines sont encouragées à intégrer ces considérations dans leurs plans d’étude.
Voici quelques exemples de facteurs de confusion potentiels :
- affluents et autres sources de rejet ponctuelles et diffuses (p. ex., autres rejets industriels, ruissellement agricole, installations d’aquaculture, stations d’épuration des eaux usées);
- variables naturelles de l’environnement ou de l’habitat;
- dommages antérieurs.
Il importe de considérer, pendant la conception de l’étude, les facteurs de confusion potentiels trouvés pendant la caractérisation du site. Les facteurs peuvent ainsi être réduits au minimum ou pris en compte dans la conception de l’étude de façon à pouvoir évaluer leur influence au moment de l’interprétation des données.
2.2.5 Affluents et autres sources de rejet ponctuelles et diffuses
L’eau de dilution d’un cours d’eau, d’un lac, d’un estuaire ou d’un océan provient des affluents. Cette eau n’a pas nécessairement les mêmes propriétés chimiques que le plan d’eau à l’étude. L’eau des affluents prend également un certain temps à se mélanger à l’eau du cours d’eau à l’étude, et ce mélange se produit sur une certaine distance. Ainsi, s’il existe un affluent entre la zone de référence et la zone exposée, l’apport d’eau additionnel provenant de cet affluent peut brouiller l’interprétation des données.
La présence d’autres sources de rejet ponctuelles ou diffuses peut compliquer la distinction entre les effets dus à l’effluent de la mine et ceux imputables aux autres rejets, particulièrement s’ils se situent à proximité du point de rejet de la mine. Lorsque d’autres points de rejet se trouvent immédiatement en amont du point de rejet de l’effluent minier, il convient d’utiliser des zones de référence multiples. Une de ces zones de référence devrait être située entre l’autre point de rejet et le point de rejet de l’effluent minier. De cette manière, il pourrait être possible de constater l’influence de l’autre source de pollution et de déterminer l’ampleur des effets dus à l’effluent de la mine. En outre, la zone de référence devrait présenter les mêmes concentrations naturelles de métaux. S’il n’y a aucune différence entre les deux zones de référence, elles peuvent être comparées ensemble à la zone exposée.
S’il y a d’autres sources ponctuelles de rejet d’effluents non liées aux mines dans la zone d’étude, le plan d’étude devrait tenter de réduire au minimum les effets potentiels des facteurs de confusion. S’il s’avère impossible d’occulter l’influence des facteurs de confusion en modifiant le plan d’étude, il faut envisager le recours à d’autres plans et méthodes d’échantillonnage.
2.2.6 Variations de l’environnement et de l’habitat naturels
Les biocénoses (communautés biotiques de populations animales et végétales ) naturelles peuvent présenter des différences tant spatiales que temporelles. En particulier, si les zones d’étude sont vastes, les biocénoses naturelles et leurs caractérisques peuvent différer d’un endroit à l’autre. Il peut alors être difficile de distinguer les effets de l’effluent minier, s’il en est, des variations naturelles.
Voici des facteurs de confusion qui devraient être pris en compte du fait qu’ils sont couramment observés en milieu naturel :
- type d’habitat (seuil, rapide, fosse);
- type de substrat (teneur en matières organiques, granulométrie);
- profondeur de l’eau;
- écoulement et débit de l’eau;
- effets des marées, des courants, des vagues;
- salinité;
- oxygène dissous, température;
- couverture végétale émergente et/ou submergée;
- chimie de l’eau (conductivité, dureté, pH, etc.);
- propriétés biologiques.
Une fois qu'ils figurent dans la conception de l’étude, les facteurs de confusion ne peuvent être éliminés. C'est uniquement en accordant une grande attention aux facteurs modificateurs potentiels au moment de la préconception ou des étapes antérieures du plan d’étude que l’effet de ces facteurs pourra être éliminé ou réduit au cours des étapes suivantes. Lorsqu'il n'est pas possible d'éliminer les facteurs de confusion, l’augmentation du nombre de zones d'échantillonnage ou l’ajout d’autres paramètres chimiques et/ou biologiques pourront permettre aux responsables d'évaluer leur effet sur l’interprétation des données.
Lorsqu’il est impossible de résoudre les facteurs confusion en modifiant le plan d’étude, d’autres plans et méthodes d’échantillonnage (chapitre 9) devraient être considérés.
2.2.7 Dommages antérieurs
Quand la zone dans laquelle une mine rejette son effluent a été perturbée dans le passé par d’autres activités, il peut être difficile de départager les effets actuels de l’effluent de ceux des pratiques passées. Dans ce cas, il faudra peut-être recourir à une méthode de remplacement.
2.3 Programme général d’assurance et de contrôle de la qualité et modes opératoires normalisés
2.3.1 Assurance de la qualité et contrôle de la qualité
Chaque chapitre du présent guide contient une section traitant du programme d’assurance et de contrôle de la qualité (AQ/CQ). L’assurance de la qualité et le contrôle de la qualité forment un système documenté intégrant l’examen, la vérification et le contrôle interne de la qualité. L’objectif du programme d’AQ/CQest de veiller à ce que toutes les activités d’échantillonnage sur le terrain et d’analyse en laboratoire produisent des résultats valables sur les plans technique et scientifique.
L’assurance de la qualité est un système planifié d’opérations et de modes opératoires destiné à garantir au client le respect des normes de qualité établies. Appliquée aux analyses, l’assurance de la qualité précise la façon dont les tâches sont exécutées de manière à ce que les données satisfassent à des objectifs pré‑établis de qualité. Ces tâches englobent non seulement les analyses, mais aussi tous les aspects de la manipulation des échantillons et de la gestion des données.
L’assurance de la qualité couvre une vaste gamme de pratiques internes et externes de gestion et de pratiques techniques destinées à assurer que les données sont d’une qualité satisfaisante et correspondent à l’usage prévu. Les activités externes d’AQ comprennent la participation à des comparaisons interlaboratoire pertinentes et l’exécution de vérifications par des organismes de l’extérieur. Ces vérifications peuvent porter sur le rendement des analyses de matériaux de référence étalons ou reposer sur un examen général des pratiques fondé sur la documentation traitant de l’échantillonnage, des procédures d’analyse et d’AQ/CQ, des résultats des essais et des données justificatives. Le contrôle de la qualité (CQ) est un aspect interne de l’assurance de la qualité. Il inclut les techniques qui servent à mesurer et à évaluer la qualité des données, ainsi que les mesures correctrices à prendre lorsque les objectifs de qualité des données (OQD) ne sont pas atteints. Dans le contexte d’une étude particulière, la qualité des données ne peut être assurée que si des OQD ont été fixés. Les utilisateurs des données devraient jouer un rôle de premier plan dans l’établissement des OQD d’une étude et dans l’assurance que les limites de contrôle de la qualité d’un laboratoire correspondent à ces objectifs.
Il importe de définir les mesures de qualité des données de la même façon que les OQD afin de pouvoir comparer les deux dans l’évaluation du projet. Les OQD sont normalement établis en fonction des utilisations prévues des données (p. ex., hypothèses à vérifier, tests statistiques et incertitude totale tolérable). L’incertitude totale inclut l’imprécision (liée à l’échantillonnage, aux analyses et à l’environnement) et tout biais analytique éventuel (Taylor, 1987). Des objectifs peuvent être établis pour chaque composante, ainsi que pour l’incertitude totale, en vue de les intégrer aux plans d’AQ du projet. Il est possible d’estimer les différentes composantes de l’imprécision en utilisant les données fournies par les réplicats de terrain et de laboratoire.
Il convient de préciser dans le plan de gestion de la qualité les fonctions d’assurance de la qualité, l’identité des personnes chargées de chaque fonction d’AQ et les mesures correctrices prévues en cas de dépassement des limites de performance.
Les activités de contrôle de la qualité déterminent les limites de rendement acceptables du système de mesure et couvrent les vérifications de routine (mesures de qualité des données) visant à évaluer le degré de conformité du système aux objectifs de rendement préétablis. En général, quand le système ne fonctionne plus, l’enregistrement des données cesse, et des mesures correctives sont mises en œuvre. Des méthodes utilisant des diagrammes de contrôle des intervalles et des moyennes ont été décrites ailleurs (Ministère de l’Environnement de l’Ontario, 1984; ASTM, 1985, 1986; Dux, 1986).
Un aperçu des exigences d’AQ/CQpour les composantes particulières de l’étude des poissons (chapitre 3), de l’étude des communautés d’invertébrés benthiques (chapitre 4), du suivi de la qualité de l’eau et de l’effluent (chapitre 5) et du suivi de la qualité des sédiments (chapitre 7) est présenté dans chacun des chapitres. Les principaux sujets traités sont le contrôle de la qualité sur le terrain et en laboratoire, l’analyse des données et la production des rapports.
2.3.2 Modes opératoires normalisés
Les modes opératoires normalisés (MON) constituent un élément fondamental de tout programme d’AQ/CQ. Pour assurer le contrôle de la qualité, toutes les activités sur le terrain et en laboratoire devraient se dérouler conformément aux MON. Ceux-ci devraient contenir une description détaillée des éléments suivants :
- sur le terrain : méthodes et procédures d’échantillonnage, manipulation, étiquetage, équipement, conservation, tenue de registres et expédition des échantillons;
- en laboratoire : méthodes d’analyse et modes opératoires, manipulation et étiquetage des échantillons, équipement, mise en œuvre des systèmes d’essai, tenue de registres, etc.
Chaque MONdevrait consister en une méthode décrite en détail mise à la disposition de tous les analystes sous forme de document écrit. Les modes opératoires normalisés devraient être fondés sur des procédures élaborées par des organismes de normalisation comme Environnement Canada, l’U.S. Environmental Protection Agency, l’American Society for Testing and Material (ASTM) et l’American Public Health Association (APHA). Lorsque des méthodes n’ont pas fait l’objet d’une validation poussée, le MON devrait fournir des renvois complets à la documentation pertinente et, le cas échéant, contenir tous les éléments précisés dans le code de la Canadian Association for Laboratory Accreditation (CALA, 1991). Les données de validation internes devraient être annexées aux modes opératoires normalisés et inclure les procédures d’AQ/CQ, notamment les types d’échantillons destinés aux analyses de contrôle de la qualité et la fréquence de ces analyses, les degrés de précision et d’exactitude et les taux de récupération attendus ainsi que les limites de détection des méthodes.
Les méthodes d’analyse chimique sont en général assez bien documentées, mais ce n’est souvent pas le cas des méthodes d’échantillonnage en général et des plans d’échantillonnage en particulier. L’erreur d’échantillonnage est habituellement responsable d’une grande part, sinon de la majeure part, de l’incertitude inhérente aux mesures environnementales. L’inclusion des opérations sur le terrain dans les MON contribue à réduire cette incertitude ou, à tout le moins, à la quantifier. Tout le personnel qui participe à l’étude sur le terrain doit connaître les MON.
Une attention particulière devrait être accordée aux mesures destinées à prévenir la contamination accidentelle des échantillons et à en préserver l’intégrité. En outre, les MON devraient contenir des instructions concernant la préparation de l’équipement et fournitures d’échantillonnage ainsi que l’étalonnage de tous les instruments (p. ex., instruments de mesure).
2.4 Références
ASTM – American Society for Testing and Materials. 1985. Standard Practice for Establishing Conditions for Laboratory Sensory Evaluation of Foods and Beverages. Philadelphia (PA). ASTM E480-84.
ASTM – American Society for Testing and Materials. 1986. Physical Requirement Guidelines for Sensory Evaluation Laboratories. Philadelphia (PA). ASTM STP 913.
Bisson, P.A., et D.R. Montgomery. 1996. « Valley segments, stream reaches, and channel units », dans F.R. Hauer et G.A. Lamberti (éd.), Methods in Stream Ecology. San Diego (CA), Academic Press. Pp. 23-52.
Booth, J., D. Hay et J. Truscott. 1996. Standard Methods for Sampling Resources and Habitats in Coastal Subtidal Regions of British Columbia: Part I – Review of Mapping with Preliminary Recommendations. Rapport technique canadien des sciences halieutiques et aquatiques, no 2118, 53 pages.
Budd, W.W., P.L. Cohen, P.R. Saunders et F.R. Steiner. 1987. « Stream corridor management in the Pacific Northwest: 1. Determination of stream-corridor widths », Environmental Management, 11 : 587-597.
Busch, W.-D.N., et P.G. Sly. (éd.) 1992. The Development of an Aquatic Habitat Classification System for Lakes. Boca Raton (FL), CRC Press. 225 pages.
CALA – Canadian Association for Laboratory Accreditation (formerly CAEAL – Canadian Association of Environmental Analytical Laboratories). 1991. Code of Practice and QA Manual for Laboratory Analysis of Sewage Treatment Effluent in Support of the MISA Program. Rapport préliminaire préparé par Zenon Environmental Laboratories pour CAEAL et le ministère de l’Environnement de l’Ontario.
Conquest, L.L., S.C. Ralph et R.J. Naiman. 1994. « Implementation of large-scale stream monitoring efforts: Sampling design and data analysis issues », dans S.L. Loeb et A. Spacie (éd.), Biological Monitoring of Aquatic Systems. Boca Raton (FL), Lewis Publishers. Pp. 69‑90.
Corkum, L.D. 1989. « Patterns of benthic invertebrate assemblages in rivers of northwestern North America », Freshwater Biology, 21 : 191-205.
Corkum, L.D. 1992. « Spatial distributional patterns of macroinvertebrates along rivers within and among biomes », Hydrobiologia, 239 : 101-114.
Corkum, L.D. 1996. « Responses of chlorophyll a, organic matter and macroinvertebrates to nutrient additions in rivers flowing through agricultural and forested land », Archiv für Hydrobiologie, 136 : 391-411.
Cowardin, L.M., et F.C. Golet. 1995. « U.S. Fish and Wildlife Service 1979 wetland classification: A review », Vegetatio, 118 : 139-152.
Cowardin, L.M., V. Carter, F.C. Golet et E.T. LaRoe. 1979. Classification of Wetlands and Deepwater Habitats of theUnited States. Washington (DC), U.S. Fish and Wildlife Service. FWS/OBS-79/31.
Cupp, C.E. 1989. Valley Segment Type Classification for Forested Lands of Washington. Olympia (WA), Washington Forest Protection Association, Timber, Fish and Wildlife Ambient Monitoring Program. AM-89-001, 42 pages.
Dolman, W.B. 1990. « Classification of Texas reservoirs in relation to limnology and fish community associations », Transactions of the American Fisheries Society, 119 : 511‑520.
Dux, J.P. 1986. Handbook of Quality Assurance for Analytical Chemistry Laboratory. New York (NY), Van Nostrand Reinhold Co.
Eadie, J.M., et A. Keast. 1984. « Resource heterogeneity and fish species diversity in lakes », Canadian Journal of Zoology, 62 : 1689-1695.
Environnement Canada. 1997. Fish Population Survey Expert Working Group Final Report: Recommendations from Cycle 1 Review. Ottawa, Direction de la qualité de l'environnement et de la politique scientifique, Bureau national des ESEE. EEM/1997/6.
Environnement Canada. 2003. Guide technique révisé pour la réalisation d'études de délimitation du panache des effluents. Sur le Web : http://www.ec.gc.ca/esee-eem/D450E00E-61E4-4219-B27F-88B4117D19DC/GUIDE%20TECHNIQUE %20R%C9VIS%C9%20POUR%20LA%20R%C9ALISATION%20D.pdf.
Équipe d’examen de l’ESEE des mines de métaux. 2007. Rapport de l’Équipe d’examen de l’Étude de suivi des effets sur l’environnement des mines de métaux. Sur le Web :
http://www.ec.gc.ca/esee-eem/default.asp?lang=Fr&n=2DAFFC56-1.%20.
Finlayson, C.M., et A.G. van der Valk. 1995. « Wetland classification and inventory. A summary », Vegetatio, 118 (1-2) : 185-192.
Fischer, H.B., E.J. List, R.C.Y. Koh, J. Imberger et N.H. Brooks. 1979. Mixing in Inland and Coastal Waters. San Diego (CA), Academic Press Inc.
Foran, J., et S. Ferenc. 1999. Multiple Stressors in Ecological Risk and Impact Assessment. Pensacola (FL), SETAC Press. 100 pages.
Freeze, R.A., et J.A. Cherry. 1979. Groundwater. Englewood Cliffs (NJ), Prentice-Hall.
Frissell, C.A., W.L. Liss, C.E. Warren et M.D. Hurley. 1986. « A hierarchical framework for stream habitat classification: Viewing streams in a watershed context », Environmental Management, 10 : 199-214.
Frith, H.R., G. Seraring, P. Wainwright, H. Harper et B. Emmett. 1993. Review of Habitat Classification Systems and an Assessment of their Suitability to Coastal B.C. Sidney (C.‑B.), L.G.L. Ltd., pour Environnement Canada. Rapport non publié.
Green, R.H. 1993. « Application of repeated measures designs in environmental impact and monitoring studies », Australian Journal of Ecology, 18 : 81-98.
Hay, D.E., R.D. Waters et T.A. Boxwell (éd.) 1996. Proceedings. Marine Ecosystem Monitoring Network Workshop,Nanaimo, B.C. March 28-30. 1995. Rapport technique canadien des sciences halieutiques et aquatiques, no 2108, 160 pages.
Hawkins, C.P., J.L. Kershner, P.A. Bisson, M.D. Bryant, L.M. Decker, S.V. Gregory, D.A. McCullough, C.K. Overton, G.H. Reeves, et al. 1993. « A hierarchical approach to classifying stream habitat features », Fisheries, 18 : 3-12.
Hughes, R.M. 1995. « Defining acceptable biological status by comparing with reference conditions », dans W.S. Davis et T.P. Simon (éd.), Biological Assessment and Criteria: Tools for Water Resource Planning and Decision Making. Boca Raton (FL), Lewis Publishers. Pp. 31-47.
Hughes, R.M., S.A. Heiskary, W.J. Matthews et C.O. Yoder. 1994. « Use of ecoregions in biological monitoring », dans S.L. Loeb et A. Spacie, Biological Monitoring of AquaticSystems. Boca Raton (FL), Lewis Publishers. Pp. 125-149.
Hutchinson, G.E. 1957. A Treatise on Limnology.VolI. Geology, Physics, and Chemistry. New York (NY), John Wiley & Sons Inc. 1015 pages.
Kerr, S.R., et R.A. Ryder. 1988. « The applicability of fish yield indices in freshwater and marine ecosystems », Limnology and Oceanography, 33 : 973-981.
Kilgour, B.W., M.G. Dubé, K. Hedley, C.B. Portt et K.R. Munkittrick. 2007. « Aquatic environmental effects monitoring guidance for environmental assessment practitioners », Environmental Monitoring Assessment, 130 : 423-436.
Leopold, L.B. 1994. A View of the River. Cambridge (MA), Harvard University Press. 297 pages.
Leopold, L.B., G.M. Wolman et J.P. Miller. 1964. Fluvial Processes in Geomorphology. San Francisco (CA), W.H. Freeman & Co. 522 pages.
Levings, C.D., et R.M. Thom. 1994. « Habitat changes in the Georgia Basin: Implications for resource management and restoration », dans R.C.H. Wilson, R.J. Beamish, F. Aitkens et J. Bell (éd.), Review of the Marine Environment and Biota of Strait of Georgia, Puget Sound and Juan de Fuca Strait : Proceedings of the BC/Washington Symposium on the Marine Environment, Jan. 13, 14 1994. Rapport technique canadien des sciences halieutiques et aquatiques, no 1948. Pp. 330-351.
Marshall, T.R., et P.A. Ryan. 1987. « Abundance and community attributes of fishes relative to environmental gradients », Canadian Journal of Fisheries and Aquatic Sciences, 44 : 196-215.
Matthews, G.W.T. 1993. The Ramsar Convention: Its History and Development. Glan (CH), Ramsar Convention Bureau.
Maxwell, J.R., C.J. Edwards, M.E. Jensen, S.J. Paustian, H. Parrott et D.M. Hill. 1995. A Hierarchical Framework of Aquatic Ecological Units in North America (Nearctic Zone). St. Paul (MN), U.S. Department of Agriculture, Forest Service, North Central Forest Experimental Station. Gen. Tech. Rep. NC-176, 72 pages.
Meador, M.R., C.R. Hupp, T.F. Cuffney et M.E. Gurtz. 1993. Methods for Characterizing Stream Habitat as Part of the National Water-quality Assessment Program. Raleigh (NC), U.S. Geological Survey. Open-File Report 93-408.
Ministère de l’Environnement de l’Ontario. 1984. Principles of Control Charting. D.E. King et R.C. Ronan (éd.). Rexdale (Ont.), Ministère de l’Environnement de l’Ontario, Laboratory Services Branch. Data Quality Report Series.
Ministère des Richesses naturelles de l’Ontario. 1989. Manual of Instructions. Aquatic Habitat Inventory Surveys.Toronto (Ont.), ministère des Richesses naturelles de l’Ontario.
Montgomery, D.R., et J.M. Buffington. 1993. Channel Classification, Prediction of Channel Response, and Assessment of Channel Condition. Olympia (WA), Department of Natural Resources. Washington State Timber/Fish/Wildlife Agreement, Report TFW‑SH10-93-002.
Munkittrick, K.R., M. McMaster, G. Van Der Kraak, C. Portt, W. Gibbons, A. Farwell et M. Gray. 2000. Development of Methods for Effects-Based Cumulative Effects Assessment Using Fish Populations: Moose River Project. Pensacola (FL), SETAC Press. xviii + 236 pages.
Newbury, R.W. 1984. « Hydrological determinants of aquatic insect habitats », dans V.H. Resh et D.M. Rosenberg (éd.), The Ecology of Aquatic Insects. New York (NY), Praeger. Pp. 323-357.
Newbury, R.W., et M.N. Gaboury. 1993. Stream Analysis and Fish Habitat Design. A Field Manual. Gibson (C.-B.), Newbury Hydraulics Ltd., The Manitoba Habitat Heritage Corporation, Manitoba Fisheries Branch.
OEPA – Ohio Environmental Protection Agency. 1990. Ohio Water Resource Inventory. Columbus (OH), Ohio Environmental Protection Agency.
Omernik, J.M. 1995. « Ecoregions: A spatial framework for environmental management », dans W.S. Davis et T.P. Simon (éd.), Biological Assessment and Criteria: Tools for Water Resource Planning and Decision Making. Boca Raton (FL), Lewis Publishers. Pp. 49-62.
Orth, D.J. 1989. « Aquatic habitat measurements », dans L.A. Neilson et D.L. Johnson (éd.), Fisheries Techniques. Bethesda (MD), American Fisheries Society. Pp. 61-84.
Pêches et Océans Canada. 1990. Coastal/Estuarine Habitat Description and Assessment Manual. Part II. Habitat Description Procedures. Coquitlam (C.-B.), préparé par G.L. Williams and Associates Ltd.
Pêches et Océans Canada et ministère de l’Environnement et des Parcs de la Colombie-Britannique. 1987. Fish Habitat Inventory and Information Program: Stream Survey Field Guide.
Peterjohn, W.T., et D.L. Correll. 1984. « Nutrient dynamics in an agricultural watershed: Observation on the role of a riparian forest », Ecology, 65 : 1466-1475.
Plafkin, J.L., M.T. Barbour, K.D. Porter, S.K. Gross et R.M. Hughs. 1989. Rapid Bioassessment Protocols for Use in Streams and Rivers: Benthic Macroinvertebrates and Fish. Washington (DC), U.S. Environmental Protection Agency. EPA/444/4-89-001.
Reynoldson, T.D., et D.M. Rosenberg. 1996. « Sampling strategies and practical considerations in building reference data bases for the prediction of invertebrate community structure », dans R.C. Bailey, R.H. Norris et T.B. Reynoldson (éd.), Study Design and Data Analysis in Benthic Macroinvertebrate Assessments of Freshwater Ecosystems Using a Reference Site Approach. Technical Information Workshop North American Benthological Society, 44th Annual Meeting, Kalispell, Montana. Pp. 1‑31.
Robinson, C.L.K., et C.D. Levings. 1995. An Overview of Habitat Classification Systems, Ecological Models and Geographic Information Systems Applied to Shallow Foreshore Marine Habitats. Rapport manuscrit canadien des sciences halieutiques et aquatiques, no 2322, 65 pages.
Robinson, C.L.K., D.E. Hay, J. Booth et J. Truscott. 1996. Standard Methods for Sampling Resources and Habitats in Coastal Subtidal Regions of British Columbia: Part 2 – Review of Sampling with Preliminary Recommendations. Rapport technique canadien des sciences halieutiques et aquatiques, no 2119. 119 pages.
Ryder, R.A. 1965. « A method for estimating the potential fish production of north temperate lakes », Transactions of the American Fisheries Society,94 : 214-218.
Scott, D.A., et T.A. Jones. 1995. « Classification and inventory of wetlands », Vegetatio, 118 : 1-16.
Simon, T.P. 1991. Development of Biotic Integrity Expectations for the Ecoregions of Indiana. I. Central Corn Belt Plain. Chicago (IL), U.S. Environmental Protection Agency, Region V, Environmental Sciences Division, Monitoring and Quality Assurance Branch, Ambient Monitoring Section. EPA 905/9-91/025.
Snelgrove, R.V.R., et C.A. Butman. 1994. « Animal sediment relationships revisited: Cause versus effect », Oceanography and Marine Biology Annual Review, 32 : 111-178.
Strahler, A.N. 1957. « Quantitative analysis of watershed geomorphology », Transactions – American Geophysical Union, 38 : 913-920.
Taylor, J.K. 1987. Quality Assurance of Chemical Measurements. Chelsea (MI), Lewis Publishers Inc.
Thorson, G. 1957. « Bottom communities (sublittoral or shallow shelf) », dans J.W. Hedgpeth (éd.), Treatise on Marine Ecology and Paleoecology, Vol. 1. Memoirs of the Geological Society of America 67. Pp. 461-534.
Underwood, A.J. 1994. « On beyond BACI: Sampling designs that might reliably detect environmental disturbances », Ecological Applications, 4 (1) : 3-15.
Underwood, A.J. 1997. Experiments in Ecology: Their Logical Design and Interpretation Using Analysis of Variance.Cambridge (UK), Cambridge University Press. 504 pages.
Wetzel, R.G. 1975. Limnology. Philadelphia (PA), W.B. Saunders Co. 743 pages.
Wickware, G.M., et C.D.A. Rubec. 1989. Écorégions de l’Ontario. Série de la classification écologique du territoire, n 26. Ottawa (Ont.), Environnement Canada.
Wiken, E.B. 1986. Écozones terrestres du Canada. Série de la classification écologique du territoire, n 19. Ottawa (Ont.), Environnement Canada.
Winter, W.T. 1977. « Classification of hydrological settings of lakes in the north-central United States », Water Resources Research, 134 : 753-767.
Winter, W.T., et M.K. Woo. 1990. « Hydrology of lakes and wetlands », dans M.G. Wolman et H.C. Riggs (éd.), Surface Water Hydrology. Boulder (CO), The Geological Society of America. Pp. 159-187.
Yoder, C.O. 1989. « The development and use of biological criteria for Ohio surface waters », dans Water Quality Standards for the 21st Century. Washington (DC), U.S. Environmental Protection Agency, Office of Water. Pp. 139-146.
Yoder, C.O. 1991. « Answering some concerns about biological criteria based on experiences in Ohio », dans Water Quality Standards for the 21st Century. Washington (DC), U.S. Environmental Protection Agency, Office of Water. Pp. 95-104.
Young, R.A., T. Huntrods et W. Anderson. 1980. « Effectiveness of vegetated buffer strips in controlling pollution from feedlot runoff », Journal of Environmental Quality, 9 : 483‑497.
Tableau
Le tableau 2-1 présente les renseignements relatifs à la caractérisation du site qui doivent figurer dans un plan d’étude d’ESEE. Les principaux types de renseignements comprennent les caractéristiques générales, l’hydrologie, les influences anthropiques, les caractéristiques des ressources aquatiques et les systèmes et pratiques de protection de l’environnement. Chacun des types de renseignements est accompagné d’une liste de renseignements qu’il est recommandé de déclarer.
Retournez à la table des matières
Chapitre 3
3. Effets sur le poisson et les ressources halieutiques
3.2 Considérations applicables au plan d’étude
- 3.2.1 Choix des zones exposées et des zones de référence
- 3.2.2 Facteurs de confusion
- 3.2.3 Rejets en milieu marin
- 3.2.4 Données historiques
3.3 Sélection des espèces de poissons sentinelles
- 3.3.1 Étude de la communauté
- 3.3.2 Poissons immatures
- 3.3.3 Poissons de petite taille
- 3.3.4 Espèces vivipares
3.6 Vérification de l’exposition des poissons
3.8 Méthodes d’échantillonnage des poissons
3.9 Étude des poissons – Assurance de la qualité et contrôle de la qualité
- 3.9.1 Pratiques de terrain pour améliorer l’analyse et l’interprétation des données
- 3.9.2 Contrôle de la qualité sur le terrain
- 3.9.3 Détermination de l’effort d’échantillonnage
- 3.9.4 Consultation avec les coordonnateurs régionaux de l’ESEE et exécution sur le terrain
- 3.9.5 Entrée des données
- 3.9.6 Contrôle de la qualité en laboratoire
3.11 Méthodes d’analyse du potentiel d’utilisation des poissons
- 3.11.1 Sélection des espèces de poissons
- 3.11.2 Prélèvement et préparation des échantillons de tissus
- 3.11.3 Analyses complémentaires : pourcentage de lipides et d’eau
- 3.11.4 Directives pour le dosage du mercure dans les tissus des poissons à l’aide de méthodes non létales
Liste des tableaux
- Tableau 3-1 : Valeurs mesurées lors de l’étude des populations de poissons afin de calculer les critères d’effets et les critères d’appui relatifs à la croissance, la reproduction, la condition et la survie des poissons
- Tableau 3-2 : Structures suggérées pour la détermination de l’âge d’espèces de poissons canadiennes
- Tableau 3-3 : Indicateurs et critères d’effets utilisés pour les différents types d’études des poissons
- Tableau 3-4 : Périodes optimales suggérées pour l’échantillonnage de poissons pour une ESEE
- Tableau 3-5 : Espèces de poissons couramment utilisées dans les ESEE, aspects à considérer dans la conception du plan d’étude et périodes d’échantillonnage recommandées
- Tableau 3-6 : Format suggéré de présentation des paramètres (A) et des régressions (B) requis pour l’analyse de l’étude des poissons
3. Effets sur le poisson et les ressources halieutiques
3.1 Aperçu
Dans le cadre du Programme d’études de suivi des effets sur l’environnement (ESEE), le suivi des poissons peut comprendre l’étude d’une population de poissons ainsi que des analyses de tissus afin de déterminer si l’effluent d’une mine a un effet sur les poissons et les ressources halieutiques. Des détails sur les exigences et les calendriers en matière de rapports se trouvent au chapitre 1 du présent guide et dans le Règlement sur les effluents des mines de métaux (REMM) (DORS/2002-222).
Aux fins du Programme d’ESEE, le terme « poisson » inclut les mollusques, les crustacés et les animaux marins, conformément à l’article 2 de la Loi sur les pêches, mais exclut les parties de ces organismes (annexe 5, article 1 du REMM).
L’étude des poissons permet d’évaluer si la croissance, la reproduction, l’état et la survie de la population de poissons diffèrent selon que celle-ci vit dans une zone exposée ou dans une zone de référence ou dans une zone exposée où existe un gradient décroissant de concentrations d’effluent. Il faudrait noter qu’une mine doit effectuer : « […] une étude de la population de poissons dans le cas où la concentration de l’effluent dans la zone exposée est supérieure à 1 % en deçà de 250 m d’un point de rejet final » (annexe 5, alinéa 9b) du REMM).
En plus de l’étude des poissons, les études de suivi biologique peuvent aussi comporter une étude des tissus de poissons si une concentration de mercure total (mercure inorganique et organique) égale ou supérieure à 0,10 µg/L a été observée lors de la caractérisation de l’effluent menée aux termes de l’alinéa 4(1)d) (annexe 5, alinéa 9c) du REMM). Un « effet sur les tissus de poissons » s’entend lorsque des mesures de la concentration du mercure total dans les tissus de poissons, prises dans la zone exposée, supérieures à 0,5 µg/g (poids humide), présentant une différence statistique et ayant une concentration plus élevée par rapport à celles mesurées dans les tissus de poissons prises dans la zone de référence (annexe 5, article 1 du REMM).
3.2 Considérations applicables au plan d’étude
Des renseignements généraux concernant le plan d’étude sont fournis au chapitre 2. Les exigences en matière de plan d’étude et les définitions des effets pour l’étude des populations de poissons et l’analyse des tissus de poissons sont analysées au chapitre 1.
Pour évaluer l’effet d’un effluent sur les poissons, il faut répondre aux questions suivantes :
- Y a-t-il un effet?
- L’effet est-il lié au site minier?
- Connaît-on l’ampleur et la portée géographique de l’effet?
- Connaît-on la cause liée au site minier?
Les représentants ou les experts-conseils de chaque mine au titre de l’ESEE sont invités à communiquer avec le responsable régional de l’ESEE afin d’examiner les résultats des travaux de la phase précédente de sélection des sites et des espèces, de l’effort de pêche, etc. et pour discuter des choix les plus appropriés pour la phase en cours. En considérant ce qui précède, les résultats des phases précédentes, les données historiques et le savoir local devraient servir à évaluer :
- la pertinence du choix des espèces sentinelles et les succès de capture;
- la pertinence de la zone de référence;
- la pertinence des méthodes d’échantillonnage et du matériel requis.
Il se peut que les mines veuillent faire des changements entre les phases, comme accroître l’effort d’échantillonnage, changer de méthodes d’échantillonnage, l’équipement ou les espèces de poissons, sélectionner des zones exposées ou des zones de référence différentes ou encore utiliser des techniques de suivi de rechange. Le plan d’étude devra peut-être être modifié pour diverses raisons, dont celles-ci :
- les résultats indiquent que la puissance statistique dans la phase précédente était insuffisante à cause du faible nombre de poissons prélevés ou d’une forte variabilité;
- les caractéristiques de l’espèce n’étaient pas mesurables ou n’étaient pas adéquates, ou l’état des populations de poissons soulevait des préoccupations;
- il est incertain que les poissons aient été exposés à l’effluent;
- les zones de référence étaient inappropriées.
Les préoccupations que soulèvent les ESEE (et les études sur le terrain en général) peuvent se répartir comme suit : le caractère adéquat des sites de référence, les effets potentiels de facteurs de confusion (p. ex., les influences potentielles de la génétique sur la variabilité des caractéristiques d’une espèce), la pertinence écologique des indicateurs d’effets utilisés, les influences des variations naturelles et les problèmes de statistiques. Le présent guide va tenter d’offrir des solutions potentielles à ces problèmes.
3.2.1 Choix des zones exposées et des zones de référence
Les deux principaux plans d’étude sont l’approche contrôle-impact et l’approche des gradients. Il faut souligner que le choix de la zone de référence est l’aspect le plus critique des études contrôle-impact sur le terrain (Munkittrick et al., 2009). Idéalement, une zone de référence est située en amont de l’effluent, dans un habitat semblable et est libre d’influences susceptibles de susciter de la confusion parce qu’un obstacle naturel limite les déplacements des poissons entre les sites. Il est rare que cette situation se présente. Les principaux problèmes cités concernant les zones de référence sont de savoir (a) si la zone de référence est comparable comme habitat; (b) si la zone de référence est libre de l’élément préoccupant (exposition) et d’influences pouvant semer la confusion (analysées au chapitre 2); (c) si la zone de référence est accessible aux poissons provenant de la zone exposée (les poissons présents dans une zone de référence d’amont peuvent avoir été exposés par le passé, et les poissons présents dans une zone exposée peuvent être de passage, ce qui réduit leur exposition à des effets potentiels); et (d) si les poissons présents dans la zone d’exposition ont été exposés à l’effluent ou au stresseur d’intérêt.
Aucune zone de référence n’est parfaite. La situation idéale consiste à posséder des données recueillies avant la construction ou le début du stresseur d’intérêt (p. ex., avant-après–contrôle-impact [BACI, de l’anglais before/after-control/impact], voir le chapitre 4 pour plus de détails). Les sites d’étude où se trouvent des obstacles qui préviennent les déplacements des poissons entre les sites (p. ex., barrages, chutes, digues de castor) peuvent être une bonne solution de rechange, pourvu que l’obstacle ne perturbe pas l’habitat. Dans les zones libres, la sélection d’une espèce peu mobile améliore le niveau de confiance parce que les poissons ne se déplacent pas, mais accroît les influences potentielles de différences locales dans l’habitat. Une situation difficile à interpréter se présente lorsqu’il n’y a pas de différences statistiques entre les caractères méristiques des poissons et qu’il n’existe pas d’obstacle empêchant leurs déplacements. Dans ces cas, il est recommandé de désigner un indicateur d’exposition à l’effluent, qui peut être de nature chimique ou physiologique (p. ex., induction des enzymes hépatiques, signatures isotopiques stables) (Galloway et al., 2003; Dubé et al., 2006).
Si les poissons de la zone de référence et de la zone exposée montrent des différences significatives dans leurs caractéristiques, il est possible d’affirmer avec un degré de confiance élevé qu’ils ne se déplacent pas entre les zones. Même si des différences sont relevées, les variations des caractéristiques des poissons (p. ex., croissance, poids, condition) sont fonction d’un certain nombre de facteurs, qui ne sont pas tous reliés au rejet de l’effluent. La sélection des espèces de poissons appropriées pour le suivi, le moment de l’étude et l’équipement d’échantillonnage faciliteront également l’interprétation de toute différence décelée. Néanmoins, d’autres facteurs naturels et facteurs anthropiques peuvent avoir une influence sur les effets subis par les poissons et leurs tissus et susciter la confusion dans l’interprétation des données. L’exigence de confirmer les effets a été établie dans le but d’accroître le niveau de confiance, échelonné sur deux phases, que les effets sont bien liés à la mine.
3.2.1.1 Échantillonnage de la zone exposée et de la zone de référence
La zone exposée doit être choisie de manière à assurer que les poissons prélevés ont été exposés à l’effluent. Dès lors, un premier échantillonnage est effectué pour déterminer quelles espèces sont présentes, ainsi que leur abondance relative. Ensuite, la zone de référence est choisie afin d’obtenir des poissons de la même espèce que ceux qui sont présents dans la zone exposée. L’échantillonnage au sein des différentes zones doit être effectué durant la même période, afin de minimiser les variations temporelles entre les sites. Le moment des échantillonnages dépendra de divers facteurs, comme la période de l’année, le stade de développement de la fonction reproductive, les différences potentielles d’habitat d’un site à l’autre (différences de température, etc.), mais il est recommandé, si c’est possible, que tous les échantillonnages soient effectués au cours de la même semaine. Si l’échantillonnage s’étend sur une plus longue période, les échantillons de poissons de référence doivent être prélevés avant et après le prélèvement d’échantillons de poissons exposés, afin de pouvoir faire une comparaison.
S’il y a des poissons dans la zone de référence, mais aucun dans la zone exposée où ils devraient résider (c.-à-d. que des poissons se trouvaient par le passé dans la zone d’échantillonnage), l’absence de poissons dans la zone exposée doit être signalée comme un effet. Un complément d’information sur le choix de la zone de référence est présenté au chapitre 2.
3.2.1.2 Caractère adéquat de la zone de référence
Il est maintenant commun dans les programmes de recherche d’utiliser un grand nombre de zones de référence. Par exemple, au cours des trois premiers cycles de suivi pour le Programme d’ESEE des fabriques de pâtes et papiers, la tendance était d’utiliser un plus grand nombre de zones de référence. Des zones de référence multiples ont été utilisées avec succès dans 3 % des études dans le cycle 1, 9 % dans le cycle 2 et 25 % dans le cycle 3. L’utilisation de zones de référence additionnelles améliore la capacité d’évaluer les problèmes liés aux variations naturelles, à la pertinence écologique et aux facteurs de confusion, ainsi que la capacité d’évaluer le caractère adéquat de la zone de référence choisie. Les études reposant sur une approche par gradient et sur des zones de référence multiples sont statistiquement plus puissantes que les études dépendant d’une seule zone de référence.
Parmi les nouvelles approches, citons les approches fondées sur les conditions de référence (Bailey et al., 1998) et l’utilisation de zones de référence négatives (la zone exposée est utilisée comme zone de référence). Quoi qu’il en soit, l’existence de changements constants sur deux phases accroît le niveau de confiance à l’effet que les changements sont réels. Les études suivantes doivent évaluer le caractère adéquat des zones de référence, en particulier si des résultats concordants ne sont pas obtenus.
3.2.2 Facteurs de confusion
Dans le cycle 2 du Programme d’ESEE des fabriques de pâtes et papiers, presque 90 % des études qui ont décelé des effets ont aussi conclu que des facteurs autres que les effluents des fabriques de pâtes et papiers étaient à l’origine de telles observations. Il existe des facteurs de confusion potentiels sur la plupart des sites, notamment d’autres exutoires, des modifications de l’habitat, des utilisations passées et la contamination, des affluents et des apports de sources diffuses. Le recours à des méthodes de rechange devrait être considéré dans le cas de situations fortement empreintes de confusion, mais il convient d’insister sur le fait qu’il est possible d’obtenir des résultats de terrain interprétables sur la plupart des sites si des ajustements sont apportés au plan d’étude. Compte tenu de la complexité de certaines situations, il est recommandé de recueillir autant de renseignements que possible afin d’être en mesure de démontrer que d’autres rejets ou sources de contaminants sont principalement responsables des changements observés ou de l’absence de changements observée. Si des changements sont notés et qu’ils sont considérés comme étant dus à des facteurs de confusion, les plans d’étude ultérieurs devraient avoir comme objectif d’éliminer les facteurs de confusion ou de déterminer leur importance.
3.2.3 Rejets en milieu marin
Les mines de métaux qui rejettent leurs effluents dans la mer ou un estuaire peuvent être confrontées à certains problèmes et facteurs de confusion, et elles doivent en tenir compte quand elles mettent au point leur plan d’étude des poissons dans le cadre du Programme d’ESEE. Certains de ces problèmes comprennent :
- des difficultés à échantillonner certaines zones marines et estuariennes (p. ex., à cause des marées, des courants, d’un taux élevé de renouvellement d’eau, d’un habitat qui ne se prête pas à l’échantillonnage); il faudrait dans ce cas avoir recours à des méthodes de remplacement;
- l’existence de gradients de courant, de température et de salinité susceptibles d’influer sur les processus physiques et l’absorption de contaminants et d’entraîner des changements physiologiques dans les organismes;
- le choix de zones de référence plus difficile en milieu marin;
- selon leur stade biologique, les poissons peuvent utiliser différentes parcelles d’habitat à différentes périodes de l’année;
- la disponibilité des espèces peut être faible en milieu marin; dans de nombreux cas, des espèces résidantes de petite taille sont présentes, et il convient de les étudier. Il peut s’agir d’espèces à fraie fractionnée ou vivipares ou d’espèces pour lesquelles il existe peu d’information de référence; toutefois, cette situation ne devrait ni restreindre ni entraver l’utilisation de ces espèces, particulièrement si elles sont abondantes; l’hypothèse de base d’un Programme d’ESEE est qu’une communauté de poissons devrait être intacte, et que les espèces normalement abondantes devraient être présentes; une deuxième hypothèse de base est qu’une population de poissons qui présente un taux de croissance, un développement reproductif et une distribution des classes d’âges identiques à ceux des poissons vivant dans la zone de référence est considérée comme étant non affectée.
Il existe quelques solutions pouvant pallier ces difficultés, comme d’utiliser une espèce de remplacement, des bivalves en cage ou de réaliser une étude en mésocosme dans le cas de milieux où il y a des facteurs de confusion. Les nouvelles installations qui auront recueilli des informations sur l’état de référence avant de commencer à rejeter un effluent seront davantage en mesure d’évaluer l’effet de leur effluent sur le milieu récepteur en comparaison des facteurs de confusion.
3.2.4 Données historiques
Les mines peuvent présenter des données historiques s’il existe déjà des données de suivi biologique qui permettent d’établir la présence d’effets sur les poissons et leurs tissus, ainsi que sur la communauté d’invertébrés benthiques. Les données historiques peuvent être utilisées pour élaborer la première ESEE. Voir le chapitre 13 pour obtenir un complément d’information sur les données historiques.
3.3 Sélection des espèces de poissons sentinelles
La méthode recommandée pour mener à bien l’étude des poissons consiste à examiner des spécimens adultes de deux espèces de poissons relativement sédentaires qui ont été exposés à l’effluent pendant une longue période. Il est préférable d’utiliser des poissons sexuellement matures à cette fin, mais s’il n’y a pas d’individus matures, il est possible de concevoir un Programme d’ESEE en utilisant des mollusques ou des poissons juvéniles, bien qu’il ne sera pas possible d’analyser tous les mêmes critères d’effets. S’il y a des poissons sexuellement matures, au moins une des espèces choisies devrait être benthivore. Les facteurs les plus importants dans le choix des espèces pour le Programme d’ESEE sont l’exposition, l’abondance, la représentativité pour la zone à l’étude (Munkittrick et al., 2000; McMaster et al., 2002) et la sensibilité à l’effluent. La sélection de ces deux espèces devrait tenir compte des espèces utilisées pour les ESEE précédentes réalisées sur le site (s’il y a lieu). La préférence devrait être accordée :
- aux espèces de poissons résidantes (non migratrices) identifiées lors de la caractérisation du site;
- aux mâles et aux femelles sexuellement matures qui sont abondants dans la zone exposée et dans la zone de référence;
- aux espèces pour lesquelles des permis de pêche ou des permis d’échantillonnage peuvent être obtenus;
- et aux espèces les plus exposées à l’effluent.
Sur certains sites, il se peut que le choix d’espèces potentielles pour l’étude de suivi soit limité. Il sera souvent nécessaire d’obtenir l’avis d’un biologiste des pêches qui connaît bien les espèces de poissons présentes dans la zone d’étude. Plus de 60 espèces ont été utilisées comme sentinelles dans les Programmes d’ESEE pour les fabriques de pâtes et papiers et les mines de métaux jusqu’à aujourd’hui. Les mines et leurs experts-conseils sont encouragés à communiquer avec les organismes gouvernementaux des paliers régional, fédéral et provincial pour obtenir de l’information sur les pêches et d’autres conseils.
Certains milieux récepteurs n’abritent pas un nombre de poissons adéquat pour l’échantillonnage. Dans les situations où il a été déterminé qu’une étude létale des poissons nuirait aux ressources halieutiques, des techniques d’échantillonnage non létales peuvent être employées. Dans les milieux qui n’abritent pas un nombre de poissons adéquat pour constituer la taille d’échantillons recommandée ou deux espèces de poissons adéquates pour le suivi, les options suivantes peuvent être considérées, en ordre de préférence :
- des poissons sexuellement matures d’une espèce donnée et des poissons sexuellement immatures d’une autre espèce;
- des poissons sexuellement immatures de deux espèces données;
- des poissons sexuellement matures d’une espèce donnée;
- ou des poissons sexuellement immatures d’une espèce donnée.
La mine devrait considérer modifier son plan d’étude (p. ex., espèces, méthodes de prélèvement) si les résultats de la phase précédente indiquent que les caractéristiques des poissons laissent supposer que l’espèce est de longue durée de vie (> 30 ans); qu’il était impossible de mesurer tous les paramètres d’étude des poissons (p. ex., âge, poids du foie et des gonades); que les individus ont été prélevés en nombre insuffisant; et que la variabilité était telle que le nombre de poissons requis pour les études suivantes selon l’analyse de puissance était excessif et qu’il n’était pas possible de le réduire par l’utilisation de méthodes d’échantillonnage sélectif. Si les espèces de poissons présentes sur un site sont également présentes dans la zone la plus exposée à l’effluent (zone rapprochée), mais seulement à certains moments de l’année ou durant certains stades de leur cycle de vie, le stade de vie et la période d’échantillonnage devraient être choisis de façon à maximiser l’exposition à l’effluent.
La sélection des espèces de poissons peut s’avérer difficile lorsque plusieurs objectifs doivent être poursuivis par un seul plan d’étude. Des préoccupations de contamination des ressources halieutiques destinées à l’alimentation humaine orientent le plan d’étude vers l’échantillonnage d’une espèce de longue durée de vie (l’accumulation de contaminants se fait sur une plus longue période), piscivore (la bioamplification est plus élevée) et de maturité tardive (il y a une plus grande concentration de contaminants), préférablement de mâles ou d'espèces qui ne frayent pas tous les ans (de façon que l’élimination des contaminants par la ponte soit réduite), et d’espèces comestibles importantes localement. Pour améliorer la sensibilité de détection d’incidences environnementales, il est préférable que les espèces soient benthiques (parce qu’en général, elles se déplaceront moins), ne présentent pas un intérêt commercial ou récréatif (parce que cela embrouille la détermination de la cause), arrivent rapidement à maturité, investissent beaucoup d’énergie dans la reproduction (de sorte que leurs besoins énergétiques sont élevés) et ont une courte durée de vie (de sorte que les impacts sont récents). De plus, l’accent devrait être mis sur le prélèvement de femelles (les incidences environnementales sur les femelles ovipares sont souvent plus graves).
Un certain nombre d’autres facteurs doivent être considérés lors de la sélection d’une espèce sentinelle (voir Munkittrick et McMaster, 2000; Munkittrick et al., 2000), y compris la confirmation que l’espèce joue un rôle actif dans le réseau alimentaire local. D’autres caractéristiques du cycle de vie, comme la période de la fraie et de la migration, doivent être évaluées à chaque site, car l’interaction du site de rejet de l’effluent, des frayères et des changements saisonniers dans le débit et la dilution peut influer sur les résultats et avoir un impact potentiel sur la sensibilité du programme de suivi.
Des facteurs clés à considérer dans le choix d’une espèce sont sa mobilité et son temps de séjour (ce qui détermine son exposition à l’effluent). Il est préférable de choisir des poissons qui habitent dans le système aquatique étudié pendant la totalité ou la majeure partie de leur cycle de vie et qui ont un comportement territorial ou une mobilité limitée à la zone d'étude, car les réponses observées chez ces espèces reflètent bien les caractéristiques propres à leur milieu. Les espèces migratrices ou qui ne passent qu'une petite partie de leur cycle de vie dans le système étudié (p. ex., les salmonidés anadromes et quelques poissons marins) ne conviennent pas, car l’exposition à l’effluent est minime ou passagère et difficile à établir. Cela est vrai également pour les espèces très mobiles, susceptibles d’entrer et de sortir de la zone exposée à l’effluent. Dans certains cas, il peut être possible de choisir des espèces plus mobiles (p. ex., les Ménominis de montagnes) (Swanson, 1993) lorsque les caractéristiques locales du système (p. ex., les barrages, les obstacles naturels et les changements dans l’habitat) limitent efficacement leurs déplacements. De façon générale, plus une espèce risque d'être exposée à l’effluent, plus grande est sa valeur comme espèce de suivi.
3.3.1 Étude de la communauté
Si une mine est nouvelle, ou s’il n’existe aucune donnée historique sur une mine déjà en exploitation, une étude de la communauté des poissons devrait être réalisée pour aider la sélection des espèces de poissons sentinelles. Les études de la communauté de poissons permettent d’évaluer si la diversité et l’abondance des espèces présentes diffèrent d’une zone à l’autre.
Un changement s’est produit dans une communauté de poissons lorsque des espèces qui devraient être abondantes, d’après les prélèvements effectués dans les zones de référence, ne sont pas présentes aux environs du point de rejet de l’effluent. Si la zone exposée n’abrite pas une ou plusieurs des espèces abondantes observées dans la zone de référence, il faudrait déterminer l’étendue géographique de cette absence. Si la composition de la communauté de poissons a changé à cause de la présence d’un effluent, il est fort probable qu’il y aura également des changements mesurables dans les populations de poissons restantes. Ces changements devraient être documentés dans les résultats du Programme d’ESEE, car ils pourraient servir à déterminer si d’autres espèces de poissons sont en danger de disparition dans la zone exposée.
Les communautés de poissons comportent souvent un certain nombre d’espèces qui sont peu abondantes pour diverses raisons, souvent sans rapport avec la présence d’un effluent de mine. Dans la mesure du possible, il est préférable d’utiliser des techniques non létales (p. ex., pêche à l’électricité) pour l’étude de la communauté, et l’échantillonnage sur le terrain devrait être conçu de façon à limiter la mortalité des espèces existantes.
3.3.2 Poissons immatures
La méthode recommandée pour réaliser l’étude des poissons est de surveiller les adultes (poissons sexuellement matures) de deux espèces relativement sédentaires qui ont été exposées à l’effluent sur une longue période. Il peut toutefois se présenter des situations où aucun poisson adulte ne peut être prélevé dans un milieu récepteur. Par exemple, certaines zones peuvent ne pas être fréquentées par les adultes, mais elles constituent des aires d’alevinage pour leurs juvéniles. Si des poissons sexuellement matures ne résident pas dans la zone exposée à l’effluent, l’utilisation de juvéniles peut être considérée. Lorsque des poissons sexuellement immatures sont utilisés, le développement de la fonction reproductive ne peut pas être mesuré directement. Il est possible toutefois d’utiliser l’abondance relative des jeunes de l’année en cours comme une mesure du succès de la reproduction.
Les mesures pertinentes pour les poissons juvéniles seraient semblables à celles pour les poissons matures, sauf pour les mesures des gonades : croissance (longueur, poids ou poids selon l’âge, dans la mesure du possible), condition (relation entre la longueur et le poids du corps), poids du foie selon le poids du corps, abondance (survie des jeunes de l’année, composition en pourcentage des classes d’âges) et difformités associées à l’exposition à des effluents, comme la fusion des vertèbres et le tassement vertébral, la courbure rachidienne y compris la lordose et la scoliose, l’érosion des nageoires, et enfin la croissance des juvéniles exposés à l’effluent en comparaison de celle des juvéniles de la zone de référence. Les méthodes de prélèvement des poissons juvéniles sont bien établies, et il est possible de déterminer l’âge de plusieurs d’entre eux (p. ex., Secor et al., 1995).
3.3.3 Poissons de petite taille
La tendance croissante à l’utilisation d’espèces de poissons proies de petite taille (Munkittrick et al., 2002) se fait de plus en plus marquée. En fait, leur utilisation est passée de 10 % dans les études du cycle 1 des pâtes et papiers, à 26 % dans celles du cycle 2 et à 34 % dans les études du cycle 3. Un poisson de petite taille peut être défini comme étant un poisson mesurant au maximum 150 mm. L’utilisation des poissons de petite taille comporte plusieurs avantages et désavantages. Les espèces de poissons de petite taille sont en général plus abondantes, faciles à capturer et sédentaires que les espèces de grande taille. Il a également été démontré que les poissons de petite taille sont plus sensibles aux modifications de l’environnement, comme le pH (Shuter, 1990). En outre, l’étendue de leur domaine vital présente une corrélation positive avec leur taille (Minns, 1995), et de nombreuses espèces de petite taille intègrent très bien les conditions locales.
Par contre, l’utilisation de poissons de petite taille requiert de les mesurer soigneusement et de les peser à l’aide d’une balance analytique plus sensible. Il faut également considérer qu’ils sont plus sensibles aux différences de microhabitat parce qu’ils intègrent facilement les conditions de l’habitat local. Ils sont aussi plus sensibles aux différences liées aux moments de l’échantillonnage (voir la section 3.5).
En outre, la durée de vie des poissons de petite taille est souvent courte. Si des espèces de poissons de petite taille sont choisies pour l’une ou les deux espèces de poissons, il faudrait prélever 20 individus immatures (des classes d’âge 0+ et 1+) additionnels pour faciliter l’analyse de la taille selon l’âge (croissance). De plus, puisque la durée de vie d’une espèce de petite taille pourrait ne pas dépasser trois ou quatre ans, les classes d’âges 0+ et 1+ représenteront une portion significative de la population (p. ex., chez le Chabot visqueux [Cottus cognatus], les classes d’âges 0+ et 1+ représentent jusqu’à 50 % à 70 % de la population). Cette mesure de la proportion d’un échantillon composée de jeunes poissons de l’année est une mesure de remplacement du succès de la reproduction (Gray et al., 2002).
Il y a aussi d’autres considérations en jeu. Le cycle de vie, la biologie et les caractéristiques de reproduction de certaines espèces de poissons de petite taille étant inconnus, il est difficile d’établir quels sont les meilleurs sites, le meilleur moment et les meilleures méthodes d’échantillonnage. Certaines de ces espèces comptent des reproducteurs à pontes multiples, ce qui signifie qu’il est difficile d’estimer l’effort de reproduction à partir d’un seul échantillon, car les tissus reproducteurs peuvent se renouveler presque entièrement entre chaque ponte (c.-à-d. que la majeure partie de la masse d’ovules dans l’ovaire est évacuée lors de la ponte et ce n’est que par la suite qu’une nouvelle masse d’ovules matures se développe). En général, l’ovaire contient des œufs appartenant à deux classes de tailles ou plus, et la période de fraie peut s’étendre sur plusieurs semaines à plus d’un mois. Ainsi, le nombre de pontes pendant la saison de fraie devient le principal indicateur de l’activité reproductrice, et l’estimation de ce paramètre est difficile sur le terrain, même en cas d’échantillonnage fréquent. Il est également difficile d’évaluer la signification des changements dans la production d’œufs chez les géniteurs à fraies multiples s’ils montrent une reproduction normale lors des premières pontes.
L’identification des espèces de poissons de plus petite taille devrait être vérifiée, en particulier dans le cas des Cyprinidés, qui peuvent paraître très semblables en l’absence d’un examen plus approfondi. Parmi les ouvrages utiles à cette fin, citons : Scott, 1967; Scott et Crossman, 1974; Roberts, 1988; Nelson et Paetz, 1992; Jenkins et Burkhead, 1993; Coad et al., 1995. La pesée des petits organes de ces poissons nécessite une balance très sensible. Il peut être nécessaire d’utiliser un microscope à dissection pour enlever les organes sans les endommager et pour éviter de fausser les résultats en raison de la présence de tissus étrangers ou d’eau. Il est recommandé d’effectuer la dissection sur des poissons frais, prélevés récemment, car il est alors plus facile d’identifier les tissus et de séparer le foie et les gonades du tissu des intestins. La dissection de spécimens congelés de petite taille peut s’avérer difficile et provoquer des erreurs dans la mesure des organes. La préservation dans une solution aqueuse de formaldéhyde peut donner des résultats adéquats, mais il faut prendre soin de traiter les poissons provenant de la zone exposée et ceux provenant de la zone de référence de la même manière (p. ex., la durée d’entreposage), afin de minimiser la distorsion résultant de la préservation.
La mesure de la fécondité et du poids des œufs exige une attention particulière. Chez nombre d’espèces de petite taille, les œufs sont peu nombreux, mais de grande taille. Il est beaucoup plus facile d’évaluer la fécondité et le poids des œufs à un moment se rapprochant de celui de la fraie. Le moment de l’échantillonnage dépendra également de la résidence, et il faudra donc optimiser ces deux facteurs. Enfin, il importe de conserver la gonade dans son intégrité et d’effectuer le décompte des œufs à l’aide d’un microscope à dissection.
3.3.4 Espèces vivipares
Les espèces de poissons vivipares ne sont pas communes dans les milieux récepteurs d’eau douce au Canada, mais si elles sont utilisées, il faut leur accorder une attention particulière lors de la mesure des paramètres de la reproduction. Des espèces vivipares ont été utilisées avec succès pour évaluer les impacts des effluents de fabriques de pâtes et papiers en Suède (Larsson et al., 2000, 2002; Larsson et Forlin, 2002). Pour estimer la fécondité, il faut prélever les gonades et faire le dénombrement des embryons vivants et des embryons morts. En outre, pour que l’échantillonnage soit optimal, il faut disposer de données préliminaires sur le moment de la fraie et le développement des gonades.
3.4 Indicateurs d’effets
Les indicateurs d’effets utilisés dans les divers types de plans d’étude des poissons sont présentés au tableau 3-3. Pour une analyse plus détaillée de ces questions, consulter l’étude de Munkittrick et al. (2009), dans laquelle les auteurs réitèrent l’objectif initial du Programme d’ESEE et établissent pourquoi les indicateurs d’effets actuels d’ESEE sont utilisés plutôt que d’autres paramètres de suivi. Munkittrick et al. (2009) se penchent également sur l’influence des variations naturelles (c.-à-d., la tendance des valeurs des paramètres à changer d’une année à l’autre ou potentiellement d’un site à l’autre), l’adaptation génétique et quatre importants problèmes de conception statistique (sélection des sites, pseudorépétition, analyse de puissance et préoccupations soulevées par le nombre de comparaisons effectuées).
Le Programme d’ESEE met l’accent sur les paramètres mesurables chez des groupes d’individus pour plusieurs raisons, entre autres :
- l’approche offre un compromis entre, d’une part, la sensibilité et la réversibilité d’approches biochimiques et, d’autre part, la pertinence des paramètres établis au niveau de la communauté;
- le suivi de la communauté ne révèlera pas la présence d’effets réversibles et importants au niveau des populations;
- puisque des changements dans la croissance, la reproduction, la condition ou la survie des poissons mettent ceux-ci en péril, l’évaluation de ces paramètres mesurables au niveau des populations permet de respecter l’objectif global de la Loi sur les pêches, qui est la protection des ressources halieutiques;
- il est important de connaître ce niveau de risque pour la gestion des écosystèmes.
3.4.1 Échantillonnage létal
Pour savoir si l’effluent a entraîné des changements chez les poissons, il faut examiner les effets sur leur croissance, leur reproduction, leur condition et leur survie. Il est recommandé, pour l’étude des poissons, que des indicateurs clés soient mesurés chez les adultes (mâles et femelles) de deux espèces de poissons. Le niveau de précision des mesures est indiqué au tableau 3-1. L’intention est d’obtenir des estimations de la distribution des âges ou des longueurs, de la mesure dans laquelle les poissons utilisent l’énergie disponible à des fins de croissance et de reproduction, ainsi que de la quantité d’énergie mise en réserve. Le nombre d’échantillons requis peut être calculé à l’aide d’une équation statistique comprenant l’écart-type (ET) de la taille des gonades pour l’espèce et le site (provenant d’échantillons antérieurs) et un seuil critique de l’effet (SCE) de 25 % (voir la section 3.7.1). Lorsque les données sont insuffisantes pour calculer la taille de l’échantillon par une analyse de puissance, la taille minimale de l’échantillon recommandée pour une étude des poissons par échantillonnage létal est de 20 mâles et 20 femelles, sexuellement matures, de deux espèces de poissons, pour chacun des sites d’échantillonnage. Une taille d’échantillon de 20 individus de chaque sexe est utilisée pour l’échantillonnage létal, parce que l’utilisation d’un nombre plus élevé entraîne peu de changements dans les limites de confiance à 95 %. Par exemple, Munkittrick (1992) a établi que, dans le cas du Meunier noir (Catostomus commersonii), une taille d’échantillon supérieure à 16 individus améliorait peu la précision des estimations de la variance.
Lorsqu’il existe des renseignements antérieurs, ils devraient servir à calculer la taille adéquate de l’échantillon avant de faire l’étude des poissons. Il est important également d’examiner la taille de l’échantillon et la variabilité au début de l’étape de conception de l’étude, de sorte à pouvoir modifier le plan d’étude si les estimations de la variabilité sont si élevées que l’étude n’atteindra pas un niveau de puissance adéquat. Le plus grand avantage dans l’étude des poissons provient de la réduction de la variabilité. Lorsque la variabilité est élevée au point que les tailles des échantillons ne sont pas justifiables du point de vue écologique et économique, la première considération devrait être de reprendre la conception de l’étude pour a) réduire la variabilité, b) choisir des espèces de remplacement qui seraient moins variables ou c) considérer une méthode de rechange.
Il est fortement recommandé d’examiner les poissons échantillonnés et d’en déterminer le sexe immédiatement sur le terrain afin d’assurer que le rapport des sexes des poissons prélevés soit égal. La détermination ultérieure en laboratoire du sexe d’échantillons congelés peut révéler un rapport asymétrique des sexes, alors que le rapport des sexes des poissons prélevés sur le terrain devrait être égal.
Il est important d’identifier les poissons immatures (qui ne sont pas en état de frayer) de sorte qu’ils puissent être exclus de l’analyse statistique. Chez les poissons, le développement des gonades n’est pas uniforme dans trois cas, notamment : a) les espèces à pontes multiples chez lesquelles la fraie n’est pas synchronisée, b) les espèces à pontes multiples chez lesquelles l’âge ou la taille des individus déterminent le nombre de pontes par année et c) les populations nordiques de poissons qui peuvent ne pas accumuler des réserves d’énergie suffisantes pour frayer tous les ans. Dans tous ces cas, les poissons doivent être analysés en groupes, et des comparaisons doivent être faites entre les poissons qui vont frayer, et d’autres comparaisons, entre ceux qui ne vont pas frayer. Il est également possible d’analyser la proportion de poissons dans chaque catégorie. Dans les situations où il existe deux groupes ou plus avant l’échantillonnage, il peut être possible, lors de l’échantillonnage, de diviser les poissons en catégories selon leur condition ou leur taille.
Le Programme d’ESEE étant itératif, il n’est pas nécessaire d’effectuer une évaluation complète des populations de poissons à partir d’un seul échantillon. Les mesures sont destinées à servir de substituts pour permettre d’effectuer une évaluation sur plusieurs phases. Tout effet dans l'étude des poissons doit être confirmé au cours d’une phase ultérieure et évalué par rapport aux SCE avant que l’étude ne progresse (le SCE est abordé dans le chapitre 1). Bien que les mesures indiquées ci-dessous soient les mesures requises, il peut s’avérer nécessaire d’en fournir d’autres, en raison de problèmes propres au site ou à une espèce.
| Détermination exigée (annexe 5, alinéas 16a) et b) du REMM) | Précision attendue*** | Statistiques sommaires à fournir (annexe 5, article 16 du REMM) et autres informations générales |
|---|---|---|
| Longueur (à la fourche, totale ou standard)* | +/- 1 mm | Moyenne, médiane, ET, erreur-type, valeurs minimales et maximales dans les zones d’échantillonnage |
| Poids corporel total (frais) | ± 1,0 % | Moyenne, médiane, ET, erreur-type, valeurs minimales et maximales dans les zones d’échantillonnage |
| Âge | ± 1 an (10 % exigent une confirmation indépendante) | Moyenne, médiane, ET, erreur-type, valeurs minimales et maximales dans les zones d’échantillonnage |
| Poids des gonades (si les poissons ont atteint la maturité sexuelle) | ± 0,1 g pour les espèces de poissons de grande taille et 0,001 g pour les espèces de poissons de petite taille | Moyenne, médiane, ET, erreur-type, valeurs minimales et maximales dans les zones d’échantillonnage |
| Poids des œufs (si les poissons ont atteint la maturité sexuelle) | ± 0,001 g | (taille minimale recommandée des sous-échantillons : 100 œufs), moyenne, médiane, erreur-type, valeurs minimales et maximales dans les zones d’échantillonnage |
| Fécondité ** (si les poissons ont atteint la maturité sexuelle) | ± 1,0 % | Nombre total d’œufs par femelle, moyenne, médiane, erreur-type, valeurs minimales et maximales dans les zones d’échantillonnage |
| Poids du foie ou de l’hépatopancréas | ± 0,1 g pour les espèces de poissons de grande taille et 0,001 g pour les espèces de poissons de petite taille | moyenne, médiane, écart-type, erreur-type, valeurs minimales et maximales dans les zones d’échantillonnage |
| Anomalies | s.o. | Présence de tout parasite, lésion, tumeur ou de toute autre anomalie |
| Sexe | s.o. |
* Si la nageoire caudale est fourchue, mesurer la longueur à la fourche (de l’extrémité de la partie antérieure jusqu’à la fourche de la nageoire caudale). Autrement, mesurer la longueur totale et indiquer le mode de mesure de la longueur utilisé pour chaque espèce. Si une usure prononcée de la nageoire est observée, il faut mesurer la longueur standard.
** La fécondité peut être déterminée en divisant le poids total des ovaires par le poids individuel des œufs, qui peut être estimé en comptant le nombre d’œufs dans un sous-échantillon d’au moins 100 œufs.
*** Pour les poissons de petite taille, l’utilisation d’une balance à au moins trois décimales est recommandée.
3.4.1.1 Survie
L’âge moyen vise à donner une évaluation des âges dans la population exposée et la population de référence. Si des engins sélectifs de taille, comme des filets maillants, sont utilisés et qu’il existe une différence significative entre les âges moyens des poissons échantillonnés aux deux sites avec des engins identiques, cette différence indique qu’il est nécessaire d’effectuer, lors de phases ultérieures, d’autres études sur la population de poissons et sur la raison de cette différence d’âges. Il est possible d’obtenir plus d’informations à l’aide de graphiques de distribution des âges ou des tailles, en autant que la taille de l’échantillon soit adéquate. En outre, comme de nombreuses espèces de poissons ont une courte durée de vie (moins de quatre ans), il peut s’avérer nécessaire de prélever des poissons immatures et des juvéniles pour être en mesure d’effectuer une évaluation appropriée de cet indicateur d’effet. Il est également très difficile d’obtenir une différence de 25 % dans les âges lorsque les espèces ont une courte durée de vie; il peut être possible de substituer une différence de 25 % dans la taille moyenne (longueur) comme substitut de l’âge dans ces cas.
Une liste des structures pour la détermination de l’âge convenant à diverses espèces sentinelles est présentée au tableau 3-2. En outre, il existe de nombreux ouvrages sur les méthodes de détermination de l’âge (p. ex., Mackay et al., 1990) qu’il est possible de consulter. Les méthodes employées pour la détermination de l’âge doivent être les mêmes pour chaque zone d'échantillonnage ainsi que d’une phase à l’autre. Il faut également se conformer aux modalités d’assurance et de contrôle de la qualité (AQ/CQ) appropriées (p. ex., confirmation par une autre personne). Il est recommandé de conserver toutes les structures ayant servi à déterminer l’âge pour référence ultérieure. S’il est impossible de déterminer l’âge de façon certaine ou à un coût raisonnable, la distribution de fréquences des tailles peut permettre de l’estimer. Cette méthode peut s’avérer particulièrement utile dans les cas de l’échantillonnage d’espèces de petite taille ou d’un échantillonnage non létal. Il serait en outre possible de confirmer les distributions de fréquences des tailles en déterminant l’âge de sous-échantillons représentatifs de chaque classe de taille. Pour de plus amples renseignements sur la distribution de fréquences des tailles, veuillez consulter Nielsen et Johnson (1983).
3.4.1.2 Utilisation d’énergie (croissance et reproduction)
Les mesures de la croissance et de la reproduction permettent d’évaluer la capacité des poissons d’utiliser la nourriture à leur disposition. La croissance s’entend du changement de taille (poids ou longueur) en fonction du temps ou de l’âge. Dans le cas de la croissance, il peut être utile de recueillir de l’information sur d’autres classes d’âges, afin de savoir s’il se produit des changements dans la croissance des premiers stades du cycle de vie. Cette information sera utile lors de la détermination de l’ampleur de l’effet. Lors des phases suivantes, l’accent devrait être mis sur la confirmation des changements décelés et l’examen de la pertinence des changements pour d’autres classes de tailles et espèces.
La reproduction est évaluée en termes d’effort reproductif, au moyen de mesures de la fécondité, du poids des œufs ou du poids des gonades par rapport à la taille. La reproduction peut être la mesure la plus sensible chez les poissons résidants. Des changements dans l’allocation d’énergie à la reproduction peuvent apparaître en moins d’un an, car les tissus reproducteurs se renouvellent généralement chaque année. La fécondité et le poids des gonades doivent être mesurés à un moment approprié, soit lorsque les tissus reproducteurs sont bien développés. Des changements confirmés dans le poids des gonades pourraient nécessiter la réalisation de travaux additionnels pour en déterminer l’ampleur, notamment si l’on soupçonne que ces changements peuvent varier dans le temps (pour les reproducteurs à pontes multiples) ou se retrouver chez d’autres espèces présentes dans le même milieu.
| Structures | Famille ou sous-famille (noms communs ou d’espèces) | Commentaires |
|---|---|---|
| Épine dorsale | Squalidés (chiens de mer) | |
| Épine dorsale écailles | Percidés (Perchaude) | Épines plus précises pour les poissons plus âgés |
| Otolithes | Anguillidés (Anguille d’Amérique), Athérinidés (Capucette), Batrachoïdidés (poissons-crapauds), Carangidés (carangues), Clupéidés (harengs), Haemulidés (grogneurs), Gastérostéidés (épinoches), Percopsidés (Omisco), Cottidés (chabots) | |
| Gadidés (morues, Lotte) | Structure préférée; difficile de déterminer l’âge à partir des rayons des nageoires pectorales | |
| Otolithes, rayons de nageoires | Scombridés (maquereaux) | |
| Otolithes, quatre premiers rayons marginaux des nageoires pectorales, écailles | Coregoninés (corégones) | |
| Otolithes, rayons des nageoires pectorales | Acipenséridés (esturgeons) | |
| Otolithes, rayons des nageoires pectorales, épines dorsales, écailles | Percidés (Doré jaune, Doré noir) | Écailles préférées pour les poissons à croissance rapide ou mesurant < 40 cm; épines ou otolithes pour les poissons mesurant > 40 cm (ou > 8 ans), en particulier les poissons à croissance lente |
| Otolithes, rayons des nageoires pectorales, écailles | Catostomidés (meuniers), Coregoninés (ciscos), Cyprinidés (ménés), Salmonidés (truites, ombles), Sciaenidés (tambours) | Rayons de nageoire pour les meuniers très âgés, seuls les otolithes sont utiles pour le Méné jaune, et otolithes pour tous les tambours |
| Otolithes, écailles | Bothidés (turbots), Pleuronectidés (plies) | |
| Rayons de nageoires pectorales, écailles | Esocidés (Grand Brochet, Maskinongé) | Écailles appropriées, mais les rayons de nageoire donnent un meilleur niveau de confiance; le cléithrum est parfois approprié |
| Épine pectorale | Ictaluridés (barbottes) | |
| Écailles | Centrarchidés (crapets, achigans), Cichlidés, Cyprinodontidés (fondules), Hiodontidés (Laquaiche aux yeux d’or et Laquaiche argentée), Mugilidés (muges), Percichthyidés (bars), Serranidés (mérous), Sparidés (spares) | Rayons de nageoire pour les individus très âgés |
| Vertèbres, rayons de nageoire | Lophiidés (baudroies) | |
| Centre de vertèbre | Rajidés (raies) |
3.4.1.3 Accumulation d’énergie (condition)
Les mesures des réserves d’énergie fournissent des renseignements importants sur la disponibilité et la qualité de la nourriture dont disposent les poissons. Le Programme d’ESEE utilise la condition (relation entre la longueur et le poids) et la taille du foie comme indicateurs des réserves d’énergie. Comme dans le cas d’autres indicateurs, la cohérence des résultats obtenus pour les différents indicateurs est importante. Le poids du foie peut augmenter pour diverses raisons, telles que le stockage de lipides et de glycogène, mais aussi en raison d’un accroissement de l’activité de détoxication.
3.4.1.4 Anomalies
Durant l’étude des poissons, il faut aussi réaliser un examen visuel des poissons afin de déceler la présence d’anomalies externes et internes, telles que des déformations au niveau du corps, des nageoires, des yeux, la présence de lésions, de tumeurs, de néoplasmes, de cicatrices ou d’autres anomalies, telles que des nageoires érodées, effilochées ou hémorragiques, de lésions internes, d’excroissances anormales, de parasites et d’autres observations inhabituelles. Il est également recommandé de prévoir un champ sur la feuille d’enregistrement des données pour consigner d’autres observations importantes. La photographie peut être un outil précieux pour documenter les anomalies évidentes observées sur les poissons capturés.
Il est recommandé d’intégrer sur la feuille d’enregistrement des données un croquis grossier des espèces échantillonnées en vue d’y localiser, le cas échéant, les anomalies externes détectées. Ces informations pourront être utilisées ultérieurement si des différences significatives existent entre la zone de référence et la zone exposée.
Un complément d’information sur l’anatomie des poissons se trouve dans des manuels de biologie générale des poissons. Des instructions pour la description de tumeurs peuvent être trouvées (en anglais seulement) sur http://www.glfc.org/tumor/tumor1.htm (J.J. Black, Gross Signs of Tumors in Great Lakes Fish: A Manual for Field Biologists) ou encore dans C. Uhland et al., Les maladies des poissons d’eau douce du Québec – Guide de diagnostic.
| Indicateurs d’effets | Critères d’effets et d’appui pour les études létales | Critères d’effets et d’appui pour les études non létales | Critères d’effets et d’appui pour les études des mollusques sentinelles |
|---|---|---|---|
| Survie | *Âge *Distribution de fréquences des classes d’âges Distribution de fréquences des longueurs | *Distribution de fréquences des longueurs Distribution de fréquences des classes d’âges (si possible) | *Analyse de la fréquence des longueurs |
| Croissance | *Taille selon l’âge (poids corporel selon l’âge) Longueur selon l’âge | *Longueur des jeunes de l’année (âge 0+) à la fin de la période de croissance *Poids des jeunes de l’année (âge 0+) à la fin de la période de croissance Taille des poissons 1+ Taille selon l’âge (si possible) | Poids humide des animaux entiers Longueur et largeur de la coquille Poids humide des tissus mous |
| Reproduction | *Poids des gonades selon le poids corporel Poids des gonades selon la longueur Fécondité (nbre d’œufs par femelle selon le poids corporel, la longueur et/ou l’âge) | *Abondance relative des jeunes de l’année (% de jeunes de l’année) Survie des jeunes de l’année | *Poids des gonades selon le poids corporel (indice gonado-somatique [IGS]) (bivalves seulement) |
| Condition | *Poids corporel selon la longueur *Poids du foie selon le poids corporel Poids du foie selon la longueur Poids des œufs selon le poids corporel et/ou l’âge (femelles matures seulement) | *Poids corporel selon la longueur | *Poids (poids secs des animaux entiers, poids sec de la coquille ou des tissus mous) en fonction de la longueur de la coquille Poids des tissus mous en fonction du poids de la coquille Poids des tissus mous en fonction du volume de la coquille |
* Critères d’effets des études des poissons utilisés pour établir la présence ou non d’effet, un effet étant défini comme une différence statistiquement significative entre les données des zones exposées et celles des zones de référence. Des critères d’appui peuvent aussi être utilisés pour appuyer les analyses.
3.4.2 Échantillonnage non létal
Ce type d’échantillonnage ne doit être utilisé que dans des situations où cela est justifié, c'est-à-dire lorsqu’il existe une préoccupation réelle au sujet des répercussions potentielles de l'échantillonnage sur les populations de poissons composées de peu d’individus. L’échantillonnage létal des adultes est privilégié dans la mesure du possible, bien que les renseignements qui sont obtenus à partir d’échantillons non létaux lorsqu’un grand nombre de poissons sont prélevés au cours de l’échantillonnage puissent être également précieux. Les indicateurs utilisés pour l’échantillonnage non létal sont présentés au tableau 3-3, et les renseignements supplémentaires sur l’analyse statistique pour l'échantillonnage non létal se trouvent au chapitre 8.
Si la seule option pour une installation est de réaliser un échantillonnage non létal de poissons pour évaluer les effets sur la population de poissons d’un effluent, il est recommandé de prélever un minimum de 100 poissons plus âgés que les jeunes de l'année à chaque site d'étude. Il faut également conserver et échantillonner (mesurer) les jeunes de l'année obtenus pendant la collecte des 100 poissons plus âgés. Les jeunes de l’année peuvent généralement être séparés des autres groupes en fonction de leur taille; toutefois, cela ne sera peut-être pas possible pour les espèces ayant des périodes de fraie prolongées. La proportion des poissons qui sont des jeunes de l'année doit être estimée à partir des 100 premiers poissons recueillis. Si l’abondance des jeunes de l’année est extrêmement élevée (plus de 80 à 90 %), l’échantillonnage doit se poursuivre jusqu’à ce que 100 poissons autres que des jeunes de l’année aient été capturés afin de calculer la distribution de fréquences des tailles des poissons plus âgés. La collecte des poissons supplémentaires autres que des jeunes de l'année permet de mieux caractériser les groupes de poissons plus âgés. Les poissons plus âgés que les jeunes de l’année recueillis doivent représenter la gamme complète des tailles de poissons et ils doivent être représentatifs de la population (matures et immatures). Les tailles d'échantillon recommandées pour chaque site donneront une bonne idée de la répartition de la population entre les différentes classes de longueurs-poids. De même, lorsqu’on examine les différences entre l’abondance relative des jeunes poissons par rapport aux poissons matures, on obtient une assez bonne résolution (Gray et al., 2002).
Dans la mesure du possible, l’échantillonnage doit être effectué lorsque les jeunes de l'année ont une taille exploitable avec les engins de pêche utilisés. De plus, il faut utiliser les mêmes engins d’échantillonnage dans les zones d’exposition et de référence; s’il n’est pas possible d’utiliser les mêmes engins dans ces différentes zones ou s’il faut utiliser plusieurs engins, alors les distributions de fréquences des tailles dans un site doivent être comparées d’un engin à l’autre. S’il y a des différences de tailles entre les poissons recueillis avec des engins différents, les comparaisons entre les sites doivent se limiter au type d’engin. Les techniques d'échantillonnage et les efforts connexes doivent être identiques dans toutes les zones d’échantillonnage. Il faut éviter la mise en commun des données provenant de diverses techniques d’échantillonnage, et toutes les méthodes utilisées doivent être déclarées. Si plus d’un type d’engin est utilisé, il faut consigner les poissons attrapés par chaque méthode, et toute mise en commun de données doit être clairement décrite. Il faut mesurer la longueur (± 1 mm) et le poids (± 0,01 g) (Gray et Munkittrick, 2005) des poissons, les examiner afin de déceler la présence d’anomalies externes et déterminer leur sexe au moyen d’une méthode de détermination externe, si possible. Tous les poissons doivent ensuite être rejetés à l’eau. Dans la mesure du possible, un petit nombre de poissons plus grands devraient être sacrifiés afin de vérifier l’âge des individus plus âgés. Si on n’utilise que des adultes, il faudrait effectuer l'échantillonnage en priorité avant la saison de la fraie ou au début de celle-ci (se reporter aux conseils relatifs aux périodes d’échantillonnage privilégiées au tableau 3-5). Cependant, s’il faut recueillir des jeunes de l’année, il vaudrait mieux attendre à la fin de l’automne, puisqu’il sera plus facile de mesurer ces jeunes pour la plupart des espèces. L’échantillonnage des jeunes de l’année en automne sera beaucoup plus difficile si les poissons ne sont pas des reproducteurs synchrones uniques du printemps, étant donné que les distributions de fréquences des tailles des jeunes de l’année seront plus étendues.
Un grand nombre de zones peuvent généralement faire l’objet d'un échantillonnage pour la réalisation d’une étude non létale, et la mine est encouragée à échantillonner plusieurs sites d’exposition et de référence. Les programmes qui échantillonnent des adultes et des jeunes de l'année permettront une évaluation maximale des indicateurs d’effets.
Le choix des espèces pour l’échantillonnage non létal peut être difficile, et il sera souvent fondé sur la disponibilité. Lorsqu’il y a du choix, un reproducteur synchrone du printemps offrira le plus d’avantages en matière de différenciation des jeunes de l'année des autres classes d’âges. La différenciation des classes d’âges peut aussi être influencée par la longévité de l’espèce. Une espèce annuelle telle que la Capucette ne présente qu’une classe d’âge, ce qui élimine le besoin de différencier les classes d’âge. Une espèce ayant une courte durée de vie (deux à trois ans), une croissance rapide et des groupes d’âges qui se distinguent aisément présente aussi des avantages. Cependant, ces espèces ne sont pas toujours disponibles.
Lorsqu’il est possible de choisir parmi plusieurs espèces, il est recommandé de recueillir des échantillons initiaux et de comparer les espèces selon la capacité à distinguer les jeunes de l’année et les groupes d’âges.
3.4.2.1 Survie (distributions de fréquences des tailles)
L’utilisation de renseignements relatifs à l’âge de nombreuses espèces de poissons ayant une courte durée de vie comporte des défis. Si un poisson vit pendant deux ou trois ans, il ne sera pas possible de mesurer une différence de 25 % de l'âge moyen. Si les structures prélevées de façon non létale pour la détermination de l’âge n’ont pas été validées pour l’espèce sentinelle en cours d’utilisation, alors la distribution de fréquences des tailles doit être examinée comme remplacement pour les différences d'âges.
La distribution de fréquences des tailles doit être comparée entre les zones d’exposition et de référence au moyen du test de Kolmogorov-Smirnov, bien que ce test soit peu sensible. Les comparaisons des tailles doivent examiner les distributions de fréquence pour les jeunes de l’année de façon séparée, pour les deux mesures de taille combinées. Si des différences sont décelées, les phases ultérieures devront être axées sur la compréhension de cette différence et des causes éventuelles. Lorsque cela est possible, la vérification des âges des poissons plus grands et des jeunes de l'année peut s'avérer utile.
3.4.2.2 Utilisation d'énergie
Il devrait être possible, à la plupart des sites, d'obtenir des estimations de la croissance et de la reproduction à l’aide de méthodes non létales. D’une part, la croissance peut être évaluée d'après la taille des jeunes de l'année au terme de la saison de croissance et d'après la taille des poissons d’âge 1+. De plus, une comparaison de la taille des jeunes poissons de l'année entre les sites constitue un bon indicateur de croissance, car il s'agit d’un indicateur direct, par rapport à la comparaison de la taille selon l’âge, qui est indirect. Les jeunes de l’année sont utilisés, parce que leur croissance est en totalité attribuable aux conditions environnementales depuis la période de fraie, et que la croissance n’est pas compliquée par l’énergie consacrée au développement de la fonction de reproduction. Les différences de périodes de fraie entre les sites seront intégrées à cette analyse. Il est aussi possible d'obtenir une estimation de la croissance en suivant, en fonction du temps, les changements dans les distributions de fréquences des tailles (p. ex., reprendre des mesures à tous les deux mois aux mêmes sites) ou de la taille moyenne (cela nécessiterait un deuxième échantillonnage pour les déterminer). Si l'espèce de poisson choisie est sexuellement dimorphe en apparence, il est possible d'examiner s’il existe des différences propres au sexe dans le taux de croissance.
La reproduction peut être évaluée en examinant l’abondance relative des classes d’âges les unes par rapport aux autres ou celle des jeunes de l’année par rapport au reste de la population (Gray et al., 2002) ou d’après la survie des jeunes de l'année, ce qui nécessite deux périodes d’échantillonnage. Une distribution de fréquences de longueurs peut être utilisée à défaut d’avoir une distribution de fréquences d’âges. En outre, une analyse des fréquences de tailles peut servir à examiner les distributions des tailles et les distributions des coefficients de condition (calculés à l’aide des données sur la longueur et le poids), et à inférer les distributions des âges et les données sur les tailles en fonction de l’âge (si l’âge peut être obtenu) (Gray et al., 2002). Dans la mesure du possible, il est recommandé de recueillir les structures pour la détermination de l’âge sur des sous-échantillons de chaque classe d’âges, au cas où l’âge devrait être vérifié (comme à la section 3.4.1.1, l’utilité des renseignements portant sur l’âge est moindre dans les situations où l’espèce a une courte durée de vie). Chez le Chabot visqueux, la croissance rapide des jeunes poissons de l’année au printemps peut entraîner un chevauchement de cette classe d’âge avec la suivante (1+), ce qui rend leur différenciation difficile (Gray et al., 2002). La capacité de distinguer les jeunes de l’année dépendra de la durée de la saison de fraie et de la durée s’écoulant entre la période de fraie et la période d'échantillonnage. La solution la plus facile réside peut-être (pour les espèces se reproduisant au printemps et au début de l'été) dans l’examen des distributions de fréquences des longueurs en utilisant des données de la fin de l’été et du début de l’automne, lorsque les jeunes de l'année sont les plus faciles à distinguer. Afin d'évaluer les différences d’abondance relative des jeunes de l’année entre la zone d’exposition et la zone de référence, un test de Kolmogorov-Smirnov peut être effectué sur la distribution de fréquences des longueurs avec et sans l’inclusion des jeunes de l'année. Si l’inclusion des jeunes de l'année modifie l'interprétation de la différence (c’est-à-dire qu’elle est significative lorsqu’ils sont inclus et qu’elle ne l’est pas sans eux), alors il y a aussi une différence dans l’abondance relative des jeunes de l'année. Sinon, un plus grand nombre de sites peuvent être soumis à un échantillonnage pour permettre l’utilisation de plus de méthodes statistiques, ou les proportions de jeunes de l’année peuvent être comparées à l'aide d'un test du khi carré.
Il ne sera peut-être pas possible de distinguer les jeunes de l’année dans le cas des espèces qui se reproduisent plusieurs fois, dans les régions du nord où ces jeunes peuvent apparaître plus tard dans l'année, ou dans des situations où il existe des différences de préférence d'habitat qui dépendent de l’âge chez une espèce. Dans ces cas, il ne sera pas possible de déduire facilement les impacts potentiels sur la reproduction. Un certain jugement professionnel sera requis. Si l’espèce vit plusieurs années et que les poissons immatures peuvent être distingués de façon non létale (l’état du poisson lorsque la période de fraie approche peut être utilisé dans de nombreuses situations pour cela), la proportion de poissons immatures peut être utilisée en remplacement. Dans les situations où cela est impossible, il faudra alors réaliser une interprétation à partir des distributions des tailles uniquement, et dans ce cas, faire preuve de vigilance tout en ayant conscience des répercussions potentielles de la mortalité des adultes sur l'interprétation.
Enfin, il est important de se souvenir qu’une différence de température de l’eau entre les sites aura une incidence sur la période de fraie. Ainsi, les différences relevées à la fin de l’été en matière de distribution des tailles pourraient tout aussi bien découler de différences dans les périodes de fraie dues à la température que d’autres causes potentielles. Si une différence de température de l’eau entre des sites est soupçonnée être une cause importante des différences observées, alors des études ultérieures devront déterminer si cette différence de température entre les sites est due à la mine ou au choix inadéquat des sites de référence.
S’il est possible de faire plusieurs campagnes d’échantillonnage, il peut également être possible de mesurer les changements dans la condition avant et après la fraie comme indicateur de l’investissement en matière de reproduction. Chez certaines espèces de petite taille, les femelles sont très faciles à distinguer en période de fraie à partir du coefficient de condition. Pour obtenir l’investissement en matière de reproduction, les différences de coefficient de condition des femelles entre les sites avant la période de fraie ou une indication du changement avant et après cette période chez les femelles pourraient être utilisées si les femelles peuvent être distinguées après la période de fraie.
3.4.2.3 Condition
Le coefficient de condition k peut être évalué par la relation (k = 100 000 × pds/l3) des poissons examinés, où pds représente le poids en grammes, et l représente la longueur en millimètres. L’analyse pertinente pour l’interprétation finale est une analyse de la covariance du poids par rapport à la longueur, par site.
3.4.3 Mollusques sauvages
En l’absence de poissons appropriés au suivi, le prélèvement de mollusques sauvages, comme des huîtres ou des moules, peut s’avérer une option. En effet, les mollusques sont inclus dans la définition du terme « poissons » dans la Loi sur les pêches, et ils ont été utilisés par quelques fabriques de pâtes et papiers dans leur Programme d’ESEE. Leur utilisation comporte toutefois certains inconvénients, notamment les difficultés associées à la détermination de l’âge des individus et à l’estimation de l’allocation d’énergie à la reproduction chez certaines espèces. Les crabes et les homards ne sont pas des espèces adéquates, parce que leur âge ne peut pas actuellement être déterminé avec précision (Environnement Canada, 1997). Il existe des directives sur l’utilisation de l’indice gonadosomatique relatif (indice somatique mantélique [ISM]) pour les bivalves (voir les directives relatives au mésocosme dans le chapitre 9).
Les mollusques constituent un groupe taxinomique diversifié qui inclut les bivalves et les gastéropodes, et ils sont largement répandus dans tout le Canada. Les mollusques possèdent de nombreuses qualités recherchées chez une espèce utilisée à des fins de suivi :
- ils sont relativement sédentaires, bien que certaines espèces (les unionidés) puissent migrer sur de courtes distances (mètres) dans leur habitat;
- ils sont largement distribués dans tout le Canada, et sont identifiés sans le besoin de connaissances taxinomiques poussées;
- la plupart des spécimens de bivalves unionidés sont assez gros pour fournir une quantité de tissus suffisante pour le dosage;
- plusieurs espèces de bivalves ont démontré qu’elles accumulaient facilement de nombreux produits chimiques de sources diverses (eau, sédiments, nourriture) et présentaient des effets sublétaux associés à l’exposition;
- la croissance des bivalves est relativement facile à mesurer, et il a été démontré que ce facteur était aussi sensible, sinon plus, que les tests normalisés de mortalité avec des espèces comme les daphnies, les Ménés à grosse tête et les Truites arc-en-ciel (voir Salazar et Salazar, 2001).
En général, les périodes de reproduction et les fluctuations de l’abondance des mollusques sont liées au climat et à la quantité de nourriture disponible. Pour la plupart des types d’habitats lotiques et lentiques, il est préférable d’effectuer l’échantillonnage en automne, car la majorité des taxons y seront présents et/ou seront de taille assez grande pour être facilement prélevés. Dans les milieux marins, l’échantillonnage devrait être effectué à la fin de l’été ou à l’automne, car les populations comprenant des recrues printanières seront stables à ce moment-là.
3.5 Période d’échantillonnage
Il faut tenir compte d’une gamme de facteurs lorsque vient le temps de choisir la période d’échantillonnage, y compris le comportement migratoire possible de certaines espèces sentinelles, les conditions hydrologiques (p. ex., débit, turbidité, action des vagues), l’accessibilité et le cycle de développement des gonades. Lorsqu’il y a des données historiques, il convient de les examiner à cette étape et, si possible, d’effectuer l’étude durant la même période qu’aux phases précédentes afin de pouvoir comparer les études entre elles.
L’échantillonnage devrait avoir lieu lorsque les tissus des gonades sont suffisamment développés, afin d’être en mesure de bien évaluer la présence d’effets sur la fonction reproductive. Cependant, pour plusieurs espèces de poissons, cette information est inconnue. Les espèces pour lesquelles il existe de l’information détaillée sur la biologie et les caractéristiques du cycle vital devraient être privilégiées comme espèces sentinelles, afin que l’échantillonnage puisse être synchronisé avec le développement optimal des tissus gonadiques.
Des recherches ont récemment été menées pour établir le moment optimal d’interprétation du stade de développement des gonades en utilisant des collections saisonnières de poissons de diverses espèces. Cinq types de poissons, répartis d’après leurs caractéristiques de fraie, ont été identifiés, et le tableau 3-4 indique les périodes d’échantillonnage recommandées selon des études de prélèvement de référence. Ces dernières comprenaient des espèces de poissons d’eau douce du Canada qui sont des reproducteurs synchrones (comme le Chabot visqueux; Gray et al., 2005; Brasfield, 2007), des reproducteurs à pontes multiples ne frayant que quelques fois chaque année (comme le Naseux noir de l’Est [Rhinichthys atratulus]; Galloway et Munkittrick, 2006; Hicks et Munkittrick, données inédites), des reproducteurs à pontes multiples frayant à de nombreuses reprises chaque saison (comme le Ventre rouge du nord [Chrosomus eos]; Carroll, 2007) et des reproducteurs asynchrones (frayant à intervalle de quelques jours, comme le Choquemort [Fundulus heteroclitus]; McMullin et al., 2009). Un cinquième type de poissons d’eau douce comprend les espèces à développement asynchrone qui ne frayent que tous les deux ans à cause de la basse température de l’eau et/ou d’un manque de nourriture. Cette variabilité a une forte incidence sur les besoins en matière de puissance et de taille des échantillons.
L’examen de ces données a permis de confirmer que la puissance de détection de différences est plus élevée à des moments particuliers et lorsque les gonades sont suffisamment développées pour pouvoir déceler un effet. Les énoncés présentés au tableau 3-4 sont des généralisations et peuvent ne pas s’appliquer à toutes les espèces ou dans toutes les régions. Il faudrait consulter la personne-ressource d’ESEE de la région pour obtenir une mise à jour des directives régionales.
Chez les reproducteurs synchrones, il y a une différence temporelle dans le développement des gonades entre les mâles et les femelles. On peut habituellement obtenir des données adéquates sur les reproducteurs synchrones de printemps en réalisant les échantillonnages aussi tard que possible à l’automne ou avant la fraie au printemps. Si on dispose déjà de données pour un site, on peut estimer la stratégie de reproduction d’après l’ordre de grandeur du coefficient de corrélation (R2) entre le poids des gonades et le poids corporel, si les échantillonnages précédents ont été effectués à un moment lorsque les gonades étaient bien développées.
| Type de reproducteurs | Période d’échantillonnage | R2 pour la relation entre le poids des gonades et le poids corporel pour les femelles de la zone de référence |
|---|---|---|
| Reproducteurs synchrones | Fin de l’automne (dans le cas des reproducteurs de printemps) Début ou milieu de l’été (dans le cas des reproducteurs d’automne) | > 0,85 |
| Reproducteurs à pontes multiples, quelques reprises | 4 à 6 semaines avant la première ponte (d’avril au début de mai habituellement) | 0,4 < R2 < 0,8 |
| Reproducteurs à pontes multiples, nombreuses reprises | Aussi près du début de la fraie que possible | < 0,4 |
| Reproducteurs asynchrones | Après le début de la fraie ou près du début de la période de fraie | Non significatif |
| Développement asynchrone (tous les deux ans) | Diviser les groupes et les traiter séparément | Deux groupes de poissons d’un site montrant des pentes différentes |
La durée de la période de fraie complique l’évaluation dans le cas des espèces de poissons à pontes multiples. Dans le cas de ces espèces, il peut être intéressant d’utiliser la distribution des classes d’âges ou de longueurs comme indice complémentaire du succès de la reproduction.
Les reproducteurs à pontes multiples qui ne frayent que quelques fois chaque année devraient être échantillonnés au moins six semaines avant le début de la période de la fraie (pour de l’information sur les températures au moment de la fraie, consulter Scott, 1967; Scott et Crossman, 1974; Roberts, 1988; Nelson et Paetz, 1992; Jenkins et Burkhead, 1993; Coad et al., 1995). Cette différence pourrait être due à une augmentation de la variabilité de la relation entre le poids des gonades et le poids corporel à mesure que la période de la fraie approche, à cause de l’absence de synchronisation du moment de la deuxième ponte (Galloway et Munkittrick, 2006). Les reproducteurs à pontes multiples qui frayent à de nombreuses reprises chaque année et les reproducteurs asynchrones devraient être échantillonnés près du début de la période de la fraie en raison du développement rapide de leurs gonades.
Des données du Programme d’ESEE ont été utilisées pour les fabriques de pâtes et papiers (cycles 1 à 3) afin d’examiner les conséquences d’un échantillonnage effectué à un moment inopportun. Dans plus de 33 % des études antérieures, les poissons appartenant à des espèces de poissons de grande taille ont été échantillonnés en dehors de la période optimale, mais l’interprétation des données divergeait peu d’après la comparaison des études optimales et des études sous-optimales. Toutefois, les espèces de poissons de petite taille ont été échantillonnées à des périodes sous-optimales dans plus de 75 % des cas, et les données recueillies en dehors des périodes optimales n’ont pas permis de déceler des effets importants sur la taille des gonades ou du foie (Barrett et Munkittrick, données inédites).
| Famille Nom commun (Genre et espèce†) | Stratégie de reproduction | Période de fraie (mois) | Temp. fraie (ºC) | Période d’échantillonnage |
|---|---|---|---|---|
| Salmonidés | ||||
| Touladi (Salvelinus namaycush) | S | 8-12 | 8-11 | 4-6 sem. avant la fraie |
| Omble de fontaine (Salvelinus fontinalis) | S | 8-12 | <11 | 4-6 sem. avant la fraie |
| Omble chevalier (Salvelinus alpinus) | S(I), K | 8-12 | 1-3 | 4-6 sem. avant la fraie |
| Dolly Varden (Salvelinus malma) | S(I) | 9-11 | 8 | 4-6 sem. avant la fraie |
| Omble à tête plate (Salvelinus confluentus) | S(I) | 8-10 | 5-9 | 4-6 sem. avant la fraie |
| Truite fardée (Salmo clarki) | S(I) | 2-5 | 5-6 | Fin de l’automne |
| Truite arc-en-ciel (Oncorhynchus mykiss) | S | 3-5 | 5-13 | Fin de l’automne |
| Ombre arctique (Thymallus arcticus) | S(I) | 5-7 | 5-10 | Fin de l’automne |
| Ménomini de montagnes (Prosopium williamsoni) | S(I) | 9-10 | 3-5 | 4-6 sem. avant la fraie |
| Ménomini rond (Prosopium cylindaceum) | S(I) | 11-12 | 2.8-4.4 | 4-6 sem. avant la fraie |
| Grand Corégone (Coregonus clupeaformis) | S(I) | 10,11 | 8 | 4-6 sem. avant la fraie |
| Cisco de lac (Coregonus artedii) | S(I) | 9-11 | <4 | 4-6 sem. avant la fraie |
| Hiodontidés | ||||
| Laquaiche aux yeux d’or (Hiodon alosoides) | S | 5-7 | 10-12.8 | Fin de l’automne |
| Laquaiche argentée (Hiodon tergisus) | S(I) | 4-6 | 10-13 | Fin de l’automne |
| Esocidés | ||||
| Grand Brochet (Esox lucius) | S(IGS) | 3-4 | 4.4 | Fin de l’automne |
| Cyprinidés | ||||
| Carpe (Cyprinus carpio) | M | 5-8 | 17-23 | 4-6 sem. avant la fraie |
| Ouitouche (Semotilus corporalis) | S? | 5 | 16.6 | 4-6 sem. avant la fraie |
| Mulet à cornes (Semotilus atromacualtus) | S(IGS) | 4-7 | 12.8-17 | 4-6 sem. avant la fraie |
| Méné deux-barres (Mylocheilus caurinus) | S(IGS) | 4-7 | 10-15 | 4-6 sem. avant la fraie |
| Méné de lac (Couesius plumbeus) | S? | 4-8 | 14 | 4-6 sem. avant la fraie |
| Naseux de rapides (Rhinichthys cataractae) | M | 4-8 | 11 | 4-6 sem. avant la fraie |
| Naseux noir de l’Est (Rhinichthys atratulus) | M | 5-6 | 21 | 4-6 sem. avant la fraie |
| Mulet perlé (Margariscus margarita) | S or M? | 3-6 | 17.2-18.3 | 4-6 sem. avant la fraie |
| Ventre rouge du Nord (Phoxinus eos) | MM | 6-8 | 13 | Fraie |
| Méné à tache noire (Notropis hudsonius) | S or M? | 5-7 | 18.3 | 4-6 sem. avant la fraie |
| Méné pâle (Notropis volucellus) | S | 5-8 | ? | 4-6 sem. avant la fraie |
| Méné émeraude (Notropis atherinoides) | M? | 6-9 | 20.1-23.2 | 4-6 sem. avant la fraie |
| Méné à museau noir (Notropis heterolepis) | M | 6-8 | ? | 4-6 sem. avant la fraie |
| Méné à nageoires rouges (Luxilus cornutus) | Ma | 5-7 | 16 | 4-6 sem. avant la fraie |
| Méné jaune (Notemigonus crysoleucas) | M | 5-8 | 20-27 | 4-6 sem. avant la fraie |
| Méné rose (Richardsonius balteatus) | S? or M? | 5-8 | 14.5-18 | 4-6 sem. avant la fraie |
| Méné à museau arrondi (Pimephales notatus) | MM | 4-8 | 20 | Fraie |
| Méné à grosse tête (Pimephales promelas) | MM | 4-8 | 15.6 | Fraie |
| Catostomidés | ||||
| Meunier noir (Catostomus commersoni) | S(I) | 5-6 | 10-12 | Fin de l’automne |
| Meunier rouge (Catostomus catostomus) | S(I) | 4-5 | 5-15 | Fin de l’automne |
| Meunier à grandes écailles (Catostomus macrocheilus) | S(I) | 5-6 | 10-12 | Fin de l’automne |
| Meunier de l’Ouest (Catostomus columbianus) | S(I) | 6 | 6-13 | Fin de l’automne |
| Chevalier rouge (Moxostoma macrolepidotum) | S(I) | 5-6 | 10-15 | Fin de l’automne |
| Chevalier blanc (Moxostoma anisurum) | S(I) | 6 | 10-14 | Fin de l’automne |
| Ictaluridés | ||||
| Barbotte brune (Ameiurus nebulosus) | S(IGS), G | 5-7 | 20 | 4-6 sem. avant la fraie |
| Barbue de rivière (Ictalurus punctatus) | S(I), G | 5-7 | 21-30 | 4-6 sem. avant la fraie |
| Fundulidés | ||||
| Choquemort (Fundulus heteroclitus) | MM | 4-8 | 15-30 | Fraie |
| Gadidés | ||||
| Lotte (Lota lota) | S, K | 12, 1-3 | 1-4 | Fin de l’automne |
| Atherinidés | ||||
| Capucetteb (Menidia menidia) | M | 6-7 | 9-12 | 4-6 sem. avant la fraie |
| Gasterostéidés | ||||
| Épinoche à cinq épines (Culaea inconstans) | MM, G | 4-8 | 8 | Fraie |
| Épinoche à trois épines (Gasterosteus aculeatus) | MM, G | 4-10 | ? | Fraie |
| Épinoche à neuf épines (Pungitius pungitius) | MM, G | 5-7 | 11.5 | Fraie |
| Percopsidés | ||||
| Omisco (Percopsis omiscomaycus) | M | 5-8 | 15.6-20 | 4-6 sem. avant la fraie |
| Centrarchidés | ||||
| Crapet de roche (Ambloplites rupestris) | S/M, G | 5-6 | 20.5-26 | 4-6 sem. avant la fraie |
| Crapet-soleil (Lepomis gibbosus) | S/M, G | 5-8 | 19.4 | 4-6 sem. avant la fraie |
| Achigan à petite bouche (Micropterus dolomieui) | S(I), G | 5-6 | 12-24 | 4-6 sem. avant la fraie |
| Percidés | ||||
| Doré jaune (Sanders vitreus) | S(IGS) | 4-5 | 5.6-10 | Fin de l’automne |
| Perchaude (Perca flavescens) | S(IGS) | 4-5 | 6.7-19 | Fin de l’automne |
| Dard à ventre jaune (Etheostoma exile) | S(I), G | 5,6 | 16.4 | 4-6 sem. avant la fraie |
| Raseux-de-terre noir (Etheostoma nigrum) | S, G | 4-6 | 10 | 4-6 sem. avant la fraie |
| Fouille-roche zébré (Percina caprodes) | S(I) | 6 | 10-15 | 4-6 sem. avant la fraie |
| Cottidés | ||||
| Chabot tacheté (Cottus bairdii) | S(I), G | 5 | 5-16 | 4-6 sem. avant la fraie |
| Chabot visqueux (Cottus cognatus) | S(I), G | 5 | 5-10 | 4-6 sem. avant la fraie |
| Chabot de torrent (Cottus rhotheus) | S(I), G | 4-6 | >5? | 4-6 sem. avant la fraie |
| Chabot à tête plate (Cottus ricei) | S?, G | 5-7 | 4-6 | 4-6 sem. avant la fraie |
| Chaboisseau à épines courtes (Myoxocephalus scorpius) | S, G | 11-12 | 3-5 | 4-6 sem. avant la fraie |
| Chaboisseau à dix-huit épines (Myoxocephalus octodecimspinosus) | S(IGS) G? | 11,12,1 | 3-5 | 4-6 sem. avant la fraie |
| Pleuronectidés | ||||
| Plie rouge (Pseudopleuronectes americanus) | S, K | 5,6 | 3 | Fin de l’automne |
| Labridés | ||||
| Tanche-tautogue (Tautogolabrus adspersus) | S(I) | 7,8 | 11.5-18.3 | 4-6 sem. avant la fraie |
| Pholidés | ||||
| Sigouine de roche (Pholis gunnellus) | S, G | 12,1,2 | <7 | Fin de l’automne |
† Les noms français d’espèces ont été tirés en majeure partie du site Internet Faune vertébrée du Québec du ministère des Ressources naturelles et de la Faune du Québec à l’adresse : http://www3.mrnf.gouv.qc.ca/faune/vertebree/index.asp
Stratégies de reproduction:
S, une seule ponte; M, pontes multiples (quelques reprises); MM, pontes multiples (nombreuses reprises); K, saute une période de fraie; G, gardent les nids et (ou) fournissent une certain forme de soins parentaux aux œufs ou aux jeunes; (IGS), stratégie déterminée grâce aux données sur l’IGS échelonnées sur un cycle de reproduction; (I), strategie présumée ou certaines informations appuyant une stratégie particulière (e.g., durée de la saison de fraie); ?, données non disponibles pour appuyer une stratégie reproductive, la stratégie a été prédite sur la base d’observations par les auteurs de la grosseur des ovules dans des ovaires matures.
Période de fraie:
Nombres de 1 à 12 indiquant les mois durant lesquels l’espèce est connue pour frayer au Canada. Les intervalles correspondent à tous les mois dans cet intervalle (e.g., 5–7 correspond aux mois de mai, juin et juillet).
Température de fraie:
Une température unique associée aux symboles > ou < indique le seuil auquel une espèce est connue pour initier les activités de fraie; une température unique sans les symboles > ou < correspond simplement à une température de fraie unique fournie dans la littérature; un intervalle de températures indique l’intervalle de températures auxquelles des activités de fraie ont été observées; ? indique que des données sur la température n’étaient pas disponibles ou les valeurs ont été prédites en se basant sur des données relatives à d’autres espèces du même genre.
Périodes d’échantillonnage:
Fin de l’automne, aussi tard que possible avant l’apparition de la glace; 4–6 semaines avant la fraie, quatre à six semaines avant la première ponte; fraie, près du début de la première période de fraie.
a La stratégie de reproduction selon Barrett et Munkittrick 2010 est S(I). Cependant, des données de 2011 et 2012 provenant du Nouveau Brunswick semblent indiquer que les Ménés à nageoires rouges sont des reproducteurs à pontes multiples (Barrett, comm. pers., avril 2013).
b Stratégie de reproduction, période de fraie et période d’échantillonnage recommandée présentées dans Barrett et Munkittrick 2010 ont été révisées suite aux résultats d’une étude plus récente menée au Nouveau Brunswick (Barrett, pers. comm., avril 2013).
3.6 Vérification de l’exposition des poissons
Il est crucial de concevoir les études de façon à maximiser la possibilité de détecter des effets éventuels. Pour y parvenir, l’échantillonnage devrait être réalisé au bon moment de l’année, avec les engins de pêche et les zones de référence appropriés et lorsque les poissons résident dans la zone exposée à l’effluent. S’il est incertain que le poisson soit exposé à l’effluent de la mine, il faudrait envisager de modifier l’étude (en choisissant d’autres espèces, en utilisant des traceurs, en changeant le moment de l’échantillonnage ou en changeant la zone exposée ou la zone de référence) ou d’utiliser des méthodes de suivi de rechange à la phase suivante.
La controverse survient lorsque les poissons ne montrent aucune différence dans leurs caractéristiques entre les sites en l’absence d’un indicateur d’exposition. Dans ce cas, il est difficile de déterminer si les poissons présents dans les deux zones proviennent de la même population. Pour vérifier que les poissons pris dans la zone exposée ont été exposés à l’effluent et que les poissons pris dans la zone de référence ne l’ont pas été, il peut être nécessaire d’utiliser un traceur qui s’accumule dans les tissus de poissons. Le choix du traceur sera fonction du type de mine et de la complexité du milieu récepteur.
Il est possible de déduire qu’il y a eu exposition en examinant les teneurs en métaux des tissus des indicateurs. Les indicateurs et les tissus à analyser varient selon le type de mine et les espèces utilisées. En général, ce sont les branchies, le foie et le rein qui conviennent le mieux pour estimer l’exposition et la biodisponibilité des métaux. Il a été démontré que le mercure est le seul métal préoccupant qui s’accumule dans le tissu musculaire. Par conséquent, si la contamination par le mercure est une source de préoccupation, des tissus musculaires dorsaux devraient être analysés. Le sang et le tissu osseux peuvent refléter l’exposition au plomb, et ils devraient être analysés si le plomb est le principal élément préoccupant (Hodson et al., 1984). Les concentrations dans les os constituent normalement le meilleur indicateur d’une exposition à long terme aux métaux, tandis que les concentrations dans le sang sont une indication d’une exposition de courte durée (ETIMA, 1998). Sur les espèces de grande taille, il est possible de prélever des échantillons de foie ou de rein. Les tissus devraient être congelés en vue de leur préparation et de leur analyse ultérieures. Pour les espèces de petite taille (< 10 cm), le dosage peut être effectué à partir de spécimens entiers ou éviscérés (retrait du tube digestif). Voir la section 3.11 pour en apprendre davantage sur les études sur le potentiel d’utilisation des poissons.
Si plusieurs paramètres des poissons de la zone de référence et de la zone exposée montrent de grandes différences statistiques, on peut affirmer avec un certain degré de confiance que les échantillons proviennent de différentes populations. S’il n’y a pas de différences entre les zones, il se peut que les poissons se déplacent ou qu’il n’y ait pas d’effet. Des isotopes stables de carbone et d’azote peuvent servir à documenter les différences dans le temps de résidence des poissons, pourvu que les stresseurs en question modifient ces isotopes localement (Farwell, 1999; Galloway et al., 2004) ou qu’il existe des différences géochimiques locales qui, parce qu’elles modifient la signature des isotopes stables, peuvent servir à démontrer que les poissons résident localement (Gray et al., 2004). Toutefois, les isotopes stables ne sont pas toujours suffisamment différents d’un site à l’autre pour être utiles, et la possibilité de les utiliser doit être évaluée selon le site (Dubé et al., 2006).
En choisissant une période d’échantillonnage appropriée et une espèce de poisson plus susceptible d’être exposée à l’effluent du fait de ses habitudes de vie, l’exposition potentielle peut être maximisée. Par exemple, si l’on choisit des espèces qui sortent ou qui séjournent temporairement dans la zone exposée pendant la période de la fraie, une étude menée pendant cette période serait inefficace. Dès lors, pour les espèces qui fraient en eau douce au printemps, une étude en automne serait appropriée, et l’inverse vaudrait dans le cas des espèces qui fraient en automne. Cela ne s’appliquerait pas aux poissons dont les œufs se développent rapidement; ainsi, certains cyprinidés qui fraient à la fin du printemps devraient faire l’objet d’un échantillonnage au début du printemps plutôt qu’en automne, où il se peut que les œufs ne soient pas encore entièrement développés. Par conséquent, il est utile d’avoir des informations sur les caractéristiques des cycles biologiques des espèces choisies lorsqu’on conçoit l’échantillonnage pour l’étude des poissons.
Il faut choisir le moment des échantillonnages et les espèces de poissons en fonction du fonctionnement normal de la mine, afin que l’effluent soit présent dans le milieu. Il faut éviter de faire des échantillonnages lorsqu’un rejet d’effluent n’a pas eu lieu pendant de longues périodes (plusieurs mois). L’engin de pêche choisi, les conditions d’écoulement et les conditions régulant le rejet d’effluent peuvent toutefois limiter la saison favorable à la réalisation de l’étude.
Si aucun poisson n’est capturé (ou si seulement quelques-uns sont capturés) et qu’aucun poisson résidant n’est trouvé dans la zone exposée, cela pourrait vouloir dire que les poissons évitent cette zone. La pertinence des espèces de poissons choisies devrait être évaluée à la fin de chaque phase de suivi, en tenant compte de la nature des résultats et des préoccupations propres au site au sujet de la résidence et de l’exposition.
Il se présente des situations où les poissons peuvent entrer et sortir librement de la zone exposée, de sorte qu’aucune espèce ne passe beaucoup de temps exposée à l’effluent. Dans ces cas, l’échantillonnage devrait être conçu de sorte à maximiser la durée de l’exposition des poissons à l’effluent et, dans la mesure du possible, être effectué durant la période de développement optimale des gonades.
Deux questions importantes s’imposent au sujet de la résidence : les poissons de la zone de référence se mêlent-ils aux poissons de la zone exposée? Et les poissons capturés dans la zone exposée sont-ils vraiment exposés? Si les poissons prélevés dans la zone exposée montrent les effets d’une exposition et diffèrent des poissons de la zone de référence, il ne devrait pas y avoir matière à controverse. D’autres études de suivi peuvent permettre de vérifier si les différences relevées sont présentes chez d’autres espèces.
Si, dans la zone exposée, les poissons montrent les effets d’une exposition sans montrer de différences avec les poissons de la zone de référence, il n’entre pas dans la portée de l’ESEE de déterminer pourquoi aucun effet n’est détecté dans la zone exposée. Si les phases de suivi ultérieures confirment l’absence d’effets observés et que le plan d’étude est adéquat, on conclura que, selon le plan utilisé, les conditions de la zone font en sorte que les poissons qui sont exposés à l’effluent ne sont pas affectés par celui-ci.
3.7 Analyse de puissance
Le but d’établir une ampleur d’effet et un niveau de puissance est de déterminer si le programme d’échantillonnage recueille suffisamment d’informations pour permettre la prise de décisions. La puissance statistique d’une comparaison est fonction de la taille de l’échantillon, de la variabilité et de la différence cible établie entre les zones. Pour déterminer la taille d’échantillon permettant de détecter une différence précise, il faut posséder une certaine connaissance du niveau acceptable de puissance statistique nécessaire au processus décisionnel, ainsi que de la variabilité de la population.
3.7.1 Niveaux de puissance et de signification
Les premiers cycles du Programme d’ESEE des fabriques de pâtes et papiers ont réglé la puissance (1 – bêta [β]) à 0,80 et l'alpha (α) à 0,05. Le Programme d’ESEE encourage maintenant l'égalité de α et de β. Si les valeurs sont fixées à α = β = 0,10, les tailles des échantillons requis pour déceler le même effet sont environ les mêmes qu’aux phases précédentes. Autant que possible, pourvu que les tailles des échantillons provenant de l’analyse de puissance ne soient pas excessivement grandes, les mines sont encouragées à utiliser α = β = 0,05 (valeur traditionnelle pour alpha). Dans de nombreux programmes statistiques, la valeur de β par défaut se chiffre à 0,20; elle doit être ajustée en conséquence. À nouveau, ces recommandations visent à assurer que les études sont conçues de sorte à avoir une probabilité raisonnablement élevée de détecter au plan statistique une ampleur préétablie de l’effet étudié, s’il s’est produit (c.-à-d. que la puissance du test [1 – ß] devrait être élevée). Veuillez consulter le chapitre 8 pour connaître la justification de l’égalité de α et de β.
Il est important de comprendre que la variabilité et la puissance diffèrent selon le paramètre étudié. Chez les poissons, le degré de variabilité fluctue d’une caractéristique à l’autre. Sur une échelle relative, la variabilité des paramètres liés à la reproduction est généralement équivalente ou supérieure à celle d’autres paramètres comme la longueur, le poids corporel et le poids du foie (Environnement Canada, 1997). Si l’ampleur des effets est également exprimée sur une échelle relative (c.-à-d. écarts exprimés sous forme de pourcentage), une étude capable de détecter un écart de plus ou moins 25 % dans la taille relative des gonades permet de détecter des différences similaires ou plus faibles concernant d’autres paramètres importants.
3.7.2 Ampleur de l’effet
On recommande de concevoir le Programme d’ESEE de façon à détecter une différence de 20 à 30 % dans la taille des gonades, avec un niveau de puissance recommandé de 0,90 (1 – ß). Pour les autres paramètres, l’importance de la différence pouvant être détectée serait fixée en fonction de la taille de l’échantillon permettant de déceler un effet sur la taille des gonades. Pendant l’élaboration du plan de l’étude, il est recommandé de vérifier la puissance permettant de détecter des différences relativement à d’autres paramètres afin d’assurer l’obtention d’une puissance raisonnable pour le plus grand nombre possible de variables. L’approche retenue pour établir l’ampleur (ou taille) de l’effet cible pour le poids relatif des gonades devrait être appliquée à d’autres variables. Il convient d’effectuer des analyses de sensibilité utilisant des modèles de population pour explorer les conséquences de l’ampleur de l’effet choisie tant pour une variable choisie que pour l’ensemble des variables (Environnement Canada, 1997).
Un examen approfondi de la documentation a révélé que les seuils critiques d’effets (SCE) définis dans d’autres programmes correspondent souvent à un SCE d’environ 25 % ou à 2 ET pour de nombreuses variables biologiques ou écologiques. Cette valeur semble raisonnable à des fins d’utilisation pour une vaste gamme de programmes de suivi et un vaste éventail de variables (Munkittrick et al., 2009). Barnthouse et al. (1989) soutiennent qu’un changement de 10 % dans les paramètres serait significatif sur le plan sociétal et écologique, mais les essais de toxicité en laboratoire les préoccupaient davantage que les études sur le terrain. Ces chercheurs ont délibérément proposé un SCE prudent (bas) à cause des préoccupations soulevées par l’extrapolation des résultats de laboratoire aux conditions de terrain.
Lorsque les analyses préliminaires montrent que la puissance sera insuffisante avec des tailles d’échantillons raisonnables, il est recommandé de revoir la conception des évaluations. Les études sont conçues en fonction des caractéristiques individuelles de chaque site minier, et il convient de s’attarder en priorité à réduire la variabilité plutôt qu’à augmenter la taille des échantillons. Comme le degré de variabilité diffère d’une campagne d’échantillonnage à l’autre, l’ampleur de l’effet cible ne devrait pas correspondre à une valeur fixe, mais plutôt à une gamme de changements que l’on souhaite détecter, tel un écart de 20 à 30 %. Les tailles d’échantillons peuvent être calculées à l’aide des méthodes proposées par Green (1989). Des programmes de détermination de la taille des échantillons peuvent aussi être téléchargés de l’Internet, comme le programme connu qui est offert (en anglais seulement) à l’adresse : http://biostat.mc.vanderbilt.edu/wiki/Main/PowerSampleSize.
Les calculs de puissance a priori et les calculs de SCE sont décrits à la section 8.6.2.1 du chapitre 8.
3.8 Méthodes d’échantillonnage des poissons
Le choix de la méthode d’échantillonnage devrait être fonction du site, tandis que le choix des engins et l’effort de pêche devraient être axés sur les méthodes qui se révèlent efficaces. Les mêmes méthodes d’échantillonnage peuvent être utilisées pour les études de populations et de communautés. La différence réside dans la sélectivité des engins de pêche utilisés. Pour une étude de la communauté, l’engin devrait être aussi peu sélectif et destructeur que possible. Pour une étude de la population centrée sur une ou deux espèces, l’engin devrait être plus sélectif. Par exemple, on pourra privilégier un filet-trappe pour l’étude de la communauté, alors qu’on choisira un filet maillant avec un seul type de maille de dimension appropriée pour l’étude de la population.
L’uniformité de l’échantillonnage doit constituer une priorité. Par conséquent, si les espèces sentinelles sont les mêmes qu’à une phase précédente et que les techniques de pêche déjà employées ont permis de capturer le nombre souhaité de représentants de chacune de ces espèces, il conviendrait de conserver ces techniques, à moins qu’il existe de bonnes raisons de faire autrement, notamment une quantité excessive de prises accessoires. Les techniques d’échantillonnage et l’effort relatif devraient être les mêmes à tous les sites d’échantillonnage. Le regroupement des données provenant de diverses techniques d’échantillonnage des poissons doit être évité, et toutes les méthodes utilisées doivent être signalées. Si plus d’un type d’engin est utilisé, le nombre de poissons capturés selon chaque méthode doit être signalé, et tout regroupement de données, clairement décrit.
Il existe quelques bons manuels dans lesquels sont décrites des méthodes de prélèvement de poissons (Schneider, 2000; Portt et al., 2006). Portt et al. (2006) décrivent la méthode d’utilisation et l’efficacité 1) des filets maillants; 2) des sennes de plage; 3) des verveux, des verveux avec filet-barrage et des trappes; 4) de la pêche à l’électricité; 5) de l’observation sous-marine; 6) des nasses à vairon de type Gee; et 7) de pièges clos (calés, dépliants ou lancés). Toutefois, il faudra habituellement développer des méthodes et les optimiser pour le site à échantillonner.
3.8.1 Prises accessoires
Des échantillons peuvent être obtenus à partir des prises accessoires des pêches commerciales, scientifiques ou autres, en milieu marin ou en eau douce. En plus de veiller au respect des méthodes et conditions d’échantillonnage (AQ/CQ) et de fournir les documents à l’appui, l’investigateur devrait également s’assurer que les poissons ont bien été exposés. Il est également recommandé d’utiliser les mêmes méthodes de capture dans toutes les zones.
3.8.2 Télédétection
La quantité de poissons présents près des exutoires peut être déterminée à l’aide de caméras ou d’appareils photo montés sur des véhicules actionnés à distance. Cette façon de faire peut être particulièrement efficace dans les zones rocheuses et accidentées où il peut être difficile d’utiliser des engins de pêche. De plus, ces appareils peuvent permettre de reconnaître le fond avant le mouillage de chaluts ou de pièges à poisson. Toute méthode proposée doit être clairement exposée dans le plan d’étude aux fins d’examen.
3.8.3 Autres méthodes
Il peut y avoir des situations où il ne convient pas d’effectuer l’étude des poissons. Les raisons varient selon les sites, mais les plus courantes sont la présence de conditions dangereuses (p. ex., des courants forts) ou de facteurs de confusion comme d’autres effluents rejetés dans la zone exposée. Il devient alors difficile ou impossible d’isoler les effets attribuables à l’effluent faisant l’objet du suivi. En pareilles circonstances, la mine peut remplacer l’étude des poissons et/ou l’évaluation du potentiel d’utilisation des poissons par une méthode de remplacement. Les autres méthodes de suivi recommandées pour l’étude des poissons sont les études en mésocosme et l’utilisation de bivalves en cage. Des directives détaillées sur l’utilisation des méthodes de remplacement de suivi biologique et l’interprétation des données recueillies se trouvent au chapitre 9.
3.9 Étude des poissons – Assurance de la qualité et contrôle de la qualité
3.9.1 Pratiques de terrain pour améliorer l’analyse et l’interprétation des données
La qualité des données recueillies sur le terrain agit sur la facilité d’analyse et d’interprétation des données. La préparation à l’avance de fiches de consignation des données sauvera du temps sur le terrain; il est recommandé d’utiliser du papier imperméabilisé à cette fin. Les conditions de terrain, l’habitat, l’engin utilisé et les renseignements nécessaires pour calculer les prises par unité d’effort doivent y être inscrits. L’utilisation de la même balance et du même dispositif de mesure pour effectuer toutes les mesures ainsi que la même personne pour faire les mesures permettra de réduire les erreurs de mesure. Advenant que cette personne transmet les données à une autre qui les consigne, il ne faut pas que le mesureur utilise des virgules décimales lorsqu’il le fait. Il doit énoncer chaque élément numérique de toutes les mesures pour éviter les erreurs de transcription (p. ex., 16,5 cm sera rapporté comme 1-6-5 et la mesure sera exprimée en mm), car il est facile de confondre certains nombres lorsqu’ils sont communiqués par voie orale, par exemple six et seize.
Il est essentiel que le même type d’engin d’échantillonnage soit utilisé à tous les sites d’échantillonnage parce que la plupart des engins sélectionnent des classes d’âges ou de tailles précises. Par conséquent, l’utilisation d’engins d’échantillonnage différents d’un site à l’autre pourrait donner lieu à la détection de fausses différences (p. ex., dans l’âge ou la taille).
3.9.2 Contrôle de la qualité sur le terrain
Il s'agit de la première étape de la collecte de données. Pour ce faire, les méthodes d’AQ/CQ pour l’étude des poissons devraient être mises en œuvre dès l’application du plan d'étude et être suivies scrupuleusement pour assurer le maintien d'une grande qualité des données. Un plan d’AQ/CQ pour l’échantillonnage sur le terrain peut comporter une multitude de composantes, dont les suivantes :
- il faut initier et maintenir le contact avec les organismes gouvernementaux et administratifs de l’endroit (p. ex., pour les permis de pêche, les dates et lieux de capture des poissons, les espèces en péril, etc.);
- tout le personnel prenant part à l’échantillonnage sur le terrain devrait avoir l’instruction et/ou la formation voulues et avoir pris connaissance des modes opératoires normalisés (MON) écrits relatifs à l’étude;
- toutes les mesures de sécurité doivent être établies, comprises et acceptées;
- les méthodes et le matériel de capture des poissons doivent être adaptés au plan d'eau et à l’espèce de poisson visée;
- description de l’habitat, y compris les éventuels facteurs modificateurs (profondeur de l’eau et débit, concentration d’oxygène dissous, température, classification du substrat, salinité, conductivité, etc., et signes de pollution tels que décoloration, odeur et résidus);
- date et heure de la capture;
- les méthodes de capture devraient être uniformes tout au long de l’étude;
- emplacement des sites d’échantillonnage et des zones de capture des poissons (coordonnées géographiques) et photographie des lieux de capture;
- nombre d’espèces de poissons et d’autres animaux capturées par lieu de capture;
- estimation du nombre de prises par unité d’effort;
- les échantillons provenant des poissons (p. ex., ovaires, éléments indicateurs de l’âge, contenu de l’estomac) doivent être placés dans des récipients appropriés;
- il faut utiliser les agents de préservation ou de fixation appropriés (p. ex., ovaires à congeler ou à placer dans du formol);
- tous les échantillons doivent porter les étiquettes appropriées;
- toutes les mesures devraient être effectuées à l’aide du matériel pertinent avec une justesse et une précision acceptables (il faudrait donner des détails à ce sujet);
- les appareils devraient être étalonnés et maintenus en bon état de fonctionnement (les données enregistrées et les méthodes devraient être indiquées);
- les notes détaillées prises sur le terrain devraient être consignées dans un carnet;
- des formulaires de chaîne de possession et des procédures d’expédition et d’entreposage appropriées devraient être utilisés.
3.9.3 Détermination de l’effort d’échantillonnage
Pour aider à évaluer l’effort d’échantillonnage requis à des endroits particuliers, le plan d’étude soumis à Environnement Canada devrait fournir tous les détails sur l’exécution de l’échantillonnage.
Voici une série de conseils et de critères fondés sur le rendement afin de déterminer « un niveau raisonnable d'effort de pêche ». Chaque emplacement est unique. Le succès de la pêche dans un secteur n’est pas assuré seulement parce qu’un certain effort d’échantillonnage a été couronné de succès à d’autres endroits par le passé, ou encore au même endroit à d’autres moments.
- Le plan d’étude devrait documenter tous les détails sur les méthodes d'échantillonnage de poissons adultes, afin d'aider à l’évaluation de l’effort de pêche. Les détails à fournir dans le plan d’étude (au besoin) sont les suivants :
- pourquoi et comment les espèces sentinelles ont été choisies;
- qui a été consulté quant à l’emplacement et aux techniques retenus pour capturer les espèces sentinelles proposées;
- plan de contingence relativement aux engins de pêche et espèces sentinelles de remplacement;
- dates où le travail sera effectué, afin que les personnes-ressources de l’ESEE puissent être disponibles à des fins de consultation;
- type, emplacement et dimensions des engins (p. ex., filets maillants, filets-trappes, trappes, palangres; dans certains cas, il peut être utile d'utiliser plus d'un type d'engin);
- type de maille (p. ex., nylon, fil ou fibre de coton, noué ou sans nœud) et grandeur de la maille;
- nombre d’engins et effort de pêche proposés;
- heure de l’échantillonnage (c.-à-d. l’heure du jour);
- durée de l’échantillonnage (c.-à-d. l’intervalle de temps entre le placement de l’engin et sa récupération);
- fréquence des vérifications.
Tous les résultats ou observations d'une étude préliminaire de poissons réalisée durant les activités de préconception devraient être fournis si ces données ont servi à la sélection des espèces sentinelles ou des méthodes de travail. La personne-ressource de l’ESEE dans la région examinera ces données et pourra demander des renseignements supplémentaires, afin de clarifier les procédures d'échantillonnage.
- Il faut employer des procédures opérationnelles appropriées. Ces procédures comprennent l’utilisation d’engins conformes aux indications du plan d’étude. Les engins doivent être vérifiés à des intervalles réguliers afin d’assurer la récupération d’espèces sentinelles en bon état et la libération des espèces non ciblées (surtout les espèces protégées ou menacées de disparition). Il y a donc lieu de considérer la possibilité d’utiliser des techniques sélectives ou des techniques non destructives. Un registre de l’identité et du nombre estimatif de prises de poissons non ciblés pourrait constituer un élément additionnel utile à ajouter aux plans de contingence. La mine et le consultant doivent bien comprendre l’habitat, les caractéristiques des espèces et l’engin que l’on envisage d'utiliser.
- Il faut consulter les experts locaux (p. ex., le personnel des services fédéraux et provinciaux des pêches, les groupes autochtones, les particuliers et les organismes qui s’occupent de la pêche commerciale et récréative dans la localité, le public, et d’autres personnes qui connaissent les ressources halieutiques locales), afin de voir à ce que la sélection des espèces sentinelles, l’emplacement des filets, la période de capture, etc. soient optimaux.
- Le personnel chargé de la capture du poisson et des méthodes d’échantillonnage doit avoir une expérience reconnue dans ce domaine.
- Il faut obtenir les permis de pêche auprès des organismes responsables des pêches de la localité.
- Il faut conserver des registres dans lesquels seront consignées les procédures opérationnelles utilisées (p. ex., la grandeur des mailles des filets, la durée des échantillonnages, les emplacements, la fréquence des vérifications, etc.). Ces registres pourraient être nécessaires pour évaluer convenablement la manière dont l’étude a été menée.
Bien que ce ne soit pas obligatoire, il est recommandé de fournir une estimation des prises par unité d’effort (PUE) pour chaque zone d’échantillonnage (c.-à-d. le nombre de poissons capturés par période, zone, filet, etc.). Cette estimation renseigne sur l’effort de pêche déployé dans les cas où il peut être difficile de prélever le nombre minimal de poissons requis.
3.9.3.1 Exemples de calculs de l’effort d’échantillonnage
Voici quelques exemples de méthodes de pêche qui ont permis de prendre des échantillons de poissons en fonction du temps. Ces exemples sont fournis afin d’aider les consultants durant l’élaboration et la mise en œuvre de leur plan d'étude et d’indiquer les cas où il y a lieu de consulter le coordonnateur régional de l’ESEE qui a été désigné par Environnement Canada.
- Des données tirées d’une étude effectuée dans deux lacs de l’Ontario indiquent que 40 spécimens appartenant à six espèces d’eaux chaudes ont été prélevés en un à six déploiements d’une durée de 24 heures. L’engin utilisé était un filet-trappe de 6 × 6 pieds. Les détails de la méthode sont exposés dans le bulletin du Groupe d’évaluation des pêches du ministère des Richesses naturelles de l’Ontario (MRNO, 1994a).
- Pendant l’évaluation de l’abondance des communautés de poissons d’eaux froides de l’Ontario, l’effort de pêche recommandé pour capturer 40 Touladis dans sept lacs a varié entre 12 et 120 heures. Le dispositif utilisé était un jeu de filets maillants de 46 m, composé de trois panneaux de 15,2 m. De plus amples renseignements sur la méthode utilisée sont présentés dans le bulletin du Groupe d’évaluation des pêches du ministère des Richesses naturelles de l’Ontario (MRNO, 1994b). Le maillage devrait être uniforme et choisi en fonction de l’espèce cible.
- L’expérience a montré qu’avec des filets maillants à quatre panneaux de 50 m mouillés 24 h sur 24 pendant cinq jours (ce qui équivaut à un effort de 24 000 mètres-heures) dans des systèmes d’eau douce, il est possible de prélever 20 poissons de chaque sexe. Il faut pour cela que les panneaux de filet soient correctement déployés et qu’ils soient déplacés de manière à couvrir les zones fréquentées par les poissons. Le maillage devrait être uniforme et choisi en fonction de l’espèce cible.
- Une autre stratégie consiste à déployer au départ une quantité minimale de filets pour réduire les prises accessoires (< 400 m). Si la pêche s’avère suffisamment sélective, et si la quantité de prises accessoires est acceptable, il peut être nécessaire d’utiliser 2 km de filets à maillage unique dans les petits cours d’eau peu productifs.
- En milieu marin, l’expérience a montré que 48 heures de pêche au chalut à perche, à la palangre avec des tailles diverses d’hameçons ou à l’aide d’autres méthodes comme les trappes (seules ou combinées) permettent normalement d’obtenir les 20 poissons de chaque sexe requis.
- Une consultation d’adeptes de la pêche électrique (matériel embarqué, grands cours d’eau) a révélé que l’on peut prendre tous les poissons voulus en une seule journée. Pour accroître le succès de l’opération, il est recommandé de pêcher au crépuscule ou la nuit, parcourir le même secteur au moins trois fois et utiliser des impulsions intermittentes (un champ électrique continu pouvant éloigner les poissons). Dans les cours d’eau et les lacs de petite taille, les difficultés posées par le déplacement dans ces milieux ont souvent pour effet de prolonger l’échantillonnage.
- En 1999, un consultant a prélevé des poissons pour une fabrique de pâtes et papiers de la côte Est, située près d’un estuaire sous l’influence des marées. L’espèce ciblée était le Choquemort (Fundulus heteroclitus), et le consultant utilisait une senne de rivage à mailles de 0,5 cm qui mesurait 15 m sur 1,5 m. Un premier technicien vêtu de pantalons-bottes prenait un côté de la senne, entrait dans l’eau et s’éloignait d’environ 10 mètres, tandis que le second technicien tenait l’autre côté du filet le long du rivage. Les techniciens tiraient ensuite la senne perpendiculairement à la côte, sur une distance de 20 à 30 m, puis le premier ramenait le côté extérieur vers la plage de façon à former une poche avec le filet. Une fois que les deux côtés reposaient solidement sur le rivage, les techniciens ramenaient avec soin le haut et le bas du filet pour y capturer les poissons emprisonnés. Le consultant a constaté que la pêche était particulièrement fructueuse à l’étale de la marée haute. En tout, 108 Choquemorts ont été capturés et conservés durant les quatre jours qu’a duré l’échantillonnage. Le temps de pêche s’est élevé à 12,5 heures. Comme il fallait obtenir un nombre semblable de mâles et de femelles, de nombreux Choquemorts ont été capturés et relâchés, tout comme des poissons de 11 autres espèces (Final Report – Repap New Brunswick Inc. Kraft Mill, Second Cycle Aquatic EEM Study – Jacques Whitford Environment Limited – avril 2002).
Bien que les techniques et engins décrits ci-dessus puissent s’appliquer à diverses espèces, ces exemples ne couvrent pas toutes les possibilités, étant donné le caractère unique de chaque site. Par conséquent, ces exemples sont proposés à titre de suggestions seulement. Les experts locaux peuvent donner des conseils supplémentaires. Les exemples susmentionnés indiquent la marche à suivre pour capturer un minimum de 20 poissons par sexe, par espèce et par zone.
3.9.4 Consultation avec les coordonnateurs régionaux de l’ESEE et exécution sur le terrain
Si tous les critères précédents sont respectés et que l’expert-conseil ou la mine ont des difficultés à respecter les exigences minimales quant aux données de l’étude des poissons adultes, le propriétaire ou l’exploitant peut s’écarter du plan d’étude, mais il doit en informer l’agent d’autorisation sans tarder et lui décrire la manière dont l’étude a été ou sera réalisée. Tous les efforts raisonnables doivent être faits pour prélever les tailles d’échantillons cibles de deux espèces de poissons, et la mine doit faire preuve de diligence.
Voici un aperçu des résultats et des options possibles après consultation avec le coordonnateur de l’ESEE :
1. Continuer – Les conseils sur les situations suivantes dépendront des conditions particulières au site. Fixer des dates de consultation ultérieures, au besoin.
- Absence d'espèces sentinelles dans la zone de référence :
- continuer avec les engins et les techniques actuels;
- continuer dans une autre zone de référence selon les indications du plan de contingence;
- continuer dans la zone de référence actuelle en utilisant d’autres engins ou techniques et d’autres espèces sentinelles selon les indications du plan de contingence.
- Absence d'espèces sentinelles dans la zone exposée :
- continuer en utilisant les techniques et les engins de pêche actuels;
- continuer dans une autre zone exposée selon les indications du plan de contingence;
- continuer dans la zone exposée actuelle en utilisant des engins de pêche, des techniques ou des espèces sentinelles différents, selon les indications du plan de contingence.
- Absence d’espèces sentinelles dans la zone de référence et la zone exposée :
- continuer dans d’autres zones, avec d’autres espèces sentinelles, engins de pêche et/ou d’autres techniques, selon les indications du plan de contingence.
2. Reporter (ne pas continuer) – Existence de conditions dangereuses : conditions d'échantillonnage qui ne permettent pas la récolte de poissons (p. ex., température, froid); engins de pêche de remplacement non disponibles; absence d’autres solutions de remplacement exploitables (p. ex., s’il n’existe pas d’autres espèces possibles, il est nécessaire de procéder à des études plus approfondies) :
- concevoir un nouveau plan d’échantillonnage en consultant la personne-ressource de l’ESEE dans la région;
- recommencer à une date ultérieure en utilisant les zones, les engins, les espèces sentinelles et les techniques actuelles ou de remplacement, mais sous des conditions plus favorables;
- établir la date des consultations futures.
3. Discontinuer – Si l’on n’a pas capturé le nombre voulu de poissons, l’absence (ou la pénurie) de poissons sera considérée comme un résultat, lequel sera expliqué dans les conclusions de l’étude en tenant compte de tous les facteurs déterminants possibles. Si le nombre minimal de poissons n’est pas prélevé, cela pourrait entraîner une hausse de la variance estimée. La décision de poursuivre ou de ne pas poursuivre dépendra, d’abord et avant tout, des considérations de sécurité. Dans tous les cas, se rapporter au plan de contingence, au besoin, et établir des dates où se tiendront des discussions ultérieures. Les techniciens sur le site d’étude devraient parler directement à la personne-ressource de l’ESEE dans la région. Les espèces sentinelles sont représentées tant dans la zone de référence que dans la zone exposée proche. La mise en commun de données recueillies durant des saisons différentes n’est pas valable.
3.9.5 Entrée des données
L’entrée des données et la préparation de l’analyse sont abordées au chapitre 8, et le compte rendu des résultats, au chapitre 10.
3.9.6 Contrôle de la qualité en laboratoire
Bien qu’une bonne partie de l’information soit recueillie sur le terrain, les paramètres comme le poids des œufs, la fécondité et l’âge des spécimens sont généralement déterminés plus tard au laboratoire. Pour chaque mesure, l’objectif premier du programme d’AQ/CQ en laboratoire est d’assurer l’uniformité (précision) et l’exactitude des données. Les exigences suivantes devraient faire partie intégrante des processus de mesure :
- tout le personnel participant au traitement et à l’analyse des échantillons devrait posséder l’éducation et/ou la formation nécessaires;
- la prise de mesures devrait être réalisée selon des protocoles et méthodes reconnus (bien documentés), et tous les appareils devraient être étalonnés et entretenus adéquatement (registres, méthodes disponibles);
- consigner les mesures prises sur chaque poisson (espèces cibles);
- consigner la présence de lésions, de tumeurs et de parasites externes, etc.;
- consigner les données sur la fécondité ainsi que les méthodes utilisées pour la détermination de la fécondité et la précision du sous-échantillonnage (le cas échéant);
- consigner les données sur l’âge ainsi que les méthodes utilisées pour la détermination de l’âge et le nom des personnes ayant confirmé l’exactitude des données;
- tenir des registres décrivant les échantillons prélevés, les mesures effectuées et le personnel responsable; si possible, la mesure de certaines variables devrait être confiée à un nombre minimal de personnes, afin de conserver l’uniformité et de prévenir les erreurs de mesure (particulièrement dans le cas de la détermination de l’âge);
- si un sous-échantillonnage s’impose (p. ex., fécondité, poids des œufs), le degré d’efficacité et d’exactitude de la méthode utilisée devrait être consigné; cette information devrait également pouvoir servir au calcul de facteurs de correction ou de mise à l’échelle (si nécessaire) permettant de minimiser les écarts éventuels associés aux méthodes et au degré d’efficacité;
- toutes les données devraient être vérifiées; par exemple, certaines mesures comme la fécondité et le poids des œufs devraient être répétées pour en garantir la précision et l’exactitude; un expert reconnu devrait vérifier les estimations de l’âge;
- consigner les ouvrages de référence et les clés utilisés pour l’identification des poissons;
- conserver les échantillons et les spécimens de référence;
- consigner des notes détaillées sur le traitement des échantillons et le travail de laboratoire dans un carnet.
3.10 Analyse des données
Les problèmes d’AQ/CQ soulevés par l’analyse des données sont la vérification et la validation des données, la répétabilité et la robustesse des analyses statistiques ainsi que la rigueur et la pertinence des analyses. Dans la plupart des cas, le succès de la validation et de la vérification des données dépend de l’efficacité des méthodes d’AQ/CQ appliquées durant l’échantillonnage sur le terrain, le traitement des échantillons et les analyses en laboratoire (voir ci-dessus). Toutefois, la vérification des données et les analyses devraient comporter les points suivants :
- appliquer des méthodes de vérification en vue de repérer d’éventuelles erreurs de transcription, les données aberrantes et d’autres points potentiellement suspects;
- conserver sous forme de tableau des sommaires des descripteurs statistiques généraux (taille de l’échantillon, moyenne, valeur minimale, valeur maximale, erreur-type et l’écart-type) des paramètres mesurés sur les poissons (voir le tableau 3-6 pour un exemple);
- fournir les résultats de l’évaluation des hypothèses de normalité des données et d’homogénéité de la variance;
- conserver un registre des modes de transformation employés;
- fournir les estimations paramétriques de la variabilité (erreur quadratique moyenne [EQM] de l’analyse de la variance [ANOVA], EQM de l’analyse de la covariance [ANCOVA], écart-type pour l’âge à la maturité);
- fournir les calculs des exigences relatives à la taille de l’échantillon pour chaque paramètre;
- fournir un résumé sur le degré de conformité aux objectifs de qualité des données et aux modes opératoires normalisés et sur les éventuels problèmes observés durant l’étape d’AQ/CQ en laboratoire et sur le terrain;
- pour assurer la reproduction des analyses et des résultats, joindre en annexe toutes les données brutes et archiver les fichiers informatisés pendant une période approuvée après la publication des résultats des analyses dans un rapport;
- décrire de façon claire et détaillée les méthodes utilisées pour les analyses;
- vérifier que les logiciels de calcul employés donnent les mêmes produits et résultats que d’autres logiciels;
- évaluer la robustesse des analyses (c.-à-d. les résultats et les conclusions devraient être similaires);
- prendre note de la présence ou de l’absence de données aberrantes, et du recours à des transformations, etc., afin de s’assurer que les résultats ne sont pas fonction d’une manipulation ou d’une hypothèse formulée avant ou pendant les analyses;
- tenir des notes détaillées sur les analyses des données de l’étude.
3.10.1 Analyse statistique
L’indépendance, la normalité et l’homogénéité des variances constituent les postulats de nombreux tests statistiques paramétriques. Ceux-ci et des renseignements supplémentaires sur l’évaluation et l’interprétation des données sont discutés au chapitre 8.
| Espèce | Sexe | Paramètre | Site de référence | Site exposé | Diff. en % | Sign. stat. | ||
|---|---|---|---|---|---|---|---|---|
| Réf. (n) | Site de référence Moyenne et ET | Exp. (n) | Site exposé Moyenne et ET | |||||
| Espèce | Sexe | Régression | Réf. (n) | Site de réf. Moy. ajust. | Exp. (n) | Site exp. Moy. ajust. | Diff. en % | Sign. stat. | Inter. sign. |
|---|---|---|---|---|---|---|---|---|---|
Remarque – Il faut indiquer la différence en pourcentage entre le site exposé et le site de référence. La signification statistique doit être indiquée sous la forme d’une valeur p.
Légende – Diff. : différence. Sign. stat. : signification statistique (valeur de p). Réf. : référence. Exp. : exposé. Moy. ajust. : moyenne ajustée. Inter. sign. : interaction significative.
3.11 Méthodes d’analyse du potentiel d’utilisation des poissons
La question à savoir si l’effluent a produit un changement dans le potentiel d’utilisation des poissons a pour but de déterminer si l’effluent a altéré les poissons au point de limiter leur utilisation par les humains. Le potentiel d’utilisation des poissons peut être influencé par une modification de l’apparence, une altération du goût ou de l’odeur, ou la présence de concentrations de contaminants dans les tissus qui dépassent les seuils fixés pour la consommation humaine et qui sont statistiquement différentes des concentrations mesurées dans la zone de référence. La présente section porte sur le potentiel d’utilisation des poissons par rapport aux concentrations de mercure.
Le mercure est le seul métal faisant l’objet d’une norme fixée par Santé Canada concernant la concentration permise dans les tissus des poissons vendus au détail aux fins de consommation par l’être humain. Le mercure est donc un polluant qui constitue une source de préoccupation d’ordre national. Santé Canada a récemment achevé une étude sur le mercure dans laquelle le Ministère réaffirme la norme (limite maximale) fixée à 0,5 µg/g, à l’exception du thon frais ou congelé, du requin, de l’espadon, de l’escolier, du marlin et de l’hoplostète orange. Les gouvernements provinciaux et territoriaux ont la responsabilité d’émettre des avis concernant la consommation du poisson issu de la pêche sportive, à l’exception de la pêche sportive pratiquée dans les parcs fédéraux. Les limites de consommation de poissons provenant de la pêche sportive commencent à des concentrations de mercure total supérieures à 0,45 mg/g.
Les études de suivi biologique se composent d’une étude sur les tissus de poissons si une concentration de mercure total égale ou supérieure à 0,10 µg/L a été relevée lors de la caractérisation de l’effluent menée aux termes de l’alinéa 4(1)d) (annexe 5, alinéa 9c) du REMM).
Un « effet sur les tissus de poissons » s’entend lorsque des mesures de la concentration du mercure total dans les tissus de poissons, prises dans la zone exposée, supérieures à 0,5 µg/g (poids humide), présentant une différence statistique et ayant une concentration plus élevée par rapport à celles mesurées dans les tissus de poissons prises dans la zone de référence (annexe 5, article 1 du REMM). Il est possible que, à certains sites miniers, les tissus des poissons prélevés dans les zones de référence montrent des concentrations de mercure total supérieures à la consigne (p. ex., dans le nord du Québec – Schetagne et al., 1996; Schetagne et Verdon, 1999). Par conséquent, pour être considéré un effet dans les tissus des poissons, un test statistique unilatéral doit être effectué, et il doit révéler une différence statistique entre les zones et un dépassement de la consigne.
Comme il est mentionné au chapitre 5, la limite de la méthode de détection pour le mercure dans les effluents a été modifiée et fixée à 0,01 µg/L (0,00001 mg/L) de manière à ce que la concentration de 0,1 µg/L stipulée à l’alinéa 9c) de l’annexe 5 du REMM puisse être détectée avec confiance. Voici des méthodes d’analyse qui permettent d’atteindre ce niveau de détection : spectrométrie d’absorption atomique (vapeur froide), spectrométrie de fluorescence atomique (vapeur froide) et spectrométrie de masse avec plasma à couplage inductif.
Le Guide de consommation du poisson gibier de l’Ontario mentionne que d’autres métaux, soit le plomb (Pb), le cuivre (Cu), le nickel (Ni), le zinc (Zn), le cadmium (Cd), le magnésium (Mg), le chrome (Cr), l’arsenic (As) et le sélénium (Se), peuvent être présents dans les tissus des poissons, sans avoir des concentrations justifiant une limite de la consommation. Selon les endroits, les métaux peuvent constituer une source de préoccupation si d’autres directives pour la consommation humaine applicables à la région où se déroule l’étude ont été émises par un autre organisme de réglementation (p. ex., provincial ou territorial) et si le métal visé par une directive de consommation est présent dans l’effluent. Les pêches destinées à la consommation locale et les pêches commerciales devraient être prises en compte lorsqu’on détermine quels tissus comestibles (foie, reins, os, chair ou même poisson entier) devraient être analysés. Il est recommandé d’analyser les autres métaux dans les tissus de poissons lorsque des problèmes sur un site en particulier sont signalés. Le Guide de consommation du poisson gibier de l’Ontario se trouve à l’adresse suivante : http://www.ene.gov.on.ca/fr/water/fishguide/index.php.
Les mollusques peuvent accumuler les métaux (Cd, Cu, Zn, Pb, Ni, mercure [Hg], As, argent [Ag] et Cr). Des études sur le terrain donnent à croire que la relation entre les concentrations de métaux dans les tissus des mollusques et les concentrations de métaux dans le milieu ambiant est modulée par un certain nombre de paramètres biologiques, physiques et chimiques qui, de ce fait, devraient être pris en compte. En dernière analyse, la relation dépend du type de métal considéré et de sa disponibilité à l’état dissous et particulaire (ETIMA, 1997).
Le protocole d’ESEE pour l’analyse des tissus des poissons est présenté ci-dessous. D’autres protocoles peuvent être utilisés s’ils satisfont aux normes minimales d’ESEE. Par exemple, le protocole d’Hydro-Québec pour le suivi des concentrations de mercure chez les poissons (Tremblay et al., 1998) est largement utilisé au Québec, puisqu’il comporte l’analyse du mercure chez différentes classes d’âge. Ce protocole est affiché sur le site Web des ESEE.
3.11.1 Sélection des espèces de poissons
Dans le choix de l’emplacement des sites pour procéder à l’échantillonnage des tissus de poissons, il faut prendre en compte les mêmes facteurs considérés pour l’étude des poissons. Les espèces choisies pour l’analyse des tissus devraient être, si elles sont présentes, des espèces qui font l’objet d’une pêche sportive, de subsistance et/ou commerciale, y compris des mollusques et des crustacés, si possible. Les espèces retenues pour l’analyse des tissus ne sont pas nécessairement les mêmes que celles qui ont été utilisées aux fins de l’étude des poissons. Selon les sites étudiés, les tissus prélevés aux fins des analyses devraient être choisis en considération de la portion du poisson qui est consommée par la population locale (muscles, foie, œufs, hépatopancréas [crustacés], os ou toute autre partie pertinente). Pour les mollusques, il faut prélever les parties molles entières du corps, et il peut être nécessaire de combiner des tissus provenant de plus de dix spécimens pour obtenir un échantillon de poids suffisant. Pour le homard ou le crabe, il faudrait prélever du tissu comestible (p. ex., muscles, œufs, hépatopancréas).
3.11.2 Prélèvement et préparation des échantillons de tissus
Les analyses des tissus devraient être réalisées sur un minimum de 16 échantillons (pour obtenir une puissance de 95 %) d’une seule espèce, soit huit provenant de la zone exposée et huit de la zone de référence. Les huit échantillons pour chacune des zones peuvent être des tissus prélevés sur huit poissons différents, ou chaque échantillon peut être composé de tissus de plusieurs poissons. Toutefois, les tissus prélevés sur un poisson ne doivent être utilisés que dans un seul échantillon. Dans la mesure du possible, les spécimens utilisés pour la constitution de l’échantillon devraient appartenir au même sexe et à la même classe d’âge. Le sexe de chaque poisson de l’échantillon doit être indiqué. Si les poissons n’appartiennent pas à la même classe d’âge, les classes d’âge des poissons doivent être constantes entre les sites d’échantillonnage. Bien que les poissons les plus gros (les plus âgés) de taille semblable soient préférables, les limites de taille établies par l’autorité responsable dans les règlements de pêche, qui s’appliquent dans la région où l’étude est menée, doivent être respectées.
La quantité de tissus prélevés devrait être proportionnelle aux exigences de la méthode d’analyse utilisée. Le tissu de chaque poisson devrait servir à la constitution d’un seul échantillon et ne devrait pas être mélangé à d’autres échantillons. Il importe de manipuler les tissus prélevés aux fins des analyses de façon à éviter leur contamination par des sources comme le carburant du bateau utilisé pour l’échantillonnage. Chaque échantillon doit être clairement étiqueté, scellé dans un contenant exempt de contaminants, congelé et expédié au laboratoire d’analyse. Chaque échantillon doit être homogénéisé séparément puis sous-échantillonné pour le dosage du mercure.
3.11.3 Analyses complémentaires : pourcentage de lipides et d’eau
Le monométhylmercure (MeHg) représente presque la totalité (au moins 95 %) du mercure total présent dans le tissu musculaire des poissons, quelle que soit la composition du régime alimentaire et les concentrations dans l’eau exposée (Bloom, 1992). En raison de sa forte affinité pour les groupements sulfhydriles des protéines, de la facilité relative avec laquelle il traverse les parois des voies digestives et du fait que sa dépuration s’effectue relativement plus lentement que celle du mercure inorganique, le MeHg s’accumule dans les tissus biologiques (Clarkson, 1994; Saouter et al., 1993).
La teneur en lipides a été utilisée pour normaliser les résidus dans les tissus d’une espèce à l’autre ou au sein d’une même espèce d’une saison à l’autre, et elle constitue une variable clé pour l’élaboration de modèles de bioaccumulation. Pour l’extraction des lipides, les méthodes proposées par Randall et al. (1991) et la méthode d’extraction au chloroforme et au méthanol sont recommandées. L’analyse des lipides ne devrait être effectuée que lorsque le contaminant à l’essai est reconnu comme lipophile.
La teneur relative (%) en lipides et en eau devrait être fournie pour chaque échantillon faisant l’objet d’un dosage des métaux totaux. Il faudrait également signaler les teneurs en lipides pour les réplicats analysés dans le même lot que l’échantillon soumis. La précision de la mesure des teneurs en lipides pour les réplicats devrait être de ± 30 % pour les tissus contenant plus de 2 % de lipides et ± 60 % pour les tissus contenant moins de 2 % de lipides. La méthode utilisée pour le dosage des lipides devrait être indiquée, et la nature des solvants utilisés clairement précisée.
3.11.4 Directives pour le dosage du mercure dans les tissus des poissons à l’aide de méthodes non létales
Ce dosage se fait habituellement en prélevant un filet sur les poissons. Des méthodes d’échantillonnage non létales permettent aussi d’obtenir des mesures exactes et fiables des concentrations de mercure dans les muscles des poissons pourvu qu’on utilise les bonnes méthodes d’analyse (Tyus et al., 1999; Baker, 2002; Baker et al., 2004; Peterson et al.,2005). Le recours à des méthodes non létales pour le dosage du mercure s’avère particulièrement intéressant dans les sites où l’emploi de méthodes d’échantillonnage destructrices nuirait aux populations de poissons, par exemple, dans les endroits où la densité des poissons est faible. Le but de la présente section est de décrire les méthodes non létales adéquates pour l’échantillonnage et l’analyse des tissus.
À l’heure actuelle, il est recommandé d’analyser les tissus de 16 échantillons (pour obtenir une puissance de 95 %), soit huit échantillons provenant de la zone exposée et huit provenant de la zone de référence, prélevés sur des individus d’une même espèce, de la même classe d’âge et du même sexe, dans le cadre d’une étude d’échantillonnage létal. Cette directive doit également être suivie dans les études non létales, sauf pour ce qui est de la détermination du sexe, qui s’avère impossible pour la plupart des espèces dans le cadre d’un échantillonnage non létal. Plusieurs études n’ont cependant pas réussi à relever de différences dans les concentrations de mercure entre les mâles et les femelles, malgré les différences possibles dans leurs besoins énergétiques (Lange et al., 1994; Henderson et al., 2003; Ward et Neumann, 1999).
Baker et al. (2004) ont démontré que de petites quantités de tissus prélevées à l’aide de deux types différents d’outils de biopsie non létaux (poinçon cutané et aiguille à biopsie Tru-CutMD) permettaient d’obtenir des estimations aussi exactes et précises de la concentration de mercure dans les muscles de poisson que les valeurs de référence établies à l’aide des méthodes classiques avec prélèvement de filets. Ces auteurs ont par ailleurs constaté que l’emploi de ces différents outils ne réduisait pas la survie du Grand Brochet après recapture. De leur côté, Tyus et al. (1999) ont étudié la survie de la Truite arc-en-ciel et du catostome Xyrauchen texanus soumis à un prélèvement de tissus à l’aide de poinçons (prélèvement de tissus cutanés et hépatiques, et de tissus de nageoire) sans relever de différences significatives dans la croissance ou la survie d’aucun des poissons touchés.
3.11.4.1 Méthodologie recommandée
La fiabilité de la technique non létale peut dépendre de l’outil de biopsie, de la méthode d’analyse et du poids de l’échantillon de tissu (Baker et al., 2004). La méthode recommandée ici pour le prélèvement de tissus musculaires chez les poissons à l’aide d’une approche non destructive est fondée sur les travaux de Baker (2002) et de Baker et al. (2004).
- Pratique – Dans la mesure du possible, on devrait s’exercer au prélèvement sur du matériel archivé ou sur des poissons morts accidentellement avant d’utiliser la méthode sur des poissons vivants. En se familiarisant avec une technique, on réduit au minimum tout stress éventuel lié à la manipulation et à l’échantillonnage.
- Capture et anesthésie des poissons – Après avoir préparé deux contenants, un rempli d’eau bien oxygénée et l’autre renfermant une solution anesthésiante (p. ex., MS-222), on capture les poissons à l’aide d’une méthode non létale (pêche à la ligne, pêche de courte durée au filet maillant, pêche électrique, etc.), et on les place dans le contenant rempli d’eau oxygénée. On les transfère ensuite (un par un au besoin) dans le contenant de solution anesthésiante.
- Mesures externes des poissons – Une fois les poissons anesthésiés, on mesure leur longueur et on les pèse et, s’il y a lieu, on prélève une structure anatomique (comme un rayon de nageoire pelvienne) pour en déterminer l’âge.
- Prélèvement des tissus – Il existe deux outils pour recueillir de petits échantillons de tissus : les poinçons cutanés et les aiguilles à biopsie Tru-CutMD.
- Tru-CutMD. À l’aide d’une aiguille stérilisée, enlever deux ou trois écailles de la région dorsale du poisson, juste sous la nageoire dorsale. Insérer ensuite obliquement (pour réduire au minimum la profondeur de pénétration) la canule externe à une profondeur d’environ 1 cm dans le tissu musculaire sous les écailles. L’aiguille à encoche (trocart) de 2 cm de longueur s’enfonce alors dans la chair. La guillotine glisse sur l’aiguille enfoncée pour couper le tissu et le retenir dans l’encoche. Retirer ensuite l’aiguille, ouvrir la canule et, à l’aide d’une pince en inox (qui doit être lavée à l’acide entre chaque prélèvement) ou d’une pince jetable en plastique, retirer le morceau de tissu que l’on place dans un petit flacon étiqueté. Les échantillons prélevés pèsent environ 25 mg. Il faut donc prélever et combiner au moins deux échantillons de tissus par poisson pour obtenir une quantité suffisante pour l’analyse. Selon Baker et al. (2004), cette méthode permet à une personne d’expérience de prélever un échantillon en une dizaine de secondes.
- Ponction cutanée. Comme la ponction cutanée permet de prélever une plus grande quantité de tissu, c’est la méthode de prélèvement recommandée si l’on n’a accès qu’à la spectrophotométrie d’absorption atomique (vapeur froide) pour l’analyse des tissus. Cette méthode peut être utilisée avec les poissons dont la taille est supérieure à 200 mm. Enlever quelques écailles, puis placer le poinçon sur la peau de l’animal. En appliquant une pression modérée tout en exerçant un mouvement de torsion, pénétrer la musculature épaxiale pour prélever un petit morceau de tissu (environ 60 mg). Comme c’est le cas dans la méthode par biopsie, il faut prélever et combiner deux échantillons par poisson.
- Conservation des échantillons – Les échantillons doivent être congelés avec de la glace sèche ou de l’azote liquide pour prévenir toute décomposition pendant le stockage et le transport vers le laboratoire d’analyse. Ils doivent être lyophilisés et pesés avant l’analyse.
- Prévention de l’infection – Les méthodes de prélèvement de tissus, notamment la ponction cutanée, laissent une plaie ouverte qui augmente le risque d’infection. Pour atténuer ce risque, il faut refermer les plaies à l’aide d’une colle stérile, comme NexabandMD, qui agit comme un bandage imperméable.
- Suivi et réintroduction des poissons – Après avoir prélevé les échantillons de tissus, les poissons sont remis dans le contenant d’eau oxygénée jusqu’à ce qu’ils semblent avoir bien récupéré et nagent normalement, puis ils sont relâchés dans le milieu récepteur.
- Analyse chimique – Le choix de la méthode analytique doit tenir compte de l’exactitude des mesures chimiques pour les petites quantités de tissu. La spectrophotométrie d’absorption atomique (vapeur froide) nécessite un échantillon d’au moins 100 mg. La spectrométrie de fluorescence atomique (vapeur froide) a de plus faibles limites de détection et convient mieux au dosage des concentrations de mercure dans de petites quantités de tissu. La spectrométrie d’absorption atomique par combustion avec amalgamation à l’or est une méthode simple et rapide qui permet de doser le mercure total dans de petites quantités de tissu (Cizdziel et al., 2002).
3.12 Références
Bailey, R.C., M.G. Kennedy, M.Z. Dervish et R.M. Taylor. 1998. « Biological assessment of freshwater ecosystems using a reference condition approach: Comparing predicted and actual benthic invertebrate communities in Yukon streams », Freshwater Biology, 39 : 765-774.
Baker, R. 2002. Fish Mercury Database Summary – 2001, British Columbia. Préparé par Aqualibrium Environmental Consulting Group (maintenant Azimuth Consulting Group, Vancouver BC) pour BC Hydro.
Baker, R.F., P.J. Blanchfield, M.J. Paterson, R.J. Flett et L. Wesson. 2004. « Evaluation of nonlethal methods for the analysis of mercury in fish tissue », Transactions of the American Fisheries Society, 33 : 568-576.
Barnthouse, L.W., G.W. Suter II et A.E. Rosen. 1989. « Inferring population-level significance from individual-level effects: An extrapolation from fisheries science to ecotoxicology », dans G.W. Sutter II et M.A. Lewis (éd.), Aquatic Toxicology and Environmental Fate, 11th Edition. Philadelphia (PA), American Society for Testing and Materials. ASTM STP 1001, pp. 289-300.
Barrett, T.J., et K.R. Munkittrick. 2010. « Seasonal reproductive patterns and recommended sampling times for sentinel fish species used in environmental effects monitoring programs in Canada », Environmental Reviews, 18 : 115-135.
Bloom, N.S. 1992. « On the chemical form of mercury in edible fish and marine invertebrate tissue », Canadian Journal of Fisheries and Aquatic Sciences, 49 : 1010-1017.
Brasfield, S.M. 2007. « Investigating and interpreting reduced reproductive performance in fish inhabiting streams adjacent to agricultural operations ». Saint-Jean (N.-B.), Université du Nouveau-Brunswick. Thèse de doctorat.
Carroll, L. 2007. « The reproductive cycle of the redbelly dace (Phoxinus eos) ». Saint-Jean (N.-B.), Université du Nouveau-Brunswick, Département de biologie. Mémoire de spécialisation.
Cizdziel, J.V., T.A. Hinners et E.M. Heithmar. 2002. « Determination of total mercury in fish tissues using combustion atomic absorption spectrometry with gold amalgamation », Water Air and Soil Pollution, 135 : 355-370.
Clarkson, T.W. 1994. « The toxicology of mercury and its compounds », dans C.J. Watras et J.W. Huckabee (éd.), Mercury Pollution: Integration and Synthesis. Boca Raton (FL), Lewis Publishers.
Coad, B.W., H. Waszczuk et I. Labignan. 1995. Encyclopedia of Canadian Fishes. Musée canadien de la nature et Canadian Sportfishing Productions Inc. 928 pages.
Dubé, M.G., G.A. Benoy et L.I. Wassenaar. 2006. « Contrasting pathways of assimilation: Stable isotope assessment of fish exposure to pulp mill effluents », Journal of Environmental Quality, 35 : 1884-1893.
Environnement Canada. 1997. Fish Survey Working Group Final Report: Recommendations from Cycle 1 Review. EEM/1997/6.
ETIMA – Évaluation des techniques de mesure d’impacts en milieu aquatique. 1997. Technical Evaluation of Molluscs as a Biomonitoring Tool for the Canadian Mining Industry. Préparé par Robin Stewart et Diane F. Malley pour le Programme d’évaluation des techniques de mesure d’impacts en milieu aquatique (ETIMA), Centre canadien de la technologie des minéraux et de l’énergie (CANMET), Ressources naturelles Canada.
ETIMA – Évaluation des techniques de mesure d’impacts en milieu aquatique. 1998. Technical Evaluation of Fish Methods in Environmental Monitoring for the Mining Industry in Canada. Préparé par EVS Environment Consultants pour le Programme d’évaluation des techniques de mesure d’impacts en milieu aquatique (ETIMA), Centre canadien de la technologie des minéraux et de l’énergie (CANMET), Ressources naturelles Canada.
Farwell, A. 1999. « Stable isotope study of riverine benthic food webs influenced by anthropogenic developments ». Guelph (Ont.), Université de Guelph, Département de biologie environnementale. Thèse de doctorat.
Galloway, B.J., et K.R. Munkittrick. 2006. « Influence of seasonal changes in relative liver size, condition, relative gonad size and variability in ovarian development in multiple spawning fish species used in environmental monitoring programmes », Journal of Fish Biology, 69 : 1788-1806.
Galloway, B.J., K.R. Munkittrick, S. Currie, M.A. Gray, R.A. Curry et C.S. Wood. 2003. « Examination of the responses of slimy sculpin (Cottus cognatus) and white sucker (Catostomus commersoni) collected on the Saint John River (Canada) downstream of pulp mill, paper mill, and sewage discharges », Environmental Toxicology and Chemistry, 22 : 2898-2907.
Galloway, B.J., K.R. Munkittrick, R.A. Curry, C.S. Wood et S. Dunn. 2004. « Identifying a suitable fish species for monitoring multiple effluents in the Upper Saint John River, Canada », dans D.L. Borton, T.J. Hall, R.P. Fisher et J.F. Thomas (éd.), Pulp and Paper Mill Effluent Environmental Fate and Effects. Lancaster (PA), DesTech Publications. Pp. 169-181.
Gray, M.A., et K.R. Munkittrick. 2005. « An effects-based assessment of slimy sculpin (Cottus cognatus) populations in agricultural regions of northwestern New Brunswick », Water Quality Research Journal of Canada, 40 : 16-27.
Gray, M.A., R.A. Curry et K.R. Munkittrick. 2002. « Non-lethal sampling methods for assessing environmental impacts using a small-bodied sentinel fish species », Water Quality Research Journal of Canada, 37 : 195-211.
Gray, M.A., R.A. Cunjak et K.R. Munkittrick. 2004. « Site fidelity of slimy sculpin (Cottus cognatus): Insights from stable carbon and nitrogen analysis », Canadian Journal of Fisheries and Aquatic Sciences, 61 : 1717-1722.
Gray, M.A., R.A. Curry et K.R. Munkittrick. 2005. « Impacts of nonpoint inputs from potato farming on populations of slimy sculpin (Cottus cognatus) », Environmental Toxicology and Chemistry, 24 : 2291-2298.
Green, R.H. 1989. « Power analysis and practical strategies for environmental monitoring », Environmental Research, 50 : 195-205.
Henderson, B.A., N. Collins, G.E. Morgan et A. Vaillancourt. 2003. « Sexual size dimorphism of walleye (Stizostedion vitreum vitreum) », Canadian Journal of Fisheries and Aquatic Sciences, 60 : 1345-1352.
Hodson, P.V., B.R. Blunt et D.M. Whittle.1984. « Monitoring lead exposure of fish », dans V.W. Cairns, P.V. Hodson et J.O. Nriagu (éd.), Contaminant Effects of Fisheries. New York (NY), John Wiley and Sons. Pp. 87-98.
Jenkins, R.E., et N.M. Burkhead. 1993. Freshwater Fishes of Virginia. Bethesda (MD), American Fisheries Society. 1079 pages.
Lange, T.R., H.E. Royals et L.L. Connor. 1994. « Mercury accumulation in largemouth bass (Micropterus salmoides) in a Florida lake », Archives of Environmental Contamination and Toxicology, 27 : 466-471.
Larsson, D.G.J., et L. Forlin. 2002. « Male-biased sex ratios of fish embryos near a pulp mill: Temporary recovery after a short-term shutdown », Environmental Health Perspectives, 110 : 739-742.
Larsson, D.G.J., H. Hallman et L. Forlin. 2000. « More male fish embryos near a pulp mill », Environmental Toxicology and Chemistry, 19 : 2911-2917.
Larsson, D.G.J., I. Mayer, S.J. Hyllner et L. Forlin. 2002. « Seasonal variations of vitelline envelope proteins, vitellogenin, and sex steroids in male and female eelpout (Zoarces viviparus) », General and Comparative Endocrinology, 125 : 184-196.
Mackay, W.C., G.R. Ash et H.J. Norris (éd.). 1990. Fish Ageing Methods for Alberta. Edmonton (Alb.), R.L. & L. Environmental Services Ltd. en collaboration avec l’Alberta Fish and Wildlife Division et l’Université de l’Alberta.
McMaster, M.E., M. Frank, K.R. Munkittrick, R. Riffon et C. Wood. 2002. « Follow-up studies addressing questions identified during cycle one of the adult fish survey of the pulp and paper EEM program », Water Quality Research Journal of Canada, 37 (1) : 133-153.
McMullin, V.A., K.R. Munkittrick et D.A. Methven. 2009. « Latitudinal variability in lunar spawning rhythms: Absence of a lunar patter in the Northern Mummichog (Fundulus heteroclitus macrolepidotum Walbaum) », Journal of Fish Biology, 75 (4) : 885-900.
Minns, C.K. 1995. « Allometry of home range size in lake and river fishes », Canadian Journal of Fisheries and Aquatic Sciences, 52 : 1499-1508.
MRNO – Ministère des Richesses naturelles de l’Ontario. 1994a. « Nearshore community index netting (NSCIN): Indexing the abundance of the warm water fish community », FAU Update 94-1, Fisheries Assessment Unit Newsletter. Sutton West (Ont.), Lake Simcoe Fisheries Assessment Unit.
MRNO – Ministère des Richesses naturelles de l’Ontario. 1994b. « Spring littoral index netting (SLIN): Indexing the abundance of the coldwater fish community », FAU Update 94-2, Fisheries Assessment Unit Newsletter. Bracebridge (Ont.), Muskoka Lakes Fisheries Assessment Unit.
Munkittrick, K.R. 1992. « A review and evaluation of study design considerations for site-specificity in assessing the health of fish populations », Journal of Aquatic Ecosystem Health, 1 : 283-292.
Munkittrick, K.R., et M.E. McMaster. 2000. « Assessment of multiple stressors in aquatic ecosystems by directed assessment of cumulative effects using fish populations », dans S.A. Ferenc et J.A. Foran (éd.), Multiple Stressors in Ecological Risk and Impact Assessment: Approach to Risk Estimation. Pensacola (FL), SETAC Press. Pp. 27-65.
Munkittrick, K.R., M. McMaster, G. Van Der Kraak, C. Portt, W. Gibbons, A. Farwell et M. Gray. 2000. Development of Methods for Effects-Based Cumulative Effects Assessment Using Fish Populations: Moose River Project. Pensacola (FL), SETAC Press. xviii + 236 pages.
Munkittrick, K.R., S.A. McGeachy, M.E. McMaster et S.C. Courtenay. 2002. « Overview of freshwater fish studies from the pulp and paper environmental effects monitoring program », Water Quality Research Journal of Canada, 37 : 49-77.
Munkittrick, K.R., C.J. Arens, R.B. Lowell et G.P. Kaminski. 2009. « A review of potential methods for determining critical effect size for designing environmental monitoring programs », Environmental Toxicology and Chemistry, 28 : 1361-1371.
Nelson, J.S., et M.J. Paetz. 1992. The Fishes of Alberta. Calgary (Alb.), University of Calgary Press.
Nielsen, L.A., et D.L. Johnson. 1983. Fisheries Techniques. Bethesda (MD), American Fisheries Society.
Peterson, S.A., J. Van Sickle, R.M. Hughes, J.A. Schacher et S.F. Echols. 2005. « A biopsy procedure for determining filet and predicting whole-fish mercury concentration », Archives of Environmental Contamination and Toxicology, 48 : 99-107.
Portt, C.B., G.A. Coker, D.L. Ming et R.G. Randall. 2006. A Review of Fish Sampling Methods Commonly Used in Canadian Freshwater Habitats. Rapport technique canadien des sciences halieutiques et aquatiques, no 2604. No de cat. Fs97-6/2604E.
Randall, R.C., H. Lee II, R.J. Ozretich, J.L. Lake et R.J. Pruell. 1991. « Evaluation of selected lipid methods for normalizing pollutant bioaccumulation », Environmental Toxicology and Chemistry, 10 : 1431-1436.
Roberts, W.E. 1988. « The sculpins of Alberta », Alberta Naturalist, 18 : 121-127.
Salazar, M., et S. Salazar. 2001. Standard Guide for Conducting In-Situ Field Bioassays with Caged Marine, Estuarine and Freshwater Bivalves. Philadelphia (PA), American Society for Testing and Materials (ASTM), 2001 Annual Book of ASTM Standards.
Saouter, E., L. Hare, P.G.C. Campbell, A. Boudou et F. Ribeyre. 1993. « Mercury accumulation in the burrowing mayfly Hexagenia rigida (Ephemeroptera) exposed to CH3HgCl or HgCl2 in water and sediment », Water Research, 27 : 1041-1048.
Schetagne, R., et R. Verdon. 1999. « Mercury in fish of natural lakes of northern Quebec », dans M. Lucotte, R. Schetagne, N. Thérien, C. Langlois et A. Tremblay (éd.), Mercury in the Biogeochemical Cycle: Natural Environments and Hydroelectric Reservoirs of Northern Quebec. Springer-Verlag. Pp. 115–130.
Schetagne, R., J.-F. Doyon et R. Verdon. 1996. Rapport synthèse : évolution des teneurs en mercure dans les poissons du complexe La Grande (1978-1994). Rapport conjoint d’Hydro-Québec et du groupe-conseil Génivar inc. Montréal (Qc).143 pages et annexes.
Schneider, J.C. (éd.). 2000. Manual of Fisheries Survey Methods II: With Periodic Updates. Ann Arbor (MI), Michigan Department of Natural Resources, Fisheries Special Report No. 25.
Scott, W.B. 1967. Freshwater Fishes of Eastern Canada. Toronto (Ont.), University of Toronto Press. 137 pages.
Scott, W.B., et E.J. Crossman. 1974. Les poissons d’eau douce du Canada. Bulletin – Office des recherches sur les pêcheries du Canada, no 184. Ottawa (Ont.), Pêches et Océans Canada. 1026 pages.
Secor, D.H., A.R. Henderson, A. Zapalo et P.M. Piccoli. 1995. « Can otolith microchemistry chart patterns of migration and habitat utilization in anadromous fishes? », Journal of Experimental Marine Biology and Ecology, 192 : 15-33.
Shuter, B.J. 1990. « Population-level indicators of stress », American Fisheries Society Symposium, 8 : 145-166.
Swanson, S.M. 1993. Wapiti/Smoky River Ecosystem Study. Grand Prairie (Alb.), Sentar Consultants Ltd, pour Procter and Gamble Ltd. et Weyerhaeuser Canada Ltd. 176 pages.
Tremblay, G., J.-F. Doyon et R. Schetagne. 1998. Réseau de suivi environnemental du complexe La Grande : Démarche méthodologique relative au suivi des teneurs en mercure des poissons. Rapport conjoint de la direction principale Communication et Environnement d’Hydro-Québec et du groupe-conseil Génivar Inc. 41 pages.
Tyus, H.M., W.C. Starnes, C.A. Karp et J.F. Saunders III. 1999. « Effects of invasive tissue collection on rainbow trout, razorback and bonytail chub », North American Journal of Fisheries Management, 19 : 848-855.
Ward, S.M., et R.M. Neumann. 1999. « Seasonal variation in concentrations in mercury in axial muscle tissue of largemouth bass », North American Journal of Fisheries Management, 19 : 89-96.
Tableaux
Le tableau 3-1 présente le degré de précision attendu et les statistiques sommaires des valeurs mesurées lors de l’étude des populations de poissons. Les valeurs exigées devant être évaluées sont notamment la longueur, le poids corporel total, l’âge, le poids des gonades, le poids des œufs, la fécondité, le poids du foie ou de l’hépatopancréas, les anomalies et le sexe. Le degré de précision attendu est indiqué pour chaque valeur exigée de même que les statistiques sommaires à fournir.
Le tableau 3-2 présente les structures suggérées pour la détermination de l’âge d’espèces de poissons au Canada. Les espèces de poissons sont catégorisées en fonction d’une structure commune. Des commentaires sont indiqués concernant les rapports entre les structures pour la détermination de l’âge et les espèces de poissons.
Le tableau 3-3 présente les indicateurs et les critères d’effets utilisés pour les différents types d’études des poissons. Les principaux indicateurs d’effets comprennent la survie, la croissance, la reproduction et la condition. Chaque indicateur d’effet est accompagné des critères d’effets et d’appui pour les études létales, des critères d’effets et d’appui pour les études non létales, ainsi que des critères d’effets et d’appui pour les études des mollusques sentinelles.
Le tableau 3-4 présente des généralités et les périodes optimales suggérées pour l’échantillonnage des espèces de poissons utilisées dans les études de suivi des effets sur l’environnement. Les périodes d’échantillonnage sont établies en fonction du type de reproducteurs. Selon le type de reproducteurs et la période d’échantillonnage, la relation entre le poids des gonades et le poids corporel des femelles de la zone de référence est indiquée.
Le tableau 3-5 présente les espèces de poissons couramment utilisées dans les ESEE, les aspects à considérer dans la conception du plan d’étude, ainsi que les périodes d’échantillonnage recommandées. Les poissons sont identifiés par famille, par espèce et par nom scientifique.
Le tableau 3-6 présente le format suggéré pour présenter, en deux parties, les paramètres et les résultats des analyses de régression requis pour l’analyse de l’étude des poissons. Le tableau A présente le format suggéré pour indiquer les sommaires des paramètres, tandis que le tableau B illustre le format suggéré pour présenter les résultats des analyses de régression.
Retournez à la table des matières
Chapitre 4
4. Effets sur l’habitat du poisson : étude de la communauté d’invertébrés benthiques
- 4.2.1 Première phase et phases subséquentes des ESEE
- 4.2.2 Ampleur et portée géographique
- 4.2.3 Recherche des causes
4.3 Considérations relatives au plan d’étude de la communauté d’invertébrés benthiques
- 4.3.1 Analyse de puissance et taille des échantillons
- 4.3.2 Facteurs de confusion
- 4.3.3 Uniformisation de la terminologie
- 4.3.4 Indication de l’emplacement des stations d’échantillonnage
- 4.3.5 Plans d’échantillonnage recommandés
- 4.3.6 Répartition des zones de référence et des zones exposées selon les phases de l’ESEE
- 4.3.7 Sélection d’habitats pertinents sur le plan écologique
- 4.3.8 Sélection des saisons d’échantillonnage pertinentes sur le plan écologique
4.4 Aspects statistiques pour les plans d’étude
- 4.4.1 Détermination de l’effort d’échantillonnage pour l’ACR
- 4.4.2 Détermination de l’effort d’échantillonnage pour le sous-échantillonnage sur le terrain
- 4.4.3 Utilisation d’ellipses de probabilité pour les plans ACR
4.5 Méthodes de terrain pour le suivi de la communauté d’invertébrés benthiques
- 4.5.1 Maillage des dispositifs d’échantillonnage
- 4.5.2 Équipement d’échantillonnage
- 4.5.3 Substrats artificiels
- 4.5.4 Équipement d’échantillonnage dans les habitats marins et estuariens
- 4.5.5 Récipients à échantillons
- 4.5.6 Fixation et conservation des spécimens
- 4.5.7 Assurance et contrôle de la qualité des travaux de terrain
- 4.6.1 Programme de certification de la NABS
- 4.6.2 Niveau d’identification taxinomique
- 4.6.3 Collections de référence
- 4.6.4 AQ/CQ pour le traitement des échantillons d’invertébrés benthiques en laboratoire
4.7 Évaluation et interprétation des données
4.8 Exigences relatives à la présentation des données
4.9 Critères d’effet et critères d’appui de la communauté d’invertébrés benthiques
- 4.11.1 Application des approches fondées sur le poids de la preuve à la recherche des causes des effets
- 4.11.2 Essais de toxicité létale et sublétale
- 4.11.3 Analyse de carottes de sédiments pour l’étude des tendances historiques
- 4.11.4 Autres paramètres associés aux invertébrés benthiques et autres organismes
Liste des tableaux
- Tableau 4-1 : Plans d’études recommandés pour l’échantillonnage
- Tableau 4-2 : Clés taxinomiques - Invertébrés benthiques dulcicoles
- Tableau 4-3 : Niveaux de résolution taxinomique recommandés pour les invertébrés benthiques marins (approche « niveau taxinomique le plus bas »)
- Tableau 4-4 : Clés taxinomiques – Invertébrés benthiques marins et estuariens du Canada
Liste des figures
- Figure 4-1 : Exemples de l’échelle spatiale d’une zone, d’une station répétée et d’un sous-échantillon de terrain pour un plan d’étude de type contrôle-impact
- Figure 4-2 : Plans d’étude contrôle-impact
- Figure 4-3 : Plans d’étude par gradients
- Figure 4-4 : Approche des conditions de référence
- Figure 4-5 : Niveaux de stress entraînant une perturbation déduits à partir de la position des sites de référence dans un espace d’ordination hybride multidimensionnel
4. Effets sur l’habitat du poisson : étude de la communauté d’invertébrés benthiques
4.1 Aperçu
L’étude de la communauté d’invertébrés benthiques réalisée aux fins des études de suivi des effets sur l’environnement (ESEE) a pour objet de déterminer l’ampleur et la portée géographique de la dégradation de l’habitat attribuable au rejet de l’effluent, et de fournir une évaluation des ressources alimentaires disponibles pour les poissons choisis dans l’étude des poissons (chapitre 3). Toutefois, puisqu’elle ne comprend pas une comparaison directe du régime alimentaire des poissons et des invertébrés benthiques, l’étude de la communauté d’invertébrés benthiques sert principalement à étudier la dégradation de l’habitat. Par conséquent, l’objectif de l’étude de la communauté benthique est de déterminer s’il y a des différences structurales (p. ex., densité totale des invertébrés, nombre de taxons, changements de la structure de dominance des taxons) entre les communautés d’invertébrés situées près du point de rejet final de l’effluent de la mine de métaux et les communautés de référence. Le plan d’étude sera différent selon que la mine de métaux rejette son effluent en eaux douces, estuariennes ou marines (voir la section 4.3). Par ailleurs, le plan d’étude des invertébrés benthiques ne correspond pas nécessairement à celui utilisé pour l’étude des poissons adultes ou l’évaluation de la qualité de l’eau, en raison des différents critères et difficultés inhérents à chaque protocole d’échantillonnage.
Si l’étude sur la communauté des invertébrés benthiques est effectuée dans une zone qui le permet, des échantillons de sédiments sont prélevés et la distribution granulométrique et la teneur en carbone organique total des sédiments de ceux –ci sont déterminées (Règlement sur les effluents des mines de métaux [REMM], annexe 5, sous-alinéa 16a)(iii)). Des échantillons d’eau doivent aussi être prélevés lorsque des études sur les invertébrés benthiques sont réalisées (REMM, annexe 5, sous-alinéa 7a)(ii)). Pour en savoir plus sur l’échantillonnage de l’eau et des sédiments, veuillez consulter les chapitres 5 et 7.
Le présent chapitre a pour objet de fournir des directives sur le plan d’étude et sur l’interprétation des résultats d’une étude de la communauté d’invertébrés benthiques, compte tenu des exigences des ESEE. Plus particulièrement, le présent document aborde 1) les divers plans d’étude; 2) la normalisation des méthodes; 3) les méthodes d’analyse des données appropriées au plan d’étude. Le Règlement sur les effluents des mines de métaux (REMM, annexe 5) établit les exigences et les échéanciers pour les études des communautés d’invertébrés benthiques. Le cadre général du Programme d’ESEE est présenté dans le chapitre 1 du présent guide technique.
Parmi les descripteurs des communautés d’invertébrés benthiques utilisés pour déterminer les effets (critères d’effet), figurent la densité totale des invertébrés benthiques, la richesse des taxons, l’indice de régularité (de Simpson) et l’indice de similarité (de Bray-Curtis) [REMM, annexe 5, sous-alinéa 16a)(iii)]. D’autres descripteurs des communautés (critères d’appui) susceptibles de faciliter l’interprétation des résultats pourraient être mesurés et présentés, mais ne sont pas des critères requis aux fins de la détermination des effets. Parmi ces critères d’appui figurent l’indice de diversité de Simpson, la densité des taxons (familles), la proportion des taxons (familles) et la présence/absence de taxons (familles). Pour en savoir plus sur les critères d’effet et les critères d’appui des communautés d’invertébrés benthiques, veuillez consulter la section 4.9.
4.2 Phases des ESEE
4.2.1 Première phase et phases subséquentes des ESEE
La première phase de l’ESEE doit servir à caractériser les communautés benthiques des principaux habitats susceptibles d’être touchés par l’effluent d’une mine de métaux et à établir les conditions de référence requises aux fins de la comparaison des données obtenues au cours des phases suivantes. Il permet également de faire une évaluation critique de la nécessité de raffiner le plan d’étude des phases ultérieures ou d’ajouter d’autres méthodes de suivi. Nous énumérons ci-après les exigences relatives au plan d’étude à respecter pour atteindre les objectifs de l’étude de la communauté d’invertébrés benthiques s’appliquant aux mines de métaux de la phase 1.
L’étude de la phase 1 vise notamment à définir des zones qui sont relativement homogènes quant à la classe d’habitat et qui présentent une gamme particulière de degrés d’exposition à l’effluent de la mine de métaux.
Le plan d’étude de la première étude de la communauté d’invertébrés benthiques devrait comprendre :
- l’échantillonnage pendant une saison représentative sur le plan écologique;
- l’échantillonnage dans une zone de référence et dans une zone fortement exposée (p. ex., zone la plus proche du point de rejet de l’effluent);
- l’échantillonnage dans des habitats écologiquement représentatifs;
- un des sept plans d’échantillonnage sélectionné selon les caractéristiques des sites (tableau 4-1);
- les variables environnementales propres à chaque site qui seront mesurées;
- l’uniformisation des méthodes de terrain et de laboratoire.
Les phases subséquentes de l’ESEE servent à confirmer les résultats des phases précédentes, à raffiner au besoin les méthodes de suivi et à déterminer les facteurs responsables des effets détectés.
4.2.2 Ampleur et portée géographique
Les études sur l’ampleur et la portée géographique visent à déterminer l’étendue spatiale des effets sur la communauté d’invertébrés benthiques qui sont causés par l’effluent d’une mine de métaux. Le chapitre 1 présente des renseignements sur les mines de métaux menant de telles études et sur les seuils critiques d’effets (SCE) établis par Environnement Canada afin de cibler les activités de suivi additionnelles.
Les plans d’étude sur l’ampleur et la portée géographique devraient comprendre :
- les mêmes éléments des plans d’étude et d’échantillonnage que ceux du suivi précédent, mais une couverture géographique plus grande (zones d’échantillonnage additionnelles);
- une évaluation de la pertinence des zones échantillonnées antérieurement. La nouvelle couverture géographique peut comprendre des types d’habitat et de substrat additionnels (par ex., cours d’eau ou lacs d’un ordre supérieur, ou zones marines ou estuariennes allant des zones intertidales aux zones infralittorales). Si ces nouveaux habitats n’étaient pas représentés dans les zones de référence utilisées dans le cadre du suivi précédent, il convient de réévaluer la pertinence de ces zones de référence;
- l’échantillonnage d’autres habitats, saisons ou stades du cycle vital des invertébrés présentant un intérêt écologique, si cela est approprié pour l’évaluation de l’ampleur des effets détectés;
- la possibilité de considérer d’autres indicateurs biotiques comme outils d’évaluation de l’ampleur des effets, si l’utilisation de tels indicateurs paraît appropriée et utile. Parmi les indicateurs susceptibles d’être utilisés à cette fin, mentionnons la biomasse et la composition taxinomique des communautés de périphyton, de phytoplancton, de macrophytes ou de zooplancton, l’échantillonnage des invertébrés à d’autres stades du cycle vital, l’identification plus fine des invertébrés, la biomasse des invertébrés, la production secondaire, d’autres habitats vulnérables ou saisons, et les essais de toxicité des sédiments et de l’eau.
Lors d’études sur l’ampleur et la portée géographique, les questions suivantes pourraient être abordées :
Ampleur :
- Combien de groupes taxinomiques sont touchés?
- Quelle est l’ampleur des effets (p. ex., importance de la variation de la densité) sur les groupes taxinomiques touchés?
- Les effets sont-ils observés chez d’autres organismes benthiques, comme le périphyton ou les macrophytes, présents dans la zone de référence et vraisemblablement présents dans la zone exposée? Il est à noter que cette question n’a pas à être abordée dans le cadre du Programme d’ESEE, mais pourrait faire partie d’une étude de recherche des causes.
Portée géographique :
- Quelle est la superficie du territoire touché?
- Les communautés d’invertébrés benthiques se trouvant aux stations d’échantillonnage les plus éloignées du point de rejet de l’effluent sont-elles similaires à celles des stations de référence?
4.2.3 Recherche des causes
Pour en savoir plus sur la recherche des causes, veuillez consulter le chapitre 12 du présent guide.
4.3 Considérations relatives au plan d’étude de la communauté d’invertébrés benthiques
Diverses considérations et recommandations devant être examinées au cours du processus d’élaboration du plan d’étude sont analysées ci-dessous. Les plans pour les études sur la communauté d’invertébrés benthiques doivent être appropriés au site visé. Les sept plans recommandés sont décrits à la section 4.3.5. Ils cherchent tous à prendre en compte les contraintes possibles et les facteurs liés à la disponibilité et la distribution spatiale des zones de référence convenables ainsi que sur l’étendue et l’hétérogénéité des zones exposées potentielles. Il faut souligner que, bien que ces plans d’étude soient considérés comme les plans existants, d’application générale, les plus faciles à suivre, il ne s’agit pas d’une liste exhaustive des moyens possibles de réaliser une étude de la communauté d’invertébrés benthiques. Il est présumé que chaque responsable d’étude possède suffisamment de connaissances scientifiques pour appliquer les présentes recommandations avec toute la rigueur voulue et déterminer si certaines conditions particulières justifient l’apport de modifications aux plans d’étude.
4.3.1 Analyse de puissance et taille des échantillons
Pour une description détaillée de l’analyse de puissance, veuillez consulter le chapitre 8 du présent guide technique.
Dans le cadre de la première phase de l’ESEE, il est recommendé que l’étude comporte ce qui suit :
- au moins deux zones d’étude : la zone de référence et une zone fortement exposée à l’effluent;
- au moins cinq station répétées dans chacune des deux zones d’étude;
- au moins trois sous-échantillons de terrain à prélever dans chacune des stations.
En l’absence d’information a priori sur la densité et la variabilité des populations d’invertébrés à l’intérieur d’une station, on fixe arbitrairement à trois le nombre de sous-échantillons requis pour refléter avec exactitude la densité réelle à chacune des stations. Le nombre total d’échantillons d’invertébrés benthiques recommandé s’élève donc à 30 pour les mines de métaux qui mènent leur première étude de suivi (phase 1). Lorsque des plans d’étude autre que le plan contrôle-impact sont requis, il est essentiel de conserver le même effort d’échantillonnage minimal, bien que la répartition des zones, des stations et des échantillons puisse différer.
En outre, il est important que les stations soient réparties de manière que seule la classe dominante d’habitat soit échantillonnée (voir la section 4.3.7). Le fait de limiter l’échantillonnage à l’habitat dominant réduit la variation des données. Les zones d’étude caractérisées par des habitats extrêmement hétérogènes ou qui présentent deux habitats d’importance égale pourraient exiger un effort d’échantillonnage supérieur à l’effort minimal recommandé ci-dessus. Il est souhaitable de dépasser les exigences minimales liées à l’effort d’échantillonnage. Dans ce cas, l’une ou l’autre des mesures suivantes pourraient être mises en œuvre : ajout d’une ou de plusieurs zones de référence, ajout d’une zone peu exposée à l’effluent ou très peu exposée à l’effluent, augmentation du nombre de stations par zone ou augmentation du nombre de sous-échantillons de terrain par station. La décision d’accroître l’effort d’échantillonnage devrait être prise en consultation avec le coordonnateur régional.
4.3.2 Facteurs de confusion
Il convient de noter que le Programme d’ESEE des mines de métaux ne charge pas l’industrie des mines de métaux de déterminer les effets des rejets d’autres industries ou sources de pollution sur les communautés d’invertébrés benthiques lorsqu’en présence de rejets multiples.
Est-il possible d’éliminer les effets de certains facteurs de confusion en modifiant le plan d’étude?
L’interprétation des effets sur la communauté d’invertébrés benthiques peut être difficile si des facteurs de confusion sont présents dans la zone à l’étude. Un examen minutieux des données historiques ou existantes et des informations amassées durant la caractérisation du site afin de mieux éclairer le choix des composantes des plans d’étude et d’échantillonnage peut souvent aider à résoudre les problèmes posés par les facteurs de confusion. Pour en savoir plus sur les facteurs de confusion, veuillez consulter Hauer et Lamberti (1996), Culp et al. (2000) et Lowell et al. (2000).
Ces facteurs peuvent être regroupés dans quatre catégories :
Variables environnementales : les variables environnementales peuvent fausser l’interprétation des effets sur la communauté d’invertébrés benthiques lorsqu’il n’est pas possible de distinguer les effets de l’effluent d’une mine de métaux des effets engendrés par les différences de certains paramètres de l’habitat naturel. Pour tenter de résoudre ce problème, le plan peut être modifié de manière à mieux caractériser les conditions de référence et à inclure tous les types d’habitat. À cette fin, des zones de référence peuvent être choisies dans des bassins hydrographiques adjacents ou plus éloignés ou l’échantillonnage de zones de référence additionnelles peut être effectué (c.-à-d. en délaissant l’approche contrôle-impact simple pour un plan plus approprié – voir les figures 4-3, 4-4 et le tableau 4-1). Parmi les facteurs de confusion potentiels dont les effets peuvent être éliminés par l’adoption de plans d’étude et d’échantillonnage plus appropriés, mentionnons les gradients de profondeur, la granulométrie du substrat, la dilution rapide de l’effluent, les événements interannuels ou rares et les fluctuations saisonnières ou à long terme de paramètres physiques comme la température ou les régimes d’écoulement. Il peut être possible d’évaluer l’influence des variations des paramètres environnementaux ou d’habitat en examinant les corrélations entre les mesures de ces paramètres et celles des indicateurs benthiques.
Rejets multiples ou effets historiques : l’interprétation des résultats peut également se révéler difficile lorsque les zones exposées à divers degrés à l’effluent d’une mine de métaux sont également exposées à d’autres effluents ou facteurs de stress à des degrés divers ou encore lorsque les habitats ont été perturbés dans le passé par la construction d’ouvrages tels que des digues ou des bassins de retenue. Lorsque c’est possible, le changement de l’emplacement des stations d’échantillonnage pourrait remédier au problème. Dans les zones sédimentaires, la collecte de carottes de sédiments peut également aider à résoudre les problèmes posés par les facteurs de confusion résultant d’effets historiques (pour de plus amples renseignements sur le suivi des sédiments, voir le chapitre 7).
Moment de l’échantillonnage : la période de l’année ou l’année durant laquelle l’échantillonnage est réalisé peut compliquer l’interprétation des effets de l’effluent sur la communauté d’invertébrés benthiques. Une bonne connaissance de la phénologie des diverses espèces d’invertébrés formant la communauté benthique (c.-à-d. la relation entre le climat et les caractéristiques du cycle vital des invertébrés) et un examen minutieux des données recueillies au cours des années antérieures dans les zones de référence permettent normalement de tenir compte de ces facteurs.
Méthodes d’échantillonnage : si les méthodes d’échantillonnage courantes (types de dispositif d’échantillonnage, dimensions des mailles ou identification réalisée selon des niveaux de résolution taxinomique différents) n’ont pas été utilisées de manière systématique dans une même étude ou dans plusieurs études consécutives, les effets de l’effluent sur les communautés d’invertébrés benthiques pourraient être masqués. Il peut être possible de procéder à un examen plus approfondi des données et d’utiliser un niveau de résolution taxinomique comparable en ramenant toutes les identifications à un niveau commun plus élevé. Toutefois, dans bien des cas, une révision complète du plan d’étude afin de permettre une utilisation cohérente des méthodes d’échantillonnage courantes peut être nécessaire afin de résoudre ces problèmes. Enfin, si des conditions environnementales ou divers aspects logistiques ne permettent pas de mener à bien l’échantillonnage correctement et en toute sécurité, l’utilisation d’autres méthodes peut être envisagée.
À l’heure actuelle, la seule autre méthode recommandée pour le volet des invertébrés benthiques est l’utilisation de mésocosmes afin de mener sur le terrain des bioessais à l’échelle des communautés. La mine de métaux peut toutefois proposer d’autres méthodes de suivi, justifiables sur le plan scientifique, permettant de déterminer si l’effluent a des effets sur la communauté d’invertébrés benthiques. Les mésocosmes sont également utiles comme outil de recherche des causes (voir le chapitre 12). Leur applicabilité et les diverses méthodologies sont décrites en détail au chapitre 9. D’autres méthodes sont également décrites au chapitre 9.
4.3.3 Uniformisation de la terminologie
Aux fins du Programme d’ESEE, il est essentiel d’adopter des définitions standardisées pour désigner les lieux d’échantillonnage, afin de faciliter les évaluations régionales et nationales. La terminologie uniformisée suivante s’appliquant aux lieux d’échantillonnage devrait être adoptée et appliquée de manière cohérente et rigoureuse, et ce, pour toutes les ESEE comportant une étude de la communauté d’invertébrés benthiques. Une représentation schématique de ces termes est présentée à la figure 4-1.
La présente section définit les termes station répétée et sous-échantillon de terrain. Les zones de référence et d’exposition sont définies au chapitre 2. Pour les plans d’étude de base convenant à l’analyse de variance (ANOVA) (contrôle-impact, contrôle-impact multiple), dont les objectifs consistent à déterminer les différences entre les zones et au sein de chaque zone, chaque zone exposée et chaque zone de référence comporte un certain nombre de stations répétées (c.-à-d. les répétitions pour l’ANOVA), et chaque station répétée, un certain nombre de sous-échantillons de terrain regroupés. De la même façon, les plans d’étude par gradient ou fondés sur les conditions de référence (c.-à-d. approche fondée sur les conditions de référence [ACR]) utilisent les stations répétées comme échelle spatiale de répétition, des sous-échantillons de terrain étant recueillis au besoin (voir la section 4.3.5 pour la description de ces approches).
Le concept de zone ne s’applique pas directement au plan d’étude par gradient ou à l’approche fondée sur les conditions de référence (ACR). Lorsqu’un plan d’étude par gradient ou de l’ACR est élaboré ou utilisé, les comparaisons ne sont pas fondées sur un plan équilibré avec un nombre similaire de stations répétées dans les zones d’exposition et de référence. Par exemple, pour l’ACR, les stations exposées sont comparées individuellement à une distribution de stations de référence représentant les conditions de référence appropriées. Dans le cas des études par gradient, le manque de zones de référence ou exposées appropriées pourrait justifier le choix de ce type d’étude. Par conséquent, la terminologie propre à l’ANOVA ne s’applique pas directement à cette méthode. La section 4.3.5 présente ces plans d’études de manière plus détaillée.
De plus amples informations concernant le nombre requis de stations répétées et leur répartition en fonction de l’échelle spatiale et du plan d’étude sont fournies aux sections 4.3.5 et 4.4.2.
Sous-échantillons de terrain
Les sous-échantillons de terrain sont constitués d’invertébrés benthiques récoltés dans une superficie déterminée ou pendant une période de temps fixe (p. ex., échantillon prélevé à l’aide d’une benne, d’un carottier, d’un cylindre, d’un quadrat, d’un filet troubleau ou d’un filet en U). Afin d’assurer la répartition spatiale adéquate des sous-échantillons à l’intérieur d’une station d’échantillonnage, ils devraient être prélevés selon un plan d’échantillonnage aléatoire ou aléatoire stratifié. Aux fins des nombreuses analyses statistiques utilisées pour évaluer les effets en eau douce ou en milieu marin (section 4.9), les données de tous les sous-échantillons de terrain provenant d’une même station sont regroupées afin de fournir une seule valeur pour chaque descripteur à chaque station.
Regroupement des sous-échantillons de terrain
Le regroupement des données des sous-échantillons de terrain peut être effectué à divers moments du programme de suivi. Le moment précis où ce regroupement peut être effectué dépend de divers facteurs, dont :
- l’efficacité du traitement et de l’entreposage des échantillons de terrain (les récipients d’entreposage des échantillons de terrain ont-ils la taille requise pour recevoir des échantillons regroupés?)
- l’efficacité du tri en laboratoire (le tri d’échantillons plus petits est-il plus efficient?)
- la capacité de répondre aux questions soulevées dans le plan d’étude.
Les deux premiers facteurs, qui ont pour résultat le regroupement physique des sous-échantillons, sont essentiellement de nature logistique. Leur applicabilité devrait être établie en fonction des caractéristiques propres à chaque site et des méthodes utilisées. Il convient de noter que le regroupement physique entraîne la perte des informations se rapportant à chacun des sous-échantillons. En ce qui a trait au troisième facteur s’il s’avère nécessaire d’obtenir des informations additionnelles pour résoudre certaines questions soulevées dans le plan d’étude (p. ex., examen des aires de répartition des espèces ou évaluation de la précision des sous-échantillons de terrain), les sous-échantillons peuvent être conservés et traités individuellement. Les données non regroupées peuvent alors être utilisées pour examiner les questions posées par le plan d’étude, puis regroupées électroniquement aux fins des analyses statistiques appropriées. Pour les divers paramètres, le regroupement électronique doit être fait de façon à donner des résultats équivalents à ceux qui auraient été obtenus avec le regroupement physique des sous-échantillons de terrain. Cet aspect est particulièrement important pour le critère de la richesse des taxons. Des exemples de calcul de la densité et de la richesse des taxons à une station avec les données regroupées sont présentés ci-dessous.
Pour la densité, le calcul doit être effectué comme ceci :
Densité calculée en regroupant les sous-échantillons = (nombre dans le sous-échantillon a + nombre dans le sous-échantillon b + nombre dans le sous-échantillon c) / superficie totale des sous-échantillons a, b et c.
Il faut noter que le nombre obtenu est le même que si la densité était calculée pour chaque sous-échantillon et qu’une moyenne était effectuée.
Toutefois, le calcul de la richesse des taxons pour une station n’est pas équivalent à la moyenne de la richesse des taxons dans les trois sous-échantillons. La richesse des taxons d’une station doit être calculée comme suit :
Richesse des taxons de la station = tous les taxons observés à une station, dans tous les sous-échantillons (et non pas le nombre moyen de taxons des trois sous-échantillons).
Station répétée
Une station répétée est un site d’échantillonnage précis et fixe à l’intérieur d’une zone à l’étude. C’est une entité reconnaissable qui peut faire l’objet d’échantillonnages répétés et qui peut être définie quantitativement (p. ex., latitude et longitude, description écrite). Dans chaque type d’habitat, un certain nombre de stations répétées sont échantillonnées. L’échantillonnage de chaque station produit un échantillon composite constitué préférablement d’au moins trois sous-échantillons d’invertébrés benthiques. Les stations situées dans la zone exposée doivent être exposées au panache de l’effluent. En outre, les stations répétées doivent être suffisamment éloignées les unes des autres pour être considérées comme des répétitions au sens statistique du terme.
La superficie des stations répétées varie selon qu’elles sont situées dans des lacs, des cours d’eau ou des milieux marins côtiers. Les superficies recommandées pour les lacs et les cours d’eau sont les suivantes :
Lacs : chaque station répétée devrait mesurer au moins 10 m × 10 m et se trouver à au moins 20 m de la station la plus rapprochée.
Cours d’eau : chaque station répétée devrait comprendre un tronçon longitudinal comportant une séquence d’une fosse et un seuil et s’étalant sur une longueur équivalente à six fois la largeur à pleins bords du chenal (Leopold et al., 1964; Newbury, 1984; Leopold, 1994). La distance entre les stations situées dans un habitat similaire devrait être égale à au moins trois fois la largeur à pleins bords. Pour faire en sorte que l’échantillonnage prévu dans le cadre du Programme d’ESEE s’effectue de façon cohérente, il est recommandé d’utiliser la définition de la largeur à pleins bords proposée par Newbury et Gaboury (1993) et dans le chapitre 5 du présent guide technique. S’il est n’est pas faisable d’échantillonner une telle longueur de cours d’eau (p.ex., grands cours d’eau ou ruisseaux d’amont dont les gradients changent rapidement), on pourra alors retenir la définition de superficie d’une station répétée proposée pour les lacs (c.-à-d., site revisitable mesurant au moins 10 m × 10 m et suffisamment éloignée des stations voisines).
Milieux côtiers marins : chaque station répétée devrait être un lieu défini où il est possible, par ses dimensions, d’y revenir (c.-à-d. 10 m × 10 m). Les stations répétées doivent être espacées les unes des autres d’au moins 50 m, cette distance variant selon la superficie de la zone. Dans certains estuaires, une station répétée devrait comprendre un tronçon longitudinal qui inclut le principal habitat à échantillonner (p. ex., distance équivalente à six fois la largeur à pleins bords). Si cette longueur de tronçon n’est pas réalisable dans de grands estuaires, une définition similaire à celle proposée pour les zones côtières peut être adoptée.
Zone
Les renseignements généraux et les définitions des zones de référence et des zones exposées sont présentés au chapitre 2.
La superficie recommandée pour une zone d’étude des invertébrés benthiques diffère selon que celle-ci est située dans un lac, un cours d’eau et un estuaire. Les superficies recommandées pour les lacs et les cours d’eau sont les suivantes :
Lacs : la zone d’étude devrait mesurer au moins 100 m × 100 m et être suffisamment grande pour contenir le nombre nécessaire de stations répétées suffisamment éloignées les unes des autres.
Cours d’eau : la superficie de la zone d’étude dépend de la morphologie du cours d’eau. Cette zone devrait correspondre à un tronçon de cours d’eau suffisamment grand pour contenir le nombre nécessaire de stations répétées suffisamment éloignées les unes des autres. La longueur totale du cours d’eau contenant la zone est donc équivalente au produit du nombre de stations répétées par six fois la largeur à pleins bords. Cette longueur de tronçon devrait permettre normalement de contenir une séquence d’un seuil et une fosse (Newbury, 1984).
Estuaires : pour les estuaires relativement homogènes et de faible salinité, les exigences régissant la délimitation de la zone sont les mêmes que pour les cours d’eau. Pour les régions marines longues et étroites se prêtant à un plan de type contrôle-impact, comme certaines baies et les fjords, la zone devrait être suffisamment grande (au moins 100 × 100 m) pour inclure l’habitat homogène à échantillonner, la gamme d’exposition recherchée et le nombre nécessaire de stations répétées (suffisamment éloignées les unes des autres).
4.3.4 Indication de l’emplacement des stations d’échantillonnage
Veuillez consulter la section 2.2.3 du chapitre 2 pour obtenir des renseignements généraux sur la façon d’indiquer l’emplacement des stations d’échantillonnage.
4.3.5 Plans d’échantillonnage recommandés
Les caractéristiques propres au site doivent être prises en compte dans la sélection d’un plan pour l’étude de la communauté d’invertébrés benthiques. L’un des sept plans d’échantillonnage suivants est recommandé.
- contrôle-impact (C-I);
- contrôle-impact multiple (C-IM);
- avant-après–contrôle-impact (BACI; de l’anglais before/after-control/impact);
- gradient linéaire (GL)
- gradient radial (GR);
- gradients multiples (GM);
- approche des conditions de référence (ACR).
Des exemples de ces plans se trouvent aux figures 4-2, 4-3 et 4-4.
Ces plans se subdivisent en trois catégories fondamentales qui relèvent chacune d’une approche conceptuelle différente. Ces catégories sont les suivantes :
- les plans d’échantillonnage contrôle-impact et contrôle-impact multiple (ainsi que BACI) satisfont aux conditions d’application de l’analyse de variance et permettent de détecter d’éventuelles différences entre la zone exposée et la zone de référence.
- les plans d’échantillonnage par gradient(s) (linéaire, radial ou multiples) permettent d’examiner les changements qui surviennent dans la structure de la communauté tout au long d’un gradient physique ou d’un gradient de concentration de l’effluent. Ces plans se prêtent mieux aux analyses de régression ou de covariance (ANCOVA).
- l’approche multivariable fondée sur les conditions de référence permet de comparer des stations potentiellement « perturbées » ou exposées à des stations de référence pertinentes choisies.
Il convient de noter que les plans des deux dernières catégories se prêtent dans certaines circonstances aux analyses de variance. D’autres méthodes de suivi (p. ex., mésocosmes) sont également recommandées, mais leur utilisation doit se justifier scientifiquement. Les caractéristiques, l’applicabilité et les limites des plans d’échantillonnage susmentionnés sont brièvement présentées au tableau 4-1 et décrites de façon plus détaillée ci-dessous.
Les descriptions qui suivent s’appliquent principalement à la conception de la première phase et des phases subséquentes. Des applications spéciales permettant de déterminer l’ampleur et la portée géographique d’un effet sont présentées, le cas échéant.
Plan d’étude contrôle-impact
Le plan d’étude le plus simple à utiliser pour l’ESEE est le plan contrôle-impact (ou référence-exposition) (Green, 1979). Dans les cours d’eau et les estuaires, ce système prévoit la sélection d’au moins une zone de référence et d’une série de zones exposées en aval. Pour le suivi régulier, il devrait y avoir au moins une zone fortement exposée à l’effluent. Les degrés d’exposition à l’effluent diffèrent entre les zones exposées et les zones de référence, mais ils devraient être comparables d’une station à l’autre dans une zone donnée. Les classes d’habitat échantillonnées devraient être uniformes d’une zone à l’autre et, exception faite du degré d’exposition, être le plus similaires possible relativement à des caractéristiques comme le substrat, la profondeur, la vitesse du courant, les propriétés de l’eau, les gradients environnementaux, l’utilisation des terres, etc. Dans le premier plan d’étude, l’analyse de variance est utilisée pour comparer les zones, et ce plan est recommandé pour les cours d’eau simples et homogènes qui ne comportent pas de rejets en amont ou provenant d’autres sources près du site pouvant masquer les effets.
La mine de métaux peut proposer des modifications à ce plan d’ANOVA de base, à condition que la version modifiée soit scientifiquement justifiable et permette d’examiner les questions de suivi appropriées. Par exemple, des modifications du plan contrôle-impact peuvent être appropriées si la présence d’un facteur de confusion ne permet pas de trouver une zone de référence en amont ou dans un bassin hydrographique adjacent, mais qu’un tel plan pourrait s’appliquer. Dans ce cas particulier, la zone de référence peut être choisie en aval du point de rejet plutôt qu’en amont. Cette zone de référence devrait cependant se trouver hors de la zone exposée et satisfaire aux mêmes critères applicables aux zones de référence que les autres plans.
Ce premier plan est également recommandé pour les estuaires simples et homogènes ou les baies ou bras étroits ne comportant pas d’effluents en amont ou provenant d’autres sources près du site pouvant masquer les effets, ou encore lorsque les habitats pertinents sur le plan écologique sont répartis en îlots isolés mais homogènes (par ex., affleurements rocheux épars).
Ampleur et portée géographique
Le plan C-I peut également être utilisé pour évaluer la portée géographique d’un effet en faisant d’abord appel à des protocoles de bioévaluation rapide (Plafkin et al., 1989) ou à d’autres informations existantes pour évaluer approximativement la distance jusqu’à laquelle se fait sentir l’effet. Cette étape peut être suivie d’un programme de suivi de type C-I englobant la zone fortement exposée et ciblant des zones exposées additionnelles situées dans des endroits où les effets détectés semblent se dissiper. Ces zones additionnelles devraient être réparties de manière à englober le point le plus éloigné où l’on soupçonne que les effets de l’effluent demeurent perceptibles. L’échantillonnage devrait comprendre également les zones de référence et les zones exposées déjà suivies. À l’aide d’une analyse de variance, des comparaisons entre les zones peuvent dès lors être effectuées afin de déterminer la portée géographique d’un effet à un niveau de signification donné.
Plan d’étude contrôle-impact multiple
L’utilisation d’une zone de référence unique soulève deux difficultés importantes : 1) la possibilité élevée de la présence d’autres facteurs de confusion et 2) le manque d’indépendance entre les stations d’une même zone de référence (pseudorépétition) (Hurlbert, 1984). Dans les systèmes où il est impossible de trouver une zone de référence appropriée en raison de la présence de facteurs de confusion ou dans les cas où il y a constat, après examen des données historiques, qu’il est préférable d’utiliser plus d’une zone de référence, le plan d’étude contrôle-impact multiple devrait être utilisé. Un schéma illustrant l’application de ce plan d’étude aux mines de métaux rejetant leur effluent dans les cours d’eau importants, les lacs ou les eaux côtières est présenté à la figure 4-2d, e, f. Le plan d’échantillonnage devrait être conçu de manière à ce que les zones de référence additionnelles soient situées dans des bassins hydrographiques adjacents ou dans des baies voisines et comportent un assemblage de classes d’habitats comparable à la gamme d’habitats trouvés dans la zone exposée.
De par leur conception, les plans C-I et C-IM visent à étudier une différence particulière d’ampleur de l’effet entre les zones à l’étude. Ces plans satisfont aux conditions d’application des analyses de variance et des analyses de puissance qui s’y rattachent. Ces méthodes s’appliquent avec souplesse et peuvent fournir des indicateurs permettant de déterminer si l’effluent de la mine de métaux a un effet biologique ou non sur la communauté d’invertébrés benthiques. Ces plans supposent au départ que l’exposition à l’effluent et les conditions de l’habitat sont relativement homogènes dans toutes les stations comprises à l’intérieur d’une zone d’échantillonnage, ou encore que l’exposition à l’effluent varie à l’intérieur de limites acceptables dans une zone donnée.
Plan d’étude avant-après–contrôle-impact (BACI)
Les plans C-I et C-IM peuvent être améliorés lorsque des données sont recueillies avant et après le début du rejet de l’effluent dans le plan d’eau récepteur. Les mêmes aspects décrits précédemment s’appliquent au choix des zones de référence (contrôle) et des zones exposées (impact). Le plan est toutefois amélioré grâce à la collecte de données à la fois avant et après que l’installation devient fonctionnelle. Ce type de plan de suivi a été nommé « avant-après–contrôle-impact » (BACI, de before/after-control/impact) (Schmitt et Osenberg, 1996). Son utilisation aide à distinguer les effets de l’effluent par rapport aux différences naturelles entre les zones de référence et les zones exposées qui existaient déjà avant le rejet de l’effluent.
Green (1979), Schmitt et Osenberg (1996), Underwood (1997), de même que les références qu’ils contiennent, présentent des descriptions détaillées de plusieurs types de plans BACI et des analyses statistiques effectuées. Dans sa forme la plus simple, un plan BACI nécessite la collecte de données de suivi au moins une fois avant et une fois après le début du rejet de l’effluent dans une zone de référence et dans une zone exposée, puis les données sont analysées par ANOVA factorielle superfie-temps (Green, 1979). Dans cette situation, l’existence d’un effet de l’effluent est inférée quand le terme d’interaction superficie-temps de l’ANOVA est significatif. Quand les zones de référence et exposée ont été échantillonnées de manière répétée pendant la période avant et la période après, il est possible de recourir à une analyse BACI pour séries appariées; dans ce cas, les effets potentiels sont étudiés en recherchant un changement dans la valeur de delta (différence entre les zones de référence et les zones exposées), de la période avant à la période après le rejet (Schmitt et Osenberg, 1996). Il est possible d’améliorer ce plan en intégrant plusieurs zones de référence (Schmitt et Osenberg, 1996; Underwood, 1997). Veuillez consulter la section 2.2.2.2.2 du chapitre 2 pour en savoir plus sur les données de base.
Plan d’étude par gradient linéaire ou gradient radial
Les plans d’étude par gradient linéaire ou radial (figure 4-3a, b, c) conviennent dans le cas où la dilution rapide de l’effluent empêche la sélection d’une zone exposée présentant des concentrations d’effluent relativement homogènes. Comme le plan C-I, les plans par gradient peuvent être utilisés lorsqu’il est impossible de trouver une zone de référence appropriée en amont du point de rejet de l’effluent ou dans une baie ou un bassin hydrographique adjacent. Ces plans permettent également de déterminer la distance à laquelle les effets demeurent perceptibles le long du panache de l’effluent (soit l’objectif de la détermination de l’ampleur et de la portée géographique).
L’approche par gradient permet d’examiner les écarts par rapport à un « modèle » attendu (non perturbé) de corrélations entre des facteurs biotiques et environnementaux le long de gradients spatiaux. Elle se prête davantage à l’analyse de régression (ou à une méthode équivalente), pour laquelle il est plus approprié d’obtenir des mesures exactes des variables biotiques et d’habitat pour une gamme suffisamment grande de conditions que de consacrer des efforts équivalents à des répétitions (p. ex., cinq stations à l’intérieur d’une zone). Dans le cas le plus simple, on conclura à la présence d’un effet statistiquement significatif si la pente de la droite de régression d’une variable réponse (variable dépendante) en fonction de la distance du point de rejet de l’effluent est significativement différente de 0. Cette méthode est fondée sur la présence d’un gradient d’effet s’amenuisant en fonction de la distance à partir de la source ponctuelle de rejet, et il n’est pas toujours possible de confirmer la présence ou l’absence d’un effet dans une station donnée. Il convient alors de déterminer à quel endroit précis le long du gradient les effets étudiés ne sont plus détectables ou cessent d’être importants. Par conséquent, avec les plans par gradient, les données de référence proviennent des stations les plus éloignées de la source de l’effluent.
Un gradient n’est pas nécessairement rectiligne, et les stations d’une zone donnée ne sont pas nécessairement équidistantes le long de ce dernier. L’intervalle entre les stations peut être plus ou moins continu le long du gradient à mesure qu’on s’éloigne de la source de l’effluent. Comparativement au plan C-I, l’effort d’échantillonnage porte moins sur des zones de dilution nettement différentes que sur une couverture spatiale adéquate. Il n’existe souvent pas d’espaces « vides » entre les zones d’échantillonnage distinctes, mais plutôt un continuum de stations d’échantillonnage réparties le long du gradient. Toutefois, si la dilution de l’effluent change brusquement dans le milieu récepteur, il convient d’accroître l’effort d’échantillonnage dans cette portion particulière du gradient afin de détecter avec exactitude les changements soudains des effets de l’effluent de la mine de métaux.
Un plan par gradient linéaire est particulièrement indiqué pour les plans d’eau étroits tels que les cours d’eau. Le plan par gradient radial peut mieux convenir aux plans d’eau plus larges comme les lacs et les zones côtières ouvertes. L’échantillonnage s’effectue en divers points s’éloignant de la source de l’effluent, le long de plusieurs transects suivant des gradients. Comme le plan d’étude C-IM, le plan d’étude par gradient radial permet d’accroître le nombre de sites de référence. Il offre en outre une meilleure couverture spatiale, ce qui est un atout dans le cas des zones lacustres ou marines ouvertes et non homogènes, où la circulation de l’eau et les courants sont souvent assujettis à des régimes complexes et où l’on peut trouver une variété de classes d’habitats ou de gradients d’importance égale.
Pour le plan par gradient radial, la comparaison des résultats des régressions pour chaque gradient (p. ex., abondance des invertébrés benthiques en fonction de la distance du point de rejet) peut aider à déterminer l’orientation et l’étendue des effets. Il est également possible de soumettre les données de tous les gradients à une analyse de régression, si la comparaison s’effectue entre des facteurs biotiques et des facteurs physiques non liés à des facteurs géographiques ou de l’habitat naturel. Si l’effort d’échantillonnage est suffisamment intense (p. ex., gradient radial), il peut être possible de choisir des stations répétées sans facteurs de confusion (habitats homogènes) en vue d’effectuer une analyse de régression entre une variable biotique et une variable liée à l’effluent.
Dans la mesure du possible, le gradient d’exposition devrait être dissocié de tout gradient environnemental. En présence d’un gradient d’exposition décroissant le long de zones de profondeurs différentes, l’application d’un plan par gradient linéaire ou radial peut encore être envisagée si les gradients d’exposition et de profondeur ne sont pas corrélés et si les différences de profondeur ne sont pas importantes au point de masquer les effets de l’effluent. Dans les cas où une corrélation peut être établie entre le gradient d’exposition et un gradient environnemental, il peut être préférable d’appliquer un plan d’étude à gradients multiples (voir la prochaine section). Autrement, il peut être nécessaire d’utiliser une approche multivariable pour éliminer l’effet des variations de profondeur.
Plans d’étude par gradients, et ampleur et portée géographique
En raison de la répartition des stations d’échantillonnage, l’utilisation de plans d’étude par gradient est particulièrement appropriée pour déterminer la portée géographique d’un effet. Le plan le plus simple pour étudier l’ampleur et la portée géographique consiste à répartir les stations d’échantillonnage le long d’un gradient d’exposition décroissant, en veillant à ce que les stations les plus éloignées soient situées à bonne distance de la zone d’influence de l’effluent. Il est alors possible de déterminer la portée géographique des effets en reportant sur un graphique les variables réponse en fonction de la distance à partir de la mine de métaux et en examinant les données afin de trouver le point d’inflexion où les variables réponse convergent asymptotiquement vers les conditions de référence. Il est également possible d’inclure les données des stations ainsi réparties, avec les paramètres physicochimiques mesurés, dans une analyse multivariable (ordination ou groupement) en vue d’établir quelles stations distantes sont groupées avec les stations de référence et lesquelles sont associées aux stations distinctement soumises aux effets de l’effluent. Ces deux approches (représentation graphique et analyse multivariable) visent à relever des tendances parmi l’ensemble des données en vue de déterminer de façon approximative la portée géographique des effets. Comme ces approches ne comportent pas de vérification d’hypothèses, une analyse de puissance ne s’appliquerait pas (contrairement à l’application de l’approche C-I à l’étude de l’ampleur et de la portée géographique; voir ci-dessus).
Il est également possible de concevoir un plan d’étude par gradient prévoyant la vérification d’hypothèses pour examiner la portée géographique d’un effet. Il faut alors utiliser les sous-échantillons de terrain comme répétitions (et traiter les stations comme des zones) et effectuer des comparaisons station par station à l’aide d’une analyse de variance le long d’un gradient en vue de déterminer à quel endroit les effets s’estompent, à un niveau de signification donné. Cette approche peut cependant nécessiter un effort d’échantillonnage considérable, selon le nombre de stations réparties le long du gradient et le nombre de sous-échantillons de terrain requis (par l’analyse de puissance) par station.
Plan d’étude par gradients multiples
Dans certains cas, il peut également être utile de comparer les gradients de référence à ceux qui sont exposés à l’effluent de la mine de métaux, en particulier lorsqu’un gradient environnemental concomitant masque un gradient d’exposition à l’effluent dans la zone exposée. En utilisant un plan par gradients multiples (voir diagrammes d et e de la figure 4-3), il devient possible d’effectuer une comparaison statistique entre le gradient d’une zone exposée et un gradient environnemental similaire dans la zone de référence. Les gradients de référence devraient être aussi similaires que possible au gradient de la zone exposée pour ce qui est de la profondeur et de l’habitat. Une analyse de covariance permet de vérifier la présence éventuelle d’effets liés à l’effluent et d’éliminer l’influence du gradient environnemental concomitant.
Approche des conditions de référence
Le concept de base de l’approche des conditions de référence (ACR) consiste à établir une base de données biologiques et environnementales mesurées dans des sites présentant des conditions non perturbées (stations de référence). Cette base de données est utilisée pour élaborer des modèles prédictifs associant une série de variables environnementales à des conditions biologiques. Le modèle analyse ensuite un ensemble de variables environnementales mesurées dans une nouvelle station pour prévoir les conditions biologiques attendues dans cette station (c.-à-d. les conditions biologiques du groupe de stations de référence présentant des attributs environnementaux similaires). Une comparaison des conditions biologiques réelles à la nouvelle station avec les conditions prévues permet d’évaluer l’état de la nouvelle station.
L’application de l’ACR à l’étude d’un système perturbé réduit le besoin de trouver des stations de référence comparables à proximité, ce qui peut poser un problème avec certaines approches courantes. Avec l’ACR, au lieu d’avoir à trouver et à échantillonner des stations de référence situées en amont (système fluvial) ou dans une baie voisine (lac), il est possible d’utiliser un ensemble de stations de référence biologiquement comparables choisies dans une base de données existantes pour évaluer une station exposée. Dans la mesure où elle est mise à jour régulièrement, cette base de données peut être utilisée dans le cadre de plusieurs étapes de l’ESEE.
La base de données sur les conditions de référence est établie au moyen d’un programme d’échantillonnage normalisé effectué à des échelles géographiques très diverses. Le même protocole d’échantillonnage de la communauté d’invertébrés benthiques est utilisé dans le plus grand nombre d’écorégions et d’ordres de cours d’eau ou de lacs possible à l’échelle d’un bassin hydrographique. Un certain nombre de variables environnementales sont mesurées durant l’échantillonnage des invertébrés. Les données recueillies sont soumises à une analyse multivariable à trois étapes dans le cadre de laquelle :
- un certain nombre de groupes d’invertébrés sont formés d’après la similarité de la structure des communautés;
- les données biologiques sont corrélées avec les variables environnementales, et un ensemble optimal de variables environnementales permettant de prédire la répartition dans les divers groupes est établi;
- la condition biologique des stations exposées est évaluée en utilisant l’ensemble optimal de variables environnementales pour prédire la répartition dans les divers groupes. La qualité de l’ajustement de la station exposée au groupe dans lequel elle a été assignée par le modèle détermine si elle diffère du groupe de référence et, le cas échéant, l’ampleur de cet écart. L’évaluation peut se faire soit en utilisant les variables décrivant la communauté, en déterminant si le site se trouve dans l’étendue de variation observée aux sites de référence (deux écarts-types [ET]), ou encore en utilisant des méthodes d’ordination pour déterminer si le site exposé se retrouve dans l’ellipse de probabilité à 95 % des sites de références jumelés.
Selon le moment et l’endroit où se déroule l’échantillonnage, la base de données ainsi constituée pourra également être utilisée pour effectuer des comparaisons par analyse de variance entre les zones de référence et les zones exposées.
Une fois la base de données établie, l’ACR peut être utilisée comme méthode d’évaluation biologique rapide et pour examiner des enjeux d’envergure nationale et locale à l’aide de la même base de données et du même logiciel. En raison de l’ampleur de l’effort d’échantillonnage requis au départ, l’application de cette approche à une seule mine de métaux située dans une région éloignée est peu possible, à moins qu’une base de données de référence existe déjà. Toutefois, son application peut être envisagée dans les régions comportant plusieurs industries (dont des secteurs industriels faisant l’objet d’une ESEE). Dans ces conditions, il peut être utile et rentable pour plusieurs usagers de collaborer à la constitution de la base de données de référence. Pour de plus amples renseignements sur l’ACR, voir Bailey et al. (2003).
Pour aider l’industrie à localiser des sites de référence propices au Programme d’ESEE, l’Unité conjointe d’écologie d’eau douce de l’Université Laurentienne a dirigé le réseau de biosurveillance par l’ACR des invertébrés benthiques du nord de l’Ontario (Northern Ontario RCA Network). Pour en savoir plus sur ce réseau, veuillez consulter le site Web suivant (en anglais seulement).
Le Réseau canadien de biosurveillance aquatique (RCBA) est un programme de collaboration mis sur pied et maintenu par Environnement Canada qui vise à établir un réseau de sites de référence en utilisant l’approche des conditions de référence. Tous les utilisateurs intéressés à évaluer la santé biologique des eaux douces du Canada peuvent accéder à cette information. Pour en savoir plus sur le RCBA, veuillez consulter son site Web.
| Type de plan | Milieu récepteur | Zone de référence (contrôle) | Zone exposée (impact) | Méthode statistique |
|---|---|---|---|---|
| Contrôle-impact (C-I) Figure 4-2 | Cours d’eau ou lacs homogènes ou estuaires de faible salinité. | Une seule zone de référence en amont du point de rejet final de l’effluent de la mine de métaux. | Zone fortement exposée (des zones exposées sont ajoutées pour l’étude de l’ampleur et de la portée géographique). | ANOVA |
| Contrôle-impact multiple (C-IM) Figure 4-2d, e, f | Cours d’eau ou lacs à rives homogènes, estuaires et zones côtières homogènes. | Zones de référence multiples dans un même bassin hydrologique ou une même baie, ou dans un bassin ou une baie adjacents similaires. | Zone fortement exposée (des zones exposées sont ajoutées pour l’étude de l’ampleur et de la portée géographique). | ANOVA |
| Avant-après-contrôle-impact (BACI) | Les mêmes que ceux des plans contrôle-impact et contrôle-impact multiple | Les mêmes que celles des plans contrôle-impact et contrôle-impact multiple, mais des données sont recueillies avant et après le rejet de l’effluent | Les mêmes que celles des plans contrôle-impact et contrôle-impact multiple, mais des données sont recueillies avant et après le rejet de l’effluent | ANOVA |
| Gradient linéaire (GL) Figure 4-3a, b | Cours d’eau ou lacs présentant des contraintes géographiques, estuaires étroits, non homogènes ou baies marines, bras de mer ou fjords présentant des contraintes géographiques. | Série de stations de référence non exposées ou faiblement exposées à l’effluent et situées vers la fin d’un gradient décroissant d’exposition à l’effluent de la mine de métaux. | Gradient unique décroissant de la concentration de l’effluent dans le milieu récepteur. | Régression/ ANCOVA |
| Gradient radial (GR) Figure 4-3c | Lacs, baies marines ouvertes non homogènes et zones côtières. | Comme ci-dessus, mais les stations sont situées vers l’extrémité de plusieurs gradients radiaux. | Comme ci-dessus, mais les gradients sont répétés de façon radiale. | Comme ci-dessus |
| Gradients multiples (GM) Figure 4-3d, e | Lacs ou cours d’eau, Baies marines ouvertes non homogènes ou zones côtières. | Série de stations de référence non exposées à l’effluent, réparties le long d’un transect suivant un gradient environnemental comparable à celui observé dans la zone exposée. | Gradient de concentrations d’effluent de plus en plus faibles et gradient environnemental concomitant dans le milieu récepteur. | ANCOVA, les transects de référence et exposés considérés comme groupes de traitement. |
| Approche des conditions de référence (ACR) Figure 4-4 | Cours d’eau ou lacs, en particulier pour les projets d’études conjoints ou lorsqu’une base de données sur les conditions de référence existe. | Séries multiples de stations de référence non exposées ou faiblement exposées à l’effluent situées dans des bassins hydrographiques similaires, à l’intérieur d’une même écorégion. | Série de stations situées dans la zone exposée, comparées individuellement à la distribution des stations de référence. | Analyse multivaria-ble/ANOVA (si possible) |
Note : les données recueillies suivant l’un ou l’autre des plans ci-dessus peuvent être soumises à des analyses multivariables afin de distinguer des tendances (c.-à-d. sans tests d’hypothèses) qui peuvent être utiles pour déterminer des zones potentiellement préoccupantes.
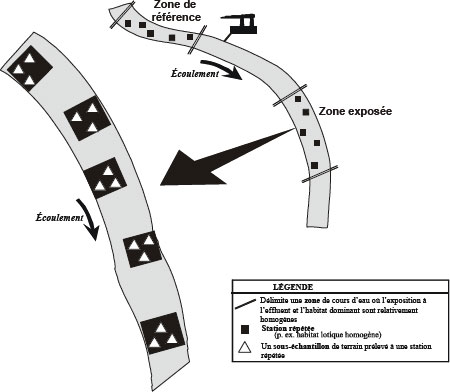
Figure 4-1 : Exemples de l’échelle spatiale d’une zone, d’une station répétée et d’un sous-échantillon de terrain pour un plan d’étude de type contrôle-impact (description longue)
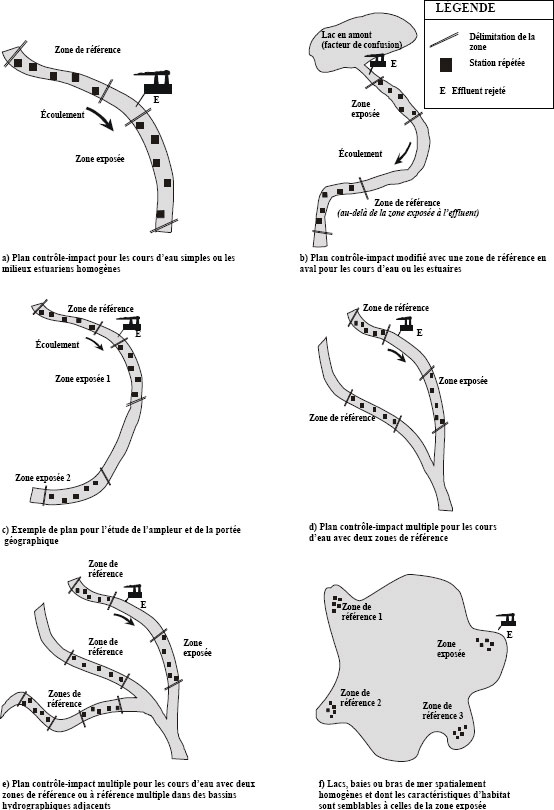
Figure 4-2 : Plans d’étude contrôle-impact (description longue)
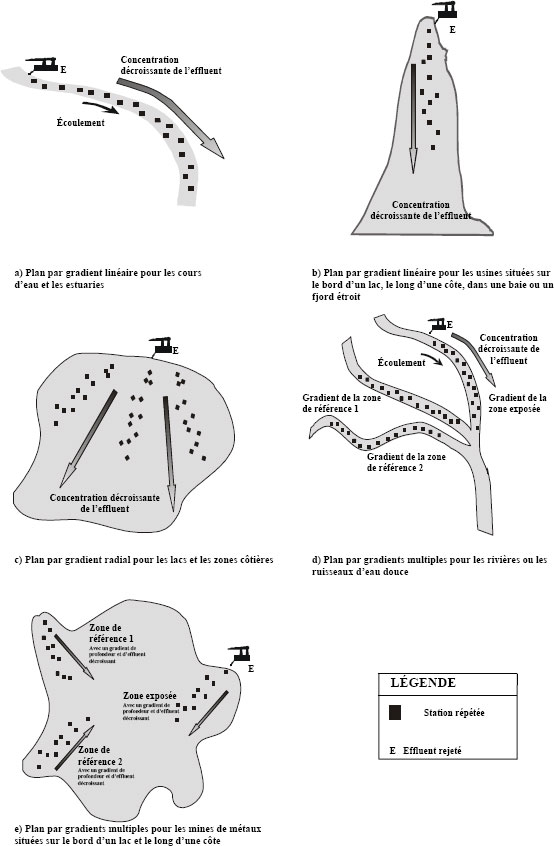
Figure 4-3 : Plans d’étude par gradients (description longue)
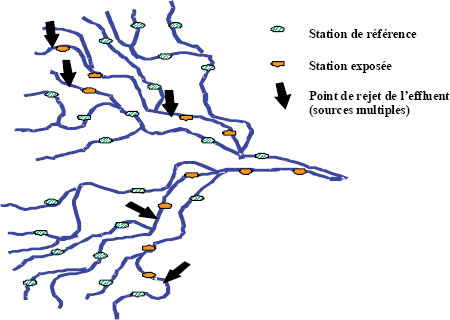
Figure 4-4 : Approche des conditions de référence (description longue)
4.3.6 Répartition des zones de référence et des zones exposées selon les phases de l’ESEE
La répartition des zones de référence et des zones exposées dépend du plan d’étude choisi et de la phase du Programme d’ESEE.
Lors de la phase 1, l’objectif consiste à déterminer si l’effluent d’une mine de métaux a des effets sur la communauté d’invertébrés benthiques de la zone fortement exposée à l’effluent, où la présence d’un effet est le plus vraisemblable. Cette restriction spatiale de l’examen a pour objectif de concentrer l’effort d’échantillonnage dans une perspective de rentabilité. Cet objectif devrait sous-tendre le choix du plan d’étude et la répartition des zones de référence et des zones exposées.
Pour les phases subséquentes, les objectifs sont de confirmer les résultats, de détecter les changements et de recueillir des données de suivi des tendances. Comme ces objectifs visent une échelle géographique semblable à celle de la phase 1, les critères de sélection des zones de référence et exposées devraient être les mêmes. Toutefois, comme pour tout programme de surveillance continue, le caractère adéquat de la sélection des zones de référence et exposées doit être réévalué au fur et à mesure que de nouvelles données sont acquises.
En ce qui concerne l’ampleur et la portée géographique, l’objectif consiste à déterminer l’étendue spatiale des effets détectés antérieurement. L’échantillonnage devrait donc être mené dans des zones exposées plus éloignées du point de rejet de l’effluent, jusqu’à ce que les conditions redeviennent similaires à celles des zones de référence. La répartition spatiale des multiples zones et stations exposées dépend du plan d’échantillonnage choisi. Si un facteur de confusion est détecté dans la zone peu exposée à l’effluent avant que les conditions redeviennent similaires à celles observées dans les zones de référence et si ce facteur ne peut être éliminé par une modification du plan d’étude (tableau 4-1), alors la zone exposée ne devrait pas s’étendre au-delà du point où le facteur de confusion a été détecté. D’autres plans d’étude ou méthodes efficientes peuvent également être appliqués (voir le chapitre 9 et le tableau 4-1).
En outre, durant l’examen des données de suivi, l’acceptabilité des zones de référence échantillonnées au cours des suivis précédents doit être réévaluée aux fins de l’étude de l’ampleur et de la portée géographique. La nouvelle portée géographique pourrait couvrir de nouveaux habitats, tels que des cours d’eau ou des lacs d’un ordre plus élevé. Si ces nouveaux habitats n’étaient pas représentés dans les zones de référence utilisées durant les suivis précédents, une réévaluation de l’acceptabilité de ces dernières sera nécessaire. L’ajout de zones de référence devrait également être envisagé si cette mesure permet d’établir un meilleur équilibre entre le nombre de zones de référence et le nombre de zones exposées.
Si les suivis antérieurs ont été menés avec l’ACR, il peut ne pas être nécessaire d’accroître le nombre de zones de référence (dans la mesure où elles représentent adéquatement les types d’habitat), mais il est recommandé d’en rééchantillonner un certain nombre afin de déterminer les effets de la variation temporelle naturelle.
4.3.7 Sélection d’habitats pertinents sur le plan écologique
4.3.7.1 Directives générales pour la sélection des habitats
Les habitats les plus représentatifs au plan écologique devraient être échantillonnés dans les zones exposées, et des habitats similaires doivent être repérés et échantillonnés dans les zones de référence. Les questions suivantes doivent orienter la sélection des types d’habitat appropriés :
- Quel type d’habitat est proportionnellement le plus important dans la zone exposée?
- Quel habitat, en l’absence de toute influence anthropique, abrite les plus riches assemblages d’invertébrés (diversité des invertébrés benthiques) à l’intérieur de la zone d’étude?
- Dans quel habitat les invertébrés sont-ils plus susceptibles d’être exposés de façon prolongée aux contaminants présents dans les sédiments ou dans l’eau?
- Existe-t-il des données historiques pour un habitat donné?
Il faut d’abord échantillonner l’habitat qui couvre la plus grande superficie de la zone exposée. Toutefois, d’autres facteurs peuvent justifier la sélection d’un autre habitat plus circonscrit. Ainsi, il peut être plus important, au plan écologique, d’échantillonner des habitats très sensibles et plus diversifiés, même s’ils couvrent une plus faible superficie de la zone à l’étude. Par exemple, dans les cours d’eau, les rapides peuvent abriter un assemblage diversifié d’espèces présentant des sensibilités fort diverses aux changements de la qualité de l’eau. En conséquence, la communauté de cet habitat risque de présenter des changements de plus forte amplitude que les communautés moins riches en espèces. En revanche, la faune des zones de sédimentation, bien qu’elle soit généralement moins riche au plan taxinomique, présente un intérêt pour les études de suivi biologique, car elle pourrait être directement exposée pendant des périodes plus longues aux contaminants dans les sédiments. La réaction des communautés des zones de sédimentation à la présence de contaminants pourrait donc être différente de celle des communautés plus sensibles, mais moins exposées, vivant dans les rapides. Pour de plus amples informations sur la sélection des habitats dans les cours d’eau, veuillez consulter Cuffney et al. (1993), Plafkin et al. (1989) et Meador et al. (1993).
4.3.7.2 Sélection des habitats pour le Programme d’ESEE
Le choix des habitats en vue de l’échantillonnage dépend des caractéristiques propres àchaque site. La décision d’échantillonner plus d’un habitat important au plan écologique au cours d’une même étude dépend de la phase du Programme d’ESEE.
Pour la phase 1 ainsi que les phases subséquentes, l’objectif est d’établir si l’effluent a des effets sur la communauté d’invertébrés benthiques; par conséquent, l’habitat où ces effets sont les plus susceptibles de se manifester devrait être échantillonné. S’il est établi que plus d’un habitat est important au plan écologique, l’effort devrait être accru pour échantillonner tous ces habitats durant l’évaluation de l’ampleur et de la portée géographique. Cette façon de faire permet de réduire le risque de ne pas détecter d’effets dans un habitat sensible ou la nécessité d’étendre l’étude à de nouveaux habitats durant les études subséquentes. Il peut être rentable d’accroître l’effort d’échantillonnage durant la même visite sur le terrain afin d’examiner certaines questions à propos de l’ampleur et la portée géographique des effets.
L’ajout de types d’habitat écologiquement importants ne devrait pas entraîner une réduction de l’effort d’échantillonnage dans l’habitat dominant. Pour la plupart des études de suivi biologique, la décision de restreindre l’échantillonnage à un seul habitat vise à réduire la variabilité inhérente à l’échantillonnage de substrats naturels. Cette variabilité ne ferait qu’augmenter si le même effort d’échantillonnage était étendu à plusieurs habitats différents.
En ce qui concerne la détermination de l’ampleur et de la portée géographique, les habitats les plus importants sur le plan écologique dans les zones exposées doivent être échantillonnés, et des habitats similaires doivent être repérés et échantillonnés dans les zones de référence. La détermination du nombre et des types d’habitat à échantillonner est fondée sur les résultats des suivis précédents, les caractéristiques particulières de chaque site et les objectifs de l’étude de l’ampleur et de la portée géographique. Par exemple, pour déterminer la portée géographique d’un effet observé, il peut être important d’échantillonner des habitats additionnels comme des cours d’eau ou des lacs d’un ordre supérieur. En revanche, si une réponse à l’effluent n’a été observée que dans un seul des types d’habitats échantillonnés lors des suivis précédents, l’échantillonnage durant l’étude de détermination de l’ampleur et de la portée géographique pourrait cibler ce type d’habitat.
4.3.7.3 Sélection des habitats marins et estuariens
En milieu marin ou estuarien, l’échantillonnage peut se dérouler soit dans des habitats de sédimentation, soit dans des habitats d’érosion. De plus, la décision d’échantillonner des substrats intertidaux plutôt que des substrats infralittoraux dépendra du milieu récepteur qui est approprié et de la possibilité d’obtenir des échantillons utiles. Les questions suivantes orientent la sélection des types d’habitat en milieu marin ou estuarien :
- Quels habitats est-il possible d’échantillonner?
L’habitat qui occupe la plus vaste superficie et qui risque le plus de subir les effets de l’effluent devrait être sélectionné. Toutefois, la sélection des habitats principaux est faite, en partie, en fonction de la faisabilité de l’échantillonnage. Par exemple, l’échantillonnage des invertébrés benthiques risque d’exiger des moyens techniques très lourds si l’habitat principal est un escarpement rocheux vertical qui plonge à une profondeur de 300 m immédiatement sous l’émissaire de l’effluent. L’échantillonnage serait également difficilement faisable si l’habitat principal est situé dans la zone intertidale et consiste en une falaise rocheuse escarpée balayée par de fortes vagues et exposée aux vents ou aux accumulations de glace. Par ailleurs, lorsque plusieurs habitats appropriés sont disponibles, un choix doit être fait. Dans certains cas, on pourra décider d’échantillonner plus d’un habitat (plan par gradient radial ou plan similaire). Les habitats à substrats mous devraient être choisis de préférence, puisqu’on peut généralement y utiliser des méthodes plus quantitatives.
- Quel est l’habitat le plus actif ou « important » au plan biologique?
Lorsque le milieu infralittoral le plus exposé à l’effluent est constitué à la fois de sédiments consolidés et non consolidés, il est possible d’échantillonner les deux types de sédiments ou de se limiter à un seul. Tout bien considéré, les sédiments non consolidés se prêtent plus facilement à un échantillonnage quantitatif. Toutefois, s’il apparaît évident que la couche superficielle (10 premiers centimètres; ou la profondeur de pénétration de l’appareil d’échantillonnage) d’un substrat composé de sable grossier n’abrite pratiquement aucun macro-organisme alors que le récif rocheux voisin est extrêmement riche et abrite un grand nombre d’espèces de poissons, c’est ce dernier habitat qui est le plus « actif » et qui devrait être choisi. De la même façon, si un des principaux types d’habitats directement exposés à l’effluent de la mine de métaux abrite une importante ressource halieutique, il pourra être jugé comme étant le plus important au plan biologique.
- L’habitat pertinent sur le plan écologique peut-il être « classifié » en fonction d’un type physique reconnu et d’espèces caractéristiques?
Les systèmes de classification des habitats ont été décrits et étudiés par de nombreux chercheurs et peuvent être utiles pour comparer les facteurs biotiques « attendus » aux facteurs biotiques réels observés au voisinage de la mine de métaux. Parmi les travaux applicables au milieu marin, mentionnons un document détaillé préparé à l’intention du ministère des Pêches et des Océans pour la délimitation du détroit de Georgia, le long de la côte ouest du Canada et du nord ouest des États-Unis (Watson, 1997). Des informations utiles sur la classification des habitats littoraux marins et des zones côtières profondes du monde sont fournies par Frith et al. (1993), Booth et al. (1996), Robinson et Levings (1995), Hay et al. (1996) et Robinson et al. (1996). La classification des milieux estuariens a été plus particulièrement étudiée par Matthews (1993), Scott et Jones (1995), Finlayson et van der Valk (1995) et Levings et Thom (1994). Aux États-Unis, le système le plus couramment utilisé est celui de Cowardin et al. (1979) et de Cowardin et Golet (1995), avec des améliorations proposées par divers autres auteurs.
- Du fait de la profondeur à laquelle il est rejeté ou de sa flottabilité, l’effluent risque-t-il d’influer davantage sur les zones intertidales ou infralittorales?
Si l’effluent est rejeté dans une zone intertidale et demeure principalement dans cette zone, c’est cette dernière qui devrait être retenue aux fins de l’échantillonnage. Toutefois, si l’effluent touche à la fois des habitats de la zone intertidale et de la zone infralittorale, on retiendra de préférence l’habitat infralittoral puisque les incidences sur les poissons y seront vraisemblablement plus importantes. Lorsque la situation s’y prête, les deux types d’habitats peuvent être échantillonnés. Il faudrait également prendre en compte les fluctuations saisonnières de la colonne d’eau, car celles-ci peuvent avoir des effets sur les zones intertidales.
- Quel type d’habitat occupe la plus grande superficie de la zone à l’étude?
Dans bien des cas, les substrats des habitats côtiers sont constitués d’un mélange de limon, de sable, de gravier et de roches. Dans les baies situées près de l’embouchure d’un cours d’eau, une accumulation de sédiments sablonneux ou limoneux est généralement observée. Les sédiments des zones d’étude estuariennes sont généralement constitués en large partie de substrats meubles provenant des rivières. Si les proportions d’habitats de sédimentation et d’érosion s’équivalent, il serait préférable d’effectuer l’échantillonnage dans les habitats de sédimentation, puisque c’est là que les substances rejetées dans l’effluent de la mine de métaux s’accumulent habituellement et que les effets néfastes risquent le plus de se manifester. Les substrats des zones d’érosion ont tendance à être « nettoyés » ou « récurés » par l’action du courant ou des vagues ou par l’érosion par la glace.
Cependant, si la proportion des milieux à substrats consolidés est largement supérieure à celle des substrats non consolidés, ou si les sédiments charriés par l’effluent de la mine de métaux ont commencé à se déposer le long d’une côte rocheuse autrefois non contaminée, il pourrait être préférable de choisir ce type d’habitat aux fins de l’échantillonnage.
- Existe-t-il des facteurs de confusion susceptibles d’influer sur les communautés d’invertébrés benthiques?
L’utilisation des communautés d’invertébrés benthiques présentes dans les zones d’échantillonnage soumises à des facteurs de confusion d’origine naturelle ou anthropique pour interpréter les effets d’une mine de métaux pose des problèmes et devrait, de toute évidence, être évitée. Par exemple, si des substrats consolidés et non consolidés sont présents, un seul de ces types de substrat peut se trouver hors de la zone d’influence des facteurs de confusion. Les effets saisonniers ou continus du gel ou de l’érosion par la glace constituent une source de facteur de confusion particulièrement importante dans les régions arctiques, en particulier dans les zones intertidales et infralittorales. Ces facteurs peuvent perturber considérablement les communautés de surface.
- Quel est le milieu touché par les rejets en zone infralittorale?
De toute évidence, c’est le milieu le plus exposé à l’effluent qui devrait être retenu aux fins de l’échantillonnage et qui déterminera le plan d’échantillonnage retenu. Dans un estuaire, si le rejet s’effectue à la surface et si la surface est composée d’une couche importante et permanente d’eau douce avec un faible apport d’eau salée en profondeur à marée haute, l’habitat dominant à échantillonner devrait se trouver en aval de la mine de métaux. Toutefois, si l’apport d’eau salée résultant de l’action des marées est important, l’échantillonnage devrait être effectué en amont et en aval de la mine de métaux. Un grand nombre d’autres facteurs de ce type doivent être pris en compte, et dans ces cas, il faut recueillir des informations détaillées en vue de mieux caractériser les habitats et la dispersion de l’effluent.
En résumé, lorsque plusieurs habitats se prêtent à l’échantillonnage, il est premièrement recommandé d’échantillonner les habitats infralittoraux, car ceux-ci présentent habituellement une diversité faunique plus élevée et les organismes y sont moins répartis par îlots que dans les habitats intertidaux, les conditions y étant moins extrêmes ou rigoureuses. Ces caractéristiques sont particulièrement évidentes dans l’Arctique, où les conditions hivernales extrêmement rigoureuses peuvent entraîner l’élimination de la plupart des organismes à espérance de vie plus longue qui intègrent habituellement les effets des contaminants de façon plus évidente. Deuxièmement, la préséance devrait être accordée aux zones de sédimentation, particulièrement dans les zones infralittorales, car l’échantillonnage y présente moins de difficultés et permet l’utilisation de méthodes plus quantitatives. De plus, les contaminants s’accumulent habituellement dans les zones de sédimentation, alors qu’ils ne le font généralement pas dans les zones d’érosion.
4.3.8 Sélection des saisons d’échantillonnage pertinentes sur le plan écologique
4.3.8.1 Directives générales pour la sélection des saisons d’échantillonnage
Toutes les études des communautés d’invertébrés benthiques devraient se dérouler durant les saisons les plus pertinentes sur le plan écologique. L’échantillonnage devrait se tenir durant une période de rejet de l’effluent et après que le milieu récepteur a été exposé à l’effluent pendant une période suffisante, durant laquelle on peut raisonnablement s’attendre à ce que des effets se produisent (en général de trois à six mois).
La période de l’année à choisir de préférence devrait être celle durant laquelle la diversité biologique est maximale, car cette période correspond aux cycles saisonniers de recrutement des organismes benthiques (généralement liés au climat et à l’abondance de nourriture). De nombreux insectes dont le cycle biologique comporte un stade aquatique se reproduisent au printemps et à l’automne. D’autres, cependant, produisent plusieurs cohortes durant la période de l’année où les plans d’eau sont libres de glace. Dans de nombreux habitats lotiques, l’échantillonnage est effectué en automne (septembre-octobre), alors que la plupart des taxons sont présents ou ont atteint une taille suffisante pour être récoltés à l’aide de l’équipement d’échantillonnage et que les régimes d’écoulement sont favorables. Dans les grands lacs où les communautés benthiques sont souvent dominées par les annélides, les crustacés et les mollusques, les périodes d’émergence des insectes et les régimes hydrologiques jouent un rôle moins important dans la détermination du calendrier d’échantillonnage (Rosenberg et Resh, 1993).
Si des données historiques sur la communauté d’invertébrés benthiques existent pour le système à l’étude, il peut être utile d’examiner ces données et, le cas échéant, de procéder à des échantillonnages pendant les mêmes périodes à des fins de comparaisons. Parmi les autres facteurs qui sont susceptibles d’influer sur le choix de la période d’échantillonnage, mentionnons les fluctuations saisonnières du débit (en particulier les débits d’étiage et de crue), le gel et l’érosion par la glace, les cycles de rejets de la mine de métaux, le type d’équipement d’échantillonnage choisi, la faisabilité de l’échantillonnage et la sécurité du personnel sur le terrain. Il faut éviter les périodes où il n’y a pas de rejet d’effluent. La détermination du calendrier d’échantillonnage exige une bonne connaissance des fluctuations saisonnières et du cycle vital des organismes benthiques ainsi que de l’évolution du régime hydrologique du système étudié. Rosenberg et Resh (1993), Johnson et al. (1993), Rees (1984), Malley et Reynolds (1979), Barber et Kevern (1974) et Jonasson (1955) fournissent des indications utiles pour le choix de la période d’échantillonnage.
4.3.8.2 Sélection de la saison d’échantillonnage pour les phases du Programme d’ESEE
Il est recommandé de restreindre l’échantillonnage à une seule saison, à moins que les données existantes révèlent l’existence de plus d’une période critique pour la communauté d’invertébrés benthiques du bassin à l’étude. Comme cette saison d’échantillonnage sera retenue au cours des études subséquentes, il est important de prendre cette décision après avoir examiné toutes les données existantes propres au site concernant les cycles vitaux des taxons présents et les régimes hydrologiques.
De même, la saison d’échantillonnage adoptée aux fins de la détermination de l’ampleur et de la portée géographique devrait être la même que celle choisie pour les suivis antérieurs, à moins que l’examen des données existantes justifie la modification du calendrier d’échantillonnage pour des raisons scientifiques ou logistiques. En outre, l’ajout de saisons peut être indiqué pour évaluer l’ampleur de la réponse de la communauté d’invertébrés benthiques. Par exemple, si l’échantillonnage se fait lorsqu’un stade du cycle vital d’un invertébré donné est absent, il peut être nécessaire d’ajouter une saison d’échantillonnage pour évaluer si des effets sont présents chez cet invertébré. Les bivalves, par exemple, ne sont pas facilement échantillonnés en automne. Or, l’automne est une période critique pour de nombreux autres invertébrés. Dans ce cas, une saison pourrait être ajoutée au programme de suivi, et le plan d’échantillonnage adapté pour résoudre ce problème propre au site (activité additionnelle d’échantillonnage en été à l’aide de méthodes spécialement conçues pour les bivalves).
Pour la plupart des zones estuariennes et marines, l’échantillonnage peut se dérouler n’importe quand entre le printemps et le milieu de l’automne. Pour les milieux marins situés en zones tempérées, l’échantillonnage des invertébrés benthiques est habituellement réalisé à la fin de l’été ou à l’automne, car de nombreux organismes benthiques comportent un stade larvaire planctonique qui n’atteint pas le fond avant cette période. En outre, les populations dont le recrutement se produit au printemps se sont alors stabilisées. Dans l’Arctique, l’échantillonnage est normalement réalisé à la fin de l’été ou le début de l’automne, lorsque la longue durée d’éclairement et les températures plus chaudes ont permis à la flore et à la faune de croître et de se développer, et que la surface de la mer est encore libre de glace. En général, la période de reproduction et les fluctuations de l’abondance des organismes benthiques sont liées au cycle des marées, aux saisons et à l’abondance de la nourriture.
4.4 Aspects statistiques pour les plans d’étude
Des directives générales relatives aux aspects statistiques (p. ex., sélection des valeurs de a et de b et détermination de l’effort d’échantillonnage) sont présentées au chapitre 8. La présente section fournit des directives précises sur les statistiques appliquées aux invertébrés benthiques, notamment l’effort d’échantillonnage et l’utilisation d’ellipses de probabilité dans l’espace d’ordination pour l’ACR. En outre, on indique comment déterminer le nombre de sous-échantillons de terrain à prendre à une station donnée et comment utiliser les données tirées de ces sous-échantillons pour améliorer les futurs plans d’étude.
Il convient ici de rappeler que, bien que l’ACR puisse être utilisée pour présenter les résultats de l’étude de la communauté d’invertébrés benthiques, les mines de métaux doivent aussi soumettre l’information relative aux critères d’effets qui sont prescrits par le REMM (voir section 4.9).
4.4.1 Détermination de l’effort d’échantillonnage pour l’ACR
Lorsque l’approche des conditions de référence est utilisée, la question de la répétition est différente. La répétition est appliquée à l’échelle de la station et, puisque que la variation à l’intérieur d’une station est souvent nettement inférieure à la variation entre les stations, des échantillons individuels sont prélevés à chaque station, et la variation entre les stations est utilisée pour décrire les conditions de référence. Le nombre de réplicats de référence est déterminé par le nombre de stations dans le groupe auquel la station exposée appartient selon la prévision de l’ACR. Ce nombre est déterminé au moment de la formation des groupes de stations de référence, lors de la classification initiale (voir la section 4.3.5), mais il a été établi à au moins 10 stations. La variation entre les stations de référence formant le groupe de référence détermine l’erreur de type I, fixée à 0,1 à l’aide d’une ellipse de probabilité de 90 %. Comme cette approche prévoit la comparaison de stations exposées individuelles à des stations de référence multiples (minimum de 10), il est impossible d’établir la valeur de l’erreur de type II, qui nécessite une estimation de la variance associée à une station unique. Une autre façon de faire consiste à prélever plus d’un échantillon à la station exposée, mais ce procédé renseigne sur la variation à l’intérieur de chaque station, et non pas sur celle qui existe entre les stations. Il est clair que l’erreur de type II associée à la station ne peut être déterminée avec une seule station exposée. Les analyses de puissance décrites ci-dessus ne conviennent donc pas au plan ACR. Par conséquent, les études menées selon ce plan doivent être conçues de manière à permettre une détermination exacte et précise des conditions de référence et à ainsi accroître la probabilité de détecter les éventuels écarts par rapport aux conditions de référence dans les stations exposées.
4.4.2 Détermination de l’effort d’échantillonnage pour le sous-échantillonnage sur le terrain
Le prélèvement de sous-échantillons multiples à chaque station répétée vise à faire en sorte que l’effort d’échantillonnage permette d’obtenir une estimation juste des différentes variables à l’étude (p. ex., nombre de taxons, densité, etc.) pour chacune des stations échantillonnées. Cette approche est nécessaire parce que la répartition des espèces peut ne pas être homogène à l’intérieur d’une station (dont les dimensions sont largement supérieures à celles du dispositif d’échantillonnage utilisé). Un sous-échantillonnage inadéquat : 1) fournit une estimation peu précise de la vraie moyenne à chaque station et 2) peut contribuer à gonfler l’estimation de la vraie variance entre les stations et, par le fait même, à réduire la puissance des analyses.
Par conséquent, la répartition des sous-échantillons de terrain à l’intérieur de chaque station répétée dépend des deux facteurs interdépendants suivants (voir ci-dessous), qui doivent être pris en considération dans tout exercice de conception d’un plan d’échantillonnage des invertébrés benthiques. Toutefois, en l’absence d’informations existantes, il est recommandé de prélever au moins trois sous-échantillons à chaque station.
1. Relation entre l’abondance (ou la densité) et le degré d’agrégation des organismes et le niveau de précision souhaitée pour les estimations à chaque station.
Pour une station donnée, le nombre de sous-échantillons de terrain doit être suffisant pour fournir une moyenne et une variance attestant de la capture d’un nombre représentatif d’organismes (voir la synthèse de Burd et al., 1990). Plus le degré d’agrégation d’une communauté s’élève, plus la variance de l’abondance moyenne augmente dans chaque station répétée. Elliott (1977) et Holme et McIntyre (1984) ont proposé la même méthode simple de détermination du nombre de sous-échantillons requis pour obtenir un niveau prédéfini de précision. Selon Elliott (1977), un indice de précision (D) de 20 % (erreur type égale à 20 % de la moyenne) est acceptable pour la plupart des échantillons de benthos. Le nombre de sous-échantillons de terrain peut alors être déterminé à l’aide de l’équation suivante :
![]()
où
X = moyenne de l’échantillon
n = nombre de sous-échantillons de terrain
s2 = variance de l’échantillon
D = indice de précision (c.-à-d. 0,20)
Donc, pour déterminer le nombre de sous-échantillons de terrain (c.-à-d. nombre de coups de benne) qu’il faut prélever dans chaque station répétée pour obtenir une estimation avec un degré de précision de 20 %, il est possible d’utiliser les données disponibles pour calculer la moyenne et la variance et, ainsi, le nombre approprié de sous-échantillons de terrain. Ce nombre peut varier d’un site à l’autre, en réponse aux changements du rapport de la moyenne à la variance. Il est donc recommandé de calculer le nombre de sous-échantillons pour les sites qui présentent la plus grande variabilité et d’appliquer les valeurs obtenues à toutes les zones, de manière à uniformiser l’effort d’échantillonnage. Cette recommandation prudente fournit des estimations plus précises dans les habitats plus homogènes, mais elle permet d’uniformiser l’effort d’échantillonnage entre les zones et les stations répétées. Il faut en outre noter que dans le cas des populations agrégées, bien que la moyenne globale ne devrait pas varier, selon l’échelle d’agrégation par rapport à la taille de l’échantillonneur, la variance varie en fonction de la taille de l’échantillonneur. Par conséquent, les estimations de la taille de l’échantillon fondées sur des données préliminaires ne sont pertinentes que pour un programme qui utilise un échantillonneur du même type et de la même taille que celui qui a servi à la collecte des données préliminaires. Lorsqu’il est impossible de déterminer l’effort d’échantillonnage à partir des données d’une phase antérieure de l’étude, le dénombrement des organismes dans les sous-échantillons prélevés dans le cadre de l’étude en cours au moment de leur traitement et le calcul des moyennes et des variances permettent de déterminer le nombre d’échantillons qui doivent être traités en laboratoire. Toutefois, cette approche a posteriori suppose qu’un nombre suffisant d’échantillons ont été prélevés sur le terrain, ainsi, l’effort consacré au calcul de la taille de l’échantillon a priori à l’intérieur d’une station répétée devrait minimiser les problèmes causés par un effort d’échantillonnage insuffisant.
Une autre approche utilise l’abondance et la variance pour déterminer l’effort de sous-échantillonnage et la précision et peut être utilisée pour déterminer le nombre de sous-échantillons de terrain à prélever à chacune des stations répétées. Cette méthode est fondée sur la relation qui existe entre l’abondance moyenne à une station donnée et la variance entre toutes les stations répétées dans la zone ou le long du gradient à l’étude. Downing (1979, 1986) a utilisé la loi de puissance de Taylor (1961) pour estimer le degré d’agrégation dans une communauté d’invertébrés benthiques dulcicoles et ainsi déterminer l’effort d’échantillonnage requis pour réduire la variance à un niveau acceptable. Il faut en effet un nombre donné d’organismes dans chaque station répétée pour estimer avec la précision requise l’abondance moyenne à partir de l’échantillon. Vézina (1988) a utilisé la même méthode pour déterminer empiriquement le degré d’agrégation de communautés benthiques marines. L’équation de régression de la puissance décrivant la relation entre le logarithme de l’abondance moyenne à une station donnée et le logarithme de la variance entre toutes les stations donne une formule qui est ensuite utilisée pour déterminer la variance estimée attendue pour une abondance donnée d’organismes dans la région visée par l’étude. Avec cette formule, la variance estimée pour chaque valeur d’abondance moyenne à chaque station répétée est calculée et est ensuite utilisée, comme l’a fait Elliott (1977), pour estimer le nombre de sous-échantillons à prélever à cette station répétée. Les méthodes d’Elliott (1977) et de Downing (1979) se distinguent par le fait que la variance utilisée dans l’équation pour déterminer le nombre de sous-échantillons de terrain est fondée, dans le premier cas, sur la variance de l’échantillon et, dans le deuxième cas, sur la variance calculée pour la moyenne de l’échantillon à partir de l’équation de régression de la puissance pour tous les échantillons de la région étudiée. En outre, l’indice d’agrégation (pente) de l’équation de régression de la puissance peut ensuite être utilisé pour déterminer la transformation de données la plus appropriée aux fins des analyses statistiques paramétriques. Malheureusement, cette méthode présume que l’agrégation est uniforme dans toute la région d’étude, ce qui n’est pas nécessairement le cas lorsqu’un agent de stress environnemental externe intervient. Toutefois, la qualité de l’ajustement des données de moyenne et de variance à l’équation de régression logarithmique fournit une bonne indication du degré de validité de l’hypothèse d’agrégation homogène. Le cas échéant, les valeurs aberrantes doivent être exclues de l’analyse afin d’éviter une distorsion des résultats. Comme le degré d’agrégation des communautés benthiques peut varier sous l’influence de changements des conditions environnementales d’origine naturelle ou anthropique, il est conseillé d’examiner la relation qui existe entre la moyenne et la variance chaque fois qu’on procède à un échantillonnage du benthos. Enfin, il convient de noter que « l’équation de régression de puissance » utilisée ici pour le calcul du nombre de sous-échantillons de terrain ne présente aucun lien avec les analyses de puissance servant à déterminer le nombre de stations répétées (voir les sections précédentes).
2. Relation entre le nombre et la distribution des différentes espèces et la représentativité des échantillons.
Pour vérifier si le nombre d’espèces échantillonnées est suffisant, il est possible d’utiliser des méthodes simples de raréfaction comme la « courbe de l’abondance des espèces » ou la courbe des espèces en fonction de la superficie d’échantillonnage (voir Burd et al., 1990), lesquelles comparent le nombre d’espèces obtenu au nombre de spécimens pour différents nombres de répétitions groupées. Cette analyse est particulièrement importante dans les régions arctiques, où la diversité peut être élevée, mais seulement à une échelle spatiale dépassant largement la portée de l’échantillonnage. En d’autres mots, le nombre d’espèces par rapport à l’abondance est élevé, mais l’abondance est passablement faible. La même situation peut également se présenter en haute mer. En raison des hypothèses inhérentes à la distribution des organismes sous-entendues dans le cas des courbes logarithmiques d’abondance des espèces, la méthode fondée sur la courbe de la similarité en fonction de la superficie échantillonnée, qui utilise des indices de similarité calculés avec des données de présence/absence afin de déterminer l’effort d’échantillonnage requis pour obtenir un degré de similarité globale acceptable de la faune entre les stations répétées, apparaît mieux adaptée à la situation (Weinberg, 1978; Kronberg, 1987).
Si les données préliminaires font défaut ou ne permettent pas de déterminer le nombre de sous-échantillons de terrain requis pour obtenir une collection représentative d’espèces, une vérification très simple de l’effort d’échantillonnage peut être effectuée. S’il est estimé qu’un nombre X d’échantillons par station répétée suffit pour atteindre l’objectif de qualité des données visant à récupérer 95 % des espèces benthiques présentes à n’importe quelle des stations répétées, des échantillons supplémentaires peuvent être recueillis et analysés dans quelques stations choisies. La détermination de la diversité maximale obtenue à l’aide de ces échantillons supplémentaires permettra d’établir si le nombre initial d’échantillons suffisait pour atteindre l’objectif de 95 % (à l’aide d’une courbe espèces/superficie).
4.4.3 Utilisation d’ellipses de probabilité pour les plans ACR
Dans le cadre d’une vaste étude sur la qualité de l’eau des cours d’eau réalisée au Royaume-Uni en 1990, un certain nombre de méthodes permettant de circonscrire le continuum de réponses en une série de bandes représentant les niveaux de qualité biologique ont été élaborées (Clarke et al., 1992). Cette étude a fourni une représentation simplifiée du continuum de réponses dans des sites présentant une qualité biologique allant d’élevée à faible. Cette approche était considérée comme un mécanisme approprié pour obtenir un constat de la qualité biologique et établir des comparaisons générales dans le temps et l’espace utiles à des fins de gestion. Du point de vue de la gestion, il est souhaitable de pouvoir assigner un niveau de perturbation. À cette fin, il faut établir des catégories de réponse allant de faible à grave. Dans l’étude précitée (Clarke et al., 1992), un certain nombre de systèmes de classification des réponses ont été considérés et évalués. Le seuil entre les sites non stressés et stressés (bande A) a été fixé au seuil de probabilité de 90 % (écart-type [ET] = 1,64) pour le nombre de taxons et le score BMWP (Biological Monitoring Working Party) et à 95% pour le score moyen par taxon (« Average score per taxon », ou ASPT). En Australie, le seuil est fixé à 2 ET pour le nombre moyen de taxons au site de référence. Enfin, la valeur de 95 % est souvent retenue comme limite pour la détermination d’un effet biologique pour les données univariables et les descripteurs simples des communautés (Lowell, 1997). Au Royaume-Uni, Wright (1995) a distingué les différents niveaux de perturbation en quantifiant les seuils pour les sites stressés et non stressés à l’aide de trois bandes de dimensions égales. Selon Wright (1995), il n’y a aucune raison logique de choisir un autre système pour diviser le continuum de sites.
Une approche similaire peut être utilisée pour établir des niveaux d’impact à l’aide de méthodes d’ordination multidimensionnelle. L’assemblage d’invertébrés de référence peut être décrit d’après sa distribution dans un espace réduit, et l’assemblage de tout site donné peut être caractérisé par sa position dans cet espace bidimensionnel (X et Y) (figure 4-5). Plus la similarité entre les sites est grande, plus ils seront rapprochés l’un de l’autre dans cet espace XY. Si cette approche est utilisée pour déterminer la taille de l’effet pour un assemblage d’invertébrés, il faut positionner tous les sites de référence dans cet espace avec le site à l’étude. La probabilité que le site étudié soit comparable aux sites de référence est déterminée en traçant des ellipses de probabilité pour les sites de référence seulement. Reynoldson et al. (1995) ont choisi l’ellipse de probabilité de 90 % comme représentant la première bande, soit le seuil à partir duquel un site peut être considéré comme équivalent aux sites de référence. La justification du choix de cette ellipse plutôt que de l’ellipse de 95 %, plus courante, est fondée sur le fait que l’approche multivariable est plus bruyante que les mesures univariables; par conséquent, il a été jugé approprié d’adopter un seuil plus conservateur. Les sites dans l’espace réduit compris dans l’ellipse la plus petite (probabilité de 90 %) seraient considérés comme équivalents aux sites de référence et, de ce fait, non perturbés. Deux autres ellipses de probabilité (figure 4-5), de même largeur, sont utilisées pour raffiner l’examen des écarts par rapport aux sites de référence, en accord avec les arguments de Wright et ses collaborateurs (Clarke et al., 1992; Wright, 1995). Les sites compris entre l’ellipse la plus petite (90 %) et l’ellipse suivante (99 %) peuvent être considérés comme potentiellement différents, la probabilité que la variabilité naturelle soit en cause s’élevant à 10 %. Les sites compris entre l’ellipse de 99 % et la plus grande ellipse (99,9 %) sont considérés comme différents, la probabilité qu’il en soit autrement s’élevant à seulement 1 %. Enfin, les sites se trouvant à l’extérieur de l’ellipse de 99,9 % sont déclarés très différents.
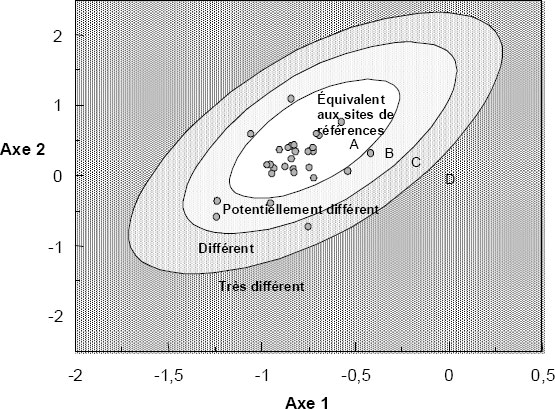
Note : Les bandes, fondées sur des ellipses de probabilité de 90 %, 99 % et 99,9 %, sont identifiées respectivement par les lettres A (non perturbé), B (potentiellement perturbé), C (perturbé) et D (fortement perturbé).
Figure 4-5 : Niveaux de stress entraînant une perturbation déduits à partir de la position des sites de référence dans un espace d’ordination hybride multidimensionnel (« hybrid multidimensional scaling ordination space ») (description longue)
4.5 Méthodes de terrain pour le suivi de la communauté d’invertébrés benthiques
4.5.1 Maillage des dispositifs d’échantillonnage
Les échantillons d’invertébrés benthiques renferment habituellement diverses quantités de sédiments fins et de débris. Pour accélérer le transfert des échantillons dans les récipients à échantillon, ainsi que leur entreposage et leur expédition, le volume de ces échantillons est réduit sur le terrain par tamisage. Ce tamisage devrait être réalisé le plus rapidement possible, de préférence immédiatement après la récupération des échantillons et avant leur conservation, car de nombreux organismes deviennent fragiles et cassants après la conservation. Diverses techniques de tamisage existent, mais la plupart prévoient le lavage des échantillons avec un tamis ou un ensemble de tamis.
Pour les études en eau douce, la taille recommandée pour les mailles des filets et tamis est de 500 µm.
En eau douce, les macroinvertébrés sont définis comme étant tous les organismes retenus par des mailles de 200 à 500 µm (Slack et al., 1973; Weber, 1973; Wiederholm, 1980; Suess, 1982). Les stades immatures de certains taxons peuvent être plus petits, et les adultes de certains autres, plus grands.
Il faut noter que les maillages recommandés s’appliquent à tous les équipements utilisés sur le terrain et en laboratoire, qu’il s’agisse des filets en Nitex des échantillonneurs de benthos ou du dispositif de tamisage.
Dans certaines circonstances propres à un site, il peut être souhaitable de récupérer les organismes plus petits en utilisant un tamis à mailles plus fines (moins de 500 µm). Ceci peut être justifié dans les cas suivants :
- pour des fins de comparaison si des tamis à mailles plus fines avaient été utilisés lors d’études du benthos effectuées antérieurement dans l’écosystème considéré;
- pour des raisons pratiques, si l’échantillonnage doit être effectué durant des périodes où les organismes sont très petits. Rees (1984), Barber et Kevern (1974) et Jonasson (1955) ont examiné les variations saisonnières de l’efficacité du tamisage.
Dans tous les cas susmentionnés, il est fortement recommandé d’utiliser une série de tamis comprenant au moins les mailles recommandées et, le cas échéant, des mailles plus fines. Cette façon de procéder tient compte des enjeux particuliers au site tout en satisfaisant aux objectifs du Programme d’ESEE, car elles permettent la tenue de comparaisons aux échelles nationale et régionale des échantillons recueillis à l’aide de tamis standardisés. Un tamisage fin peut être effectué sur le terrain, à condition de procéder en laboratoire au fractionnement approprié des échantillons à l’aide d’une série de tamis avant d’entreprendre le traitement.
Pour les invertébrés marins, le tamisage des échantillons est effectué avec de l’eau de mer et non de l’eau douce, car le choc osmotique causé par l’eau douce peut provoquer l’éclatement des cellules et une distorsion importante des organismes. Par ailleurs, le cas échéant, l’eau utilisée pour le tamisage devrait être débarrassée au préalable des organismes qu’elle peut contenir à l’aide d’un tamis à mailles plus petites que les mailles les plus fines utilisées aux fins de l’étude. En outre, il importe d’apporter un soin particulier au lavage des échantillons afin d’éviter d’endommager les spécimens et ainsi de réduire sérieusement la fiabilité des déterminations taxinomiques ainsi que la rentabilité globale de l’opération. Des méthodes visant à protéger les spécimens, en particulier dans les échantillons marins, ont été proposées (Gray et al., 1990).
Pour les études en milieu marin, il est recommandé d’utiliser sur le terrain une paire de tamis à mailles de 1 000 et de 500 mm et de conserver et de traiter les échantillons retenus par le tamis à mailles de 500 mm uniquement si cela s’avère approprié. Le macrobenthos marin englobe typiquement les organismes retenus par les mailles de 500 à 1 000 µm (Reish, 1959; Thiel, 1975; Pearson, 1975; Holme et McIntyre, 1984; Gray et al., 1990). Il a été estimé qu’un tamis à mailles de 1 000 mm retient environ 95 % de la biomasse de la macrofaune marine (Reish, 1959), tout en réduisant la proportion, dans les échantillons obtenus, des formes juvéniles ou des spécimens appartenant à la méiofaune, lesquelles présentent une réaction fonctionnelle aux perturbations de l’environnement différente de celle des adultes des espèces composant la macrofaune (Schwinghamer, 1981, 1983; Warwick, 1986).
L’étude des plus petits organismes benthiques pour la détermination de l’ampleur et de la portée géographique dans les écosystèmes marins peut inclure l’évaluation de la méiofaune, en particulier les nématodes, les copépodes et les plus petits oligochètes, ou encore celle des foraminifères vivants et morts (Schwinghamr, 1981, 1983) ou celle des formes juvéniles de la macrofaune. Toutes ces approches nécessitent l’utilisation de mailles plus fines ou d’échantillonneurs différents de ceux qui sont actuellement recommandés (les carottiers peuvent convenir davantage à de telles études que les bennes – voir Holme et McIntyre, 1984). Toutefois, s’il est important d’amasser des données sur les formes de plus petite taille, le simple ajout d’un tamis supplémentaire risque de ne pas donner les résultats escomptés. Il convient d’évaluer l’efficacité des techniques d’échantillonnage pour les organismes de petite taille. En milieu marin, Gray et al. (1990) ont indiqué que le carottier est l’instrument le plus approprié pour la récolte du méiobenthos. Or, ce type d’appareil n’est pas recommandé pour le Programme d’ESEE. Par conséquent, avant d’entreprendre un tamisage plus fin, il convient d’élaborer des protocoles d’échantillonnage appropriés.
4.5.2 Équipement d’échantillonnage
Les études sur le benthos comportent deux aspects importants qui doivent être pris en compte : le maillage (voir section précédente) et l’équipement d’échantillonnage quantitatif. L’échantillonnage quantitatif des communautés benthiques s’effectue à l’aide de dispositifs qui couvrent une superficie préétablie ou qui prélèvent un volume connu de l’habitat, comme les bennes ou les filets. Les dispositifs choisis doivent être non sélectifs et convenir à la nature particulière du substrat. Les échantillons de benthos prélevés dans les substrats naturels fournissent des indications sur les facteurs de stress historiques et actuels. Il est donc recommandé d’utiliser des échantillonneurs qui permettent de récolter les organismes présents dans les sédiments, à moins que des obstacles d’ordre physique rendent cette opération impossible. L’échantillonneur utilisé pour une classe d’habitat donnée devrait être le même pour toutes les stations et pour toutes les zones. Toutefois, l’utilisation d’échantillonneurs différents est permise au cours d’une même étude, mais uniquement pour l’échantillonnage de classes d’habitat différentes. Par exemple, si des habitats d’érosion et de sédimentation doivent être échantillonnés dans des zones de références et des zones exposées, une des bennes recommandées pourrait être utilisée pour les habitats de sédimentation, alors qu’un échantillonneur Hess conviendrait mieux pour les habitats d’érosion. Il est également recommandé d’utiliser des bennes munies d’un grillage et de portes s’ouvrant par le haut afin de limiter le phénomène d’onde de choc pouvant entraîner la perte d’une partie du substrat et de faciliter l’examen (et, au besoin, la caractérisation chimique) de la surface non perturbée des échantillons de sédiments.
L’uniformisation des échantillonneurs benthiques facilite la comparaison des données des études des invertébrés benthiques à l’échelle régionale ou nationale. Des recommandations sont fournies ci-dessous quant aux dispositifs appropriés à utiliser pour les diverses classes d’habitat rencontrées durant les études d’invertébrés benthiques dans le cadre de l’ESEE. Eleftheriou et Holme (1984), Klemm et al. (1990) et Scrimgeour et al. (1993) présentent les options appropriées pour divers milieux récepteurs potentiels et résument les avantages et les inconvénients des appareils recommandés. Le choix d’un échantillonneur peut également être dicté par le type d’appareil qui a été utilisé au cours des études antérieures effectuées dans le même milieu. Pour assurer la comparabilité des études avec les études précédentes, il est recommandé d’utiliser des échantillonneurs similaires. Le lecteur est invité à consulter les références traitant des échantillonneurs quantitatifs et des méthodes appropriées citées par Klemm et al. (1990), Eleftheriou et Holme (1984), Elliott et Tullett (1978, 1983), Rosenberg (1978), Downing (1984) et Mason (1991). Voir également Rabeni et Gibbs (1978) et alberta Environment (1990).
L’uniformisation des techniques ne vise pas uniquement les échantillonneurs utilisés, mais également le niveau d’expérience requis pour les employer correctement. Les personnes qui manipulent ces appareils doivent avoir reçu une formation appropriée pour réduire le plus possible les variations due aux erreurs de manipulation. Par exemple, lorsqu’on procède à l’échantillonnage d’une zone d’érosion dans un cours d’eau, il est important d’uniformiser la profondeur à laquelle le substrat est remué, car certaines personnes pourraient faire preuve à cet égard d’un zèle excessif en brassant le substrat plus profondément et vigoureusement que d’autres. Il est essentiel que le chef d’équipe connaisse bien les méthodes d’échantillonnage des invertébrés benthiques et organise des séances de formation efficaces à l’intention des employés chargés de l’échantillonnage sur le terrain. Une bonne formation prévient normalement les erreurs liées à l’utilisateur (Reynoldson et Rosenberg, 1996).
Habitats de sédimentation - eau douce
Les bennes sont des appareils à mâchoires actionnées par des ressorts ou par gravité qui « mordent » dans les substrats meubles (sable, limon, vase, etc.) et prélèvent des sédiments sur une superficie déterminée du fond. Ces appareils sont généralement descendus au fond au bout d’une ligne ou d’un câble à partir d’une embarcation, parfois à l’aide d’un treuil. Si le dispositif choisi n’est pas adapté au type de substrat à échantillonner, l’efficacité de l’échantillonnage peut être compromise. Parmi les facteurs qui peuvent influer sur l’efficacité de l’échantillonnage, mentionnons la profondeur de pénétration, le degré de fermeture des mâchoires et la perte de matériel pendant la remontée. Dans les zones de sédimentation des cours d’eau ou des lacs, les bennes Ponar ou Ekman sont recommandées pour l’échantillonnage des invertébrés aux fins des ESEE. Veuillez consulter Eleftheriou et Holme (1984), Klemm et al. (1990) et Scrimgeour et al. (1993) pour en savoir plus sur les échantillonneurs.
Habitats d’érosion - eau douce
Les échantillonneurs à filet pour les cours d’eau sont des dispositifs qui permettent de capturer les organismes benthiques dans les cours d’eau exposés à l’érosion. Ces dispositifs comportent des mailles de différentes tailles (voir la section 4.5.1) qui permettent de tamiser les organismes qui sont délogés du substrat sur une superficie connue et emportés par le courant. Pour les habitats d’érosion en eau douce, il est recommandé d’utiliser un échantillonneur cylindrique de type Neill-Hess, car ce dernier permet d’estimer la superficie échantillonnée (généralement, 0,1 m2). Un des inconvénients de l’utilisation d’échantillonneurs cylindriques dans les cours d’eau est leur incompatibilité possible avec la granulométrie du substrat. En effet, dans certains systèmes, la taille moyenne des particules pourrait être trop grande pour que l’échantillonneur cylindrique Neill-Hess puisse échantillonner efficacement les invertébrés benthiques. Dans ce cas, un filet en U (Scrimgeour et al., 1993) peut fournir des échantillons sur une superficie délimitée et peut être modifié selon la granulométrie du substrat. Ce dispositif a été utilisé avec succès dans des substrats de granulométrie diverse (Glozier, 1989) et permet l’échantillonnage tant de roches individuelles que de superficies délimitées. Le filet troubleau, même s’il ne fournit pas d’estimation pour une superficie connue, a été largement utilisé au Royaume-Uni, aux États-Unis, en Australie et au Canada dans le cadre de programmes de suivi à grande échelle (Reynoldson et al., 1995). L’échantillonnage au filet troubleau convient particulièrement à l’approche des conditions de référence (ACR), qui prévoit l’échantillonnage de nombreuses stations. Un échantillon est prélevé pendant un temps prédéterminé à chaque station aux fins de l’estimation des descripteurs de la communauté benthique. La normalisation des méthodes d’échantillonnage au filet troubleau est essentielle pour préserver le pouvoir de comparaison et exige une formation minimale (Reynoldson et Rosenberg, 1996). L’échantillonnage au filet troubleau prévoit le prélèvement d’un seul échantillon composite à chaque station en déplaçant le filet pour une période de trois minutes pendant que le substrat est perturbé (Reynoldson et al., 1997). Il convient de noter qu’il n’est pas nécessaire de conserver séparément les sous-échantillons de terrain pour la méthode d’échantillonnage au filet troubleau recommandée pour l’ACR.
Pour l’échantillonnage d’habitats plus difficiles (p. ex., zones très profondes, à faible courant ou zones à substrat dur), d’autres types d’échantillonneurs comme les quadrats en métal ou les systèmes d’extraction à l’air peuvent se révéler utiles. Toutefois, pour les besoins des comparaisons aux échelles nationale ou régionale, les dispositifs d’échantillonnage recommandés devraient convenir dans la majorité des habitats présentant un intérêt particulier au plan écologique. Pour les habitats où l’échantillonnage se révèle très difficile, d’autres méthodes peuvent être utilisées.
4.5.3 Substrats artificiels
L’utilisation de substrats artificiels pour l’échantillonnage des invertébrés benthiques n’est généralement pas recommandée comme protocole d’échantillonnage dans le cadre d’un Programme d’ESEE.
Il n’y a aucun avantage à utiliser des substrats artificiels, quand les méthodes courantes fournissent des données au moins aussi fiables que les substrats artificiels, sans leurs nombreux inconvénients et problèmes (AETE, 1995). Les substrats artificiels ne permettent pas d’obtenir des échantillons représentatifs de la communauté benthique indigène du site où ils sont placés. Il s’agit d’engins sélectifs qui favorisent les espèces mobiles, sujettes à la dérive, des substrats durs. En outre, les substrats artificiels ne permettent pas de surveiller adéquatement les effets des contaminants présents dans les sédiments ou liés à ces derniers sur les organismes aquatiques, car les taxons associés aux sédiments sont généralement sous-représentés dans les échantillons prélevés à l’aide de substrats artificiels. Les communautés d’invertébrés sur les substrats artificiels reflètent uniquement les conditions qui prévalaient durant la période d’exposition et n’intègrent pas les effets à plus long terme. L’utilisation de substrats artificiels pour l’échantillonnage des invertébrés benthiques peut donc se révéler inefficace pour détecter les effets des effluents, particulièrement lorsque les espèces non mobiles, les contaminants liés aux sédiments et l’intégration à long terme des effets sont importants. Toutefois, il convient de noter que dans certaines circonstances particulières, notamment lorsque des substrats artificiels sont utilisés depuis longtemps dans un écosystème ou en présence de conditions extrêmes (plans d’eau très profonds à courant très fort), l’utilisation de substrats artificiels peut s’avérer la seule méthode de terrain possible et peut être envisagée conjointement à d’autres solutions de rechange, si elle permet de déterminer d’éventuels effets sur la communauté d’invertébrés benthiques d’une manière scientifiquement défendable.
4.5.4 Équipement d’échantillonnage dans les habitats marins et estuariens
Habitats de sédimentation – milieux marins et estuariens
Les habitats de sédimentation marins peuvent être échantillonnés à l’aide d’une benne Smith-McIntyre (benne Van Veen modifiée), qui est un appareil approprié et disponible au Canada. Eleftheriou et Holme (1984) passent en revue les méthodes d’échantillonnage utilisées en milieu marin. Toutefois, dans les zones infralittorales peu profondes où l’utilisation des plus grandes bennes est impossible, une petite benne Ponar peut être utilisée. Ce modèle peut être manipulé à partir d’un petit canot pneumatique et remonté à la main.
Les sédiments meubles intertidaux peuvent être échantillonnés au moyen de tout appareil couvrant une superficie d’au moins 0,1 m2. À l’aide d’un dispositif approprié, une profondeur de substrat meuble fixée à 10 cm est prélevée. Soulignons qu’on choisira de préférence la partie la plus profonde possible de la zone intertidale, puisque les conditions physiques moins rudes y favorisent une richesse et une abondance des espèces plus grande.
Habitats d’érosion - milieux marins et estuariens
Dans les milieux marins ou estuariens, une benne peut être utilisée pour échantillonner les sédiments meubles constitués de grosses particules (p. ex., gravier). Pour l’échantillonnage des substrats compacts des habitats d’érosion (intertidal et infralittoral), il est préférable d’utiliser des quadrats délimitant une superficie minimale de 0,1 m2. Toutefois, le recours à d’autres techniques quantitatives pourrait s’avérer nécessaire pour la collecte des mollusques et crustacés et d’autres espèces de plus grande taille. Parmi ces méthodes, mentionnons la récolte à la main par des plongeurs, la télédétection sur des surfaces définies (Eleftheriou et Holme, 1984; Gray et al., 1990), et les récoltes effectuées à l’intérieur de limites définies le long de transects. La description d’un protocole d’échantillonnage pour le milieu marin se trouve dans une série de rapports du Puget Sound Estuary Program (Tetra Tech, 1986a, 1986b, 1987). Lorsqu’ils sont effectués correctement, les relevés photographiques peuvent fournir des informations quantitatives, au moins pour les organismes épibenthiques de plus grande taille (voir Burd et al., 1990). Les coûts de traitement sont habituellement beaucoup plus bas que pour les relevés des matériaux meubles à l’aide d’une benne ou d’un carottier.
La zone intertidale devrait être échantillonnée si elle est fortement envahie par le panache de l’effluent. La détermination du niveau de marée présentant le plus d’intérêt pour l’étude des impacts de la mine de métaux devrait tenir compte de certaines considérations logistiques. Essentiellement, il est préférable d’échantillonner dans les portions les plus profondes de la zone intertidale puisque les conditions moins rudes qui les caractérisent favorisent une plus grande uniformité et diversité de la flore et de la faune (variabilité inter-échantillon). La répartition verticale des plantes et des animaux de cet habitat côtier reflète habituellement les gradients de divers paramètres environnementaux comme l’exposition à l’air, la température (y compris le gel), la salinité, l’intensité lumineuse et la photopériode, l’abrasion due aux troncs d’arbre ou à la glace et l’action des vagues. Il faut tenir compte de ces gradients lors de la planification et de la réalisation des études biologiques dans le milieu intertidal. Les protocoles d’échantillonnage adaptés à ces milieux diffèrent à certains égards de ceux décrits dans les sections précédentes (voir Gray et al., 1990). Lorsque c’est possible, il faut effectuer des relevés semi-quantitatifs à l’aide de quadrats de 0,1 m2. La détermination du substrat ou du type d’habitat à échantillonner dépend des limites des méthodes d’échantillonnage et de l’habitat dominant présent (pour en savoir plus sur la sélection de l’habitat dominant, voir la section 4.3.7). Toutefois, si la récolte d’échantillons s’avère impossible pour des considérations écologiques ou autres, on peut recourir à des relevés visuels, après consultation de l’agent d’autorisation local. Les relevés par examen visuel font appel à des techniques d’enregistrement et de cartographie (échelle approximative de 1/5 000) des principales caractéristiques biologiques, aux fins de l’évaluation des changements globaux de la communauté biologique.
4.5.5 Récipients à échantillons
D’après les directives d’Environnement Canada pour le suivi du benthos en eau douce (Guidelines for Monitoring Benthos in Freshwater Environments; EVS Environment Consultants, 1993), les récipients à échantillons doivent :
- être assez gros pour que l’échantillon n’occupe pas plus de 50 % du volume, le reste étant réservé à l’agent de conservation;
- être assez solides pour leur manipulation et leur transport réguliers;
- être étanches;
- posséder des propriétés physiques et chimiques qui ne sont pas modifiées par l’agent de fixation ou de conservation;
- être conformes au règlement sur le transport des marchandises dangereuses.
4.5.6 Fixation et conservation des spécimens
Il faut procéder sur le terrain à la fixation de tous les échantillons dans une solution tamponnée de formol à 10 % afin d’éviter que les vers marins et dulcicoles ne soient endommagés. Le formol est également couramment utilisé pour la conservation de la plupart des insectes aquatiques. La conservation directement dans l’éthanol entraîne souvent le ramollissement des spécimens, qui deviennent difficiles à manipuler. Après l’ajout de l’agent de conservation sur le terrain, il faut brasser doucement les récipients à échantillon à plusieurs reprises pour faire pénétrer l’agent dans tout matériel fin présent dans l’échantillon. Comme le formol est une substance cancérogène et irritante, les personnes qui l’utilisent doivent porter des gants et des verres, et le port de cet équipement de protection devrait être obligatoire. De plus, les récipients à échantillons incassables doivent être scellés à l’aide d’une pellicule de paraffine, placés dans un sac double pour le transport jusqu’au laboratoire et étiquetés convenablement. Les échantillons doivent être fixés aussitôt que possible après leur prélèvement pour éviter que les invertébrés prédateurs ne se nourrissent des autres invertébrés.
4.5.7 Assurance et contrôle de la qualité des travaux de terrain
Un survol des recommandations en matière d’assurance et de contrôle de la qualité (AQ/CQ) pour le volet terrain de l’étude des communautés d’invertébrés benthiques est présenté ci-dessous.
L’échantillonnage sur le terrain est la première étape de la collecte des données. Les procédures d’AQ/CQ pour l’étude des communautés d’invertébrés benthiques sont énoncées dans le plan d’étude et doivent être respectées à la lettre, de manière à garantir la haute qualité des données. Les modes opératoires normalisés de terrain devraient spécifier les équipements et les protocoles d’échantillonnage appropriés pour l’étude. Un plan d’AQ/CQ pour l’échantillonnage sur le terrain comporte de nombreux éléments, dont les principaux sont :
- tout le personnel participant à l’échantillonnage sur le terrain devrait avoir une formation appropriée et une bonne expérience de l’équipement et des objectifs de l’étude;
- toutes les consignes de sécurité doivent être connues, comprises et respectées;
- l’équipement d’échantillonnage devrait être adapté au type de plan d’eau et au groupe d’invertébrés étudiés et devrait être inspecté et entretenu régulièrement;
- il convient d’établir a priori des critères d’acceptabilité des échantillons obtenus et des consignes précises en cas de non-respect de ces critères (c.-à-d., circonstances justifiant le prélèvement d’un nouvel échantillon; pour un échantillon prélevé à l’aide d’une benne, une pénétration de 10 cm serait jugée acceptable [Gray et al., 1990]). De plus, les méthodes doivent être uniformes tout au long de l’étude;
- une description de l’examen visuel des échantillons prélevés à l’aide d’une benne devrait être consignée (couleur, odeur et texture des sédiments, présence de débris);
- la contamination pendant l’échantillonnage des paramètres chimiques devrait être vérifiée à l’aide de blancs de transport et d’analyse de l’eau utilisée pour le rinçage de l’équipement;
- le tamisage sur le terrain, s’il est nécessaire, devrait être effectué le plus rapidement possible après la récolte des échantillons;
- les échantillons doivent être entreposés dans des récipients adéquats, avec un agent de conservation approprié pour éviter leur détérioration;
- tous les récipients à échantillons doivent être convenablement étiquetés;
- un carnet de terrain détaillé devrait être tenu;
- des formulaires de chaîne de possession et des méthodes appropriées d’expédition et d’entreposage doivent être utilisés.
On trouvera de plus amples renseignements sur tous les aspects des procédures d’AQ/CQ applicables à l’étude des invertébrés benthiques dans le rapport de 1999 du programme ETIMA (Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique = Aquatic Effects Technology Evaluation Program [AETE]) (Beak, 1999).
4.6 Méthodes de laboratoire
Pour en savoir plus sur le tri des échantillons et le sous-échantillonnage, veuillez consulter le document Protocoles de tri des échantillons et de sous- échantillonnage dans les études de suivi des effets sur l’environnement portant sur les communautés d’invertébrés benthiques, accessible sur le site de l’ESEE (http://www.ec.gc.ca/esee-eem/default.asp?lang=Fr&n=B9DBF4CC-1).
4.6.1 Programme de certification de la NABS
L’identification exacte des invertébrés benthiques aquatiques est cruciale pour les programmes de suivi tels que le Programme d’ESEE des mines de métaux. La North American Benthological Society (NABS) a mis en œuvre un programme de certification pour l’identification des invertébrés benthiques. Ce programme évalue les connaissances et compétences des candidats en matière de taxinomie des invertébrés aquatiques et vérifie que ces derniers fournissent des identifications de haute qualité. Il est recommandé que l’identification des invertébrés benthiques soit effectuée par une personne qui a suivi et réussi le programme de certification de la NABS. Pour en savoir plus, veuillez visiter le site Web suivant : http://www.nabstcp.com/.
4.6.2 Niveau d’identification taxinomique
L’identification des invertébrés benthiques devrait satisfaire aux exigences du programme d’évaluation. Des recherches récentes indiquent qu’une identification jusqu’à la famille fournit un niveau de résolution taxinomique suffisant pour détecter les réponses des communautés aux perturbations anthropiques (Warwick, 1988a, 1988b; Bowman et Bailey, 1997). Comme il a été mentionné précédemment, le niveau de résolution taxinomique utilisé pour les études de suivi peut varier d’une étape à l’autre, des niveaux plus fins étant requis pour détecter des effets environnementaux plus subtils.
Aux fins du premier suivi et des suivis subséquents en eau douce, la famille est le niveau d’identification recommandé. Toutes les statistiques sommaires et les mesures descriptives doivent être calculées et présentées à ce niveau de résolution dans les rapports d’interprétation des résultats du premier suivi et des suivis subséquents. Les organismes qui ne peuvent être identifiés avec la précision taxinomique requise doivent être regroupés dans une catégorie distincte dans l’ensemble de données de base. L’utilisation de clés couvrant la région géographique étudiée est recommandée. Le tableau 4-2 présente les références taxinomiques généralement utilisées pour divers groupes d’organismes dulcicoles.
Pour certaines étapes, il peut être nécessaire de pousser plus loin l’identification selon les questions et les objectifs de l’étude. Le genre a été défini comme le plus bas niveau pratique pour la majorité des insectes, alors que pour les autres groupes, le plus bas niveau pratique est le plus bas niveau pouvant être atteint sans avoir recours à des méthodes spéciales (dissection, microscope) ou à des spécialistes (Taylor, 1997). Cette définition peut servir de guide si une identification plus fine s’avère souhaitable pour la détermination de l’ampleur et de la portée géographique ou la recherche des causes.
Certaines conditions propres aux sites peuvent justifier une identification plus fine pour une partie ou l’ensemble des familles taxinomiques. Par exemple, si dans les études historiques disponibles les invertébrés benthiques ont été identifiés à un niveau plus bas, il peut être souhaitable de poursuivre les travaux à ce même niveau à des fins de comparaison. Dans ce cas, les statistiques sommaires et les mesures descriptives peuvent être présentées pour ce niveau, à condition de fournir également un ensemble de données sommaires à l’échelle de la famille.
Les deux objectifs visés par la détermination de l’ampleur et de la portée géographique des effets peuvent nécessiter des niveaux de résolution taxinomique différents. L’identification jusqu’à la famille convient pour la détermination de la portée géographique des effets. Ce niveau d’identification fournit les données nécessaires pour calculer et présenter les statistiques sommaires et descriptives requises relatives à la portée géographique des effets. Ce premier objectif est similaire à ceux de la phase 1 et des suivis subséquents par sa portée, la principale différence étant l’ajout de zones exposées plus éloignées du point de rejet de l’effluent.
Lors du deuxième objectif, soit la détermination del’ampleur des effets, l’identification peut être faite à la famille, mais il peut aussi être nécessaire de mener une identification plus fine. La question suivante peut orienter le choix du niveau d’identification requis aux fins de l’évaluation de l’ampleur des effets :
- Quelle est l’ampleur de l’effet sur des groupes taxinomiques potentiellement sensibles aux caractéristiques de l’effluent rejeté au site en question (en d’autres mots, combien de groupes sont touchés parmi les familles sensibles)?
L’une ou l’autre des options suivantes peut être utilisée pour évaluer l’ampleur des effets durant la détermination de l’ampleur et de l’étendue géographique :
- Identifier jusqu’au plus bas niveau pratique tous les organismes échantillonnés. Cette façon d’établir l’ampleur des effets fournit des renseignements additionnels potentiellement utiles pour la conception de l’étude, au début de la recherche des causes.
- Analyser à nouveau les données des familles significativement touchées durant le premier suivi afin de déterminer des taxons indicateurs pouvant être utilisés pour évaluer l’ampleur des effets dans les stations plus éloignées. Par exemple, si un effet a été observé parmi la famille des Baetidés (ordre des Éphéméroptères) durant le premier suivi, il convient de pousser plus loin (p. ex., jusqu’au genre) l’identification de tous les Baetidés échantillonnés durant la détermination de l’ampleur et de la portée géographique des effets. Cette approche permet de répertorier les taxons sensibles dans la famille et d’évaluer l’ampleur des effets après examen des réponses observées à l’intérieur de ce sous-ensemble de taxons sensibles.
- D’autres approches scientifiquement défendables peuvent être utilisées pour évaluer l’ampleur des effets.
Pour tous les invertébrés benthiques provenant du milieu marin ou estuarien, il est recommandé de pousser l’identification jusqu’au niveau de lafamille. Dans les rapports d’interprétation, les statistiques sommaires doivent être calculées et présentées à ce même niveau. Divers auteurs ont examiné l’utilité de recourir aux taxons plus élevés pour le suivi environnemental de sites exposés à divers degrés de pollution organique en Europe (voir Warwick et Clarke [1993] et les références citées par ces auteurs). Dans le cas du benthos marin, les spécimens juvéniles et immatures devraient être identifiés et dénombrés séparément des adultes, car ils réagissent différemment aux effets environnementaux.
Bien que la famille soit le niveau d’identification recommandé pour la présentation des données et la détermination des effets, les mines de métaux peuvent opter pour une identification plus fine. Certaines conditions propres aux sites peuvent justifier ce niveau d’identification pour une partie ou l’ensemble des groupes familiaux. Par exemple, si dans les études historiques disponibles les invertébrés benthiques ont été identifiés à un niveau plus bas, il peut être souhaitable de poursuivre les travaux à ce même niveau à des fins de comparaison. Dans ce cas, les statistiques sommaires et les mesures descriptives peuvent être présentées pour ce niveau, à condition de fournir également un ensemble de données sommaires à l’échelle de la famille.
Dans le cas des échantillons marins, il est suggéré d’utiliser les collections de référence, si celles-ci contiennent un nombre suffisant de spécimens représentatifs, non seulement aux fins précitées, mais aussi pour élaborer pour chaque mine de métaux une base de données sur la taille et la biomasse, comme un autre indicateur ou outil (voir la section 4.11.4). À cette fin, il est recommandé de conserver 5 à 10 spécimens représentatifs de chaque taxon, en notant pour chacun d’eux les valeurs moyennes de la largeur, de la longueur et du poids frais égoutté.
4.6.3 Collections de référence
Pour obtenir des informations utiles pour le suivi des effets environnementaux, il faut s’assurer que l’identification des invertébrés est effectuée de façon uniforme durant toute la durée d’une étude ainsi que d’une étude à l’autre. Par conséquent, il est recommandé de constituer des collections d’organismes de référence à des fins de comparaison et de contrôle de la qualité des identifications taxinomiques. L’identité de chaque taxon versé dans la collection de référence devrait en outre être confirmée par un taxinomiste professionnel indépendant. Les musées sont parfois en mesure d’offrir ce service lorsque l’étude porte sur des régions éloignées et qu’il est probable que de nouvelles mentions de spécimens soient faites ou que des aires de répartition soient étendues. Les collections de référence peuvent être utilisées pour confirmer des identifications, assurer l’uniformité des déterminations taxinomiques entre les études et la formation du personnel. Des protocoles pour la préparation et l’entretien de collections de référence d’invertébrés benthiques sont présentés dans un rapport préparé pour le Plan d’action du Fraser d’Environnement Canada (Green, 1994). Selon les recommandations formulées dans ce rapport, chaque mine de métaux (ou groupe de mines de métaux) devrait constituer, entretenir et tenir à jour une collection de référence exhaustive contenant plusieurs spécimens représentatifs de chaque taxon et de chaque zone étudiée. Chaque spécimen devrait être identifié à l’aide d’une étiquette indiquant l’endroit et la date de capture. Ce genre de collection occupe peu de place et loge normalement dans une seule armoire. Cette collection devrait être sous la garde de la mine de métaux. Si cette dernière ne dispose pas des installations ou du personnel requis pour constituer, maintenir et entretenir sa propre collection de référence, il se peut qu’une université ou un musée soit en mesure de le faire à sa place. Toutefois, comme l’entretien à long terme du matériel biologique préservé nécessite un effort considérable, la quantité de matériel soumise doit être minimisée.
| Taxon | Références taxinomiques couramment utilisées |
|---|---|
| Clés générales | Merritt et Cummins, 1984, 1996; Peckarsky et al., 1990; Pennak, 1978; Thorp et Covich, 1991 |
| Clés régionales | Clifford, 1991 (Alberta) Lehmkuhl, 1975a, 1975b, 1976, 1979 (Saskatchewan) Laplante et al., 1991 (Québec) |
| Clés pour taxons particuliers | |
| ANNÉLIDES Oligochètes Hirudinés | Brinkhurst, 1986 Klemm, 1972, 1985, 1991 |
| CRUSTACÉS Amphipodes Décapodes Cladocères Copépodes | Bousfield, 1958 Brandlova et al., 1972 Dussart, 1969 Crocker et Barr, 1968 Fitzpatrick, 1983 |
| INSECTES | Chu et Cutkomp, 1992; Hilsenhoff, 1995 |
| PLÉCOPTÈRES (perles) | Fullington et Steward, 1980; Harper et Stewart, 1984; Hitchcock, 1974; Stewart et Stark, 1993 |
| ÉPHÉMÉROPTÈRES (éphémères) | Bednarik et McCafferty, 1979; Edmunds et al., 1976; Lewis, 1974; Morihara et McCafferty, 1979; McCafferty et Waltz, 1990; Waltz, 1994 |
| ODONATES (libellules et demoiselles) | Hilsenhoff 1995; Westfall and May 1996; Walker 1933, 1953, 1958; Walker and Corbet 1978 |
| TRICHOPTÈRES (phryganes) | Schefter et Wiggins, 1986; Schuster et Etnier, 1978; Wiggins, 1996 |
| COLÉOPTÈRES | Hilsenhoff et Schmude, 1992 |
| DIPTÈRES (mouches) | Hilsenhoff, 1995; Johannsen, 1977; Oliver et al., 1978; Saether, 1975, 1977; Simpson et Bode, 1980; Wiederhom, 1983, 1986; Wood et al., 1963 |
| GASTÉROPODES (escargots) | Burch, 1989; Clarke, 1981 |
| PÉLÉCYPODES (Bivalves; moules) | Mackie et al., 1980; Clarke, 1981; Burch, 1975a, 1975b; Mackie et Huggins, 1983 |
Le tableau 4-3 précise les niveaux de résolution taxinomique recommandés pour les principaux groupes d’invertébrés benthiques marins. Habituellement, le niveau de résolution taxinomique devrait être uniforme à l’intérieur de chaque groupe principal pour tous les échantillons prélevés durant une étude ainsi que d’une étude à l’autre. Les organismes qui ne peuvent être identifiés au niveau taxinomique requis doivent être regroupés dans une catégorie distincte dans l’ensemble de données de base, au niveau de résolution taxinomique le plus précis possible. Comme l’exactitude du travail taxinomique repose sur la disponibilité d’une documentation à jour, il est important d’avoir accès aux ouvrages taxinomiques de base. L’utilisation de clés couvrant la région géographique étudiée est fortement recommandée. Une liste détaillée des ouvrages taxinomiques pour les milieux marins et estuariens est présentée au tableau 4-4. Pour les taxons dont l’identification exige un examen microscopique détaillé, un montage sous lame de microscope peut s’imposer. La préparation de tels montages peut comporter plusieurs étapes, notamment la dissection, le lavage et la coloration des spécimens. Les techniques de montage sous lame de microscope sont décrites par Klemm et al. (1990). Dans le cas du benthos marins, les formes juvéniles ou immatures doivent être identifiées et dénombrées séparément des adultes, car elles présentent des réactions différentes aux effets environnementaux. Toutes les identifications doivent être effectuées ou vérifiées par un taxinomiste qualifié et expérimenté. Les collections de référence déjà établies peuvent également se révéler fort utiles. Le Centre de référence de l’Atlantique au Centre des sciences de la mer Huntsman, à St. Andrews (Nouveau-Brunswick), possède une excellente collection de référence. Des iconographies ont également été utilisées avec succès (Camburn et al., 1984-1986).
Tableau 4-3 : Niveaux de résolution taxinomique recommandés pour les invertébrés benthiques marins (approche du plus bas niveau taxinomique pratique) (description longue)
| Taxon | Niveau |
| Porifères | Classe |
| Cnidaires | Genre |
| Turbellariés | Genre |
| Némertéens | Genre |
| Nématodes | (à exclure des analyses*) |
| Sipunculiens | Espèce |
| Priapulides | Espèce |
| Brachiopodes | Genre |
| Bryozoaires | Family |
| Mollusques | |
| • Aplacophores • Gastéropodes • Bivalvia • Polyplacophores • Scaphopodes | Genre Espèce Espèce Genre Espèce |
| Annélides | |
| • Polychètes • Oligochètes | Espèce (sauf quelques immatures) Genre |
| Arthropodes | |
| • Pycnogonides • Céphalocarides • Malacostracés • Copépodes • Cirripèdes | Famille Sous-classe Espèce (à exclure des analyses*) Espèce |
| Ascidiacés | Famille |
| Échinodermes | Espèce |
* Les Nématodes et les Copépodes (p. ex. les Harpacticoïdes) appartiennent à la méiofaune, et seule une fraction des spécimens sera retenue dans un tamis à mailles de 500 ou 1 000 mm. Par conséquent, les données ne sont pas représentatives et doivent être exclues des analyses (Holme et McIntyre, 1984).
Tableau 4-4 : Clés taxinomiques – Invertébrés benthiques marins et estuariens du Canada (description longue)
Abbot 1974 (seashells)
Abbott, R.T., 1974 (Coquillages)
Abbott, R.T., Zim, H.S., Sandström, G.F., 2001 (Mollusques)
Appy et al., 1980 (Polychètes de la baie de Fundy)
Austin, W.C., 1985 (Invertébrés du Pacifique)
Baker, H.R., 1980 (Espèces de Tubificidés)
Banse, K., 1972; Banse, K., et Hobson, K.D., 1974 (Polychètes)
Berkeley, C., et Berkeley, E., 1952a, 1952b (Annélides du Pacifique)
Blake, J.A., 1971 (Polydora, Côte Est)
Blake, J.A., 1991 (Polychètes, Atlantique Nord)
Blake, J.A., 1988 (Phyllodocidés [Polychètes], Atlantique)
Bousfield, E.L., 1960 (Coquillages de l’Atlantique)
Bousfield, E.L., et Hendryks, E.A., 1994, 1995a, 1995b (Amphipodes du Pacifique)
Bousfield, E.L., et Hoover, P.M., 1995 (Amphipodes du Pacifique)
Bousfield, E.L., et Kendall, J.A., 1994 (Amphipodes du Pacifique)
Bousfield, E.L., 1973 (Amphipodes de l’Atlantique)
Brinkhurst, R.O., 1982 (Oligochètes)
Brinkhurst, R.O., et Baker, H.R., 1979 (Tubificidés marins [Oligochètes])
Brunel, P., Bossé, L. et Lamarche, G., 1998
(Catalogue des invertébrés du golfe du Saint-Laurent)
Butler, T.H., 1983 (Crevettes du Pacifique)
Clark, H.L., 1924 (Holothuroïdes)
Clark, H.L., 1915 (Ophiuroïdes)
Coates, K.A., 1980 (Enchytraeides de la Colombie-Britannique)
Coe, W.R., 1912 (Échinodermes, Atlantique)
Coe, W.R., 1943 (Némertes, Atlantique)
Cutler, E.B., 1973 (Sipunculiens)
Fauchald, K., 1977 (Polychètes)
Fournier, J.A., et Petersen, M.E., 1991 (Polychètes)
Gibson, R., 1994 (Némertéens)
Gosner, K.J., 1971
Graham, A., 1988 (Gastéropodes)
Hart, J.F.L., 1982 (Crabes de la Colombie-Britannique)
Hobson, K.D., et Banse, K., 1981 (Polychètes de la Colombie-Britannique)
Hyman, L.H., 1940 (Polycladidés (Turbellariés), Atlantique)
Hyman, L.H., 1944 (Turbellariés, Atlantique)
Keen, A.M., et Coan, E., 1974 (Mollusques)
Knight-Jones, P., 1978 (Spirorbidés [Polychètes], Pacifique et Atlantique)
Knight-Jones, P., 1983 (Sabellidés [Polychètes])
Kozloff, E.N., 1987 (Invertébrés du Nord-Ouest du Pacifique)
Lambert, P., 1981 (Étoiles de mer de la Colombie-Britannique)
Laubitz, D.R., 1972 (Caprellidés)
Light, W.J., 1977 (Spionidés [Polychètes], Pacifique)
Morris, P.A., 1951 (Mollusques, Atlantique)
Pettibone, M.H., 1963 (Polychètes, Atlantique)
Pettibone, M.H., 1992 (Pholoïdes [Polychètes])
Pettibone, M.H., 1993 (Polynoïdes [Polychètes])
Pohle, G.W., 1990 (Décapodes, Atlantique)
Sars, G.O., 1895 (Amphipodes)
Sars, G.O., 1899 (Isopodes)
Sars, G.O., 1900 (Cumacés)
SBMNH, 1994a,b,c, 1995a,b,c, 1996a,b,c, 1997a,b
Schultz, G.A., 1969 (Crustacés isopodes)
Smith, R.I., 1964 (Clés des invertébrés marins, Atlantique)
Squires, H.J., 1990 (Décapodes, Atlantique)
Steele, D.H., et Brunel, P., 1968 (Amphipodes)
Tattersall, W.M., et Tattersall, O.S., 1951 (Mysidacés)
Thorp, J.H., et Covich, A.P., 1991 (Clés des invertébrés dulcicoles)
Ushakov, P.V., 1955 (Polychètes)
Wallace, N.A., 1919 (Isopodes de la baie de Fundy)
Watling, L., 1979 (Cumacés, Atlantique)
Weiss, H.M., 1995 (Macrofaune marine)
4.6.4 AQ/CQ pour le traitement des échantillons d’invertébrés benthiques en laboratoire
Le traitement des échantillons et le dénombrement des divers taxons d’invertébrés s’effectuent en laboratoire. Une fois triés, les échantillons prélevés dans le cadre de chaque étude devraient être conservés en lieu sûr pendant au moins six ans, ou jusqu’à ce qu’on détermine qu’aucune information supplémentaire ne sera requise à leur sujet. Tous les échantillons doivent être traités de façon uniforme afin de réduire le plus possible les risques d’erreurs expérimentales lors des dénombrements. Pour limiter les erreurs de traitement, les éléments suivants devraient être intégrés au programme d’AQ/CQ :
- toutes les personnes qui participent au traitement et aux analyses des échantillons doivent avoir suivi une formation appropriée. À cet égard, la NABS a implanté un programme de certification pour les taxinomistes des invertébrés aquatiques. Pour obtenir des informations supplémentaires, consultez le site : http://www.nabstcp.com/;
- les effets du sous-échantillonnage (le cas échéant) sur les estimations de l’abondance doivent être évalués sur au moins 10 % des échantillons et documentés;
- une série d’échantillons choisis au hasard devrait être soumise à un nouveau tri aux fins de l’évaluation de l’efficacité du tri initial (voir ci-après);
- les références taxinomiques appropriées doivent être consultées, selon le type et l’emplacement géographique de l’habitat étudié;
- une collection de référence complète devrait être constituée pour chaque mine de métaux, vérifiée par un taxinomiste reconnu de l’extérieur et mise à jour au besoin (p. ex., lorsque de nouveaux taxons sont récoltés);
- le système utilisé pour l’archivage des échantillons devrait être décrit;
- des notes détaillées sur le traitement et l’analyse des échantillons en laboratoire doivent être consignées.
La première étape du traitement des échantillons consiste à séparer les organismes des débris et, au besoin, à sous-échantillonner les organismes triés en vue de pratiquer une identification plus poussée. Le taux d’erreur résultant inévitablement de ces activités devrait être estimé (voir par exemple Kreis, 1986, 1989).
4.6.4.1 Efficacité du tri
L’efficacité du tri peut être facilement vérifiée de façon ponctuelle si les débris résiduels d’un échantillon sont conservés. Il est recommandé de soumettre au moins 10 % des échantillons à un nouveau tri, et le critère de tri acceptable veut qu’au plus 10 % du nombre total d’organismes aient été manqués. Cette estimation doit être consignée dans le rapport d’interprétation. Si les organismes manqués constituent plus de 10 % du nombre total d’organismes pendant le nouveau tri, alors tous les échantillons du groupe d’échantillons doivent être triés de nouveau.
Il en ira de même lorsqu’un groupe entier d’invertébrés benthiques aura échappé à l’attention de la personne chargée du tri (c.-à-d. qu’il n’aura pas été reconnu comme un organisme), et ce, même si ces organismes représentent moins de 10 % du nombre total. Les facteurs suivants doivent être pris en compte dans la détermination de groupes d’échantillons semblables : 1) zone d’échantillonnage; 2) classe d’habitat; 3) personne effectuant le tri. Les directives d’AQ/CQ s’appliquent indépendamment à chaque groupe d’échantillons triés. Les fractions triées et non triées doivent être conservées tant et aussi longtemps que l’efficacité du tri et l’exactitude des identifications n’auront pas été confirmées.
4.6.4.2 Sous-échantillonnage
Le sous-échantillonnage des échantillons d’invertébrés en laboratoire est acceptable si la méthode utilisée est quantitative. Les gros échantillons ou ceux qui contiennent de grandes quantités de débris sédimentaires peuvent nécessiter un sous-échantillonnage avant le tri. Veuillez consulter la version révisée du document technique Protocoles de tri des échantillons et de sous-échantillonnage dans les études de suivi des effets sur l’environnement portant sur les communautés d’invertébrés benthiques (Environnement Canada, 2002), accessible sur le site Web du Bureau national des études de suivi des effets sur l’environnement (http://www.ec.gc.ca/esee-eem/Default.asp?lang=Fr&n=4B14FBC1-1). Le rapport détaillé de l’exactitude et de la précision du sous-échantillonnage, pour toutes les méthodes utilisées, est essentiel à l’AQ/CQ des études des invertébrés benthiques pour l’ESEE. Le critère d’un protocole de sous-échantillonnage acceptable est le suivant : les estimations de chaque groupe d’échantillons ne doivent pas différer par plus de 20 % des dénombrements réels. Lorsque l’erreur est supérieure à 20 % pour une technique de sous-échantillonnage donnée ou un type d’échantillon donné (type et quantité de matière organique), il faut modifier la technique pour atteindre le niveau de précision exigé ou faire le tri complet de tous les échantillons du groupe de sorte que le processus de sous-échantillonnage ne compromette pas l’intégrité des données. Les estimations sont ensuite comparées aux dénombrements réels, et l’exactitude des estimations ainsi que la précision entre les sous-échantillons peuvent être calculées au moyen de l’équation suivante :
% d’erreur de l’estimation = [1 – (nombre estimé dans l’échantillon/nombre réel)] × 100
L’exactitude devrait être mentionnée dans le rapport d’interprétation.
Il est recommandé qu’au moins 300 organismes soient prélevés d’un échantillon dans tout programme de sous-échantillonnage pour assurer une normalisation additionnelle. Dans le cas des stations d’échantillonnage où il a été impossible d’obtenir le nombre minimum d’organismes (300) recommandé ou pour lesquelles l’exactitude était faible, l’échantillon devrait être signalé lorsqu’il en est fait mention.
On trouvera de plus amples renseignements sur tous les aspects des procédures d’AQ/CQ applicables à l’étude des invertébrés benthiques dans le rapport de 1999 de l’ETIMA (Beak, 1999).
4.7 Évaluation et interprétation des données
4.7.1 Méthodes de traitement des données
4.7.1.1 AQ/CQ pour la saisie et la vérification des données
Une fois la saisie des données achevée, la première étape de l’analyse des données consiste à vérifier les erreurs de transcription. L’omission de cette étape invalide les analyses subséquentes. Il importe de vérifier toutes les données saisies en comparant un exemplaire imprimé du fichier aux feuilles de données brutes. Idéalement, cette vérification ne devrait pas être confiée à la personne qui a effectué la saisie originale. Les systèmes à double entrée et les vérifications de transcription à partir des registres de données originales sont des techniques de contrôle de la qualité utiles. Il faut clairement distinguer les données manquantes de l’absence d’un taxon en utilisant des codes uniques différents de 0 pour identifier les valeurs manquantes, avec les définitions des codes intégrées dans chaque fichier. L’utilisation de fichiers de données en mode lecture seulement permet d’assurer l’intégrité des données. Les préoccupations relatives à l’AQ/CQ en matière d’analyse des données sont la vérification et la validité des données, la répétitivité et la robustesse des analyses statistiques et la rigueur et la pertinence des analyses. Selon EVS Environment Consultants (1993), les résultats de l’analyse des données devraient être reproductibles. En d’autres mots, un chercheur analysant les données présentées en annexe d’un rapport particulier et utilisant les méthodes décrites dans ce rapport devrait parvenir aux mêmes conclusions que l’auteur du rapport. Les précautions additionnelles suivantes s’imposent durant la vérification et l’analyse des données :
- recourir à un personnel ayant reçu une formation appropriée et possédant l’expérience requise;
- utiliser diverses techniques de représentation graphique des données en vue de repérer les erreurs de transcription, les valeurs aberrantes et toutes autres données douteuses;
- présenter les données brutes sous forme de base de données électronique et, sous forme de tableaux, en annexe des rapports;
- décrire les méthodes (tests statistiques particuliers) et les logiciels (le cas échéant) utilisés aux fins des analyses;
- prendre des notes détaillées sur les analyses des données.
Pour de plus amples renseignements sur tous les aspects des méthodes d’AQ/CQ applicables aux programmes de suivi des invertébrés benthiques, veuillez consulter le rapport de 1999 de l’ETIMA 1999 (Beak, 1999).
4.7.1.2 Traitement des valeurs aberrantes
En posant l’hypothèse que la saisie a été effectuée correctement, les données devraient être synthétisées, épurées des valeurs erronées et aberrantes, évaluées quant à leur normalité et, le cas échéant, transformées (EVS Environment Consultants, 1993). Diverses techniques de représentation graphique comme les diagrammes en rectangles et moustaches, les courbes de distribution normale et les diagrammes arborescents peuvent être utilisés pour repérer les valeurs extrêmes (valeurs aberrantes véritables ou erreurs de saisie) (voir Tukey, 1977). Norris et Georges (1993) recommandent d’examiner les estimations de l’abondance de chaque taxon afin de déterminer si les valeurs enregistrées sont plausibles. Ils recommandent également de calculer les moyennes et les écarts-types, les valeurs excessivement élevées ou faibles pouvant indiquer des erreurs. Les valeurs extrêmes ou aberrantes qui ne sont pas dues à des erreurs doivent être conservées, car leur élimination entraînerait la perte d’observations et, de là, une baisse de la puissance statistique associée à l’étude de la communauté d’invertébrés benthiques. Il convient plutôt de souligner l’existence de ces valeurs dans le rapport et d’en préciser l’incidence sur les résultats en procédant à une nouvelle analyse après exclusion de ces valeurs.
4.7.1.3 Organismes inconnus, immatures et non benthiques
Dans plusieurs cas, des organismes non benthiques ont été inclus dans les études réalisées dans le cadre du Programme d’ESEE des effluents de mines de métaux. S’il est documenté qu’un groupe d’organismes donné peut, à un moment de son développement, s’établir sur le fond (tels que les Simocephalus), alors il est acceptable de l’inclure dans la communauté d’invertébrés benthiques étudiée. Toutefois, certaines espèces, comme celles appartenant au genre Daphnia qui sont planctoniques, doivent être retirées de l’ensemble de données.
Certains échantillons peuvent contenir des spécimens immatures impossibles à identifier jusqu’au niveau de résolution taxinomique recommandé. Une telle situation peut également survenir lorsque des caractéristiques essentielles à l’identification sont perdues à cause d’une conservation inadéquate des échantillons (p. ex., dissolution des coquilles des mollusques par le formol non tamponné). Pour rendre compte correctement des données brutes, les taxons non identifiés et leur abondance doivent être fournis dans les fichiers électroniques de données brutes et dans les annexes aux rapports. Toutefois, aux fins de l’analyse, les chercheurs et consultants devraient décider s’il convient ou non de répartir les spécimens inconnus selon l’abondance relative des taxons correctement identifiés. Il faut pour cela présumer que la répartition des spécimens inconnus correspond à celle des spécimens identifiés, ce qui n’est pas nécessairement le cas. Les solutions suivantes peuvent être considérées :
- exclure tous les spécimens immatures ou endommagés;
- regrouper tous les spécimens (matures et immatures, identifiés ou non) en une seule catégorie au niveau taxinomique supérieur suivant;
- traiter les taxons non identifiés comme des catégories distinctes au cours de l’analyse.
La première option n’est pas la meilleure solution si le taxon « problématique » représente une grande proportion de la communauté benthique totale. Quant à la deuxième option, elle présume que tous les taxons appartenant à un niveau taxinomique supérieur réagissent de la même façon aux éventuels effets nocifs de l’effluent, ce qui n’est pas nécessairement le cas. Enfin, la troisième option aura des effets variables sur l’interprétation des données, selon l’abondance du taxon en cause. La solution retenue dépend de l’expertise et de l’expérience du chercheur, mais elle devrait être décrite en détail dans le rapport d’interprétation à la section traitant des méthodes utilisées.
Pour les études en milieux marins, il est exigé que les individus immatures et juvéniles soient dénombrés séparément des adultes, qu’il soit possible ou non de les identifier à l’espèce, de manière à ce que l’analyse de la communauté d’adultes soit soustraite à l’influence confondante des formes juvéniles transitoires. Ainsi, les analyses devraient présenter les résultats avec et sans la présence des immatures. Cette précaution est nécessaire puisque les formes benthiques récemment fixées présentent des caractéristiques de survie différentes de celles des adultes, lesquels sont présents dans les sédiments depuis beaucoup plus longtemps et intègrent les effets des perturbations de l’habitat dans le temps. Selon la chronologie de l’échantillonnage, les juvéniles récemment fixés peuvent être abondants dans les échantillons, mais ils peuvent également tous périr en quelques jours sous l’influence des facteurs de stress, de la prédation ou de la compétition. Il faut toutefois se garder de conclure que les données sur les immatures ne sont pas importantes. Toute variation importante du taux de fixation des immatures entre deux échantillons voisins prélevés dans des habitats physiquement homogènes peut trahir l’existence de niveaux de stress différents. En ne combinant pas les groupes pour les analyses, on évite de fausser les résultats.
4.7.1.4 Réduction et transformation des données
La transformation des données est souvent effectuée sans prendre en considération les effets sur l’interprétation des résultats. Pour obtenir des renseignements généraux sur la transformation des données, veuillez consulter le chapitre 8. La transformation ne devrait être envisagée que s’il y a une connaissance parfaite des effets sur les données et leur interprétation, et uniquement si elle est nécessaire pour permettre les analyses statistiques. Les transformations devraient :
- homogénéiser les variances hétérogènes ou rendre la variance indépendante de la moyenne pour les analyses paramétriques;
- normaliser les distributions;
- linéariser les relations entre les variables;
- réduire les effets sur l’analyse multivariable (ou l’ordination) des taxons extrêmement dominants dans un ensemble de données;
- atténuer le problème que pose pour l’analyse la présence d’un trop grand nombre de zéros dans la matrice de données (voir Clarke et Green, 1988).
La réduction des données devrait servir uniquement à faciliter les analyses statistiques paramétriques ou multivariables, et ce, pour les mêmes raisons que celles invoquées pour la transformation des données. La réduction des données peut entraîner l’élimination ou le regroupement de taxons plus rares, ou la réduction des sous-échantillons par regroupement ou calcul de moyennes. Il existe divers protocoles de réduction des données pour les communautés marines, mais l’interprétation subséquente des résultats des analyses de données doit tenir compte des réductions effectuées. Par exemple, l’élimination des taxons rares pourrait conduire à l’exclusion d’au moins 90 % de la biomasse dans une station donnée si les organismes considérés sont de grande taille. Dans certains cas, les taxons rares peuvent être regroupés dans un niveau taxinomique supérieur, ce qui limite la perte d’informations, mais suppose qu’on considère comme uniforme le comportement des groupes taxinomiques mixtes ainsi formés. Stephenson et Cook (1980) passent en revue les principales méthodes de réduction des données et Burd et al. (1990) examinent certaines considérations écologiques associées à ces méthodes.
Des transformations logarithmiques ont souvent été appliquées aux données d’invertébrés benthiques, parce que l’abondance de ces organismes varie généralement de façon exponentielle (Green, 1979). La transformation logarithmique réduit l’importance des membres numériquement dominants et accroît la probabilité de déterminer la structure lorsque les différences observées sont dues à des taxons d’abondance moyenne ou rare. Toutefois, la transformation logarithmique est passablement radicale. D’autres chercheurs ont préconisé le recours à d’autres formes de conversion géométrique comme la racine carrée, la racine cubique, la racine quatrième, le logarithme naturel, etc. (voir Hoyle, 1973; Tukey, 1977; Hoaglin et al., 1983; Downing, 1981). Downing (1979) a démontré empiriquement que la meilleure transformation générale pour stabiliser la variance pour le benthos dulcicole était la racine quatrième (x0,25), puisque cette méthode améliore grandement la performance des méthodes multivariables paramétriques comme les ordinations. Après avoir répété l’exercice avec des communautés marines infralittorales, Vézina (1988) a conclu que ces communautés étaient empiriquement moins agrégées que les communautés dulcicoles et qu’elles nécessitaient donc une transformation moins radicale (p. ex., x0,4). Toutefois, les deux chercheurs insistent sur l’importance d’analyser les rapports entre la moyenne et la variance en vue de trouver la méthode de transformation la plus appropriée pour une communauté donnée. Cette étape permet de vérifier si la transformation choisie a bel et bien permis de stabiliser la variance.
4.8 Exigences relatives à la présentation des données
Les données sont présentées sous la forme d’une base de données électronique et sur support papier (rapport d’interprétation), conformément aux spécifications d’Environnement Canada (voir le chapitre 10 pour en savoir plus sur la présentation électronique). L’ensemble complet des données de base, incluant les données concernant les taxons rares ou d’abondance très variable et les identifications douteuses, devrait être conservé sous cette forme, même si une filtration des données a été réalisée avant le calcul des descripteurs de la communauté. Il est ainsi possible de recourir à d’autres méthodes de filtration, de calcul des descripteurs ou d’analyse lors d’analyses ou de méta-analyses ultérieures. La liste suivante présente les aspects des travaux sur le terrain et en laboratoire et des analyses des données de l’étude des invertébrés de l’ESEE qui doivent être décrits dans le rapport d’interprétation.
Travaux sur le terrain
- conserver les feuilles de terrain pendant six ans;
- préciser l’emplacement des stations répétées (coordonnées de quadrillage);
- préciser la date et l’heure de l’échantillonnage;
- indiquer la composition de l’équipe d’échantillonnage;
- décrire l’habitat, y compris les variables environnementales connexes;
- décrire les méthodes d’échantillonnage utilisées, y compris le type et la taille du dispositif d’échantillonnage ainsi que le maillage des filets et tamis.
Travaux en laboratoire
- conserver les feuilles de rapport d’analyse pendant six ans;
- consigner les données brutes pour chaque sous-échantillon de terrain individuel ou regroupé, en précisant les taxons présents et le nombre de spécimens;
- décrire les méthodes et le niveau de sous-échantillonnage utilisés lors du tri en laboratoire;
- présenter l’efficacité du tri atteinte;
- indiquer les références taxinomiques consultées;
- préciser le lieu où sont conservées les collections de référence et décrire les vérifications taxinomiques effectuées.
Analyse des données
- fournir en annexe des tableaux de l’abondance de chaque taxon répertorié dans chaque échantillon;
- fournir des tableaux synoptiques des descripteurs calculés avec les estimations de la variance;
- fournir des estimations de la puissance atteinte durant l’étude;
- décrire les effets des valeurs aberrantes ou extrêmes sur les résultats (le cas échéant);
- préciser dans quelle mesure les objectifs de qualité des données, les modes opératoires normalisés et les protocoles d’échantillonnage ont été respectés, et signaler tout problème éventuel décelé au cours de l’AQ/CQ.
4.9 Critères d’effet et critères d’appui de la communauté d’invertébrés benthiques
Densité totale des invertébrés : nombre total de spécimens récoltés par station, toutes catégories taxinomiques confondues, exprimé par unité de surface (p. ex., nombre d’invertébrés/m2). Les valeurs de densité devraient être indiquées pour chaque station. Ces valeurs doivent être accompagnées de la moyenne arithmétique (± erreur type, ± ET [écart-type]), de la médiane et des valeurs maximale et minimale pour la zone.
Richesse des taxons (familles) : nombre total de catégories taxinomiques différentes récoltées à chaque station. Ces valeurs doivent être accompagnées de la moyenne arithmétique (± erreur type, ± ET), de la médiane et des valeurs maximale et minimale pour la zone.
Indice de régularité (indice de régularité de Simpson) (équitabilité) : La régularité (R) peut être quantifiée pour chaque station. La moyenne (R moyen ± erreur type, ± ET), la médiane, les valeurs minimale et maximale pour la zone doivent être présentées. La régularité est calculée selon la méthode de Smith et Wilson (1996):
![]()
où :
R = régularité
pi = proportion du ie taxon à la station
S = nombre total de taxons à la station
Indice de similarité (indice de Bray-Curtis [B-C])* : L’indice de Bray-Curtis est un coefficient de distance qui varie de 0 pour deux sites possédant des descripteurs identiques à 1 pour deux sites totalement différents. La valeur du coefficient rend donc compte du degré d’association entre les sites. L’indice de B-C fait partie de la classe des coefficients de distance qualifiés de semimétriques, que certains appellent coefficients de dissimilarité. L’indice de B-C mesure le pourcentage de différence entre les sites (Legendre et Legendre, 1983), et la mesure de distance (D) se calcule selon l’équation suivante :
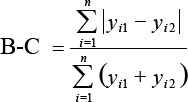
où :
B-C = distance de Bray-Curtis entre les sites 1 et 2
yi1 = nombre d’invertébrés de taxon i au site 1
yi2 = nombre d’invertébrés de taxon i au site 2
n = nombre total de taxa présent dans les deux sites
La distance de Bray-Curtis (B-C) calculée à partir de la médiane des stations de référence devra être indiquée pour chaque station, et la moyenne arithmétique (± erreur type, ± ET) et les valeurs maximale et minimale pour chaque zone. Comme l’application de cet indice à la détermination des effets peut être nouvelle pour certains, nous présentons ci-dessous un certain nombre de références traitant de la question ainsi qu’un exemple détaillé illustrant l’utilisation de cet indice dans le cadre d’une étude de la communauté d’invertébrés benthiques.
La plupart des descripteurs des communautés d’invertébrés dont il est question ci-dessus constituent des mesures de la densité totale et de la richesse des taxons et ne fournissent aucune information quantitative sur les types d’organismes présents. L’utilisation d’un indice de similarité est donc également recommandée, car il résume en un seul chiffre la différence globale de la structure des communautés entre les sites de référence et les sites exposés. En outre, il ne repose sur aucune prémisse concernant la nature de la communauté et varie dans une seule direction (Taylor et Bailey, 1997). Parmi les divers indices disponibles, le coefficient de Bray-Curtis (Bray et Curtis, 1957) est le plus fiable selon de nombreux auteurs (Bloom, 1981; Pontasch et al., 1989; Jackson, 1993). Il est également peu affecté par la nature des communautés comparées (Bloom, 1981), et les différences ont la même contribution au calcul du coefficient, sans égard à l’abondance du taxon. Après avoir examiné quatre indices, Bloom (1981) a conclu que seul l’indice de Bray-Curtis rendait fidèlement la vraie ressemblance entre les sites.
Exemple de l’utilisation de l’indice de Bray-Curtis dans le cadre du Programme d’ESEE
Cet exemple vise à illustrer comment il convient d’utiliser cet indice pour évaluer les effets dans le cadre d’un Programme d’ESEE. La base de données utilisée pour les besoins de la présente démonstration comporte cinq stations échantillonnées dans la zone de référence et cinq stations dans la zone exposée, chacune présentant cinq taxons.
- la densité de chaque taxon est inscrite dans un tableau;
- une densité médiane est calculée pour chaque taxon pour les stations de référence (voir tableau ci-dessous).
Tableau montrant la densité des taxons médian des stations de référence Densité des taxons Stations de référence Taxon 1 Taxon 2 Taxon 3 Taxon 4 Taxon 5 Réf. 1 2 3 2 3 1 Réf. 2 3 5 2 4 3 Réf. 3 9 1 1 1 1 Réf. 4 4 6 3 4 1 Réf. 5 5 4 2 3 2 Médiane de référence 4 4 2 3 1 - Un tableau similaire est élaboré pour les stations exposées. Aucune médiane n’est calculée.
Tableau montrant la densité des taxons médians pour les stations exposition. Densité des taxons Stations exposées Taxon 1 Taxon 2 Taxon 3 Taxon 4 Taxon 5 Exp. 1 23 4 2 10 1 Exp. 2 12 2 2 8 3 Exp. 3 14 6 1 6 2 Exp. 4 13 1 3 12 2 Exp. 5 15 3 2 4 1 - La distance entre chaque station (référence et exposée) et la médiane de référence est calculée selon la séquence exposée ci-dessous pour la station 1.
Pour cette approche, la médiane de référence pour un taxon donné devient yi2, soit le nombre d’invertébrés du taxon i au site 2 dans l’équation présentée précédemment.
La distance entre chaque station (référence et exposée) et la médiane de référence Taxa 1 Taxa 2 Taxa 3 Taxa 4 Taxa 5 Réf. 1 (yi1) 2 3 2 3 1 Médiane de référence (yi2) 4 4 2 3 1 | yi1-yi2 | ou
Réf. 1 - médiane de référence2 1 0 0 0 (yi1+yi2) 6 7 4 6 2
En remplaçant les éléments de l’équation de l’indice de B-C par leur valeur, on obtient :
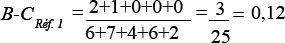
- La distance de Bray-Curtis par rapport à la médiane de référence est calculée de la même façon pour chaque station.
- Les résultats sont présentés pour chaque station, avec la moyenne (± erreur type) pour la zone.
Le calcul des distances de Bray-Curtis avec la base de données fictive donnerait les résultats suivants :
Le calcul des distances de Bray-Curtis Station Σ | yi1-yi2 | Σ (yi1+yi2) Distance de B-C
par rapport à la médianeMoyenne
± erreur typeRéf. 1 3 25 0,12 0,18 ± 0,06 Réf. 2 5 31 0,16 Réf. 3 11 27 0,41 Réf. 4 4 32 0,13 Réf. 5 2 30 0,07 Exp. 1 26 54 0,48 0,43 ± 0,03 Exp. 2 17 41 0,41 Exp. 3 17 43 0,40 Exp. 4 23 45 0,51 Exp. 5 13 39 0,33 - Enfin, pour vérifier la présence éventuelle d’un effet dans la zone exposée, la distance de Bray-Curtis moyenne entre les stations de référence et la médiane de référence (0,18 ± 0,06) peut être comparée statistiquement à la distance moyenne entre les stations exposées et la médiane de référence (0,43 ± 0,03).
Indice de diversité de Simpson (D) : l’indice de diversité de Simpson tient compte tant de l’abondance et que de la richesse taxinomique de la communauté d’invertébrés. Il est calculé en déterminant la contribution relative (ou proportionnelle) de chaque catégorie taxinomique au total observé à chaque station. La valeur de D calculée pour chaque station devrait être indiquée, avec la moyenne (± erreur type, ± ET), la médiane et les valeurs maximale et minimale de D pour la zone. Le calcul de l’indice de diversité de Simpson s’effectue selon l’équation suivante (Krebs, 1985) :
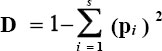
où :
D = indice de diversité de Simpson
S = nombre total de taxons à la station
pi = proportion du ie taxon à la station
Densité de chaque taxon (famille) : nombre d’individus de chaque taxon (famille), exprimé par unité de surface (p. ex., nombre d’invertébrés/m2). Les valeurs de densité doivent être indiquées pour chacun des taxons à chaque station. Ces valeurs doivent être accompagnées de la moyenne (± erreur type) de chaque taxon pour la zone.
Abondance relative de chaque taxon (familles) : abondance relative (exprimée en pourcentage) de chaque taxon à chaque station. Ces valeurs doivent être accompagnées du pourcentage moyen (± erreur type) pour chaque taxon pour la zone.
Présence/absence de chaque taxon (familles) : présentée sous la forme d’une matrice indiquant la présence ou l’absence de chaque taxon à chaque station d’échantillonnage. Les colonnes correspondent aux stations, et les lignes, aux taxons.
Outre les descripteurs des invertébrés benthiques, les variables de suivi des sédiments sont également présentées (voir le chapitre 7).
4.10 Évaluation des résultats
4.10.1 Effets sur la communauté d’invertébrés benthiques
L’objectif de l’étude de la communauté des invertébrés benthiques réalisée dans le cadre du Programme d’ESEE est de répondre à la question suivante :
« L’effluent a-t-il des effets sur la communauté d’invertébrés benthiques? »
La définition du terme « effet » est donnée à l’article 1 de l’annexe 5 du Règlement sur les effluents des mines de métaux.
Pendant les premières phases du programme de suivi et lors de la détermination de l’ampleur et de la portée géographique, les critères d’effet suivants sont calculés et rapportés. Ils servent à déterminer s’il y a des effets sur la communauté d’invertébrés benthiques :
- la densité totale des invertébrés benthiques;
- la richesse des taxons (familles);
- l’indice de régularité (de Simpson);
- l’indice de similarité (de Bray-Curtis).
Pour le volet des invertébrés benthiques, il est recommandé de calculer et de présenter également les critères d’appui suivants :
- Indice de diversité de Simpson
- Densité de chaque taxon (familles)
- Abondance relative de chaque taxon (familles)
- Présence/absence de chaque taxon (familles)
Tous ces critères, décrits en détail à la section précédente (4.9), sont essentiellement des paramètres sommaires choisis pour englober toute l’étendue des effets éventuels de l’effluent d’une mine de métaux.
De nombreux autres descripteurs des invertébrés benthiques sont proposés dans la documentation scientifique. Si on le souhaite, d’autres descripteurs propres au site peuvent être calculés et servir à étayer l’interprétation des effets. Resh et al. (1995) énumèrent les divers critères qui orientent la sélection de ces descripteurs et évaluent leur applicabilité à l’étude des invertébrés benthiques.
Pour les analyses statistiques et la détermination du niveau de puissance approprié, les recommandations relatives à l’établissement de la taille de l’effet et des valeurs de a et de b formulées à la section 8.6.1 demeurent valides. Il était recommandé dans cette section d’utiliser des valeurs de a et b égales ne dépassant pas 0,10. La méthode d’analyse convenant à chacun des types de plans d’étude (c.-à-d., ANOVA, ANCOVA, régression, analyse multivariable) est indiquée au tableau 4-1.
Une dernière mise en garde concernant l’étude des effets sur la communauté d’invertébrés benthiques s’impose. Il est essentiel que l’exploitant de la mine de métaux choisisse un plan d’étude propre au site afin de mener une évaluation appropriée. Il est donc vital de bien choisir la ou les zones de référence (voir la section 4.3.5). L’exemple assez courant qui suit illustre l’importance de sélectionner judicieusement la ou les zones de référence. Si une mine de métaux opte pour un plan contrôle-impact simple comportant une zone de référence en amont, ce sont les différences relevées entre la communauté en amont et la communauté en aval qui, selon leur importance, indiqueront la présence ou l’absence d’effets. Toutefois, si les communautés se trouvant en aval sont perturbées par un facteur tel que le rétablissement du débit original qui était obstrué en amont (p. ex., par une digue), ces communautés, bien que différentes de celles se trouvant en amont, pourraient ressembler davantage, mais sans nécessairement être similaires, à celles d’une zone de référence choisie dans un bassin hydrographique adjacent (ou plus éloignée du point de rejet). En pareilles circonstances, la sélection d’une zone de référence additionnelle (voir l’exemple fourni à la figure 4-2d) pourrait bien être justifiée en dépit des coûts supplémentaires découlant d’une telle décision, l’interprétation et l’évaluation des effets à chaque site pouvant alors être réalisées de façon appropriée. Dans cet exemple, les différences significatives relevées entre les zones en amont et en aval ne seront pas nécessairement considérées comme un effet si un nombre suffisant de données additionnelles tendent à démontrer le contraire.
4.10.2 Prochaine étape
Une fois les données de suivi analysées, il faut décider de la prochaine étape du Programme d’ESEE. Cette étape dépend de la relation entre plusieurs facteurs clés, qui sont brièvement examinés ci-dessous.
La conclusion statistique de l’étude des invertébrés benthiques précédente
L’étude de la communauté d’invertébrés benthiques peut conduire à l’une des trois conclusions statistiques suivantes :
- aucun effet n’est détecté, mais la puissance est insuffisante (puissance < 0,90);
- aucun effet n’est détecté et la puissance est suffisante (puissance ≥ 0,90);
- un effet est détecté.
Si l’un des critères d’effet (densité totale des invertébrés, richesse des taxons, indice de régularité [de Simpson] et indice de similarité [de Bray-Curtis]) révèle la présence d’une différence statistiquement significative entre les zones exposées et les zones de référence (ou le long d’un gradient), il faut conclure à la présence d’un effet sur la communauté d’invertébrés benthiques. Diverses méthodes statistiques peuvent conduire à ce résultat. Le choix des méthodes dépend du plan d’étude du programme de suivi.
Si la puissance est insuffisante, la mine de métaux peut réévaluer le nombre de stations d’échantillonnage retenues ou le plan d’échantillonnage choisi de manière à ce que la prochaine étude ait la puissance requise.
Options du Programme d’ESEE lorsque des effets ont été décelés
Si des effets sur la communauté d’invertébrés benthiques sont détectés, il faudra répondre à la question suivante :
Les effets sont-ils liés à l’exploitation de la mine de métaux?
Les questions suivantes peuvent aider à déterminer si les effets observés sont effectivement liés à l’exploitation de la mine de métaux :
- La cause des effets est-elle connue ou soupçonnée?
- Les effets peuvent-ils être imputés à un changement naturel des conditions dans l’environnement aquatique récepteur?
- Les effets peuvent-ils être raisonnablement corrélés à un facteur anthropique autre que l’effluent de la mine de métaux?
- L’approche fondée sur le poids de la preuve indique-t-elle une relation de cause à effet (voir la section 4.11)?
Cette série de questions peut être utilisée comme approche pour permettre de déterminer si les effets observés sont liés à la mine de métaux. Si la présence de facteurs de confusion rend difficile la détermination des effets de l’effluent de la mine de métaux sur la communauté d’invertébrés benthiques, la mine de métaux devrait réexaminer le plan d’étude pour la phase suivante. Si les effets observés sont confirmés et que leur cause est inconnue, la mine de métaux passe à l’étape suivante de l’évaluation et de l’interprétation des données : la détermination de l’ampleur et de la portée géographique des effets.
L’ampleur et la portée géographique des effets sont-elles connues?
Si les effets observés sont confirmés (voir le chapitre 1 pour plus de détails sur les effets confirmés) et que leur cause est inconnue, la mine de métaux passe à l’étape suivante et détermine l’ampleur et la portée géographique des effets. Pour en savoir plus, veuillez consulter la section 4.2.2.
4.11 Autres outils pour le suivi ciblé, les approches fondées sur le poids de la preuve ou la recherche des causes
Un certain nombre d’autres outils et approches peuvent être utilisés pour la recherche des causes dans le cadre du Programme d’ESEE. Les méthodes décrites dans le présent guide ne se veulent pas exhaustives et les mines de métaux peuvent proposer d’autres approches scientifiquement défendables. Les outils doivent être rentables, reconnus dans les publications scientifiques et offerts par les laboratoires consultants, universitaires et gouvernementaux, et ils doivent satisfaire aux exigences du Programme d’ESEE.
Des renseignements complémentaires se trouvent dans les chapitres 9 et 12 du présent guide.
4.11.1 Application des approches fondées sur le poids de la preuve à la recherche des causes des effets
Pour distinguer parmi les impacts cumulatifs d’agents de stress multiples, dont les effets peuvent parfois se confondre, il faut établir clairement un lien de cause à effet avec l’effluent étudié. Cette situation s’impose particulièrement dans le cadre des évaluations environnementales des écosystèmes aquatiques, car ces derniers reçoivent souvent plus d’un effluent présentant des effets interdépendants. L’évaluation des résultats d’un suivi est souvent fondée, dans une large mesure, sur les données de suivi sur le terrain. Or, si ces données permettent d’établir des corrélations entre l’effluent d’une mine de métaux et son effet présumé, elles ne révèlent pas l’existence d’une relation claire de cause à effet. L’utilisation d’une approche fondée sur le poids de la preuve alliant des informations de provenances diverses peut cependant faciliter l’établissement d’un tel lien. Pour en savoir plus sur l’utilisation des approches fondées sur le poids de la preuve, veuillez consulter les chapitres 9 et 12 du présent guide technique.
4.11.2 Essais de toxicité létale et sublétale
Les essais de toxicité létale et sublétale peuvent être utilisés durant les études de l’ampleur et de la portée géographique des effets et de la recherche des causes lorsqu’un effet a été détecté ou lorsque des travaux antérieurs n’ont pas permis d’élucider de façon satisfaisante les causes. Ces méthodes permettent de déterminer directement la toxicité létale ou sublétale et de confirmer que les perturbations du benthos sont attribuables à la toxicité de l’effluent plutôt qu’à des facteurs de confusion. Par exemple, les effets néfastes sur la structure de la communauté d’invertébrés benthiques peuvent être dus à d’autres facteurs que la toxicité de l’effluent, dont des différences de conditions environnementales. Mais lorsque l’altération de la structure de la communauté s’accompagne d’une toxicité, l’effluent devrait être la cause des changements observés chez les invertébrés benthiques. Ces méthodes fournissent également des renseignements importants pour l’interprétation des effets notés sur le terrain lorsque les données sur la communauté d’invertébrés benthiques sont peu concluantes ou lorsque seulement des espèces tolérant la pollution sont présentes dans les sites exposés et les sites de référence.
4.11.3 Analyse de carottes de sédiments pour l’étude des tendances historiques
Le profil sédimentaire des zones de sédimentation des plans d’eau peut refléter les conditions limnologiques récentes et anciennes (Frey, 1988). La détermination précise de l’âge des sédiments combinée à un inventaire des restes de certains organismes et végétaux (p. ex., diatomées, zooplancton, insectes) permet de retracer la chronologie des changements, lesquels sont souvent liés à la période d’influence anthropique. Cette façon de faire permet de reconstituer non seulement l’histoire du plan d’eau, mais aussi celle des bassins hydrographique et atmosphérique, et de distinguer les effets des événements naturels de ceux des perturbations anthropiques. De nombreux ouvrages ont été rédigés sur le sujet. Frey (1988) présente une synthèse des connaissances dans ce domaine. Malheureusement, ce type d’analyse exige une grande expertise, et les services paléolimnologiques demeurent peu disponibles. En outre, les analyses ne révèlent que les tendances qui se sont maintenues sur de longues périodes (plusieurs années à plusieurs décennies) du fait de la nature des processus de sédimentation comme la bioturbation. Le coût de ces analyses varie selon les caractéristiques des sites étudiés.
4.11.4 Autres paramètres associés aux invertébrés benthiques et autres organismes
Les invertébrés benthiques sont les principaux organismes indicateurs dont l’utilisation est recommandée dans le cadre d’un Programme d’ESEE pour le suivi des effets sur les habitats du poisson. Toutefois, les niveaux d’identification et les mesures recommandés dans le présent guide ne constituent pas la liste des seules mesures permettant d’évaluer les communautés d’invertébrés benthiques. D’autres mesures comme la biomasse, un niveau d’identification taxinomique plus poussé, la production secondaire et divers paramètres rendant compte du degré d’adaptation des communautés d’invertébrés peuvent également se révéler utiles pour les programmes de suivi.
En milieu marin, la biomasse des invertébrés benthiquespeut livrer des informations additionnelles utiles parce qu’elle renseigne sur la quantité d’énergie disponible pour les autres niveaux trophiques (p. ex., poissons). Pour les communautés marines, certains chercheurs affirment qu’une analyse de l’abondance et de la biomasse des organismes benthiques fournit un indicateur sensible des changements de la composition de la communauté benthique (p. ex., Warwick, 1986; Warwick et al., 1987; Clarke, 1990; Burd et al., 1990). Ainsi, dans les échantillons marins, la distribution de la biomasse permet de séparer les trois principaux groupes fonctionnels d’organismes benthiques, soit la microfaune (organismes vivant à la surface des particules de sédiments), la méiofaune (organismes occupant les espaces interstitiels) et la macrofaune (organismes fouisseurs et épifaune) (Schwinghamer, 1981, 1983). Comme ces trois groupes d’organismes présentent des modes de reproduction, des rythmes métaboliques, des adaptations environnementales et des cycles vitaux différents, ils réagissent différemment aux perturbations de l’habitat. Cette particularité peut devenir fort importante dans les habitats infralittoraux arctiques, où l’abondance peut être faible mais les individus de grande taille. Toutefois, la mesure précise de la biomasse peut être fastidieuse et difficile (Crisp, 1984), à moins qu’elle soit effectuée selon un niveau de précision et une fréquence excédant la portée d’un Programme d’ESEE. Ainsi, l’analyse des échantillons prélevés dans le cadre d’un tel programme permet seulement de révéler les changements relatifs de biomasse. La méthode consiste à mesurer le poids humide égoutté de spécimens adultes de taille représentative de chacune des espèces répertoriées au cours de chaque étude. Comme cette méthode est non destructrice, la collection de référence peut être utilisée à cette fin avant la vérification externe ou l’archivage. Le poids moyen d’une espèce donnée peut alors être utilisé pour transformer les données d’abondance en biomasse relative aux fins de la réalisation d’analyses statistiques additionelles. Ces données n’indiquent que les changements relatifs importants et ne peuvent être utilisées pour déduire la production ou le flux trophique au sein des communautés benthiques.
Outre les invertébrés benthiques, plusieurs autres types de biote aquatique ont été envisagés en vue du Programme d’ESEE. Parmi les plus pertinents figuraient : 1) le phytoplancton; 2) les macrophytes; 3) le périphyton.
4.12 Références
Abbott, R.T. 1974. American Seashells. 2nd Edition. New York (NY), Van Nostrand Reinhold Co. 633 pages.
Abbott, R.T., H.S. Zim et G.F. Sandström. 2001. Seashells of North America. A Guide to Field Identification. Golden Field Guides from St. Martin’s Press. New York (NY), St. Martin’s Press. 280 pages.
AETE – Aquatic Effects Technology Evaluation Program. 1995. Field Evaluation of Aquatic Effects Monitoring Methods-Pilot Study. Volume 1. AETE Project 4.1.1. Ottawa (Ont.), Centre canadien de la technologie des minéraux et de l'énergie.
Alberta Environment. 1990. Selected Methods for the Monitoring of Benthic Invertebrates in Alberta Rivers. Environmental Quality Monitoring Branch, Alberta Environment.
Appy, T.D., I.F. Linkletter et M.J. Dadswell. 1980. A Guide to the Marine Flora and Fauna of the Bay of Fundy: Annelida: Polychaeta. Biological Station, St. Andrews (NB), Fisheries and Marine Service Technical Report No. 920. 124 pages.
Austin, W.C. 1985. An Annotated Checklist of Marine Invertebrates in the Cold Temperate Northeast Pacific, Vol. 1, 2 and 3. Cowichan Bay (C.-B.), Khoyatan Marine Laboratory, Rapport pour Pêches et Océans Canada.
Bailey, R.C., R.H. Norris et T.B. Reynoldson. 2003. Bioassessment of Freshwater Ecosystems. Boston (MA), Kluwer.
Baker, H.R. 1980. Key to the Common Tubificid Species of the Northeast Pacific. Manuscript from Oligochaeta Workshop.
Banse, K. 1972. « Redescription of some species of Chone Kröyer and Euchone Malmgren, and three new species (Sabellidae, Polychaeta) », Fishery Bulletin, 70 (2) : 459-495.
Banse, K, et K.D. Hobson. 1974. Benthic Errantiate Polychaetes of British Columbia and Washington. Ottawa (Ont.), Bulletin of the Fisheries Research Board of Canada 185. 111 pages.
Barber, W.E., et N.R. Kevern. 1974. « Seasonal variation of sieving efficiency in a lotic habitat », Freshwater Biology, 4 : 293-300.
Beak. 1999. Quality Assurance Program for Assessing Mine-Related Effects Using Benthic Invertebrate Communities. Aquatic Effects Technology Evaluation (AETE) project 2.1.4. Ottawa (Ont.), Ressources Naturelles Canada, Centre canadien de la technologie des minéraux et de l'énergie (CANMET). 33 pages.
Bednarik, A.F., et W.P. McCafferty. 1979. Biosystematic Revision of the Genus Stenonema (Ephemeroptera: Heptageniidae). Bulletin canadien des sciences halieutiques et aquatiques, no 201. 73 pages.
Berkeley, C., et E. Berkeley. 1952a. Canadian Pacific Fauna, 9. Annelida 9b (1) Polychaeta Errantia. Toronto (Ont.), University of Toronto Press, Fisheries Research Board of Canada.
Berkeley, C., et E. Berkeley. 1952b. Canadian Pacific Fauna 9. Annelida 9b (2) Polychaeta Sedentaria. Toronto (Ont.), University of Toronto Press, Fisheries Research Board of Canada.
Blake, J.A. 1971. « Revision of the genus Polydora from the east coast of North America (Polychaeta: Spionidae) », Smithsonian Contributions to Zoology, 75 : 1-32.
Blake, J.A. 1988. « New species and records of Phyllodocidae (Polychaeta) from Georges Bank and other areas of the western North Atlantic », Sarsia, 73 : 245-257. Bergen ISSN 0036-4827.
Blake, J.A. 1991. « Revision of some genera and species of Cirratulidae (Polychaeta) from the western North Atlantic », dans M.E. Petersen et J.B. Kirkegaard (éd.), Systematics, Biology and Morphology of World Polychaeta. Proceedings of the Second International Polychaete Conference, Copenhagen, August 18-23, 1986. Ophelia Supplement 5. Pp. 17-30.
Bloom, S.A. 1981. « Similarity indices in community studies: Potential pitfalls », Marine Ecology Progress Series, 5 : 125-128.
Booth, J., D.E. Hay et J. Truscott. 1996. Standard Methods for Sampling Resources and Habitats in Coastal Subtidal Regions of British Columbia: Part 1: Review of Mapping with Preliminary Recommendations. Rapport technique canadien des sciences halieutiques et aquatiques, no 2118 : viii + 53 pages.
Bousfield, E.L. 1958. « Fresh-water amphipod crustaceans of glaciated North America », Canadian Field-Naturalist, 72 (2) : 55-113.
Bousfield, E.L. 1973. Shallow-Water Gammaridean Amphipoda of New England. Ithaca (NY), Cornell University Press.
Bousfield, E.L. 1960. Canadian Atlantic seashells. Ottawa (Ont.), Ministère du Nord canadien et des Ressources nationales, Musée national du Canada. 72 pages.
Bousfield, E.L., et E.A. Hendryks. 1994. « The amphipod superfamily Leucothoidea on the Pacific coast of North America. Family Pleustidae: subfamily Pleustinae. Systematics and Biogeography », Amphipacifica, 1 (2) : 3-69.
Bousfield, E.L., et E.A. Hendryks. 1995a. « The amphipod Family Pleustidae on the Pacific coast of North America. Part III. Subfamilies Parapleustinae, Dactylopleustinae, and Pleusirinae: systematics and distributional ecology », Amphipacifica, 2 (1) : 65-133.
Bousfield, E.L., et E.A. Hendryks. 1995b. « The amphipod superfamily Eusiroidea in the North American Pacific region. I. Family Eusiridae: systematics and distributional ecology », Amphipacifica, 1 (4) : 3-60.
Bousfield, E.L., et P.M. Hoover. 1995. « The amphipod superfamily Pontoporeioidea on the Pacific coast of North America. II. Family Haustoriidae. Genus Eohaustorius J.L. Barnard: systematics and distributional ecology », Amphipacifica, 2 (1) : 35-63.
Bousfield, E.L., et J.A. Kendall. 1994. « The amphipod superfamily Dexaminoidea of the North American Pacific coast; families Atylidae and Dexaminidae: systematics and distributional ecology », Amphipacifica, 1 (3) : 3-66.
Bowman, M.F., et R.C. Bailey. 1997. « Does taxonomic resolution affect the multivariate description of the structure of freshwater benthic macroinvertebrate communities? », Canadian Journal of Fisheries and Aquatic Sciences, 54 : 1802-1807.
Brandlova, J., Brandl Z. et C. H. Fernando. 1972. « The Cladocera of Ontario with remarks on some species and distribution », Canadian Journal of Zoology, 50 : 1373-1403.
Bray, J.R., et J.T. Curtis. 1957. « An ordination of the upland forest communities of southern Wisconsin », Ecological Monographs, 27 : 325-349.
Brinkhurst, R.O. 1982. British and Other Marine and Estuarine Oligochaetes. Synopses of the British Fauna (N.S.) 21. Cambridge (Royaume-Uni), Cambridge University Press. 127 pages.
Brinkhurst, R.O. 1986. Guide to the Freshwater Aquatic Microdrile Oligochaetes of North America. Publication spéciale canadienne des sciences halieutiques et aquatiques no 84. Ottawa (Ont.), Pêches et Océans Canada, Direction de l’information et des publications scientifiques. 259 pages.
Brinkhurst, R.O., et H.R. Baker. 1979. « A review of the marine Tubificidae (Oligochaeta) of North America », Canadian Journal of Zoology, 57 : 1553-1569.
Brunel, P., L. Bossé et G. Lamarche. 1998. Catalogue des Invertébrés marins de l’estuaire et du golfe du Saint-Laurent / Catalogue of the Marine Invertebrates of the Estuary and Gulf of Saint Lawrence. Publication spéciale canadienne des sciences halieutiques et aquatiques no 126. Ottawa (Ont.), Conseil national de recherches du Canada. 405 pages.
Burch, J.B. 1975a. Freshwater Sphaeriacean clams (Mollusca: Pelecypoda) of North America. Hamburg (MI), Malacological Publications.
Burch, J.B. 1975b. Freshwater Unionacean Clams (Mollusca: Pelecypoda) of North America. Hamburg (MI), Malacological Publications.
Burch, J.B. 1989. North American Freshwater Snails. Ann Arbor, (MI), Malacological Publications. 365 pages.
Burd, B.J., A. Nemec et R.O. Brinkhurst. 1990. « The development and application of analytical methods in benthic marine infaunal studies », Advances in Marine Biology, 26 : 169-247.
Butler, T.H. 1983. Shrimps of the PacificCoast of Canada. Bulletin canadien des sciences halieutiques et aquatiques, no 202. Ottawa (Ont.), Ministère des Pêches et des Océans.
Camburn, K.E., J.C. Kingston et D.F. Charles (éd.). 1984-1986. PIRLA Diatom Iconograph. Contient 53 planches photographiques et 1059 figures avec légendes. PIRLA unpublished Report Series, Report No. 3. Bloomington (IN), Indiana University.
Chu, H.F., et L.K. Cutkomp. 1992. How to Know the Immature Insects. 2nd edition. Dubuque (IA), Wm. C. Brown Publishers.
Clark, H.L. 1915. « Catalogue of recent ophiurans », Mem. Mus. Comp. Zool. Harv., 25: 165-376 + 20 plates.
Clark, H.L. 1924. « Some holothurians from British Columbia », Canadian Field-Naturalist, 38 : 54-57.
Clarke, A.H. 1981. Les Mollusques d’Eau Eouce du Canada. Ottawa (Ont.), Musée national des sciences naturelles, Musées nationaux du Canada. 447 pages.
Clarke, K.R. 1990. « Comparisons of dominance curves », Journal of Experimental Marine Biology and Ecology, 138 : 143-157.
Clarke, K.R., et R.H. Green. 1988. « Statistical design and analysis for a ‘biological effects’ study », Marine Ecology Progress Series, 46 : 213-226.
Clarke, R.T., M.T. Furse et J.F. Wright. 1992. A Comparison of Single, Paired and Three Season Combined Macro-Invertebrate Samples for the Biological Banding of River Quality. Bristol (R.-U.), National Rivers Authority.
Clifford, H.F. 1991. Aquatic Invertebrates of Alberta. Edmonton (Alb.), University of Alberta Press. 538 pages.
Coates, K.A. 1980. Keys to Intertidal Genera and Species of Enchytraeidae found in British Columbia. Manuscript from Oligochaeta Workshop. Victoria (C.-B.), University of Victoria.
Coe, W.R. 1912. « Echinoderms of Connecticut », Connecticut State Geological and Natural History Survey, 19 :1-147.
Coe, W.R. 1943. « Biology of the nemerteans of the west coast of North America », Transactions of the Connecticut Acadademy of Arts and Sciences, 35 : 129-328 + plates 1-4.
Cowardin, L.M., V. Carter, F.C. Golet et E.T. LaRoe. 1979. Classification of wetlands and deepwater habitats of the United States. Washington (DC), U.S. Fish and Wildlife Service. FWS/OBS-79/31.
Cowardin, L.M., et F.C. Golet. 1995. « US Fish and Wildlife Service 1979 wetland classification: A review », Vegetatio, 118 : 139-152.
Crisp, D.J. 1984. « Energy flow measurements», dans N.A. Holme et A.D. McIntyre (éd.), Methods for the Study of Marine Benthos. IBP Handbook 16. Oxford (Royaume-Uni), Blackwell Scientific Publications. Pp. 284-370.
Crocker, D.W., et D.W. Barr. 1968. Handbook of the Crayfishes of Ontario. Toronto (Ont.), University of Toronto Press. 158 pages.
Cuffney, T.F., M.E. Gurtz et M.R. Meador. 1993. Guidelines for the Processing and Quality Assurance of Benthic Invertebrate Samples Collected as part of the National Water-Quality Assessment Program. U.S. Geological Survey Open-File Report 93-407.
Culp, J.M., R.B. Lowell et K.J. Cash. 2000. « Integrating mesocosm experiments with field and laboratory studies to generate weight-of-evidence risk assessments for large rivers », Environmental Toxicology and Chemistry, 19 : 1167-1173.
Cutler, E.B. 1973. « Sipuncula of the western North Atlantic », Bulletin of the American Museum of Natural History, 152 (3) : 1-204.
Downing, J.A. 1979. « Aggregation, transformation and the design of benthos sampling programs », Journal of the Fisheries Research Board of Canada, 36 : 1454-1463.
Downing, J.A. 1981. « How well does the fourth-root transformation work? », Canadian Journal of Fisheries and Aquatic Sciences, 38 : 127-129.
Downing, J.A. 1984. « Sampling the benthos of standing waters », dans J.A. Downing et F.H. Rigler (éd.), A Manual on Methods for the Assessment of Secondary Productivity in Fresh Waters. Second Edition. IBP Handbook 17. Oxford (Royaume-Uni), Blackwell Scientific Publications. Pp. 87-130.
Downing, J.A. 1986. « Spatial heterogeneity: Evolved behaviour or mathematical artefact? », Nature, 323 : 255-257.
Dussart, B. 1969. Les copépodes des eaux continentales. Paris (FR), Éditions N. Boubée & Cie. 292 pages.
Edmunds Jr., G.F., S.L. Jensen et L. Berner. 1976. The Mayflies of North and Central America. Minneapolis (MN), University of Minnesota Press. 330 pages.
Eleftheriou, A., et N.A. Holme. 1984. « Macrofauna techniques », dans N.A. Holme et A.D. McIntyre (éd.), Methods for the Study of Marine Benthos. IBP Handbook 16. Oxford (Royaume-Uni), Blackwell Scientific Publications. Pp. 140-216.
Elliott, J.M. 1977. Some Methods for the Statistical Analysis of Samples of Benthic Invertebrates. Freshwater Biological Association Scientific Publication No. 25. Ambleside (Royaume-Uni), Freshwater Biological Association. 160 pages.
Elliott, J.M., et P.A. Tullett. 1978. A Bibliography of Samplers for Benthic Invertebrates. Freshwater Biological Association Occasional Publication No. 4. Ambleside (Royaume-Uni), Freshwater Biological Association. 61 pages.
Elliott, J.M., et P.A. Tullett. 1983. A Supplement to a Bibliography of Samplers for Benthic Macroinvertebrates. Freshwater Biological Association Occasional Publication No. 20. Ambleside (Royaume-Uni), Freshwater Biological Association. 27 pages.
Environnement Canada. 2002. Le Guide révisé pour les protocoles de tri des échantillons et de sous-échantillonnage pour les ESEE portant sur les communautés d’invertébrés benthiques. Ottawa (Ont.). Bureau national des ESEE, Environnement Canada.
EVS Environment Consultants. 1993. Guidelines for Monitoring Benthos in Freshwater Environments. Prepared for: Environment Canada, 224 West Esplanade, North Vancouver, B.C.
Fauchald, K. 1977. The Polychaeta Worms. Definitions and Keys to Orders, Family and Genera. Science Series 28. Los Angeles (CA), Natural History Museum of Los Angeles County,. 188 pages.
Finlayson, C.M., et A.G. van der Valk. 1995. « Wetland classification and inventory: A summary », Vegetatio, 118 (1-2) : 185-192.
Fitzpatrick Jr., J.F. 1983. How to Know the Freshwater Crustacea. Dubuque (IA), Wm. C. Brown Publishers.
Fournier, J.A., et M.E. Petersen. 1991. « Cossura longocirrata: Redescription and distribution, with notes on reproductive biology and a comparison of described species of Cossura (Polychaeta: Cossuridae) », Ophelia Supplement, 5 : 63-80.
Frey, D.G. 1988. « What is paleolimnology? », Journal of Paleolimnology, 1 : 5-8.
Frith, H.R., G. Seraring, P. Wainwright, H. Harper et B. Emmett. 1993. Review of Habitat Classification Systems and an Assessment of their Suitability to Coastal B.C. Rapport inédit. Sidney (C.-B.), L.G.L. Ltd pour Environnement Canada, Direction des services des urgences environnementales.
Fullington, K.E., et K.W. Stewart. 1980. « Nymphs of the stonefly genus Taeniopteryx (Plecoptera: Taeniopterygidae) of North America », Journal of the Kansas Entomological Society, 53 : 237-259.
Gibson, R. 1994. Nemerteans. 2nd edition. Synopses of the British Fauna (New Series) No. 24. Shrewsbury (Royaume-Uni), Field Studies Council. 224 pages.
Glozier, N. 1989. The Effects of Biotic and Abiotic Factors on the Foraging Success of a Lotic Minnow, Rhinichthys cataractae. Mémoire de maîtrise. Calgary (AB), University of Calgary. 151 p.
Gosner, K.I. 1971. Guide to the Identification of Marine and Estuarine Invertebrates. New York (NY), J. Wiley and Sons. 693 pages.
Graham, A. 1988. Molluscs: Prosobranchs and Pyramellid Gastropods. 2nd edition. D.M. Kermack & R.S.K. Barnes (éd.), Synopses of the British Fauna (New Series) No. 2. The Linnean Society of London.
Gray, J.S., K.R. Clarke, R.M. Warwick et G. Hobbs. 1990. « Detection of initial effects of pollution on marine benthos: An example from the Ekofisk and Eldfisk oilfields, North Sea », Marine Ecology Progress Series, 66 : 285-299.
Green, R.H. 1979. Sampling Design and Statistical Methods for Environmental Biologists. Toronto (Ont.), John Wiley and Sons. 257 pages.
Green, G. 1994. Protocols for Reference and Voucher Collections of Aquatic Invertebrates Stored at the Royal British Columbia Museum. DOE-FRAP 1994-15.
Harper, P.P., et K.W. Stewart. 1984. « 13. Plecoptera », dans R.W. Merritt et K.W. Cummins (éd.), An Introduction to the Aquatic Insects of North America. 2nd edition. Dubuque (IA), Kendall/Hunt Publ. Co. Pp. 182-230.
Hart, J.F.L. 1982. Crabs and Their Relatives of British Columbia. Handbook No. 40. Victoria (C.-B.), British Columbia Provincial Museum.
Hauer, F.R., et G.A. Lamberti (éd.). 1996. Methods in Stream Ecology. San Diego (CA), Academic Press Inc. 674 pages.
Hay, D.E., R.D. Waters et T.A. Boxwell (éd.). 1996. Proceedings, Marine Ecosystem Monitoring Network Workshop, Nanaimo, B.C. March 28-30. 1995. Rapport technique canadien des sciences halieutiques et aquatiques, no 2108. 160 pages.
Hilsenhoff, W.L. 1995. Aquatic Insects of Wisconsin. Keys to Wisconsin Genera and Notes on Biology, Habitat, Distribution and Species. Madison (WI), Publication Number 3 of the Natural History Museams Council, University of Wiconsin-Madison. 79 pages.
Hilsenhoff, W.L., et K.L. Schmude. 1992. « Riffle beetles of Wisconsin (Coleoptera: Dryopidae, Elmidae, Lutrochidae, Psephenidae) with notes on distribution, habitat, and identification », Great Lakes Entomologist, 25 (3) : 191-213.
Hitchcock, S.W. 1974. Guide to the Insects of Connecticut. Part VII. The Plecoptera or Stoneflies of Connecticut. Bulletin of the State Geological and Natural History Survey of Connecticut 107. vi + 262 pages.
Hoaglin, D.C., F. Mosteller et J.W. Tukey. 1983. Understanding Robust and Exporatory Data Analysis. New York (NY), John Wiley.
Hobson, K.D., et K. Banse. 1981. Sedentariate and Archiannelid Polychaetes of British Columbia and Washington. Bulletin 209. Ottawa (Ont.), Ministère des Pêches et des Océans.
Holme, N.A., et A.D. McIntyre (éd). 1984. Methods for the Study of Marine Benthos. IBP Handbook 16. Oxford (Royaume-Uni), Blackwell Scientific Publications. 387 pages.
Hoyle, M.H. 1973. « Transformations – An introduction and a bibliography », International Statistical Review, 41 : 203-223.
Hurlbert, S.H. 1984. « Pseudoreplication and the design of ecological field experiments », Ecological Monographs, 54 : 187-211.
Hyman, L.H. 1940. « The polyclad flatworms of the Atlantic coast of the United States and Canada », Proc. U.S. Nat. Mus., 89 : 449-495.
Hyman, L.H. 1944. Marine Turbellaria from the Atlantic coast of North America. American Museum Novitates, No. 1266. 15 pages.
Jackson, D.A. 1993. « Multivariate analysis of benthic invertebrate communities: The implication of choosing particular data standardizations, measures of association, and ordination measures », Hydrobiologia, 268 : 9-26.
Johannsen, O.A. 1977. Aquatic Diptera. Los Angeles (CA), Entomological Reprint Specialists. Fourth reprinting.
Johnson, R.K., T. Wiederholm et D.M. Rosenberg. 1993. « Freshwater biomonitoring using individual organisms, populations, and species assemblages of benthic macroinvertebrates », dans D.M. Rosenberg et V.H. Resh (éd.), Freshwater Biomonitoring and Benthic Macroinvertebrates. New York (NY), Chapman and Hall. Pp. 40-125.
Jónasson, P.M. 1955. « The efficiency of sieving techniques for sampling freshwater bottom fauna », Oikos, 6 : 183-207.
Keen, A.M., et E. Coan. 1974. Marine Molluscan Genera of Western North America. Palo Alto (CA), Stanford University Press.
Klemm, D.J. 1972. Freshwater Leeches (Annelida: Hirudinea) of North America. U.S. Environmental Protection Agency, Identification Manual No. 8. Washington (DC), U.S. Environmental Protection Agency. 53 p.
Klemm, D.J. 1985. A Guide to the Freshwater Annelida (Polychaeta, Naidid and Tubificid Oligochaeta, and Hirudinea) of North America. Dubuque (IA), Kendall/Hunt Publ. Co. 198 pages.
Klemm, D.J. 1991. « Taxonomy and pollution ecology of the Great Lakes region leeches (Annelida: Hirudinea) », Michigan Academician, 24 : 37-103.
Klemm, D.J., P.A. Lewis, F. Fulk et J.M. Lazorchak. 1990. Macroinvertebrate Field and Laboratory Methods for Evaluating the Biological Integrity of Surface Waters. EPA 600/4-90/030. Cincinnati, (OH), U.S. Environmental Protection Agency, Environmental Monitoring Laboratory.
Knight-Jones, P. 1978. « New Spirorbidae (Polychaeta: Sedentaria) from the East Pacific, Atlantic, Indian and southern oceans », Zoological Journal of the Linnean Society, 64 : 201-240.
Knight-Jones, P. 1983. « Contributions to the taxonomy of Sabellidae (Polychaeta) », Zoological Journal of the Linnean Society, 79 : 245-295.
Kozloff, E.N. 1987. Marine Invertebrates of the Pacific Northwest. Seattle (WA), University of Washington Press.
Krebs, C.J. 1985. Ecology. The Experimental Analysis of Distribution and Abundance. Third edition. New York (NY), Harper and Row. 800 pages.
Kreis Jr., R.G. 1986. « Variability study. Section 17 », dans D.F. Charles et D.R. Whitehead (éd.), Paleoecological Investigation of Recent Lake Acidification (PIRLA): Methods and Project Description. Palo Alto (CA), Electric Power Research Institute.
Kreis Jr., R.G. 1989. « Variability Study - Interim Results. Section 4 », dans D.F. Charles et D.R. Whitehead (éd.), Paleoecological Investigation of Recent LakeAcidification (PIRLA): 1983-1985: Interim Report. October 1989. Palo Alto (CA), Electric Power Research Institute.
Kronberg, I. 1987. « Accuracy of species and abundance minimal areas determined by similarity area curves », Marine Biology, 96 : 555-561.
Lambert, P. 1981. The Sea Stars of British Columbia. B.C. Provincial Museum Handbook No. 39. Victoria (C.-B.), British Columbia Provincial Museum.
Laplante, S., Y. Bousquet, P. Bélanger et C. Chantal. 1991. Liste des espèces de coléoptères du Québec. Fabreries, Supplément no 6. Sillery (QC), Association des entomologistes amateurs du Québec. 136 pages.
Laubitz, D.R. 1972. The Caprellidae (Crustacea, Amphipoda) of Atlantic and Arctic Canada. Publication en océanographie biologique no 4. Ottawa (Ont.), Musée national des sciences naturelles, Musées nationaux du Canada. 82 pages.
Legendre, L., et P. Legendre. 1983. Numerical Ecology. Amsterdam (NL), Elsevier.
Lehmkuhl, D.M. 1975a. « Field guide to aquatic insect families », Blue Jay, 33 : 199-219.
Lehmkuhl, D.M. 1975b. « Saskatchewan damselflies and dragonflies », Blue Jay, 33 : 18-27.
Lehmkuhl, D.M. 1976. « Mayflies », Blue Jay, 34 : 70-81.
Lehmkuhl, D.M. 1979. How to Know the Aquatic Insects. Dubuque (IA), Wm. C. Brown Company Publishers.168 pages.
Leopold, L.B., G.M. Wolman et J.P. Miller. 1964. Fluvial Processes in Geomorphology. San Francisco (CA), W.H. Freeman and Co. 522 pages.
Leopold, L.B. 1994. A View of the River. Cambridge (MA), Harvard University Press. 297 pages.
Lewis, P.A. 1974. Taxonomy and Ecology of Stenonema Mayflies (Heptageniidae: Ephemeroptera). EPA-670/4-74-006. Cincinnati (OH), U.S. Environmental Protection Agency. 81 pages.
Levings, C.D., et R.M. Thom. 1994. « Habitat changes in the Georgia Basin: Implications for resource management and restoration », dans R.C.H. Wilson, R.J. Beamish, F. Aitkens et J. Bell (éd.), Review of the Marine Environment and Biota of Strait of Georgia, Puget Sound and Juan de Fuca Strait. Proceedings of the BC/Washington Symposium on the Marine Environment, Jan. 13-14, 1994. Rapport technique canadien des sciences halieutiques et aquatiques, no 1948. Pp. 330-351.
Light, W.J. 1977. « Spionidae (Annelida: Polychaeta) from San Francisco Bay, California: A revised list with nomenclatural changes, new records, and comments on related species from the northeastern Pacific Ocean », Proceedings of the Biological Society of Washington, 90 (1) : 66-88.
Lowell, R.B. 1997. Discussion Paper on Critical Effect Size Guidelines for EEM using Benthic Invertebrate Communities. Report to the Environmental Effects Monitoring Program. EEM/1997/9.
Lowell, R.B., J.M. Culp et M.G. Dubé. 2000. « A weight-of-evidence approach for northern river risk assessment: Integrating the effects of multiple stressors », Environmental Toxicology and Chemistry, 19 : 1182-1190.
Mackie, G.L., D.S. White et T.W. Zdeba. 1980. A Guide to Freshwater Molluscs of the Laurentian Great Lakes with Special Emphasis on the Genus Pisidium. EPA-600/3-80-068. Duluth (MN), U.S. Environmental Protection Agency, Office of Research and Development, Environmental Research Laboratory. 143 pages.
Mackie, G.L., et D.G. Huggins. 1983. Sphaeriacean Clams of Kansas. Technical Publications of the State Biological Survey of Kansas. Lawrence (KS), University of Kansas. 92 pages.
Malley, D.F., et J.B. Reynolds. 1979. « Sampling strategies and life history of non-insectan freshwater invertebrates », Journal of the Fisheries Research Board of Canada, 36 : 311-318.
Mason, C.F. 1991. Biology of Freshwater Pollution. Second Edition. New York (NY), Longman Scientific & Technical. 351 pages.
Matthews, G.W.T. 1993. The Ramsar Convention: Its History and Development. Gland, Suisse, Ramsar Convention Bureau.
McCafferty, W.P., et R.D. Waltz. 1990. « Revisionary synopsis of the Baetidae (Ephemeroptera) of North and Middle America », Transactions of the American Entomological Society, 116 : 769-800.
Meador, M.R., C.R. Hupp, T.F. Cuffney et M.E. Gurtz. 1993. Methods for Characterizing Stream Habitat as Part of the National Water-Quality Assessment Program. Raleigh (NC), U.S. Geological Survey. Open-File Report 93-408.
Merritt, R.W., et K.W. Cummins. 1984. An Introduction to the Aquatic Insects of North America. Second Edition. Dubuque (IA), Kendall/Hunt. 722 pages.
Merritt, R.W., et K.W. Cummins. 1996. An Introduction to the Aquatic Insects of North America. Third Edition. Dubuque (IA), Kendall/Hunt.
Morihara, D.K., et W.P. McCafferty. 1979. « The Baetis larvae of North America (Ephemeroptera: Baetidae) », Transactions of the American Entomological Society, 105 : 139-221.
Morris, P.A. 1951. A Field Guide to the Shells of our Atlantic and GulfCoasts. The Peterson Field Guide Series. Boston (MA), Houghton Mifflin Company. 236 pages.
Newbury, R.W. 1984. « Hydrolic determinants of aquatic insect habitats », dans V.H. Resh et D.M. Rosenberg (éd.), The Ecology of Aquatic Invertebrates. New York (NY), Praeger Publishers, New York.
Newbury, R.W., et M. Gaboury. 1993. Stream Analysis: Fish Habitat and Design. A field Manual. Gibsons (C.-B.), Newbury Hydraulics.
Norris, R.H., et A. Georges. 1993. « Analysis and interpretation of benthic macroinvertebrate surveys », dans D.M. Rosenberg et V.H. Resh (éd.), Freshwater Biomonitoring and Benthic Invertebrates. New York (NY), Chapman & Hall. Pp. 234-286.
Oliver, D.R., D. McClymont et M.E. Roussel. 1978. A Key to some Larvae of the Chironomidae (Diptera) from the Mackenzie and Porcupine River Watersheds. Fisheries and Marine ServiceTechnical Report No. 791. Ottawa (Ont.), Agriculture Canada.
Pearson, T.H. 1975. « The benthic ecology of Loch Linnhe and Loch Eil, a sea-loch system on the west coast of Scotland. IV. Changes in the benthic fauna attributable to organic enrichment », Journal of Experimental Marine Biology and Ecology, 20 : 1-41.
Peckarsky, B.L., P.R. Fraissinet, M.A. Penton et D.J. Conklin (éd.). 1990. Freshwater Macroinvertebrates of Northeastern North America. Ithaca (NY), Cornell University Press. 442 pages.
Pennak, R.W. 1978. Freshwater Invertebrates of the United States: Protozoa to Mollusca. Third edition. New York (NY), John Wiley & Sons Inc. 803 pages.
Pettibone, M.H. 1963. « Marine polychaete worms of the New England Region. 1. Aphroditidae through Trochochaetidae », U.S. Natl. Mus. Bull. 227:1. Washington (DC), Smithsonian Institute. Pp. 1-356.
Pettibone, M.H. 1992. « Contribution to the polychaete family Pholoidae Kinberg », Smithsonian Contributions to Zoology, 532 : 1-22.
Pettibone, M.H. 1993. « Scaled polychaetes (Polynoidae) associated with ophiuroids and other invertebrates and review of species referred to Malmgrenia McIntosh and replaced by Malmgreniella Hartman, with descriptions of new taxa », Smithsonian Contributions to Zoology, 538: 1-92.
Plafkin, J.L., M.T. Barbour et K.D. Porter. 1989. Rapid Bioassessment Protocols for use in Streams and Rivers: Benthic Macroinvertebrates and Fish. EPA/444/4-89-001. Washington (DC), U.S. Environmental Protection Agency, Office of Water Assessment and Watershed Protection Division. 162 pages.
Pohle, G.W. 1990. A Guide to Decapod Crustacea from the Canadian Atlantic: Anomura and Brachyura. Rapport technique canadien des sciences halieutiques et aquatiques, no 1771. 29 pages.
Pontasch, K.W., E.P. Smith et J. Cairns Jr. 1989. « Diversity indices, community comparison indices and canonical discriminant analysis: Interpreting the results of multispecies toxicity tests », Water Research, 23 : 1229-1238.
Rabeni, C.F., et K.E. Gibbs. 1978. « Comparison of two methods used by divers for sampling benthic invertebrates in deep rivers », Journal of the Fisheries Research Board of Canada, 35 : 332-336.
Rees, H.L. 1984. « A note on mesh selection and sampling efficiency in benthic studies », Marine Pollution Bulletin, 15 : 225-229.
Reish, D.J. 1959. « A discussion of the importance of the screen size in washing quantitative marine bottom samples », Ecology, 40 : 307-309.
Resh, V.H., R.H. Norris et M.T. Barbour. 1995. « Design and implementation of rapid assessment approaches for water resource monitoring using benthic macroinvertebrates », Australian Journal of Ecology, 20 : 108-121.
Reynoldson, T.B., R.C. Bailey, K.E. Day et R.H. Norris. 1995. « Biological guidelines for freshwater sediment based on BEnthic Assessment of SedimenT (the BEAST) using a multivariate approach for predicting biological state », Australian Journal of Ecology, 20 : 198-219.
Reynoldson, T.B., et D.M. Rosenberg. 1996. « Sampling strategies and practical considerations in building reference data bases for the prediction of invertebrate community structure », dans R.C. Bailey, R.H. Norris et T.B. Reynoldson (éd.), Study Design and Data Analysis in Benthic Macroinvertebrate Assessments of Freshwater Ecosystems using a Reference Site Approach. Technical Information Workshop, North American Benthological Society, 44th Annual Meeting, Kalispell, Montana. Pp. 1-31.
Reynoldson, T.B., R.H. Norris, V.H. Resh et D.M. Rosenberg. 1997. « The reference condition: A comparison of multimetric and multivariate approaches to assess water-quality impairment using benthic macroinvertebrates », Journal of the North American Benthological Society, 16 : 833-852.
Robinson, C.L.K., et C.D. Levings. 1995. An Overview of Habitat Classification Systems, Ecological Models, and Geographic Information Systems Applied to Shallow Foreshore Marine Habitats. Rapport manuscrit canadien des sciences halieutiques et aquatiques, no 2322. 65 pages.
Robinson, C.L.K., D.E. Hay, J. Booth et J. Truscott. 1996. Standard Methods for Sampling Resources and Habitats in Coastal Subtidal Regions of British Columbia: Part 2 - Review of Sampling with Preliminary Recommendations. Rapport technique canadien des sciences halieutiques et aquatiques, no 2119. xii + 119 pages.
Rosenberg, D.M. 1978. Practical Sampling of Freshwater Macrozoobenthos: A Bibliography of Useful Texts, Reviews, and Recent Papers. Canadian Fisheries and Marine Service Technical Report No. 790. 15 pages.
Rosenberg, D.M., et V.H. Resh (éd.). 1993. Freshwater Biomonitoring and Benthic Macroinvertebrates. New York (NY), Chapman & Hall. 488 pages.
Saether, O.A. 1975. Nearctic and Palaearctic Heterotrissocladius (Diptera: Chironomidae). Ottawa (Ont.), Bulletin of the Fisheries Research Board of Canada No. 193. 67 pages.
Saether, O.A. 1977. Taxonomic studies on Chironomidae: Nanocladius, Pseudochironomus and the Harnischia complex. Ottawa (Ont.), Bulletin of the Fisheries Research Board of Canada No. 196. 143 pages.
Sars, G.O. 1895. An Account of the Crustacea of Norway with Short Descriptions and Figures of all the Species. Vol. 1. Amphipoda. Christiana and Copenhagen, Danemark, A.L.B. Cammermeyers Forlag.. viii + 711 pages, 248 planches.
Sars, G.O. 1899. An Account of the Crustacea of Norway with Short Descriptions and Figures of all the Species. Vol. II. Isopoda. Bergen, Norvège, Bergen Museum. x + 270 pages, 104 planches. (Texte sur les Cryptoniscidae et les planches publiés en 1899).
Sars, G.O. 1900. An Account of the Crustacea of Norway with Short Descriptions and Figures of all the Species. Vol. III. Cumacea. Bergen, Norvège, Bergen Museum.
SBMNH – Santa Barbara Museum of Natural History. 1994a. Taxonomic Atlas, Vol. 1, Platyhelminthes, and Nemertea. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1994b. Taxonomic Atlas, Vol. 2, Porifera. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1994c. Taxonomic Atlas, Vol. 4, Oligochaeta and Polychaeta: Phyllodocidae to Paralacydoniidae. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1995a. Taxonomic Atlas, Vol. 5, The Annelida, Part 2, Polychaeta: Phyllodocida (Syllidae and Scale-Bearing Families), Amphinomida and Eunicida. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1995b. Taxonomic Atlas, Vol. 12, The Crustacea, Part 3, The Amphipoda. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1995c. Taxonomic Atlas, Vol. 13, The Bryozoa. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1996a. Taxonomic Atlas, Vol. 6, The Annelida, Part 3, Polychaeta: Orbiniidae to Cossuridae. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1996b. Taxonomic Atlas, Vol. 9, The Mollusca, Part 2, The Gastropoda. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1996c. Taxonomic Atlas, Vol. 14, Miscellaneous Taxa. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1997a. Taxonomic Atlas, Vol 10, The Pycnogonida, The Crustacea, Part 1, The Decapoda and Mysidacea. Santa Barbara (CA), Santa Barbara Museum of Natural History.
SBMNH – Santa Barbara Museum of Natural History. 1997b. Taxonomic Atlas, Vol. 11, The Crustacea, Part 2, The Isopoda, Cumacea and Tanaidacea. Santa Barbara (CA), Santa Barbara Museum of Natural History.
Schefter P., et G.B. Wiggins. 1986. A Systematic Study of the Nearctic Larvae of the Hydropsyche morosa Group (Trichoptera: Hydropsychidae). Toronto (Ont.), Royal Ontario Museum,.
Schmitt, R.J., et C.W. Osenberg. 1996. Detecting Ecological Impacts: Concepts and Applications in Coastal Habitats. San Diego (CA), Academic Press. 401 pages.
Schultz, G.A. 1969. The Marine Isopod Crustaceans. Dubuque (IA), Wm. C. Brown Co.
Schuster, G.A., et D.A. Etnier. 1978. A Manual for the Identification of the larvae of the Caddisfly Genera Hydropsyche Pictet and Symphitopsyche Ulmer in Eastern and Central North America. Cincinnati (OH), U.S. Environmental Protection Agency.
Schwinghamer, P. 1981. « Characteristic size distributions of integral benthic communities », Canadian Journal of Fisheries and Aquatic Sciences, 38 : 1255-1263.
Schwinghamer, P. 1983. « Generating ecological hypotheses from biomass spectra using causal analysis: A benthic example », Marine Ecology Progress Series, 13 : 151-166.
Scott, D.A., et T.A. Jones. 1995. « Classification and inventory of wetlands », Vegetatio, 118 : 1-16.
Scrimgeour, G.J., J.M. Culp et N.E. Glozier. 1993. « An improved technique for sampling lotic invertebrates », Hydrobiologia, 254 : 65-71
Simpson, K., et R. Bode. 1980. Common Larvae of Chironomidae (Diptera) from New York State Streams and Rivers, with Particular Reference to the Fauna of Artificial Substrates. New York State Museum Bulletin No. 439. 105 pages.
Slack, K.V., R.C. Averett, P.E. Geeson et R.G. Lipscomb. 1973. Methods for collection and analysis of aquatic biological and microbiological samples. U.S. Geological Survey Techniques of Water-Resources Investigations, Book 5, Chapter 4A. Washington, (D.C.), U.S. Department of the Interior, Geological Survey. 165 pages.
Smith, R.I. 1964. Keys to Marine Invertebrates of the Woods Hole Region: A Manual for the Identification of the More Common Marine Invertebrates. Contribution No. 11. Woods Hole (MA), Systematics-Ecology Program, Marine Biological Laboratory.
Smith, B., et J.B.Wilson. 1996. « A consumer’s guide to evenness indices », Oikos,76 : 70-82.
Squires, H.J. 1990. Decapod Crustacea of the AtlanticCoast of Canada. Ottawa (Ont.), Ministères des Pêches et des Océans. 532 pages.
Steele, D.H., et P. Brunel. 1968. « Amphipoda of the Atlantic and Arctic coasts of North America: Anonyx (Lysianassidae) », Journal of the Fisheries Research Board of Canada, 25 (5) : 943-1060.
Stephenson, W., et S.D. Cook. 1980. « Skewness of data in the analysis of species-in-sites-in-times », Proceedings of the Royal Society of Queensland, 91 : 37-52.
Stewart, K.W., et B.P. Stark. 1993. Nymphs of North American Stonefly Genera (Plecoptera). Denton (TX), University of North Texas Press. 460 pages.
Suess, M.J. (éd.) 1982 Examination of Water For Pollution Control. A Reference Handbook. Vol. 3. Biological, Bacteriological and Virological Examination. Oxford (Angleterre), Permagon Press.
Tattersall, W.M., et O.S. Tattersall. 1951. The British Mysidacea. Londres (Angleterre), Ray Society. 460 pages.
Taylor, L.R. 1961. « Aggregation, variance and the mean », Nature, 189 : 732-735.
Taylor, B.R. 1997. Optimization of Field and Laboratory Methods for Benthic Invertebrate Monitoring. Final Report. Aquatic Effects Technology Evaluation (AETE) project 2.1.2. Ottawa (Ont.), Ressources naturelles Canada, Centre canadien de la technologie des minéraux et de l’énergie (CANMET). 100 pages.
Taylor, B.R, et R.C. Bailey. 1997. Technical Evaluation on Methods for Benthic Invertebrate Data Analysis and Interpretation. Final Report. Aquatic Effects Technology Evaluation (AETE) project 2.1.3. Ottawa (Ont.), Ressources naturelles Canada, Centre canadien de la technologie des minéraux et de l’énergie (CANMET). 26 pages.
Tetra Tech, Inc. 1986a. General QA/QC Considerations for Collecting Environmental Samples in Puget Sound. Seattle (WA), Rapport préparé pour le U.S. Environmental Protection Agency, Region 10. Final Report TC-3991-04.
Tetra Tech, Inc. 1986b. Recommended Protocols for Station Positioning in Puget Sound. Seattle (WA), Rapport préparé pour le U.S. Environmental Protection Agency, Region 10. Final Report TC-3090-05.
Tetra Tech, Inc. 1987. Recommended Protocols for Sampling and Analyzing Subtidal Benthic Macroinvertebrate Assemblages in Puget Sound. Seattle (WA), Rapport préparé pour le U.S. Environmental Protection Agency, Region 10. Final Report TC-3991-04.
Thiel, T.H. 1975. « The size structure of the deep-sea benthos », Internationale Revue der gesamten Hydrobiologie, 60 : 575-606.
Thorp, J.H., et A.P. Covich. 1991. Ecology and Classification of North American Freshwater Invertebrates. New York (NY), Academic Press.
Tukey, J. 1977. Exploratory Data Analysis. Reading (MA), Addison-Wesley. 688 pages.
Underwood, A.J. 1997. Experiments in Ecology: Their Logical Design and Interpretation Using Analysis of Variance. Cambridge (Royaume-Uni), Cambridge University Press. 504 pages.
Ushakov, P.V. 1955. Polychaeta of the Far Eastern Seas of the USSR. Acad. Sci. USSR. Jerusalem (Israël), Israel Program for Scientific Translation (traduit en anglais, 1965). 419 pages
Vézina, A.F. 1988. « Sampling variance and the design of quantitative surveys of the marine benthos », Marine Biology, 97 : 151-155.
Walker, E.M. 1933. « The nymphs of the Canadian species of Ophiogomphus Odonata, Gomphidae », The Canadian Entomologist, 65 : 217-229.
Walker, E.M. 1953. The Odonata of Canada and Alaska. Volume 1, Part I: General. Part II: The Zygoptera - Damselflies. Toronto (Ont.), University of Toronto Press. 292 pages.
Walker, E.M. 1958. The Odonata of Canada and Alaska. Volume 2, The Anisoptera. Toronto (Ont.), University of Toronto Press. 318 pages.
Walker, E.M., et P.S. Corbet. 1978. The Odonata of Canada and Alaska. Volume 3, The Anisoptera - Macromiidae, Corduliidae, Libellulidae. Toronto (Ont.), University of Toronto Press. 307 pages.
Wallace, N.A. 1919. The Isopoda of the Bay of Fundy. University of Toronto Studies, Biological Series No. 18. 42 pages.
Waltz, R.D. 1994. Field recognition of adult Acentrella and Heterocloeon (Ephemeroptera: Baetidae). Great Lakes Entomologist 26 : 321-323.
Warwick, R.M. 1986. « A new method for detecting pollution effects on marine benthic communities », Marine Biology, 92 : 557-562.
Warwick, R.M. 1988a. « Analysis of community attributes of the macrobenthos of Frierfjord/Langesundfjord at taxonomic levels higher than species », Marine Ecology Progress Series, 46 : 167-170.
Warwick, R.M. 1988b. « The level of taxonomic discrimination required to detect pollution effects on marine benthic communities », Marine Pollution Bulletin, 19 : 259-568.
Warwick, R.M., et K.R. Clarke. 1993. « Increased variability as a symptom of stress in marine communities », Journal of Experimental Marine Biology and Ecology, 172 : 215-226.
Warwick, R.M., T.H. Pearson et Ruswahyuni. 1987. « Detection of pollution effects on marine macrobenthos: Further evaluation of the species abundance/biomass method », Marine Biology, 95 : 193-200.
Watling, L. 1979. Marine Flora and Fauna of the Northeastern United States. Crustacea: Cumacea. NOAA Technical Report NMFS Circular 423 : 1-22.
Watson, J. 1997. A Review of Ecosystem Classification: Delineating the Strait of Georgia. Vancouver (C.-B.), Pêches et Océans Canada, Région du Pacifique, Direction des sciences.
Weber, C.I. (éd.) 1973. Biological Field and Laboratory Methods for Measuring the Quality of Surface Waters and Effluents. EPA-670/4-73-001. Cincinnati (OH), U.S. Environmental Protection Agency.
Weinberg, S. 1978. « The minimal area problem in invertebrate communities of Mediterranean rocky substrata », Marine Biology, 49 : 33-40.
Weiss, H.M. 1995. Marine Animals of Southern New England and New York: Identification Keys to Common Nearshore and Shallow Water Macrofauna. Bulletin 115 of the State Geological and Natural History Survey of Connecticut. Hartford (CT), Department of Environmental Protection.
Westfall Jr., M.J., et M.L. May. 1996. Damselflies of North America. Gainesville (FL), Scientific Publishers. 650 pages.
Wiederholm, T. 1980. « Use of benthos in lake monitoring », Journal Water Pollution Control Federation, 52 : 537-547.
Wiederholm, T. (éd.). 1983. Chironomidae of the Holarctic region. Keys and diagnosis. Part 1. Larvae. Entomologica Scandinavica Supplement No. 19. 457 pages.
Wiederholm, T. (éd.). 1986. Chironomidae of the Holarctic region. Keys and diagnosis. Part 2. Pupae. Entomologica Scandinavica Supplement No. 28. 482 pages.
Wiggins, G.B. 1996. Larve of the North American Caddisfly Genera (Trichoptera), 2nd Edition. Toronto (Ont.), University of Toronto Press. 457 pages.
Wood, D.M., B.V. Peterson, D.M. Davies et H. Gyorkos. 1963. « The black flies (Diptera: Simuliidae) of Ontario. Part II. Larval identification with descriptions and illustrations », Proceedings of the Entomological Society of Ontario 93 : 99-129.
Wright, J.F. 1995. « Development and use of a system for predicting the macroinvertebrate fauna in flowing waters », Australian Journal of Ecology, 20 : 181-197.
Figures et tableaux
Le tableau 4-1 présente les plans d’études recommandés pour l’échantillonnage. Pour chacun des types de plans, le milieu récepteur, la zone de référence (ou zone de contrôle), la zone exposée (impact) et la méthode statistique sont indiqués.
La figure 4-1 est une représentation schématique des échelles spatiales d’une zone de référence et d’une zone exposée, de stations répétées et de sous-échantillons de terrain pour un plan d’étude de type contrôle-impact.
La figure 4-2 illustre six exemples de plans d’étude contrôle-impact. L’image (a) présente un plan contrôle-impact pour les cours d’eau simples ou les milieux estuariens homogènes. L’image (b) illustre un plan contrôle-impact modifié avec une zone de référence en aval pour les cours d’eau ou les estuaires. L’image (c) présente un exemple de plan pour l’étude de l’ampleur et de la portée géographique. L’image (d) illustre un plan contrôle-impact multiple pour les cours d’eau avec deux zones de référence. L’image (e) présente un plan contrôle-impact multiple pour les cours d’eau avec deux zones de référence ou à référence multiple dans des bassins hydrographiques adjacents. Enfin, l’image (f) illustre des lacs, des baies ou des bras de mer spatialement homogènes dont les caractéristiques d’habitat sont semblables à celles de la zone exposée.
La figure 4-3 est une illustration de cinq exemples de plans d’étude par gradients. L’image (a) présente un plan par gradient linéaire pour les cours d’eau et les estuaires. L’image (b) illustre un plan par gradient linéaire pour les mines situées sur le bord d’un lac, le long d’une côte, dans une baie ou un fjord étroit. L’image (c) présente un plan par gradient radial pour les lacs ou les zones côtières. L’image (d) présente un plan par gradients multiples pour les rivières ou les ruisseaux d’eau douce. Enfin, l’image (e) présente un plan par gradients multiples pour les mines de métaux situées sur le bord d’un lac ou le long d’une côte.
La figure 4-4 est une représentation schématique qui illustre l’emplacement des stations de référence et des stations exposées par rapport au point de rejet de l’effluent (sources multiples) dans une approche des conditions de référence.
La figure 4-5 est un graphique qui illustre les niveaux de stress entraînant une perturbation déduits à partir de la position des sites de référence dans un espace d’ordination hybride multidimensionnel. Les bandes, basées sur des ellipses de probabilité de 90 %, 99 % et 99,9 %, sont désignées par les lettres A (non perturbé), B (potentiellement perturbé), C (perturbé) et D (fortement perturbé).
Le tableau 4-2 présente les clés taxinomiques applicables à l’identification taxinomique des invertébrés benthiques. Chaque taxon est présenté avec les références taxinomiques normalement utilisées.
Le tableau 4-3 illustre le niveau recommandé de résolution taxinomique pour les invertébrés benthiques dans un milieu marin, selon l’approche du plus bas niveau taxinomique pratique. Chaque taxon correspond à un niveau. Ces niveaux comprennent la famille, la classe, la sous-classe, le genre et l’espèce.
Le tableau 4-4 établit une liste des clés taxinomiques correspondant aux invertébrés benthiques marins et estuariens du Canada. Les références sont énumérées en ordre alphabétique.
Retournez à la table des matières
Chapitre 5
5. Caractérisation de l’effluent et suivi de la qualité de l’eau
5.2 Fréquence d’échantillonnage
5.4 Emplacement de l’échantillonnage
5.6 Caractérisation de l’effluent
- 5.6.1 Méthodes d’échantillonnage et analyses en laboratoire
- 5.6.2 Modification de la limite de détection de la méthode pour le mercure
- 5.6.3 Méthodes de dosage des thiosels
5.7 Suivi de la qualité de l’eau
- 5.7.1 Préparation en vue des travaux sur le terrain
- 5.7.2 Mesure sur le terrain des paramètres de la qualité de l’eau
- 5.7.3 Prélèvement d’échantillons d’eau destinés aux analyses en laboratoire
- 5.7.4 Manipulation, entreposage et analyse des échantillons pour le suivi de la qualité de l’eau
- 5.7.5 Comparaison des données sur la qualité de l’eau dans la zone exposée et dans la zone de référence
- 5.7.6 Estimation de l’étendue de la zone de concentrations élevées
5.8 Assurance et contrôle de la qualité pour le suivi de la qualité de l’eau
- 5.8.1 Contrôle de la qualité sur le terrain
- 5.8.2 Assurance de la qualité sur le terrain
- 5.8.3 Assurance de la qualité durant la manipulation, le transport et l’entreposage des échantillons
- 5.8.4 Utilisation de blancs et de duplicata d’échantillons
- 5.8.5 Contrôle de la qualité en laboratoire
- 5.8.5.1 Précisions sur les aspects du contrôle de la qualité des analyses en laboratoire
- 5.8.5.2 Bonnes pratiques de laboratoire
- 5.8.5.3 Contrôle de l’étalonnage
- 5.8.5.4 Précision
- 5.8.5.5 Exactitude et biais
- 5.8.5.6 Récupération
- 5.8.5.7 Limites de détection
- 5.8.5.8 Conventions relatives à la présentation des données
- 5.8.5.9 Précision et exactitude des analyses
- 5.8.6 Assurance de la qualité en laboratoire
- 5.8.7 Compilation et présentation des données d’AQ/CQ
Liste des tableaux
- Tableau 5-1 : Paramètres mesurés pour la caractérisation de l’effluent et le suivi de la qualité de l’eau
- Tableau 5-2 : Sommaire des utilisations recommandées des blancs et des duplicata sur le terrain et en laboratoire
5. Caractérisation de l’effluent et suivi de la qualité de l’eau
5.1 Aperçu
La caractérisation de l’effluent et le suivi de la qualité de l’eau ont pour but de fournir des éléments de réponse à la question suivante : « Quelle est l’ampleur estimée du changement dans les concentrations de contaminants causé par l’activité minière au sein de la zone exposée? ». Les données recueillies lors de la caractérisation de l’effluent et du suivi de la qualité de l’eau seront utilisées aux fins suivantes :
- surveiller les modifications de la qualité de l’eau et les conditions environnementales dans le milieu récepteur;
- fournir des informations sur la variabilité de la qualité de l’effluent et des tendances temporelles ou saisonnières;
- fournir des mesures de variables environnementales pour faciliter l’interprétation des résultats du suivi biologique (études des poissons et de la communauté d’invertébrés benthiques) et des évaluations de la toxicité sublétale.
La caractérisation de l’effluent s’effectue par l’analyse d’un échantillon d’effluent afin de fournir de l’information sur les concentrations de contaminants potentiels.
Le suivi de la qualité de l’eau est réalisé en prélevant des échantillons d’eau à chaque point de rejet de l’effluent dans la zone exposée et dans les zones de référence appropriées, et en analysant ces échantillons. De plus, des échantillons d’eau sont prélevés dans les zones d’échantillonnage des milieux récepteurs où la surveillance biologique est achevée, puis analysés (article 7 de l’annexe 5 du Règlement sur les effluents des mines de métaux [REMM]).
5.2 Fréquence d’échantillonnage
La caractérisation de l’effluent et le suivi de la qualité de l’eau doivent être réalisés quatre fois par année civile, les prélèvements d’échantillons d’effluent et d’eau étant réalisés avec un intervalle d’au moins un mois pendant les périodes où la mine rejette des effluents (article 7 de l’annexe 5 du REMM). Il est recommandé, dans la mesure du possible, de prélever les échantillons destinés à la caractérisation de l’effluent et au suivi de la qualité de l’eau une fois par trimestre civil. Il est également recommandé de prélever les échantillons destinés à ces deux fins le même jour.
Il convient de tenir compte des facteurs suivants pour décider du moment auquel les aliquotes d’échantillons d’effluent seront prélevés pour la caractérisation des effluents :
- la variabilité saisonnière de la composition et du débit de l’effluent;
- le temps de l’année où le prélèvement des échantillons d’effluent a été effectué antérieurement;
- le temps de l’année où l’échantillonnage est réalisé aux fins du suivi de la qualité de l’eau;
- le temps de l’année où il est attendu que les concentrations des substances nocives réglementées soient maximales dans la zone exposée.
Aux fins du suivi de la qualité de l’eau, les facteurs suivants devraient être pris en considération pour décider du moment où les échantillons d’eau seront prélevés dans le milieu récepteur :
- la variabilité saisonnière de la qualité et du débit de l’eau dans la zone exposée;
- le temps de l’année où il est attendu que les concentrations des substances nocives réglementées soient maximales dans la zone exposée;
- le temps de l’année où des échantillons d’eau ont été prélevés antérieurement aux fins du suivi de la qualité de l’eau;
- le temps de l’année où l’échantillonnage est réalisé aux fins de la caractérisation de l’effluent;
- le temps de l’année où la surveillance biologique est réalisée.
5.3 Variables mesurées
La caractérisation de l’effluent et le suivi de la qualité de l’eau sont assurés par l’analyse des paramètres présentés au tableau 5.1. Si une mine n’utilise pas de cyanure comme réactif de procédé dans la zone d’exploitation, il n’est pas nécessaire de l’enregistrer (alinéa 7(1)d) de l’annexe 5 du REMM). En outre, si la concentration de mercure total est inférieure à 0,10 mg/L dans 12 échantillons consécutifs, l’enregistrement de cette concentration peut être arrêté (paragraphe 4(3) de l’annexe 5 du REMM).Environnement Canada que la mine satisfait à l’exigence susmentionnée. Aussi, le tableau 5.1 comprend des paramètres optionnels qui sont recommandés en fonction des caractéristiques du site. Afin de procéder à une caractérisation chimique plus approfondie, le propriétaire ou l’exploitant de la mine peut enregistrer les mesures de ces paramètres. En plus des paramètres requis présentés dans le tableau qui suit, la mesure de certains paramètres de l’effluent, telles la conductivité et les concentrations de sulfates ou de chlorures, peut être utile. En effet, ces substances pourraient servir de traceurs afin de délimiter la zone de mélange de l’effluent dans la zone exposée. En outre, les concentrations de calcium, de magnésium, de chlorures, de potassium, de sodium, de sulfates et de carbone organique dissous peuvent servir à estimer la toxicité potentielle de certains métaux en utilisant l’approche du modèle de ligand biotique (p. ex., U.S. EPA, 2007; Reiley, 2007). Enfin, la justification des paramètres utilisés pour la caractérisation de l’effluent et le suivi de la qualité de l’eau figure dans l’annexe 1.
| Paramètres de la qualité de l’effluent1 (article 4 de l’annexe 5 du REMM) | Paramètres de la qualité de l’eau1 (article 7 de l’annexe 5 du REMM) | Paramètres particuliers au site3 (exigence non réglementaire) |
|---|---|---|
| Aluminium | Aluminium | Fluorures |
| Cadmium | Cadmium | Manganèse |
| Fer | Fer | Uranium |
| Mercure4 | Mercure4 | Phosphore total |
| Molybdène | Molybdène | Calcium |
| Ammoniac | Ammoniac | Chlorures |
| Nitrates | Nitrates | Magnésium |
| Dureté | Dureté6,7 | Potassium |
| Alcalinité | Alcalinité6,7 | Sodium |
| Sélénium | Arsenic | Sulfates |
| Conductivité électrique2,10 | Cuivre | Thallium |
| Température2 | Plomb | Thiosels totaux |
| Nickel | Profondeur de l’eau2 | |
| Zinc | Profondeur optique ou transparence2 | |
| Radium 2269 | Carbone organique dissous | |
| Cyanures5 | Carbone organique total | |
| Matières totales en suspension | Débit d’eau | |
| Concentration d’oxygène dissous2 | ||
| Température2 | ||
| pH2,6,7 | ||
| Salinité2,7,8 | ||
| Sélénium | ||
| Conductivité électrique10 |
1 Toutes les concentrations sont des valeurs totales; les concentrations dissoutes peuvent également être déclarées; les charges de l’effluent (article 20 du REMM) doivent également être calculées et déclarées.
2 Paramètres mesurés in situ.
3 Ces paramètres additionnels sont des contaminants potentiels ou des variables environnementales complémentaires; les analyses permettant d’en déterminer la valeur sont facultatives et peuvent être effectuées si des données historiques de surveillance propres au site ou des données géochimiques attestent de leur utilité.
4 L’enregistrement de la concentration de mercure total dans l’effluent peut être arrêté si la concentration mesurée est inférieure à 0,10 mg/L dans 12 échantillons consécutifs (paragraphe 4(3) de l’annexe 5 du REMM).
5 Il n’est pas nécessaire de mesurer les cyanures si on n’en utilise pas comme réactifs de procédé dans la zone d’exploitation (alinéa 7d) de l’annexe 5 du REMM).
6 Dans le cas d’un effluent rejeté dans de l’eau douce, enregistrer le pH, la dureté et l’alcalinité des échantillons d’eau.
7 Dans le cas d’un effluent rejeté dans de l’eau estuarienne, enregistrer le pH, la dureté, l’alcalinité et la salinité des échantillons d’eau.
8 Dans le cas d’un effluent rejeté dans de l’eau de mer, enregistrer la salinité des échantillons d’eau.
9 Il n’est pas nécessaire de mesurer les concentrations de radium 226 si les conditions mentionnées au paragraphe 13(2) de REMM sont remplies.
10 Veuillez vous référer au document d’Environnement Canada : Document d’orientation pour l’échantillonnage et l’analyse des effluents de mines de métaux (SPE 2/MM/5) pour les références aux méthodes de mesure. La calibration de la température et la procédure de compensation de la température lors d’une mesure de conductivité doivent être faites selon les indications du fabriquant de l’appareil de mesure.
5.3.1 Calcul des charges
En vertu de l’article 20 du REMM, le propriétaire ou l’exploitant de la mine est tenu d’enregistrer les charges totales mensuelles des substances nocives réglementées par le REMM. Dans le cadre de la caractérisation de l’effluent, la mine devrait également signaler les charges des autres contaminants mesurées aux fins de la caractérisation de l’effluent. Le calcul des charges peut être effectué en multipliant la concentration moyenne mensuelle de chaque substance nocive dans l’effluent par le volume mensuel total d’effluent rejeté durant la période de temps considérée (habituellement un an pour la caractérisation de l’effluent).
5.4 Emplacement de l’échantillonnage
Les échantillons destinés à la caractérisation de l’effluent doivent être prélevés à chaque point de rejet final déterminé par le propriétaire ou l’exploitant de la mine, conformément au REMM(paragraphe 4(2) de l’annexe 5).
De plus amples renseignements sur la façon de choisir les zones d’échantillonnage pour la caractérisation de l’effluent sont présentés dans le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001). Ce document traite principalement des méthodes permettant le prélèvement d’échantillons d’effluent à partir de sources ponctuelles (à la sortie de l’émissaire). S’il est envisagé de prélever des échantillons à partir de sources diffuses, il convient d’examiner la pertinence des zones et des méthodes de prélèvement projetées avec l’agent d’autorisation.
Le suivi de la qualité de l’eau est réalisé en prélevant des échantillons d’eau dans la zone exposée entourant le point d’entrée de l’effluent dans l’eau à partir de chaque point de rejet final ainsi qu’à partir des zones de référence connexes (paragraphe 7(1) de l’annexe 5 du REMM). Selon toute vraisemblance, ces points de prélèvement ne seront pas les mêmes que ceux servant au suivi biologique. Lors du choix des points de prélèvement dans la zone exposée, le propriétaire ou l’exploitant d’une mine devrait tenir compte de l’endroit où la concentration de l’effluent est la plus élevée.
En plus des éléments susmentionnés, le propriétaire ou l’exploitant d’une mine doit prélever des échantillons d’eau dans les zones de prélèvement retenues pour les études sur les populations et les tissus de poissons ainsi que pour celles sur les communautés d’invertébrés benthiques. Le suivi de la qualité de l’eau est donc réalisé en même temps que les études de suivi biologique, si la mine doit réaliser de telles études (sous-alinéa 7(1)a(ii) de l’annexe 5 du REMM). Pour ce faire, les paramètres de surveillance de la qualité de l’eau présentés dans le tableau 5.1 sont mesurés dans ces échantillons d’eau.
Il est recommandé de prélever au moins trois échantillons d’eau à chaque station d’échantillonnage afin d’obtenir une estimation de la variabilité et de déterminer si les concentrations des contaminants sont homogènes à l’intérieur de la station. Toutefois, cette façon de faire pourrait ne pas être suffisamment robuste pour permettre une analyse statistique des données. La sélection de stations additionnelles à l’intérieur de chaque zone de prélèvement pourrait permettre de mieux caractériser la répartition des concentrations des contaminants dans la zone exposée. Au moins un échantillon composite constitué de quelques sous-échantillons prélevés en divers endroits de la station devrait être produit.
Lorsque les zones de prélèvement des invertébrés benthiques et/ou des poissons sont relativement éloignées des stations d’échantillonnage pour le suivi de la qualité de l’eau, il est fortement recommandé de prélever concurremment des échantillons d’eau aux stations d’échantillonnage pour le suivi routinier de la qualité de l’eau. De cette façon, les résultats des analyses des échantillons d’eau prélevés dans les zones de prélèvement des invertébrés benthiques et/ou des poissons pourront être comparés à ceux des analyses des échantillons prélevés dans les stations de suivi de la qualité de l’eau.
5.5 Déclaration des résultats
Les résultats des analyses effectuées pour la caractérisation de l’effluent et le suivi de la qualité de l’eau doivent être présentés à l’agent d’autorisation dans le rapport des études de suivi de l’effluent et de la qualité de l’eau (article 8 de l’annexe 5 du REMM). Plus particulièrement, ce rapport réalisé au cours d’une année civile doit être présenté à l’agent d’autorisation au plus tard le 31 mars de l’année suivante. Veuillez consulter le chapitre 10 pour en savoir plus sur la présentation électronique des données sur la caractérisation de l’effluent et le suivi de la qualité de l’eau. Par ailleurs, ce rapport annuel devrait comprendre les renseignements décrits ci-après.
(Veuillez noter que dans la liste qui suit, les exigences réglementaires (selon l’article 8 de l’annexe 5 du REMM) sont écrites en italique et sont suivies de recommandations et de descriptions supplémentaires).
a) Les dates de prélèvement des échantillons pour la caractérisation de l’effluent, les essais de toxicité sublétale et le suivi de la qualité de l’eau, notamment :
- dates pour la caractérisation de l’effluent, à raison de quatre fois par année civile et à au moins un mois d’intervalle (paragraphe 7(2) de l’annexe 5 du REMM), lorsque la mine rejette un effluent;
- dates pour le suivi de la qualité de l’eau, à raison de quatre fois par année civile et à au moins un mois d’intervalle (paragraphe 7(2) de l’annexe 5 du REMM), lorsque la mine rejette un effluent;
- dates pour les essais de toxicité sublétale, à raison de deux fois par année civile pendant les trois premières années et une fois par année après cela, le premier essai se faisant sur un échantillon d’effluent prélevé au plus tard six mois après la date à laquelle la mine est assujettie à l’article 7 du présent règlement(article 6 de l’annexe 5 du REMM). Les dates des essais de toxicité sublétale devraient correspondre à celles de la caractérisation de l’effluent, compte tenu que les échantillons pour les essais de toxicité sublétale doivent être constitués par une portion aliquote d’échantillons prélevés pour la caractérisation de l’effluent;
- si le nombre d’essais requis n’a pas été effectué, en préciser la raison (c.-à-d. le nombre de jours de rejet de cet effluent ou les conditions de l’habitat qui ont empêché le prélèvement d’échantillons pour la caractérisation de l’effluent et/ou le suivi de la qualité de l’eau).
b) L’emplacement des points de rejet final où les échantillons ont été prélevés pour la caractérisation de l’effluent, en prenant soin de noter que la caractérisation de l’effluent doit être réalisée à TOUS les points de rejet final établis.
c) L’emplacement du point de rejet final où les échantillons ont été prélevés pour les essais de toxicité sublétale et les données qui ont servi à le sélectionner conformément au paragraphe 5(2) du REMM :
- indiquer à quel point de rejet final les échantillons d’effluent ont été prélevés pour les essais de toxicité sublétale;
- indiquer pourquoi ce point de rejet final a été choisi, s’il y a plus d’un point de rejet sur le site minier (p. ex., effluent rejeté dans un milieu récepteur sensible, effluent ayant la charge massique la plus élevée, etc.).
d) La latitude et la longitude des zones d’échantillonnage utilisées pour le suivi de la qualité de l’eau, exprimées en degrés, minutes et secondes, et une description qui permet de reconnaître l’emplacement de ces zones :
- si des données autres que la latitude et la longitude sont utilisées (p. ex., UTM) pour l’emplacement de la station de prélèvement, Ressources naturelles Canada fournit des outils sur le Web qui permettent de faire la conversion;
- une description des stations de prélèvement (avec des cartes si possible) permettant de localiser l’emplacement des zones de prélèvement; par exemple, « échantillon d’eau recueilli sous le premier pont ». Cette description doit faciliter le prélèvement d’autres échantillons aux mêmes stations.
e) Les résultats de la caractérisation de l'effluent, des essais de toxicité sublétale et du suivi de la qualité de l'eau, notamment :
- les résultats de toutes les analyses physicochimiques effectuées sur les échantillons de l’effluent, des essais de toxicité sublétale et du suivi de la qualité de l’eau;
- les résultats obtenus pour tous les paramètres requis ainsi que pour les paramètres optionnels propres au site (voir le tableau 5.1);
- les rapports de laboratoire sur les essais de toxicité sublétale doivent être joints au rapport annuel.
f) Les méthodes utilisées pour la caractérisation de l'effluent et le suivi de la qualité de l'eau, ainsi que les limites de détection de ces méthodes :
- certaines méthodes de prélèvement des échantillons sont décrites dans le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001); version électronique disponible à : http://dsp-psd.communication.gc.ca/Collection/En49-24-1-39F.pdf;
- préciser la méthode utilisée pour la caractérisation de l’effluent et le suivi de la qualité de l’eau (spectrométrie de masse à plasma induit par haute fréquence [SM-PIHF], spectrométrie d'absorption atomique à four en graphite [SAA-FG]);
- indiquer les limites de la méthode de détection utilisée (pour les substances délétères du REMM, les limites de détection données à l’annexe 3 devraient être respectées); voir la section 5.6.2 pour la limite de détection qui s’applique au mercure; veuillez aussi noter que les recommandations pour la qualité de l’eau pour la protection de la vie aquatique du Conseil canadien des ministres de l’environnement (CCME) ou d’autres recommandations provinciales pour la qualité de l’eau devraient aussi être prises en considération;
- indiquer si les recommandations pour la qualité de l’eau pour la protection de la vie aquatique du CCME sont respectées.
g) Les précisions voulues sur les mesures d’assurance de la qualité et de contrôle de la qualité qui ont été prises ainsi que les données associées à leur mise en œuvre :
- fournir une brève description des mesures d’AQ/CQ qui ont été prises et les résultats concernant le prélèvement d’échantillons d’effluent et d’eau, leur expédition et leur conservation;
- pour de plus amples renseignements, veuillez consulter les sections 7.3 à 7.5 du Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001) à l’adresse : http://dsp-psd.communication.gc.ca/Collection/En49-24-1-39F.pdf ainsi que la section 5.8 du présent document.
Puisque les échantillons pour la caractérisation de l’effluent sont des portions aliquotes d’échantillons prélevés pour le suivi de la conformité de l’effluent, les mesures du pH et des concentrations des substances nocives (arsenic, cuivre, cyanures totaux, plomb, nickel, zinc, radium 226 et matières totales en suspension) devraient être indiquées dans les rapports sur la caractérisation de l’effluent et le suivi de la qualité de l’eau de chaque mine.
5.6 Caractérisation de l’effluent
5.6.1 Méthodes d’échantillonnage et analyses en laboratoire
Comme les échantillons d’effluent utilisés aux fins de la caractérisation sont des portions aliquotes des échantillons prélevés aux fins du suivi de la conformité de l’effluent, comme le stipule le REMM, les spécifications et recommandations relatives aux méthodes d’échantillonnage et d’analyse chimique présentées dans le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001) s’appliquent également à la caractérisation de l’effluent réalisée dans le cadre du programme d’ESEE. Le volume d’effluent prélevé devrait être suffisant pour permettre toutes les analyses et tous les essais et la constitution d’échantillons connexes à des fins de contrôle de la qualité (p. ex., échantillons de terrain et de laboratoire en double et échantillons validés par ajout connu).
5.6.2 Modification de la limite de détection de la méthode pour le mercure
La limite de détection de la méthode pour le mercure dans l’effluent a été modifiée et fixée à 0,01 µg/L (0,000 01 mg/L) de manière à ce que la concentration de 0,1 µg/L stipulée au paragraphe 9c) de l’annexe 5 du Règlement sur les effluents des mines de métaux puisse être détectée avec confiance. Voici des méthodes d’analyse qui permettent d’atteindre ce niveau de détection : la spectrométrie d’absorption atomique à vapeur froide (SSAVF), la spectrométrie de fluorescence atomique à vapeur froide (SFAVF) et la spectrométrie de masse avec plasma induit par haute fréquence (SM-PIHF).
5.6.3 Méthodes de dosage des thiosels
Les thiosels totaux sont un paramètre optionnel propre au site qui peut être mesuré dans l’effluent de la mine; toutefois, les méthodes d’échantillonnage ou d’analyse ne sont pas dans le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001). Les thiosels sont des composés ioniques renfermant du soufre et de l’oxygène solubles qui résultent de l’oxydation incomplète de minéraux sulfurés. Ils peuvent être produits lorsque les minéraux sulfurés entrent en contact avec de l’oxygène, mais en pratique, ils se forment habituellement durant le traitement des minerais contenant de tels minéraux. Si des thiosels se retrouvent dans un effluent, leur oxydation sera complète lors du rejet de ce dernier, produisant de l’acide sulfurique et réduisant le pH dans la zone exposée. Une telle modification du pH dans les eaux réceptrices pourrait aussi être reliée à de faibles concentrations de thiosels et à la spéciation des thiosels, qui ne peut pas être entièrement abordée au moyen des techniques analytiques courantes (Vigneault et al., 2002). À une concentration de 10 ppm, la dégradation des thiosels peut encore potentiellement faire baisser le pH à 3,7 dans une eau réceptrice non tamponnée (Vigneault et al., 2002). Des renseignements sur la spéciation des thiosels peuvent être requis afin de prévoir la chute du pH, puisque les différents types de thiosels peuvent produire des quantités différentes d’acidité et sont stables dans des conditions nettement différentes.
Malgré la capacité des thiosels à altérer le pH des eaux réceptrices, la toxicité due aux thiosels dans les effluents de mines est limitée à quelques sites. Cela peut être dû à la faible toxicité des thiosels pour les animaux. Les thiosels ne sont pas considérés comme ayant une létalité aiguë dans les effluents des mines. C’est pourquoi la concentration létale pour la Truite arc-en-ciel est supérieure à 800 mg/L (Schwartz et al., 2006). Des essais de toxicité sublétale suggèrent en outre que la sensibilité des espèces aquatiques aux thiosels et la toxicité des différents anions composant les thiosels varient d’un ordre de grandeur. Schwartz et al. (2006) ont d’ailleurs signalé que Ceriodaphnia dubia était l’espèce la plus sensible des espèces utilisées lors des essais dans le cadre des ESEE. La concentration inhibitrice 25 % était équivalente à 60 mg/L pour le thiosulfate, tandis que les tétrathionates se sont avérés beaucoup moins toxiques. Au Canada, peu de mines ont des problèmes connus liés aux thiosels, mais le potentiel d’en générer existe sur de nombreux sites miniers. Dans le Programme d’ESEE, le dosage des thiosels totaux aux fins de la caractérisation des effluents et du suivi de la qualité de l’eau est facultatif.
La concentration totale de thiosels est habituellement déterminée au moyen d’une méthode de titrage ayant une limite de détection d’environ 10 ppm (exprimée en thiosulfates) (Makhija et Hitchen, 1979). Le thiosulfate est stable à un pH neutre et instable à un faible pH, alors que l’inverse est vrai pour les polythionates. Pour déterminer la concentration des différentes espèces de thiosels en solution dans la gamme des parties par milliard, on peut se servir de la chromatographie par échange d’ions. Cependant, cette technique est difficile à appliquer à des échantillons de terrain en raison de l’instabilité des thiosels. Afin de mieux prévoir les impacts environnementaux des thiosels et la dégradation de ces derniers, plus de renseignements sur la spéciation in situ et des méthodes de mesure ayant des limites de détection plus basses sont nécessaires.
Le principal inconvénient soulevé au sujet de cette méthode est qu’il faut analyser les échantillons dans les 24 heures suivant leur prélèvement. Étant donné que toute méthode de conservation existante a ses limites, il n’y a en fait rien qui puisse remplacer une analyse immédiate (O'Reilly et al., 2001). Par conséquent, le dosage des thiosels totaux devrait idéalement être effectué sur le terrain, et selon toute probabilité, aux seuls endroits où des problèmes liés à ces substances ont été décelés. Une autre option est de congeler les échantillons immédiatement après leur prélèvement en vue de les analyser dans les sept jours qui suivent. Dans ce cas, il importe de préciser que la stabilité des thiosels peut être compromise si les échantillons congelés sont conservés plus longtemps. Autrement, une résine échangeuse d’ions peut être utilisée pour préconcentrer et conserver les thiosels (Drushel et al., 2003; Vigneault et al., 2002).
5.7 Suivi de la qualité de l’eau
5.7.1 Préparation en vue des travaux sur le terrain
La manipulation des produits chimiques utilisés pour le nettoyage, le fonctionnement et l’étalonnage de l’équipement, le prélèvement, la conservation ou le traitement des échantillons devrait être confiée uniquement à des personnes qualifiées, et les informations appropriées sur la santé et la sécurité (p. ex., fiches signalétiques) devraient être disponibles.
Des protocoles et modes opératoires normalisés (MON) écrits (énonçant notamment les exigences en matière d’assurance et de contrôle de la qualité [AQ/CQ]) devraient être accessibles en tout temps, de façon à ce que l’utilisation de l’équipement se fasse de façon appropriée et sécuritaire. Il est également recommandé de préparer des formulaires de données et des carnets de manière à ce que les notes et les données puissent être consignées rapidement et efficacement sur le terrain. Il importe également de prévoir des formulaires supplémentaires en cas d’erreur ou de perte. Ces formulaires et carnets de terrain devraient être résistants à l’eau et aux déchirures. Dans certaines circonstances, l’enregistrement de bandes audio ou vidéo peut se révéler utile.
Tout le matériel utilisé pour le prélèvement et la manipulation des échantillons devrait être nettoyé, et toutes leurs composantes, inspectées avant chaque sortie sur le terrain, afin de s’assurer qu’elles fonctionnent bien (p. ex., assemblage sur place, fonctionnement). Les principaux instruments ou dispositifs devraient être munis d’une trousse de réparation afin de ne pas être pris au dépourvu en cas de panne ou de perte de pièces amovibles. Enfin, de l’équipement, des piles et des dispositifs d’échantillonnage de réserve devraient être disponibles. Les appareils utilisés pour les mesures sur le terrain des paramètres de la qualité de l’eau devrait être correctement étalonnés, conformément aux recommandations du fabricant.
Tous les récipients à échantillons et agents de conservation requis devraient être fournis par le laboratoire chargé par contrat d’effectuer les analyses. De préférence, les bouteilles devraient être neuves, inutilisées et certifiées propres. S’il s’agit de bouteilles déjà utilisées, il faut les nettoyer en employant une méthode reconnue et utiliser un système de contrôle de numéros de lot et confirmer leur état de propreté à l’aide de blancs (Fowlie et al., 2001).
Avant chaque sortie sur le terrain, tous les récipients destinés à l’entreposage, au transport et au prélèvement des échantillons, y compris les récipients de réserve en cas de perte ou de bris, devraient être nettoyés et étiquetés correctement (c.-à-d. étiquettes adhésives imperméables permettant l’inscription de données à l’aide d’un stylo à encre indélébile efficace sur des surfaces mouillées). Ces récipients devraient être pourvus de couvercles hermétiques; les couvercles avec revêtement appropriés devraient être utilisés pour prévenir la contamination (p. ex., doublés d’un matériau inerte comme le téflon, et non en papier ou en carton). La liste des échantillons à prélever et le registre de suivi des échantillons devraient être préparés avant chaque échantillonnage. La tenue de ce registre devrait être confiée à une personne chargée d’assurer la surveillance des échantillons depuis leur prélèvement jusqu’à leur analyse et leur élimination ou leur archivage.
5.7.2 Mesure sur le terrain des paramètres de la qualité de l’eau
Les paramètres de la qualité de l’eau couramment mesurés in situ sont la concentration d’oxygène dissous, le pH, la conductivité, la température et, pour les milieux marins seulement, la salinité. La profondeur de l’eau dans la zone d’échantillonnage et celle à laquelle l’échantillon d’eau a été prélevé devraient être notées, de même que la profondeur optique ou transparence. Le débit devrait également être mesuré dans les milieux lotiques. Les mesures des paramètres courants de la qualité de l’eau peuvent être prises in situ ou à partir d’un échantillon d’eau, dans l’embarcation ou sur la rive, immédiatement après le prélèvement de l’échantillon du moment que le prélèvement a été fait à la profondeur requise. Si l’oxygène dissous est mesuré une fois sur le rivage, il faut faire particulièrement attention de ne pas laisser d’air s’introduire dans l’échantillon d’eau.
Dans les plans d’eau peu profonds (≤ 2 m), les paramètres courants de la qualité de l’eau peuvent être mesurés au milieu de la colonne d’eau. Si la profondeur du plan d’eau est de 2 à 4 m, les mesures devraient être prises à deux profondeurs, soit à environ 25 cm du fond et à 25 cm sous la surface. Dans les plans d’eau plus profonds, les paramètres courants sont mesurés sur toute la colonne d’eau. Les mesures de la conductivité, du pH, de la dureté, de l’alcalinité, de la salinité, de la température et de la teneur en oxygène dissous devraient être prises près du fond et dans la colonne d’eau, à des intervalles de un à cinq mètres selon la profondeur totale. Par exemple, si la profondeur est de 5 m, ces paramètres devraient être mesurés à chaque mètre. À une profondeur de 25 m, les mesures devraient être prises à tous les cinq mètres.
En eau profonde, on doit utiliser un échantillonneur péristaltique muni de tubes en téflon d’une longueur adéquate de préférence à tout autre type de pompes. Si d’autres types d’échantillonneurs sont utilisés, ils doivent être pourvus d’un revêtement en téflon et non métallique. L’échantillonnage doit se faire en partant de la station la moins contaminée à la plus contaminée, et il faut procéder à un rinçage avec de l’acide nitrique dilué et de l’eau distillée entre les stations. Les résidus de rinçage doivent être recueillis et retournés au laboratoire afin d’être éliminés de façon appropriée. Des échantillons témoins (blancs) devraient être employés avant et après l’utilisation de l’échantillonneur afin de vérifier s’il n’y a pas eu une contamination des échantillons (Fowlie et al., 2001).
La réalisation des profils verticaux est facilitée par l’emploi d’un enregistreur de données (ou d’un instrument équivalent) équipé d’une sonde d’oxygène dissous et d’un agitateur, ainsi que de sondes de pH, de conductivité, de profondeur et de température qui évaluent la qualité de l’eau simultanément dans toute la colonne d’eau. Un enregistreur de données est particulièrement utile dans les plans d’eau profonds (> 50 m). Durant la réalisation du profil, l’utilisateur est en mesure d’observer les données recueillies et de noter les zones présentant un intérêt particulier pendant la descente et la remontée de l’appareil (hausses soudaines de la conductivité, thermocline, valeurs inhabituelles, etc.). Les données sont notées manuellement ou stockées directement dans l’enregistreur. Afin de compléter les données informatisées, il importe de consigner les mesures à la main, sur des formulaires de données, à intervalles de 2 ou 5 m selon la profondeur totale du profil.
Dans les plans d’eau peu profonds, l’utilisation d’instruments portatifs est souvent la façon la plus pratique de mesurer les paramètres de la qualité de l’eau in situ, car ils sont légers et il en existe plusieurs modèles. Leur emploi est toutefois limité, car les sondes et les câbles qui les relient à l’unité portative n’atteignent généralement que des profondeurs de 2 à 5 m. En outre, ces instruments nécessitent habituellement un entretien et un étalonnage plus réguliers; ils demandent donc des soins particuliers pour assurer leur bon état de fonctionnement. Il est aussi recommandé de tenir des registres d’étalonnage et d’entretien.
La profondeur de l’eau peut être mesurée indirectement à l’aide d’un sonar de pêche ou directement au moyen d’un ruban étalonné, d’un câble ou d’une perche de sondage étalonné. Divers niveaux de précision sont requis selon la profondeur de l’eau :
- Profondeur de l’eau moins de 2 m : niveau de précision recommandé ± 25 cm
- Profondeur de l’eau 2 à 10 m : niveau de précision recommandé ± 50 cm
- Profondeur de l’eau Plus de 10 m : niveau de précision recommandé ± 1 m
La profondeur optique est une mesure de la transparence de l’eau qui est mesurée à l’aide d’un turbidimètre sur le terrain ou en laboratoire. On peut également se servir d’un disque de Secchi. Ce dispositif est un disque de 20 cm de diamètre dont deux quartiers opposés sont peints en blanc, les deux autres en noir. Le disque est attaché à un ruban étalonné. Pour mesurer la profondeur optique, le disque est mouillé dans un secteur ombragé et il est descendu jusqu’à ce qu’il disparaisse de vue. Le disque est ensuite remonté vers la surface et la profondeur à laquelle il réapparaît est notée. Au moins deux mesures devraient être prises à chaque station d’échantillonnage, et l’estimation de la profondeur optique est fondée sur la valeur médiane de ces mesures. Les mesures devraient être prises au milieu de journée sans porter des lunettes de soleil (Nielsen et Johnson, 1983).
Un examen sommaire des données de qualité de l’eau devrait être fait pendant l’échantillonnage afin de vérifier qu’aucune erreur de mesure ou d’enregistrement n’a été commise. En cas d’erreur due à l’instrument ou d’erreur d’échantillonnage, ceci permet de remplacer l’instrument défectueux ou d’en vérifier le fonctionnement. Il est recommandé d’inspecter quotidiennement tous les dispositifs d’échantillonnage et de mesure afin de s’assurer de leur bon fonctionnement et, au besoin, de les étalonner.
Il est recommandé de consigner les mesures et les observations additionnelles suivantes sur le terrain :
- numéros de l’échantillon, des réplicats et identification du site (p. ex., nom);
- date et heure du prélèvement;
- conditions météorologiques et autres facteurs au moment de l’échantillonnage (p. ex., vitesse et direction du vent, action des vagues, courant, marée, intensité du trafic maritime, température de l’air et de l’eau, épaisseur de la glace [le cas échéant]);
- emplacement de la station (p. ex., coordonnées de positionnement) et des points de prélèvement des réplicats d’échantillons;
- type de plate-forme ou d’embarcation utilisée pour l’échantillonnage (p. ex., dimensions, puissance, type de moteur);
- nom des personnes participant à l’échantillonnage;
- informations concernant tout incident imprévu survenu durant la manipulation de l’échantillonneur (p. ex., contamination des échantillons, défectuosité ou bris d’équipement, aspect inhabituel, maîtrise du dispositif d’échantillonnage durant sa descente);
- écarts par rapport aux modes opératoires normalisés.
5.7.3 Prélèvement d’échantillons d’eau destinés aux analyses en laboratoire
Le programme de suivi de la qualité de l’eau consiste principalement à prélever des échantillons d’eau sur le terrain et à les expédier à un laboratoire pour analyse et comporte la mesure des concentrations de métaux, de nutriants, des principaux anions et cations et de plusieurs autres paramètres généraux de la qualité de l’eau.
L’analyse des métaux totaux (valeurs totales) est requise (article 4 de l’annexe 5 du REMM) pendant le suivi de la qualité de l’eau, les études ayant souvent montré qu’il n’y a aucune différence entre les « métaux totaux » et les « métaux dissous » (ESG, 1999). Cependant, des différences importantes entre ces deux concentrations peuvent être trouvées dans certains cas, et l’analyse des métaux dissous et des métaux totaux pourrait s’avérer utile sur un site en particulier dans le contexte de la recherche de causes.
En général, les échantillons d’eau devraient être prélevés à deux profondeurs, soit sous la surface (épilimnion) et près du fond (hypolimnion) pour obtenir des échantillons des deux zones de la colonne d’eau (au-dessus et au-dessous de la thermocline). Si la profondeur de l’eau est égale ou inférieure à 2 m, un prélèvement réalisé au milieu de la colonne d’eau ou à au moins 15 cm sous la surface de l’eau suffit. Les échantillons prélevés sous la surface peuvent être recueillis à la main directement dans la bouteille d’échantillonnage.a
L’utilisation d’échantillonneurs non métalliques Van Dorn d’une capacité de 2 à 16 L ou Kemmerer d’une capacité de 0,5 à 8 L (ou d’un autre type, comme l’échantillonneur Niskin) permet le prélèvement d’échantillons à des profondeurs précises. Dans les cours d’eau, il est possible d’utiliser un échantillonneur intégrateur de profondeur qui fournit des échantillons représentatifs des matières en suspension et des substances connexes. Ces échantillonneurs peuvent être utilisés à partir d’une embarcation, d’un pont ou d’une couche de glace. Pour des raisons de sécurité, ils doivent habituellement être manipulés par deux personnes. Si l’échantillonnage se déroule à de très grandes profondeurs, il est préférable d’utiliser un échantillonneur péristaltique. Sinon, on choisira un échantillonneur avec revêtement de téflon.
Entre chaque prélèvement, l’échantillonneur devrait être soumis à un triple rinçage avec de l’eau de la station d’échantillonnage. En outre, il est recommandé d’échantillonner d’abord la zone de référence afin d’éviter la contamination de l’échantillonneur avec de l’eau provenant de la zone exposée. Entre les zones d’échantillonnage, l’échantillonneur devrait être rincé deux fois à l’acide nitrique dilué de qualité réactif, surtout lorsqu’il est impossible de terminer l’échantillonnage dans la zone de référence d’abord. Les résidus de rinçage au solvant doivent être recueillis et retournés au laboratoire afin d’être éliminés de façon appropriée. Il faut vérifier que l’échantillonneur ne contamine pas les échantillons en faisant passer des blancs de laboratoire avant et après utilisation.
Au moment du prélèvement, il est important de se conformer le plus possible aux méthodes d’analyse d’ultratraces et aux protocoles d’échantillonnage de l’eau appropriés suivants :
- effectuer l’échantillonnage en progressant de la station la moins contaminée à la plus contaminée;
- rincer trois fois les bouteilles et les bouchons avant chaque prélèvement;
- ne pas introduire d’agents de conservation dans les bouteilles avant les prélèvements;
- durant le prélèvement, orienter l’ouverture de la bouteille face au courant, de façon à ce que l’échantillon n’entre pas en contact avec la main qui tient la bouteille;
- ne jamais toucher l’intérieur du récipient ou de son couvercle, ou le goulot de la bouteille, même si l’on porte des gants jetables;
- porter des gants en latex exempt de talc ou en nitryle non doublés afin d’éviter la contamination de l’échantillon;
- étiqueter immédiatement tous les échantillons clairement et employer les techniques de conservation appropriées. Consigner immédiatement toutes les données d’échantillonnage dans le carnet de terrain;
- durant le prélèvement, tenir le bouchon de la bouteille vers le bas;
- consigner l’emplacement des points d’échantillonnage.
5.7.4 Manipulation, entreposage et analyse des échantillons pour le suivi de la qualité de l’eau
5.7.4.1 Manipulation et conservation des échantillons
Le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001) renferme des recommandations sur la manipulation des échantillons ayant trait aux récipients, aux agents de conservation et aux temps de conservation pour des paramètres précis. Au besoin, des agents de conservation devraient être ajoutés dans la bouteille dès que l’échantillon a été prélevé. Le nombre d’échantillons à prélever peut varier selon les besoins du laboratoire.
Il est possible de réduire le nombre d’échantillons prélevés en utilisant le contenu d’une bouteille d’échantillonnage pour l’analyse de plusieurs substances. Avant d’entreprendre l’échantillonnage, la liste des paramètres à mesurer devrait être examinée avec les responsables du laboratoire afin de déterminer le nombre et le type de bouteilles requis.
Lors de l’échantillonnage, il est utile de se munir d’une liste de contrôle où sont indiqués, pour chaque bouteille, les substances à analyser et les agents de conservation ajoutés, le cas échéant. Chaque fois qu’un échantillon est prélevé, il devrait être coché sur la liste. Dans certaines situations, il peut être difficile de respecter la période de rétention maximale prescrite de sept à dix jours (cations et anions majeurs, nitrates-nitrites, carbone organique dissous). Si l’expédition des échantillons d’eau d’une mine est retardée, mais que l’intégrité des échantillons est préservée, l’agent d’autorisation devrait être avisé sans délai.
5.7.4.2 Expédition et entreposage des échantillons
Il est recommandé de maintenir les échantillons à une température de 4 °C durant le prélèvement et de les entreposer à la même température pendant leur expédition afin de prévenir leur dégradation. Les échantillons devraient être réfrigérés et les glacières équipées de blocs réfrigérants ou de glace en sac pour conserver les échantillons au froid.
Les échantillons devraient être expédiés au laboratoire le plus rapidement possible (dans les 24 à 48 heures au maximum). Les analyses devraient être effectuées dans les délais d’entreposage approuvés, qui sont fonction du paramètre. Le délai d’entreposage désigne l’intervalle de temps entre la fin de l’échantillonnage et le début des analyses. Les échantillons devraient être entreposés le moins longtemps possible et dans des conditions prévenant le plus possible leur dégradation. Ils devraient être conservés à une température supérieure à leur point de congélation, mais inférieure à 10 °C, et protégés le plus possible de la lumière. Les échantillons ayant subi une digestion en prévision du dosage des métaux peuvent être conservés dans un récipient scellé et analysés dans les 30 jours qui suivent. Pour de plus amples renseignements, veuillez consulter le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001).
5.7.4.3 Analyses des échantillons en laboratoire
Les analyses devraient être confiées à un laboratoire accrédité et exécutées par du personnel spécialisé, dans des conditions faisant l’objet d’un contrôle de qualité et conformément à des modes opératoires normalisés. Les laboratoires dont les mines retiennent les servicesdevraient être accrédités selon la norme ISO/IEC 17025:2005 de l’Organisation internationale de normalisation intitulée Exigences générales concernant la compétence des laboratoires d'étalonnages et d'essais, avec ses modifications successives. Les méthodes d’analyse choisies devraient être généralement acceptées et couramment utilisées dans les laboratoires au Canada. Le principe général de la méthode devrait avoir fait l’objet d’un examen par des pairs et d’une large diffusion, afin de pouvoir facilement la trouver si des précisions sont nécessaires.
Les méthodes d’analyse choisies devraient satisfaire aux critères mentionnés dans le présent document et à tout autre objectif fixé par la mine (ou par des personnes agissant au nom de la mine) ou par Environnement Canada. Le directeur de projet et le laboratoire doivent confirmer quels paramètres d’intérêt seront mesurés et que les délais de conservation seront respectés. Le laboratoire et les méthodes d’analyse devraient être choisis avant que les échantillons ne soient prélevés de manière à garantir que les exigences du laboratoire en matière d’échantillonnage soient satisfaites.
Les méthodes retenues devraient permettre d’atteindre de manière fiable les limites de détection stipulées pour les substances délétères dans l’annexe 3 du REMM (p. ex., toute concentration supérieure d’environ un dixième à la concentration maximale autorisée (Fowlie et al., 2001). Les méthodes normalement acceptées et leurs limites de détection ainsi que les objectifs de précision et d’exactitude pour les effluents des mines de métaux sont traités dans le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001). Pour les autres paramètres de qualité de l’eau requis ou propres à un site, pour lesquels il n’y a pas de limite de détection précisée, si le Conseil canadien des ministres de l’environnement a publié une recommandation pour la qualité des eaux (CCME, 1999) concernant la variable mesurée, la limite de détection de la méthode choisie devrait être assez basse pour que l’on puisse déterminer si les paramètres mesurés dépassent cette recommandation. Les recommandations du CCME peuvent être consultées à l’adresse http://ceqg-rcqe.ccme.ca/?lang=fr. Plusieurs provinces ont également élaboré des recommandations pour la qualité de l’eau. Lorsque des recommandations pour un paramètre en particulier ont été faites par le CCME et une province, la recommandation provinciale a la préséance. Toutefois, les deux recommandations devraient être rapportées.
5.7.5 Comparaison des données sur la qualité de l’eau dans la zone exposée et dans la zone de référence
Il est recommandé que le rapport d’interprétation biologique inclue une comparaison des données sur la qualité de l’eau dans les zones d’exposition et de référence. Cette comparaison devrait porter sur tous les paramètres mesurés aux fins du suivi de la qualité de l’eau, en particulier ceux pour lesquels des différences supérieures à un facteur de deux ont été relevées entre la zone exposée et la zone de référence. Cette comparaison a pour but de faciliter l’interprétation des données biologiques du rapport susmentionné.
Le choix d’un facteur de deux pour la mesure du dépassement des concentrations par rapport à la zone de référence a pour but de souligner les véritables différences entre les concentrations des zones exposées et des zones de référence, et non simplement des différences qui pourraient être attribuées à des facteurs comme de faibles concentrations de contaminants ciblés, la variabilité analytique, la taille minimale des échantillons (n = 4) et la variabilité saisonnière. Quand la zone de référence se trouve dans un plan d’eau ou un bassin hydrographique différent de celui de la zone exposée, il se peut que le facteur de deux ne puisse s’appliquer.
Pour déterminer si les concentrations diffèrent entre la zone exposée et la zone de référence, il faut examiner la valeur médiane d’au moins quatre échantillons prélevés sur une période de 12 mois aux mêmes endroits dans la zone exposée et dans la zone de référence. La valeur médiane d’un ensemble de n mesures y1, y2, y3, … yn est définie comme la valeur de y occupant la position centrale de la distribution lorsque les mesures sont classées par ordre de grandeur. Si le nombre de mesures est un chiffre pair, la médiane est la valeur correspondant à la moitié de y se trouvant entre les deux valeurs centrales. Si le nombre de données est plus élevé (n >> 4), on peut utiliser un test statistique (p. ex., moyenne ou médiane supérieure à l’intervalle de confiance de 95 % ou à deux écarts-types) pour déterminer si les concentrations dans la zone exposée sont supérieures à celles mesurées dans la zone de référence. Si, pour la zone exposée, il y a suffisamment de données sur la qualité de l’eau avant l’exploitation minière, celles-ci peuvent servir de base de comparaison.
Lorsque le rapport entre les concentrations dans la zone exposée et dans la zone de référence est supérieur à un facteur de deux, il est conseillé aux responsables de la mine d’estimer et de signaler la portée géographique de ces différences en se basant sur le suivi élargi de la qualité de l’eau ou en recourant à la modélisation. Toutefois, avant d’estimer sur quelle superficie ces différences se manifestent, il importe de prendre les facteurs suivants en considération :
- Objectifs de qualité de l’eau propres au site. Si un objectif de qualité de l’eau propre au site existe pour un paramètre particulier et que cet objectif est dépassé dans la zone exposée, la superficie sur laquelle ce dépassement est observé devrait être déterminée, quelle que soit la concentration dans la zone de référence.
- Recommandations pour la qualité de l’eau. S’il existe des recommandations pour la qualité de l’eau pour un paramètre particulier et que la valeur mesurée pour ce paramètre dans la zone exposée est plus de deux fois supérieure aux concentrations mesurées dans la zone de référence ainsi qu’aux recommandations pour la qualité de l’eau, la superficie sur laquelle ce dépassement est observé devrait être déterminée.
Les recommandations du CCME pour les paramètres de suivi de la qualité de l’eau (CCME, 1999) peuvent être consultées sur le site Web suivant : http://ceqg-rcqe.ccme.ca/?lang=fr. Plusieurs provinces ont formulé des recommandations similaires. Dans les cas où des recommandations provinciales ont aussi été établies pour la qualité de l’eau, la préséance leur est accordée, mais les écarts par rapport aux recommandations du CCME devraient également être signalés. - Limites de détection. Lorsque la limite de détection de la méthode (LDM) se situe près de la recommandation pour la qualité de l’eau (RQE) et que les concentrations du paramètre dans la zone d’étude sont près de celles-ci, il se peut qu’une différence équivalant à un facteur de deux ne soit pas significative, à cause du plus fort degré d’incertitude de l’analyse lorsque la mesure se situe près de la LDM. En pareilles circonstances, il convient de consulter l’agent d’autorisation. McQuaker (1999) a d’ailleurs présenté une comparaison des limites de détection réalisables lorsqu’il existe des recommandations pour la qualité de l’eau. Pour la plupart des paramètres, il existe des limites de détection considérablement inférieures (c.-à-d. un rapport LDM/RQE d’au moins 1/10). Toutefois, McQuaker a conclu que pour certains paramètres (arsenic, cadmium, mercure, sélénium, argent et cyanure), il n’existe pas de LDM réalisable dix fois inférieure aux RQE. Au fur et à mesure que le rapport LDM/RQE diminue, l’incertitude des mesures augmente. Au-delà d’un rapport de 1/2, les résultats obtenus ne sont pas considérés statistiquement significatifs.
- pH. Dans le cas du pH, un rapport de deux peut être particulièrement important puisque l’échelle du pH est logarithmique. Si une recommandation relative au pH existe pour un site particulier et que la valeur du pH mesurée dans la zone exposée se situe à l’extérieur de l’intervalle précisé dans la recommandation; l’étendue géographique où cette valeur est mesurée devrait être déterminée. Également, s’il n’y a pas de recommandation au sujet du pH et que la valeur mesurée dans la zone d’exposition est supérieure à 0,5 unité de la valeur mesurée dans la zone de référence et qu’elle se situe à l’extérieur de l’intervalle précisé dans les recommandations sur la qualité de l’eau (p. ex., intervalle de 6,5 à 9,0 émis par le CCME); l’étendue géographique de la zone exposée, où le pH est supérieur à 0,5 unité, devrait être déterminée. Selon les recommandations canadiennes pour la qualité de l’environnement (CCME, 1999), les activités anthropiques ne devraient pas modifier le pH par plus de 0,2 unité dans les milieux marins ou estuariens.
- Emplacement de la zone de référence. Dans les sites où la zone de référence se trouve dans un plan d’eau ou un bassin hydrographique différent de celui de la zone exposée, une différence équivalant à un facteur deux peut se révéler inapplicable. S’il est estimé que c’est le cas, il est recommandé de consulter l’agent d’autorisation.
5.7.6 Estimation de l’étendue de la zone de concentrations élevées
L’un ou l’autre des deux méthodes suivantes peut servir à estimer la superficie de la zone où les concentrations sont élevées :
- mesure directe;
- modélisation.
1) Mesure directe
Pour utiliser la méthode de mesure directe, un plus grand nombre de stations de prélèvement au sein de la zone exposée est nécessaire afin de déterminer à partir de quel point les concentrations du ou des contaminants préoccupants cessent d’être trop élevées. Le nombre de stations additionnelles requises à cette fin est normalement établi en fonction de caractéristiques propres au site, mais en général, au moins trois stations seraient requises, soit :
- la station utilisée dans la zone exposée pour le suivi de la qualité de l’eau;
- au moins deux autres stations plus éloignées situées au bord de la zone exposée où l’on s’attend à ce que les concentrations du ou des contaminants préoccupants cessent d’être trop élevées.
2) Modélisation
Si les fluctuations saisonnières des concentrations du contaminant préoccupant sont bien connues dans l’effluent et la zone exposée ainsi que celles des débits de l’effluent et du milieu récepteur; il est alors possible de prévoir l’endroit dans la zone d’exposition où les concentrations sont estimées ne plus être trop élevées.
5.8 Assurance et contrôle de la qualité pour le suivi de la qualité de l’eau
Les aspects généraux de l’assurance de la qualité et du contrôle de la qualité sont traités dans le Plan d’étude (Chapitre 2).
5.8.1 Contrôle de la qualité sur le terrain
Le contrôle de la qualité (CQ) des programmes d’échantillonnage sur le terrain englobe les aspects généraux suivants :
- toutes les personnes participant à l’échantillonnage sur le terrain devraient avoir l’éducation et la formation appropriées;
- les méthodes d’échantillonnage devraient être utilisées de façon uniforme dans tous les sites et tout au long de l’étude;
- l’échantillonnage devrait se dérouler selon des modes opératoires normalisés accessibles au personnel durant toute la durée des travaux sur le terrain;
- le dispositif d’échantillonnage devrait convenir à l’habitat étudié, être nettoyé correctement et accompagné de la documentation appropriée (c.-à-d. manuel d’utilisation, calendrier d’étalonnage et d’entretien);
- tous les échantillons devraient être identifiés au moyen d’une étiquette indiquant la date et le lieu du prélèvement, le type et le numéro d’échantillon et le nom de la personne qui a fait le prélèvement;
- les échantillons devraient être placés dans les récipients appropriés, avec l’agent de conservation ou le fixatif approprié s’il y a lieu;
- les techniciens de terrain devraient prendre des notes détaillées avec des stylos à encre indélébile et des carnets imperméables;
- le personnel devrait utiliser des formulaires de chaîne de possession et de soumission d’échantillons ainsi que des sceaux pour les échantillons contenant des contaminants;
- le personnel devrait employer les méthodes d’expédition et d’entreposage appropriées;
- des formulaires de terrain normalisés devraient être utilisés durant les travaux sur le terrain.
5.8.2 Assurance de la qualité sur le terrain
Lors d’un suivi de la qualité de l’eau, l’assurance de la qualité (AQ) sur le terrain se fait à l’aide de diverses méthodes, notamment : lectures en double, comparaison des lectures avec des étalons connus, prélèvement d’échantillons de profils pour évaluer les analyses et évaluation des paramètres à l’aide d’autres équipements (instrument de mesure de la conductivité, de la température et de la profondeur Hanna, thermomètre, etc.).
De nombreux facteurs peuvent compromettre la qualité des données. Parmi les plus fréquents, mentionnons les erreurs dues à l’étiquetage ou à l’interversion des bouteilles, la non-utilisation d’un agent de conservation approprié, les conditions inappropriées d’entreposage des échantillons, la contamination des échantillons par l’équipement d’échantillonnage et le dépassement des durées de conservation maximales. Chaque échantillon devrait être identifié à l’aide d’une étiquette permettant de le distinguer des autres échantillons. Les informations requises devraient être inscrites à l’encre indélébile sur des étiquettes posées sur les récipients de manière qu’elles ne tombent pas si elles sont mouillées ou durant le transport.
Le carnet de terrain fait partie intégrante du programme d’échantillonnage et forme la base du rapport d’échantillonnage. Son contenu est souvent très utile pour l’interprétation des données de laboratoire. Toutes les modifications apportées au plan d’échantillonnage et toutes autres observations pertinentes concernant les échantillons ou les lieux d’échantillonnage devraient y être notées. Les lacunes courantes dans les carnets de terrain incluent l’absence de notes de planification, le manque de notes prises au moment même où les événements se produisent, les entrées non signées ou datées et l’inscription de notes illisibles.
5.8.3 Assurance de la qualité durant la manipulation, le transport et l’entreposage des échantillons
L’Association canadienne des laboratoires d’analyse environnementale (ACLAE) (maintenant l’association canadienne pour l’accréditation des laboratoires [Canadian Association for Laboratory Accreditation; CALA]) a formulé les recommandations suivantes concernant l’assurance de la qualité durant la manipulation, le transport et l’entreposage des échantillons (CALA, 1991).
- Chaîne de possession des échantillons. Des formulaires de chaîne de possession devraient être utilisés pour le transport des échantillons, particulièrement dans les cas où de nombreuses personnes ou entreprises participent à l’échantillonnage, à l’expédition et à l’analyse des échantillons.
- Inspection des échantillons. L’état de chaque échantillon devrait être consigné lors de la réception. Toute divergence entre l’état exigé et l’état observé des échantillons devrait être inscrite dans un carnet ou dans un fichier d’ordinateur. Il est préférable de préserver les échantillons sur le terrain sans tarder. Toutefois, si cela n’a pas été fait sur le terrain, il faut ajouter un agent de conservation dès la réception des échantillons et noter la méthode de conservation.
- Suivi des échantillons. Un numéro ou un code unique devrait être attribué à chaque échantillon pour l’identifier dans un système de suivi des échantillons. Ce système devrait identifier l’échantillon, indiquer sa provenance, la date de réception, les analyses, la date d’échéance pour les résultats ainsi que toute autre information pertinente. Il est recommandé d’avoir recours à un système de gestion de l’information de laboratoire pour effectuer le suivi des échantillons dans les laboratoires où un grand nombre d’échantillons sont traités pour différents clients.
- Entreposage des échantillons. Les échantillons devraient être entreposés dans un endroit déterminé à l’intérieur d’un réfrigérateur ou dans une aire d’entreposage accessible seulement au personnel autorisé. Les échantillons devraient être réfrigérés à 4 °C et n’être retirés du réfrigérateur qu’à des fins d’inspection, de consignation de données et d’analyse. La température du réfrigérateur devrait être mesurée et inscrite quotidiennement.
5.8.4 Utilisation de blancs et de duplicata d’échantillons
L’utilisation de blancs et de duplicata d’échantillons sur le terrain et en laboratoire est un élément important de tout programme de contrôle de la qualité (CQ).
Il est essentiel d’utiliser des blancs et des duplicata tout au long de l’exécution de travaux sur le terrain comportant le prélèvement d’échantillons d’eau. Les échantillons de CQ de terrain permettent de vérifier si des erreurs ont été commises durant l’échantillonnage et, le cas échéant, d’apporter les correctifs qui s’imposent. Ils se distinguent des échantillons de CQ utilisés en laboratoire en ce qu’ils permettent de mesurer les effets de l’échantillonnage plutôt que les effets des procédures de laboratoire.
Les blancs de terrain ont pour objet de vérifier si les échantillons ont été contaminés par une des nombreuses sources potentielles de contamination : récipients à échantillon, bouchons, agents de conservation, équipement, papier filtre (dans le cas des échantillons qui doivent être filtrés), air ambiant, techniques d’échantillonnage et analyse. Ces blancs, constitués d’eau désionisée fournie par le laboratoire responsable des analyses, sont transportés sur le terrain et soumis aux mêmes procédures de prélèvement, de manipulation et de traitement que les échantillons destinés aux analyses (p. ex., transfert dans un récipient à échantillon, conservation et exposition à l’environnement). Ils sont ensuite transportés, entreposés et analysés selon les mêmes méthodes que les échantillons de terrain destinés aux analyses (McQuaker, 1999).
Des duplicata d’échantillons devraient être prélevés pour vérifier les résultats des analyses et la fiabilité de l’équipement. Les duplicata de terrain permettent d’évaluer l’homogénéité du site d’échantillonnage et la constance de l’équipement d’échantillonnage. Ce sont des échantillons entièrement distincts, et non les produits de la division d’un échantillon dans deux récipients. Les duplicata de terrain devraient être traités comme s’il s’agissait d’échantillons en aveugle et ne sont pas identifiés comme tels au laboratoire.
Le dernier type d’échantillon utilisé à des fins de CQ est le blanc de transport. Ce type de blanc sert à vérifier la présence d’une contamination éventuelle par les récipients à échantillon, les bouchons et les agents de conservation durant le transport, l’entreposage et l’analyse. Un blanc de transport consiste en un récipient rempli d’eau désionisée en laboratoire et qui est soumis au même traitement de conservation que les échantillons destinés à l’analyse (Fowlie et al., 2001). Les blancs de transport sont transportés sur le terrain avec les autres récipients à échantillon puis retournés sans avoir été ouverts au laboratoire avec les échantillons prélevés. Au laboratoire, ils sont ouverts, et leur contenu est soumis aux mêmes analyses que les échantillons de terrain (McQuaker, 1999).
Les blancs de terrain et de transport ainsi que les duplicata de terrain devraient représenter 5 à 10 % du nombre total d’échantillons. Par exemple, si des prélèvements sont effectués à 10 zones de suivi de la qualité de l’eau, un seul de chaque type d’échantillon de CQ serait requis par station. Cette proportion peut être augmentée au besoin pour évaluer les erreurs attribuables à l’échantillonnage et l’homogénéité de la matrice d’échantillonnage. Si l’on n’utilise pas de blancs de transport et de terrain aux fins du CQ, toute inexactitude due à l’échantillonnage passera inaperçue ou sera imputée à tort au laboratoire chargé des analyses. De plus amples renseignements sur l’utilisation de blancs et de duplicata en laboratoire sont présentés à la section 5.8.5. Le tableau 5-2 résume les utilisations recommandées des blancs et des duplicata sur le terrain et en laboratoire dans le cadre des programmes d’échantillonnage de plus grande envergure. Pour les programmes d’échantillonnage courants prévoyant le prélèvement d’échantillons dans deux stations, l’une dans la zone exposée et l’autre dans la zone de référence, il est recommandé de soumettre un seul blanc de terrain avec les échantillons à analyser. Dans ce cas, le laboratoire va analyser les échantillons par lots, en même temps que les échantillons soumis par d’autres clients. Le laboratoire va alors assurer le CQ interne nécessaire pour l’ensemble du lot analysé.
| Paramètre | Nbre d’échan-tillons | CQ - interne ou terrain | Limites de contrôle | Description |
|---|---|---|---|---|
| Blanc de terrain | 1 | Terrain | Vérifier si les échantillons ont été contaminés pendant leur manipulation. Un blanc par jour par matrice. | |
| Blanc de transport | 1 | Terrain | Vérifier la validité de la conservation et des conditions d’entreposage des échantillons. Un blanc par jour par matrice. | |
| Duplicata de terrain | 1 | Terrain | Évaluer l’homogénéité du site d’échantillonnage et la constance de la méthode et de l’équipement d’échantillonnage. | |
| Blanc de méthode | 1 | Interne | < limite de détection (LD) ou < 0,1 % de la concentration dans l’échantillon | Vérifier si les échantillons ont été contaminés par les réactifs et les procéduresa. |
| Duplicata de laboratoire | 1 | Interne | Vérifier la précision de l’échantillonnage. Un blanc par jour par type de matricea. | |
| Verrerie | 1 | Interne | < LD ou < 0,1 % de la concentration dans l’échantillon | Vérifier si la verrerie de laboratoire utilisée durant les analyses a été contaminéea. |
| Matériau de référence étalon (MRE) | 1 | Interne | Vérifier l’exactitude de la méthodea. | |
| Matrice enrichie | 1 | Interne | 75 à 125 % | Peut remplacer le MREb. |
| Contrôle de l’étalonnage : | ||||
| à l’intérieur d’une série d’analyses (blanc et étalon de concentration intermédiaire) | 1 | Interne | Dérive maximale de 10 % | Le contrôle statistique de l’étalonnage peut être assuré entre les séries d’analyses au moyen de deux étalons de contrôle, A et B, et à l’intérieur d’une série d’analyses au moyen de blancs et d’étalons de concentration intermédiaire (King, 1976). |
| entre les séries d’analyses (à 20 % et à 80 % de la plage des concentrations) | 2 par série | Interne | ± 5 % de la valeur cible |
Remarque – Les valeurs indiquées sont fondées sur un lot de 20 échantillons.
a Intrinsèque à chaque lot de 20 échantillons.
b Peut être utilisé en remplacement du MRE si ce dernier n’est pas disponible.
5.8.5 Contrôle de la qualité en laboratoire
Le contrôle de la qualité des analyses en laboratoire comporte les éléments généraux suivants :
- les données devraient être vérifiées et validées par des vérifications de la transcription; les données chimiques seront vérifiées par rapport aux rapports d’AQ du laboratoire accompagnant les données;
- les analyses des données seront répétables, robustes et feront l’objet de contre-vérifications par rapport aux objectifs de qualité des données;
- les analyses des données seront rigoureuses et valides, et devraient inclure une justification de toutes les analyses statistiques et les transformations de données.
5.8.5.1 Précisions sur les aspects du contrôle de la qualité des analyses en laboratoire
Les procédures de contrôle de la qualité des analyses sont conçues pour assurer le contrôle statistique de l’étalonnage, de la précision, de l’exactitude et du biais ainsi que de la récupération (ACLAE [maintenant CALA], 1991).
Le contrôle statistique de ces paramètres peut être assuré à l’aide d’échantillons de contrôle d’une qualité prédéterminée durant chaque série d’analyses. Les résultats de l’analyse de ces échantillons de CQ sont comparés statistiquement à des intervalles de confiance établis à partir de données historiques. Ces intervalles de confiance, ou limites de contrôle, correspondent généralement à trois écarts-types par rapport à la moyenne de la variable contrôlée. Les limites d’avertissement sont couramment fixées à deux écarts types par rapport à cette moyenne. Les indicateurs de résultats excédant les limites de contrôle sont les suivants :
- deux résultats successifs de blancs de méthodes, de duplicata de laboratoire, de matériaux de référence étalons, de blancs enrichis, d’échantillons de contrôle de l’étalonnage ou taux de récupération des analogues organiques;
- un de ces résultats excédant les limites de contrôle.
Les données de CQ peuvent être reportées sur des diagrammes de contrôle. Ce sont des représentations graphiques des données de CQ en fonction du temps ou en fonction du numéro des séries d’analyses consécutives. Ces diagrammes font ressortir les tendances temporelles, le cas échéant, et fournissent une indication graphique du contrôle statistique à long terme de l’analyse. Les limites de contrôle et les diagrammes de contrôle sont décrits en détail dans le manuel de l’ASTM (1986).
5.8.5.2 Bonnes pratiques de laboratoire
Toutes les procédures de laboratoire devraient se dérouler dans le respect de bonnes pratiques de laboratoire (BPL) bien établies. Une liste succincte des pratiques recommandées est présentée ci-dessous. On trouvera une description détaillée des BPL dans ELAP (1988).
- Les données relatives à la préparation des réactifs devraient être consignées dans un registre. Les récipients des réactifs préparés devraient porter des étiquettes indiquant le nom du réactif, la date de préparation, la date d’expiration et le nom de la personne qui en est responsable.
- Les appareils devraient être entretenus ou inspectés régulièrement. Les données d’entretien devraient elles aussi être consignées dans un registre.
- Il faudrait disposer d’instructions écrites pour tous les appareils.
- Des méthodes normalisées pour le nettoyage de la verrerie et des récipients devraient être suivies.
- Il faudrait vérifier régulièrement la pureté de l’eau distillée et consigner les résultats obtenus. L’eau distillée ou désionisée devrait être vérifiée au moins une fois par jour à l’aide d’un conductivimètre.
- Les réactifs chimiques devraient être conformes aux exigences de pureté fixées pour chaque méthode d’analyse.
- Les réactifs et les solvants devraient être stockés conformément aux instructions du fabricant.
- Il faudrait vérifier les étalons de travail et les solutions mères afin de déceler tout changement de concentration.
- Les réactifs devraient être préparés et étalonnés avec des étalons de référence primaires.
- La température de tous les réfrigérateurs et incubateurs devrait être vérifiée quotidiennement et les écarts de température devraient être consignés.
- Chaque four devrait avoir son propre thermomètre, et la température devrait y être vérifiée avant et après utilisation.
- Il faudrait utiliser la verrerie volumétrique appropriée.
- La verrerie devrait être nettoyée selon les spécifications de la méthode.
- Les bouteilles de gaz devraient être remplacées à 700-1 400 kilopascals.
- Le personnel de laboratoire devrait avoir une formation adéquate en méthodes d’analyse de laboratoire, en particulier à propos de celles dont il est responsable.
5.8.5.3 Contrôle de l’étalonnage
Le contrôle statistique de l’étalonnage peut être confirmé, entre les séries, au moyen de deux étalons de contrôle A et B, et à l’intérieur d’une même série, grâce à des blancs et à des étalons de concentration intermédiaire (au milieu de la plage des concentrations).
- Contrôle de l’étalonnage entre les séries : Deux étalons de contrôle A et B peuvent être utilisés pour analyser et contrôler les changements dans l’étalonnage entre les séries; ceci se fait une fois au début de chaque série analytique. Ces étalons sont préparés et conservés indépendamment des solutions étalons; ils sont généralement choisis de façon à représenter respectivement 80 % et 20 % environ de la plage complète des concentrations. Les résultats sont réunis pour un grand nombre de séries et les sommes (A + B) et différences (A – B) sont portées sur des graphiques de contrôle. À l’intérieur d’une série donnée, un changement significatif de la somme (A + B), par rapport à la moyenne historique, laisse supposer qu’un changement significatif de l’ordonnée à l’origine s’est produit, les autres facteurs demeurant constants. Un changement significatif de la différence (A – B) laisse supposer un changement significatif de la pente, les autres facteurs demeurant constants. Les limites de contrôle (LC) et d’avertissement (LA) pour (A – B) sont calculées pour la moyenne (X) et l’écart-type (ET) de la population des différences de la façon suivante:
- Limites supérieure et inférieure d’avertissement
(LSA, LIA) = XA-B ± 2 ETA-B - Limites supérieure et inférieure de contrôle
(LSC, LIC) = XA-B ± 3 ETA-B
- LSA/LIA = XA+B ± 2 ETA-B
- LSC/LIC = XA+B ± 3 ETA-B
- Limites supérieure et inférieure d’avertissement
- Contrôle de l’étalonnage à l’intérieur d’une même série (analyses inorganiques) : Les changements de l’étalonnage à l’intérieur d’une même série, attribuables à la dérive de la pente et de la ligne de base, devraient être vérifiés à intervalles réguliers. Cela peut être fait au moyen d’un étalon de concentration intermédiaire et d’un blanc de réactifs passés après chaque groupe de 20 échantillons. Chaque laboratoire devrait établir des limites de contrôle pour chaque méthode. La dérive ne devrait pas dépasser 10 %. Si on décèle une dérive plus grande, il faudrait interrompre l’analyse, réétalonner l’appareil et réanalyser les échantillons qui sont passés après le dernier échantillon de vérification et le dernier blanc acceptables.
- Contrôle de l’étalonnage à l’intérieur d’une même série (analyses organiques) : Dans les analyses organiques par chromatographie en phase gazeuse (CPG), les changements de l’étalonnage à l’intérieur d’une même série devraient être vérifiés par injection d’un étalon de vérification de concentration intermédiaire à une fréquence de 5 % ou toutes les 12 heures. On compare le résultat de cette injection à l’étalonnage initial en calculant l’écart en pourcentage entre le facteur de réponse de chaque substance à analyser dans l’étalon de vérification et le facteur de réponse moyen déterminé au cours de l’étalonnage initial. Si la différence relative exprimée en pourcentage est supérieure à 25 %, la vérification de l’étalonnage devrait être répétée. Si cette vérification donne encore un écart relatif supérieur à 25 %, il est recommandé d’apporter des corrections.
5.8.5.4 Précision
La précision est le degré de variation entre les différentes mesures d’une même variable obtenues à l’aide d’une méthode d’analyse particulière; elle est habituellement exprimée par l’écart-type des réplicats (U.S. EPA, 1990). Le contrôle statistique de la précision analytique est assuré par l’analyse de duplicata à l’intérieur d’une série à une fréquence d’au moins 10 %. Les duplicata de laboratoire sont des portions aliquotes d’un échantillon divisé en laboratoire.
La différence absolue entre les duplicata à l’intérieur d’une série d’analyses est comparée à une limite de contrôle établie à partir de données historiques. Pour obtenir ces limites de contrôle, les résultats des analyses des duplicata sont réunis pour un grand nombre de séries d’analyses et sont triés selon des intervalles de concentration.
Ces intervalles sont souvent fixés de 0 à 20 %, de 20 à 50 % et de 50 à 100 % de la plage complète des concentrations (King, 1976). À l’intérieur de chaque intervalle de concentration, les limites de contrôle pour la différence absolue entre les duplicata à l’intérieur d’une série d’analyses se calculent selon la formule suivante :
LSC = D4 × R
où D4 est un facteur statistique (3,267) et R, la différence moyenne entre les duplicata (ASTM, 1986; Taylor, 1987).
Si la différence entre les résultats des analyses des duplicata de laboratoire dépasse la limite de contrôle supérieure, la situation devrait être évaluée afin de choisir la mesure correctrice qui s’impose.
5.8.5.5 Exactitude et biais
L’exactitude est le degré de concordance entre une valeur mesurée et la vraie valeur déterminée par l’analyse d’un matériau de référence accepté (U.S. EPA, 1990). L’inverse de l’exactitude est le degré d’erreur systématique inhérent à l’analyse, ou biais. L’exactitude se vérifie au moyen de blancs de méthode et de matériaux de référence certifiés. Des renseignements sur le contrôle de la qualité recommandé pour les analyses de composés inorganiques peuvent être trouvés dans le document de l’ACLAE (CALA, 1991).
- Blancs de méthode : Un blanc de méthode est une portion aliquote d’eau contenant un réactif dont le volume est équivalent à celui des échantillons traités, et qui est analysé exactement de la même manière que ces échantillons. Il permet de quantifier le degré de contamination survenue durant le traitement et l’analyse des échantillons. Le nombre de blancs de méthode correspond à 10 % du nombre d’échantillons à analyser ou à un blanc par série d’analyses. Les résultats de leur analyse devraient être reportés sur des diagrammes et les limites d’avertissement devraient être fixées à ± 2 écarts-types et les limites de contrôle, à ± 3 écarts-types. Si un blanc de méthode dépasse la limite de contrôle et est jugé contaminé, les échantillons analysés en même temps que ce blanc et dont les valeurs dépassent la limite de détection devraient être analysés à nouveau pour la ou les variables en cause. En règle générale, on considère que le blanc de méthode est exempt de contamination si les résultats sont inférieurs à la limite de détection ou à 0,1 fois le niveau de contamination décelé dans tous les échantillons avec lesquels il a été analysé (ACLAE [maintenant CALA], 1991).
- Matériaux de référence étalons : Les matériaux de référence étalons sont des échantillons disponibles dans différentes matrices qui ont été soumis à de nombreuses analyses par plusieurs laboratoires et dont les concentrations sont certifiées par des organismes de normalisation, comme le National Institute of Science and Technology, l’Environmental Protection Agency des États-Unis, l’Institut national de recherche sur les eaux d’Environnement Canada et le Conseil national de recherches. Le matériau de référence étalon, lorsqu’on peut se le procurer, devrait représenter 5 % du nombre d’échantillons analysés ou être analysé à raison d’un par série d’analyses (ACLAE [maintenant CALA], 1991; King, 1976). La matrice et la concentration du matériau de référence étalon devraient être les plus proches possible de celles des échantillons à analyser. Les résultats des analyses des matériaux de référence étalons devraient être accumulés et les limites de contrôle et d’avertissement fixées à ± 3 écarts-types et à ± 2 écarts-types, respectivement.
5.8.5.6 Récupération
Le taux de récupération d’une substance à analyser au cours de l’ensemble du processus d’analyse est déterminé à partir d’échantillons de matrice et de blancs enrichis avec des concentrations connues de la substance à analyser et d’analogues.
- Échantillons de matrice enrichis : Un échantillon de matrice enrichi est une portion aliquote d’un échantillon choisi au hasard, à laquelle est ajoutée une quantité connue de toutes les substances à analyser avant le traitement de l’échantillon. L’analyse d’un échantillon ainsi enrichi permet d’évaluer le taux de récupération obtenu pour la matrice propre à cet échantillon. L’échantillon devrait être enrichi avec toutes les substances à analyser, à une concentration aussi proche que possible de la concentration donnant une réponse égale à celle de l’étalon de concentration intermédiaire. La solution d’enrichissement devrait être préparée à partir d’une solution mère distincte de celle utilisée pour l’étalonnage. La fréquence recommandée pour les matrices ainsi enrichies est de 10 % ou de une par série. La récupération est calculée comme suit :
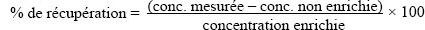
Les résultats obtenus avec les matrices enrichies devraient être portés sur des diagrammes de contrôle distincts pour chaque matrice. Les limites internes devraient être fixées à ± 3 ET pour un minimum de 10 points de données. Lors d’analyses à paramètres multiples, au moins 90 % des substances à analyser devraient présenter un taux de récupération se situant à l’intérieur des limites fixées. Le taux de récupération pour les substances inorganiques devrait se situer entre 75 et 125 %. La récupération pour les variables organiques devrait se situer à l’intérieur des limites précisées au tableau 4 de ACLAE [maintenant CALA] (CALA, 1991). Si une matrice enrichie ne respecte pas ces critères, il faut répéter l’enrichissement et l’analyse de la matrice. Si le taux de récupération ne respecte toujours pas les critères lors de la prochaine analyse et que celle-ci ne semble présenter aucun autre problème, il faudrait signaler l’existence d’un effet dû à la matrice. - Blanc de méthode enrichi : Un blanc de méthode enrichi est une fraction de la même eau que celle utilisée pour le blanc de méthode à laquelle on ajoute la substance à analyser à une concentration aussi proche que possible de celle de l’étalon de concentration intermédiaire. Le blanc ainsi enrichi donne une idée de la fiabilité de la méthode sans les effets de la matrice des échantillons réels. Le blanc enrichi doit être analysé avec les autres échantillons et de la même façon. Comme dans le cas de la matrice enrichie, la solution d’enrichissement doit être préparée à partir d’une solution mère différente de celle utilisée pour l’étalonnage.
Les limites de récupération internes devraient être calculées pour le blanc de méthode enrichi en prenant comme base ± 3 ET et un minimum de 10 points de données. Les taux de récupération pour les analyses inorganiques devraient se situer entre 75 % et 125 % et, pour les variables organiques, entre 70 % et 120 %. Si le taux de récupération pour un blanc fortifié ne respecte pas ces critères, il faudrait recommencer l’enrichissement et l’analyse du blanc. Si le blanc fortifié ne présente toujours pas une récupération satisfaisante, les échantillons associés à ce blanc devraient être réanalysés. S’il ne reste pas assez d’échantillon pour répéter l’analyse, les résultats seront consignés tels quels et annotés comme étant suspects avec une explication. - Étalons internes (analyses organiques) : Toutes les analyses utilisant la chromatographie en phase gazeuse (CPG) devraient être effectuées à l’aide d’étalons internes ou avec des méthodes correctement validées faisant appel à des étalons externes. Un étalon interne est une substance qui se comporte de la même façon dans un système analytique que les substances ciblées, mais dont la présence est peu probable dans l’échantillon. Des étalons internes sont ajoutés à la même concentration à tous les échantillons, étalons et échantillons de contrôle avant d’effectuer les mesures, mais après la préparation des échantillons. Tous les résultats obtenus pour les substances à analyser devraient être normalisés en fonction de la valeur obtenue pour l’étalon interne, de façon à tenir compte de la variabilité instrumentale attribuable à des facteurs comme les variations dans les volumes d’injection, les fluctuations de température et le volume final d’extraction. La valeur de l’étalon interne lors de l’analyse de l’échantillon devrait se situer à moins de 20 % de la réponse interne d’un étalon analysé à l’intérieur de la même période de 12 heures. Si ce critère n’est pas respecté, l’échantillon devrait être réanalysé. Si le critère n’est toujours pas respecté après la nouvelle analyse, les résultats obtenus pour l’échantillon ne devraient pas être corrigés en fonction du résultat de l’échantillon interne et devraient être annotés avec une explication.
- Échantillons avec ajout d’un analogue (analyses organiques) : Un étalon analogue est une substance dont la présence est peu probable dans l’échantillon et qui se comporte de la même façon que les substances à analyser lors de la préparation et de l’analyse de l’échantillon. Les analogues devraient être ajoutés, le cas échéant, à tous les échantillons (y compris les échantillons de CQ) avant leur préparation, de façon à déterminer le rendement de la méthode et l’effet de la matrice des échantillons. Les analyses effectuées par chromatographie en phase gazeuse couplée à la spectrométrie de masse (CPG-SM) devraient comporter au moins deux analogues et celles qui font appel à la CPG seule devraient en compter au moins un. La quantité d’analogue ajoutée à chacun des échantillons devrait être la même que celle ajoutée aux solutions d’étalonnage. Les limites de contrôle internes pour les taux de récupération des analogues sont basées sur une valeur de ± 3 ET pour un minimum de 10 points de données. Les limites de contrôle internes pour les taux de récupération des analogues devraient se situer entre 60 % et 120 %. Si l’un des analogues se situe à l’extérieur de la plage de récupération prévue, l’échantillon devrait être réanalysé. Si, après une nouvelle analyse, le taux de récupération de l’analogue se situe toujours à l’extérieur de la plage permise, les résultats devraient alors être annotés et accompagnés d’une explication.
5.8.5.7 Limites de détection
La limite de détection doit être consignée en tant que limite de détection de la méthode (LDM), conformément à la description de l’U.S. EPA (1984). La LDM est définie comme étant la quantité minimale d’une substance à analyser qui devrait être décelée pour pouvoir conclure à sa présence, avec un risque précisé (généralement 5 % ou 1 %) de détection erronnée.
La LDM est calculée à partir de l’écart-type de l’analyse pour l’intervalle des concentrations les plus faibles :
LDM = t0,05, n–1 × S
où : t0,05, n–1 est la valeur du t de Student (test unilatéral) pour un risque de détection erronée de 5 %, à n – 1 degrés de liberté, et S est l’écart-type.
Idéalement, l’écart type est calculé à partir d’une analyse de réplicats de faibles concentrations avec des échantillons réels dont la matrice est identique ou similaire à celle des échantillons considérés. On peut calculer cet écart-type à partir d’un minimum de sept réplicats dans la même série d’analyses en utilisant la formule statistique standard (U.S. EPA, 1984). Toutefois, il est préférable de le calculer à partir de paires de réplicats accumulées sur un grand nombre de séries d’analyses différentes.
L’écart-type de paires de réplicats de faibles concentrations accumulées sur un grand nombre de séries d’analyses se calcule selon l’équation suivante :
![]()
où D est la différence entre les réplicats, et n, le nombre de paires de réplicats. Il est recommandé d’utiliser au moins 40 paires de réplicats (MEO, 1988). Ensuite, on peut introduire dans l’équation de la LDM la valeur de l’écart-type obtenu selon l’une ou l’autre de ces approches.
Les valeurs en dessous de la limite de détection devraient être consignées comme étant « < LDM » avec la LDM pour l’échantillon en question (Fowlie et al., 2001). Il y a habituellement trois façon d’attribuer une valeur aux résultats qui sont « < LDM » au moment de l’analyse des données : établir qu’elle est égale à la LDM, égale à la moitié de la LDM ou égale à 0. Aux fins du Programme d’ESEE, une valeur égale à la moitié de la LDM est utilisée pour l’analyse et l’interprétation des données. Pour de plus amples renseignement sur l’interprétation des données relatives aux concentrations non détectables, se reporter à Helsel (2005a, 2005b) et à Shumway et al. (2002).
5.8.5.8 Conventions relatives à la présentation des données
Des protocoles établis devraient être suivis pour l’arrondissement des résultats des analyses. Si un trop grand nombre de chiffres sont arrondis avant l’analyse des données, il s’ensuit une perte d’information, et des différences réelles de concentrations entre des échantillons provenant de différents sites ou prélevés à différents moments peuvent être masquées. En outre, la précision du contrôle de la qualité peut être inférieure au niveau souhaitable ou nécessaire, et les valeurs de la moyenne, de l’écart type ou d’autres paramètres statistiques se rapportant à un ensemble de résultats peuvent être biaisées. À l’inverse, quand un trop grand nombre de chiffres significatifs sont conservés, des différences relativement faibles et sans signification statistique peuvent sembler plus importantes qu’elles ne le sont en réalité (Hunt et Wilson, 1986).
L’écart type est le critère à utiliser de préférence pour déterminer le nombre de chiffres significatifs (King, 1989). L’arrondissement devrait se faire au chiffre occupant la même position après la virgule que le chiffre le plus significatif de l’écart type calculé. Par exemple, si l’analyse donne un résultat de 12,345 et que l’écart-type calculé d’après l’analyse de réplicats au sein d’une série à cette concentration est de 0,32, il faut arrondir la valeur à 12,3.
5.8.5.9 Précision et exactitude des analyses
La précision est le degré de concordance entre les résultats de l’analyse des réplicats d’un échantillon. Elle est habituelleme nt exprimée sous la forme d’un écart-type. La reproductibilité est l’étroitesse de l’accord entre les résultats de la mesure d’un paramètre obtenus dans différentes conditions de mesure. Elle correspond à l’écart type associé aux mesures d’un échantillon donné obtenues dans différentes séries d’analyses et est appelée précision entre les séries. La précision entre les séries intègre la variabilité due à l’étalonnage effectué en des temps différents, la dérive due à l’instrument et nombre d’autres facteurs.
Les erreurs aléatoires ont une incidence sur la précision, laquelle est un paramètre mesurable et contrôlable. La précision de toutes les analyses devrait être estimée en soumettant des portions aliquotes distinctes à l’ensemble du processus analytique. Les laboratoires devraient vérifier la précision de leurs analyses et pouvoir en rendre compte en se fondant sur des données recueillies sur plusieurs jours. Pour la plupart des paramètres, la précision devrait correspondre à un écart maximal de 10 %. Pour les matières en suspension totales, elle devrait correspondre à un écart maximal de 15 % à des concentrations de plus de 10 fois la LDM. Dans le cas du pH, la précision devrait correspondre à ± 0,1 unité (annexe 3 du REMM).
L’exactitude intègre les biais et la précision d’une méthode d’analyse et reflète la qualité de l’accord entre la valeur mesurée et la vraie valeur d’un paramètre d’un échantillon. Le biais est une erreur systématique occasionnée par une composante du système de mesure qui entraîne une surestimation ou une sous-estimation des valeurs. Divers facteurs peuvent entraîner un biais, dont la contamination de l’échantillon, les pertes mécaniques, les blancs, l’interférence spectrale, les erreurs d’étalonnage ou l’influence des divers utilisateurs. L’exactitude est exprimée sous la forme d’un taux de récupération de concentrations connues, comme des matériaux de référence certifiés, des échantillons enrichis ou des échantillons de référence préparés et analysés par le laboratoire dans les mêmes conditions que les autres échantillons.
Le degré d’exactitude requis dépend de l’utilisation finale à laquelle les données sont destinées. Le laboratoire devrait vérifier l’exactitude des données et pouvoir en rendre compte en se fondant sur des ensembles de données recueillis sur plusieurs jours. L’exactitude devrait correspondre à un écart maximal de 10% dans le cas des métaux et de la plupart des autres paramètres, tandis que l’écart maximal dans le cas des matières totales en suspension devrait être en dedans de 15 %, à des concentrations supérieures à 10 fois la LDM. Enfin, l’exactitude devrait concorder à ± 0,1 unité dans le cas du pH (annexe 3 du REMM).
5.8.6 Assurance de la qualité en laboratoire
L’assurance de la qualité (AQ) englobe de nombreuses activités de gestion et de pratiques techniques internes et externes visant à garantir l’obtention de données de qualité connue convenant à l’utilisation à laquelle elles sont destinées.
Les activités externes d’AQ comprennent la participation à des comparaisons interlaboratoire pertinentes et l’exécution de vérifications par des organismes externes. Ces vérifications peuvent porter sur le rendement des analyses de matériaux de référence étalons ou reposer sur un examen général des pratiques fondé sur la documentation traitant de l’échantillonnage, des méthodes d’analyse et d’AQ/CQ, des résultats des essais et des données justificatives.
5.8.7 Compilation et présentation des données d’AQ/CQ
5.8.7.1 Documentation
Il est recommandé de documenter tous les aspects des analyses afin de confirmer la qualité et la fiabilité des résultats. Le propriétaire ou l’exploitant d’une mine doit conserver tous les registres ou autres documents requis par le Règlement sur les effluents des mines de métaux sur le site de la mine pendant au moins cinq ans (article 27 du REMM). Enfin, pour chaque échantillon ou lot d’échantillons, il est recommandé de conserver les informations suivantes :
- Limites de détection de la méthode (LDM). Toutes divergences entre les LDM et les LDM établies par le laboratoire (en raison d’interférences, de dilutions, etc.) devraient être notées.
- Dates se rattachant aux échantillons. Des registres des dates de prélèvement, de réception, de préparation et d’analyse des échantillons devraient être conservés. Ces renseignements font partie du processus de suivi des échantillons.
- Performance et entretien des instruments. Il convient de tenir un registre de suivi de la performance, ainsi que des réglages et des réponses, des instruments de laboratoire. Les dossiers d’entretien de chaque instrument devraient être conservés.
- Échantillons destinés au contrôle de la qualité. Les registres des résultats d’analyse des duplicata et des blancs, des taux de récupération des blancs enrichis, des analogues et des matrices enrichies et des résultats d’analyse de matériaux de référence certifiés ainsi que les registres de l’étalonnage et de la vérification de l’étalonnage devraient être conservés.
- Réception, préparation et analyse des échantillons. Toutes les anomalies détectées durant la livraison, l’entreposage, la préparation et l’analyse des échantillons, y compris les modifications apportées aux modes opératoires normalisés, devraient être notées.
5.8.7.2 Présentation des données d’AQ/CQ
Les résultats des analyses sont présentés sous la forme d’un rapport d’essais ou d’analyses incluant toutes les informations pertinentes nécessaires pour évaluer la validité des données, y compris les données d’AQ/CQ. Le rapport devrait être exact, clair, non ambigu et objectif, et présenter les informations suivantes :
- titre (p. ex., rapport d’essais, rapport d’analyses, rapport sur la qualité des données);
- nom et adresse du laboratoire ayant effectué les analyses;
- numéro d’identification unique (p. ex., numéro de série ou de groupe) facilitant sa recherche;
- nom et adresse du client;
- identification ou description de l’échantillon analysé;
- état des échantillons (sans agent de conservation, bouteille qui fuit, etc.) lorsque nécessaire;
- date de réception des échantillons et date de publication du rapport;
- méthode(s) d’analyse employée(s) et, s’il y a lieu, description des essais non normalisés réalisés;
- date et méthode de prélèvement des échantillons (échantillons instantanés, échantillons composites prélevés à divers moments, etc.);
- modifications apportées à la méthode d’analyse habituelle (filtration, rectification du pH, ajout d’un étalon, etc.);
- résultats des analyses, et unités clairement indiquées;
- énoncé indiquant si les résultats ont fait l’objet d’une correction en fonction de blancs;
- données de contrôle de la qualité;
- qualité des résultats (p. ex., résultats n’ayant pas passé le CQ, taille insuffisante des échantillons);
- signature de la personne responsable et date d’autorisation du rapport;
- nom du technicien qui a effectué l’essai;
- noms des sous-traitants clairement indiqués;
- mises à jour ou corrections aux rapports clairement indiquées;
- le laboratoire devrait aviser les clients si de nouvelles données invalident les rapports déjà publiés.
Les données inférieures à la limite de détection analytique devraient être clairement consignées en tant que telles ainsi que la LDM applicable pour cet échantillon.
5.9 Références
AQUAMIN. 1996. Évaluation des effets de l’exploitation minière sur le milieu aquatique au Canada. Rapport final. Préparé par les Groupes de travail 7 et 8 d’AQUAMIN pour le Groupe directeur d’AQUAMIN.
ASTM – American Society for Testing and Materials. 1986. Manual on Presentation of Data and Control Chart Analysis. Philadelphia (PA), American Society for Testing and Materials. Committee E-11 on Statistical Methods, ASTM Special Technical Publication 15D.
CALA – Canadian Association for Laboratory Accreditation. 1991. Code of Practice and QA Manual for Laboratory Analysis of Sewage Treatment Effluent in Support of the MISA Program. Rapport préliminaire préparé pour CAEAL et le ministère de l’Environnement de l’Ontario par Zenon Environmental Laboratories.
CCME – Conseil canadien des ministres de l’environnement. 1999. Recommandations canadiennes pour la qualité des eaux : protection de la vie aquatique.
Druschel, G.K., M.A.A Schoonen, D.K. Nordstorm, J.W. Ball, Y. Xu et C.A. Cohn. 2003. « Sulfur geochemistry of hydrothermal waters in Yellowstone National Park, Wyoming, USA. III. An anion-exchange resin technique for sampling and preservation of sulfoxyanions in natural waters », Geochemical Transactions, 4 : 12-19.
ELAP – Environmental Laboratory Approval Program. 1988. Environmental Laboratory Approval Program Certification Manual. New York State Department of Health.
ESG – Ecological Services Group. 1999. AETE Synthesis Report of Selected Technologies for Cost-Effective Environmental Monitoring of Mine Effluent Impacts in Canada. Ottawa (Ontario), Ressources naturelles Canada, CANMET. Rapport préparé pour le programme ETIMA, projet no 4.1.4.
Fowlie, P., D.R. Hart et R. Turle. 2001. Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final. Ottawa (Ontario), Environnement Canada, Service de protection de l’environnement, Division des minéraux et des métaux. Rapport SPE 2/MM/5, ix + 34 pages. Sur le Web : http://dsp-psd.communication.gc.ca/Collection/En49-24-1-39F.pdf.
Helsel, D.R. 2005a. Nondetects and Data Analysis: Statistics for Censored Environmental Data. Hoboken (NJ), Wiley-Interscience. 250 pages.
Helsel, D.R. 2005b. « More than obvious: better methods for interpreting nondetect data », Environmental Science & Technology, 39(20) : 419A-423A.
Hunt, D.T.E., et A.L. Wilson. 1986. The Chemical Analysis of Water; General Principles and Techniques, 2nd edition. London (GB), The Royal Society of Chemistry.
ISO/CEI – Organisation internationale de normalisation/Commission électrotechnique internationale. 2005. Exigences générales concernant la compétence des laboratoires d'étalonnages et d'essais. Norme ISO/IEC 17025:2005.
King, D.E. 1976. Quality Control and Data Evaluation Procedures. Section I. Analytical Responsibility. Rapport spécial pour la Direction des services de laboratoire, Ministère de l’Environnement de l’Ontario.
King, D.E. 1989. Code of Practice for Environmental Laboratories. Rapport spécial pour le ministère de l’Environnement de l’Ontario, ISBN 0-7729-5874-2.
Makhija, R., et A. Hitchen. 1979. « The titrimetric determination of sulphate, thiosulphate and polythionates in mining effluents », Analytica Chimica Acta, 105 (1) : 375-382.
McQuaker, N.R. 1999. Technical Evaluation on Water Quality Design and Analysis Draft. Ottawa (Ont.), Ressources Naturelles Canada, CANMET. Rapport pour le Programme ETIMA, projet no 3.1.1.
MEO – Ministère de l’Environment de l’Ontario. 1988. Estimation of Analytical Detection Limits (MDL). Rapport du Ministère de l’Environment de l’Ontario, ISBN-0-7729-4117-3.
MEEO – Ministère de l’Environnement et de l’Énergie de l’Ontario. 1993. MISA (Municipal/Industrial Strategy for Abatement) Draft Development Document for the Effluent Limits Regulation for the Metal Mining Sector. Toronto (Ontario), Imprimeur de la reine pour l’Ontario.
Nielsen, L.A., et D.L. Johnson (éd.). 1983. Fisheries Techniques. Blacksburg (VA), The American Fisheries Society, Southern Printing Company. 468 pages.
O’Reilly, J.W., G.W. Dicinoski, M.J. Shaw et P.R. Haddad. 2001. « Chromatographic and electrophoretic separation of inorganic sulfur and sulfur–oxygen species », Analytica Chimica Acta, 432 (2) :165-192.
Reiley, M. 2007. « Science, policy, and trends of metals risk assessment at EPA: How understanding metals bioavailability has changed metals risk assessment at U.S. EPA », Aquatic Toxicology, 84 (2) : 292-298.
Schwartz, M., B. Vigneault et J. McGeer. 2006. « Assessing the potential toxicity of thiosalts in the context of the Metal Mining Effluent Regulation ». Présentation faite au 33rd Aquatic Toxicity Workshop, Jasper (Alberta).
Shumway, R.H., R.S. Azari et M. Kayhanian. 2002. « Statistical approaches to estimating mean water quality concentrations with detection limits », Environmental Science & Technology, 36 (15) : 3345-3353.
Taylor, J.K. 1987. Quality Assurance of Chemical Measurements. Chelsea (MI), Lewis Publishers Inc.
U.S. EPA – United States Environmental Protection Agency. 1984. Definition and Procedure for the Determination of the Method Detection Limit - Revision 1.11; Appendix B to Part 136. Federal Register Vol. 49, No. 209, Oct. 26,1984, Part VI, 40 CFR Part 136.
U.S. EPA – United States Environmental Protection Agency. 1990. Proposed Glossary of Quality Assurance Related Terms. QAMS RD-680. Rapport préliminaire.
U.S. EPA – United States Environmental Protection Agency. 2007. Aquatic Life Ambient Freshwater Quality Criteria--Copper 2007 Revision. EPA-822-F-07-001.
Vigneault, B., J. Holdner et J. Bélanger. 2002. Validation of an Anion Exchange Method for the Preservation and Analysis of Thiosalt Speciation in Mining Waste Waters. ; Ottawa (Ontario), Laboratoires des mines et des sciences minérales CANMET. Projet LMSM no 602507.
Annexe 1 : Justifications du choix des paramètres à mesurer aux fins de la caractérisation de l'effluent et du suivi de la qualité de l'eau
Arsenic
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que l'arsenic soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation de l'effluent.
- L'arsenic peut être présent dans les effluents de plusieurs types de mines, notamment les mines d'or, de métaux communs et d'uranium, et ce, dans tout le Canada.
- Selon le document préparatoire de la SMID1 (MEEO, 1993), 26 % des effluents de mines de métaux échantillonnés contenaient de l'arsenic à une concentration moyenne de 0,036 mg/L.
- L'arsenic est bioaccumulable chez le poisson et est reconnu comme toxique pour les organismes aquatiques.
- Selon les Recommandations canadiennes pour la qualité de l'environnement (RCQE)2, la concentration maximale d'arsenic pour la protection des organismes dulcicoles est de 0,005 mg/L (0,0125 mg/L pour les organismes marins).
Cuivre
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le cuivre soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le cuivre peut être présent dans les effluents de plusieurs types de mines, en particulier les mines d'or et de métaux communs, et ce, dans tout le Canada.
- Le document préparatoire de la SMID (MEEO, 1993), révèle que 39 effluents échantillonnés sur une période de 12 mois en Ontario renfermaient du cuivre à une concentration moyenne de 0,07 mg/L.
- Le cuivre est reconnu comme toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de cuivre pour la protection des organismes dulcicoles varie de 0,002 à 0,004 mg/L, selon la dureté de l'eau.
Plomb
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le plomb soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le plomb peut être présent dans les effluents de plusieurs types de mines, en particulier les mines de métaux communs, et ce, dans tout le Canada.
- Selon le document préparatoire de la SMID (MEEO, 1993), 20 % des effluents de mines de métaux échantillonnés contenaient du plomb à une concentration moyenne de 0,02 mg/L.
- Le plomb est reconnu comme toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de plomb pour la protection des organismes dulcicoles varie de 0,001 à 0,007 mg/L, selon la dureté de l'eau.
Nickel
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le nickel soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le nickel peut être présent dans les effluents d'un large éventail de types de mines, en particulier les mines de métaux communs et d'uranium, et ce, dans toutes les régions du Canada.
- Selon le document préparatoire de la SMID (MEEO, 1993), 68 % des effluents de mines de métaux échantillonnés renfermaient du nickel, dont la concentration moyenne était de 0,14 mg/L.
- Le nickel est reconnu comme toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de nickel pour la protection des organismes dulcicoles doit se situer entre 0,025 et 0,150 mg/L, selon la dureté de l'eau.
pH
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le pH soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Les effluents rejetés par un grand nombre de mines de différents types peuvent présenter un pH trop élevé ou trop faible, et ce, dans l'ensemble du Canada.
- Comme le pH détermine souvent la solubilité des espèces métalliques, il est lié à la toxicité des effluents.
- Les eaux dont le pH est excessivement élevé ou excessivement faible sont reconnues comme toxiques pour les organismes aquatiques.
- Selon les RCQE, l'intervalle de pH pour la protection des organismes dulcicoles oscille entre 6,5 et 9,0 (7,0 à 8,7 en milieu marin ou estuarien).
Radium 226
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le radium 226 soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le radium 226 est présent principalement dans les effluents des mines d'uranium. Par conséquent, il ne se retrouve pas partout au Canada.
- Les RCQE,ne font pas mention du radium 226.
Cyanures totaux
- Le cyanure est utilisé comme réactif dans la plupart des mines d'or et dans certaines mines de métaux communs.
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que les exploitations qui se servent de cyanure comme réactif incluent le cyanure dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Selon le document préparatoire de la SMID (MEEO, 1993), 54 % des effluents de mines de métaux échantillonnés contenaient du cyanure à une concentration moyenne de 0,084 mg/L (mines d'or) ou de 0,006 mg/L (mines de métaux communs).
- Le cyanure est reconnu comme toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de cyanures libres pour la protection des organismes dulcicoles est de 0,005 mg/L.
Matières totales en suspension
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que les matières totales en suspension soient inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Des matières en suspension peuvent être présentes dans les effluents de tous les types de mine, et ce, partout au Canada;
- Selon le document préparatoire de la SMID (MEEO, 1993), 80 % des effluents de mines de métaux échantillonnés contenaient des matières en suspension à une concentration moyenne de 7 mg/L.
- Les matières en suspension peuvent non seulement tuer directement les poissons en obstruant leurs branchies, mais aussi altérer l'habitat du poisson en étouffant ces habitats, en contaminant les sédiments ou en entravant la pénétration de la lumière dans les eaux réceptrices.
Zinc
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le zinc soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le zinc peut être présent dans les effluents d'un large éventail de types de mines, en particulier les mines de métaux communs, et il est vraisemblablement répandu dans tout le Canada.
- Selon le document préparatoire de la SMID (MEEO, 1993), 76 % des effluents des mines de métaux échantillonnés contenaient du zinc à la concentration moyenne de 0,07 mg/L.
- Le zinc est reconnu comme toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de zinc pour la protection des organismes dulcicoles est de 0,030 mg/L.
Alcalinité
- L'alcalinité renseigne sur la capacité tampon de l'eau et donne une indication de la sensibilité de l'eau aux variations du pH.
- L'alcalinité influe sur le devenir et la biodisponibilité des métaux.
Aluminium
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que l'aluminium soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- L'aluminium est présent dans un certain nombre d'importants minéraux lithogénétiques; les effluents des bassins de décantation et de stockage des résidus de différents types de mines peuvent également contenir des ions d'aluminium dissous ainsi que de l'aluminium lié chimiquement sous forme d'argile ou d'autres particules minérales silico‑alumineuses.
- Selon le document préparatoire de la SMID (MEEO, 1993), 70 % des effluents des mines de métaux échantillonnés en Ontario contenaient de l'aluminium à une concentration moyenne de 0,20 mg/L.
- Ce document indiquait également que l'aluminium dissous n'est pas une composante importante de la plupart des effluents de mines de métaux.
- Selon les RCQE, la concentration maximale d'aluminium pour la protection des organismes dulcicoles varie de 0,005 à 0,100 mg/L, selon la dureté de l'eau.
- L'aluminium est reconnu comme toxique pour les organismes aquatiques, et sa toxicité varie en fonction du pH de l'eau.
- Les données sur l'aluminium peuvent aider à interpréter les impacts potentiels des métaux et d'autres paramètres.
Cadmium
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le cadmium soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le cadmium est présent dans relativement peu de types de minerai, par contre il est probable qu'il soit présent dans les effluents miniers à l'échelle du Canada.
- Selon le document préparatoire de la SMID (MEEO, 1993), 12 % des effluents de mines de métaux échantillonnés contenaient du cadmium à une concentration moyenne de 0,003 mg/L.
- Le cadmium est reconnu comme toxique pour les organismes aquatiques et comme bioaccumulable.
- Selon les RCQE, la concentration maximale de cadmium pour la protection des organismes dulcicoles est de 0,000017 mg/L. Veuillez noter que la formule permettant d'ajuster la recommandation en fonction de la dureté de l'eau est comme suit : recommandation pour le cadmium = 10{0,86[log(dureté)]-3,2} (0,12 µg/L en milieu marin)
Fer
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le fer soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le fer est présent dans pratiquement tous les types de minerais et se rencontre dans les secteurs miniers à l'échelle du Canada.
- Selon le document préparatoire de la SMID (MEEO, 1993), 100 % des effluents de mines de métaux échantillonnés renfermaient du fer à une concentration moyenne de 0,45 mg/L.
- Le fer est toxique pour les organismes aquatiques, et les précipités d'hydroxyde de fer peuvent avoir des effets nocifs sur l'habitat du poisson.
- Selon les RCQE, la concentration maximale de fer pour la protection des organismes dulcicoles est de 0,30 mg/L.
- Le fer peut également avoir une incidence déterminante sur le devenir d'autres contaminants.
- Les données sur le fer peuvent aider à l'interprétation des impacts potentiels des métaux ou d'autres paramètres.
Composés azotés (ammoniac et nitrates)
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que l'ammoniac total soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Les explosifs utilisés dans la plupart des mines contiennent des composés azotés, et des résidus de ces explosifs peuvent se retrouver dans les effluents. La dégradation du cyanure peut également entraîner la formation de composés azotés dans les effluents.
- Pendant l'élaboration de la SMID, en Ontario, les concentrations d'ammoniac et d'ammonium, d'azote total Kjeldahl et de nitrates et nitrites ont été mesurées dans des effluents.
- 100 % des effluents de mines de métaux échantillonnés (50) contenaient de l'ammoniac + ammonium aux concentrations moyennes de 1,4 mg/L (mines de métaux communs) et de 6,3 mg/L (mines d'or).
- 96 % des effluents de mines de métaux échantillonnés contenaient de l'azote total Kjeldahl à une concentration moyenne de 8 mg/L.
- 90 % des effluents de mines de métaux échantillonnés contenaient des nitrates et nitrites à une concentration moyenne de 8,8 mg/L.
- Les composés azotés peuvent être toxiques pour les organismes aquatiques. En outre, comme ils sont des éléments nutritifs, ils peuvent stimuler de façon excessive la croissance des végétaux. Une telle croissance peut entraîner un appauvrissement en oxygène suffisamment important pour causer la mort des poissons.
- Selon les RCQE, la concentration d'ammoniac total maximale pour la protection des organismes dulcicoles varie de 1,370 à 2,200 mg/L, selon la température et le pH de l'eau.
- La valeur provisoire proposée au titre de ces mêmes recommandations pour la concentration des nitrates est de 13 mg/L en eau douce (16 mg/L en milieu marin).
- Selon ces mêmes recommandations, la concentration maximale de nitrites pour la protection des organismes dulcicoles est de 0,060 mg/L.
Mercure
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le mercure soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le mercure est présent dans différents types de roche. Il se rencontre dans les mines d'or et d'argent et, moins fréquemment, dans les mines de métaux communs, et ce, partout au Canada.
- Le mercure provient de diverses sources, notamment de sources éloignées d'où il est transporté par voie atmosphérique, ainsi que de sources naturelles et d'effluents miniers. Par conséquent, les groupes de travail d'AQUAMIN estiment qu'il est souvent difficile de déterminer la source d'une contamination par le mercure dans un milieu aquatique. C'est sur cette base qu'ils ont recommandé que le mercure soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le document préparatoire de la SMID (MEEO, 1993) indique que 14 % des effluents de mines de métaux échantillonnés contenaient du mercure à une concentration moyenne de 0,0002 mg/L.
- Le mercure est toxique pour les organismes aquatiques, et sa bioamplification à travers les chaînes alimentaires représente un problème important.
- Selon les RCQE, la concentration maximale de mercure pour la protection des organismes dulcicoles est de 0,026 μg/L pour le mercure inorganique et de 0,004 μg/L pour le méthylmercure; elle est de 0,016 μg/L pour le mercure inorganique en milieu marin.
Molybdène
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le molybdène soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Ce métal se rencontre principalement dans les minerais d'uranium, mais aussi dans les minerais de métaux communs et dans un petit nombre de minerais d'or; il n'est cependant pas répandu à l'échelle du Canada.
- Le molybdène peut être toxique pour les organismes aquatiques, mais sa toxicité est mal connue.
- Il peut également réduire la qualité de l'eau potable et causer la molybdénose chez les bovins d'élevage.
- Selon les RCQE, la concentration maximale de molybdène pour la protection des organismes dulcicoles est de 0,073 mg/L.
Dureté
- La dureté correspond à la quantité de cations, principalement bivalents, dissous dans l'eau.
- Le calcium et le magnésium étant les principaux facteurs responsables de la dureté de l'eau, les concentrations de ces ions peuvent servir de base au calcul de ce paramètre.
- La dureté a une incidence déterminante sur le devenir, la biodisponibilité et la toxicité des métaux.
Sélénium
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont jugé de ne pas inclure le sélénium dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Selon le document préparatoire de la SMID (MEEO, 1993), 10 % des effluents de mines de métaux échantillonnés contenaient du sélénium à une concentration moyenne de 0,007 mg/L.
- Le sélénium se rencontre le plus souvent en association avec le soufre, mais il est rarement présent dans les effluents miniers.
- Le sélénium est toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de sélénium pour la protection des organismes dulcicoles est de 0,001 mg/L.
Conduc-
tivité électrique
- La conductivité est une mesure de la capacité de l'eau à conduire un courant électrique.
- La conductivité peut être mesurée sur le terrain ou en laboratoire.
- La conductivité fournit une mesure approximative des matières totales en suspension et peut faciliter la localisation des panaches de l'effluent en eau douce.
Oxygène dissous
- La teneur en oxygène dissous peut être mesurée sur le terrain ou en laboratoire.
- La teneur en oxygène dissous influe sur le devenir et la biodisponibilité des métaux.
Température
- Les variations de température peuvent modifier les propriétés limnologiques des lacs et avoir des effets néfastes pour les organismes aquatiques.
- Selon les RCQE, pour la protection des organismes d'eau douce, les hausses de température ne devraient pas altérer la stratification thermique ou les dates de renversement des eaux ni entraîner un dépassement des températures hebdomadaires maximales moyennes et des températures maximales sur de courtes périodes.
Calcium
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le calcium soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le calcium est un important cation présent dans les écosystèmes aquatiques, et il peut également être présent dans les effluents miniers en cas d'utilisation de chaux pour la neutralisation d'acides.
- Le calcium rejeté par les mines peut avoir des effets sur l'habitat du poisson.
- La connaissance des concentrations de calcium est essentielle pour le calcul de la dureté de l'eau.
- Le calcium influe sur la toxicité des métaux et/ou d'autres paramètres des effluents miniers.
- Les données sur le calcium peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
Chlorures
- Selon le document préparatoire de la SMID (MEEO, 1993), 80 % des effluents de mines de métaux échantillonnés contenaient des chlorures à une concentration moyenne de 83 mg/L.
- Les chlorures peuvent influer sur la toxicité des métaux et/ou d'autres paramètres des effluents miniers.
- Les données sur les chlorures peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
Fluorures
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que les fluorures soient inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents dans le cas des exploitations où leur présence est probable.
- Les fluorures sont présents dans un nombre limité de types de minerai, et ils ne sont vraisemblablement pas présents partout au Canada.
- Il se bioaccumulent dans les squelettes des poissons, mais leurs effets sur les organismes aquatiques demeurent méconnus.
- Les fluorures ont des effets létaux sur les poissons à des concentrations de 10 à 200 mg/L.
- Les fluorures ont été déclarés toxiques à la suite d'une évaluation des substances contenues dans la première liste des substances d'intérêt prioritaire, du fait qu'ils peuvent avoir, immédiatement ou à long terme, un effet nocif sur l'environnement.
Magnésium
- Le magnésium est un important cation dans les écosystèmes aquatiques; la connaissance des concentrations de magnésium est essentielle pour le calcul de la dureté de l'eau.
- Le magnésium influe sur la toxicité des métaux et/ou d'autres paramètres des effluents miniers.
- Les données sur le magnésium peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
Manganèse
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont jugé de ne pas inclure le manganèse dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le manganèse est présent dans de nombreux types de minerai, et ce, dans toutes les régions du Canada, étant donné que ce métal constitue 0,1 % de la croûte terrestre.
- Les RCQE concernant la protection des organismes dulcicoles ne font pas mention du manganèse.
- Le manganèse peut exercer une grande influence sur le devenir d'autres contaminants, spécialement sur la disponibilité d'autres métaux.
- Ce métal est toxique pour les organismes aquatiques, mais les facteurs qui déterminent sa toxicité demeurent méconnus.
Potassium
- Le potassium influe sur la toxicité des métaux et/ou d'autres paramètres des effluents miniers.
- Les données sur le potassium peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
Sodium
- Le sodium influe sur la toxicité des métaux et/ou d'autres paramètres des effluents miniers.
- Les données sur le sodium peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
Sulfates
- Les sulfates sont des anions importants dans l'eau.
- Les effluents des mines contenant du minerai sulfuré peuvent être d'importantes sources de sulfates.
- Les données sur les sulfates peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
- Selon le document préparatoire de la SMID, 86 % des effluents de mines de métaux échantillonnés contenaient des sulfates à une concentration moyenne de 644 mg/L.
Phosphore total
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) n'ont pas inclus le phosphore total dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Selon le document préparatoire de la SMID (MEEO, 1993), 24 % des effluents de mines de métaux échantillonnés contenaient du phosphore total à une concentration moyenne de 0,1 mg/L.
- Le phosphore total se rencontre dans les effluents miniers à l'état dissous ou particulaire.
- Le phosphore total étant un élément nutritif, il peut stimuler la croissance des végétaux de façon excessive.
Uranium
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) n'ont pas inclus l'uranium dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- L'uranium est présent en petite quantité dans de nombreux types de roches au Canada, mais il se rencontre essentiellement dans les effluents des mines d'uranium.
- Selon le document préparatoire de la SMID (MEEO, 1993), 22 % des effluents de mines de métaux échantillonnés renfermaient de l'uranium à une concentration moyenne de 0,06 mg/L.
- Il a été démontré que l'uranium est bioaccumulable chez les poissons.
Thiosels totaux
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que les thiosels totaux soient inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents (les thiosels totaux sont mentionnés au tableau 4.1 du rapport d'AQUAMIN, mais de manière non explicite dans le texte du rapport) et que leur impact fasse l'objet d'un suivi dans le cadre de l'ESEE.
- Les thiosels constituent un groupe d'anions oxysulfurés métastables formés par oxydation partielle des minéraux sulfurés pendant le traitement.
- Les thiosels sont relativement peu toxiques, mais leur oxydation dans les milieux aquatiques peut abaisser fortement le pH de l'eau.
- Les thiosels ont été associés à la diminution de populations de poissons et d'organismes benthiques.
- Des thiosels peuvent se former dans les exploitations minières qui ont recours à la flottation pour la séparation des minéraux sulfurés, mais seulement quelques mines au Canada ont signalé des problèmes causés par les thiosels.
Carbone organique dissous et carbone organique total
- Les teneurs en carbone organique dissous et en carbone organique total ont une incidence déterminante sur le devenir et la biodisponibilité des métaux.
Salinité
- La salinité est un important paramètre dans les milieux marins et peut être une source de contamination dans certaines mines d'uranium.
Profondeur optique ou transparence
- Mesurée sur le terrain, la profondeur optique est une mesure du degré de pénétration de la lumière dans l'eau et dépend de la couleur (matières dissoutes) et de la turbidité (matières en suspension) de l'eau.
- La profondeur optique se mesure à l'aide d'un disque de Secchi ou d'un turbidimètre.
- Un faible degré de pénétration de la lumière peut réduire la productivité primaire dans l'eau et la capacité des prédateurs à trouver des proies.
Profondeur de l'eau
- La profondeur peut agir sur la température et la teneur en oxygène dissous de l'eau et sur le degré de dilution des effluents, autant de paramètres qui influent sur la toxicité des effluents.
Thallium
- Les mines de métaux peuvent être une source de thallium dans les environnements aquatiques.
- La recommandation du CCME pour la qualité de l'eau pour la protection de la vie aquatique est de 0,0008 mg/L.
1 Dans le document préparatoire de la Stratégie municipale et industrielle de dépollution (SMID) du MEEO (1993), cité tout au long de cette annexe, sont résumés les résultats de travaux poussés de caractérisation d'effluents de mines de toutes les régions de l'Ontario, effectués au début des années 1990. Ces résultats ne sont pas représentatifs du niveau de qualité actuel des effluents miniers à l'échelle du Canada.
2 Les Recommandations canadiennes pour la qualité de l'environnement (RCQE) sont citées tout au long de cette annexe dans le but de fournir une évaluation préliminaire des concentrations dans les effluents quant à leur importance sur le plan écologique et à leurs effets potentiels sur les milieux récepteurs (CCME, 1999) en ligne à http://ceqg-rcqe.ccme.ca/?lang=fr.
Tableaux
Le tableau 5-1 présente les paramètres mesurés pour la caractérisation de l’effluent et le suivi de la qualité de l’eau. Les paramètres de la qualité de l’effluent sont associés aux paramètres de la qualité de l’eau et aux paramètres particuliers du site.
Le tableau 5-2 présente un sommaire des utilisations recommandées des blancs et des duplicata sur le terrain et en laboratoire. Le nombre d’échantillons, le type de contrôle de la qualité (interne ou sur le terrain), les limites de contrôle, ainsi qu’une description sont indiqués pour chaque paramètre.
Le tableau de l’annexe 1 du chapitre 5 décrit les justifications du choix des paramètres à mesurer aux fins de la caractérisation de l’effluent et du suivi de la qualité de l’eau. Les différentes sections comprennent les substances nocives et le pH selon l’annexe 3 du REMM, les paramètres inscrits à l’annexe 5 du REMM aux fins de la caractérisation des effluents et du suivi de la qualité de l’eau, les paramètres prescrits aux fins du suivi de la qualité de l’eau seulement, les autres paramètres propres au site dont la mesure est recommandée aux fins de la caractérisation des effluents et du suivi de la qualité de l’eau, les paramètres dont la mesure est recommandée aux fins de la caractérisation des effluents seulement et les paramètres propres au site dont la mesure est recommandée aux fins du suivi de la qualité de l’eau seulement.
Retournez à la table des matières
Chapitre 6
6. Essais de toxicité sublétale
6.2 Prélèvement des échantillons
6.3 Emplacement de l’échantillonnage
6.4 Fréquence des essais et production de rapports
6.5 Compilation des critères de toxicité sublétale et validation des résultats des essais
6.6 Interprétation des données par rapport aux objectifs de l’essai de toxicité
- 6.6.1 Changements dans la qualité de l’effluent
- 6.6.2 Interprétation en présence de rejets multiples
- 6.6.3 Contribution à l’approche fondée sur le poids de la preuve
- 6.6.4 Considérations pour l’intégration des résultats des essais de toxicité
6.7 Description des essais de toxicité sublétale en eau douce et en eau salée
6.8 Eau de dilution dans les essais de toxicité sublétale en milieu d’eau douce
- 6.9.1 Acclimatement des organismes d’essai
- 6.9.2 Essais préliminaires
- 6.9.3 Essais de toxicité de l’effluent ou de l’eau de surface exposée à l’effluent
Liste des tableaux
- Tableau 6-1 : Méthodes prescrites pour les essais de toxicité sublétale des effluents
- Tableau 6-2 : Descriptions des essais de toxicité sublétale en eau douce et en eau salée dans le cadre du Programme d’ESEE pour les mines de métaux
- Tableau 6-3 : Spécifications des méthodes d’essai recommandées par Environnement Canada et recommandations pour le prélèvement, l’entreposage et l’utilisation de l’eau de dilution prélevée sur le site
- Tableau 6-4 : Volumes d’eau de dilution/d’eau témoin et volumes de l’effluent correspondant pour les essais de toxicité sublétale
- Tableau 6-5 : Préparation de divers degrés de dureté et d’alcalinité
6. Essais de toxicité sublétale
6.1 Aperçu
Les essais de toxicité sublétale effectués dans le cadre du Programme d’études de suivi des effets sur l’environnement (ESEE) ont principalement deux fonctions : comparer les procédés et mesurer les changements dans la qualité de l’effluent, et aider à mieux comprendre la contribution relative de la mine en présence de rejets multiples.
Les essais de toxicité sublétale effectués dans le cadre du Programme d’ESEE pour les mines de métaux visent à obtenir une estimation des effets potentiels de leurs effluents sur les composantes biologiques (phytoplancton, zooplancton, invertébrés benthiques, poissons, macrophytes) dans la zone exposée, que ces composantes soient ou non mesurées directement sur le terrain.
Afin d’estimer les effets potentiels des effluents sur les composantes biologiques, des essais de toxicité sublétale doivent être menés en conformité avec les méthodes applicables prévues aux paragraphes (3) et (4) de l’article 5 de l’annexe 5 du Règlement sur les effluents des mines de métaux (REMM) (et avec les modifications successives de ces méthodes). Il faut procéder à quatre essais de toxicité sublétale sur des organismes dulcicoles (espèces de poissons, d’invertébrés, d’algues et de plantes) ou trois essais de toxicité sublétale sur des organismes marins ou estuariens (espèces de poissons, d’invertébrés et d’algues), selon le type de milieu récepteur étudié (article 5 de l’annexe 5 du REMM), et les résultats de ces essais doivent être consignés. Le choix de l’essai devrait tenir compte en premier lieu de la pertinence des espèces utilisées pour le milieu récepteur local et, en second lieu, de la disponibilité saisonnière des organismes d’essai.
La liste des méthodes recommandées pour les essais de toxicité sublétale figure au tableau 6-1. Le site Web suivant présente toutes les publications de la Section des méthodes biologiques d’Environnement Canada sur les méthodes d’essai biologique : http://www.ec.gc.ca/faunescience-wildlifescience/default.asp?lang=Fr&n=0BB80E7B-1. En ce qui concerne l’évaluation de la validité des résultats, des listes de vérification ont été établies pour chacun des essais et leurs options et figurent sur le site Web des ESEE (http://www.ec.gc.ca/esee-eem/default.asp?lang=Fr&n=D450E00E-1). L’information sur la sensibilité relative des différents essais de toxicité sublétale est présentée dans ESG (1999).
Pour en savoir plus sur l’interprétation des résultats des essais de toxicité sublétale pour suivre l’évolution de la qualité d’un effluent ou pour tout autre usage, veuillez consulter les sections 6.6 et 6.10.
| Description de l’essai | Milieu récepteur | Espèces utilisées pour les essais | Méthodes |
|---|---|---|---|
| Essai sur des poissons aux premiers stades de leur cycle biologique | Eau de mer | Capucettes (Menidia beryllina ou Atherinops affinis) | U.S. EPA (2002) |
| Eau douce | Méné à grosse tête (Pimephales promelas)1 ou Truite arc-en-ciel (Oncorhynchus mykiss) | Environnement Canada (1992a) ou Environnement Canada (1998) | |
| Essai sur la reproduction des invertébrés | Eau de mer | Échinides (oursins verts ou oursins plats) | Environnement Canada (1992b) |
| Eau douce | Puces d’eau (Ceriodaphnia dubia) | Environnement Canada (2007a) | |
| Essai de toxicité sur des plantes et des algues | Eau de mer – algue | Algue rouge(Champia parvula) | U.S. EPA (2002) |
| Eau douce – algue | Algue verte (Pseudokirchneriella subcapitata) | Environnement Canada (2007b) ou MDDEP (2007)2 | |
| Eau douce – plante | Lenticule mineure ou lentille d’eau (Lemna minor) | Environnement Canada (2007c) |
1. Aux endroits où le Méné à grosse tête n’est pas une espèce indigène, Environnement Canada (1998) recommande d’utiliser la Truite arc-en-ciel.
2. Pour les essais sur Pseudokirchneriella subcapitata dans le cadre du Programme d’ESEE, certaines provinces et certains territoires jugent acceptables tant les exigences d’Environnement Canada (2007b) que celles du MDDEP (2007).
Remarque – Pour tous les essais de toxicité en milieu marin, il est recommandé de se conformer à la méthode proposée par Environnement Canada (2001) pour ajuster la salinité de l’échantillon d’effluent. Pour tous les essais de toxicité sublétale utilisant des organismes achetés à cette fin, il est recommandé de respecter les exigences d’Environnement Canada (1999) relatives à l’importation des organismes d’essai.
6.2 Prélèvement des échantillons
Les essais de toxicité sublétale doivent être effectués sur une portion aliquote d’échantillons d’effluent prélevés conformément au paragraphe 4(2) de l’annexe 5 du REMM (caractérisation de l’effluent) (paragraphe 5(2) de l’annexe 5 du REMM).
Lors de la sélection de la période d’échantillonnage aux fins des essais de toxicité, les deux aspects suivants doivent être pris en compte :
- la période où l’effluent a le plus grand risque de répercussions néfastes sur l’environnement;
- le moment où le suivi biologique est réalisé afin de pouvoir établir des liens avec les effets observés dans la zone exposée.
6.3 Emplacement de l’échantillonnage
Afin de déterminer lequel parmi les émissaires d’effluent est susceptible d’avoir le plus d’effets néfastes sur l’environnement, il convient de tenir compte de ce qui suit :
- des charges mensuelles de substances nocives;
- de la façon dont l’effluent se mélange dans la zone exposée;
- des données historiques de caractérisation ou de toxicité sublétale.
Dans le cas où il est difficile de savoir quelle source de rejet risque le plus d’avoir des effets néfastes sur l’environnement, la mine peut choisir d’effectuer des essais de toxicité sublétale à l’aide d’une concentration unique à partir de chaque point de rejet final pour déterminer quelle source engendre les réactions sublétales les plus intenses.
Pour estimer l’intensité de la réaction engendrée par chaque source de rejet, il est possible d’observer et de noter le temps écoulé avant que la réaction se produise (p. ex., après avoir exposé des Ceriodaphnia dubia adultes à des échantillons d’effluent non dilués provenant de chaque source, le temps écoulé avant d’obtenir une mortalité de 25 % ou de 50 % des sujets exposés est noté). Si l’objectif premier est d’observer la survie, le TL25 ou le TL50 (temps écoulé entre l’exposition initiale et la mort de 25 % ou de 50 % des sujets exposés) est le critère ciblé. En pareilles circonstances, la réalisation d’essais utilisant une concentration unique constitue une approche rentable pour déterminer quelle source de rejet risque le plus d’avoir des effets néfastes sur le milieu récepteur.
6.4 Fréquence des essais et production de rapports
Les essais de toxicité sublétale sont effectués deux fois par année civile pendant les trois premières années et, par la suite, une fois par année (paragraphe 6(2) de l’annexe 5 du REMM). Le premier essai doit être exécuté sur un échantillon d’effluent prélevé au plus tard six mois suivant la date à laquelle la mine devient assujettie à l’article 7 du REMM (paragraphe 6(1) de l’annexe 5).
Les résultats des essais de toxicité sublétale sont présentés à l’agent d’autorisation dans un rapport sur les études de suivi de l’effluent et de la qualité de l’eau. Le chapitre 5 comporte de plus amples informations sur le contenu du rapport sur les études de suivi de l’effluent et de la qualité de l’eau. Les exigences en lien avec la présentation des résultats des essais de toxicité sublétale sont décrites dans le REMM (à l’article 23, ainsi qu’à l’article 8 de l’annexe 5). Veuillez consulter le chapitre 10 pour en savoir plus sur la présentation électronique des données de toxicité sublétale.
Il est possible de consulter les méthodes d’essai mentionnées dans le tableau 6-1 pour connaître les exigences sur les rapports à présenter pour chaque méthode d’essai.
Le rapport doit comprendre ce qui suit :
- les dates de prélèvement des échantillons aux fins des essais de toxicité sublétale;
- l’emplacement du point de rejet final à partir duquel les échantillons ont été prélevés aux fins des essais de toxicité sublétale et les données sur la façon dont ce point a été choisi;
- les résultats des essais de toxicité sublétale, y compris la concentration létale médiane (CL50), la concentration inhibitrice 25 % (CI251) et la concentration effective 25 % (CE25) (le cas échéant), les limites de confiance à 95 % et les statistiques quantitatives utilisées;
- une description des mesures d’assurance et de contrôle de la qualité (AQ/CQ) appliquées et les données sur la mise en œuvre de ces mesures;
- les données satisfaisant aux exigences minimales décrites dans les méthodes d’essai et les listes de contrôle de la toxicité sublétale.
Pour déterminer si elles peuvent utiliser ou non des données historiques de toxicité sublétale dans le cadre du Programme d’ESEE, les mines devraient tenir compte des aspects suivants :
- les mesures d’assurance de la qualité en laboratoire prévues dans les méthodes présentées au tableau 6-1;
- le nombre d’espèces étudiées (au moins trois espèces permettant de répondre à la question justifiant la conduite des essais);
- la date des données (essais réalisés après le 31 décembre 1997);
- la nature des conditions d’exploitation de la mine (p. ex., les conditions d’exploitation sont-elles demeurées inchangées depuis que les essais de toxicité sublétale ont été réalisés?);
- la question à savoir si l’un des essais de toxicité sublétale a été réalisé sur un échantillon d’effluent en même temps qu’était effectué un suivi des poissons et des invertébrés benthiques sur le terrain.
Les données sur la toxicité fournies dans le cadre du Programme d’ESEE visant l’industrie des mines de métaux doivent être accompagnées d’une description du matériel, des méthodes et des calculs utilisés pour chaque essai. Les exigences minimales sur la production de rapports sont énoncées en détail dans les sections 8 ou 9 des méthodes d’essai toxicologique publiées par Environnement Canada. En ce qui concerne l’évaluation de la validité des résultats des essais, des listes de vérification ont été établies pour chaque option d’essai. Ces listes peuvent être consultées sur le site Web des ESEE à l’adresse : http://www.ec.gc.ca/esee-eem/default.asp?lang=Fr&n=D450E00E-1. Les exigences minimales en matière de rapports liées aux méthodes de l’U.S. Environmental Protection Agency (U.S. EPA, 2002) ont été adoptées aux fins des phases ultérieures des ESEE. En général, ces exigences concordent avec celles d’Environnement Canada.
6.5 Compilation des critères de toxicité sublétale et validation des résultats des essais
Les critères de toxicité sublétale rapportés varient selon l’essai effectué (voir les méthodes d’essai dans le tableau 6-1), mais, pour illustrer notre propos, nous traiterons ici de la CI25. La moyenne géométrique2 de la CI25 (MG-CI25) pour une espèce donnée doit être calculée pour chaque phase.
6.5.1 Validation des résultats des essais
Les équipes chargées de prélever les échantillons sur le terrain et celles chargées d’effectuer les essais de toxicité en laboratoire respecteront les procédures d’assurance de la qualité et du contrôle de la qualité (AQ/CQ) exposées dans les documents décrivant les méthodes d’essai de toxicité prescrites.
Par conséquent, une première étape dans l’interprétation des données sur la toxicité dans une ESEE devrait consister à résoudre les problèmes liés à l’AQ/CQ. Les exigences et les recommandations supplémentaires décrites ci-dessous s’ajoutent aux mécanismes d’assurance de la qualité présentés dans chacune des méthodes d’essai de toxicité sublétale :
- les essais utilisant une substance toxique de référence doivent être menés de la même manière que ceux menés sur l’effluent ou sur l’eau de surface exposée à l’effluent;
- un essai utilisant une substance toxique de référence doit avoir été réalisé dans les 30 jours entourant l’essai sur l’effluent ou sur l’eau de surface exposée à l’effluent;
- tous les essais de toxicité sublétale sur les effluents doivent satisfaire aux critères de validité propres à l’essai;
- les essais de toxicité sublétale doivent être entrepris dans les trois jours suivant le prélèvement des échantillons;
- des critères de toxicité sublétale quantitatifs doivent être fournis pour tous les essais de toxicité sublétale des échantillons d’effluent ou d’eau exposée à l’effluent;
- les critères de toxicité sublétale compris entre 0,1 % et 100 % doivent se situer dans l’intervalle d’au moins une concentration d’essai;
- lorsque les essais de toxicité sublétale ne respectent pas les critères de validité des méthodes d’essai, ils seront répétés en utilisant un nouvel échantillon;
- la présentation de valeurs « inférieures à » un seuil donné en tant que critère de toxicité sublétale n’est plus acceptée.
Les données pourraient être rejetées si une ou plusieurs des conditions essentielles de la méthode d’essai ne sont pas respectées (p. ex., non-respect des critères de santé des organismes, manipulations inappropriées de l’échantillon, absence d’un suivi minimal en cours d’essai, emploi de statistiques incorrectes pour le calcul des critères de toxicité sublétale).
Les laboratoires dont les mines de métaux retiennent les services pour l’exécution des essais de toxicité sublétale devraient être accrédités selon la norme ISO/CEI 17025:2005 de l’Organisation internationale de normalisation intitulée Exigences générales concernant la compétence des laboratoires d’étalonnages et d’essais, avec ses modifications successives.
6.5.2 Compilation des critères de toxicité sublétale
Si l’effluent ne cause pas une inhibition sublétale ou un effet à 25 % lors des essais de toxicité sublétale en eau douce, alors la CI25 et la CE25 ne peuvent pas être calculées. Le résultat est rapporté sous la forme > 100 %.
À certaines concentrations, la mortalité peut aussi empêcher le calcul de la CI25 et de la CE25. Par exemple, il pourrait ne pas y avoir d’effets mesurés (mortalité, croissance ou reproduction) pour une concentration de 32 %, mais une mortalité appréciable à 56 %. Il serait alors impossible d’obtenir une bonne estimation de l’inhibition de la croissance ou de la reproduction pour une concentration de 56 %, et il serait, par conséquent, impossible de déterminer la CI25 et la CE25. Dans un tel cas, il faut supposer que la CI25 et la CE25 sont égales à la plus grande concentration, soit 56 % dans le cas présent.
Il devrait y avoir des CI25 pour chacune des espèces soumises à l’essai. L’information se résume en calculant la moyenne géométrique pour chaque groupe de valeurs de CI25. Ainsi, l’essai avec l’effluent d’une mine en six occasions produisant des valeurs de CI25 mesurées de 10 %, 15 %, 17 %, 23 %, 25 % et 30 % donnerait une moyenne géométrique de 19 %.
6.6 Interprétation des données par rapport aux objectifs de l’essai de toxicité
6.6.1 Changements dans la qualité de l’effluent
La moyenne géométrique de la CI25 (MG-CI25) peut être comparée pour chaque espèce d’une phase à l’autre afin de déterminer l’évolution de la qualité de l’effluent dans le temps à chaque mine, d’une mine à l’autre ou selon le type de mine. Les modifications apportées aux procédés ou au traitement des effluents devraient entraîner des améliorations.
6.6.2 Interprétation en présence de rejets multiples
La comparaison des données sur la toxicité de l’effluent d’une mine avec celles d’autres établissements industriels ou municipaux voisins peut aider à comprendre la contribution relative de chaque effluent à l’impact potentiel sur l’environnement. Lorsqu’elles sont connues, les données pertinentes sur la toxicité, le débit et la dispersion des autres effluents permettent de mieux comprendre le chevauchement des divers panaches ou les relations entre ceux-ci. Une autre méthode de comparaison de la charge relative (contribution à la toxicité) de chaque source en présence consiste à calculer le facteur de rejet toxique = [(100/MG-CI25) × débit]. Toutefois, ce calcul ne se rapporte pas au milieu récepteur, étant donné que la dispersion et la dilution de l’effluent ne sont pas prises en compte. Voir la section 6.10 pour plus de renseignements sur les facteurs de confusion.
6.6.3 Contribution à l’approche fondée sur le poids de la preuve
Lorsque les données de toxicité sublétale donnent une CI25 inférieure à 30 %, les mines sont encouragées à calculer la portée géographique de la réponse dans la zone exposée et à cibler la zone où la concentration d’effluent est comparable à la CI25. Pour ce faire, elles ont besoin des données sur l’effluent et le débit récepteur du mois correspondant. L’estimation de la portée géographique potentielle de la réponse peut être présentée sous la forme d’une carte et être indiquée dans le rapport d’interprétation.
Une zone d’effets potentiels peut donner une indication approximative de l’étendue de l’inhibition à 25 % reliée à l’effluent dans l’environnement. Si, par exemple, la MG-CI25 d’une mine s’élève à 1 % v/v selon un essai donné, ce résultat correspondrait à une étendue de 1 % de la zone. Les CI25 propres aux invertébrés et aux plantes ne seront sans doute pas les mêmes, étant donné que la sensibilité varie d’une espèce à l’autre et compte tenu des différents paramètres des méthodes d’essai de toxicité sublétale. Par conséquent, elles peuvent avoir différentes zones d’effets potentiels.
6.6.4 Considérations pour l’intégration des résultats des essais de toxicité
Il faut tenir compte des éléments suivants lorsqu’on se sert des données sur la toxicité pour estimer une zone d’effets potentiels.
1) Résultats des essais en laboratoire. Les essais de toxicité sublétale en laboratoire permettent d’estimer la toxicité pour chaque espèce étudiée dans des conditions étroitement contrôlées. Ces conditions ne reflètent pas les conditions environnementales observées au site à l’étude. Chapman (2000) décrit divers facteurs abiotiques et biotiques modificateurs qui sont présents dans le milieu récepteur non contrôlé et qui peuvent influer sur la réaction de l’organisme à une substance toxique en conditions naturelles.
2) Différences entre les espèces. Il importe de prendre en considération les différences dans la sensibilité des espèces à l’effluent des mines de métaux lorsque sont extrapolés les résultats des essais de toxicité sublétale en laboratoire aux effets sur le biote indigène.
3) Toxicité en amont de l’effluent. La description ci-dessus suppose que l’eau en amont de l’effluent ne contribue pas à la toxicité observée. Cette supposition serait erronée si des panaches se superposaient.
4) Types d’eaux réceptrices. Le pH, la dureté et le carbone organique dissous (COD) des eaux réceptrices et d’autres facteurs modifiant les conditions du milieu peuvent faire en sorte que la toxicité d’un effluent soit plus élevée ou plus faible que celle de l’eau de laboratoire.
5) Incertitudes liées au panache. Les calculs de dilution peuvent être difficiles à effectuer ou imprécis, et la position de la zone de mélange peut varier. En présence de telles incertitudes, l’estimation de l’étendue d’une zone d’effets potentiels comprend un degré d’incertitude équivalent.
6.7 Description des essais de toxicité sublétale en eau douce et en eau salée
Le tableau 6-2 présente une brève description des essais de toxicité sublétale en eau douce et en eau salée recommandés aux fins du Programme d’ESEE pour les mines de métaux. L’information sur la sensibilité relative des différents essais de toxicité sublétale est présentée dans ESG (1999).
Pour les essais en eau douce, l’eau du laboratoire ou du site peut servir de source d’eau de dilution et d’eau témoin. Pour les essais utilisant des organismes marins ou estuariens, la mine peut utiliser soit de l’eau de mer non polluée ou de l’eau de mer artificielle produite à partir de saumure hautement concentrée (SHC). Il est recommandé de suivre la procédure décrite dans Environnement Canada (2001) pour ajuster la salinité des échantillons d’effluents et de l’eau de dilution et pour préparer la saumure hautement concentrée.
Le cas échéant, il convient également de respecter les exigences sur l’importation des organismes d’essai (Environnement Canada, 1999) lorsque des organismes sont achetés en vue de les employer immédiatement dans des essais de toxicité sublétale.
Aux fins de l’AQ/CQ, le laboratoire doit valider et tenir des registres détaillés de tous les aspects concernant les échantillons, les organismes utilisés, l’entretien des cultures, les conditions dans lesquelles se sont déroulés les essais, le matériel et les résultats obtenus. La validité des données sur la toxicité des effluents est établie au moyen d’un essai faisant appel à un toxique de référence. Les données successives portant sur les toxiques de référence sont reportées sur une fiche de contrôle. Si les résultats sont compris à l’intérieur des limites prévues, le rendement du lot d’organismes utilisés aux fins des essais est validé. Les exigences minimales se rattachant à la présentation des résultats sont énoncées dans chacune des méthodes d’essai.
Le personnel technique affecté aux essais devrait posséder les compétences voulues pour pratiquer la culture ou l’élevage des algues, des macrophytes, des invertébrés et des poissons et pour réaliser des essais de toxicité en se conformant aux techniques d’aseptisation.
Pour des descriptions plus détaillées, veuillez consulter les documents correspondant à chaque méthode d’essai.
| Essai | Objectif et résultats | Description | Méthode d’essai biologique |
|---|---|---|---|
| Méthode d’essai biologique | Évaluer les effets de l’exposition à l’effluent sur des larves de poissons. Le résultat exprime la concentration à laquelle la croissance des larves est réduite de 25 % (CI25). Si la mortalité est importante, il est possible de calculer la concentration létale pour 50 % de la population étudiée (le résultat statistique est une CL50). | La capucette est un petit poisson qui occupe des habitats divers et tolère une vaste gamme de température (2,9 °C à 32,5 °C) et de salinité (0 à 58 g/kg). La capucette est une espèce à ponte multiple, et la ponte peut être induite par une interruption diurne de la circulation de l’eau dans les bassins de culture. Les œufs adhèrent à la végétation dans le milieu naturel ou à la soie des filtres dans les bassins de laboratoire. Le temps d’éclosion des œufs est de six à sept jours lorsqu’ils sont incubés à 25 °C et maintenus dans une eau de mer dont la salinité est de 5 à 30 g/kg. Des larves âgées de 7 à 11 jours sont exposées à au moins cinq concentrations de l’échantillon d’effluent et à une solution témoin pendant sept jours à 25 °C dans un système à renouvellement périodique. Pendant ces sept jours, les larves sont nourries d’artémias une ou deux fois par jour, et les solutions sont renouvelées quotidiennement. À la fin de la période d’exposition de sept jours, les larves survivantes sont dénombrées et pesées individuellement pour évaluer les changements de croissance, et des comparaisons statistiques sont effectuées entre les larves exposées à l’effluent et les larves témoins. Pour que l’essai soit valide, le poids sec moyen des larves témoins doit être ≥ 0,50 mg, et le taux de survie des larves témoins doit être ≥ 80 %. L’essai nécessite environ 40 litres d’effluent. | Short Term Methods for Estimating Chronic Toxicity of Effluent and Receiving Waters to Marine and Estuarine Organisms (troisième édition) (méthode de référence EPA-821-R-02-014), octobre 2002, publiée par l’U.S. EPA. Lorsque cette méthode est suivie, les exigences minimales se rattachant à la présentation de rapports énoncées dans les méthodes d’essai d’Environnement Canada doivent être respectées. |
| Essai de croissance et de survie sur des larves de capucettes barrées (Atherinops affinis) | Évaluer les effets de l’exposition à l’effluent sur des larves de poissons. Le résultat exprime la concentration à laquelle la croissance des larves est réduite de 25 % (CI25). Si la mortalité est importante, il est possible de calculer la concentration létale pour 50 % de la population étudiée (le résultat statistique est une CL50). | La capucette barrée est un petit poisson que l’on retrouve du golfe de Californie jusqu’à l’île de Vancouver. Elle se reproduit de mai à août, pondant ses œufs sur des algues benthiques dans le fond des estuaires et des baies. On a réussi à provoquer une fraie hors saison chez une population maintenue en laboratoire. Le déclenchement de la fraie est induit par une combinaison de trois stimuli environnementaux : éclairement, cycle des marées et température. Des larves âgées de 9 à 15 jours sont exposées à au moins cinq concentrations de l’échantillon d’effluent et à une solution témoin pendant sept jours à 20 °C dans un système à renouvellement périodique. Pendant ces sept jours, les larves sont nourries d’artémias deux fois par jour, et les solutions sont renouvelées quotidiennement. À la fin des sept jours d’exposition, les larves survivantes sont dénombrées et pesées individuellement pour évaluer les changements dans la croissance, et des comparaisons statistiques sont effectuées entre les groupes exposés à l’effluent et les groupes témoins. Pour que l’essai soit valide, le poids sec moyen des larves témoins doit être ³ 0,85 mg, et le taux de survie des larves témoins doit être ≥ 80 %. L’essai nécessite environ 40 litres d’effluent. | Short Term Methods for Estimating Chronic Toxicity of Effluent and Receiving Waters to West Coast Marine and Estuarine Organisms (première édition) (méthode de référence EPA/600/R-95/136), août 1995, publiée par l’U.S. EPA. Lorsque cette méthode est suivie, les exigences minimales se rattachant à la présentation de rapports énoncées dans les méthodes d’essai d’Environnement Canada doivent être respectées. |
| Essai de croissance et de survie sur le Méné à grosse tête (Pimephales promelas) | Évaluer les effets de l’exposition à l’effluent sur des poissons aux premiers stades de leur cycle biologique. Les résultats expriment la concentration à laquelle la croissance et la survie des larves sont réduites de 25 % (CI25). Si la mortalité est importante, il est possible de calculer la concentration létale pour 50 % de la population étudiée (le résultat statistique est une CL50). | Le Méné à grosse têteest un petit poisson d’eau tempérée que l’on retrouve partout en Amérique du Nord dans les étangs et les portions lentes des cours d’eau. La femelle pond ses œufs sur la face inférieure d’une surface dure, et c’est le mâle qui veille sur la ponte jusqu’à l’éclosion. Des larves du Méné à grosse têteâgées de moins de 24 heures sont exposées pendant sept jours à au moins sept concentrations d’effluent et à une solution témoin sous incubation à 25 °C. Pendant ces sept jours, les larves sont nourries d’artémias deux ou trois fois par jour, et les solutions d’essai et les solutions témoins sont remplacées quotidiennement. À la fin de la période d’exposition de sept jours, les larves survivantes sont dénombrées et pesées individuellement pour évaluer les changements de croissance, et des comparaisons statistiques sont effectuées entre les larves exposées à l’effluent et les larves témoins. L’essai nécessite environ 40 litres d’effluent. | Méthode d’essai biologique : essai de croissance et de survie sur des larves de tête-de-boule (rapport SPE 1/RM/22), février 1992, modifiée en septembre 2008, publiée par Environnement Canada. |
| Essai sur le développe- ment d’un embryon de la Truite arc-en-ciel (Oncorhyn- chus mykiss) | Évaluer les effets de l’exposition à l’effluent sur des poissons aux premiers stades de leur cycle biologique. Les résultats expriment la concentration à laquelle la viabilité de l’embryon est réduite de 25 % (le résultat statistique est une CE25). | La Truite arc-en-ciel est une espèce commune dans les rivières aux eaux froides et non polluées d’Amérique du Nord. Dans certaines régions, l’espèce n’est pas indigène, mais elle a été introduite dans le bassin hydrologique. Dans tout le pays, la Truite arc-en-ciel fait l’objet d’un élevage dans des écloseries commerciales. Les adultes migrent vers les eaux peu profondes pour frayer dans le gravier propre. Les œufs sont enfouis dans le gravier, et les jeunes s’y développent jusqu’à ce que leur vésicule vitelline se soit résorbée. Aux fins de l’essai sur le développement de l’embryon, des œufs de Truite arc-en-ciel récemment fécondés sont exposés à une série de concentrations de l’échantillon d’effluent pendant sept jours à 14 °C. Les solutions d’essai sont renouvelées quotidiennement. Les embryons morts sont dénombrés et éliminés pendant l’essai. À la fin de l’essai, la viabilité des embryons est évaluée, et les embryons en santé sont dénombrés à des fins de comparaison statistique entre les groupes exposés et les groupes témoins. L’essai nécessite environ 80 à 90 litres d’effluent. | Méthode d’essai biologique : essais toxicologiques sur des salmonidés (truite arc-en-ciel) aux premiers stades de leur cycle biologique (méthode de référence SPE 1/RM/28), juillet 1998, publiée par Environnement Canada. |
| Essai sur la fécondation chez les échinides (oursins verts et oursins plats) | Évaluer les effets de l’exposition à l’effluent sur le succès de la fécondation des œufs d’échinides. Les résultats expriment la concentration à laquelle le nombre d’œufs fécondés est réduit de 25 % (le résultat statistique est alors une CI25). | Les échinides sont considérés comme des invertébrés évolués et complexes sur le plan structural. Sept espèces d’oursins verts et trois espèces de clypéastres (oursins plats) sont couramment observées dans les eaux côtières marines du Canada. La reproduction des échinides matures et gravides, mâles et femelles, est stimulée par une injection de chlorure de potassium. La semence d’au moins trois mâles est regroupée, et les rapports sont ajustés pour obtenir le rapport spermatozoïdes–œufs recherché. Les œufs d’au moins trois femelles sont regroupés, et les nombres sont ajustés pour obtenir 2000 œufs/ml. Le sperme est exposé pendant 10, 20 ou 60 minutes (selon l’option retenue pour l’essai) à une série de concentrations de l’échantillon d’effluent. Les œufs sont ensuite introduits dans les flacons pendant une période d’exposition additionnelle de 10 ou 20 minutes. L’essai se termine avec l’ajout de formol. Les œufs préservés (de l’ordre de 100 à 200 œufs) sont alors dénombrés et classés en deux groupes, fécondés ou non, sous un microscope grossissant 100 fois les objets. Pour que l’essai soit valide, le taux de fécondation dans la solution témoin doit être supérieur ou égal à 50 %, mais inférieur à 100 %, et la courbe dose-effet doit être positive et logique. L’essai nécessite environ un litre d’effluent. | Méthode d’essai biologique : essai sur la fécondation chez les échinides (oursins verts et oursins plats) (méthode de référence SPE 1/RM/27), décembre 1992, modifiée en novembre 1997, publiée par Environnement Canada. |
| Essai de reproduction et de survie du cladocère Ceriodaphnia dubia | Évaluer les effets de l’exposition à l’effluent sur la reproduction d’un invertébré. Les résultats expriment la concentration à laquelle le nombre moyen de jeunes par femelle est réduit de 25 % (CI25). Si la mortalité est importante, la concentration létale peut être calculée pour 50 % de la population exposée (le résultat statistique est une CL50). | Ceriodaphnia est une espèce zooplanctonique abondante dans les lacs, les étangs et les zones calmes des cours d’eau de l’Amérique du Nord. Aux fins de l’essai, les Ceriodaphnia sont séparées de façon à obtenir une femelle adulte par éprouvette et à obtenir 10 réplicats par concentration. De jeunes Ceriodaphnia âgées de moins de 24 heures sont exposées à au moins sept concentrations de l’effluent et à une solution témoin à 25 °C. L’essai prend fin lorsque au moins 60 % des cladocères témoins survivants ont produit trois pontes de larves néonates ou à la fin d’une période de huit jours, selon la plus courte de ces deux périodes. Chaque jour pendant le déroulement de l’essai, la survie des adultes est évaluée, les jeunes produits sont retirés et dénombrés, et les solutions d’essai sont renouvelées. À la finde l’essai, le nombre d’adultes vivants et le nombre de jeunes produits par adulte dans trois pontes font l’objet d’une comparaison statistique entre les groupes exposés et les groupes témoins. L’essai nécessite trois à quatre litres d’effluent. | Méthode d’essai biologique : essai de reproduction et de survie du cladocère Ceriodaphnia dubia (rapport SPE 1/RM/21), 2e édition, février 2007, publiée par Environnement Canada. |
| Essai de reproduction sexuée sur la macroalgue rouge Champiaparvula | Évaluer les effets de l’exposition à l’effluent sur la reproduction sexuée d’une macroalgue rouge marine. Le résultat exprime la concentration à laquelle le nombre de cystocarpes est réduit de 25 % (le résultat statistique est une CI25). | Le plant mature de Champia parvula est creux, cloisonné et fortement ramifié. La propagation sexuée de nouvelles cultures est possible par bouturage (ramifications excisées), et le matériel de clonage peut ainsi être maintenu indéfiniment. Deux ramifications mâles et cinq ramifications femellessexuellement matures de Champia parvula sont exposées dans un système statique pendant deux jours à une série de concentrations de l’échantillon d’effluent, puis placées pour une période de récupération de cinq à sept jours dans une solution témoin. La période de récupération permet le développement sur les ramifications femelles de cystocarpes résultant de la fécondation induite pendant la période d’exposition. Pour que l’essai soit valide, la mortalité des femelles témoins doit être < 20 %, et le nombre moyen de cystocarpes par plant femelle témoin doit être ≥ 10. L’essai nécessite environ deux litres d’effluent. | Short Term Methods for Estimating Chronic Toxicity of Effluent and Receiving Waters to Marine and Estuarine Organisms (troisième édition) (méthode de référence EPA-821-R-02-014), octobre 2002, publiée par l’U.S. EPA. Lorsque cette méthode est suivie, les exigences minimales se rattachant à la présentation de rapports énoncées dans les méthodes d’essai d’Environnement Canada doivent être respectées. |
| Essai d’inhibition de la croissance de l’algue Pseudo- kirchne- riella subcapitata | Évaluer les effets de l’exposition à l’effluent sur la croissance d’une algue unicellulaire d’eau douce. Le résultat exprime la concentration à laquelle le nombre de cellules est réduit de 25 % (le résultat statistique est une CI25). | Pseudokirchneriella subcapitata, une algue verte unicellulaire non motile en forme de croissant (40 à 60 micromètres3 [µm3]), est présente dans la plupart des plans d’eau douce de l’Amérique du Nord. Sa morphologie uniforme en fait une candidate idéale pour les numérations au compteur électronique de particules. Cette algue s’agglutine rarement, car elle ne possède pas de structures complexes et ne forme pas de chaînes. La croissance est suffisamment rapide pour permettre une numération précise des cellules après 72 heures. Des sujets axéniques (c.-à-d. issus de cultures pures préparées aseptiquement) à croissance exponentielle sont exposés aux solutions d’essai dans une microplaque statique à 96 cupules. Les algues sont exposées à une série de dilutions de l’échantillon d’effluent filtré, sur plusieurs générations, à température constante (24 °C) et sous éclairage continu pendant 72 heures. Le nombre de cellules algales formées dans les solutions exposées est comparé au nombre présent dans les solutions témoins. Un effluent est considéré comme toxique s’il provoque l’inhibition de la croissance des algues de façon statistiquement significative et que l’inhibition est fonction de la dose. L’essai nécessite moins d’un litre d’effluent. | Méthode d’essai biologique : essai d’inhibition de la croissance d’une algue d’eau douce (méthode de référence SPE 1/RM/25), 2e édition, mars 2007, publiée par Environnement Canada ou Détermination de la toxicité : inhibition de la croissance chez l’algue Pseudokirchneriella subcapitata(méthode de référence MA. 500-P.sub 1.0), septembre 1997, publiée par le Centre d’expertise en analyse environnementale du Québec, ministère du Développement durable, de l’Environnement et des Parcs du Québec. |
| Essai d’inhibition de la croissance de l’algue macroscopique Lemna minor | Évaluer les effets de l’exposition à l’effluent sur la croissance d’une plante d’eau douce. Le résultat exprime la concentration à laquelle le nombre de frondes et le poids sec des frondes sont réduits de 25 % (le résultat statistique est une CI25). | Lemna minor (lenticule mineure ou lentille d’eau) est une petite plante vasculaire macrophyte qui prolifère à la surface ou juste en dessous de la surface des plans d’eau douce (étangs, lacs, eaux stagnantes et zones calmes des cours d’eau). Cette macrophyte commune se trouve pratiquement partout dans le monde, des zones tropicales aux zones tempérées, et dans la plupart des régions du Canada. Sa croissance est rapide et s’effectue par ramification latérale. Des plantes âgées de sept à dix jours et présentant une croissance rapide (la taille typique de la fronde Lemna minor est de 1 cm) sont exposées pendant sept jours à une série de concentrations de l’échantillon d’effluent dilué dans le milieu de croissance, sous incubation à 25 °C en présence d’un éclairement continu et de conditions statiques. Les plantes s’acclimatent au milieu d’essai durant 18 à 24 heures avant le début de l’essai. Les feuilles sont comptées et pesées à la fin de l’essai, et la croissance des plantes fait l’objet d’une comparaison statistique entre les groupes exposés et les groupes témoins. Pour que l’essai soit valide, à la fin de l’essai, le nombre de feuilles des plantes témoins doit être huit fois plus élevé qu’au départ. Le volume d’effluent requis aux fins de l’essai est d’environ un à deux litres. | Méthode d’essai biologique : Essai de mesure de l’inhibition de la croissance de la plante macroscopique dulcicole Lemna minor(méthode de référence SPE 1/RM/37), 2e édition, janvier 2007, publiée par Environnement Canada. |
6.8 Eau de dilution dans les essais de toxicité sublétale en milieu d’eau douce
6.8.1 Choix de l’eau de dilution
Les méthodes d’essai de toxicité sublétale requises dans le cadre du Programme d’ESEE pour les mines de métaux définissent clairement les conditions de culture et les procédures d’essai à suivre (Environnement Canada, 1992a, 1992b, 1998, 2007a, 2007b, 2007c; U.S. EPA, 1994a, 1994b, 1995, 2002). Certaines décisions sont laissées à la discrétion du laboratoire, du moment que les critères d’acceptabilité de l’essai normalisé sont respectés. Par exemple, les méthodes normalisées d’essais sur Ceriodaphnia,le Méné à grosse tête, Pseudokirchneriella et la Truite arc-en-ciel permettent l’utilisation d’eau souterraine ou d’eau de surface non contaminée, d’eau du robinet déchlorée ou d’eau reconstituée comme source d’eau pour la culture ou d’eau témoin et d’eau de dilution, tant que l’eau choisie ne compromet ni la santé des organismes, ni la validité des résultats de l’essai.
La plupart des laboratoires du Canada utilisent une eau « normalisée de laboratoire » pour répondre aux exigences en matière de culture et d’essai de routine. Les laboratoires sont généralement approvisionnés par un système d’eau souterraine naturelle (puits) ou une source d’eau municipale locale, qui doit être déchlorée et parfois tamponnée pour satisfaire aux critères de culture acceptables. L’eau désionisée reconstituée de manière à respecter les paramètres cibles de qualité de l’eau est également utilisée. L’utilisation de cette eau de laboratoire comporte les avantages suivants :
- sa qualité peut être maintenue à un niveau constant, et le risque de contamination par des produits chimiques ou des organismes indésirables ou nocifs est minime;
- le suivi régulier de la composition chimique de l’eau et de la santé des cultures et la réalisation d’essais avec des toxiques de référence permettent de s’assurer que l’eau est d’une qualité acceptable pour les essais de toxicité;
- les cultures étant maintenues dans l’eau de laboratoire, aucun acclimatement supplémentaire des organismes n’est requis aux fins des essais d’exposition à des effluents ou à des substances chimiques lorsque cette eau est utilisée comme eau témoin et eau de dilution;
- l’eau de laboratoire est normalement employée dans les essais réglementaires partout au Canada, car elle fournit une mesure de la toxicité inhérente des effluents et permet de comparer la qualité des effluents dans le temps.
Au cours du Programme d’ESEE du secteur minier, les laboratoires effectueront vraisemblablement la plupart de leurs essais de toxicité sublétale avec de l’eau de laboratoire comme source d’eau témoin et d’eau de dilution afin de pouvoir comparer leurs résultats entre eux et dans le temps. Il est également probable que, dans de nombreux essais de toxicité sublétale où la toxicité des effluents est mesurable, cette toxicité soit attribuée à des substances inorganiques telles que les métaux et l’ammoniac. En outre, la toxicité de l’effluent peut également dépendre de caractéristiques propres au site, notamment le pH, l’alcalinité et la dureté. Ces caractéristiques peuvent être contrôlées et reproduites en laboratoire s’il est souhaité que les résultats de l’essai reflètent les conditions du site. Toutefois, une mine peut décider d’évaluer la toxicité de son effluent à l’aide d’une eau de surface non exposée (comme source d’eau témoin et d’eau de dilution), à condition que l’échantillon ne soit pas exposé à l’effluent. Par ailleurs, la mine peut également utiliser une zone de référence dont les caractéristiques physicochimiques sont semblables à celles du site pour obtenir l’eau témoin et l’eau de dilution.
L’utilisation d’eau de surface non exposée peut être particulièrement utile pour ce qui suit :
Estimation de l’effet atténuant ou stimulant de l’eau de surface non exposée utilisée comme eau de dilution sur l’expression de la toxicité de l’effluent ou de l’eau de surface exposée à l’effluent
Bien que des essais parallèles portant sur des effluents et des eaux de surface exposées à des effluents et utilisant l’eau des sites étudiés et l’eau de laboratoire à dureté ajustée aient produit des résultats similaires (BEAK, 1998, 1999), il est impossible de simuler toutes les caractéristiques physicochimiques de l’eau du site en utilisant l’eau de laboratoire. Par conséquent, si certaines caractéristiques de l’eau du site autres que la dureté, l’alcalinité et le pH sont soupçonnées d’influencer l’expression de la toxicité, il peut être utile d’effectuer les essais de toxicité à l’aide de l’eau du site pour bien tenir compte des effets qui sont propres au site.
L’eau de surface non exposée peut être de l’eau du site de la mine qui a été prélevée en amont d’un point de rejet d’effluent ou dans une zone de référence voisine. Les caractéristiques physiques, chimiques et biologiques de l’eau de surface non exposée du site de la mine peuvent varier dans le temps.
L’utilisation d’eau de surface non exposée comme source d’eau témoin et d’eau de dilution comporte toutefois les inconvénients suivants :
- les essais peuvent nécessiter des volumes relativement importants d’eau de surface non exposée, ce qui peut entraîner une augmentation des coûts de prélèvement, d’expédition et d’entreposage des échantillons d’eau du site;
- certains organismes de laboratoire doivent s’acclimater à l’eau de surface non exposée si cette eau présente des caractéristiques physicochimiques nettement différentes de celles de l’eau de laboratoire (voir la section 6.9.1);
- il faut obligatoirement passer l’eau dans un filtre de 60 µm pour éviter que les populations indigènes de micro-organismes ou de macro-organismes présents dans l’eau de surface ne compromettent la santé des organismes utilisés dans les essais de laboratoire.
En dépit de ses inconvénients sur les plans pratique et technique en tant qu’eau témoin ou eau de dilution, l’eau de surface non exposée peut fournir davantage de renseignements toxicologiques propres au site. Les avantages associés à son utilisation sont les suivants :
- elle reflète les caractéristiques physicochimiques du milieu récepteur;
- elle pourrait indiquer le potentiel d’effets non liés au rejet;
- les essais réalisés avec l’eau de surface non exposée reflètent probablement mieux l’influence des caractéristiques du milieu récepteur sur la puissance des toxiques que ceux effectués avec l’eau de laboratoire.
Au Canada, cette pratique est contraignante du point de vue logistique à cause des grands volumes d’eau devant être expédiés sur de longues distances. Toutefois, il a été montré récemment qu’il est possible de trouver un ou deux organismes d’essai susceptibles de détecter les changements de la qualité de l’effluent qui sont propres à un site donné, de sorte que des essais employant seulement une ou deux espèces pourraient être effectués pour certaines eaux réceptrices (Taylor et al., 2010). Par exemple, l’essai sur les algues Pseudokirchneriella demande de moins grands volumes d’eau, ce qui en fait l’essai idéal pour évaluer les effets des propriétés chimiques du milieu récepteur sur la toxicité de l’effluent (Taylor et al., 2010). Les mines devraient choisir le type d’eau convenant le mieux aux objectifs de leurs études.
Il convient de noter que l’utilisation de l’eau du site comme source d’eau de référence comporte un risque de réponses sublétales. Beak International Inc. (BEAK, 1998) attribue ce problème à la présence de micro-organismes indigènes infectant les organismes de laboratoire. L’équipe de BEAK est parvenue à réduire la mortalité provoquée par ces micro-organismes en faisant bouillir l’eau du site avant de l’utiliser pour les essais.
Dans le cadre d’une vaste analyse des études de toxicité, Sprague (1997) a comparé les résultats des essais de toxicité à l’impact sur les eaux réceptrices et a conclu qu’il y a en général une corrélation entre les effets mesurés dans les essais de toxicité sublétale et les effets environnementaux, particulièrement si de l’eau prélevée en amont du point de rejet de l’effluent est employée comme source d’eau témoin et d’eau de dilution.
Quand un essai de toxicité sublétale a pour objet d’estimer les effets propres au site des contaminants, l’emploi d’eau de surface non exposée prélevée à proximité de la mine comme source d’eau témoin et d’eau de dilution est recommandé par Environnement Canada, l’U.S. EPA et l’American Society for Testing and Materials (ASTM) dans leurs publications sur les méthodes recommandées et les guides connexes (Environnement Canada, 1992a, 1992b, 1998, 2007a, 2007c; U.S. EPA, 1994a; ASTM, 1998).
| Critères | Ceriodaphnia dubia | Méné à grosse tête | Pseudokirchneriellasubcapitata | Lemna minor | Embryon de Truite arc-en-ciel |
|---|---|---|---|---|---|
| Eau de dilution acceptable | |||||
| Pour la culture | Eau souterraine, eau de surface, eau déchlorée, eau reconstituée, eau minérale diluée ou eau réceptrice non contaminée | Eau souterraine, eau de surface ou eau déchlorée non contaminée | Milieu de culture | Milieu Hoagland E+ | Eau souterraine, eau de surface, eau reconstituée, eau déchlorée ou eau réceptrice |
| Pour les essais | Eau reconstituée, eau déchlorée, eau souterraine ou de surface non contaminée, eau réceptrice | Eau reconstituée, eau déchlorée, eau souterraine ou de surface non contaminée, eau réceptrice | Eau de qualité « réactif », eau réceptrice, eau souterraine, eau de surface ou eau reconstituée non contaminée | Milieu de croissance APHA modifié, milieu de croissance ISN, eau réceptrice | Eau souterraine, eau de surface, eau reconstituée, eau déchlorée ou eau réceptrice |
| Eau du site | |||||
| Point de prélèvement | En amont ou dans une zone adjacente non exposée à l’effluent | En amont ou dans une zone adjacente non exposée à l’effluent | En amont ou dans une zone adjacente non exposée à l’effluent | En amont ou dans une zone adjacente non exposée à l’effluent | En amont ou dans une zone adjacente non exposée à l’effluent |
| Méthode de prélèvement | Comme pour l’effluent | Comme pour l’effluent | Comme pour l’effluent | Comme pour l’effluent | Comme pour l’effluent |
| Méthode d’acclimate- ment | Acclimater au moins deux générations de géniteurs avant de recueillir des néonates pour les essais | Acclimater des géniteurs avant d’entreprendre les essais | Aucun acclimatement requis | Placer les plantes dans de l’eau de dilution prélevée sur le site, 18 à 24 heures avant les essais | Aucun acclimate- ment requis |
| Justification de l’acclimate- ment | Procéder à l’acclimatement si les plages de dureté et d’alcalinité diffèrent de ± 20 % de celles de l’eau de culture. | Procéder à l’acclimatement si les plages de dureté et d’alcalinité diffèrent de ± 20 % de celles de l’eau de culture. | s.o. | Nécessaire pour tous les types de milieu d’essai | s.o. |
| Traitements | Filtre de 60 µm, ébullition si nécessaire | Filtre de 60 µm, ébullition si nécessaire | Filtre de 0,45 µm | Filtre de 1 µm, puis de 0,22 µm, milieu additionné de nutriants | Filtre de 60 µm, ébullition si nécessaire |
| Entreposage | De préférence pas plus de 14 jours; maximum d’un mois à 4 °C; éliminer tout espace vide dans le contenant. | De préférence pas plus de 14 jours; maximum d’un mois à 4 °C; éliminer tout espace vide dans le contenant. | De préférence pas plus de 14 jours; maximum d’un mois à 4 °C; éliminer tout espace vide dans le contenant. | De préférence pas plus de 14 jours; maximum d’un mois à 4 °C; éliminer tout espace vide dans le contenant. | De préférence pas plus de 14 jours; maximum d’un mois à 4 °C; éliminer tout espace vide dans le contenant. |
| Pendant les essais de toxicité | Inclure une eau témoin de laboratoire. Si les résultats de l’essai préliminaire révèlent une anomalie, faire bouillir l’eau. Si l’anomalie persiste, employer de l’eau de laboratoire dont la dureté a été ajustée au préalable. | Inclure une eau témoin de laboratoire. Si les résultats de l’essai préliminaire révèlent une anomalie, faire bouillir l’eau. Si l’anomalie persiste, employer de l’eau de laboratoire dont la dureté a été ajustée au préalable. | Inclure une eau témoin de qualité « réactif ». | Inclure une eau témoin de laboratoire. | Inclure une eau témoin de laboratoire. Si les résultats de l’essai préliminaire révèlent une anomalie, faire bouillir l’eau. Si l’anomalie persiste, employer de l’eau de laboratoire dont la dureté a été ajustée au préalable. |
Légende – APHA : American Public Health Association. ISN : Institut suédois de normalisation.
Si l’emploi d’eau de dilution de surface non exposée pour prédire les effets propres au site est couramment accepté, c’est parce que l’interaction des contaminants avec les caractéristiques de la qualité de l’eau est connue. Par exemple, il est établi que les caractéristiques physicochimiques de l’eau comme le pH, l’alcalinité et la dureté influent sur la toxicité des métaux (l’action de ces facteurs a été examinée par Wang, 1997 et Sprague, 1995). Toutefois, des études comparant les résultats d’essais de toxicité sur des effluents et des eaux de surface exposées à des effluents de quatre mines différentes ont révélé que l’utilisation d’eau de surface non exposée ou d’eau de laboratoire comme source d’eau de dilution fournit des estimations comparables de la toxicité, en particulier si la dureté, l’alcalinité et le pH de l’eau de laboratoire ont été ajustés en fonction des mêmes paramètres de l’eau du site (BEAK, 1998, 1999). Par conséquent, l’utilisation d’eau de dilution prélevée sur le site n’est pas toujours nécessaire, puisqu’il est possible de préparer les eaux de laboratoire de manière à ce qu’elles reflètent certaines caractéristiques de l’eau du site comme la dureté, le pH et l’alcalinité.
La présence de teneurs naturellement élevées en carbone organique est une caractéristique importante de certaines eaux de sites miniers; le carbone organique est connu pour atténuer les effets de la toxicité des métaux en réduisant leur biodisponibilité. Des concentrations de carbone organique dissous (COD) pouvant atteindre 58 mg/L ont été observées dans certains lacs de l’Ontario (Neary et al., 1990, cité par Welsh et al., 1993). La présence de telles concentrations peut influer sur l’expression de la toxicité des métaux dans les matrices d’effluent ou d’eau de surface exposée à l’effluent. Toutefois, aucune différence significative dans la réaction des organismes n’a été observée dans le cadre d’essais parallèles de toxicité d’un effluent minier réalisés avec de l’eau du site présentant une concentration modérément élevée de carbone organique (concentration de carbone organique total de 9,4 mg/L) et de l’eau de laboratoire dont la dureté avait été préalablement ajustée (BEAK, 1999). Il convient de noter que la présence d’une forte teneur en carbone organique n’entraîne pas nécessairement une réduction de la biodisponibilité des métaux. Dans les eaux très dures, le calcium et le magnésium peuvent être présents en concentrations suffisamment élevées pour se lier à l’acide humique (qui forme la majeure partie du carbone organique). Les sites de liaison avec l’acide humique seraient donc limités, et la liaison des ions métalliques libres serait compromise. En pareilles circonstances, la toxicité sublétale de l’effluent ne serait pas réduite par la forte teneur en COD des eaux réceptrices (Winner, 1985). De plus, le type de matières organiques influe aussi sur la biodisponibilité des métaux (p. ex., les matières organiques plutôt allochtones diminuent davantage la toxicité du Cu que les matières organiques naturelles se rapprochant des substances autochtones; Schwartz et al., 2004), ce qui complique l’interprétation du rôle du COD dans la réduction de la toxicité des métaux pour le biote aquatique.
Comparaison de la toxicité de l’effluent ou de l’eau de surface exposée à l’effluent avec celle d’une eau contaminée prélevée en amont
Si l’eau d’amont est contaminée par des sources diffuses ou ponctuelles de pollution qui sont sans rapport avec l’exploitation de la mine, cette dernière peut décider d’utiliser cette eau comme source d’eau de dilution dans le cadre des essais de toxicité de manière à pouvoir comparer adéquatement les réactions des organismes étudiés, mais seulement si cette eau ne compromet pas la santé des organismes. Dans le cas où elle nuirait à la santé des organismes, on peut évaluer cette eau séparément au moyen d’une série de dilutions afin d’en quantifier les effets, en utilisant comme eau témoin et eau de dilution de l’eau non contaminée provenant d’un site de référence ou de l’eau de laboratoire.
6.9 Prélèvement, expédition et entreposage des échantillons destinés aux essais de toxicité sublétale
Les procédures de prélèvement, d’expédition et d’entreposage de l’eau de dilution recueillie sur le site sont énoncées dans chacune des méthodes d’essai d’Environnement Canada et de l’Environmental Protection Agency des États-Unis (Environnement Canada, 1992a, 1992b, 1998, 2007a, 2007b, 2007c; U.S. EPA, 1994a, 1994b). Le tableau 6-4 présente des estimations des volumes d’eau du site requis pour la réalisation d’une série d’essais dans le cadre des ESEE, de même que des estimations des volumes d’effluents ou d’eau de surface exposée à des effluents. Comme le recommande l’U.S. EPA (1994a), les échantillons d’eau de dilution prélevés sur le site doivent être représentatifs du plan d’eau et ne pas avoir été perturbés par un ruissellement récent ou une érosion récente qui pourraient faire augmenter la concentration des matières totales en suspension dans l’eau.
| Essai | Volume d’eau de dilution (L) | Volume d’effluent (L) |
|---|---|---|
| Méné à grosse tête | 45 | 21 |
| Truite arc-en-ciel (essai sur les embryons) | 300 | 125 |
| Ceriodaphnia dubia | 10 | 4 |
| Pseudokirchneriella subcapitata | 1 | 1 |
| Lemna minor | 5 (systèmes statiques) 12 (systèmes à renouvellement périodique) | 2 (systèmes statiques) 5 (systèmes à renouvellement périodique) |
| Série d’essais | Volume d’eau de dilution (L) | Volume d’effluent (L) |
| Méné à grosse tête, Ceriodaphnia, Pseudokirchneriella subcapitata, Lemna (systèmes statiques) | 65 | 30 |
| Méné à grosse tête, Ceriodaphnia, Pseudokirchneriella subcapitata, Lemna (systèmes à renouvellement périodique) | 72 | 35 |
| Embryons de Truites arc-en-ciel, Ceriodaphnia, Pseudokirchneriella subcapitata, Lemna (systèmes statiques) | 325 | 140 |
| Embryons de Truites arc-en-ciel, Ceriodaphnia, Pseudokirchneriella subcapitata, Lemna (systèmes à renouvellement périodique) | 330 | 150 |
Remarque – Tous les volumes sont calculés en fonction d’un groupe témoin et de sept concentrations d’essai, sauf pour l’essai sur les embryons de Truites arc-en-ciel, pour lesquels les volumes sont calculés selon un groupe témoin et cinq concentrations d’essai. Pour le Méné à grosse tête, on suppose un volume d’essai de 500 ml et trois réplicats (échantillons répétés), et pour Lemna minor, un volume d’essai de 150 ml et quatre réplicats.
* Les volumes d’effluent estimés pour les essais de toxicité sublétale en milieu marin ou estuarien sont présentés dans le tableau 6-2.
6.9.1 Acclimatement des organismes d’essai
Il est recommandé d’acclimater les organismes de culture avant de les exposer à l’eau du site. Comme l’utilisation de l’eau du site comme source d’eau témoin et d’eau de dilution vise à prédire plus précisément l’effet de l’effluent dans les eaux réceptrices, c’est en utilisant des organismes adaptés aux conditions physicochimiques du milieu récepteur que les prédictions les plus fiables sont obtenues. Par exemple, Lloyd (1965) a découvert que les poissons élevés en eau dure doivent perdre du calcium pour devenir aussi sensibles aux métaux que les poissons élevés dans des eaux plus douces. Par conséquent, si l’eau du site destinée à servir d’eau de dilution est plus douce que l’eau du laboratoire, l’acclimatement des poissons aux conditions du site leur permet de perdre les quantités de calcium voulues avant le début des essais. Inversement, si l’eau prélevée sur le site est plus dure que l’eau du laboratoire, l’acclimatement leur permettra d’accumuler du calcium avant le début des essais.
Les méthodes d’Environnement Canada préconisant l’utilisation de Ceriodaphnia dubia et du Méné à grosse tête recommandent de maintenir les cultures dans de l’eau dont la dureté, l’alcalinité et le pH sont comparables (à 20 % près) à ceux de l’eau du site utilisée comme eau de dilution (Environnement Canada, 1992a, 2007a). Étant donné que de nombreuses mines canadiennes sont situées sur les rives de cours d’eau ou de lacs dont la dureté est faible, il est probable qu’il faudra acclimater les organismes de culture en vue des essais. Dans une étude entreprise en 1997 dans le cadre du Programme d’évaluation des techniques de mesure d’impacts en milieu aquatique (ETIMA), BEAK a mis au point une procédure de pré-acclimatement applicable au Méné à grosse têteet à Ceriodaphnia dubia (BEAK, 1998, 1999). Des améliorations ont subséquemment été apportées à cette procédure au cours de l’étude réalisée en 1999. Selon la dureté, l’alcalinité et le pH prévus de l’eau du site, les cultures sont graduellement exposées à de l’eau de laboratoire dont la dureté a été réduite sur une période de plusieurs jours jusqu’à l’obtention du seuil recherché. Cette procédure est une adaptation de la méthode employée en 1996 par B.A.R. Environmental Inc. (BAR) pendant le programme ETIMA, alors que les cultures avaient été graduellement acclimatées à de l’eau de laboratoire à dureté ajustée et à de l’eau du site, chaque fois que les essais préalables avaient révélé des effets négatifs chez les organismes de laboratoire non acclimatés (BAR, 1997).
Aux fins du pré-acclimatement des cultures, il est possible de préparer de l’eau de laboratoire à dureté réduite en diluant l’eau de laboratoire normalisée avec de l’eau désionisée. À l’inverse, la dureté de l’eau peut être augmentée en ajoutant dans les proportions appropriées les sels utilisés pour la préparation de l’eau reconstituée (tableau 6-5). Lorsqu’on ajuste la dureté de l’eau, il est important de maintenir un degré d’alcalinité correspondant à la dureté, car l’alcalinité affecte la spéciation des métaux (U.S. EPA, 2002; Laurén et McDonald, 1986). Les relations entre la dureté et l’alcalinité sont exposées au tableau 6-5, et des valeurs additionnelles peuvent être interpolées (U.S. EPA, 1994b) à partir de ces résultats.
Ci-dessous se trouve une description détaillée des modalités pour le pré-acclimatement de Ceriodaphnia dubia et du Méné à grosse tête. Quand la dureté est modifiée, il faut supposer un changement correspondant de l’alcalinité et du pH. Les méthodes d’acclimatement pour l’essai sur la Truite arc-en-ciel ne sont pas présentées, puisque les œufs sont directement acheminés de l’écloserie et sont utilisés dans les 24 heures qui suivent (Environnement Canada, 1998). De même, les cultures de Pseudokirchneriellaet de Lemna sont maintenues dans des milieux normalisés qui diffèrent des milieux d’essais courants, bien que les cultures de Lemna puissent être soumises à un certain acclimatement, les plantes étant transférées dans le milieu d’essai 18 à 24 heures avant le début des essais (Environnement Canada, 2007c).
| Type d’eau | Réactif ajouté (mg/L)1 | Qualité finale de l’eau | |||||
|---|---|---|---|---|---|---|---|
| NaHCO3 | CaCSO4-2H20 | MgSO4 | KCL | pH3 | Dureté4 | Alcalinité4 | |
| Très douce | 12,0 | 7,5 | 7,5 | 0,5 | 6,4–6,8 | 10–13 | 10–13 |
| Douce | 48,0 | 30,0 | 30,0 | 2,0 | 7,2–7,6 | 40–48 | 30–35 |
| Modérément dure | 96,0 | 60,0 | 60,0 | 4,0 | 7,4–7,8 | 80–100 | 60–70 |
| Dure | 192,0 | 120,0 | 120,0 | 8,0 | 7,6–8,0 | 160–180 | 110–120 |
| Très dure | 384,0 | 240,0 | 240,0 | 16,0 | 8,0–8,4 | 280–320 | 225–245 |
Source : U.S. EPA(1994a).
1 Produits chimiques de qualité « réactif » ajoutés à l’eau désionisée.
2 Chlorure de potassium.
3 Équilibre approximatif du pH après 24 heures d’aération.
4 Exprimée en milligrammes de CaCO3 par litre.
Ceriodaphnia dubia
Les cultures de Ceriodaphnia sont préparées et maintenues conformément à la méthode normalisée d’Environnement Canada. Pour le pré-acclimatement des cultures à la dureté de l’eau de dilution prélevée sur le site, il faut exposer une couvée de larves néonates âgées de moins de 24 heures à de l’eau dont la dureté a été réduite de 20 % par rapport à celle de l’eau de laboratoire en y ajoutant de l’eau désionisée. Chaque jour, les organismes sont transférés dans de nouvelles solutions dont la dureté est chaque fois de nouveau réduite de 20 ou de 30 %. Lorsque le seuil de dureté recherché est atteint (en une semaine environ) et que les organismes de culture satisfont aux critères de santé énoncés dans la méthode d’Environnement Canada (production d’au moins trois couvées, production totale d’au moins 15 larves néonates par adulte et mortalité inférieure à 20 % parmi les adultes), une nouvelle ponte est induite. Les cultures de la deuxième génération sont maintenues dans de l’eau à dureté ajustée jusqu’à ce que les organismes répondent aux critères de santé (environ une semaine). Si la dureté est trop faible, il faut ajouter du sélénium et de la vitamine B12 à l’eau de culture à dureté ajustée, comme le recommande la méthode normalisée.
Méné à grosse tête
Dans le cadre des études réalisées en 1996 et 1997 pour le Programme ETIMA, BAR et BEAK ont procédé à l’acclimatement et au pré-acclimatement du Méné à grosse tête dans des bassins d’élevage, en ajustant graduellement la dureté et l’alcalinité de l’eau jusqu’à l’obtention de valeurs comparables à celles de l’eau du site (eau de laboratoire à dureté ajustée) (BAR, 1997; BEAK, 1998). Les œufs ont été prélevés et maintenus dans l’eau de laboratoire à dureté ajustée jusqu’à l’éclosion. Des travaux préliminaires réalisés par BEAK au début de 1999 ont toutefois montré que les œufs pouvaient éclore dans l’eau de laboratoire à dureté ajustée sans avoir subi de pré-acclimatement dans les bassins d’élevage. L’omission de l’étape du pré-acclimatement dans les bassins d’élevage permet de réduire le volume d’eau de laboratoire à dureté ajustée requise pour le pré-acclimatement tout en maintenant un stock d’œufs capables d’éclore dans un certain nombre de types d’eau différents. L’éclosion des œufs est induite conformément à la méthode normalisée d’Environnement Canada, avec renouvellement de l’eau toutes les 24 heures.
6.9.2 Essais préliminaires
Une fois qu’ils ont été pré-acclimatés aux conditions physicochimiques de l’eau du site, les organismes peuvent être exposés à l’eau du site dans le cadre d’essais préliminaires. Si ces organismes satisfont aux critères d’acceptabilité pour le contrôle de la méthode d’essai, l’eau du site peut être considérée comme acceptable comme eau de dilution si elle répond aux critères de validité pour le contrôle de la méthode d’essai. Dans le cadre d’un essai préliminaire, une comparaison des réactions dans l’eau du site avec les réactions dans l’eau de laboratoire peut révéler une réduction statistiquement significative de la reproduction et(ou) de la survie, même si le groupe exposé à l’eau du site satisfait aux critères d’acceptabilité pour le contrôle de l’essai. Tant que l’eau du site respecte les critères de validité pour le contrôle de la méthode d’essai, elle peut être considérée comme acceptable aux fins des essais. Pour en savoir plus, veuillez consulter les méthodes d’essai d’Environnement Canada.
6.9.2.1 Anomalies décelées durant les essais préliminaires
S’il est permis aux organismes de s’acclimater graduellement aux caractéristiques physicochimiques de l’eau du site en les exposant à de l’eau de laboratoire à dureté ajustée, les anomalies décelées pendant les essais préliminaires ne devraient pas être dues au choc engendré par l’exposition à des caractéristiques différentes de la qualité de l’eau comme la dureté, l’alcalinité ou le pH, mais plutôt à la présence d’agents biologiques nuisibles ou de substances toxiques.
Il y a lieu de s’interroger chaque fois qu’une exposition à de l’eau du site pure (100 %) provoque une mortalité importante parmi un ou plusieurs réplicats. Des organismes microbiologiques présents dans l’eau du site peuvent compromettre la santé des organismes d’essai, et des données anecdotiques provenant de plusieurs laboratoires d’écotoxicologie indiquent que les anomalies dues à la présence de micro-organismes indigènes apparaissent généralement après quelques jours d’exposition. Ce problème a notamment été observé lors d’essais sur le Méné à grosse tête réalisés par BEAK, et était caractérisé par l’observation d’une mortalité importante et soudaine frappant souvent uniquement un ou deux réplicats du groupe témoin exposé à l’eau du site. À l’occasion, des signes de prolifération fongique ou bactérienne peuvent se manifester dans les flacons utilisés pour les essais. Si une telle contamination est décelée durant les essais préliminaires, il est peu probable que l’acclimatement des organismes réussira à remédier à cette anomalie. Par conséquent, il convient de traiter l’eau du site selon une méthode appropriée (ébullition, traitement à l’ultraviolet – voir ci-dessous) afin d’éliminer la source de l’anomalie ou d’utiliser comme substitut de l’eau de laboratoire à dureté ajustée.
Des essais limités en laboratoire ont montré qu’il est possible d’éliminer ce genre d’anomalie en faisant bouillir l’eau du site doucement pendant 10 minutes et en la laissant refroidir avant d’entreprendre les essais. D’autres traitements ont été proposés dans les publications, comme l’irradiation à l’ultraviolet et la filtration de l’eau à l’aide d’une membrane à pores de 0,45 µm (Grothe et Johnson, 1996; Kszos et al., 1997). Si l’eau du site est prélevée entre la fin du printemps et le début de l’automne, on peut s’attendre à une certaine contamination biologique (à moins que des expériences effectuées avec de l’eau du site n’aient démontré le contraire), et il convient alors de prendre les précautions qui s’imposent, telle l’ébullition.
Si l’anomalie est due à une contamination chimique, il faut remettre en question l’acceptabilité de l’eau du site comme source d’eau de dilution et d’eau témoin, même si les cultures peuvent être acclimatées à des concentrations naturellement élevées de métaux dans l’eau du site (voir la section 6.9.1). Si les cultures sont exposées à de plus fortes concentrations de contaminants, un post-acclimatement peut réduire ou accroître la sensibilité des organismes de laboratoire selon les caractéristiques du contaminant, de l’organisme utilisé aux fins des essais et de l’eau, et l’utilité de la procédure de post-acclimatement doit être remise en question. Si l’anomalie est détectée durant un essai préliminaire, il est recommandé de faire bouillir l’eau ou d’utiliser de l’eau de laboratoire à dureté ajustée à la place de l’eau de dilution. Si l’on soupçonne que l’eau du site est contaminée, on peut prévoir dans le cadre des essais préliminaires une exposition à de l’eau du site bouillie afin de déterminer si le traitement par ébullition a permis de corriger le problème.
6.9.3 Essais de toxicité de l’effluent ou de l’eau de surface exposée à l’effluent
Le tableau 6-3 résume les recommandations concernant le prélèvement, l’entreposage et l’utilisation des eaux de dilution prélevées sur le site aux fins des essais de toxicité sublétale.
Lorsque l’eau du site a été jugée acceptable aux fins des essais, les essais de toxicité peuvent être entrepris conformément à la méthode appropriée d’Environnement Canada. En plus de l’eau témoin du site, il faut inclure une eau témoin additionnelle de la culture de laboratoire afin de vérifier l’état de santé de la culture et la qualité de l’eau du site. Il n’est pas nécessaire d’ajouter un témoin additionnel lorsque l’eau de dilution utilisée comme témoin est la même que l’eau de culture. Pour les essais sur Lemna minor et Pseudokirchneriella subcapitata, le témoin de laboratoire doit être le milieu de croissance normalisé pour l’essai prescrit par la méthode normalisée.
Si l’eau du site est jugée inacceptable pour être utilisée comme eau témoin et eau de dilution, il est possible de recourir à un traitement comme l’ébullition pour tenter de résoudre le problème. Si ce traitement se révèle efficace, l’eau de dilution provenant du site, une fois traitée, devrait être utilisée pour les essais. Par contre, dans les essais comme ceux réalisés sur la Truite arc-en-ciel, l’ébullition de grands volumes d’eau peut se révéler peu pratique et, dans ce cas, le fait d’utiliser de l’eau de laboratoire à dureté ajustée pourrait être une meilleure solution. Si aucun traitement pratique ne permet d’éliminer les effets néfastes de l’eau de dilution provenant du site sur les organismes d’essai, il faudrait utiliser de l’eau à dureté ajustée comme eau de dilution avec des organismes pré-acclimatés. Il importe de veiller à ce que le pH de l’eau à dureté ajustée et celui de l’eau de dilution prélevée sur le site soient les plus semblables possible.
6.10 Utilisation des essais de toxicité sublétale pour résoudre les problèmes posés par les facteurs de confusion
Les données de toxicologie sublétale peuvent également aider à résoudre les problèmes posés par les facteurs de confusion. Un groupe composé de divers intervenants en toxicologie des mines de métaux a examiné plus à fond ce troisième usage des données de toxicité sublétale.
Estimation de la contribution relative des rejets d’effluents et d’autres influences naturelles et(ou) anthropiques sur la toxicité sublétale dans le même plan d’eau récepteur
Au cours de n’importe quelle phase du Programme d’ESEE, les données sur les essais de toxicité sublétale peuvent être utiles pour rectifier une situation où des facteurs de confusion sont en cause. Parfois, les caractéristiques d’un site ne permettent pas de déterminer complètement les effets des effluents de la mine, et ce, même après l’adaptation du plan d’étude. Les renseignements obtenus lors d’essais de toxicité sublétale peuvent alors aider à interpréter les résultats obtenus sur le terrain. La décision à savoir s’il convient d’utiliser à cette fin les essais de toxicité sublétale revient à l’exploitant de la mine et dépend de la nature des facteurs de confusion. Dans les faits, la présence de multiples sources ponctuelles de rejet et(ou) d’un apport diffus constituent les scénarios pour lesquels les essais de toxicité sublétale s’avèrent les plus pertinents. Les essais de toxicité sublétale et la fréquence de suivi doivent être déterminés selon la nature des facteurs de confusion propres au site.
Les estimations de la toxicité sublétale peuvent aider à comprendre la contribution relative des divers rejets industriels ou municipaux aux effets décelés chez les organismes aquatiques vivant dans les eaux réceptrices, que les rejets proviennent d’une source ponctuelle ou diffuse située en amont (p. ex., lixiviat d’une décharge municipale, ruissellement agricole) ou de la propriété même de la mine. Il est possible d’estimer la contribution d’une source située en amont d’un effet observé dans l’environnement en se fondant sur les données de toxicité sublétale de l’eau de surface, le débit du rejet et la façon dont la dispersion s’effectue dans le milieu récepteur. Si les profils de diffusion de différents points de rejet d’une mine se chevauchent, il faudra redoubler d’efforts pour distinguer les effets toxiques des sources de rejet de la mine de ceux des sources situées en amont. Dans ce cas, il sera possible d’analyser des échantillons d’eau de surface prélevés à des points stratégiques des zones fortement exposées à l’effluent en vue d’estimer la contribution combinée des sources aux effets toxiques observés.
La démarche en trois étapes qui suit vise à estimer la contribution relative de différentes sources de toxicité sublétale dans la zone fortement exposée à l’effluent du milieu récepteur :
- Soumettre à une série d’essais de toxicité sublétale des échantillons provenant de toutes les sources de rejet importantes situées sur le terrain de la mine. Utiliser comme source d’eau de dilution et d’eau témoin de l’eau de laboratoire normalisée ou de l’eau du site non exposée à l’effluent. Cette façon de faire permet d’estimer la toxicité sublétale absolue de chaque source de rejet de la mine. Répéter l’échantillonnage et les essais pour chaque source de rejet dont la toxicité est considérée comme variable afin d’obtenir une estimation du degré de variabilité.
- Soumettre à une série d’essais parallèles de toxicité sublétale des échantillons provenant de chaque source de rejet dans un cours d’eau, en utilisant comme source d’eau de dilution et d’eau témoin de l’eau prélevée immédiatement en amont du point de rejet. Pour les lacs ou les estuaires, effectuer la série d’essais parallèles en utilisant comme source d’eau de dilution et d’eau témoin de l’eau prélevée à l’extérieur de la zone immédiatement touchée par les rejets. Aux fins de l’assurance de la qualité, il faut effectuer des essais témoins séparés et simultanés à l’aide d’eau normalisée non contaminée. Il convient de noter que les sources d’eau témoin et d’eau de dilution situées en amont de la mine peuvent déjà être contaminées par d’autres effluents ou sources de substances toxiques. Par conséquent, l’eau de dilution prélevée en amont pourrait contribuer aux effets significatifs observés sur la croissance ou la reproduction, dans les concentrations des effluents à l’étude ou même dans les récipients témoins. En pareils cas, les résultats des essais demeurent valides, puisque l’objet de la recherche consiste à évaluer les contributions relatives des rejets à la toxicité totale des eaux réceptrices.
- Il est recommandé de confirmer la contribution relative des divers rejets en soumettant des échantillons d’eau de surface provenant du plan d’eau récepteur à des essais de toxicité sublétale (mesure des concentrations ambiantes). Cette façon de faire peut aider à :
- confirmer si un effluent présente une toxicité mesurable une fois mélangé aux eaux réceptrices;
- estimer la persistance de la toxicité provenant de toutes les sources dans les eaux réceptrices;
- mesurer la toxicité combinée résultant du mélange de toutes les sources ponctuelles et diffuses afin d’obtenir une estimation de l’effet global sur le milieu récepteur.
Les essais portant sur les échantillons d’eau de surface recevant des rejets ou des substances toxiques de sources multiples doivent être réalisés de façon synoptique, de préférence pendant les périodes d’étiage ou les périodes correspondant au pire scénario. L’échantillonnage devrait être mené à bien aussi rapidement que possible (p. ex., sur un ou deux jours). Il convient également de prévoir des rondes répétées d’échantillonnage et d’essais si la toxicité des rejets est variable. Les recommandations précédentes sur la façon de réaliser les évaluations de la toxicité pour estimer la contribution de sources multiples de rejets aux effets décelés dans le cours d’eau sont fondées sur les résultats des recherches réalisées dans huit sites dans le cadre du Complex Effluent Toxicity Testing Program de l’U.S. EPA. Des rapports détaillés de ces études ont été préparés par Mount et Norberg-King (1985, 1986), Mount et al. (1984, 1985, 1986a, 1986b, 1986c) et Norberg-King et Mount (1986). Les résultats de ce programme, comprenant des critiques indépendantes et des analyses complémentaires, ont été examinés par Sprague (1997) dans le cadre d’un projet entrepris pour le Programme d’évaluation des techniques de mesure d’impacts en milieu aquatique (ETIMA). Selon Sprague, les résultats des études entreprises dans le cadre de ce programme de l’U.S. EPA sont valides et devraient être pris en compte par les mines de métaux canadiennes lorsqu’elles conçoivent des programmes de suivi des milieux aquatiques pour leur mine.
Les mines peuvent décider de mener des recherches supplémentaires lorsque les espèces les plus sensibles exposées à l’effluent ont présenté une CI25 inférieure à 30 %. Les démarches supplémentaires mentionnées ci-après sont recommandées à cette fin. Les espèces qui présentent les réactions les plus marquées aux essais peuvent être utilisées, tout au moins, pour estimer la portée géographique de la réponse potentielle. Par ailleurs, les résultats des essais de toxicité peuvent amener une mine à utiliser d’autres outils recommandés pour le suivi en laboratoire ou sur le terrain.
Pour éliminer les facteurs de confusion, il est recommandé d’avoir recours à une approche par étape, en commençant par réaliser les essais recommandés ci-dessous :
- répétition de l’essai de toxicité sublétale qui a fourni la CI25 la plus sensible en utilisant comme source d’eau témoin et d’eau de dilution de l’eau prélevée en amont de l’effluent ou dans un site de référence;
- évaluation de la toxicité des eaux réceptrices en utilisant des échantillons prélevés dans la zone où l’on prévoit observer une réaction sublétale.
6.11 Références
ASTM – American Society for Testing and Materials. 1998. Standard Guide for Conducting Acute Toxicity Tests on Aqueous Ambient Samples and Effluents with Fishes, Macroinvertebrates, and Amphibians. Conshohochen (PA). Publication annuelle des normes de l’ASTM, section 11 : Water and Environment Technology. ASTM E1192-97.
BAR – B.A.R. Environmental Inc. 1997. Toxicity Assessment of Mining Effluents using Upstream or Reference Site Waters and Test Organism Acclimation Techniques. Programme d’évaluation des techniques de mesure d’impacts en milieu aquatique, projet de l’ETIMA 4.1.2a.
BEAK – Beak International Incorporated. 1998. Additional Tool Evaluations. Programme d’évaluation des techniques de mesure d’impacts en milieu aquatique. Beak Reference 20776.1.
BEAK – Beak International Incorporated. 1999. Final Report: Effects of Dilution Water on the Results of Sublethal Toxicity Tests. Rapport présenté à Ressources naturelles Canada. Beak Reference 33940.
Chapman, P.M. 2000. « Whole effluent toxicity testing – Usefulness, level of protection, and risk assessment », Environmental Toxicology and Chemistry, 19 (1) : 3-14.
Environnement Canada. 1992a. Méthode d’essai biologique : essai de croissance et de survie sur des larves de tête-de-boule. Ottawa (Ontario), Centre de technologie environnementale. Rapport SPE 1/RM/22, février 1992, modifié en septembre 2008.
Environnement Canada. 1992b. Méthode d’essai biologique : essai sur la fécondation chez les échinides (oursins verts et oursins plats). Ottawa (Ontario), Centre de technologie environnementale. Rapport SPE 1/RM/27, décembre 1992, modifié en novembre 1997.
Environnement Canada. 1998. Méthode d’essai biologique : essais toxicologiques sur des salmonidés (truite arc-en-ciel) aux premiers stades de leur cycle biologique. Ottawa (Ontario), Centre de technologie environnementale. Rapport SPE 1/RM/28, 2e édition, juillet.
Environnement Canada. 1999. Procédure recommandée pour l’importation d’organismes destinés à des essais de toxicité sublétale. Ottawa (Ontario), Centre de technologie environnementale.
Environnement Canada. 2001. Procédure révisée pour l’ajustement de la salinité d’échantillons d’effluents soumis à un essai de toxicité sublétale en milieu marin conduit dans le cadre des programmes d’étude de suivi des effets sur l’environnement (ESEE). Ottawa (Ontario), Centre de technologie environnementale, Section de l’élaboration des méthodes et des applications.
Environnement Canada. 2007a. Méthode d’essai biologique : Essai de reproduction et de survie du cladocère Ceriodaphnia dubia. Ottawa (Ontario), Centre des sciences et technologies environnementales. Rapport SPE 1/RM/21, 2e édition, février.
Environnement Canada. 2007b. Méthode d’essai biologique : essai d’inhibition de la croissance d’une algue d’eau douce. Ottawa (Ontario), Centre des sciences et technologies environnementales. Rapport SPE 1/RM/25, 2e édition, mars 2007.
Environnement Canada. 2007c. Méthode d’essai biologique : Essai de mesure de l’inhibition de la croissance de la plante macroscopique dulcicole Lemna minor. Ottawa (Ontario), Centre de technologie environnementale. Rapport SPE 1/RM/37, 2e édition, janvier 2007.
ESG – ESG International Inc. 1999. AETE Synthesis Report of Selected Technologies for Cost-Effective Environmental Monitoring of Mine Effluent Impacts in Canada. Ottawa (Ontario), Ressources naturelles Canada, Centre canadien de la technologie des minéraux et de l’énergie. Projet de l’ETIMA 4.1.4, mars 1999.
Grothe, D.R., et D.E. Johnson. 1996. « Bacterial interference in whole effluent toxicity tests », Environmental Toxicology and Chemistry, 15 (5) : 761-764.
Kszos, L.A., A.J. Stewart et J.R. Sumner. 1997. « Evidence that variability in ambient fathead minnow short-term chronic tests is due to pathogenic infection », Environmental Toxicology and Chemistry, 16 (2) : 351-356.
Laurén, D.J., et D.G. McDonald. 1986. « Influence of water hardness, pH and alkalinity on the mechanisms of copper toxicity in juvenile rainbow trout, Salmo gairdneri », Canadian Journal of Fisheries and Aquatic Sciences, 43 : 1488-1496.
Lloyd, R. 1965. « Factors that affect the tolerance of fish to heavy metal poisoning », dans Biological Problems in Water Pollution, third seminar, 1962. Washington (DC), U.S. Public Health Service. Publ. 999-WP-25, pp. 181-187.
MDDEP – ministère du Développement durable, de l’Environnement et des Parcs du Québec. 2007. Détermination de la toxicité : inhibition de la croissance chez l’algue Pseudokirchneriella subcapitata. Centre d’expertise en analyse environnementale du Québec. MA. 500 – P.sub. 1.0, rév. en septembre 2007.
Mount, D.I., et T.J. Norberg-King (éd.). 1985. Validity of Effluent and Ambient Toxicity Tests for Predicting Biological Impact, Scippo Creek, Circleville, Ohio. Washington (DC), U.S. Environmental Protection Agency. EPA 600/3-85/044.
Mount, D.I., et T.J. Norberg-King (éd.). 1986. Validity of Effluent and Ambient Toxicity Tests for Predicting Biological Impact, KanawhaRiver, Charleston, West Virginia. Washington (DC), U.S. Environmental Protection Agency. EPA 600/3-86/006.
Mount, D.I., N.A. Thomas, T.J. Norberg-King, M.T. Barbour, T.H. Roush et R.W. Brandes. 1984. Effluent and Ambient Toxicity Testing and Instream Community Response on the Ottawa River, Lima, Ohio. Washington (DC), U.S. Environmental Protection Agency. EPA 600/3-84/080.
Mount, D.I., A.E. Steen et T.J. Norberg-King. 1985. Validity of Effluent and Ambient Toxicity Testing for Predicting Biological Impact on Five Mile Creek, Birmingham, Alabama. Washington (DC), U.S. Environmental Protection Agency. EPA 600/8-85/015.
Mount, D.I., T.J. Norberg-King et A.E. Steen. 1986a. Validity of Effluent and Ambient Toxicity Tests for Predicting Biological Impact, NaugatuckRiver, Waterbury, Connecticut. Washington (DC), U.S. Environmental Protection Agency. EPA 600/8-86/005.
Mount, D.I., A.E. Steen et T.J. Norberg-King. 1986b. Validity of Effluent and Ambient Toxicity Tests for Predicting Biological Impact, Back River, Baltimore Harbor, Maryland. Washington (DC), U.S. Environmental Protection Agency. EPA 600/8-86/001.
Mount, D.I., A.E. Steen et T.J. Norberg-King. 1986c. Validity of Ambient Toxicity Tests for Predicting Biological Impact, Ohio River near Wheeling, West Virginia. Washington (DC), U.S. Environmental Protection Agency. EPA 600/3-85/071.
Neary, B.P., P.J. Dillon, J.R. Munro et B.J. Clark. 1990. The Acidification of OntarioLakes: An Assessment of their Sensitivity and Current Status with Respect to Biological Damage. Toronto (Ontario), ministère de l’Environnement de l’Ontario. 171 pages.
Norberg-King, T.J., et D.I. Mount (éd.). 1986. Validity of Effluent and Ambient Toxicity Tests for Predicting Biological Impact, Skeleton Creek, Enid, Oklahoma. Washington (DC), U.S. Environmental Protection Agency. EPA 600/8-86/002.
Schwartz, M.L., P.J. Curtis et R.C. Playle. 2004. « Influence of natural organic matter source on acute copper, lead, and cadmium toxicity to rainbow trout (Oncorhynchus mykiss) », Environmental Toxicology and Chemistry, 23 (12) : 2889-2899.
Sprague, J. 1995. « Factors that modify toxicity », dans Gary Rand (éd.), Fundamentals of Aquatic Toxicology, 2nd Edition. Washington (DC), Taylor and Francis.
Sprague, J. 1997. Review of Methods for Sublethal Aquatic Toxicity Tests Relevant to the Canadian Metal-Mining Industry. Ottawa (Ontario), Ressources naturelles Canada, Centre canadien de la technologie des minéraux et de l’énergie, Programme d’évaluation des techniques de mesure d’impacts en milieu aquatique.
Taylor, L.N., L.A. Van der Vliet et R.P. Scroggins. 2010. « Sublethal toxicity testing of canadian metal mining effluents: National trends and site-specific uses », Human and Ecological Risk Assessment, 16 (2) : 264-281.
U.S. EPA – United States Environmental Protection Agency. 1994a. Short-term Methods for Estimating the Toxicity of Effluents and Receiving Water to Freshwater Organisms, Third Edition. Cincinnati (OH), Environmental Monitoring Systems Laboratory, U.S. Environmental Protection Agency. EPA 600/4-90/027.
U.S. EPA – United States Environmental Protection Agency. 1994b. Interim Guidance on Determination and Use of Water-Effect Ratios for Metals. Office of Water. EPA 823-B-94-001.
U.S. EPA – United States Environmental Protection Agency. 1995. Short-term Methods for Estimating the Toxicity of Effluents and Receiving Water to West Coast Organisms, First Edition. Cincinnati (OH), Environmental Monitoring Systems Laboratory, U.S. Environmental Protection Agency. EPA 600/R-95/136.
U.S. EPA – United States Environmental Protection Agency. 2002. Short-term Methods for Estimating Chronic Toxicity of Effluent and Receiving Waters to Marine and Estuarine Organisms, Third Edition. Cincinnati (OH), Environmental Monitoring Systems Laboratory, U.S. Environmental Protection Agency. EPA/821/R-02/014, octobre 2002.
Wang, W. 1997. « Factors affecting metal toxicity to (and accumulation by) aquatic organisms – An overview », Environment International, 13 : 437-457.
Welsh, P.G., J.F. Skidmore, D.J. Spry, D.G. Dixon, P.V. Hodson et B.E. Hickie. 1993. « Effect of pH and dissolved organic carbon on the toxicity of copper to larval Fathead Minnows (Pimephales promelas) in natural lake waters of low alkalinity », Canadian Journal of Fisheries and Aquatic Sciences, 50 : 1356-1362.
Winner, R.W. 1985. « Bioaccumulation and toxicity of copper as affected by interactions between humic acid and water hardness », Water Research, 19 : 449-455.
Tableaux
Le tableau 6-1 présente les méthodes prescrites pour les essais de toxicité sublétale des effluents. La description des essais, qui comprennent les essais sur des poissons aux premiers stades de leur cycle biologique, les essais sur la reproduction des invertébrés et les essais de toxicité sur des plantes et des algues, est reliée au milieu récepteur, aux espèces utilisées pour les essais et aux méthodes.
Le tableau 6-2 décrit les essais de toxicité sublétale en eau douce et en eau salée dans le cadre du Programme d’ESSE pour les mines de métaux. L’objectif, les résultats, la description, la méthode d’essai biologique et le coût correspondant sont décrits pour chaque essai.
Le tableau 6-3 présente les spécifications des méthodes d’essai recommandées par Environnement Canada et les recommandations pour le prélèvement, l’entreposage et l’utilisation des eaux de dilution recueillies sur les sites. Les critères d’acceptabilité des eaux de dilution et des eaux des sites sont décrits, notamment pour deux exemples : le Méné à grosse tête et l’embryon de Truite arc-en-ciel.
Le tableau 6-4 décrit les volumes d’eau de dilution/d’eau témoin et les volumes de l’effluent correspondant pour les essais de toxicité sublétale. Les essais et les séries d’essais sont énumérés et reliés aux volumes d’eau de dilution (en litres) et aux volumes d’effluent (en litres) correspondants.
Le tableau 6-5 détaille la préparation des eaux en fonction de différents degrés de dureté et d’alcalinité. Les types d’eau comprennent l’eau très douce, l’eau douce, l’eau modérément dure, l’eau dure et l’eau très dure. Les réactifs ajoutés (en mg/L) et la qualité finale de l’eau sont indiqués pour chaque type d’eau.
1 La CI25 se définit comme la concentration de l’effluent à laquelle une inhibition de 25 % est observée chez les organismes d’essai exposés.
2 La moyenne géométrique correspond à la ne racine de la multiplication des n nombres entre eux. Aussi, la somme des logarithmes de n CI25 (CE25 ou CL50) peut être divisée par n, et l’antilog du résultat est la moyenne géométrique.
Retournez à la table des matières
Chapitre 7
7. Suivi des sédiments
7.2 Prélèvement des échantillons de sédiments
- 7.2.1 Mesures et observations sur le terrain
- 7.2.2 Critères de sélection des dispositifs d’échantillonnage
- 7.2.3 Profondeur de pénétration des dispositifs d’échantillonnage
- 7.2.4 Volume des échantillons
- 7.2.5 Utilisation de la benne
- 7.2.6 Sous-échantillonnage des échantillons de sédiments
- 7.2.7 Critères d’acceptabilité des échantillons
- 7.2.8 Réplicats d’échantillons
- 7.2.9 Variables des sédiments pouvant être mesurées sur le terrain
7.3 Manipulation et analyse des échantillons
- 7.3.1 Procédures pour la manipulation des échantillons de sédiments
- 7.3.2 Constitution d’échantillons composites
- 7.3.3 Récipients à échantillons
- 7.3.4 Transport et entreposage des échantillons de sédiments
- 7.3.5 Préparation des échantillons à analyser en laboratoire
- 7.3.6 Prévention de la contamination des échantillons de sédiments
- 7.4.1 Détermination de la distribution granulométrique
- 7.4.2 Détermination de la teneur en carbone organique total
- 7.4.3 Détermination des concentrations de métaux totaux
7.5 Essais de toxicité sur les sédiments
7. Suivi des sédiments
7.1 Aperçu
Chaque fois que l’étude d’une communauté d’invertébrés benthiques est entreprise, les exploitants de mines doivent prélever des échantillons de sédiments, lorsqu’il est possible de le faire, afin d’en déterminer la teneur en carbone organique total et la distribution granulométrique (annexe 5, sous-alinéa 16a)(iii) du Règlement sur les effluents des mines de métaux [REMM]). Les échantillons de sédiments sont prélevés aux mêmes stations d’échantillonnage et au même moment que les échantillons d’invertébrés benthiques.
Un plus grand nombre de stations échantillonnées dans chaque zone peut aider à avoir une meilleure idée des concentrations éventuelles de contaminants dans la zone exposée. Chaque plan d’étude pour le suivi de la communauté d’invertébrés benthiques devrait indiquer les méthodes qui seront utilisées pour le prélèvement des échantillons de sédiments et leur analyse en laboratoire (méthodes sur le terrain et en laboratoire choisies). Les résultats de ces analyses, y compris le calcul de la moyenne, de la médiane, de l’écart-type, de l’erreur-type ainsi que des valeurs minimales et maximales dans chacune des zones d’échantillonnage, devront également figurer dans le rapport d’interprétation. Les résultats des analyses granulométriques et du dosage du carbone organique total (COT) servent à déterminer si l’habitat de la zone exposée diffère de celui de la zone de référence, et ils facilitent l’interprétation des résultats des études de la communauté d’invertébrés benthiques. L’objectif global du suivi des sédiments est de déterminer s’il y a des différences entre les habitats qui pourraient contribuer aux effets décelés dans la communauté d’invertébrés benthiques.
Pour les programmes de suivi dans le cadre desquels l’échantillonnage des invertébrés benthiques est effectué dans des habitats soumis à l’érosion, il sera peut-être impossible de procéder à l’échantillonnage des sédiments afin d’obtenir des variables environnementales supplémentaires; dans ce cas, le rapport sur les données de suivi des sédiments ne sera pas effectué. Certaines des méthodes utilisées pour prélever des sédiments dans les zones d’érosion nécessitent un équipement sophistiqué ou deux visites sur le terrain; soit une pour l’installation et une pour la récupération des pièges à sédiments. Des conditions propres au site pourraient justifier l’échantillonnage des sédiments dans des habitats soumis à l’érosion, si des renseignements utiles sur le degré d’exposition à l’effluent peuvent ainsi être obtenus. Ces approches pourraient être envisagées durant la conception des plans d’étude pour déterminer l’ampleur et la portée géographique des effets ou pour la recherche des causes, car elles peuvent fournir des variables environnementales supplémentaires ou des outils pour déterminer les effets.
Lorsqu’une étude de la communauté d’invertébrés benthiques est réalisée dans le cadre d’une étude sur l’ampleur et la portée géographique des effets ou d’une étude sur la recherche des causes, il est recommandé que chaque échantillon de sédiments prélevé soit également soumis à une analyse chimique (p. ex., métaux). Le plan pour cette étude devrait préciser les paramètres à déterminer lors de l’analyse des échantillons de sédiments et les méthodes de laboratoire qui seront utilisées à cette fin, et les résultats des analyses devraient être indiqués dans le rapport d’interprétation.
Lorsqu’une recherche des causes est réalisée en vue de déterminer les causes d’un effet observé chez la communauté d’invertébrés benthiques, la conduite d’analyses approfondies des sédiments peut se révéler fort utile. Le chapitre 12 fournit des instructions techniques détaillées sur la conduite d’analyses approfondies des sédiments (p. ex., transport en masse des sédiments, vitesse de sédimentation, carottage, composition chimique, essais de toxicité, analyse en triade de la qualité des sédiments, analyse de l’eau interstitielle, évaluation de données sur la toxicité et évaluation de données sur la diminution de la toxicité).
7.2 Prélèvement des échantillons de sédiments
Cette section contient des directives sur la façon de prélever, de manipuler, d’entreposer et de transporter des échantillons de sédiments, ainsi que sur la prise de mesures et la compilation d’observations sur le terrain. Ces directives s’appliquent aux échantillons de sédiments prélevés dans l’une ou l’autre des phases du Programme d’études de suivi des effets sur l’environnement (ESEE).
7.2.1. Mesures et observations sur le terrain
La prise de mesures et la compilation d’observations sur le terrain occupent une place capitale dans tout projet d’échantillonnage de sédiments. Il est recommandé de consigner les informations suivantes au moment du prélèvement de chaque échantillon de sédiments (Mudroch et MacKnight, 1991) :
- numéros de l’échantillon, des réplicats et de la station d’échantillonnage, et identification du site (p. ex., nom);
- date et heure du prélèvement;
- conditions météorologiques et autres facteurs au moment de l’échantillonnage (p. ex., vitesse et direction du vent, action des vagues, courant, marée, intensité du trafic maritime, température de l’air et de l’eau, épaisseur de la glace [le cas échéant]);
- emplacement de la zone d’échantillonnage (p. ex., coordonnées de positionnement) et des points de prélèvement des réplicats;
- type de plate-forme ou d’embarcation utilisée pour l’échantillonnage (p. ex., dimensions, puissance, type de moteur);
- type de dispositif d’échantillonnage utilisé et toute modification apportée durant l’échantillonnage;
- profondeur de l’eau à chaque station et profondeur à laquelle les échantillons de sédiments ont été prélevés;
- nom des personnes participant à l’échantillonnage;
- informations concernant tout incident inhabituel ou imprévu survenu durant la manipulation de l’échantillonneur (p. ex., contamination possible des échantillons, défectuosité ou bris d’équipement, aspect inhabituel des sédiments, maîtrise du dispositif d’échantillonnage durant sa descente);
- description des sédiments : texture, consistance, couleur, odeur, présence d’organismes vivants, estimation du volume de sédiments récupérés à l’aide d’une benne ou longueur et aspect des carottes récupérées (les photographies sont une bonne façon de documenter de manière permanente les caractéristiques d’un échantillon);
- écarts par rapport aux modes opératoires normalisés.
7.2.2 Critères de sélection des dispositifs d’échantillonnage
Divers auteurs ont passé en revue les méthodes et les procédures utilisées pour prélever divers types d’échantillons de sédiments en vue de déterminer les dispositifs d’échantillonnage convenant le mieux à différents types de milieux (p. ex., milieux d’eau douce ou d’eau salée ou milieu estuarien) (voir Baudo et al., 1990; Mudroch et MacKnight, 1991; Environnement Canada, 1994; ASTM, 1992; Burton, 1992). Environnement Canada (1994), Baudo et al. (1990) et Håkanson et Jansson (1983) énumèrent plusieurs facteurs dont il convient de tenir compte au moment de choisir un dispositif et un endroit pour l’échantillonnage des sédiments. Idéalement, le dispositif choisi devrait :
- permettre le libre passage de l’eau durant sa descente, de manière à prévenir la formation d’une onde de pression;
- présenter des caractéristiques réduisant le plus possible la perturbation des sédiments, notamment une surface de coupe tranchante, un faible angle de bord d’attaque, une surface interne lisse et des parois minces;
- se fermer hermétiquement durant la remontée;
- permettre le prélèvement de sous-échantillons;
- permettre de régler le poids afin de pénétrer différents substrats;
- fournir des échantillons d’un volume respectant les exigences aux fins d’analyse;
- permettre de prélever des échantillons de sédiments avec efficacité et constance à différentes profondeurs d’eau;
- permettre de prélever des échantillons de sédiments avec efficacité et constance à la profondeur d’échantillonnage déterminée;
- empêcher la contamination ou l’altération des échantillons;
- fonctionner avec un équipement d’appoint minimal;
- être facile à utiliser et sécuritaire et exiger peu de formation préalable du personnel appelé à le manipuler;
- être facile à transporter et à assembler sur le terrain.
La plupart des dispositifs d’échantillonnage sont conçus de manière à isoler et à récupérer un volume de sédiments à une profondeur prédéterminée sous la surface des sédiments en compromettant le moins possible l’intégrité de cet échantillon et en évitant sa contamination. Dans la plupart des études, il est essentiel de préserver l’intégrité des échantillons, car la moindre altération de la structure des sédiments risque de modifier leurs propriétés physicochimiques et biologiques et, par conséquent, d’influer sur la répartition, la composition et la biodisponibilité des substances toxiques qu’ils renferment, ainsi que sur la formation de complexes. Il peut également être important de préserver le profil si une division de l’échantillon en fonction des diverses profondeurs s’impose. Ces aspects deviennent encore plus importants durant les études de recherche des causes des effets, lorsque des échantillons de sédiments sont prélevés à des fins d’essais de toxicité ou d’analyses plus complexes. Toutefois, il est généralement admis qu’il est difficile, avec la plupart des dispositifs, de prélever un échantillon de sédiments sans compromettre d’une façon ou d’une autre son intégrité.
L’échantillonnage des sédiments s’effectue normalement avec une benne, un carottier ou une drague. Pour les premières études de suivi biologique et les études visant à confirmer la présence ou l’absence d’effets, les bennes sont recommandées. Ces dernières permettent de prélever des échantillons de sédiments de la couche de surface en vue de déterminer et d’évaluer la distribution horizontale de leurs caractéristiques. Pour obtenir de plus amples renseignements, voir de Groot et Zschuppe (1981), Baudo et al. (1990), ASTM (1992), Burton (1992) et Sly et Christie (1992).
Les carottiers servent à prélever une carotte de sédiments afin d’étudier la distribution chronologique ou verticale de leurs caractéristiques physicochimiques (Environnement Canada, 1994). Ils conviennent tout particulièrement lorsque l’intégrité du profil doit être préservée, car ils causent peu de perturbations. Pour cette raison, leur emploi devrait être envisagé dans les études portant sur l’ampleur et la portée géographique des effets, de même que pour les études sur la recherche des causes. Pour obtenir plus de renseignements sur les carottiers, se reporter au document d’orientation d’Environnement Canada (1994) et au chapitre 12.
Les dragues sont utilisées principalement pour le prélèvement des échantillons de benthos, car elles sont habituellement équipées de parois latérales grillagées qui laissent passer les sédiments fins, mais retiennent les sédiments grossiers et les organismes benthiques. Il est pratiquement impossible de mesurer de façon précise la superficie couverte par une drague ou d’évaluer la profondeur à laquelle l’échantillon de sédiments a été prélevé. En outre, ce type d’appareil ne permet pas de préserver l’intégrité des sédiments et ne retient ni l’eau interstitielle ni les sédiments fins durant la remontée. Pour toutes ces raisons, seuls les bennes (premières études de suivi biologique et études visant à confirmer la présence ou l’absence d’effets) et les carottiers (étude sur l’ampleur et la portée géographique des effets et étude sur la recherche des causes) sont recommandés pour le prélèvement d’échantillons de sédiments.
7.2.3 Profondeur de pénétration des dispositifs d’échantillonnage
La profondeur à laquelle on choisit d’enfoncer le dispositif d’échantillonnage dans les sédiments dépend du type d’appareil, de la nature des sédiments et du volume de sédiments requis. La profondeur à laquelle il s’enfonce réellement dépend principalement des deux premiers facteurs. En général, la plupart des contaminants préoccupants d’introduction récente et des organismes formant l’endofaune se trouvent dans les deux premiers centimètres de sédiments. L’épifaune a également accès à cet horizon (Burton, 1992). Par conséquent, pour éviter que l’échantillonnage perturbe la couche de surface des sédiments, il faut enfoncer le dispositif d’au moins 6 à 8 cm dans les sédiments, préférablement à une profondeur de 10 à 15 cm. Cette profondeur convient également pour les études de suivi dans lesquelles l’étude de la contamination historique (0 à 5 premiers centimètres de sédiments) n’est pas une priorité.
7.2.4 Volume des échantillons
Le volume ou le poids minimal recommandé pour les échantillons de sédiments dépend de l’utilisation à laquelle ils sont destinés et doit donc être déterminé au cas par cas, selon le tableau 3 du document d’orientation d’Environnement Canada (Environnement Canada, 1994). Avant d’entreprendre l’échantillonnage, il faut considérer le type et le nombre d’analyses et d’essais à réaliser, et calculer le volume ou le poids de sédiments requis par échantillon. Chaque analyse physicochimique nécessite une quantité de sédiments particulière. Une fois la taille de l’échantillon déterminée, il est important de vérifier si le dispositif d’échantillonnage choisi permet de prélever des échantillons de la taille recherchée et d’évaluer le nombre de réplicats requis par station. Les exigences relatives au volume ou au poids des échantillons peuvent nécessiter d’autres manipulations des échantillons prélevés (sous-échantillonnage, préparation d’échantillons composites ou division des échantillons).
7.2.5 Utilisation de la benne
Lors du prélèvement des échantillons de sédiments benthiques à l’aide d’une benne, il importe de bien contrôler la vitesse de descente du dispositif et d’éviter une descente en « chute libre ». Pour réduire le risque de torsion durant la descente, il faut relier la benne au câble par l’intermédiaire d’un pivot à roulement à billes. La benne doit entrer en contact avec le substrat ou être maintenue tout juste au-dessus, et sa pénétration dans les sédiments doit se faire uniquement par gravité ou à l’aide d’un mécanisme à pistons. Un treuil doit être utilisé pour diriger la benne durant sa descente et sa remontée, en particulier en eaux profondes. Une fois l’échantillon recueilli, la benne doit être remontée lentement et progressivement jusqu’à la surface, à la vitesse d’environ 30 cm/s. Une fois que la benne est à la surface, il faut rincer minutieusement ses parois extérieures avec de l’eau provenant de la station d’échantillonnage afin de prévenir tout risque de contamination de l’échantillon durant son transfert. Il faut également inspecter la benne pour s’assurer qu’elle s’est refermée correctement. Pour chaque type de benne utilisé, il faut respecter le mode opératoire normalisé prévu, afin que le dispositif choisi fonctionne correctement.
Quel que soit le type de dispositif d’échantillonnage utilisé, le mode opératoire normalisé correspondant doit être à portée de la main, et tout le personnel participant à l’échantillonnage doit en maîtriser parfaitement chacune des étapes. L’embarcation ou la plate-forme utilisée pour l’échantillonnage doit être stationnaire et suffisamment stable pour permettre l’inspection et la manipulation des échantillons prélevés. Chaque échantillon doit être accompagné de notes de terrain. Entre chaque station et entre chaque prélèvement effectué à l’intérieur d’une même station, il faut laver soigneusement le dispositif d’échantillonnage en le plongeant et en le retirant de l’eau rapidement à plusieurs reprises afin de déloger les particules de sédiments qui pourraient y adhérer. Cette opération peut également se faire à l’aide d’un boyau et d’eau provenant de la station. À chaque changement de station et avant chaque nouveau prélèvement, le dispositif doit être soigneusement rincé avec de l’eau provenant de la station où le prochain prélèvement doit être effectué.
7.2.6 Sous-échantillonnage des échantillons de sédiments
S’il est prévu de procéder au sous-échantillonnage des échantillons de sédiments prélevés à l’aide d’une benne, la possibilité d’avoir accès à la surface de l’échantillon sans provoquer la perte d’eau ou de sédiments fins est à considérer lors du choix de l’échantillonneur.
La couche d’eau non turbide présente à la surface de l’échantillon, le cas échéant, devrait être enlevée doucement par siphonnage avant le sous échantillonnage, lequel s’effectue à l’aide d’une pelle plate et propre (p. ex., fabriquée en téflon ou à partir d’autre matériau inerte, non réactif et non contaminant) ou d’un carottier à main approprié. Idéalement, chaque sous-échantillon devrait être transféré dans un récipient distinct propre et préalablement étiqueté. Ce récipient devrait être scellé, une fois l’air expulsé.
Si le dispositif d’échantillonnage ne permet pas l’accès à la surface de l’échantillon, le sous-échantillonnage doit se dérouler conformément aux étapes suivantes. Une fois ramené à la surface, l’échantillon doit être déposé dans un récipient propre fait d’un matériau inerte et de même forme que l’échantillonneur. La benne est déposée dans ce récipient, et il faut ouvrir les mâchoires lentement afin d’assurer le transfert de l’échantillon avec le moins de perturbation possible. Une fois l’échantillon transféré, les sous-échantillons peuvent être prélevés à l’aide d’un carottier à main ou d’une pelle. Les bords de l’échantillon, dont l’intégrité est plus susceptible d’être compromise durant l’extraction de la benne, ne doivent pas être inclus dans les sous échantillons.
7.2.7 Critères d’acceptabilité des échantillons
Il est essentiel d’inspecter tous les échantillons afin de s’assurer :
- que l’échantillonneur s’est bien enfoncé à la profondeur prévue;
- que les mâchoires de la benne se sont fermées correctement et que la benne ne s’est pas enfoncée obliquement dans les sédiments ou inclinée lors de la remontée (risque de perte de sédiments).
Tout échantillon qui ne respecte pas l’un ou l’autre de ces critères doit être rejeté et remplacé par un autre échantillon recueilli à la même station. Les points de prélèvement des tentatives suivantes doivent être situés le plus près possible du point de prélèvement initial, sans toutefois le chevaucher, et si la direction du courant est connue, dans la direction opposée du courant, soit en amont du prélèvement initial. Le rejet des échantillons jugés inadéquats doit se faire de manière à ne pas perturber les échantillons subséquents dans la même station d’échantillonnage ou, le cas échéant, dans d’autres stations.
7.2.8 Réplicats d’échantillons
L’obtention d’un seul échantillon de sédiments par zone fournit peu d’indications sur la variabilité des sédiments. Environnement Canada (1994) recommande donc de suivre les indications ci-dessous en ce qui concerne le nombre minimal de réplicats :
- Il faut prélever au moins cinq réplicats à une station d’échantillonnage, sauf indication contraire après échantillonnage et analyses préliminaires.
- Des réplicats doivent être prélevés aux fins du volet de l’assurance et du contrôle de la qualité de tout bon programme d’échantillonnage, et le prélèvement devrait être conforme aux objectifs de qualité des données.
- Il faut prélever un plus grand nombre de réplicats aux stations situées près d’une source de contamination (Skei, 1992).
En prélevant des réplicats distincts à chaque zone d’échantillonnage, il sera possible d’effectuer des comparaisons quantitatives statistiques à l’intérieur d’une même zone et entre plusieurs zones (Holland et al., 1993). Le prélèvement d’échantillons distincts dans une même zone d’échantillonnage peut fournir des indications précieuses sur le degré d’hétérogénéité des sédiments. La subdivision d’un échantillon en plusieurs sous-échantillons permet également d’évaluer le degré de variabilité à l’intérieur de cet échantillon, mais pas à l’échelle de la station.
Le nombre de réplicats requis pour chaque zone d’échantillonnage dépend de la sensibilité et de la puissance statistique des analyses projetées. En général, le plus faible écart par rapport à l’hypothèse nulle, dont la détection est considérée importante au plan scientifique ou environnemental, doit être établi a priori, en même temps que le niveau de puissance du test pour l’hypothèse contraire (Green, 1989).
7.2.9 Variables des sédiments pouvant être mesurées sur le terrain
En plus de la détermination de la teneur en carbone organique total et de la distribution granulométrique, il est recommandé de prendre la mesure des variables suivantes sur le terrain, en particulier durant les études sur l’ampleur et la portée géographique des effets et les études sur la recherche des causes :
- la température et le pH des sédiments à l’interface eau–sédiments;
- le potentiel d’oxydoréduction des sédiments afin de déterminer s’ils sont oxiques ou anoxiques ou d’établir la profondeur de l’interface entre ces conditions dans les sédiments. Il est recommandé de prendre la mesure de la teneur en oxygène dissous en eau douce, et celle du potentiel d’oxydoréduction en milieu marin.
La mesure des paramètres susmentionnés pourrait faciliter l’interprétation des résultats des analyses.
7.3 Manipulation et analyse des échantillons
7.3.1 Procédures pour la manipulation des échantillons de sédiments
Lors de la manipulation des échantillons de sédiments, il est recommandé de suivre les procédures suivantes :
- Comme les sédiments peuvent contenir un mélange de substances dangereuses, il faut éviter tout contact de la peau avec les sédiments, et les personnes qui participent au prélèvement ou à la manipulation et à la préparation des échantillons en vue des analyses doivent porter des vêtements protecteurs et utiliser des dispositifs de sécurité appropriés (p. ex., gants, bottes, sarrau ou tablier, lunettes de protection et respirateur).
- La manipulation des échantillons doit se dérouler dans un endroit bien ventilé (p. ex., à l’extérieur, sous une hotte ou dans une boîte à gants fermée), de manière à prévenir le plus possible l’inhalation des émanations gazeuses provenant des sédiments.
- Les surfaces de travail doivent être recouvertes de pellicules de téflon, de plateaux en polyéthylène haute densité ou d’autres matériaux inertes imperméables ou jetables.
- Un protocole de mesures d’urgence en cas de déversement doit être affiché au laboratoire ou dans l’embarcation d’où s’effectue l’échantillonnage, et les participants doivent connaître tous les modes opératoires normalisés et les recommandations.
7.3.2 Constitution d’échantillons composites
Si le regroupement des sous-échantillons prélevés individuellement dans une même station est requis pour répondre aux objectifs de l’étude, les sous-échantillons doivent être placés dans un récipient propre qui, une fois rempli, doit être scellé, sans air résiduel. La constitution d’échantillons ou de sous-échantillons composites peut également être réalisée en laboratoire.
7.3.3 Récipients à échantillons
Environnement Canada (1994) fournit de l’information sur l’entreposage et le transport des échantillons de sédiments prélevés sur le terrain.
Les échantillons de sédiments entiers peuvent être transférés directement de l’appareil de prélèvement à un grand récipient propre (p. ex., de plus de 1 L). Pour les plus petits échantillons ou les sous-échantillons de sédiments (250 à 1000 ml), l’utilisation de récipients à large ouverture pourvus d’un couvercle avec revêtement en téflon est recommandée.
Si les échantillons sont entreposés à 4 °C, il faut remplir les récipients jusqu’au bord et expulser l’air en les fermant. Toutefois, dans le cas des échantillons congelés dans des récipients de verre pour l’entreposage, il faut éviter de les remplir complètement. Ainsi, il faut laisser un espace d’environ 2,5 cm entre l’échantillon et le couvercle en prévision de l’expansion de l’échantillon une fois congelé; cet espace varie toutefois en fonction de la taille du récipient et du pourcentage d’humidité de l’échantillon. Puis, cet espace libre devrait être purgé avec de l’azote avant de sceller le récipient. Enfin, il est conseillé d’envelopper les récipients en verre transparent dans un matériel opaque (p. ex., du papier d’aluminium propre) afin de les protéger de la lumière et de réduire le risque de bris accidentel.
7.3.4 Transport et entreposage des échantillons de sédiments
Le transport et l’entreposage des échantillons de sédiments doivent se faire selon les méthodes et les conditions suivantes (Environnement Canada, 1994) :
- Le contenant utilisé pour le transport des échantillons doit être réfrigéré à 4 °C (± 2 °C) ou contenir de la glace ou des blocs réfrigérants congelés. La température de ce contenant ne doit pas dépasser 7 °C durant le transport des échantillons vers le laboratoire.
- Si les échantillons recueillis sur le terrain sont chauds (p. ex., plus de 6 °C), il faut les refroidir avec de la glace de manière à ce qu’ils atteignent une température de 1 à 6 °C avant de les placer dans le contenant d’expédition.
- Les échantillons ne doivent pas geler durant leur transport.
- Idéalement, on devrait placer un thermomètre à maxima et minima ou un thermomètre enregistreur dans le contenant d’expédition, et ce dernier devrait être scellé. Tout écart de température doit être signalé.
- Le contenu du contenant d’expédition doit être protégé de la lumière.
- Tous les échantillons de terrain nécessitant un traitement avant d’être entreposés doivent parvenir au laboratoire dans les 72 heures, et préférablement dans les 24 heures, suivant leur prélèvement.
Si ces exigences ne peuvent être respectées en raison de diverses contraintes opérationnelles, il faut faire en sorte que les méthodes et les conditions d’entreposage et d’expédition choisies compromettent le moins possible l’intégrité des échantillons (Mudroch et MacKnight, 1991).
Chaque récipient à échantillons doit être étiqueté correctement et placé à la verticale dans le contenant de transport. L’étiquette apposée sur chaque récipient doit comporter les indications minimales suivantes : identification du site, emplacement ou identification de la station, type d’échantillon, méthode d’échantillonnage utilisée, nom de la personne qui a effectué le prélèvement, et date et heure du prélèvement.
7.3.5 Préparation des échantillons à analyser en laboratoire
La préparation des échantillons de sédiments doit se dérouler dans un endroit bien ventilé (p. ex., sous une hotte), et toutes les mesures d’hygiène et de sécurité qui s’imposent doivent être prises. Aux fins de la première et de la deuxième études de suivi biologique et de l’étude sur l’ampleur et la portée géographique des effets, la préparation des échantillons sous conditions anoxiques ne constitue pas une source de préoccupation. Toutefois, pour la recherche des causes, notamment en effectuant des essais de toxicité, il peut être souhaitable de maintenir des conditions anoxiques; la préparation des échantillons doit alors être menée à bien dans une boîte à gants en présence d’un débit contrôlé de gaz inerte. Certaines des méthodes de préparation permettant de répartir les sédiments dans les récipients d’analyse sont décrites brièvement ci-dessous.
Homogénéisation : L’homogénéisation de la couleur, de la texture et de la teneur en eau des sédiments peut être faite en mélangeant l’échantillon manuellement ou mécaniquement. Toutefois, il importe de démontrer a priori l’efficacité de la méthode utilisée et de toujours utiliser le même temps de mélange afin que le traitement soit uniforme d’un échantillon à l’autre et qu’il minimise les altérations de la composition granulométrique des sédiments.
Le mélange des sédiments doit être réalisé dans le récipient à échantillons ou d’entreposage.
Division : La mise en cône et le quartage sont les méthodes recommandées pour la division des sédiments en vue de leur répartition dans les récipients d’analyse. Si l’on utilise un séparateur de sédiments, il convient d’en démontrer l’efficacité. Ce dispositif doit être fabriqué à partir d’un matériau inerte adéquat.
Séchage :Pour le séchage des sédiments, il est recommandé de faire sécher des sous-échantillons de sédiments (1 à 5 g de sédiments frais) dans un four, à basse température (40 à 60 °C), jusqu’à l’obtention d’un poids constant, ou de lyophiliser des sous-échantillons de sédiments.
Concassage et broyage : Pour le broyage de petits volumes de sédiments, il est recommandé d’utiliser un broyeur à galets et à boulets de type commercial (Mudroch et MacKnight, 1991). Il convient toutefois de noter que le broyage peut modifier les propriétés chimiques des sédiments. Le concassage peut généralement se faire à l’aide d’un mortier et d’un pilon.
Déshydratation : La centrifugation suivie de la décantation du surnageant est la méthode recommandée pour la déshydratation des échantillons de sédiments. La vitesse de centrifugation dépend de la taille de l’échantillon (poids ou volume des sédiments) et des particules.
7.3.6 Prévention de la contamination des échantillons de sédiments
Pour les échantillons destinés aux analyses chimiques, les méthodes utilisées pour le prélèvement, la manipulation, le transport et l’entreposage des sédiments sont à peu de choses près identiques à celles décrites précédemment. Il faut toutefois prendre toutes les précautions qui s’imposent pour éviter la contamination des échantillons.
Pour les échantillons destinés aux analyses chimiques, il est déconseillé d’utiliser un échantillonneur comportant des composantes non protégées en cuivre, en zinc, en laiton ou en matière galvanisée, car ces dispositifs peuvent modifier les concentrations de métaux dans les échantillons. À défaut de quoi, il faut, au moment du sous-échantillonnage, éliminer les portions de sédiments qui sont directement en contact avec les parois du dispositif d’échantillonnage. Les sous-échantillons doivent être transférés dans des récipients propres fabriqués à partir d’un matériau inerte de manière à éviter leur contamination ou l’altération de leurs caractéristiques. Avant de sceller le récipient hermétiquement, il faut s’assurer de chasser tout l’air qu’il renferme.
Il est particulièrement important de traiter les récipients avant d’y transférer les échantillons prélevés sur le terrain (Environnement Canada, 1983, 1989). Cette précaution permet d’éliminer les résidus ou les composés lixiviables, qui pourraient se trouver dans les nouveaux récipients en verre ou dans la plupart des récipients en plastique, et restreint le nombre de sites d’adsorption potentiels. Le traitement préalable des récipients s’effectue selon les étapes suivantes (adapté d’Environnement Canada, 1989) :
- frotter avec un détergent sans phosphate et de l’eau chaude;
- rincer sous un fort jet d’eau chaude;
- immerger pendant 72 heures dans un bain acide avec du HNO3 8 M (50 ml de HNO3 par litre d’eau);
- rincer quatre fois avec de l’eau chaude;
- rincer trois fois avec de l’eau bidistillée;
- laver les couvercles (en téflon ou avec revêtement en téflon) avec un détergent et de l’eau chaude, et rincer avec de l’eau bidistillée.
Le bain acide entraîne la lixiviation des métaux-traces (p. ex., cuivre [Cu], fer [Fe], molybdène [Mo], nickel [Ni] et zinc [Zn]) des matières plastiques. Le triple rinçage à l’eau distillée s’impose, parce que le traitement à l’acide peut activer les sites d’adsorption sur les polymères, qui peuvent dès lors lier les métaux-traces présents dans l’échantillon de terrain.
7.4 Variables des sédiments
7.4.1 Détermination de la distribution granulométrique
Si possible, la distribution granulométrique des sédiments doit être déterminée chaque fois que l’étude d’une communauté d’invertébrés benthiques est entreprise, et ce, pour au moins un échantillon par station d’échantillonnage d’invertébrés benthiques.
La détermination de la distribution granulométrique est importante pour l’interprétation des résultats des analyses chimiques ou biologiques. Elle l’est encore davantage pour l’interprétation des résultats des études des communautés d’invertébrés benthiques, la taille des particules ayant un effet significatif sur la structure de ces communautés. Elle peut également fournir des indications précieuses sur l’origine des matières sédimentaires et les conditions dynamiques du transport et du dépôt des sédiments. L’analyse granulométrique permet de déterminer la surface spécifique (exprimée en mètres carrés par gramme [m2/g]) des sédiments et, subséquemment, d’estimer leur capacité d’adsorption des métaux et des substances organiques.
Bien qu’il existe plusieurs échelles de classification granulométrique, c’est l’échelle de Wentworth (1922) qui est recommandée pour l’interprétation des données des ESEE.
| Classification | Taille des particules (en mm) |
|---|---|
| Gravier | 2 à 16 |
| Sable grossier | 0,2 à 2 |
| Sable fin | 0,062 à 0,2 |
| Limon | 0,0039 à 0,062 |
| Argile | < 0,0039 |
Des instructions sur la façon de mener à bien une analyse granulométrique des sédiments sont présentées par l’American Society for Testing and Materials (ASTM, 2003). L’analyse granulométrique comporte habituellement deux étapes, soit l’analyse par tamisage et l’analyse avec hydromètre. La première méthode permet de classifier les particules mesurant plus de 0,06 à 0,075 mm (la taille minimale étant fonction de la dimension des mailles de la série de tamis utilisés). Elle repose sur un tamisage humide de l’échantillon à travers au moins quatre tamis dont la taille des mailles varie entre 0,06 à 16 mm. Les particules retenues par les tamis sont séchées et pesées. Celles qui traversent les mailles de 0,06 mm sont recueillies et transférées dans un récipient de 2 L, avec l’eau de rinçage. La quantité de particules dans cette fraction de 0,06 mm à 0,0014 mm est déterminée à l’aide d’un hydromètre. L’intégration des données résultant de ces deux méthodes et une série de calculs permettent de tracer la courbe de la distribution granulométrique. Cette courbe illustre la répartition de la matière (en pourcentage) dans les différentes fractions par rapport au poids total de l’échantillon.
L’analyse granulométrique peut également se faire par diffraction du laser, méthode qui devient de plus en plus accessible. Cette méthode est plus efficace et fournit des résultats d’une plus grande résolution que les méthodes susmentionnées. L’instrument utilisé pour la diffraction du laser utilise la lumière émise par un laser à hélium-néon à faible puissance (le faisceau analyseur). Les particules de l’échantillon de sédiments traversent le faisceau à partir d’un réservoir de dispersion qui entraîne les particules en suspension dans l’eau vers une cellule. La lumière dispersée par les particules est dirigée sur les lentilles réceptrices, qui la focalisent sur une diode composée de nombreux cercles concentriques. À l’aide du processus d’ajustement sous contraintes des prédictions dispersées aux données observées par la méthode des moindres carrés, l’ordinateur calcule une distribution du volume des particules en tenant compte des caractéristiques de dispersion observées. Aucune hypothèse concernant la forme de la distribution granulométrique n’est postulée a priori, ce qui permet la caractérisation de distributions plurimodales.
L’efficacité de la diffraction du laser est un gros avantage. Les mesures s’effectuent habituellement en quelques secondes, les données sont sauvegardées numériquement et, instantanément, elles peuvent être utilisées pour le tracé des courbes et la réalisation d’autres calculs. Souvent, une seule mesure permet de connaître toute la distribution granulométrique. Selon l’instrument utilisé, l’analyseur laser peut mesurer des particules dont la taille varie de 0,05 mm à 2000 mm. Pour les échantillons comportant des particules de plus de 2000 mm, il est possible d’intégrer les résultats du tamisage aux données obtenues par diffraction du laser. Enfin, les résultats obtenus par diffraction du laser ont une résolution très élevée et sont facilement reproductibles, ce qui n’est pas le cas des méthodes par tamisage et avec hydromètre.
7.4.2 Détermination de la teneur en carbone organique total
Comme pour la distribution granulométrique, il faut déterminer la teneur en carbone organique total (COT) des sédiments chaque fois qu’une étude de la communauté d’invertébrés benthiques est entreprise, et ce, pour au moins un échantillon par station d’échantillonnage d’invertébrés benthiques.
Le carbone est présent dans les sédiments sous différentes formes organiques (matières humiques, substances chimiques, matières végétales et animales) et sous forme de carbonates inorganiques. Le carbone organique dans les sédiments et dans la colonne d’eau réduit la quantité d’oxygène dissous en utilisant l’oxygène disponible, ce qui contribue à rendre le milieu plus anoxique. En outre, à certaines valeurs de pH, les matières humiques forment des complexes avec les métaux, augmentant de ce fait la solubilité de ceux-ci dans la colonne d’eau. Deux méthodes sont couramment utilisées pour mesurer la concentration de carbone organique total dans les sédiments. La première fait appel à un analyseur d’éléments comportant un détecteur à conductivité thermique. On l’utilise pour des quantités d’échantillon allant de 0,5 à 25 mg. La deuxième méthode nécessite un four à oxydation et est recommandée pour les échantillons de 0,25 à 0,5 g. Elle est fondée sur l’utilisation de la spectrophotométrie à l’infrarouge.
Analyseur d’éléments : Le carbone inorganique est d’abord éliminé par traitement à l’acide chlorhydrique. Le COT est ensuite oxydé en dioxyde de carbone en présence d’un catalyseur. Le gaz produit est séparé par chromatographie, et sa concentration est quantifiée à l’aide d’un détecteur à conductivité thermique.
Four à oxydation : Le carbone inorganique est d’abord éliminé par traitement à l’acide chlorhydrique. Le COT est ensuite oxydé dans le four à oxydation en présence de dioxyde de manganèse. Le dioxyde de carbone formé par l’oxydation du carbone organique est mesuré directement par absorption dans l’infrarouge à la longueur d’onde caractéristique pour le dioxyde de carbone.
Ces méthodes d’analyse du COT dans les sédiments sont décrites dans les documents de l’U.S. Environmental Protection Agency (U.S. EPA, 1986) et de l’American Public Health Association (APHA, 1995).
7.4.3 Détermination des concentrations de métaux totaux
La détermination des concentrations de métaux totaux dans les sédiments n’est pas un volet obligatoire du Programme d’ESEE. Les mines sont toutefois encouragées à mesurer les teneurs en métaux totaux des sédiments chaque fois qu’elles entreprennent une étude de la communauté d’invertébrés benthiques. La connaissance de ces teneurs peut faciliter l’interprétation des résultats des études des communautés d’invertébrés benthiques et la conception des études subséquentes. Si les effets observés à un endroit donnent à penser à l’eutrophisation du milieu, il faudrait également envisager de déterminer les concentrations de nutriants dans les sédiments.
Les sédiments sont une composante à part entière des écosystèmes aquatiques et, par conséquent, ils font souvent partie des programmes de suivi environnemental. Leur formation résulte du tassement différentiel de particules terrigènes en suspension qui ont été introduites dans les écosystèmes aquatiques et de précipités qui ont été produits par les divers processus chimiques et biologiques qui se déroulent dans ces mêmes écosystèmes. Les particules en suspension qui atteignent les écosystèmes aquatiques peuvent déjà contenir des contaminants. Par ailleurs, les particules non contaminées en suspension dans l’eau peuvent accumuler des contaminants solubles présents dans l’eau de ces mêmes écosystèmes. Les processus de précipitation peuvent également piéger des contaminants. Ainsi, les sédiments peuvent être perçus comme des réservoirs ou des puits de contaminants.
Les contaminants qui atteignent les sédiments à partir de sources ponctuelles, tels que les effluents miniers, peuvent devenir biodisponibles et pénétrer les chaînes trophiques des écosystèmes aquatiques, réduisant de ce fait la qualité de ces habitats. L’évaluation de la qualité des sédiments aide à déterminer quels contaminants atteignent la zone exposée. Les sédiments se révèlent de meilleurs intégrateurs des conditions environnementales moyennes à long terme que les échantillons d’eau servant à des analyses chimiques ponctuelles.
Le choix des paramètres à mesurer dans le cadre des analyses chimiques des sédiments varie d’un site à l’autre. Si des données historiques sur la qualité des sédiments existent, il convient de les combiner avec les données de caractérisation des effluents et de qualité de l’eau pour dresser la liste des paramètres à analyser.
L’analyse chimique globale des sédiments fournit des informations sur les taux de charge de divers éléments et les tendances liées à la sédimentation. Parmi les méthodes utilisées pour le dosage des métaux dans les sédiments, mentionnons la spectrophotométrie d’absorption atomique, la fluorescence X, l’analyse par activation neutronique instrumentale, la spectrophotométrie d’absorption atomique à plasma inductif et la spectrométrie de masse à plasma inductif. Comme les concentrations de métaux dans les sédiments sont élevées, en particulier dans les régions minières, les méthodes d’analyse présentant des seuils de détection plus élevés (p. ex., plasma inductif, spectrophotométrie d’absorption atomique à plasma inductif) conviennent généralement pour l’analyse chimique des sédiments.
L’extraction des métaux totaux s’effectue après digestion de l’échantillon global dans de l’eau régale ou dans un mélange d’acides perchlorique, nitrique et chlorhydrique. Il faut noter que la taille des particules de sédiments et la teneur en carbone organique peuvent influer sur les concentrations de métaux. En effet, les particules plus fines et les matières organiques ont une plus grande affinité pour les métaux et présentent un plus grand nombre de sites de liaison que les particules plus grossières. Ainsi, si tous les autres facteurs sont par ailleurs égaux, les concentrations de métaux totaux sont plus élevées dans les substrats organiques fins. Pour tenir compte de cette différence, il est recommandé de tamiser les échantillons de sédiments à travers un tamis à mailles de 63 µm et d’analyser seulement la fraction de moins de 63 µm.
Il est également possible de normaliser les concentrations de métaux dans les sédiments en fonction de la taille des particules ou de la teneur en matières organiques en vue de comparer les résultats obtenus dans des zones différentes. La normalisation des concentrations de métaux dans les sédiments en fonction du pourcentage de fines (fractions limon et argile) s’effectue à l’aide de l’équation suivante (ESP, 1996) :
MétauxNF = Métaux / Fines
Métaux = Concentration de métaux observée dans les sédiments (mg/kg)
Fines = Proportion de fines dans les sédiments
7.5 Essais de toxicité sur les sédiments
Les essais de toxicité sur les sédiments ne sont pas un volet obligatoire du Programme d’ESEE. Ils servent à des fins diverses, notamment pour évaluer la contamination potentielle des milieux aquatiques, vérifier si les effets observés chez les communautés d’invertébrés benthiques sont dus à la toxicité des sédiments et non à d’autres facteurs physiques ou biologiques et, éventuellement, interpréter les facteurs de confusion (voir ci-dessous). Le chapitre 12 fournit des instructions détaillées sur la conduite de ces essais.
7.6 Facteurs de confusion
Les essais de toxicité sur les sédiments peuvent être utiles lorsque les effets sur le terrain ne sont pas concluants en raison de facteurs de confusion, comme la contamination passée ou l’existence de plusieurs sources de rejets dans le même cours d’eau. Lorsque des essais de toxicité sur des sédiments entiers sont réalisés en laboratoire, l’eau sus-jacente de référence est habituellement utilisée pour isoler les effets des sédiments. Une recherche en cours, effectuée par Environnement Canada (Lisa Taylor, communication personnelle, Division de l'écotoxicologie et de la santé de la faune, Environnement Canada), porte sur les effets modificateurs des paramètres chimiques de l’eau sur la toxicité des sédiments, et sur leur prise en compte lorsque de l’eau provenant du site à l’étude est utilisée comme eau sus-jacente. Il peut s’agir d’eau réceptrice prélevée en amont, d’eau réceptrice prélevée en aval (p. ex., un mélange d’effluent et d’eau réceptrice), d’un effluent non dilué ou d’eau de référence « propre » provenant du site. Le choix de l’eau sus-jacente dépend de l’objectif de l’étude. Par exemple, l’objectif est-il d’isoler les effets découlant des sédiments contaminés dans le passé des effets attribuables à l’effluent actuel, de déterminer si l’effluent actuel modifie la biodisponibilité des contaminants dans les sédiments ou d’établir si l’eau en amont du point de rejet influe sur la toxicité des sédiments prélevés en aval du point de rejet? Si la qualité de l’eau est affectée par l’existence de plusieurs sources de rejets dans le même cours d’eau, il pourrait s’avérer encore plus utile d’utiliser une eau sus-jacente de référence qui a été simulée en laboratoire pour reproduire les conditions sur le terrain. Les paramètres susceptibles de réduire la toxicité, comme le pH, la dureté, l’alcalinité ou les matières organiques dissoutes, peuvent être ajustés dans l’eau de laboratoire de façon à refléter la situation sur le terrain.
7.7 Références
APHA – American Public Health Association. 1995. Standard Methods for the Examination of Water and Wastewater. 19th Edition. Washington (DC), American Public Health Association.
ASTM – American Society for Testing and Materials. 1992. « E 1391-90, Standard guide for collection, storage, characterization and manipulation of sediments for toxicological testing », dans 1992 Annual Book of ASTM Standards, Vol. II.04, Section 11. Philadelphia (PA), American Society for Testing and Materials. Pp. 1134-1153.
ASTM – American Society for Testing and Materials. 2003. « D422-63, Standard test method for particle-size analysis of soils », dans Annual Book of ASTM Standards, Vol. 04.08. West Conshohocken (PA), American Society for Testing and Materials. Pp. 10-17.
Baudo, R., J.P. Giesy et H. Muntau (éd.). 1990. Sediments: Chemistry and Toxicity of In-place Pollutants. Chelsea (MI), Lewis Publishers, Inc. 405 pages.
Burton Jr, G.A. (éd.). 1992. Sediment Toxicity Assessment. Chelsea (MI), Lewis Publishers Inc. 457 pages.
de Groot, A.J., et K.H. Zschuppe. 1981. « Contribution to the standardization of the methods of analysis for heavy metals in sediments », Rapports et procès-verbaux des réunions du Conseil international pour l’exploration de la mer, 181 : 111-122.
Environnement Canada. 1983. Échantillonnage pour la qualité de l’eau. Ottawa (Ont.), Environnement Canada, Direction générale des eaux intérieures, Direction de la qualité des eaux. xi + 67 pages.
Environnement Canada. 1989. Bottle Washing Procedures. Burlington (Ont.), Environnement Canada, Direction générale des eaux intérieures, Institut national de recherche sur les eaux, Laboratoire national de la qualité des eaux.
Environnement Canada. 1994. Document d’orientation sur le prélèvement et la préparation de sédiments en vue de leur caractérisation physicochimique et d’essais biologiques. Ottawa (Ont.). Série de la protection de l’environnement. Rapport SPE 1/RM/29.
ESP –Ecological Services for Planning. 1996. Aquatic Effects Technology Evaluation, 1996 Field Evaluation. Final Survey Report for Dome Mine, Ontario. Préparé pour le Programme d’évaluation des techniques de mesure d’impacts en milieu aquatique. Ottawa (Ont.), Ressources naturelles Canada.
Green, R.H. 1989. « Power analysis and practical strategies for environmental monitoring », Environmental Research, 50 : 195-205.
Håkanson, L., et M. Jansson. 1983. Principles of Lake Sedimentology. Berlin (DE), Springer-Verlag. 316 pages.
Holland, P.T., C.W. Hickey, D.S. Roper et T.M. Trower. 1993. « Variability of organic contaminants in inter-tidal sandflat sediments from Manukau Harbour, New Zealand », Archives of Environmental Contamination and Toxicology, 25 : 456-463.
Mudroch, A., et S.D. MacKnight. 1991. Handbook of Techniques for Aquatic Sediments Sampling. Boca Raton (FL), CRC Press. 210 pages.
Skei, J.M. 1992. « A review of assessment and remediation strategies for hot spot sediments », Hydrobiologia, 235-236 : 629-638.
Sly, P.G., et W.J. Christie. 1992. « Factors influencing densities and distributions of Pontoporeia hoyi in Lake Ontario », Hydrobiologia, 235-236 : 321-352.
U.S. EPA – United States Environmental Protection Agency. 1986. Test Methods for Evaluating Solid Waste: Physical/Chemical Methods, SW-846. Washington (DC), United States Environmental Protection Agency.
Wentworth, C.K. 1922. « A scale of grade and class terms for clastic sediments », Journal of Geology, 30 : 377-392.
Retournez à la table des matières
Chapitre 8
8. Évaluation et interprétation des données
8.3 Évaluation et interprétation des données de l’étude de la population de poissons
- 8.3.1 Préparation des analyses
- 8.3.2 Statistiques sommaires
- 8.3.3 Analyse de variance et analyse de covariance
- 8.3.4 Transformations
- 8.3.5 Niveau de réplication
- 8.3.6 Critères d’effet et d’appui
- 8.3.7 Analyse statistique de l’échantillonnage non létal
- 8.3.8 Assurance et contrôle de la qualité des données et analyse (erreurs et valeurs aberrantes)
8.4 Effets sur l’exploitabilité des ressources halieutiques
8.5 Évaluation et interprétation des données sur la communauté d’invertébrés benthiques
- 8.5.1 Plans d’étude et méthodes statistiques
- 8.5.2 Traitement des données
- 8.5.3 Approche des conditions de référence
- 8.5.4 Critères d’appui
- 8.6.1 Établissement de α et β
- 8.6.2 Analyse de puissance : détermination de la taille d’échantillon requise, de la puissance et du seuil critique d’effet approprié
8.8 Considérations statistiques pour les études en mésocosmes
Annexe 1 : Guide étape par étape des procédures statistiques
Annexe 2 : Représentation graphique et tabulaire des données
Annexe 3 : Étude de cas – ANCOVA et analyse de puissance pour l’étude des poissons
Liste des tableaux
- Tableau 8-1 : Détermination exigée de l’étude des poissons, la précision attendue et statistiques sommaires
- Tableau 8-2 : Indicateurs et critères d’effet pour différents plans d'étude et les statistiques s’appliquant a l’étude de la population de poissons.
- Tableau 8-3 : Critères d’appui à utiliser pour les analyses complémentaires.
- Tableau 8-4 : Résumé des critères d’effet analysés au moyen de l’ANCOVA
- Tableau 8-5 : Crtières d’effets et critères d’appui pour l’exploitabilité des poissons et méthode statistique.
- Tableau 8-6 : Méthode statistique utilisée pour déterminer la présence d’un effet pour chacun des sept plans d’étude
- Tableau 8-7 : Tailles d’échantillon nécessaires pour détecter une différence de ± 2 ET
8.1 Aperçu
Selon les exigences des études de suivi des effets sur l’environnement (ESEE), en vertu du Règlement sur les effluents des mines de métaux (REMM), lorsque les études de suivi biologique sont terminées, il est requis de produire un rapport d’interprétation (REMM, annexe 5, article 17). Le propriétaire ou l’exploitant doit présenter à l’agent d’autorisation des rapports écrits sur les résultats des études. Le rôle du rapport d’interprétation dans le Programme d’ESEE est de résumer les résultats des études (y compris les difficultés ou les facteurs de confusion présents), d’effectuer les analyses pertinentes sur les tendances spatiales (et, si les données le permettent, sur les tendances temporelles), de préciser tout « effet » déterminé et de faire des recommandations pour les études subséquentes du Programme d’ESEE. L’interprétation des données ou le rôle du rapport n’inclut pas l’évaluation de la signification écologique, économique ou sociale des résultats. Le contenu du rapport d’interprétation est présenté au chapitre 10 du présent guide et dans le REMM.
L’objet du présent chapitre est de fournir des directives générales sur la façon d’évaluer et d’interpréter les données de l’ESEE, et plus précisément :
- les critères d’effets à retenir et à présenter;
- la méthode statistique (ou autre) à utiliser pour chaque critère d’effet en vue de déterminer la présence ou l’absence d’un effet;
- le rôle de l’analyse de puissance, de a, de b et du seuil critique d’effet (SCE) dans la détermination des effets.
Les ESEE sont basées sur des phases itératives de suivi et de production de rapports. Pour chaque phase, il est requis de présenter sous forme de rapport l’évaluation des données effectuée en vertu de l’article 16 de l’annexe 5. Celui-ci doit préciser tout effet sur les populations de poissons, les tissus de poissons et la communauté d’invertébrés benthiques, les conclusions générales des études de suivi biologique fondées sur les résultats de l’analyse statistique, ainsi qu’un sommaire des résultats des suivis antérieurs. Plus spécifiquement, les données recueillies pour chaque mine devraient être analysées afin de déterminer s’il existe des différences significatives pour certains indicateurs d’effet entre les zones de référence et les zones exposées ou le long d’un gradient d’exposition (détermination de l’effet). Outre l’analyse au cours d’une phase (analyse spatiale), il est recommandé d’effectuer une comparaison des effets entre les phases (comparaisons temporelles) afin de déterminer si des effets déterminés précédemment diminuent ou prennent de l’ampleur.
Aux fins de l’ESEE, seules des données particulières (les indicateurs d’effets) recueillies lors des études sur les poissons, les invertébrés benthiques et sur l’exploitabilité du poisson sont utilisées pour évaluer la présence d’effets. Les autres données de l’ESEE ne servent qu’à faciliter l’interprétation des effets sur le poisson et le benthos (p. ex., caractérisation de l’effluent et suivi de la qualité de l’eau) ou à la caractérisation des changements temporels de la qualité de l’effluent (p. ex., essais de toxicité sublétale). Les tableaux présentés dans les sections suivantes résument les procédures recommandées pour l’analyse des données pour les indicateurs d’effet, pour chaque exigence de suivi (tableaux 8‑2 et 8‑3 et section 8.5). On trouvera aussi d’autres détails dans les différentes sections du présent chapitre. Bon nombre des problèmes d’interprétation des données sont les mêmes pour les études des poissons, de l’exploitabilité des ressources halieutiques et des communautés d’invertébrés benthiques décrites dans les sections suivantes (p. ex., les conditions d’application des techniques statistiques et leur interprétation sont communes à plusieurs de ces sections). Plusieurs de ces problèmes communs sont traités dans la section sur l’étude des poissons ci-dessous et ne sont pas repris dans les sections suivantes portant sur l’exploitabilité des ressources halieutiques et les communautés d’invertébrés benthiques.
8.2 Précisions sur la définition du terme « effet » et la signification de l’interprétation des données dans le cadre d’une étude de suivi des effets sur l’environnement
Il est essentiel de connaître 1) les types d’analyses de données pertinentes, et 2) la signification du terme « interprétation », pour le Programme d’ESEE, particulièrement lors de la rédaction d’un rapport d’interprétation. Pour cela, il faut d’abord définir ce qu’est un effet.
Dans le cadre d’une ESEE, un effet est généralement défini comme une différence statistiquement significative des indicateurs d’effet pour le poisson, le potentiel d’utilisation du poisson ou les communautés d’invertébrés benthiques mesurés entre une zone exposée à un effluent et une zone de référence, ou une différence statistiquement significative de ces indicateurs d’effet dans une zone exposée où existe un gradient décroissant de concentrations d’effluent. Pour l’analyse des tissus de poissons (effectuée pour déterminer l’exploitabilité des ressources halieutiques), un effet signifie des mesures de la concentration du mercure total dans les tissus de poissons, prises dans la zone exposée, supérieures à 0,5 µg/g (poids humide), présentant une différence statistique et ayant une concentration plus élevée par rapport à celles mesurées dans les tissus de poissons prises dans la zone de référence. Dans les cas où il n’est pas possible d’examiner les poissons capturés sur le terrain ou la distribution sur le terrain des invertébrés benthiques dans les zones exposées à l’effluent et dans les zones de référence, on peut avoir recours à une autre méthode de suivi pour le poisson ou l’habitat du poisson, en vue de déterminer si l’effluent cause un effet (chapitre 9).
Tout en tenant compte de la définition d’effet présentée ci-dessus, il est important de reconnaître que ce ne sont pas tous les effets déterminés par l’ESEE qui constituent des dommages pour le poisson, son habitat ou l’exploitabilité des ressources halieutiques. Toutefois, les effets, comme ils sont définis ci‑dessus, représentent des différences ou des gradients montrés scientifiquement qui peuvent refléter des changements dans l’écosystème attribuables à l’effluent. Par conséquent, l’information détaillée sur les effets, dont leur ampleur, leur étendue géographique et leurs causes possibles, pourrait contribuer à une meilleure connaissance de l’écosystème et servir à la gestion des ressources aquatiques.
8.3 Évaluation et interprétation des données de l’étude de la population de poissons
Les données recueillies au cours de l’étude des poissons sur les indicateurs de la croissance, la reproduction, la condition et la survie (lorsqu’il est possible d’obtenir des données servant à déterminer ces indicateurs) comprennent la longueur, le poids corporel total et l’âge du poisson, le poids de son foie ou de l’hépatopancréas et, si les poissons ont atteint la maturité sexuelle, le poids des oeufs, la fécondité et le poids des gonades (REMM, annexe 5, article 16).
L’ensemble de la procédure qui doit être suivie et présentée dans le rapport peut être réaprti en cinq étapes : 1) des analyses, 2) statistiques sommaires, 3) analyses de variance (ANOVA), 4) analyses de covariance (ANCOVA) et 5) analyses de la puissance statistique. L’annexe 1 présente des instructions étape par étape sur les procédures statistiques à suivre pour l’étude des populations de poissons.
Les déterminations exigées pour l’étude des poissons, la précision attendue et les statistiques sommaires sont décrites dans le tableau 8‑1. Le tableau 8‑2 présente les indicateurs d’effet pour différents plans d'étude et les statistiques s’appliquant à l’étude de la population de poissons. Le tableau 8‑3 définit les critères d’appui.
| Détermination exigée (annexe 5, article 16 du REMM) | Précision attendue*** | Statistiques sommaires à fournir (annexe 5, article 16 du REMM) et autres informations générales. |
| Longueur (à la fourche, totale ou standard)* | ± 1 mm | Moyenne, médiane, écart-type, erreur type, valeurs minimales et maximales dans les zones d’échantillonnage |
| Poids corporel total (frais) | ± 1,0 % | Moyenne, médiane, écart-type, erreur type, valeurs minimales et maximales pour les zones d’échantillonnage |
| Âge | ± 1 an (10 % des mesures doivent être confirmées de façon indépendante) | ± 1 an (10 % des mesures doivent être confirmées de façon indépendante) |
| Poids des gonades (si les poissons ont atteint la maturité sexuelle) | ± 0,1 g pour les espèces de poissons de grande taille et 0,001 g pour les espèces de poissons de petite taille | Moyenne, médiane, écart-type, erreur type, valeurs minimales et maximales pour les zones d’échantillonnage |
| Poids des œufs (si les poissons ont atteint la maturité sexuelle) | ± 0,001 g | Poids (un minimum de 100 oeufs par sous-échantillon est recommandé), moyenne, erreur type, valeurs minimales et maximales pour les zones d’échantillonnage |
| Fécondité ** (si les poissons ont atteint la maturité sexuelle) | ± 1,0 % | Nombre total d’œufs par femelle, moyenne, erreur type, valeurs minimales et maximales pour les zones d’échantillonnage |
| Poids du foie ou de l’hépatopancréas | ± 0,1 g pour les espèces de poissons de grande taille et 0,001 g pour les espèces de poissons de petite taille | Moyenne, médiane, écart-type, erreur type, valeurs minimales et maximales pour les zones d’échantillonnage |
| Anomalies | s.o. | Présence de tout parasite, lésion, tumeur ou de toute autre anomalie |
| Sexe | s.o. |
* Si la nageoire caudale est fourchue, mesurer la longueur à la fourche (de l’extrémité de la partie antérieure jusqu’à la fourche de la nageoire caudale). Autrement, mesurer la longueur totale et indiquer le mode de mesure de la longueur utilisé pour chaque espèce. Si une usure prononcée de la nageoire est observée, il faut mesurer la longueur standard.
** La fécondité peut être déterminée en divisant le poids total des ovaires par le poids individuel des œufs, qui peut être estimé en comptant le nombre d’œufs dans un sous échantillon d’au moins 100 œufs.
*** Pour les poissons de petite taille, l’utilisation d’une balance à au moins trois décimales est recommandée.
| Indicateur d’effet | Critères d’effets et méthodes statistiques | ||
|---|---|---|---|
| Échantillonnage létal | Échantillonnage non létal | Mollusques sauvages | |
| Croissance (Utilisation de l’énergie) | Taille selon l’âge (poids corporel en fonction de l’âge) (ANCOVA) | Taille (longueur et poids) des jeunes de l’année (âge 0+) à la fin de la période de croissance. (ANOVA) | Poids humide des animaux entiers (ANOVA) |
| Reproduction (Utilisation de l’énergie) | Poids relatif des gonades (poids des gonades en fonction du poids corporel) (ANCOVA) | Abondance relative des jeunes de l'année (% de jeunes de l'année) (voir chapitre 3, section 3.4.2.2) | Poids relatif des gonades (poids des gonades en fonction du poids corporel) (ANCOVA) |
| Condition (Stockage de l’énergie) | Poids corporel en fonction de la longueur; Poids relatif du foie (poids du foie en fonction du poids corporel) (ANCOVA) | Poids corporel en fonction de la longueur (ANCOVA) | Poids sec des animaux entiers, poids sec de la coquille ou des tissus mous en fonction de la longueur de la coquille (ANCOVA) |
| Survie | Âge (ANOVA) | Distribution de fréquence des longueurs (test de Kolmogorov-Smirnov pour deux échantillons) | Distribution de fréquences des longueurs (test de Kolmogorov-Smirnov pour deux échantillons) |
| Indicateur d’effet | Critères d’appui | Méthode statistique (selon le critère) |
|---|---|---|
| Utilisation de l’énergie | Poids corporel (entier) | ANOVA |
| Longueur | ANOVA | |
| Taille selon l’âge (longueur en fonction de l’âge) | ANCOVA | |
| Poids relatif des gonades (poids des gonades en fonction de la longueur) | ANCOVA | |
| Fécondité relative (nombre d’œufs/femelle en fonction du poids corporel) | ANCOVA | |
| Fécondité relative (nombre d’œufs/femelle en fonction de la longueur) | ANCOVA | |
| Fécondité relative (nombre d’œufs/femelle en fonction de l’âge) | ANCOVA | |
| Survie des jeunes de l'année | Voir chapitre 3, section 3.4.2.2 | |
| Stockage de l’énergie | Taille relative du foie (poids du foie en fonction de la longueur) | ANCOVA |
| Taille relative des œufs (poids moyen des œufs en fonction du poids corporel) | ANCOVA | |
| Taille relative des œufs (poids moyen des œufs en fonction de l’âge) | ANCOVA |
Remarque : Ces analyses sont effectuées à des fins informatives, et les différences significatives entre les zones de référence et les zones exposées et ne sont pas nécessairement utilisées pour indiquer un effet.
1 Pour l’ANCOVA, le premier terme entre parenthèses est le critère (variable dépendante, Y) qu’on analyse pour déterminer la présence d’un effet de l’effluent. Le deuxième terme entre parenthèses est la covariable, X (âge, poids ou longueur).
8.3.1 Préparation des analyses
Lorsque les mesures sur le terrain et en laboratoire sont terminées, les données doivent rapidement être saisies dans une feuille de calcul électronique et soumises à l’assurance et au contrôle de la qualité (AQ/CQ). Les valeurs saisies dans la feuille de calcul devraient être contre-vérifiées avec les données manuscrites originales afin d’éviter les erreurs typographiques. On utilise comme outil de travail de base une matrice de données dont les colonnes indiquent la localisation des sites (zones) et les variables, et les lignes, les observations. Une colonne sera prévue pour noter les commentaires sur l’état physique et toute anomalie constatée pendant l’échantillonnage. Ces commentaires pourraient être utiles pour repérer toute observation anormale et aider à déterminer si des données devraient être exclues d’une analyse. On choisira comme identificateur de lieu ou de zone un terme qui pourra facilement être identifié comme référence ou site d’exposition. Ceci facilitera l’interprétation si elle est effectuée par des personnes qui ne sont pas familières avec les codes de localisation des sites. Si le nombre de poissons capturés à un site d’exposition est insuffisant, mais qu’un nombre suffisant est recueilli au site de référence, on prendra soin d’en prendre note.
L’omission de repérer les erreurs de transcription peut invalider les analyses subséquentes. Une fois que les données nécessaires à l’interprétation ont été entrées correctement, elles doivent être résumées et examinées afin de repérer les valeurs erronées ou aberrantes Il faut ensuite évaluer la normalité des données et les transformer, au besoin. Tout facteur de confusion important devrait aussi être résumé.
Les différences entre les sexes sont courantes sur le plan du taux de croissance, du poids corporel, du coefficient de condition, de la taille des gonades et du poids du foie, car les besoins énergétiques globaux des mâles et des femelles sont différents. Par conséquent, pour tous les critères, les sexes devraient être séparés pour les analyses. De plus, les poissons immatures ne devraient pas être inclus avec les poissons sexuellement matures pour les analyses.
8.3.1.1 Poissons immatures
Il faudrait confirmer que tous les poissons considérés comme adultes connaissent un développement gonadique en vue de la prochaine saison de fraie. L’inclusion de poissons immatures dans les analyses statistiques peut fausser les résultats. Les poissons immatures consacrent proportionnellement plus d’énergie à la croissance et la relation entre leur taille et la croissance de leurs gonades est donc différente de celle des adultes. Aux fins de l’analyse des données, les poissons identifiés commes immatures dans le fichier doivent être exclus. L’indice gonadosomatique (IGS = (poids des gonades/poids corporel) × 100) peut être utile pour identifier les poissons immatures. Chez de nombreuses espèces de poissons, les individus immatures ont habituellement un IGS inférieur à 1 %. Il y a toutefois des exceptions notables, comme les espèces qui assurent la garde des œufs comme la Barbotte brune. Un diagramme du poids des gonades en fonction du poids corporel, auquel on ajoute cette règle de l’IGS, peut être très utile pour identifier les poissons immatures. Les notes de terrain peuvent aussi aider à relever les observations inhabituelles susceptibles d’indiquer la présence de spécimens immatures (p.ex., des commentaires comme « une seule gonade pesée »). La période d’échantillonnage doit être adaptée à la biologie de l’espèce (cycle vital) afin d’éviter de capturer des poissons avant le développement de leurs gonades pour la prochaine saison de reproduction. Toutefois, lorsqu’un échantillonnage non létal est prévu et que la distribution de fréquence des âges est utilisée pour évaluer le succès de la reproduction, la période d’échantillonnage est moins importante. L’analyse des données devrait être réalisée séparément sur les poissons matures et immatures, sauf, bien entendu, lorsque l’objectif est de comparer la proportion de poissons non reproducteurs entre les sites.
8.3.2 Statistiques sommaires
Les statistiques descriptives, soit la moyenne, la médiane, l’écart-type, l’erreur type et les valeurs minimales et maximales, sont calculées, s’il est possible d’obtenir les données, afin de déterminer les indicateurs de croissance, de reproduction, de condition et de survie, ce qui inclut la longueur, le poids corporel total, l’âge, le poids du foie ou de l’hépatopancréas et, si le poisson est mature sexuellement, la taille des œufs, le taux de fécondité et le poids des gonades du poisson (REMM, annexe 5, article 16). Les variables mesurées pendant l’étude sur les poissons afin de déterminer les effets sur la croissance, la reproduction, la condition et la survie des poissons, la précision attendue et les statistiques sommaires sont décrites dans le chapitre 3.
Les statistiques sommaires doivent être calculées par espèce et par sexe, pour chaque zone dont les données sont présentées (p. ex., zone de référence et zone exposée). Avant de calculer les statistiques sommaires, des diagrammes en rectangle et moustaches des données devraient être tracés pour repérer les valeurs aberrantes. Les statistiques sommaires devraient être présentées sous forme de graphiques et de tableaux pour toutes les variables. Il faut aussi évaluer la normalité des données et l’égalité des variances (conditions d’application des tests statistiques). Il est à noter que, pour l’ANCOVA, les pentes, les moyennes ajustées et les termes d’erreur associés devraient aussi être indiqués, tel qu’il est précisé ci-dessous.
Diverses techniques de représentation graphique comme les diagrammes en rectangles et moustaches, les courbes de distribution normale et les diagrammes arborescents peuvent être utilisés pour repérer les valeurs aberrantes (valeurs aberrantes véritables ou erreurs de saisie). La plupart des logiciels de calcul statistique comportent des modules de synthèse des données capables de générer des statistiques sommaires et des graphiques. Ces descripteurs statistiques sommaires sont généralement nécessaires pour la présentation, et la présence de valeurs aberrantes anormalement élevées ou faibles peut indiquer des erreurs. Il ne faut pas éliminer les valeurs extrêmes ou aberrantes de l’ensemble de données (à moins qu’elles résultent clairement d’erreurs commises lors de l’échantillonnage, des mesures ou de la saisie des données) (Grubbs, 1969; Green, 1979), car l’élimination injustifiée de données valides aurait pour effet de réduire la puissance statistique de l’étude des poissons. Il est préférable de souligner l’existence des valeurs aberrantes dans le rapport et d’évaluer l’influence qu’elles peuvent avoir sur les résultats en reprenant les analyses des données sans ces valeurs.
8.3.3 Analyse de variance et analyse de covariance
En plus du calcul des statistiques descriptives, une analyse des résultats doit être effectuée pour déterminer s’il y a une différence statistique entre les zones d’échantillonnage (REMM, annexe 5, alinéa 16c)). Cela s’effectue habituellement au moyen de l’analyse de variance (ANOVA) ou de l’analyse de covariance (ANCOVA); toutefois, dans certains cas, d’autres procédures statistiques (c.-à-d. des méthodes non paramétriques) peuvent être utilisées. Les analyses (ANOVA et ANCOVA) utilisées pour déterminer si des effets statistiquement significatifs se sont produits devraient suivre trois étapes, soit l’examen, l’analyse et l’interprétation des données (l’annexe 1 contient des directives détaillées sur les méthodes statistiques s’appliquant à l’étude des poissons) :
- Les données devraient être examinées pour déterminer si elles satisfont aux conditions d’application de l’ANOVA ou de l’ANCOVA. Ces méthodes sont assez robustes pour permettre un non-respect modéré de certaines conditions et, dans certains cas, la transformation des données aidera à compenser les écarts par rapport aux conditions. Dans les cas où la transformation des données ne suffit pas, il peut être nécessaire d’avoir recours à des méthodes non paramétriques, auquel cas les méthodes d’analyse de puissance décrites dans la section 8.6 ne s’appliquent pas. Ces questions sont examinées ci‑dessous, et les manuels de statistique de référence (p. ex., Sokal et Rohlf, 1995) devraient être consultés pour en savoir plus sur le sujet.
- Après l’examen des données et les transformations nécessaires, on peut procéder aux comparaisons statistiques elles‑mêmes.
- Une fois réalisées les comparaisons statistiques, les principaux résultats pour les indicateurs d’effet (tableau 8‑1) sont présentés clairement de façon à indiquer si des effets a été observé et, le cas échéant, la nature des effets (dont sa direction et son amplitude). Un effet statistique existe quand la valeur de p est inférieure à la valeur de a déterminée a priori, selon les directives de la section 8.6.
8.3.3.1 Analyse de variance
L’ANOVA est utilisée afin de détecter les différences entre les sites sur le plan de la longueur, du poids et de l’âge. Les conditions d’application de l’ANOVA sont les suivantes :
- les données des populations exposées et de référence ont une distribution normale;
- les variances sont égales entre les populations exposées et de référence;
- les termes d’erreur ont une distribution indépendante.
Une ANOVA à un facteur est utilisée afin de tester les différences de la variable dépendante moyenne (longueur, poids ou âge) en utilisant le facteur « site » (p. ex., site de référence ou exposé). Un tracé des résidus peut être utile pour identifier les valeurs aberrantes. Les observations dont les résidus studentisés sont supérieurs à 4 justifient habituellement un examen plus approfondi. Les variantes non paramétriques de l’ANOVA incluent le test de Kruskal-Wallis ou, si on compare les données de deux sites, le test de Mann-Whitney (une alternative non paramétrique au test t pour deux échantillons).
8.3.3.1.1 Normalité des données et uniformité des variances
Il faut vérifier les conditions de normalité et d’homogénéité de la variance avant d’appliquer la plupart des procédures paramétriques. Toutefois, la plupart des méthodes statistiques unidimensionnelles basées sur une distribution normale sont très robustes et tolèrent un non-respect modéré des conditions d’application. La transformation des données originales aidera à normaliser les données ou à homogénéiser les variances. Les transformations logarithmiques sont souvent choisies parce que la plupart des mesures biologiques sont considérées comme suivant une échelle logarithmique ou exponentielle (Peters, 1983) et qu’une telle transformation est significative sur le plan biologique. Il est à noter qu’aux fins de l’étude des poissons de l’ESEE, on ne doit pas ajouter 1 aux valeurs avant d’effectuer une transformation logarithmique, car cela a des effets non souhaitables sur les variances calculées lorsqu’on change les unités de mesure. Si les transformations ne produisent pas de données satisfaisant aux conditions, un tracé des résidus pourrait révéler des données problématiques qui pourraient justifier un examen plus approfondi. La plupart des méthodes statistiques unidimensionnelles sont robustes lors d’une violation modérée des conditions, à l’exception de certaines cas, notamment lorsque les effectifs sont faibles et inégaux. En cas de violation grave des conditions, on pourra envisager le recours à des méthodes statistiques non paramétriques.
8.3.3.1.2 Indépendance (pseudoréplication)
Lors de la conception d’une expérience, il est souhaitable de s’assurer que les réplicats sont alloués de façon aléatoire aux différents niveaux de traitement, de façon que les réponses de chaque réplicat soient indépendantes de celles des autres. Cette dimension aléatoire permet dans une certaine mesure de s’assurer que les différences de réponses observées entre les divers traitements sont attribuables aux effets du traitement et non à d’autres facteurs.
Un manque d’indépendance peut survenir lorsque, par exemple, une personne recueille les données dans la zone exposée tandis qu’une autre personne recueille les données dans la zone de référence. Les données peuvent être biaisées si les deux personnes utilisent constamment des protocoles d’échantillonnage ou de tri légèrement différents. En général, on ne peut régler ce genre de problème qu’en modifiant la méthode d’échantillonnage pour éliminer les sources de biais.
L’attribution aléatoire des réplicats aux différents niveaux de traitement est une procédure relativement facile lorsqu’on effectue des expériences de manipulation (p. ex., essais contrôlés en laboratoire), mais elle est plus difficile à réaliser dans le cadre d’études d’observation sur le terrain comme les études d’impact environnemental (p. ex., ESEE portant sur un seul agent de stress) ou les évaluations environnementales (c.‑à‑d. agents de stress multiples). Ces études testent des hypothèses relatives à la présence et l’ampleur des effets. Toutefois, la force des conclusions qu’on peut tirer de ce type d’expérience est limitée pour deux raisons (Paine et al., 1998) :
- l’agent de stress (p. ex., point de rejet de la mine, barrage hydroélectrique) ne peut pas être reproduit;
- les agents de stress ne peuvent pas être appliqués de façon aléatoire aux réplicats.
Par conséquent, l’agent de stress ou le traitement est toujours en partie ou entièrement confondu avec des facteurs spatiaux ou temporels, et les effets observés peuvent être ou non causés par l’agent de stress à l’étude. Par exemple, s’il s’agit de déterminer si l’effluent d’une industrie a un effet sur les populations de poissons en aval, il est impossible de répéter le traitement, soit l’exposition à l’effluent (puisqu’il n’y a qu’une seule usine et un seul point de rejet), ni d’attribuer au hasard les populations de poissons aux différents niveaux de traitement (zone de référence vs zone exposée). Ainsi, si des différences significatives sont observées entre la population de poissons de la zone de référence et celle de la zone exposée, on peut seulement affirmer que ces deux populations diffèrent, mais on ne peut conclure que les différences observées sont causées par l’exposition à l’effluent. L’interprétation de différences significatives comme effets du traitement alors que les traitements ne sont pas répétés ou que les réplicats ne sont pas indépendants est nommée pseudoréplication (Hurlbert, 1984).
Avant d’attribuer la cause d’un impact à un agent de stress en particulier, il est indispensable de confirmer les observations par une répétition dans le temps et de s’efforcer de démontrer que les agents de stress à l’étude sont impliqués dans les réponses.
8.3.3.2 Analyse de covariance
L’ANCOVA est utilisée afin de tester les différences entre sites sur le plan de la condition, du poids relatif des gonades, du poids relatif du foie, du poids selon l’âge, de la taille selon l’âge et de la fécondité relative. Le tableau ci-dessous contient un résumé de cette analyse.
| Critères d’effet | Variable dépendante | Covariable |
|---|---|---|
| Condition | Poids corporel | Longueur |
| Poids relatif du foie | Poids du foie | Poids corporel |
| Poids relatif des gonades | Poids des gonades | Poids corporel |
| Poids selon l’âge | Poids corporel | Âge |
| Taille selon l’âge | Longueur | Âge |
| Fécondité relative | Oeufs/femelle | Poids corporel |
Les conditions d’application de l’ANCOVA sont les suivantes :
- la relation entre la variable dépendante et la covariable est linéaire;
- les pentes des droites de régression entre sites sont parallèles;
- la covariable est fixe et mesurée sans erreur;
- les résidus ont une distribution normale et indépendante avec moyenne nulle et variance commune.
Il faut noter que l’ANCOVA est fondamentalement une méthode à deux étapes consistant à :
- déterminer si les pentes sont à peu près parallèles;
- si les pentes sont parallèles, déterminer si les élévations des droites de régression sont significativement différentes. Cette procédure est expliquée en détail ci‑après.
L’ANCOVA est utilisée afin de détecter les différences de variables dépendantes entre les sites en tenant compte de la variabilité des sujets des tests en incluant une covariable dans l’analyse. L’inclusion d’une covariable dans l’analyse fait diminuer le terme d’erreur (en tenant compte de la variabilité expliquée par la régression de la variable dépendante en fonction de la covariable) et augmente ainsi la puissance du test (Huitema, 1980).
Il a été suggéré que la plage de valeurs de la variable indépendante (covariable) devrait être approximativement la même pour tous les sites. Il sera difficile de mettre ce principe en oeuvre, mais le non-respect de ce principe devra être pris en compte lors de l’interprétation des résultats, le cas échéant. S’il y a des raisons de croire que le chevauchement des plages de valeurs de la covariable pose problème, on effectuera une ANOVA à un critère des valeurs de la covariable entre les sites. Si les moyennes de la covariable ne diffèrent pas de manière significative entre les sites, les résultats de l’ANCOVA seront probablement fiables (Quinn et Keough, 2002). Une différence significative des valeurs moyennes de la covariable entre les sites constitue un effet significatif. Lors de l’interprétation des différences entre moyennes ou plages de covariables observées, il faut tenir compte de l’uniformité de l’utilisation du dispositif d’échantillonnage entre les sites et de la sélection des échantillons. Il pourrait être approprié de fournir une analyse d’un sous-ensemble des données qui omettrait les valeurs inhabituellement basses ou élevées de la covariable afin de fournir une analyse fiable.
Il est nécessaire d’examiner la plage de valeurs des covariables pour le critère d’effet « poids selon l’âge » avant d’effectuer une ANCOVA. Pour plusieurs espèces de poissons de petite taille, la plage de valeurs de la covariable « âge » pourrait ne s’étendre que de 2 à 3 ou de 2 à 4. Une ANCOVA avec seulement deux ou trois valeurs de la covariable peut produire des résultats trompeurs. Dans ces cas, il pourrait être approprié d’effectuer une ANOVA à un facteur du poids corporel, où le site d’échantillonnage devient le facteur pour chaque groupe d’âges.
8.3.3.2.1 Analyse des résidus
La méthode privilégiée d’examen des résidus consiste à utiliser des méthodes graphiques plutôt que des tests formels pour évaluer la normalité et l’égalité de la variance. En fait, Day et Quinn (1989) conseillent de ne pas utiliser les tests formels. Une bonne analyse du sujet peut être retrouvée dans Miller (1986). Draper et Smith (1981) examinent les diverses méthodes d’analyse des résidus, particulièrement des résidus des régressions. La plupart des logiciels de statistiques comprennent des modules pour l’examen des résidus. Ces méthodes sont généralement graphiques, mais il existe aussi des statistiques de diagnostic. Le principal avantage de ces méthodes, comparativement aux tests formels, est qu’elles permettent de caractériser la cause de la violation de la condition de normalité ou d’égalité des variances.
8.3.3.2.2 Variable indépendante
L’hypothèse selon laquelle la variable indépendante serait fixe est fréquemment enfreinte, et Draper et Smith (1981) analysent les conséquences de ce non‑respect. Une variable indépendante non fixe pourrait vraisemblablement se révéler problématique, principalement dans les situations où la plage de la variable indépendante est très petite, c’est‑à‑dire lorsque la plage de taille (ou d’âge) des poissons incluse dans la régression est très petite. Dans ce cas (plage très étroite de taille ou d’âge), il y a peu d’avantages à utiliser l’ANCOVA en prenant la taille ou l’âge comme covariable et les données serait mieux analysées en effectuant une simple comparaison entre la zone exposée et la zone de référence par ANOVA (c.-à-d. qu’il n’est pas nécessaire de prendre en compte l’influence de la covariable).
8.3.3.2.3 Régression linéaire
L’hypothèse d’une relation linéaire peut être testée pour les échantillons présentant des observations multiples à différentes valeurs de la variable indépendante. Cela pourrait être faisable pour des variables discrètes comme l’âge, mais pas pour des variables indépendantes continues comme le poids corporel. Il faudrait au moins vérifier la linéarité par inspection visuelle. On peut souvent améliorer la linéarité par transformation (p. ex., la transformation log-log est fréquemment utilisée pour les ANCOVA portant sur les poissons dans le cadre de l’ESEE). Il faut aussi examiner les graphiques des régressions pour s’assurer que les pentes ne sont pas indûment influencées par des données aberrantes. Les diagrammes de dispersion aident à détecter les valeurs aberrantes ou inhabituelles. Par exemple, pour l’analyse des données de reproduction, le graphique aide à repérer la présence potentielle de poissons « immatures » qui affecteraient les résultats. Les diagrammes de dispersion devraient être inclus dans le rapport d’interprétation.
8.3.3.2.4 Pentes des droites de régression
Une des hypothèses clés de l’ANCOVA est que les pentes des droites de régression pour la zone de référence et la zone exposée sont approximativement égales. La première partie d’une ANCOVA consiste, par conséquent, à tester les différences de pentes entre les zones. La présence d’un terme d’interaction significatif dans l’ANCOVA entre la covariable X et la zone (p. ex., âge*zone ou taille*zone) indique des pentes significativement différentes. Dans les cas où les pentes ne sont pas significativement différentes (c.‑à‑d. que le terme d’interaction n’est pas significatif), cela indique que les droites de régression sont à peu près parallèles. Si l’on prend comme exemple une ANCOVA du poids selon l’âge, des pentes parallèles indiqueraient que le gain de poids en fonction de l’âge est semblable pour les deux zones. Dans cet exemple, l’étape suivante consiste à appliquer le modèle ANCOVA et à tester les différences de moyennes ajustées (élévation) pour vérifier, si à un âge donné, les poissons sont proportionnellement plus lourds dans une zone que dans l’autre.
Il est possible que les pentes des régressions diffèrent. Par exemple, les poissons de la zone de référence peuvent prendre du poids plus rapidement en fonction de l’âge (pente plus forte) que les poissons de la zone exposée. Si les pentes de régression sont significativement différentes, on ne peut pas mener à bien l’ANCOVA. Dans ce cas, si on prend l’exemple du poids selon l’âge, l’effet ne serait pas une différence proportionnelle de poids à un âge donné, mais plutôt un taux d’augmentation du poids en fonction de l’âge qui est significativement différent d’une zone à l’autre. Ceci est considéré comme un effet significatif dans le cadre de l’étude des poissons pour l’ESEE. L’effet serait ici déterminé comme une différence significative des pentes entre les zones plutôt qu’une différence significative de l’ordonnée à l’origine. Dans une telle situation, il serait aussi intéressant de tracer séparément les droites de régression pour obtenir une meilleure compréhension qualitative de la relation du poids en fonction de l’âge pour chaque zone, sur toute l’étendue de variation de la covariable X (p. ex., où les lignes se coupent-elles?). Il faut noter que, même quand les pentes de régression diffèrent significativement d’une zone à l’autre, il reste possible de faire des comparaisons supplémentaires sur une plage particulière de valeurs de la covariable X (c.‑à‑d. une plage particulière d’âges ou de tailles) (Sokal et Rohlf, 1995). Ce genre de comparaison serait approprié si l’on juge que cette plage d’âge ou de taille est particulièrement préoccupante.
Il est aussi préférable que la plage de valeurs de la variable indépendante soit à peu près la même pour chaque « traitement » (c.-à-d. zone). Cela peut être difficile à réaliser en pratique, mais il faut tenir compte de tout non‑respect de cette prémisse lors de l’interprétation des résultats de tels cas. Par exemple, si l’étendue des valeurs de la taille utilisée comme covariable X pour la zone de référence ne chevauche pas beaucoup celle de la zone exposée, l’utilisation des résultats de l’ANCOVA nécessite la condition que les pentes de régression seraient toujours parallèles dans la portion de chevauchement des intervalles, et n’est peut-être pas appropriée dans cette situation.
8.3.3.2.5 Autres possibilités lorsque les droites de régression ne sont pas parallèles
Lorsque la condition des droites de régression parallèles n’est pas satisfaite, on ne peut pas effectuer une ANCOVA, car il est impossible d’interpréter correctement les moyennes ajustées des traitements. Dans ce cas, il y a une interaction de la covariable avec le traitement, et les différences de la variable dépendante entre les traitements varient pour diverses valeurs de la covariable. Il existe quelques solutions de remplacement permettant de traiter les cas de droites de régression non parallèles dans l’ANCOVA. Ces solutions sont présentées ci-dessous dans l’ordre dans lequel elles devraient être appliquées aux jeux de données avec pentes non parallèles. Les deux premières fournissent des techniques permettant de traiter les droites comme si elles étaient parallèles, ce qui permet de réaliser une ANCOVA complète et une comparaison des moyennes ajustées. La troisième solution est une méthode de remplacement pour calculer les effets mesurés lorsque les droites ne peuvent pas être traitées comme étant parallèles, même après avoir appliqué les deux premières solutions.
1. Points influents (de Barrett et al., 2010)
Les points influents sont des observations qui ont une grande influence sur le calcul (valeurs aberrantes dans l’espace de la covariable) et qui ont le potentiel de dominer les conclusions en raison de leur forte incidence sur les coefficients de régression (Fox, 1997). Si un ou plusieurs points ont une grande influence sur la pente d’une droite de régression et causent le non-parallélisme des droites, la suppression de ce ou ces points pourrait éliminer ce qui empêche d’ajuster les données au modèle parallèle. Le degré d’influence peut être évalué au moyen de la statistique de distance de Cook (Cook, 1977, 1979), qui est intégrée à de nombreux logiciels de calcul statistique. Elle est calculée en utilisant des résidus studentisés (valeurs aberrantes de la variable dépendante) et une mesure de l’importance de l’incidence nommée « valeur hat » (valeurs aberrantes de la variable prédictive) comme mesure de l’incidence de chaque observation (Fox, 1997). Un tracé de la distance de Cook en fonction de la covariable s’avère très utile pour identifier les observations qui ont une grande influence. Un seuil de démarcation numérique à 4/(n–k–1), où n est le nombre total d’observations et k est le nombre de variables prédictives dans le modèle de régression, peut aussi être utilisé afin d’évaluer les observations à grande infuence (Fox, 1997).
2. Coefficients de détermination (de Barrett et al., 2010)
Le coefficient de détermination (R2) exprime la proportion de la variabilité totale de la variable dépendante expliquée par sa relation linéaire avec la variable indépendante et constitue une mesure de l’association entre les deux variables (Quinn et Keough, 2002). Lorsque les pentes de régression ne sont pas parallèles, le coefficient de détermination du modèle de régression complet (qui inclut le terme d’interaction) peut être comparé avec le R2 du modèle de régression réduit (modèle dont le terme d’interaction est supprimé). Lorsque le R2 du modèle parallèle (réduit) est élevé (supérieur à 0,8), mais à peine inférieur à celui du modèle complet (différence de moins de 0,02), le modèle parallèle fournit une représentation suffisante des données, et peut être utilisé pour effectuer l’analyse.
3. Estimation des effets pour diverses tailles de poissons (de Lowell et Kilgour, 2008)
Lorsque les deux méthodes ci-dessus ne peuvent être appliquées au jeu de données (c.‑à‑d. lorsque les pentes demeurent non parallèles même après avoir appliqué les deux méthodes ci-dessus), on peut utiliser la méthode suivante pour estimer les effets mesurés pour les poissons plus petits (ou plus jeunes) ou plus grands (ou plus vieux). On détermine d’abord les valeurs minimales et maximales de la covariable dans la plage de chevauchement de la covariable des deux régressions (zones de référence et zone exposée). On détermine ensuite les valeurs prévues de la variable dépendante pour la droite de régression de chaque zone, pour ces deux valeurs de covariables (minimum et maximum). Une estimation de l’effet pour la valeur minimale de la covariable (c.-à-d. l’effet subi par les poissons plus petits ou plus jeunes) sera la différence entre les valeurs prévues, soit la valeur prévue de la zone exposée moins la valeur prévue de la zone la référence, exprimée en pourcentage de la valeur prévue de référence. Si les données ont subi une transformation logarithmique, on doit calculer l’antilogarithme (c.‑à‑d. x exprimé en 10x) des valeurs prévues avant de calculer le pourcentage de différence. Le calcul est le même pour les poissons de grande taille (ou plus vieux), mais on utilisera la valeur maximale de la covariable dans la plage de chevauchement des valeurs des deux zones. On peut alors comparer chacun de ces deux effets mesurés (pourcentage de différence pour les poissons petits ou jeunes et pour les poissons de grande taille ou plus vieux) avec les seuils critiques d’effet (SCE) de la même manière que pour les effets mesurés calculés à partir de moyennes (d’ANOVA) ou de moyennes ajustées (d’ANCOVA).
8.3.3.2.6 Méthodes non paramétriques de l’analyse de covariance
L’ANCOVA est robuste face au non-respect des conditions d’application du test lorsque les tailles des échantillons sont approximativement égales (Huitema, 1980; Hamilton, 1977). Lorsqu’il y a une violation importante des conditions et que les tailles des échantillons sont inégales, le recours à des méthodes non paramétriques au lieu de l’ANCOVA peut être envisagé. Plusieurs techniques non paramétriques qui utilisent les rangs ont été proposées. Iman et Conover (1982) ont proposé une solution non paramétrique dans laquelle la variable dépendante et la covariable sont remplacées par leur rang respectif. L’analyse est alors effectuée de la même manière que l’ANCOVA paramétrique en utilisant les rangs comme données; il s’agit de la solution non paramétrique la plus simple. Des groupes de rangs liés sont remplacés par le rang moyen de chaque groupe. Shirley (1981) et Quade (1967) présentent d’autres méthodes non paramétriques.
8.3.4 Transformations
La transformation des données peut souvent aider à améliorer la normalité et à uniformiser les variances (atténue le non-respect des conditions d’application des tests). Un examen de la relation entre les moyennes et les variances peut aider à trouver le type de transformation le plus approprié (Green, 1979). La loi de la puissance de Taylor (Taylor, 1961), qui examine la relation entre les moyennes des traitements et les variances, peut être utilisée pour déterminer les transformations spécifiques pour normaliser les données ou homogénéiser les variances (Green, 1979). Les transformations logarithmiques sont souvent adoptées parce que les mesures biologiques sont fréquemment considérées comme suivant une échelle logarithmique ou exponentielle (Peters, 1983). On notera qu’il ne faut pas ajouter 1 aux valeurs avant de d’effectuer une transformation logarithmique des données aux fins de l’ESEE, car cela aurait des effets indésirables sur les variances calculées lorsqu’on change les unités de mesure. Si les transformations ne parviennent pas à produire des données qui satisfont approximativement aux conditions, il peut être nécessaire d’avoir recours à des statistiques non paramétriques.
8.3.5 Niveau de réplication
Pour chacune des analyses par ANOVA et ANCOVA, le nombre de répétitions (taille de l’échantillon, n) correspond au nombre de poissons récoltés. La taille minimale de l’échantillon recommandée est de 20 poissons sexuellement matures par sexe (et un supplément de 20 poissons sexuellement immatures si on échantillonne des espèces de petite taille) pour chacune des deux espèces sentinelles et pour chaque zone exposée et de référence. Si l’on dispose de données appropriées, une analyse de puissance devrait être effectuée pour déterminer la taille de l’échantillon.
8.3.6 Critères d’effet et d’appui
8.3.6.1 Taille selon l’âge
Les taux de croissance sont souvent exprimés par la relation entre la taille (poids ou longueur) et l’âge. Pendant toute la durée de vie d’un poisson, cette relation est généralement curviligne, le taux d’accroissement déclinant à mesure que le poisson approche de la limite de sa durée de vie (Ricker, 1975). Puisque l’échantillonnage vise souvent uniquement les poissons adultes, il est impossible de calculer le taux de croissance selon l’approche classique. Toutefois, aux fins du Programme d’ESEE, la croissance peut être déduite à partir des estimations de la taille selon l’âge établies pour chaque zone à l’aide de l’ANCOVA. Aux fins de ce calcul, on suppose que la relation entre la taille et l’âge d’un poisson adulte est approximativement log-linéaire (log de la taille en fonction du log de l’âge) (Bartlett et al., 1984).
La taille selon l’âge peut être estimée en calculant la régression entre la taille du corps (poids ou longueur) et l’âge pour chaque zone d’échantillonnage (zone de référence et zone exposée). Il est recommandé d’utiliser la longueur et le poids pour calculer la taille selon l’âge, car il est alors possible de déterminer laquelle de ces deux mesures fournit la meilleure régression (dont la valeur du R2 est la plus élevée).
8.3.6.2 Poids des gonades, poids du foie, condition et fécondité
Le poids relatif des gonades et du foie (ainsi que la fécondité) sont calculés par régression et analysés au moyen de l’ANCOVA en utilisant le poids corporel comme covariable. De même, la condition est obtenue en calculant la régression de la relation entre le poids et la longueur du poisson, et elle reflète essentiellement le degré d’adiposité des poissons dans chaque zone.
Divers indices ont été utilisés en biologie halieutique pour décrire la condition des poissons (Bolger et Connolly, 1989). Le calcul du rapport d’une variable à une autre a été utilisé pour en dériver un grand nombre. Voici des exemples d’indices couramment utilisés:
- coefficient de condition (k) = 100 × (poids corporel/longueur3);
- indice gonadosomatique (IGS) = 100 × (poids des gonades/poids corporel);
- indice hépatosomatique (IHS) = 100 × (poids du foie/poids corporel).
Toutefois, les chercheurs sont devenus, de façon générale, plus prudents lorsqu’ils utilisent des variables dérivées et des rapports de variables, parce que ceux-ci peuvent présenter des propriétés statistiques indésirables (Green, 1979; Jackson et al., 1990). Bien que ces indices puissent être utilisés à des fins d’information, il est préférable, sur le plan statistique, d’estimer (et d’analyser) les paramètres à partir des droites de régressions calculées pour les variables originales (c.‑à‑d. ANCOVA) plutôt que les rapports (Gibbons et al., 1993).
8.3.6.3 Âge moyen
Le calcul de l’âge moyen fournit une approximation de la distribution de l’âge des poissons adultes prélevés dans chacune des zones. Il est possible d’estimer la variabilité de l’âge moyen des poissons grâce à l’ANOVA. L’erreur quadratique moyenne (EQM) du modèle est la meilleure estimation de la variabilité. Il est aussi possible d’analyser de cette façon les différences de longueur et de poids entre les sites. Il est indispensable d’uniformiser l’emploi des dispositifs d’échantillonnage d’une zone à l’autre, car la plupart des méthodes d’échantillonnage sont sélectives pour certaines classes d’âge.
8.3.6.4 Âge à la maturité
L’âge à la maturité est un paramètre souvent utilisé en biologie halieutique. Cependant, rares sont les méthodes de calcul qui comportent une mesure du niveau de confiance ou de variabilité statistique. Par conséquent, il est conseillé de procéder à l’estimation de l’âge à la maturité en utilisant une analyse traditionnelle des probits, analogue à celle de la détermination des concentrations létales médianes (CL50), dans les essais de toxicité. En déterminant la proportion (pourcentage) d’individus sexuellement matures dans chaque classe d’âge adulte, et après conversion de ces données en probits (ou tracé de ces données sur le papier probit), on obtient une relation linéaire (probit sur log de l’âge), qui permet d’estimer l’âge auquel 50 % des poissons échantillonnés sont sexuellement matures. On peut obtenir une estimation de la variabilité de l’âge à la maturité entre les poissons à partir de la pente de la droite. La pente estime le rapport 1/écart-type. Par conséquent, l’écart-type est estimé par le rapport 1/pente. En utilisant les données recueillies au cours de plusieurs phases, on peut calculer les limites de confiance sous forme d’estimations de la précision et de comparaisons statistiques des valeurs pour chaque zone. La plupart des logiciels de statistiques peuvent convertir les pourcentages en probits, et il existe plusieurs petits logiciels conçus pour effectuer l’analyse CL50//probits et générer des limites de confiance. Pour plus de renseignements sur l’analyse par la méthode des probits, voir Hubert (1980). Pour connaître les facteurs à considérer dans l’utilisation de la méthode des probits et d’autres méthodes en vue d’estimer l’âge à la maturité, consulter Trippel et Harvey (1991).
8.3.7 Analyse statistique de l’échantillonnage non létal
En ce qui concerne l’échantillonnage non létal, les distributions de fréquence des longueurs devraient être comparées au moyen du test de Kolmogorov-Smirnov (K-S) pour deux échantillons. Gray et al. (2002) ont analysé les jeunes de l’année séparément, afin d’évaluer la variabilité des taux de croissance selon l’âge.
Le test de K-S est une analyse robuste qui permet de déterminer si deux séries de données diffèrent de manière significative; il peut être utilisé pour étudier les distributions relatives des données. Il s’agit d’un test non paramétrique permettant d’estimer la similarité de deux fonctions de distribution cumulative de deux bases de données (Sokal et Rohlf, 1995) :
H0: F(X) = F(Y); H1: F(X) ≠ F(Y)
Les différences sont considérées comme significatives lorsque p < 0,05.
L’ANOVA peut être effectuée sur la longueur et le poids. Il peut être nécessaire de transformer les données. Au besoin, une analyse post hoc des différences entre les sites peut être effectuée au moyen du test HSD (Honestly Significant Difference) de Tukey.
L’ANCOVA devrait être effectuée pour la taille en fonction de l’âge (si possible) et pour le coefficient de condition (longueur par rapport au poids, par site). Les analyses devraient déterminer l’existence de régressions significatives et d’une interaction significative entre les zones. Si les pentes sont égales, les données devraient être examinées pour déterminer la différence entre les zones, déterminer quelle zone présente les plus grandes valeurs, le pourcentage de différence entre les zones, et la valeur de p pour la pente ou les différences moyennes ajustées. S’il y a une interaction, présenter les données sous forme de graphique pour voir s'il est possible de les interpréter.
8.3.8 Assurance et contrôle de la qualité des données et analyse (erreurs et valeurs aberrantes)
Des directives sur l’AQ/CQ pour l’analyse des données se trouvent plus bas. L’importance d’assurer la qualité des données ne peut être trop soulignée. Chaque chapitre où ces aspects sont pertinents donne des instructions complémentaires sur l’AQ/CQ dans la conception de l’étude, l’uniformité des méthodes et des mesures et la définition des protocoles et des procédures.
Parmi les divers types d’erreurs fréquemment commises lors de la saisie des données, mentionnons les erreurs de transcription, telles que l’inscription de la mauvaise espèce, du mauvais sexe ou stade de développement et de valeurs décimales erronées ou tronquées. Il est indispensable d’examiner les données afin de repérer les données erronées ou aberrantes avant d’entreprendre l’analyse des données. Les erreurs d’entrée ou de transcription et les données non valides sont impossibles à détecter dans les rapports finaux.
Il est parfois facile de repérer les erreurs de saisie en utilisant des graphiques de dispersion de la longueur en fonction du poids, du poids en fonction du poids des gonades et du poids en fonction du poids du foie pour la recherche des valeurs aberrantes. Les erreurs de saisie sont relativement faciles à corriger et peuvent être entrées à nouveau. S’il est impossible de régler le problème à cause d’erreurs ou d’omissions évidentes dans le fichier original de données, il faudrait exclure les individus en cause (point de données) de la série de données.
Les erreurs et les valeurs aberrantes contribuent à accroître la variance et réduisent la puissance pour détecter des différences significatives dans l’ensemble de données. Pour évaluer les données aberrantes, il faut examiner les données brutes, les conditions de terrain et le processus de collecte des données. Des points de données différents, mais qui ne sont pas dus à des erreurs de saisie, peuvent apparaître pour diverses raisons. Par exemple, un certain nombre de poissons peuvent sembler malades ou endommagés ou présenter des caractéristiques aberrantes sans raison apparente, ou encore les données aberrantes peuvent refléter un phénomène important qui fait partie de la réponse aux agents de stress à l’étude.
Dans le premier cas, il se peut qu’un petit nombre de poissons soient effectivement malades ou aient subi des dommages (d’une façon qui n’a aucun rapport avec les agents de stress à l’étude), et ils devraient être exclus de l’ensemble de données pour l’interprétation. Ces données apparaissent généralement comme des points isolés par rapport à l’ensemble de données principal. Il peut s’agir, par exemple, de poissons dont la queue a été amputée par un prédateur ou qui présentent une malformation ou une blessure à la mâchoire nuisant à leur alimentation, ou encore de poissons qui sont devenus aveugles à cause d’une blessure et qui sont plus maigres que les autres. Dans ces situations, les spécimens devraient être retirés de la comparaison.
Si la présence de données aberrantes rares ne peut être expliquée, il faudrait effectuer les analyses avec et sans les observations suspectes en vue de déterminer leur impact sur les conclusions. Si ces observations influent sur le fait qu’une relation soit significative ou non, il faut se reporter aux manuels de statistique pour déterminer s’il convient de les inclure ou non dans les analyses.
Enfin, dans le troisième cas, plusieurs poissons sont nettement différents, mais pourraient quand même faire partie de la relation étudiée. Chez d’autres poissons, la maturation sexuelle peut être retardée par des agents de stress environnementaux. Dans un tel cas, plusieurs poissons apparaîtraient comme des données aberrantes. Tel qu’il a été mentionné plus haut, il est recommandé d’effectuer les analyses en incluant dans un premier temps les données aberrantes (pour vérifier s’il y a des différences entre les sites), puis en les excluant (pour déterminer si ces poissons présentent un niveau de développement des gonades normal).
Parfois, il arrive également que certains poissons d’une population soient différents, par exemple s’ils sautent une année de fraie. Si l’un des objectifs de l’étude est d’évaluer les impacts sur la fraie, l’analyse devrait permettre d’examiner séparément les impacts potentiels sur les reproducteurs et sur les non‑reproducteurs. Les spécimens qui sautent une saison de reproduction se reconnaissent habituellement comme des données aberrantes négatives dans un tracé du poids des gonades en fonction du poids corporel, ce qui signifie que la distribution des résidus de l’ANCOVA présentera une asymétrie vers la gauche et ne suivra pas une distribution normale. Ces individus devraient être exclus des analyses des variables associées à la reproduction et, possiblement, des analyses de toutes les variables. Les réductions de variance ainsi réalisées vont généralement compenser toute perte de puissance causée par la réduction de la taille de l’échantillon. Si les femelles qui sautent une année de reproduction sont exclues des analyses, leur exclusion devrait être effectuée de façon objective (Environnement Canada, 1997). De plus, la fréquence des individus sautant une saison de reproduction dans la zone de référence et dans la zone exposée devrait être fournie, au cas où cette caractéristique serait liée à l’exposition. Il est beaucoup plus difficile d’identifier les mâles qui sautent une année de reproduction (s’il se trouve que ce phénomène se produit).
8.4 Effets sur l’exploitabilité des ressources halieutiques
L’examen du potentiel d’utilisation des ressources halieutiques a pour but de déterminer si l’effluent a eu des répercussions sur les poissons au point de limiter leur utilisation par les humains. L’exploitabilité des poissons peut être affectée par une modification de l’apparence, une altération du goût ou de l’odeur, ou des concentrations de contaminants dans les tissus qui dépassent les lignes directrices pour la consommation humaine et les concentrations mesurées dans la zone de référence. Le tableau 8-5 présente les critères d’effet et d’appui et les statistiques appropriées (ou lignes directrices) qui s’appliquent à l’exploitabilité des ressources halieutiques.
| Variable | Méthode statistique | |
|---|---|---|
| Critère d’effets1 | Contaminants dans les tissus des poissons (mercure) | ANOVA, et évaluation comparative avec les lignes directrices sur les concentrations dans les tissus |
| Critère d’appui2 | Anomalies physiques | Khi-carré (un test pour chaque classe d’anomalies; le nombre de tests dépendra du nombre de classes d’anomalies présentes chez les poissons capturés) |
| Altération | ANOVA |
1 Les critères d’effets utilisés afin de déterminer « l’effet », soit le dépassement des lignes directrices sur les concentrations dans les tissus. Des différences significatives sur le plan statistique entre les zones de référence et les zones d’exposition peuvent aussi être pertinentes (REMM, annexe 5, alinéa 9c).
2 Ces analyses sont effectuées à des fins informatives, et les différences significatives entre les zones de référence et les zones exposées ne sont pas nécessairement utilisées pour indiquer un effet.
8.4.1 Mercure dans les tissus de poissons
L’une des méthodes servant à évaluer le potentiel d’utilisation des poissons consiste à mesurer les concentrations de contaminants préoccupants dans les tissus des poissons prélevés dans la zone exposée et la zone de référence. Les contaminants peuvent être jugés préoccupants s’ils sont présents dans l’effluent et si des seuils pour la consommation humaine sont fixés dans des directives au sujet de ces contaminants. Les habitudes locales de consommation et les pêches commerciales devraient indiquer quelles sont les espèces de poissons et les tissus comestibles (p. ex. foie, reins, os, chair ou même poisson entier) à analyser. Le chapitre 3 donne des détails sur les méthodes permettant de déterminer si certains contaminants devraient être recherchés dans les analyses. Cette décision dépend en partie des données recueillies antérieurement sur les concentrations de contaminants dans les tissus des poissons et dans l’effluent.
Les mines sont tenues de mesurer les concentrations de mercure dans les tissus des poissons si elles détectent du mercure dans l’effluent (durant la caractérisation de l’effluent – chapitre 5) à une concentration dépassant 0,10 mg/L. Aux termes du REMM, un effet sur les tissus des poissons signifie des mesures de la concentration du mercure total dans les tissus de poissons, prises dans la zone exposée, supérieures à 0,5 µg/g (poids humide), présentant une différence statistique et ayant une concentration plus élevée par rapport à celles mesurées dans les tissus de poissons prises dans la zone de référence. Parmi les autres contaminants préoccupants liés aux mines de métaux pour un site particulier, on retrouve le cuivre, le zinc, le manganèse, le cyanure, le radium et l’uranium.
Le chapitre 3 recommande d’effectuer des analyses des tissus sur cinq échantillons composites (chacun composé d’au moins huit poissons) d’une seule espèce (de préférence du même sexe) pour chacune des zones. La taille d’échantillon (n) pour l’ANOVA est donc de cinq. La répétition serait alors suffisante pour permettre de détecter une ampleur de l’effet de ± 2 ET à une puissance = 0,9, si a et b sont fixés à 0,1 (voir la section 3.0). Il faut donc accorder beaucoup d’attention à l’ampleur de l’effet à retenir pour un contaminant préoccupant particulier, et déterminer si des répétitions supplémentaires se justifient. Si on établit que des tailles moindres de l’effet (c.-à-d. moins de 2 ET) ou des niveaux de puissance plus élevés seraient mieux adaptés au contaminant, il sera nécessaire d’accroître la taille de l’échantillon en analysant un plus grand nombre d’échantillons composites.
Le pourcentage de lipides et le pourcentage d’eau doivent être rapportés pour chaque échantillon de tissus. Ces données n’ont toutefois qu’une valeur d’information, pour aider à l’interprétation des données, et des différences statistiques dans les pourcentages de lipides ou d’eau ne constituent pas un effet.
8.4.2 Anomalies physiques
L’exploitabilité des ressources halieutiques peut être affectée par une modification de leur apparence. Les données recueillies pendant les études de suivi biologique doivent être utlisées pour identifier le sexe des poissons capturés et indiquer la présence de toute lésion, tumeur et de tout parasite ou de toute autre anomalie (REMM, annexe 5, alinéa 16b)). Les anomalies évidentes comprennent :
- des tumeurs ou des lésions à la surface du corps (ce qui inclut les yeux, les lèvres, le museau, les branchies);
- des malformations de la colonne vertébrale;
- des nageoires usées, effrangées ou hémorragiques;
- d’autres malformations physiques;
- des parasites visibles.
Pour chaque classe d’anomalies signalée, il faudrait effectuer une comparaison entre les poissons de la zone de référence et de la zone exposée à l’aide d’un test du khi-carré de la qualité de l’ajustement pour les fréquences relatives. Cette information sert à mieux interpréter les effets, bien que, aux fins de l’ESEE, une différence significative ne signale pas nécessairement un effet. Le nombre de tests statistiques nécessaires dépendra du nombre de classes d’anomalies notées chez les poissons capturés. La taille de l’échantillon aura été déterminée par le nombre de poissons prélevés pour l’étude des poissons. Cohen (1988) donne des indications sur la puissance d’un test du khi-carré qui serait obtenue à ce niveau de répétition.
8.5 Évaluation et interprétation des données sur la communauté d’invertébrés benthiques
Les données recueillies pendant l’étude de la communauté d’invertébrés benthiques doivent être utilisées pour déterminer les indicateurs d’effet suivants (REMM, annexe 5, sous-alinéa 16a)(iii)) :
- densité totale des invertébrés benthiques;
- indice de régularité;
- richesse des taxons;
- indice de similarité (indice de Bray-Curtis).
Les indicateurs d’effet ci-dessus doivent être utilisés pour déterminer les différences significatives sur le plan statistique entre les zones de référence et les zones exposées ou le long d’un gradient d’exposition. Voir le chapitre 4 pour plus de renseignements sur ces indicateurs d’effet. La moyenne, la médiane, l’écart-type, l’erreur type et les valeurs minimales et maximales sont déterminés pour chacun critère d’effet pour les zones d’échantillonnage. De plus, une analyse des résultats sera utilisée afin de déterminer s’il y a une différence statistique entre les zones d’échantillonnage pour chacun des indicateurs d’effet (REMM, annexe 5, sous-alinéa 16c)).
8.5.1 Plans d’étude et méthodes statistiques
Le tableau 8-6 définit les méthodes statistiques appropriées s’appliquant à l’analyse de chacun des plans d’étude recommandés. Voir le chapitre 4 pour obtenir plus de renseignements sur ces plans d’étude. À la différence de l’étude des poissons, la méthode statistique employée pour déterminer la présence d’un effet dépend du plan d’étude choisi parmi les sept plans possibles. Pour une étude donnée, les quatre indicateurs d’effet sont analysés à l’aide de la même méthode statistique, déterminée par le plan d’étude. La seule exception est l’approche des conditions de référence, qui utilise d’autres méthodes statistiques qui ne nécessitent pas de comparaisons de ces quatre indicateurs entre les zones, à moins qu’elle ne soit accompagnée d’ANOVA; les méthodes pour ce plan d’étude sont décrites ci-après et dans le chapitre 4.
| Plan d’étude | Méthode statistique |
|---|---|
| Contrôle-impact (C-I) | ANOVA |
| Contrôle-impact multiple (C-IM) | ANOVA |
| Avant-après–contrôle-impact (BACI) | ANOVA |
| Gradient linéaire (GL) | Régression/ANOVA |
| Gradient radial (GR) | Régression/ANOVA |
| Gradients multiples (GM) | ANCOVA |
| Approche des conditions de référence (ACR) | Multivariable/ANOVA |
Note : Des analyses multivariables des données recueillies à l’aide d’un des plans énumérés ci-dessus peuvent être effectuées pour distinguer des tendances qui peuvent être utiles pour déterminer des zones potentiellement préoccupantes. Dans certaines circonstances, l’ANCOVA peut aussi être appropriée pour ces plans d’étude (p. ex., pour éliminer l’effet d’une variable environnementale de confusion).
Bien qu’il soit possible d’utiliser l’ANOVA pour analyser les données recueillies dans la plupart des plans d’étude mentionnés au tableau 8-6, l’ANOVA s’applique surtout aux plans contrôle-impact (C-I) et contrôle-impact multiple (C-IM). Le plus simple de ces plans est le plan C-I (ou référence-exposition). Dans les rivières, par exemple, cela consiste à définir une zone de référence (généralement en amont), et une ou plusieurs zones exposées en aval. Le chapitre 4 propose différentes façons de concevoir les plans C-I. Dans ce type de plan d’étude, l’ANOVA est utilisée pour comparer la zone de référence et la zone exposée, une différence significative signalant un effet.
Le plan C-IM est semblable au plan C-I, à la différence qu’il emploie des zones de référence additionnelles qui sont situées dans des bassins versants ou des baies adjacents où l’habitat échantillonné est comparable à celui de la zone exposée. Ce type de plan aide à atténuer les problèmes posés par les facteurs de confusion (p. ex., quand une zone de référence unique diffère d’une zone exposée sur le plan de plusieurs variables environnementales, en plus de l’influence de l’effluent). Comme dans le cas du plan C-I, une différence significative entre une zone exposée et la moyenne des zones de référence, déterminée par l’ANOVA, signalerait un effet.
L’ANCOVA peut aussi être utilisée pour les plans C-I et C-IM pour tenir compte des covariables qui pourraient créer un « bruit de fond » rendant difficile la comparaison des zones de référence et d’exposition avec l’ANOVA. Par exemple, sans l’application de l’ANCOVA, les différences de profondeur entre les stations pourraient masquer les différences liées à l’effluent pouvant exister entre les zones d’exposition et de référence. Cette situation peut survenir lorsque les indicateurs mesurés dans l’étude de la communauté d’invertébrés benthiques changent le long d’un gradient croissant de profondeur et qu’il est impossible de prélever les échantillons à des profondeurs identiques. Dans cet exemple, l’ANCOVA peut être utilisée pour éliminer l’effet de la covariable « profondeur » afin de mettre en évidence l’effet de l’exposition à l’effluent. Cette même approche peut être employée avec d’autres covariables influant sur les indicateurs des invertébrés benthiques le long d’un continuum.
Les plans C-I et C-IM peuvent être améliorés lorsque des données sont recueillies avant et après le début du rejet de l’effluent dans le milieu récepteur. Ce type de plan de suivi a été nommé « avant-après–contrôle-impact » (BACI, de before/after-control/impact) (Schmitt et Osenberg, 1996). Son utilisation aide à distinguer les effets de l’effluent par rapport aux différences naturelles entre les zones de référence et les zones exposées qui existaient déjà avant le rejet de l’effluent.
Dans sa forme la plus simple, un plan BACI nécessite la collecte de données de suivi au moins une fois avant et une fois après le début du rejet de l’effluent dans une zone de référence et dans une zone exposée, puis les données sont analysées par ANOVA factorielle superfie-temps (Green, 1979). Dans cette situation, l’existence d’un effet de l’effluent est inférée quand le terme d’interaction superficie-temps dans l’ANOVA est significatif. Quand les zones de référence et exposée ont été échantillonnées de manière répétée pendant la période avant et la période après le rejet, il est possible de recourir à une analyse BACI pour séries appariées; dans ce cas, les effets potentiels sont étudiés en analysant le changement de la valeur de delta (différence entre les zones de référence et les zones exposées), de la période avant à la période après le rejet (Schmitt et Osenberg, 1996). Il est possible d’améliorer ce plan en intégrant plusieurs zones de référence (Schmitt et Osenberg, 1996; Underwood, 1997).
À la différence des plans C-I et C-IM, le plan par gradient linéaire (GL) et le plan par gradient radial (GR) se prêtent mieux à l’analyse de régression. Les conditions d’application de l’analyse de régression s’appliquent aussi à l’analyse des données des communautés d’invertébrés benthiques; elles ont déjà été décrites dans la section 8.3.3.2, dans la discussion portant sur l’ANCOVA (la régression est une composante de l’ANCOVA).
Pour plus de renseignements sur les plans d’étude, voir les chapitres 2 et 4.
8.5.2 Traitement des données
Comme pour l’étude des poissons, les données doivent être présentées sous forme de graphiques et de tableaux pour chaque zone présentée (zones de référence et exposées). Les données fournies doivent inclure les statistiques descriptives (moyenne, médiane, écart-type, erreur type et les valeurs minimales et maximales), ainsi que la taille des échantillons. Les données provenant de plans par gradient doivent être présentées sous forme de diagrammes de dispersion des variables en fonction de la distance par rapport au point de rejet de l’effluent. Pour les plans par gradient sans « zones » bien définies, une présentation sous forme de tableau avant l’analyse principale serait applicable aux statistiques sommaires par station, l’unité d’échantillonnage étant alors le sous-échantillon de terrain plutôt que la station. Les statistiques sommaires par station devraient aussi être présentées pour les plans de type contrôle-impact dans les cas où les sous-échantillons de terrain ne sont pas regroupés avant l’identification des taxons, bien que les principales statistiques sommaires utilisées pour déceler un effet soient celles calculées pour les zones entières (afin de faciliter l’interprétation des différences significatives [« effets »] entre les zones).
Les mêmes trois principales étapes d’analyse décrites à la section 8.3.3 devraient être suivies pour déterminer si des « effets » statistiquement significatifs se sont produits :
- Les données devraient être examinées pour déterminer si elles satisfont aux conditions d’application du test ou de la méthode statistique employée (ANOVA, ANCOVA, régression ou analyses multivariables).
- La méthode statistique appropriée est appliquée après l’examen des données et leur transformation, le cas échéant (ou application d’une méthode non paramétrique).
- Les principaux résultats pour les indicateurs d’effet devraient alors être présentés de façon à indiquer clairement si un effet statistique a été observé, en indiquant les détails sur la nature de l’effet (dont sa direction et son ampleur). Là encore, un effet statistique est signalé si la valeur de p est inférieure à la valeur dea déterminée a priori, selon les directives de la section 8.6.
Les mêmes considérations statistiques et contraintes présentées dans la section 8.3.3 pour l’ANOVA et l’ANCOVA s’appliquent aussi aux analyses des communautés d’invertébrés benthiques effectuées avec ces deux méthodes statistiques. Ainsi, l’examen, l’analyse et l’interprétation des données lorsqu’on utilise l’ANOVA ou l’ANCOVA pour l’étude de la communauté d’invertébrés benthiques devraient suivre les recommandations générales présentées à la section 8.3.3.
Les plans par gradient sont particulièrement utiles 1) dans les situations où la dilution rapide de l’effluent empêche la sélection d’une zone exposée présentant des concentrations d’effluent relativement homogènes, et 2) pour déterminer sur quelle distance le long de la trajectoire de l’effluent les effets sont observés (c.-à-d. déterminer l’étendue géographique des « effets »). L’étendue géographique des « effets » peut être déterminée graphiquement en traçant un diagramme de la ou des variables dépendantes en fonction de la distance du point de rejet de l’effluent, et en examinant les données pour repérer un point d’inflexion où la variable converge de façon asymptotique vers la condition de référence. Les données des stations d’échantillonnage ainsi organisées pourraient aussi être utilisées, avec les données physicochimiques mesurées, dans une analyse multivariable (p. ex., ordination ou groupement) utilisée pour identifier les stations éloignées qui tendent à se regrouper avec les stations de référence, et celles qui se regroupent avec des stations nettement perturbées.
Ces deux approches (représentation graphique et analyse multivariable) recherchent des tendances dans les données pour déterminer qualitativement l’étendue géographique approximative d’un effet. Il ne s’agit pas de tests d’hypothèses; par conséquent, dans le contexte du Programme d’ESEE, ces approches ne servent pas à signaler un effet avec une certitude suffisante pour justifier des mesures d’intervention, mais elles sont plutôt utiles à des fins d’information.
Néanmoins, il est possible d’effectuer des tests statistiques pour certains gradients. Dans le cas le plus simple, un effet statistiquement significatif serait attesté si la pente de la régression d’une variable en fonction de la distance du point de rejet de l’effluent est significativement différente de zéro, ou si le coefficient de corrélation est statistiquement significatif (il peut être nécessaire de transformer les données pour satisfaire aux conditions de linéarité). Dans ce cas, l’effet est un gradient relativement uniforme de valeurs de la variable à partir du point de rejet de l’effluent, plutôt qu’un effet dans une zone distincte donnée.
Un effet peut aussi être signalé par l’existence d’une différence significative entre la zone exposée et la zone de référence déterminée par ANOVA en comparant un groupe de stations le long du gradient proche de la mine à des stations de « référence » situées le long du gradient éloigné de la mine. Cette démarche est analogue à l’approche C-I, et suppose un certain degré d’uniformité de l’exposition au sein du groupe de stations exposées et au sein du groupe de stations de « référence ». En outre, les deux groupes de stations doivent être assez éloignés pour présenter des différences nettes d’exposition, et il faut que le nombre de stations dans chaque groupe soit suffisant pour atteindre le degré souhaité de puissance. En se fondant sur l’analyse de puissance dont il est question dans la section suivante, la recommandation initiale est de sélectionner au moins cinq stations plutôt uniformes situées près de l’effluent (zone fortement exposée à l’effluent) et cinq autres stations suffisamment uniformes et éloignées de l’effluent pour être considérées comme étant représentatives d’une zone de référence (impact minimal de l’effluent). Si des stations sont ajoutées entre ces deux groupes, un total d’au moins 15 stations sera nécessaire pour couvrir tout le gradient.
Quelle que soit la méthode d’analyse utilisée, la puissance statistique est habituellement améliorée lorsqu’on augmente le nombre de stations (répétition) aux deux extrémités du gradient. Il est également important de prolonger le gradient suffisamment loin de la mine (dans la mesure du possible) afin de permettre l’échantillonnage de stations les moins perturbées possible (équivalent à des stations de « référence »).
Si l’on dispose d’un nombre suffisant de sous-échantillons par station, il est aussi possible d’utiliser l’ANOVA pour déterminer la présence ou l’absence d’un effet à une station donnée. Cela suppose que les sous-échantillons de terrain sont utilisés comme répétitions (on traite alors les stations comme des zones), et que les comparaisons par ANOVA sont effectuées station par station le long du gradient, en partant des stations fortement exposées à l’effluent, jusqu’aux stations de référence les plus éloignées. Cette méthode d’analyse peut servir à déterminer l’endroit sur un gradient où un effet disparaît à un niveau de signification a donné. Cette approche peut toutefois nécessiter un effort d’échantillonnage considérable, selon le nombre de stations le long du gradient et le nombre de sous-échantillons requis par station d’après l’analyse de puissance.
Dans les cas où ces types de tests statistiques ne sont pas adéquats pour un plan par gradient donné, il sera nécessaire de revoir la conception du programme de suivi de façon à assurer que les analyses statistiques appropriées puissent être appliquées pendant la prochaine étude de suivi. Le plan révisé peut comporter un plus grand nombre de réplicats ciblant les zones (ou stations) exposées et de référence clés qui doivent être comparées (p. ex., augmentation des réplicats dans la zone la plus fortement exposée à l’effluent et dans la zone la moins exposée à l’effluent représentant le mieux les conditions de référence).
Dans certains cas, il peut être nécessaire de comparer les gradients de la zone exposée aux gradients de la zone de référence. C’est le cas lorsqu’un gradient environnemental coexistant (covariable) (non lié à la mine) vient confondre les effets de l’effluent dans la zone exposée. À l’aide d’un plan par gradients multiples, il est alors possible d’effectuer des comparaisons statistiques entre le gradient de la zone exposée et un gradient environnemental similaire (non lié à la mine) dans une zone de référence non exposée. La profondeur et l’habitat du gradient de référence devraient être aussi similaires que possible à ceux du gradient de la zone exposée. Il faudrait tester les « effets » potentiels de l’effluent en utilisant l’ANCOVA pour comparer les élévations des droites de régression (moyennes ajustées) de la zone de référence et de la zone exposée tout en tenant compte de l’influence de la covariable environnementale .
Par exemple, si le gradient d’exposition à l’effluent à partir de la mine était caractérisé par une augmentation simultanée de la profondeur, on pourrait effectuer une comparaison par ANCOVA avec une zone de référence où le gradient de profondeur est le même. Si les pentes des régressions de la zone de référence et de la zone exposée en fonction de la covariable (X = profondeur) sont à peu près égales, alors une différence significative des moyennes ajustées indiquerait un « effet » de l’effluent sur l’indicateur d’effet Y (p. ex., la richesse taxonomique). Encore une fois, la section 8.3 fournit des détails sur la réalisation des ANCOVA et sur les différentes façons d’utiliser ces analyses pour déterminer la présence d’un effet.
8.5.3 Approche des conditions de référence
L’approche des conditions de référence (ACR) est un plan d’étude qui combine l’examen de tendances multivariables dans les données à des évaluations visant à déterminer si les stations exposées se retrouvent à l’extérieur d’une ellipse de probabilité pour les stations de référence. Le concept fondamental de l’ACR est l’établissement d’une base de données de stations qui représentent des conditions non perturbées (stations de référence), où des variables biologiques et environnementales sont mesurées. Cette base de données sert à élaborer des modèles prédictifs qui associent un ensemble de variables environnementales à des conditions biologiques. Une fois les modèles mis au point, une série de mesures environnementales peuvent être effectuées à une nouvelle station, puis ces mesures sont utilisées dans le modèle afin de prévoir les conditions biologiques à cette nouvelle station. La comparaison de la condition biologique réelle de la nouvelle station (zone exposée) avec les conditions existant aux stations de référence auxquelles la nouvelle station appartient selon les prévisions du modèle permet d’évaluer s’il existe un effet à la station exposée.
La base de données sur les conditions de référence est établie au moyen d’un programme d’échantillonnage normalisé mis en œuvre à des échelles spatiales très diverses. Le même protocole d’échantillonnage des macroinvertébrés benthiques est utilisé dans le plus grand nombre possible d’écorégions et d’ordres de cours d’eau ou de lacs dans un bassin versant. Un certain nombre de variables environnementales sont mesurées pendant l’échantillonnage des invertébrés. Les données recueillies sont ensuite soumises à une analyse multivariable à trois étapes dans le cadre de laquelle :
- un certain nombre de groupes d’invertébrés sont définis d’après la similarité de la structure des communautés;
- les données biologiques sont corrélées avec des variables environnementales, et un ensemble optimal de variables environnementales permettant de prédire la répartition dans les divers groupes est établi;
- la condition biologique des stations exposées est évaluée en utilisant l’ensemble optimal de variables environnementales est utilisé pour prévoir la répartition dans les divers groupes.
La qualité de l’ajustement de la station exposée au groupe auquel elle a été assignée par le modèle détermine si elle diffère du groupe de référence et, le cas échéant, l’ampleur de la différence. Si une station ou un groupe de stations se retrouvent à l’extérieur de l’ellipse de probabilité déterminée statistiquement pour les stations de référence, cela indique la présence d’un effet. Les limites de l’ellipse de référence devraient être fixées a priori à partir de certaines des considérations présentées à la section 8.6. On trouvera un examen plus complet des hypothèses, des méthodes et de l’interprétation de l’ARC dans Reynoldson et al. (1995, 2000) et Bailey et al. (2003).
Il faut en outre noter que selon le calendrier et la localisation d’un programme d’échantillonnage ARC, il est aussi possible de se servir de la base de données obtenue pour faire des comparaisons par ANOVA entre la zone de référence et la zone exposée en vue de déterminer s’il y a eu un effet. Ce type d’analyse serait analogue à un plan C-IM.
En résumé, une procédure globalement semblable à celle qui est décrite à la fin de la section 8.3 devrait aussi être suivie (avec les modifications nécessaires) pour l’étude de la communauté d’invertébrés benthiques. Cependant, l’analyse de puissance ne s’applique pas aux méthodes graphiques ni à l’ACR. Par conséquent, les études qui utilisent l’ACR devraient être conçues de manière à effectuer une détermination exacte et précise des conditions de référence afin de maximiser les probabilités de détection des écarts par rapport aux conditions de référence aux stations d’exposition, lorsqu’il y en a. Une étude ACR peut comprendre les éléments suivants :
- préparation des analyses : AQ/CQ (y compris la vérification des erreurs de saisie des données), sommaire des facteurs de confusion, description du plan d’échantillonnage et du niveau taxonomique retenu, identification précise des unités d’échantillonnage utilisées pour les comparaisons statistiques (p. ex., stations plutôt que sous-échantillons), vérification de l’équivalence des substrats et des techniques d’échantillonnage entre les différentes zones de référence et exposées qui sont comparées;
- statistiques sommaires (présentation sous forme de graphiques et de tableaux des moyennes, etc., tel qu’il est décrit plus haut);
- analyses statistiques (tests d’hypothèses) pour déterminer les « effets » (ANOVA, ANCOVA, régression);
- méthodes graphiques (p. ex., inspection de la forme des droites de régression; utilisées pour examiner les tendances dans les données plutôt que pour déterminer des « effets »);
- analyses statistiques multivariables servant à déterminer a) les tendances dans les données et b) la position dans un espace multidimensionnel des stations exposées par rapport aux ellipses de probabilité des stations de référence; dans ce cas, seul b) peut servir à déterminer les « effets »;
- analyses de puissance (ne s’appliquent pas aux méthodes graphiques ni à l’ARC).
8.5.4 Critères d’appui
Les critères d’appui suivants devraient aussi être présentés pour les communautés d’invertébrés benthiques, accompagnés de la moyenne, de la médiane, de l’écart-type, de l’erreur type, des valeurs minimales et maximales et de la taille d’échantillon :
- indice de diversité de Simpson;
- densité des taxons (p. ex., famille);
- abondance relative des taxons (p. ex., famille);
- présence/absence des taxons (p. ex., famille).
À la différence des critères d’effets (densité totale des invertébrés benthiques, indice de régularité, richesse des taxons et indice de similarité), les critères d’appui sont inclus à titre de variables complémentaires et ne font pas l’objet d’analyses statistiques pour déterminer des « effets ». Ces variables peuvent toutefois servir à interpréter les effets à des étapes ultérieures (p. ex., déterminer l’ampleur et les causes des « effets »). Elles devraient être présentées sous forme de graphiques et de tableaux pour chaque zone étudiée (zones de référence et zones exposées). Il faut noter qu’il peut exister d’autres descripteurs qui pourraient aussi être utiles pour l’interprétation des données de suivi, en fonction de chaque site (voir l’analyse de Resh et al., 1995).
8.6 Rôle de l’analyse de puissance, de α, de β et du seuil critique d’effet pour déterminer les effets
8.6.1 Établissement de α et β
Lorsque des tests statistiques sont réalisés pour déterminer si les zones exposées diffèrent de façon significative des zones de référence, une faible probabilité d’erreur de type I (α) est généralement fixée, de telle sorte qu’une population ou une communauté normale ne soit pas prise à tort pour une population ou une communauté perturbée. Toutefois, le programme de suivi doit aussi être conçu de façon à offrir une probabilité raisonnablement élevée de détecter statistiquement un seuil critique d’effet (SCE) prédéterminé, le cas échéant. En d’autres termes, la puissance du test doit être élevée. La puissance correspond à 1 – β, β étant l’erreur de type II (voir ci-dessous).
En établissant une grande marge de variation autour de ce qui est considéré normale (non perturbé), le risque de commettre une erreur de type I est en partie réduit. Il faut aussi consacrer un effort d’échantillonnage suffisant pour réduire l’erreur de type II, en tenant compte de la faible probabilité allouée pour l’erreur de type I. Ainsi, pour déterminer l’effort d’échantillonnage nécessaire, il faut prendre en compte et fixer a priori le SCE, l’erreur de type I et l’erreur de type II. Il faut donc prendre des décisions sur la grandeur acceptable des erreurs de type I et de type II pour déterminer la puissance, et donc pour fixer l’effort d’échantillonnage nécessaire pour détecter le SCE recommandé.
L’erreur de type I (probabilité α) est l’erreur qui se produit quand l’hypothèse nulle, selon laquelle il n’y a aucun effet, est rejetée alors qu’en fait elle est vraie (p. ex., une zone exposée est déclarée différente de la zone de référence alors que ce n’est pas le cas).
On commet une erreur de type II (probabilité β) quand l’hypothèse nulle est acceptée alors qu’elle est fausse (p. ex., si la zone exposée est déclarée comme n’étant pas significativement différente de la zone de référence alors qu’elle est réellement touchée). Par conséquent, α constitue le risque pour l’industrie, et β le risque pour l’environnement.
La puissance d’un test statistique est donc 1 – β, la probabilité associée au fait de rejeter à juste titre l’hypothèse nulle quand elle est fausse (p. ex., la probabilité associée à l’identification correcte d’une zone touchée). Dans un programme de suivi bien conçu avec un nombre de répétitions appropriées, le but est de maintenir α et β bas, et la puissance élevée.
Comme le montre l’équation présentée plus loin dans cette section, une façon d’accroître la puissance, étant donné un effort d’échantillonnage fixe (c.-à-d. la taille de l’échantillon), consiste à accroître α. En d’autres termes, il faut faire des compromis lorsqu’on fixe α et β. Traditionnellement, α a été fixé à 0,05 pour les études expérimentales où, dans de nombreux cas, le coût d’une erreur de type II n’est pas particulièrement élevé. Cela signifie qu’une valeur α de 0,05 est habituellement utilisée dans les situations où la principale préoccupation est d’avoir le maximum de confiance qu’un effet statistiquement significatif est réel. Par ailleurs, il y a beaucoup moins de consensus et de publications sur ce qui constitue un niveau approprié pour β. Certaines études ont proposé d’utiliser une puissance minimale de 0,8 (c.-à-d. β = 0,2) (Alldredge, 1987; Cohen, 1988; Burd et al., 1990; Osenberg et al., 1994; Keough et Mapstone, 1995).
Dans de nombreux cas, cette « règle empirique » remonte aux travaux fondamentaux de Cohen sur l’analyse de puissance (voir Cohen, 1988), qui étaient principalement axés sur des applications en sciences du comportement. Pour ce type d’applications, Cohen soutenait que les erreurs de type I devaient vraisemblablement être plus graves que les erreurs de type II dans les cas où la préoccupation principale était de ne pas propager des conclusions erronées fondées sur des déclarations incorrectes de différences significatives. Plus précisément, le chercheur a posé que, si l’on devait considérer les erreurs de type I comme quatre fois plus graves, il serait raisonnable de fixer α à la valeur traditionnelle (pour les études expérimentales) de 0,05 et de fixer β à 4 × 0,05 = 0,2. Il a toutefois signalé que cette règle empirique ne devrait pas être utilisée dans d’autres types d’études où ces hypothèses ne sont pas valides.
Cette mise en garde s’applique aux études de suivi environnemental où, à cause du coût potentiellement élevé (tant écologique que financier) de la non-détection d’impacts négatifs, de nombreux chercheurs du domaine de la biosurveillance soutiennent que a devrait être fixé au moins au même niveau que β (p. ex., Alldredge, 1987; Underwood, 1993; Mapstone, 1995). En d’autres termes, on a souvent soutenu que, sauf circonstances atténuantes, le risque pour l’environnement ne devrait pas être fixé à un niveau plus élevé que le risque pour l’industrie. Le point de départ le plus raisonnable consisterait donc à fixer α = β, et c’est la position adoptée par le Programme d’ESEE. Toutefois, selon les conditions propres à chaque site, il faut parfois décider 1) de fixer α > β si l’on peut montrer que le risque pour l’environnement est plus préoccupant que le risque pour l’industrie, ou 2) de fixer α < β si l’on peut montrer que le risque pour l’industrie est plus préoccupant.
Après avoir décidé d’établir α = β, il est nécessaire de prendre une décision quant à la valeur appropriée de α et β. Dans de nombreux cas, la décision doit être prise en tenant compte de la puissance souhaitée pour le test, du SCE que le programme est conçu pour détecter, et des incidences sur l’effort d’échantillonnage. Ce processus décisionnel peut être illustré par un exemple portant sur l’étude de la communauté d’invertébrés benthiques (tableau 8-7). Dans cet exemple, on examine les effets de différentes valeurs de α et β sur la taille de l’échantillon afin de détecter un SCE égal à ± 2 ET en utilisant l’équation de l’analyse de puissance ci-dessous. Celle-ci fournit la taille approximative de l’échantillon (n) en une étape pour le plan C-I le plus simple pour l’ANOVA (voir aussi des détails supplémentaires dans la section qui suit) (Guenther, 1981; Alldredge, 1987) :
n = (2(Zα + Zβ)2(ET/SCE)2) + 0.25(Zα)2
où :
- n = taille de l’échantillon
- Zα = variable normale centrée réduite pour un niveau de signification α (erreur de type I)
- Zβ = variable normale centrée réduite pour un niveau de signification β (erreur de type II)
- ET = écart-type
- SCE = seuil critique d’effet
| α | 1-β | |||
|---|---|---|---|---|
| 0,99 | 0,95 | 0,90 | 0,80 | |
| 0,01 | 14 | 11 | 10 | 8 |
| 0,05 | 11 | 8 | 7 | 5 |
| 0,10 | 9 | 7 | 5 | 4 |
S’appuyant sur le tableau 8-7 (et sur la recommandation spécifiant que l’étude de la communauté d’invertébrés benthiques devrait au minimum avoir une puissance suffisante pour détecter un SCE de ± 2 ET), le groupe de travail sur les invertébrés benthiques a recommandé de fixer au départ α et β à 0,1. Cela signifiait que, dans la plupart des cas, l’effort d’échantillonnage nécessiterait une taille d’échantillon de 5, valeur qui se trouve dans la plage employée dans de nombreuses études sur le benthos (Resh et McElravy, 1993). Les calculs de l’analyse de puissance pour l’ANOVA de base indiquent aussi que α et β peuvent être fixés à 0,1 pour les critères d’effet de l’étude des poissons, avec très peu d’effet (comparativement à α = 0,05, β = 0,2) sur la taille de l’échantillon nécessaire pour obtenir le niveau de puissance recherché (1 – β). L’utilisation d’un niveau de α ou de β autre que 0,1 nécessiterait une justification appropriée de la part du promoteur ou de l’agent d’autorisation (p. ex., fixer une valeur plus basse et plus rigoureuse pour l’erreur de type II [β] quand le risque pour l’environnement est jugé plus préoccupant). Il peut aussi être nécessaire de consulter l’agent d’autorisation dans les cas où l’analyse de puissance recommande d’avoir recours à des tailles d’échantillon anormalement élevées.
Il faut aussi noter au tableau 8-7 que, si l’on augmente la taille de l’échantillon, il est possible d’obtenir des erreurs de type I et II plus basses (α et β plus bas), tout en maintenant α égal à β. Par exemple, on peut fixer α et β à 0,05, ce qui donne une puissance de 95 % pour détecter un SCE de ± 2 ET, en augmentant la taille de l’échantillon à 8 (tableau 8-7). Le même argument s’applique à d’autres composantes de l’ESEE (p. ex., l’étude des poissons et l’exploitabilité du poisson) pour divers SCE souhaités, mais les tailles d’échantillon nécessaires seront alors différentes. Le fait d’établir α = β constitue donc une incitation économique à mettre en œuvre un programme de suivi bien conçu et comportant les répétitions nécessaires, ce qui permettra de réduire la probabilité de commettre des erreurs de type I (c.-à-d. que a est maintenu bas), réduisant ainsi la probabilité de mener des études complémentaires qui ne sont pas nécessaires. En outre, étant donné que a est lié à b, la capacité du programme de suivi à détecter des effets réels sera aussi accrue. Cette amélioration du plan de suivi permettra de mieux comprendre, le cas échéant, quels types d’effets se produisent.
8.6.2 Analyse de puissance : détermination de la taille d’échantillon requise, de la puissance et du seuil critique d’effet approprié
L’analyse de puissance sert deux grands objectifs pendant l’ESEE :
- au début d’une étude de suivi (a priori), pour calculer l’effort d’échantillonnage (taille de l’échantillon) qui sera nécessaire pour détecter un SCE donné à un niveau de puissance donné;
- à la fin d’une étude de suivi (post hoc), pour déterminer le niveau de puissance qui a réellement été atteint.
Ces deux fonctions de l’analyse de puissance sont brièvement abordées dans les paragraphes suivants en vue de clarifier la relation qui existe entre elles.
8.6.2.1 Calcul de la puissance a priori
Pendant la phase initiale de la planification d’une ESEE, l’analyse de puissance peut être utilisée pour déterminer la taille de l’échantillon requise pour effectuer un test permettant de détecter un effet correspondant à un SCE déterminé avant l’échantillonnage. À l’aide du SCE, de la probabilité d’erreur de type I (α), de la probabilité d’erreur de type II (β) et d’une estimation de la variabilité dans la zone de référence (p. ex., écart type pour la zone de référence), et en posant certaines hypothèses sur la distribution des données analysées, il est possible de concevoir une stratégie d’échantillonnage scientifiquement valable. L’analyse ci-dessous décrit la procédure la plus simple (c.-à-d. pour un plan C-I pour ANOVA ou ANCOVA) pour déterminer la taille d’échantillon nécessaire. La taille de l’échantillon correspond au nombre de poissons pour l’étude des poissons et au nombre de stations pour l’étude de la communauté d’invertébrés benthiques. Dans les cas où la taille d’échantillon nécessaire calculée pour un critère d’effet (p. ex., densité des invertébrés; condition) est supérieure à celle calculée pour un autre critère (p. ex., richesse des taxons d’invertébrés; poids relatif des gonades), il faut retenir la taille d’échantillon la plus grande (à moins que, comme on l’a vu plus haut, la consultation de l’agent d’autorisation n’ait confirmé que cette décision entraînerait des tailles d’échantillon excessivement élevées).
Après que le SCE a été déterminé, que les niveaux de α et β ont été choisis et que l’ET pour le site de la mine à l’étude a été estimé, ces données sont entrées dans l’équation de l’analyse de puissance pour calculer la taille de l’échantillon nécessaire pour détecter un impact de l’ampleur du SCE entre ou dans les zones, à un niveau de puissance donné. Lorsque le SCE est établi à ± 2 ET, en raison de l’annulation de termes, il n’est pas nécessaire de déterminer l’ET pour l’analyse de puissance, et le tableau 8-7 ci-dessus présente les tailles d’échantillon précalculées pour diverses valeurs de α et β.
Il faut noter que la détermination de la taille d’échantillon requise suppose que la variabilité entre les répétitions dans la zone exposée est semblable à celle entre les répétitions dans la zone de référence. Bien que l’ANOVA soit relativement robuste en cas de non-respect des conditions de normalité des données, si la variance dans une zone exposée est beaucoup plus élevée (ou plus faible) que celle de la zone de référence, les comparaisons par ANOVA ne seront pas nécessairement appropriées, à moins qu’on ne puisse homogénéiser les variances par transformation des données. Dans les cas où les variances de la zone exposée et de la zone de référence restent significativement différentes même après la transformation, l’analyse de puissance décrite ici peut surestimer ou sous-estimer le nombre de stations d’échantillonnage nécessaire. Des tests non paramétriques pourraient être appropriés dans ce cas; une analyse de puissance non paramétrique serait alors nécessaire pour estimer l’effort d’échantillonnage (Thomas et Krebs, 1997).
Pour un plan C-I de base pour l’ANOVA ou l’ANCOVA, la taille d’échantillon jugée nécessaire pour détecter un SCE donné à un niveau de puissance donné peut se calculer en adaptant l’équation standard de l’analyse de puissance comme suit (Green, 1989) :
n = 2(tα + tβ)2 (ET/SCE)2
Où :
n = taille de l’échantillon
tα = valeur du t de Student (test bilatéral) à (n-1) degrés de liberté (d.l.), au niveau de signification α
tβ = valeur du t de Student (test unilatéral) à (n-1) d.l., au niveau de signification β
ET = écart-type
SCE = seuil critique d’effet, exprimé dans les mêmes unités de mesure que la variable dépendante
L’équation est résolue de façon itérative en choisissant une valeur approximative de n (habituellement 20 pour l’étude des poissons) pour trouver tα et tβ, puis en utilisant la solution pour trouver une valeur plus précise de n; la procédure est répétée jusqu’à ce qu’on arrive à une estimation finale pour n (voir la section A1-8 de l’annexe 1). Par ailleurs, l’équation présentée à la section 8.6.1 peut servir à déterminer approximativement n en une seule étape. Il existe des tableaux de valeurs précalculées de n (plus détaillés que le tableau 8-7) pour diverses valeurs de α, β et SCE (Alldredge, 1987; Cohen, 1988).
Le lecteur trouvera dans la documentation pertinente (p. ex., Cohen, 1988) des conseils sur l’analyse de puissance et des tableaux permettant de déterminer la taille de l’échantillon pour les plans d’étude utilisant la régression (gradient linéaire, gradient radial) et le test du khi-carré (analyse des anomalies physiques des poissons). Il existe également plusieurs logiciels pour faire l’analyse de puissance pour différents plans d’analyse statistique (Thomas et Krebs, 1997). Comme dans le cas d’un plan C-I de base, l’analyse de puissance pour ces autres plans nécessitera aussi une décision a priori sur la valeur appropriée du SCE. Pour les analyses de régression, Cohen (1988) fournit une table de conversion des SCE pour passer des unités d’ET à un coefficient de corrélation (r) et, dans certains cas, il peut être acceptable d’utiliser cette valeur de r pour calculer la taille approximative de l’échantillon nécessaire pour un plan par gradient de type régression. Par exemple, selon certaines hypothèses, l’auteur montre que l’utilisation d’un SCE de 2 ET équivaut à utiliser un r = 0,707 (ou r2 = 0,5). Bien que l’équivalence exacte dépende des hypothèses en cause, il peut être acceptable d’utiliser cette conversion (peut-être avec un facteur de correction) pour obtenir un SCE approximatif convenant à des analyses de type régression. Cohen (1988) fournit des tableaux permettant de trouver les tailles d’échantillon nécessaires pour diverses valeurs de r, α et β.
Les seuils critiques d’effet pour l’étude des poissons sont exprimés en pourcentage de la moyenne de référence, et ne sont pas représentés dans les unités de la variable dépendante, car l'ampleur de l’effet varierait d’une étude à l’autre. Par conséquent, le coefficient de variation (CV), exprimé en pourcentage de la moyenne de référence, (CV = écart-type/moyenne de référence × 100) est utilisé comme mesure de la variabilité dans le calcul de la taille de l’échantillon. Pour un plan C-I de base analysé par ANOVA pour l’étude des poissons avec des données non transformées (p. ex., pour le critère d’effet de l’âge), la taille d’échantillon estimée pour détecter une ampleur d’effet donnée à un niveau de puissance donné peut être calculée en utilisant une autre version de l’équation précédente. Cette équation est la suivante (Green, 1989) :
n = 2(tα + tβ)2 (CV/SCE)2
Où :
CV = coefficient de variation (exprimé en pourcentage en utilisant les données du site de référence)
SCE = seuil critique d’effet (exprimé en pourcentage de la moyenne de référence)
Pour un plan C-I de base analysé par ANCOVA avec des données soumises à une transformation logarithmique (p. ex., pour le critère d’effet du poids relatif des gonades), la taille d’échantillon estimée pour détecter un SCE donné à un niveau de puissance donné peut aussi être calculée en utilisant une autre version de l’équation ci-dessus. Cette équation est la suivante (Green, 1989) :
n = 2(tα + tβ)2 (ETz/SCEz)2
Où :
ETZ = écart-type des résidus obtenu en utilisant des données soumises à une transformation logarithmique
SCEZ = log(f + 1), où f = SCE est une fraction de la moyenne de référence (p. ex., pour un SCE de 25 % ⇒ f = 0,25)
Dans le cas des deux équations ci-dessus, la taille de l’échantillon doit être calculée au moyen d’un processus itératif en choisissant comme point de départ une valeur approximative de n comme il a été expliqué précédemment.
8.6.2.2 Analyses de puissance post hoc
Lorsqu’un programme d’échantillonnage est terminé, si un résultat non significatif a été obtenu, une analyse de puissance post hoc peut être utilisée pour calculer la puissance réelle disponible pour détecter un effet et le SCE minimal pouvant être détecté pour une puissance donnée (Quinn et Keough, 2002). Cet aspect est particulièrement important si certains des paramètres pertinents qui pourraient affecter la puissance (c.-à-d. n, α, SCE, ET) ont changé depuis le début de l’étude. De plus, ces calculs devraient être utilisés pour faire des recommandations sur la taille de l’échantillon pour la phase de suivi subséquent. Les calculs de puissance post hoc peuvent être effectués en réarrangeant les équations précédentes pour calculer tβ ou le SCE. Par exemple, pour calculer la puissance pour les deux équations précédentes, on obtient :
![]()
et
![]()
On peut ensuite obtenir la puissance à partir de la valeur calculée de tβ.
8.7 Seuils critiques d’effet
Afin que les efforts additionnels en matière de suivi soient axés sur les domaines appropriés, Environnement Canada a élaboré des seuils critiques d’effet pour les critères d’effet relatifs aux poissons et aux invertébrés benthiques. Consulter le tableau du chapitre 1 qui porte sur les seuils critiques d’effet pour obtenir d’autres renseignements.
8.8 Considérations statistiques pour les études en mésocosmes
Certaines considérations s’appliquent seulement à une étude de type mésocosme. Par exemple, le fait que les conditions expérimentales soient contrôlées se traduit vraisemblablement par une moindre variabilité dans les milieux de référence et d’exposition par rapport aux données de terrain. Il peut ainsi être possible d’atteindre des niveaux équivalents de puissance statistique en utilisant des tailles d’échantillon plus petites que celles utilisées sur le terrain. De même, il pourrait être possible d’atteindre des niveaux supérieurs de puissance ou de déceler des ampleurs d’effet plus petites tout en utilisant les mêmes tailles d’échantillon que celles qui sont employées sur le terrain. En fait, il peut même être souhaitable de disposer d’une puissance suffisante pour détecter de plus faibles ampleurs d’effet dans les études en mésocosme que dans les études de terrain, étant donné que les durées d’exposition sont généralement plus courtes dans les études en mésocosme. Cela signifie (si l’on utilise des chiffres hypothétiques) qu’un changement de 10 % induit par l’effluent sur une période d’exposition de 30 jours dans une étude en mésocosme peut être équivalent à un changement de 25 % sur une période beaucoup plus longue d’exposition sur le terrain.
De plus, étant donné que la mise en cage peut faire apparaître des phénomèmes parasites, il peut être nécessaire d’utiliser non pas des poissons pris individuellement comme unité d’échantillonnage pour la répétition (comme c’est le cas sur le terrain), mais de prendre les enclos expérimentaux (mésocosmes) comme unités d’échantillonnage. Ainsi, l’utilisation de seulement deux mésocosmes (un pour la référence et un pour l’exposition), contenant 20 poissons chacun, peut ne pas être valide parce qu’il n’est peut-être pas possible de séparer les effets de l’effluent des effets dus à des différences subtiles entre les enclos expérimentaux eux-mêmes. Il s’agit là d’un exemple d’effets de confusion potentiels dus à la pseudorépétition (Hurlbert, 1984).
En comparaison de l’étude des poissons, il peut être encore plus direct de substituer des études en mésocosme au suivi de la communauté d’invertébrés benthiques sur le terrain, tout au moins en ce qui concerne les plans et analyses statistiques. Comme dans le cas de l’étude des poissons, il faudrait alors suivre les mêmes étapes de préparation, de présentation et d’analyse des données. En outre, étant donné le cycle relativement court des changements de structure des communautés d’invertébrés à l’intérieur des mésocosmes, on peut envisager d’utiliser les mêmes critères d’effet que dans l’étude des invertébrés sur le terrain (section 8.5). Le plan d’étude le plus pertinent serait analogue au plan contrôle-impact (tableau 8-6), avec des comparaisons par ANOVA entre les mésocosmes répétés correspondant aux zones de référence et d’exposition. L’unité d’échantillonnage serait alors le mésocosme (ce qui est équivalent aux « stations » dans l’étude de terrain). Comme dans le cas des mésocosmes utilisés pour les poissons, le contrôle de la variabilité en conditions expérimentales peut permettre d’obtenir une plus grande puissance statistique ou de détecter de plus faibles ampleurs d’effet (en pourcentage de changement) en utilisant les mêmes tailles d’échantillon généralement utilisées sur le terrain. Cette augmentation de la précision est l’un des avantages les plus fréquemment cités de l’usage des mésocosmes par rapport à l’échantillonnage sur le terrain, et doit être évaluée par rapport au désavantage que représente une baisse potentielle de l’exactitude en raison de l’utilisation d’une simulation (aussi réaliste que possible) des conditions réelles de terrain.
Le chapitre 9 traite plus en détails de l’évaluation et de l’interprétation des données pour des méthodes de rechange.
8.9 Références
Alldredge, J.R. 1987. « Sample size for monitoring of toxic chemical sites », Environmental Monitoring and Assessment, 9 : 143-154.
Bailey, R.C., R.H. Norris et T.B. Reynoldson. 2003. Bioassessment of Freshwater Ecosystems Using the Reference Condition Approach. Boston (MA), Kluwer Academic Publishers.
Barrett, T.J., M.A. Tingley, K.R. Munkittrick et R.B. Lowell. 2010. « Dealing with heterogeneous regression slopes in analysis of covariance: New methodology applied to environmental effects monitoring fish survey data », Environmental Monitoring and Assessment, 166 (1-4) : 279-291.
Bartlett, J.R., P.F. Randerson, R. Williams et D.M. Ellis. 1984. « The use of analysis of covariance in the back-calculation of growth in fish », Journal of Fish Biology, 24 : 201-213.
Bligh, E.G., et W. Dyer. 1959. « A rapid method of total lipid extraction and purification », Canadian Journal of Biochemistry and Physiology, 37 : 911-917.
Bolger, T., et P.L. Connolly. 1989. « The selection of suitable indices for the measurement and analysis of fish condition », Journal of Fish Biology, 34 : 171-182.
Burd, B.J., A. Nemec et R.O. Brinkhurst. 1990. « The development and application of analytical methods in benthic marine infaunal studies », Advances in Marine Biology, 26 : 169-247.
Cohen, J. 1988. Statistical Power Analysis for the Behavioral Sciences, 2nd edition. Hillsdale (NJ), Lawrence Erlbaum Associates.
Cook, R.D. 1977. « Detection of influential observation in linear regression », Technometrics, 19 : 15-18.
Cook, R.D. 1979. « Influential observations in linear regression », Journal of the American Statistical Association, 74 : 169-174.
Day, R.W., et G.P. Quinn. 1989. « Comparisons of treatments after an analysis of variance in ecology », Ecological Monographs, 59 : 433-463.
Draper, N.R., et H. Smith. 1981. Applied Regression Analysis, 2nd edition. New York (NY), John Wiley & Sons, Inc.
Environnement Canada. 1997. Fish Survey Expert Working Group Report. Ottawa (ON), Environnement Canada. EEM/1997/6.
Folch, J., M. Lees et G.H. Sloane Stanley. 1957. « A simple method for the isolation and purification of total lipides from animal tissues », Journal of Biological Chemistry, 226 : 497-509.
Fox, J. 1997. Applied Regression Analysis, Linear Model, and Related Models. Thousand Oaks (CA), Sage Publications Inc.
Gibbons, D.W., J.B. Reid et R.A. Chapman. 1993. The New Atlas of Breeding Birds in Britain and Ireland: 1988–1991. London (UK), Poyser.
Gray, M.A., A.R. Curry et K.R. Munkittrick. 2002. « Non-lethal sampling methods for assessing environmental impacts using a small-bodied sentinel fish species », Water Quality Research Journal of Canada, 37 : 195-211.
Green, R.H. 1979. Sampling Design and Statistical Methods for Environmental Biologists. New York (NY), Wiley-Interscience.
Green, R.H. 1989. « Power analysis and practical strategies for environmental monitoring », Environmental Research, 50 : 195-205.
Grubbs, F. 1969. « Procedures for detecting outlying observations in samples », Technometrics, 11 : 1-21.
Guenther, W.C. 1981. « Sample size formulas for normal theory T tests », American Statistician, 35 : 243-244.
Hamilton, B.L. 1977. « An empirical investigation of the effects of heterogeneous regression slopes in analysis of covariance », Educational and Psychological Measurement, 37 : 701-712.
Hubert, J.J. 1980. Bioassay. Dubuque (IA), Kendall/Hunt Publishing.
Huitema, B.E. 1980. The Analysis of Covariance and Alternatives. New York (NY), John Wiley & Sons, Inc.
Hurlbert, S.H. 1984. « Pseudoreplication and the design of ecological field experiments », Ecological Monographs, 54 : 187-211.
Iman, R.L., et W.J. Conover. 1982. « A distribution-free approach to inducing rank correlation among input variables », Commun. Statist.-Simula. Computa., 11 : 311-334.
Jackson, D.A., H.H. Harvey et K.M. Somers. 1990. « Ratios in aquatic sciences: Statistical shortcomings with mean depth and the morphoedaphic index », Canadian Journal of Fisheries and Aquatic Sciences, 47 : 1788-1795.
Keough, M.J., et B.D. Mapstone. 1995. Protocols for Designing Marine Ecological Monitoring Associated with BEK Mills. Technical Report Series No. 11, National Pulp Mills Research Program. Canberra (AU), Commonwealth Scientific and Industrial Research Organisation.
Lowell, R.B., et B.W. Kilgour. 2008. « Interpreting effluent effects on fish when the magnitude of effect changes with size or age of fish », dans K.A. Kidd, R. Allen Jarvis, K. Haya, K. Doe et L.E. Burridge (éd.), Compes rendus du 34ième atelier annuel sur la toxicité aquatique: du 30 septembre au 3 octobre 2007, Halifax, Nouvelle-Écosse. Rapport technique canadien des sciences halieutiques et aquatiques, no 2793. Pp. 83-84.
Mapstone, B.D. 1995. « Scalable decision rules for environmental impact studies: Effect size, Type I and Type II errors », Ecological Applications, 5 : 401-410.
Miller, R.G. 1986. Beyond ANOVA: Basics of Applied Statistics. New York (NY), John Wiley & Sons, Inc.
Osenberg, C.W., R.J. Schmitt, S.J. Holbrook, K.E. Abu-Saba et A.R. Flegal. 1994. « Detection of environmental impacts: Natural variability, effect size and power analysis », Ecological Applications, 4 : 16-30.
Paine, R.T., M.J. Tegner et E.A. Johnson. 1998. « Compounded perturbations yield ecological surprises », Ecosystems, 1 : 535-545.
Peters, R.H. 1983. The Ecological Implication of Body Size. New York (NY), Cambridge University Press. 329 pages.
Quade, D. 1967. « Rank analysis of covariance », Journal of the American Statistical Association, 62 : 1187-1200.
Quinn, G.P., et M.J. Keough. 2002. Experimental Design and Data Analysis for Biologists. Cambridge (UK), Cambridge University Press.
Randall, R., H. Lee II, R. Ozretich, J. Lake et J. Pruell. 1991. « Evaluation of selected lipid methods for normalizing pollutant bioaccumulation », Environmental Toxicology and Chemistry, 10 :1431-1436.
Resh, V.H., et E.P. McElravy. 1993. « Contemporary quantitative approaches to biomonitoring using benthic macroinvertebrates », dans D.M. Rosenberg et V.H. Resh (éd.), Freshwater Biomonitoring and Benthic Macroinvertebrates. New York (NY), Chapman and Hall. Pp. 159-194.
Resh, V.H., R.H. Norris et M.T. Barbour. 1995. « Design and implementation of rapid assessment approaches for water resource monitoring using benthic macroinvertebrates », Australian Journal of Ecology, 20 : 108-121.
Reynoldson, T.B., K.E. Day et T. Pascoe. 2000. « The development of the BEAST: A predictive approach for assessing sediment quality in the North American Great Lakes », dans J.F. Wright, D.W. Sutcliffe et M.T. Furse (éd.), Assessing the Biological Quality of Fresh Waters: RIVPACS and Other Techniques. Ambleside (UK), Freshwater Biological Association. Pp. 165-180.
Reynoldson, T.B., R.C. Bailey, K.E. Day et R.H. Norris. 1995. « Biological guidelines for freshwater sediment based on BEnthic Assessment of SedimenT (the BEAST) using a multivariate approach for predicting biological state », Australian Journal of Ecology, 20 : 198-219.
Ricker, W.E. 1980. Calcul et interpretation des statistiques biologiques des populations de poissons. Bulletin canadien des sciences halieutiques et aquatiques. 191F. 409 p.
Schmitt, R.J., et C.W. Osenberg. 1996. Detecting Ecological Impacts: Concepts and Applications in Coastal Marine Habitats. San Diego (CA), Academic Press. 401 pages.
Shirley, E.A.C. 1981. « A distribution-free method for analysis of covariance based on ranked data », Applied Statistics, 30 : 158-162.
Sokal, R.R., et F.J. Rohlf. 1995. Biometry, 3rd edition. New York (NY), W.H. Freeman.
Thomas, L., et C.J. Krebs. 1997. « A review of statistical power analysis software », Bulletin of the Ecological Society of America, 78 : 126-139.
Trippel, E.A., et H.H. Harvey. 1991. « Comparison of methods used to estimate age and length of fishes at sexual maturity using populations of white sucker (Catostomus commersoni) », Canadian Journal of Fisheries and Aquatic Sciences, 48 : 1446-1495.
Underwood, A.J. 1993. « The mechanics of spatially replicated sampling programmes to detect environmental impacts in a variable world », Australian Journal of Ecology, 18 : 99-116.
Underwood, A.J. 1997. Experiments in Ecology: Their Logical Design and Interpretation using Analysis of Variance. Cambridge (UK), Cambridge University Press. 504 pages.
Annexe 1 : Guide étape par étape des procédures statistiques
- A1.1 Identification des poissons immatures
- A1.2 Statistiques sommaires
- A1.3 Analyse de variance
- A1.4 Analyse de covariance
- A1.5 Pentes non parallèles dans l’analyse de covariance
- A1.6 Analyse de covariance non paramétrique
- A1.7 Problèmes liés à la plage de valeurs de la covariable
- A1.8 Analyses de la puissance a priori
- A1.9 Analyses de la puissance post hoc
Annexe 1 : Guide étape par étape des procédures statistiques
La présente annexe donne des renseignements généraux et des instructions étape par étape au sujet des procédures statistiques requises pour l’étude des poissons de l’ESEE. Ces renseignements sont de nature générale, et ils peuvent être adaptés aux procédures du logiciel statistique utilisés. Les exemples sont tirés de divers jeux de données provenant des cycles précédents du programme d’ESEE des pâtes et papiers afin d’illustrer les principes lorsque c’est possible.
L’analyse de covariance (ANCOVA) peut être effectuée sous forme de régressions linéaires multiples où des variables indicatrices représentent les sites. En effectuant une analyse sur un site de référence (réf.) et un site exposé (exp.), les données peuvent être adaptées au modèle de régression suivant :
y = β0 + β1x1 + β2x2 + β3(x1 · x2)
(1)
où y est la variable dépendante, x1 est la covariable, x2 est une variable indicatrice pour le traitement (p. ex., 0 pour référence et 1 pour exposition), et x1 · x2 est le terme d’interaction covariable*traitement qui est égal au produit de la covariable et de la variable indicatrice pour chaque observation. Ce modèle ajuste les données à deux droites de régression ayant des ordonnées à l’origine et des pentes distinctes, soit y = β0 + β1x1 pour le site de référence et y = (β0 + β2) + (β1 + β3)x pour le site exposé. Un test vérifiant le parallélisme des pentes de régression équivaut à tester la signification statistique du coefficient du terme d’interaction x1 · x2 (c.-à-d. un test vérifiant si β3 = 0). Si ce coefficient n’est pas significatif (au niveau de signification α = 0,05), les données peuvent être décrites par deux lignes parallèles ayant des ordonnées à l’origine distinctes. Ce modèle est le suivant :
y = β0 + β1x1 + β2x2
(2)
Le test pour vérifier l’existence d’une différence de variable dépendante entre les traitements peut se faire avec le modèle (2). Ce test équivaut à vérifier si les deux droites de régression ont des ordonnées à l’origine égales (c.-à-d. qu’il vérifie si β2 = 0). Si la variable dépendante n’est pas significativement différente entre les traitements, les données peuvent être représentées par une seule droite de régression sans le terme β2.
L’analyse des données au moyen de l’ANCOVA équivaut à ajuster les données à (1) afin d’évaluer le parallélisme des pentes, et le test des différences entre les sites équivaut à tester la signification de β2 dans (2). Des comparaisons avec les seuils critiques d’effet sont effectuées en comparant le pourcentage de différence entre les moyennes ajustées (variable dépendante moyenne ajustée de manière à éliminer l’effet des différences de valeurs de la covariable) et des seuils critiques d’effet prédéterminés. Ce pourcentage de différence peut être calculé facilement à partir du modèle (2). Le coefficient β2 dans (2) est la distance verticale entre les deux droites de régression (c.-à-d. la différence entre les ordonnées à l’origine), et il peut être converti en pourcentage de différence entre les variables dépendantes comme suit :
% différence = (10β2 − 1) · 100%
(3)
lorsque la variable dépendante est soumise à une tranformation logarithmique. Les moyennes ajustées peuvent être calculées avec l’équation (2) en utilisant la moyenne générale de la covariable (valeurs moyenne de la covariable pour tous les sites) pour x1 et la valeur indicatrice appropriée pour x2 pour obtenir chacune des moyennes ajustées si on le souhaite.
A1.1 Identification des poissons immatures
- Calculer l’indice gonadosomatique (IGS) :
(IGS) = poids des gonades/poids corporel × 100.
Habituellement, les poissons immatures présentent un IGS < 1 %. - Tracer le diagramme du poids des gonades en fonction du poids corporel. Les poissons immatures peuvent habituellement être identifiés rapidement.
La figure A1-1 montre un jeu de données comportant plusieurs poissons immatures. Une droite représentant IGS = 1 % est ajoutée afin d’aider à l’identification des poissons immatures.
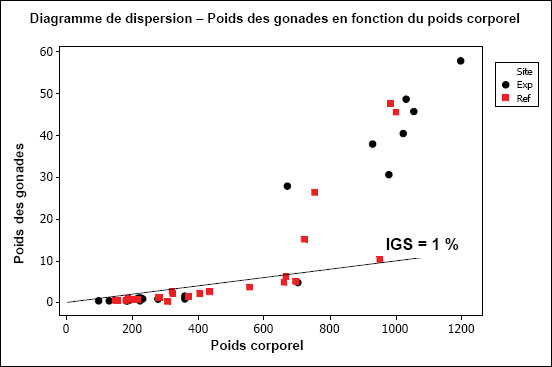
Figure A1-1 : Diagramme du poids des gonades en fonction du poids corporel de femelles de Catostomus macrocheilus. La ligne représente un IGS = 1 %. (description longue)
Certains poissons ne fraient pas chaque année et ne dépensent donc pas d’énergie chaque année pour la reproduction. On peut facilement identifier ces espèces au moyen d’un diagramme du poids des gonades en fonction du poids corporel dans lequel les données forment deux groupes différents correspondent aux poissons qui fraient et aux poissons qui ne fraient pas. Lorsque la droite correspondant à un IGS = 1 % est ajoutée au tracé, on peut facilement distinguer les poissons qui fraient de ceux qui ne fraient pas. Voir la figure A1-2.

Figure A1-2 : Diagramme du poids des gonades en fonction du poids corporel de femelles de Lota lota. La droite représente un IGS = 1 %. (description longue)
A1.2 Statistiques sommaires
- Les données sont séparées par espèces, sexes et sites (p. ex., de référence ou exposé).
- Chaque jeu de données est représenté graphiquement en utilisant un diagramme en rectangle et moustaches qui est examiné pour repérer les erreurs de saisie évidentes ou toute observation inhabituelle.
Les diagrammes en rectangle et moustaches de la longueur de femelles de Catostomus commersoni se trouvent à la figure A1-3. Le diagramme en A révèle la présence d’un poisson de longueur inhabituelle au site exposé. Un examen des notes de terrain et des commentaires dans la feuille de calcul indique que ce poisson était d’une longueur exceptionnelle comparativement à tous les autres poissons. Cette observation se trouve donc très loin hors de la plage des valeurs de la variable « longueur » et elle peut être considérée comme une valeur aberrante.
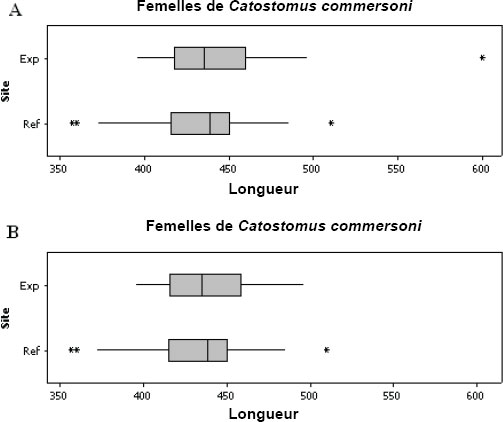
Figure A1-3 : Diagrammes en rectangle et moustaches de femelles de Catostomus commersoni par sites. A. Une valeur aberrante est détectée au site exposée. B. La valeur aberrante est supprimée. (description longue)
- Calculer et présenter les statistiques sommaires dans un tableau.
| Espèce | Sexe | Site | n | Moyenne | ET | Erreur type | Min. | Max. |
|---|---|---|---|---|---|---|---|---|
| Catostomus commersoni | F | Exp. | 39 | 437,49 | 24,57 | 3,93 | 395 | 496 |
| Catostomus commersoni | F | Réf. | 40 | 432,18 | 31,46 | 4,97 | 357 | 510 |
| Catostomus commersoni | M | Exp. | 39 | 405,36 | 19,72 | 3,16 | 367 | 448 |
| Catostomus commersoni | M | Réf. | 39 | 405,00 | 18,00 | 2,88 | 369 | 448 |
| Etheostoma exile | F | Exp. | 33 | 3,7492 | 0,349 | 0,0440 | 3,0 | 4,5 |
| Etheostoma exile | F | Réf. | 31 | 3,7129 | 0,556 | 0,0999 | 2,8 | 5,2 |
| Etheostoma exile | M | Exp. | 37 | 3,5973 | 0,295 | 0,0485 | 3,0 | 4,1 |
| Etheostoma exile | M | Réf. | 26 | 3,5346 | 0,277 | 0,0543 | 3,1 | 4,1 |
A1.3 Analyse de variance
- Tester la normalité de toutes les variables.
- Tester l’homogénéité de la variance de toutes les variables.
- Présenter tous les tests statistiques utilisés et la valeur de p de ces tests.
- En cas de divergence importante par rapport aux conditions d’application des tests ou s’il y a divergence et que les tailles des échantillons sont inégales, le recours à des méthodes statistiques non paramétriques pour remplacer l’ANOVA (p. ex., test de Kruskal-Wallis) pourra être envisagé.
- Fournir les moyennes (et les médianes pour les analyses non paramétriques), les écarts-types combinés et la valeur de p des tests.
- Tracer un graphique des résidus et vérifier la présence de valeurs aberrantes. Les observations dont les résidus studentisés sont supérieurs à 4 justifient habituellement un examen plus approfondi et peut-être leur suppression. Si des valeurs aberrantes sont supprimées, fournir une analyse portant sur toutes les données et une autre dont toute valeur aberrante est supprimée.
« Poids » - femelles de Catostomus commersoni
Normalité (testée en utilisant le test d’Anderson-Darling)
Homogénéité des variances (testée en utilisant le test de Levene)
Les conditions d’application des analyses statistiques sont satisfaites; poursuivre avec l’analyse de variance.
Variable dépendante : Poids
Résultats :
Écart-type combiné = 248,6
« Âge » - femelles de Catostomus commersoni
Normalité (testée en utilisant le test d’Anderson-Darling)
Homogénéité des variances (testée en utilisant le test de Levene)
La condition de normalité des données n’est pas respectée dans la zone de référence. Les tailles des échantillons sont respectivement de 40 (réf.) et de 39 (exp.). Les tailles des échantillons sont donc approximativement égales et il n’y a pas de violation grave des conditions d’application. L’ANOVA paramétrique ou une variante non paramétrique à l’ANOVA peuvent être utilisées. Dans le cas présent, un test non paramétrique de Kruskal-Wallis est employé.
Résultats :
« Longueur » – femelles de Catostomus commersoni
Diagramme des résidus – Résidus studentisés en fonction de l’ordre (les données d’ordre sont saisies dans la feuille de calcul).
Les valeurs aberrantes sont habituellement considérées comme des observations dont les résidus sont supérieurs à 4 et elles peuvent facilement être identifiées dans ce diagramme.
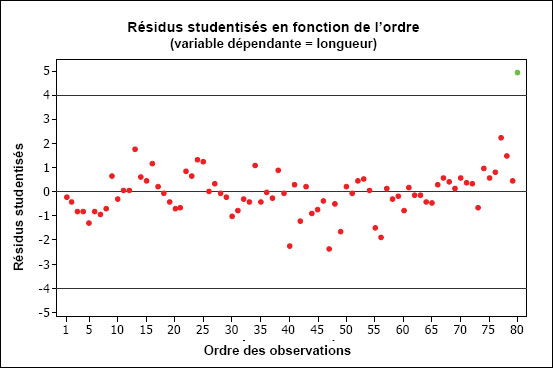
Figure A1-4 : Diagramme des résidus studentisés en fonction de l’ordre des observations (dans la feuille de calcul) pour l’ANOVA de la longueur de femelles de Catostomus commersoni (description longue)
A1.4 Analyse de covariance
- Tracer le diagramme de la variable dépendante en fonction de la covariable pour tous les sites.
- Examiner le tracé pour vérifier s’il y a une tendance linéaire et un chevauchement approprié des valeurs de la covariable.
- Examiner le tracé pour repérer les valeurs aberrantes – calculer les résidus studentisés du modèle ANCOVA.
- Évaluer l’exclusion des valeurs aberrantes dont la valeur est > 4 (résidus studentisés).
- Tester la normalité des résidus (chacune des droites de régression).
- Tester l’homogénéité de la variance des résidus (entre les droites de régression).
- Tester l’homogénéité des pentes de régression – ajuster les données au modèle de régression avec le terme d’interaction et tester la signification de ce terme. Fournir le coefficient de détermination R2 du modèle de régression.
- Tester les différences de la variable dépendante – ajuster les données au modèle de régression sans terme d’interaction et tester la signification du terme « site » (traitement). Fournir le coefficient de détermination R2 du modèle de régression et l’écart-type combiné (des résidus).
- Fournir les moyennes ajustées pour chaque site. Calculer aussi l’antilogarithme de la moyenne si les données transformées en logarithmes ont été utilisées.
- Calculer le pourcentage de différence, calculé en pourcentage du site de référence (en utilisant les antilogarithmes des moyennes ajustées).
« Condition » – mâles de Rhinichthys cataractae
Figure A1-5 : Diagramme du log(poids corporel) en fonction du log(longueur) de mâles de Rhinichthys cataractae. Les données sont ajustées à deux droites de régression distinctes; une pour chaque site. (description longue)
Le chevauchement des valeurs de la covariable semble approprié et il y a une tendance linéaire.
Normalité (testée en utilisant le test d’Anderson-Darling)
Homogénéité des variances (testée en utilisant le test de Levene)
Homogénéité des pentes de régression
β3 n’est pas significatif (p = 0,337), par conséquent, il n’y a pas d’indication que les pentes sont non parallèles.
Tester les différences de la variable dépendante
β2 est significatif (p = 0,0001), il y a donc une différence de poids significative entre les sites.
Moyenne ajustée du poids – site de référence : 1,3113 g
Moyenne ajustée du poids – site d’exposition : 1,4496 g
(l’antilogarithme des moyennes est calculé pour obtenir les unités initiales au moment de la transformation en logarithme; l’antilogarithme de x est 10x si la transformation était en log10).
Écart-type combiné = 0,0420164
Pourcentage de différence = 10,54 % (calculé en pourcentage du site de référence en utilisant les moyennes ajustées)
A1.5 Pentes non parallèles dans l’analyse de covariance
- Méthode 1
- « Poids relatif des gonades » – mâles de Catostomus commersoni
Figure A1-6 : Diagramme du log(poids des gonades) en fonction du log(poids corporel) de mâles de Catostomus commersoni. Les données sont ajustées à deux droites de régression distinctes, une pour chaque site. (description longue)
Le chevauchement des valeurs de la covariable semble approprié et il y a une tendance linéaire. Une observation justifie l’examen des données provenant de la zone exposée.
Le tracé des résidus studentisés ne révèle aucune observation ayant une valeur extrême. Voir la figure A1-7.
Figure A1-7 : Diagramme des résidus studentisés en fonction du log(poids corporel) de mâles de Catostomus commersoni - données ajustées au modèle d’interaction y = β0 + β1x1 + β2x2 + β3(x1 · x2) (description longue)
Normalité (testée en utilisant le test d’Anderson-Darling)
Homogénéité des variances (testée en utilisant le test de Levene)
Homogénéité des pentes de régression
β3 est significatif (p = 0,014); il y a donc une indication que les pentes ne sont pas parallèles.
Évaluation de l’influence en traçant la distance de Cook en fonction de la covariable.
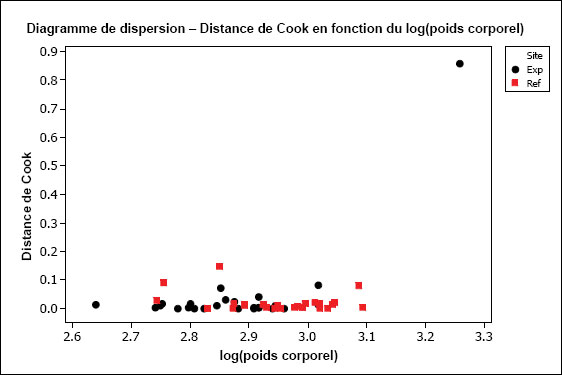
Figure A1-8 : Diagramme de la distance de Cook en fonction du log(poids corporel) de mâles de Catostomus commersoni – données ajustées au modèle d’interaction y = β0 + β1x1 + β2x2 + β3(x1 · x2) (description longue)
Une des observations parmi les données provenant du site d’exposition a une grande distance de Cook. Supprimer cette valeur et tester à nouveau l’hypothèse.
Normalité (testée en utilisant le test d’Anderson-Darling)
Homogénéité des variances (testée en utilisant le test de Levene)
Homogénéité des pentes de régression
β3 n’est pas significatif (p = 0,205), par conséquent il n’y a pas d’indication que les pentes sont non parallèles.
Poursuivre la procédure.
- Méthode 2
- « Condition » – mâles de Catostomus catostomus
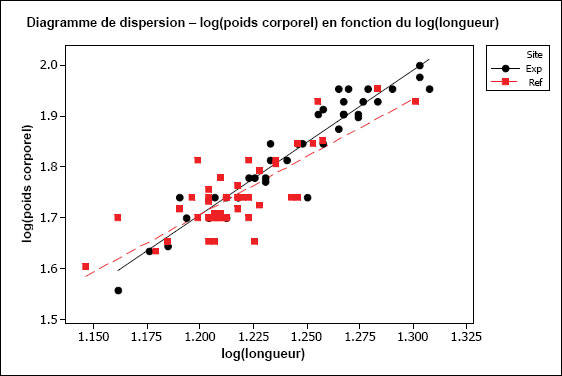
Figure A1-9 : Diagramme du log(poids corporel) en fonction du log(longueur) de mâles de Catostomus catostomus. Les données sont ajustées à deux droites de régression distinctes; une pour chaque site. (description longue)
β3 est significatif (p = 0,036), les pentes ne sont donc pas parallèles, mais R2 > 0,8. Ainsi, les données correspondent à un modèle à pentes parallèles, et la comparaison entre les coefficients de détermination peut être effectuée.
R2 pour le modèle à pentes parallèles est aussi > 0,8 et est moins de 0,02 (c.-à-d. 2 points de pourcentage) inférieur au R2 du modèle d’interaction. On utilise donc le modèle à pentes parallèles pour décrire les données et continuer l’analyse.
- Méthode 3
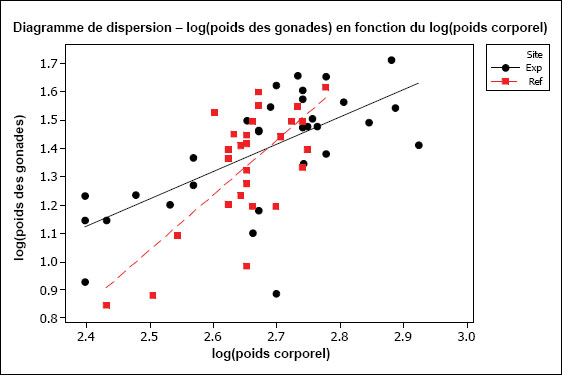
Figure A1-10a : Diagramme du log(poids des gonades) en fonction du log(poids corporel) de mâles de Catostomus catostomus. Les données sont ajustées à deux droites de régression distinctes; une pour chaque site. (description longue)
Homogénéité des pentes de régression
β3 est significatif (p = 0,036), un tracé de la distance de Cook en fonction de la covariable ne révèle aucun point influant et R2 < 0,8, donc l’application de la méthode 2 ne peut pas être tentée.
- Déterminer les valeurs minimales et maximales de la plage de valeurs de la covariable pour chaque site.
- Calculer les valeurs prévues de la variable dépendante pour chaque site (droite de régression) pour ces deux valeurs de la covariable.
- Calculer le pourcentage de différence (calculé ainsi : exposition – référence, exprimé en pourcentage de la valeur du site de référence) pour les deux valeurs de la covariable.
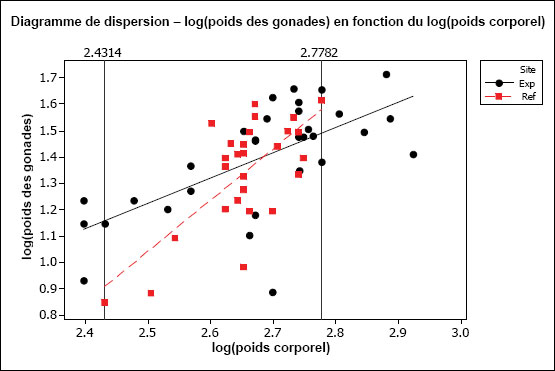
Figure A1-10b : Mêmes données que celles de la figure A1-10a, mais avec identification des valeurs minimales et maximales de la plage de chevauchement des valeurs de la covariable. (description longue)
Valeurs de la covariable : 2,4314 et 2,7782
Pour 2,4314 : les valeurs prévues de la variable dépendante sont 1,0949 (réf.) et 1,1544 (exp.).
Pour 2,7782 : les valeurs prévues de la variable dépendante sont 1,4963 (réf.) et 1,4883 (exp.).
Le calcul de la différence en pourcentage donne donc (après avoir trouvé l’antilogarithme des valeurs prévues de la variable dépendante) 14,69 % et –1,84 % respectivement pour les valeurs de la covariable 2,4314 et 2,7782. Ces valeurs sont les estimations de l’effet pour les plus petits et les plus grands poissons, respectivement, et elles peuvent être comparées à un seuil critique d’effet.
A1.6 Analyse de covariance non paramétrique
« Poids relatif des gonades » – femelles de Catostomus commersoni
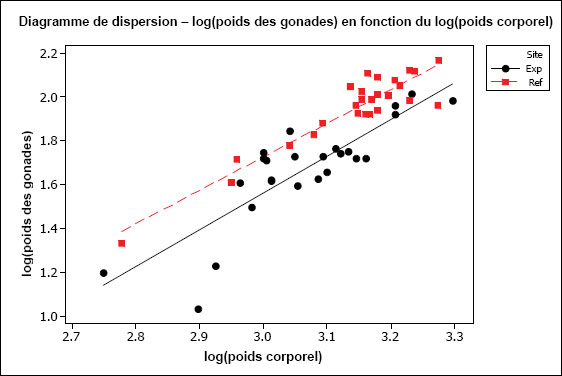
Figure A1-11 : Diagramme du log(poids des gonades) en fonction du log(poids corporel) de femelles de Catostomus commersoni. Les données sont ajustées à deux droites de régression distinctes; une pour chaque site. (description longue)
Les distributions des valeurs de la covariable pour les deux sites ne sont pas très semblables.
Taille des échantillons = 26 (réf.) et 25 (exp.)
Homogénéité des variances (testée en utilisant le test de Levene)
- Seule la condition d’homogénéité des variances n’est pas satisfaite – les tailles des échantillons sont presques égales, il est donc possible d’utliser l’ANCOVA paramétrique ou d’appliquer l’ANCOVA non paramétrique aux rangs des données.
ANCOVA non paramétrique des rangs
Variable dépendante : Rangs des poids des gonades
Covariable : Rangs des poids corporels
β3 n’est pas significatif (p = 0,364), il n’y a donc pas d’indication que les pentes sont non parallèles.
Tester les différences de la variable dépendante
β2 est significatif (p < 0,0001), il y a donc une différence significative du poids des gonades entre les deux sites.
Il est parfois possible d’effectuer des comparaisons avec les seuils critiques d’effet en calculant une différence de pourcentage en utilisant la moyenne ajustée des rangs. Cette différence de pourcentage est simplement la différence entre les moyennes ajustées des rangs, soit la valeur du site d’exposition moins celle du site de référence, exprimée en pourcentage du rang de la moyenne ajustée de référence. Les moyennes ajustées des rangs peuvent être calculées avec l’équation no 2 (présentée avec les infomrations générales sur les statistiques au début de la présente annexe) en utilisant la moyenne du rang de la covariable pour x1 et la valeur de la variable indicatrice appropriée pour x2 si l’approche par régression est utilisée pour l’ANCOVA.
Moyenne ajustée du rang du poids des gonades – site de référence : 30,8660
Moyenne ajustée du rang du poids des gonades – site d’exposition: 20,9394
Écart-type combiné = 6,31325 (rangs)
Pourcentage de différence = –31,16 % (calculé comme pourcentage de la zone de référence en utilisant les moyennes ajustées des rangs)
Note : Une ANCOVA paramétrique donnerait un pourcentage de différence de –28,90 %.
A1.7 Problèmes liés à la plage de valeurs de la covariable
Plages des valeurs de la covariable non semblables d’un site à l’autre
- Un sous-ensemble de données pour lequel il y a une plage de chevauchement des valeurs de covariable suffisamment large pour chaque site doit être cherché. Prenons comme exemple l’ensemble de données du poids relatif des gonades de mâles de Pleuronectes americanus dans la figure A1-12a. Les plages de la covariable pour les sites de référence et exposés sont assez différentes, car plusieurs poissons du site de référence sont plus petits. En prenant un sous-ensemble des données (en excluant les poissons pour lesquels le log(longueur) < 1,375), il est possible d’obtenir un ensemble de données où les plages de valeurs de la covariable sont assez semblables, avec un bon chevauchement. L’analyse peut être appliquée à ce sous-ensemble de données (illustré à la figure A1-12b). Une analyse avec toutes les données peut être effectuée à des fins de comparaison, mais l’interprétation d’une telle analyse devra être effectuée de manière circonspecte.
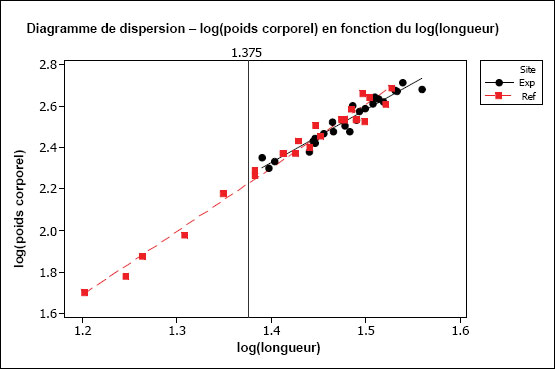
Figure A1-12a : Diagramme du log(poids corporel) en fonction du log(longueur) de mâles de Pleuronectes americanus. Les données sont ajustées à deux droites de régression distinctes; une pour chaque site. (description longue)
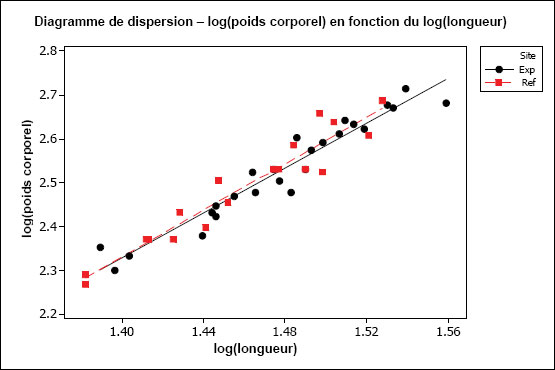
Figure A1-12b : Diagramme du log(poids corporel) en fonction du log(longueur) de mâles de Pleuronectes americanus (sous-ensemble des données de la figure A1-12a où seuls les poissons dont le log(longueur) > 1,375 sont conservés). (description longue)
Covariable observée seulement pour certaines valeurs
- La figure A1-13 est un exemple d’ensemble de données où la covariable n’est observée qu’à quelques valeurs. Ces ensembles de données sont représentatifs des analyses du poids selon l’âge de poissons de petite taille, mais ils peuvent aussi se produire avec d’autres ensembles de données. L’ANCOVA pourrait alors être non appropriée.
- Effectuer une ANOVA à un facteur du poids corporel (facteur : site) pour les poissons de un an.
- Effectuer une ANOVA à un facteur du poids corporel (facteur : site) pour les poissons de deux ans.
- Si la taille de l’échantillon pour un groupe d’âges est trop petite pour l’analyse, fournir la moyenne et la taille de l’échantillon.
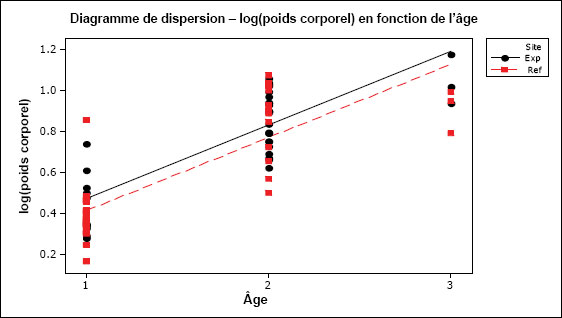
Figure A1-13 : Diagramme du log(poids corporel) en fonction de l’âge de femelles de Fundulus heteroclitus. Les données sont ajustées à deux droites de régression distinctes; une pour chaque site. (description longue)
A1.8 Analyses de la puissance a priori
« Âge » – femelles de Perca flavescens
Nous souhaitons déterminer quel sera l’effort d’échantillonnage requis pour détecter une différence d’âge de 25 % chez des femelles de Perca flavescens. Les données suivantes proviennent de l’étude des poissons du cycle précédent pour la même fabrique. Voir la section 8.6.2.1 du présent chapitre pour plus de renseignements et des définitions de termes.
| Espèce | Sexe | Site | n | Moyenne | Ecart-type | Erreur type | Min. | Max. |
|---|---|---|---|---|---|---|---|---|
| Perca flavescens | F | Exp. | 30 | 4,100 | 1,094 | 0,200 | 3 | 8 |
| Perca flavescens | F | Réf. | 29 | 3,759 | 1,300 | 0,241 | 2 | 7 |
- Supposons une probabilité d’erreur de type I (α) de 0,05 et d’erreur de type II (β) de 0,2 (ces valeurs sont utilisées seulement à des fins d’exemple; pour la plupart des cas du Programme d’ESEE, les erreurs de type I et de type II doivent être établies de manière que α = β).
- Le coefficient de variation du site de référence peut être calculé comme suit :
- CV = 1,300/3,759 · 100 = 34,58 %.
- Notre seuil critique d’effet (SCE) est de 25 %.
- Nous commençons avec n = 20 et résolvons ce qui suit par itérations pour la valeur estimée de n (
 )
)  = 2(tα + tβ)2(CV/SCE)2
= 2(tα + tβ)2(CV/SCE)2
- En utilisant n = 20, α = 0,05, et β = 0,2, nous obtenons tα = 2,093 et tβ = 0,861.
[tαcalculé pour un test bilatéral à (n–1) degrés de liberté; tβ calculé pour un test unilatéral à (n–1) degrés de liberté]  = 2(2,093 + 0,861)2(34,58/25)2= 33,39 = 34
= 2(2,093 + 0,861)2(34,58/25)2= 33,39 = 34- En utilisant n = 34, α = 0,05, et β = 0,2 nous obtenons tα = 2,035 et tβ = 0,853
 = 2(2,035 + 0,853)2(34,58/25)2 = 31,9 = 32
= 2(2,035 + 0,853)2(34,58/25)2 = 31,9 = 32- En utilisant n = 32, α = 0,05, et β = 0,2 nous obtenons tα = 2,040 et tβ = 0,853
 = 2(2,040 + 0,853)2(34,58/25)2 = 32,03 = 32
= 2(2,040 + 0,853)2(34,58/25)2 = 32,03 = 32 = n = 32
= n = 32
Environ 32 femelles de Perca flavescens seront requises pour chaque zone (de référence et exposé) afin de détecter une différence d’âge de 25 %.
« Poids relatif des gonades » de femelles de Perca flavescens
Nous souhaitons déterminer quel sera l’effort d’échantillonnage requis pour détecter une différence de 25 % du poids des gonades de femelles Perca flavescens. Les résultats suivants proviennent de l’ANCOVA du cycle précédent pour la même fabrique. Voir la section 8.6.2.1 du présent chapitre pour plus de renseignements et des définitions de termes.
- Taille des échantillons : 29 (réf.), 30 (exp.)
- Écart-type combiné (des résidus) en utilisant des données soumises à une transformation logarithmique = 0,0743033 (c’est aussi égal à la racine carrée du terme erreur quadratique moyenne obtenu en ajustant les données au modèle ANCOVA à pentes parallèles).
- Supposons une probabilité d’erreur de type I (α) de 0,05 et d’erreur de type II (β)de 0,2 (ces valeurs sont utilisées seulement à des fins d’exemple; pour la plupart des cas du Programme d’ESEE, les erreurs de type I et de type II doivent être établies de manière que α = β).
- ETZ = 0,0743033
- SCEZ = log(0,25+1) = log(1,25) = 0,09691
- Nous commençons avec n = 20 et résolvons ce qui suit par itérations pour la valeur estimée de n (
 )
)  = 2(tα + tβ)2(SDz/SCEz)2
= 2(tα + tβ)2(SDz/SCEz)2
- En utilisant n = 20, α = 0,05, et β = 0,2, nous obtenons tα = 2,093 et tβ = 0,861
[tα calculé pour un test bilatéral à (n–1) degrés de liberté; tβ calculé pour un test unilatéral à (n–1) degrés de liberté]  = 2(2,093 + 0,861)2(0,0743033/0,09691)2 = 10,26 = 11
= 2(2,093 + 0,861)2(0,0743033/0,09691)2 = 10,26 = 11- En utilisant n = 11, α = 0,05, et β = 0,2, nous obtenons tα = 2,228 et tβ = 0,879
 = 2(2,228 + 0,879)2(0,0743033/0,09691)2 = 11,34 = 12
= 2(2,228 + 0,879)2(0,0743033/0,09691)2 = 11,34 = 12- En utilisant n = 12, α = 0,05, et β = 0,2, nous obtenons tα = 2,201 et tβ = 0,876
 = 2(2,201 + 0,876)2(0,0743033/0,09691)2 = 11,13 = 12
= 2(2,201 + 0,876)2(0,0743033/0,09691)2 = 11,13 = 12 = n = 12
= n = 12
Environ 12 femelles de Perca flavescens seront requises pour chaque site (de référence et exposé) afin de détecter une différence de 25 % du poids relatif des gonades.
A1.9 Analyses de la puissance post hoc
« Condition » – femelles de Catostomus commersoni
Dans cet exemple, un résultat non significatif est obtenu pour le critère d’effet de la condition de femelles de Catostomus commersoni. Un exemple d’analyse de puissance est effectué pour déterminer la puissance du test réalisé afin de détecter le seuil critique d’effet. Nous obtenons les résultats d’ANCOVA suivants en utilisant le log(poids corporel) comme variable dépendante et le log(longueur) comme covariable. Voir la section 8.6.2.2 du présent chapitre pour plus d’explications et des définitions de termes.
| Source | Somme des carrés | d.l. | Carré moyen | Rapport F | p |
|---|---|---|---|---|---|
| log(longueur) | 0,121190 | 1 | 0,119427 | 119,32 | <0,001 |
| Site | 0,000046 | 1 | 0,000046 | 0,05 | 0,831 |
| Erreur | 0,027025 | 27 | 0,001001 | ||
| Total | 0,148261 | 29 |
- Le SCE pour la condition est 10 % de la moyenne de référence (converti à SCEZ par la formule suivante) et la probabilité d’erreur de type I (α) utilisée initialement pour l’ANCOVA de l’exemple ci-dessus était 0,05 (0,831 est plus grand que 0,05, et la comparaison entre le site d’exposition et le site de référence est donc non significative).
La formule du calcul de la puissance est :
![]()

- SCEZ = log(f +1) , où f = SCE est représenté comme fraction de la moyenne de référence.
Donc SCEZ = log(0,1+1) = log(1,1) = 0,0413926 - n = 15 pour chaque site et, par conséquent, tα = 2,145

- tβ = 1,538 correspond à β = 0,1486
- Puissance = 1 - β = 0,8514
La puissance du test est modérée (puissance = 0,8514) pour détecter une différence de 10 %, bien que l’erreur de type II (β = 0,1486) n’ait pas été suffisamment faible pour être égale à l’erreur de type I (α = 0,05). La recommendation du Programme d’ESEE est d’établir a comme égal à β (le risque pour l’industrie est égal au risque pour l’environnement). Par conséquent, une valeur supérieure de α aurait dû être utilisée pour cette ANCOVA avant de déclarer que la comparaison n’est pas significative, pour que α = β. Dans ce cas particulier, la valeur de p de l’ANCOVA (0,831) était assez élevée, ce qui fait que la comparaison entre le site d’exposition et le site de référence serait encore déclarée non significative, même si on fixait α à une valeur aussi élevée que β = 0,1486 (p = 0,831 > 0,1486). La répétition des analyses de puissance pour des valeurs plus élevés de a entraînerait une baisse des valeurs de β. D’autres analyses post hoc ne seraient donc pas nécessaires dans ce cas pour déclarer une absence de signification. Les futurs efforts de suivi à cet endroit devraient utiliser une combinaison de plus grandes tailles d’échantillons et/ou de valeurs de α plus élevées pour avoir une puissance suffisante pour détecter le SCE d’intérêt. Ainsi, la proposition d’étude en vue du prochain suivi devrait inclure des analysesde puissance a priori appropriées.
Annexe 2 : Représentation graphique et tabulaire des données
Liste des figures :
- Figure A2-1 : Diagramme du processus de décision illustrant les traitements des données des critères d’effet pour le poisson et le benthos et renvois aux exemples de tableaux et de graphiques présentés dans cette annexe
- Figure A2-2 : Diagramme en rectangles et moustaches des statistiques descriptives de l’âge selon l’espèce de poisson et le sexe
- Figure A2-3 :Résultats de l’analyse de variance (ANOVA) de l’âge moyen des poissons prélevés dans les zones de référence et d’exposition (moyenne et erreur type)
- Figure A2-4 : Régression linéaire du poids du foie du poisson en fonction du poids corporel, comme exemple de résumé des effets sur le poids du foie ou la taille des gonades (males de Catostomus sp.)
- Figure A2-5 : Statistiques descriptives de la densité totale des invertébrés benthiques provenant d’un plan d’échantillonnage contrôle-impact
- Figure A2-6 : Résutats de l’analyse de variance (ANOVA) de la densité totale des invertébrés benthiques provenant d’un plan d’échantillonnage contrôle-impact
- Figure A2-7 : Diagramme de la densité totale des invertébrés benthiques en fonction de la distance du diffuseur provenant d’un plan d’échantillonnage par gradient linéaire
Liste des tableaux :
- Tableau A2-1 :Statistiques descriptives de l’âge selon l’espèce de poisson et le sexe
- Tableau A2-2 : Résultats de l’analyse de variance (ANOVA) de l’âge selon l’espèce de poisson et le sexe
- Tableau A2-3 : Résultats de l’analyse de covariance (ANCOVA) du poids du foie par rapport au poids corporel selon l’espèce et le sexe
- Tableau A2-4 : Tableau récapitulatif des résultats pour les poissons
- Tableau A2-5 : Statistiques descriptives de la densité totale des invertébrés benthiques
- Tableau A2-6 : Résultats de l’analyse de variance (ANOVA) de la densité totale des invertébrés benthiques
- Tableau A2-7 : Tableau récapitulatif des statistiques descriptives des invertébrés benthiques
- Tableau A2-8 : Tableau récapitulatif des résultats pour les invertébrés benthiques
- Tableau A2-9 : Résumé récapitulatif des effets sur le site
Annexe 2 : Représentation graphique et tabulaire des données
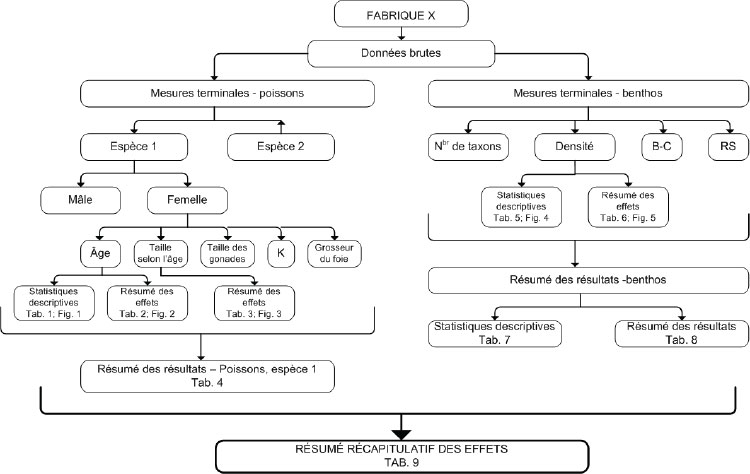
Figure A2-1 : Diagramme du processus de décision illustrant les divers traitements des données des critères d’effet pour le poisson et le benthos et renvois aux exemples de tableaux et de graphiques présentés dans cette annexe. K : coefficient de condition; B-C : indice de Bray-Curtis; RS : indice de régularité de Simpson. (description longue)
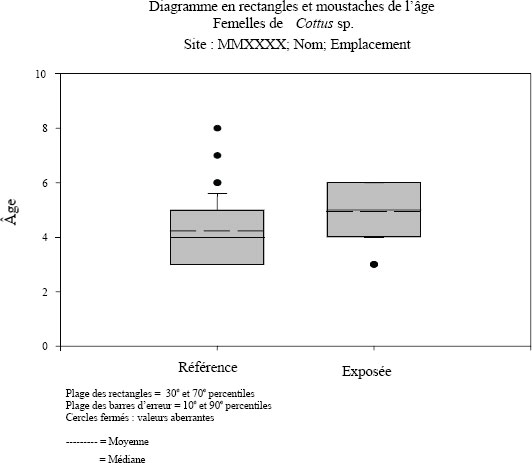
Figure A2-2 : Diagramme en rectangles et moustaches des statistiques descriptives de l’âge selon l’espèce de poisson et le sexe (description longue)
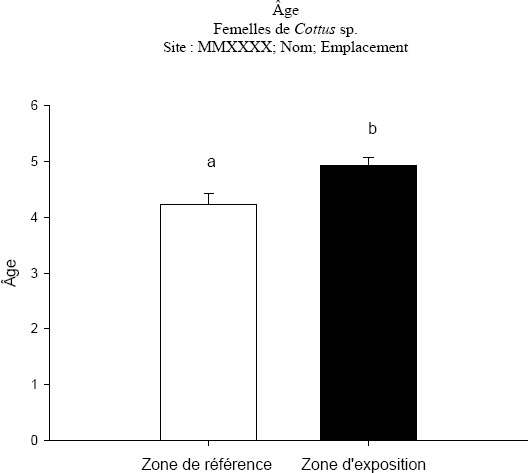
Figure A2-3 : Résultats de l’analyse de variance (ANOVA) de l’âge moyen des poissons prélevés dans les zones de référence et exposée (moyenne et erreur type) (description longue)
Note : La différence entre les bâtons identifiés par des lettres différentes est significative. La barre verticale indique la moyenne, et les barres horizontales, l’erreur type.
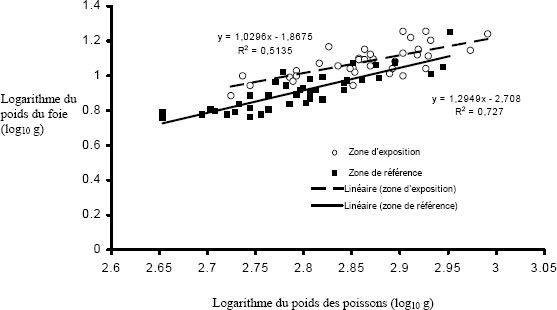
Figure A2-4 : Régression linéaire du poids du foie du poisson en fonction du poids corporel, comme exemple de résumé des effets sur le poids du foie ou la taille des gonades (males de Catostomus sp.) (description longue)
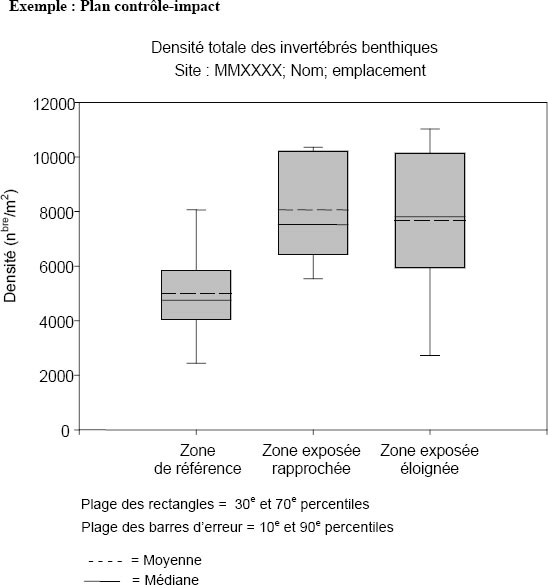
Figure A2-5 : Statistiques descriptives de la densité totale des invertébrés benthiques provenant d’un plan d’échantillonnage contrôle-impact (description longue)
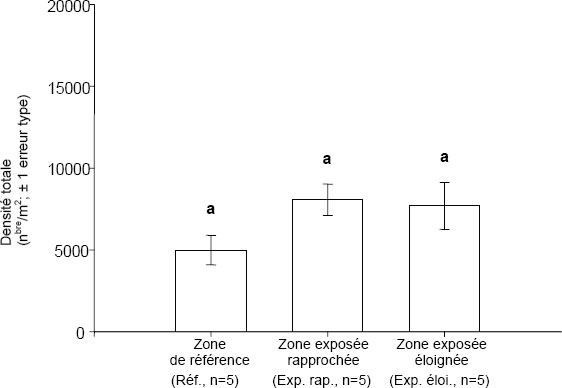
Figure A2-6 : Résultats de l’analyse de variance (ANOVA) de la densité totale des invertébrés benthiques provenant d’un plan d’échantillonnage contrôle-impact (description longue)
Note : Les bâtons identifiés par les mêmes lettres ne sont pas significativement différents. Les valeurs indiquées sont les moyennes et les erreurs types correspondantes.
Exemple : Plan par gradient linéaire
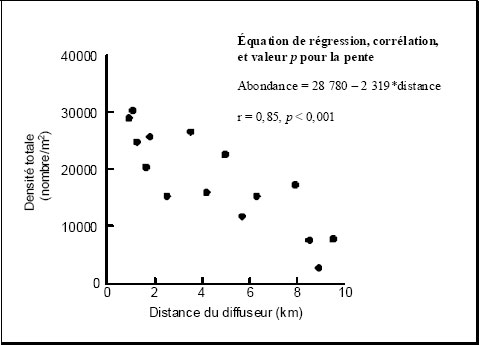
Figure A2-7 : Diagramme de la densité totale des invertébrés benthiques en fonction de la distance du diffuseur provenant d’un plan d’échantillonnage par gradient linéaire (description longue)
| Zone | Moy. | ET | Erreur type | n | Max. | Min. |
|---|---|---|---|---|---|---|
| Référence | 4,23 | 1,16 | 0,19 | 39 | 8,00 | 3,00 |
| Exposée | 4,93 | 0,93 | 0,14 | 46 | 6,00 | 3,00 |
| Sources de variation | Somme des carrés | Degrés de liberté | Carré moyen | F | p | Significatif à p < 0,05 |
|---|---|---|---|---|---|---|
| Intergroupe | 0,072624 | 1 | 0,072624 | 11,25004 | 0,001202 | oui |
| Intragroupe | 0,535802 | 83 | 0,006455 | |||
| Totale | 0,608426 | 84 |
| Zone | n | Logarithmes | (R2) | Pentes différentes? | Logarithmes | Pentes différentes? | Antilog MMC | Am- pleur de la diffé- rence | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pente | ET | p | Signi- fica- tif à p < 0,05 | Moyenne des moindres carrés (MMC) | ET | p | Signi- fica- tif à p < 0,05 | |||||
| Réf. | 39 | 1,3 | 0,0547 | 0,727 | - | - | 0,95 | 0,0624 | - | - | 8,93 | - |
| Exp. | 38 | 1,03 | 0,0632 | 0,5135 | 0,212 | Non | 1,04 | 0,0616 | 0,001 | Oui | 10,96 | 23 % |
| Niveau trophique | Espèces | Sexe | Type de réponse | Critère d’effet | Effet? | Direction | Ampleur |
|---|---|---|---|---|---|---|---|
| Poisson | Catostomus catostomus (Meunier rouge) | F | Survie | Âge | s.o. | ||
| Utilisation d’énergie | Poids selon l’âge | s.o. | |||||
| Poids relatif des gonades | Non | ||||||
| Stockage d’énergie | Condition | Oui | réf. < exp. | 7 %2 | |||
| Poids relatif du foie | Oui | réf. < exp. | 21 %2 | ||||
| M | Survie | Âge | s.o. | ||||
| Utilisation d’énergie | Poids selon l’âge | s.o. | |||||
| Poids relatif des gonades | Oui | ||||||
| Stockage d’énergie | Condition | Oui | réf. < exp. | 6 %2 | |||
| Poids relatif du foie | Oui | réf. < exp. | 23 %2 | ||||
| Cottus ricei (Chabot à tête plate) | F | Survie | Âge | Oui | réf. < exp. | 8 %2 | |
| Utilisation d’énergie | Poids selon l’âge | Oui | réf. < exp. | 52 %1 | |||
| Poids relatif des gonades | Oui | réf. < exp. | 57 %2 | ||||
| Stockage d’énergie | Condition | Oui | réf. < exp. | 31 %1 | |||
| Poids relatif du foie | Oui | réf. < exp. | 62 %2 | ||||
| M | Survie | Âge | Oui | réf. < exp. | 8 %2 | ||
| Utilisation d’énergie | Poids selon l’âge | Oui | réf. < exp. | 106 %1 | |||
| Poids relatif des gonades | Oui | réf. < exp. | 11 %2 | ||||
| Stockage d’énergie | Condition | Oui | réf. < exp. | 18 %2 | |||
| Poids relatif du foie | Oui | réf. < exp. | 52 %2 |
1 L’ANCOVA a été effectuée et les pentes sont significativement différentes. Consulter l’annexe 7.1 pour des directives sur le calcul de l’ampleur de l’effet.
2 L’ampleur est calculée en comparant les moyennes ajustées pour les zones de référence et exposée (si les données sont transformées en logarithmes; l’ampleur est calculée avec les antilogarithmes des moyennes ajustées). Dans le cas présent, les pentes ne sont pas significativement différentes de sorte que les moyennes ajustées peuvent être comparées. L’équation est la suivante :[(moyenne ajustée de la zone exposée – moyenne ajustée de la zone de référence)/moyenne ajustée de la zone de référence] × 100.
| Zone | Moyenne | ET | Erreur type | n | Max. | Min. |
|---|---|---|---|---|---|---|
| Référence | 4 986,85 | 2 011,21 | 899,44 | 5 | 8 062,02 | 2 442,73 |
| Exposée rapprochée* | 8 062,73 | 2 135,30 | 954,94 | 5 | 10360,31 | 5 535,88 |
| Exposée éloignée* | 7 685,04 | 3 205,63 | 1 433,60 | 5 | 11 027,65 | 2 717,00 |
* Exposée rapprochée = fortement exposée à l’effluent; Exposée éloignée = peu exposée à l’effluent
| Sources de variation | Somme des carrés | degrés de liberté | Carré moyen | F | p | Significatif à p < 0,05 |
|---|---|---|---|---|---|---|
| Intragroupe | 2,81 E + 07 | 2 | 1,41 E + 07 | 2,236 | 0,15 | Non |
| Intergroupe | 7,55 E + 07 | 12 | 6,29 E + 06 | |||
| Totale | 1,04 E + 08 | 14 |
| Critère d’effet | Zone | Moy. | ET | Erreur type | n | Max. | Min. |
|---|---|---|---|---|---|---|---|
| Nombre de taxons | Référence | 19,60 | 1,52 | 0,68 | 5 | 21 | 18 |
| Exposée rapprochée* | 21,20 | 1,48 | 0,66 | 5 | 23 | 19 | |
| Exposée éloignée* | 20,00 | 1,87 | 0,84 | 5 | 23 | 18 | |
| Densité | Référence | 4 986,85 | 2 011,21 | 899,44 | 5 | 8 062,02 | 2 442,73 |
| Exposée rapprochée | 8 062,73 | 2 135,30 | 954,94 | 5 | 10 360,31 | 5 535,88 | |
| Exposée éloignée | 7 685,04 | 3 205,63 | 1 433,60 | 5 | 11 027,65 | 2 717,00 | |
| Indice de régularité de Simpson | Référence | 0,77 | 0,03 | 0,014 | 5 | 0,82 | 0,75 |
| Exposée rapprochée | 0,81 | 0,03 | 0,015 | 5 | 0,86 | 0,78 | |
| Exposée éloignée | 0,67 | 0,04 | 0,017 | 5 | 0,71 | 0,63 | |
| Indice de Bray-Curtis | Référence | 0,24 | 0,11 | 0,05 | 5 | 0,42 | 0,14 |
| Exposée rapprochée | 0,37 | 0,10 | 0,05 | 5 | 0,48 | 0,24 | |
| Exposée éloignée | 0,44 | 0,09 | 0,04 | 5 | 0,55 | 0,34 |
* Exposée rapprochée = fortement exposée à l’effluent; Exposée éloignée = peu exposée à l’effluent
| Niveau trophique | Critère d’effet | Effet? | Direction | Ampleur1 | |
|---|---|---|---|---|---|
| % | ET | ||||
| Benthos | Densité | Non | |||
| Nombre de taxons | Non | ||||
| Indice de régularité de Simpson | Oui Oui | référence > exposée éloignée exposée rapprochée > exposée éloigné | 13 %1 17 %1 | 3,33 ET 4,67 ET | |
| Indice de Bray-Curtis | Oui | référence < exposée éloignée | 83 %1 | 1,82 ET | |
1 Pour un plan contrôle-impact, l’ampleur est calculée en % [(moyenne de la zone exposée – moyenne de la zone de référence)/moyenne de la zone de référence] × 100 et standardisée par rapport à l’écart-type de la zone de référence (moyenne de la zone exposée – moyenne de la zone de référence)/écart-type de la zone de référence).
| Niveau trophique | Espèces | Sexe | Type de réponse | Critère d’effet | Effet? | Observation | Ampleur3 | |
|---|---|---|---|---|---|---|---|---|
| % | ET | |||||||
| Poisson | Catostomus catostomus (Meunier rouge) | F | Survie | Âge | s.o. | |||
| Utilisation d’énergie | Poids selon l’âge | s.o. | ||||||
| Poids relatif des gonades | Non | |||||||
| Stockage d’énergie | Condition | Oui | réf. < exp. | 7 %2 | ||||
| Poids relatif du foie | Oui | réf. < exp. | 21 %2 | |||||
| M | Survie | Âge | s.o. | |||||
| Utilisation d’énergie | Poids selon l’âge | s.o. | ||||||
| Poids relatif des gonades | Non | |||||||
| Stockage d’énergie | Condition | Oui | réf. < exp. | 6 %2 | ||||
| Poids relatif du foie | Oui | réf. < exp. | 23 %2 | |||||
| Cottus ricei (Chabot à tête plate) | F | Survie | Âge | Oui | réf. < exp. | 8 %2 | ||
| Utilisation d’énergie | Poids selon l’âge | Oui | réf. < exp. | 52 %1 | ||||
| Poids relatif des gonades | Oui | réf. < exp. | 57 %2 | |||||
| Stockage d’énergie | Condition | Oui | réf. < exp. | 31 %1 | ||||
| Poids relatif du foie | Oui | réf. < exp. | 62 %2 | |||||
| M | Survie | Âge | Oui | réf. < exp. | 8 %2 | |||
| Utilisation d’énergie | Poids selon l’âge | Oui | réf. < exp. | 106 %1 | ||||
| Poids relatif des gonades | Oui | réf. < exp. | 11 %2 | |||||
| Stockage d’énergie | Condition | Oui | réf. < exp. | 18 %2 | ||||
| Poids relatif du foie | Oui | réf. < exp. | 52 %2 | |||||
| Benthos | Densité | Non | ||||||
| Nombre de taxons | Non | |||||||
| Indice de régularité de Simpson | Oui | réf. > exp. éloi. | 13 % | 3,33 | ||||
| Oui | exp. rap. > exp. éloi. | 17 % | 4,67 | |||||
| Indice de Bray-Curtis | Oui | réf. < exp. éloi. | 83 % | 1,82 | ||||
1 L’ANCOVA a été effectuée et les pentes sont significativement différentes. Consulter l’annexe 7.1 pour les directives sur le calcul de l’ampleur de l’effet.
2 L’ampleur a été calculée en comparant les moyennes ajustées pour la zone de référence et la zone exposée (si les données sont transformées en logarithmes, l’ampleur est calculée avec l’antilogarithme des moyennes ajustées). Dans le cas présent, les pentes ne sont pas significativement différentes de sorte que les moyennes ajustées peuvent être comparées. L’équation est la suivante : [(moyenne ajustée de la zone exposée – moyenne ajustée de la zone de référence)/moyenne ajustée de la zone de référence] × 100.
3 Pour les études des communautés d’invertébrés benthiques suivant un plan contrôle-impact, l’ampleur est calculée en % [(moyenne de la zone exposée – moyenne de la zone de référence)/moyenne de la zone de référence] × 100 et standardisée par rapport à l’écart-type de la zone de référence (moyenne de la zone exposée – moyenne de la zone de référence)/écart-type de la zone de référence).
Annexe 3 : Étude de cas – ANCOVA et analyse de puissance pour l’étude des poissons
Ce cas est founi pour montrer un exemple d’application des méthodes recommandées dans le présent document. Les données ont été recueillies au cours d’une étude précédente sur les poissons adultes à une fabrique de pâtes et papiers canadienne. Dans cet exemple, la fabrique produit de la pâte kraft et rejette un effluent dans un milieu récepteur lacustre. La zone de référence était une baie adjacente du lac dont l’habitat naturel possède des caractéristiques semblables à celles de l’habitat de la zone exposée rapprochée (fortement exposée à l’effluent), et elle ne reçoit pas de déversements allochtones. L’espèce sentinelle choisie pour l’étude est le Meunier noir (Catostomus commersoni). Les tailles des échantillons étaient proches de celles recommandées pour l’étude des poissons, à l’exception du nombre de mâles dans la zone exposée rapprochée :
| Zone exposée rapprochée (fortement exposée à l’effluent) | Zone de référence | |
| Mâles | 12 | 22 |
| Femelles | 26 | 24 |
L’ensemble de données comprend des renseignements sur la longueur, le poids total, le poids du foie, le sexe, le poids des gonades et l’âge des meuniers adultes mâles et femelles. Il n’y avait pas d’estimations de la fécondité.
Après l’étape initiale visant à assurer que l’ensemble des données était exempt d’erreurs de transcription, la moyenne et l’écart-type de chaque variable ont été calculés par sexe et par zone d’échantillonnage (tableau A3-1). Les opérations mathématiques ont été exécutées séparément pour les mâles et les femelles. Des courbes de distribution normale des erreurs ont été produites pour chaque variable (par sexe et par zone) pour repérer les valeurs aberrantes et évaluer la normalité des données. L’examen de ces diagrammes n’a révélé aucune valeur aberrante évidente, à l’exception d’un mâle de la zone exposée rapprochée. Les diagrammes des résidus d’ANOVA/ANCOVA peuvent aussi être utilisés pour examiner les données.
| Sexe | Zone | Longueur à la fourche (cm) | Poids corporel (g) | Poids des gonades (g) | Poids du foie (g) | Âge (ans) |
|---|---|---|---|---|---|---|
| Femelle | Référence | 44,4 ± 2,4 (24) | 1135,1 ± 150,4 (24) | 46,0 ± 7,5 (24) | 15,8 ± 2,1 (24) | 10,8 ± 3,4 (24) |
| Exposée rapprochée* | 41,5 ± 3,0 (26) | 1081,7 ± 228,4 (26) | 36,9 ± 15,9 (26) | 17,8 ± 7,5 (16) | 11,1 ± 3,0 (26) | |
| Mâle | Référence | 41,4 ± 1,8 (22) | 975,9 ± 90,1 (22) | 66,4 ± 11,1 (21) | 10,8 ± 1,6 (22) | 10,5 ± 3,0 (22) |
| Exposée rapprochée* | 39,3 ± 1,8 (12) | 950,9 ± 166,6 (11) | 48,0 ± 15,5 (12) | 18,4 ± 8,4 (12) | 12,3 ± 3,0 (12) |
* Exposée rapprochée = fortement exposée à l’effluent
Tel que mentionné précédemment, la plupart des résultats ont été obtenus en utilisant une ANCOVA. À titre d’exemple, une description détaillée est présentée pour le paramètre de la taille (longueur) selon l’âge de Meuniers noirs femelles (une critères d’appui de l’étude des poissons). Pour ces calculs, les données de la longueur et de l’âge ont été transformées en log10.
La première étape est de procéder au test préliminaire d’égalité des pentes. L’énoncé du modèle pour l’analyse de la taille selon l’âge est représenté par l’équation suivante :
log(longueur) = constante + zone + log(âge) + zone*log(âge)
où le terme d’interaction zone*log(âge) représente le test de l’égalité des pentes des droites de régression des zones, et log(âge), la covariable. D’après le tableau d’ANCOVA, il est évident que le terme d’interaction zone*log(âge) n’est pas significatif (p = 0,376) (tableau A3-2a). Cela indique que les pentes des droites de régression pour chaque zone peuvent être traitées comme étant approximativement parallèles. Ce résultat indique aussi que le terme d’interaction peut être éliminé du modèle et que nous pouvons continuer avec le modèle d’ANCOVA suivant :
log(longueur) = constante + zone + log(âge)
où « zone » représente le test des différences des moyennes ajustées. L’erreur quadratique moyenne (EQM) tirée de la table d’ANCOVA résultante fournira l’estimation de la variabilité (EQM = 0,00033) de la longueur selon l’âge (tableau A3-2b). Pendant que les analyses susmentionnées sont menées, les résidus du modèle préliminaire et du modèle d’ANCOVA peuvent être conservés pour l’évaluation des conditions de normalité et d’homogénéité de la variance.
| Source | Somme des carrés | d.l. | Carré moyen | Rapport F | p |
|---|---|---|---|---|---|
| Zone | 0,00086 | 1 | 0,00086 | 2,62639 | 0,11193 |
| Log(âge) | 0,02126 | 1 | 0,02126 | 64,58474 | < 0,0001 |
| Zone*log(âge) | 0,00026 | 1 | 0,00026 | 0,79780 | 0,37640 |
| Erreur | 0,01514 | 46 | 0,00033 |
| Source | Somme des carrés | d.l. | Carré moyen | Rapport F | p |
|---|---|---|---|---|---|
| Zone | 0,01240 | 1 | 0,01240 | 37,57576 | < 0,0001 |
| Log(âge) | 0,02167 | 1 | 0,02167 | 65,66667 | < 0,0001 |
| Erreur | 0,01541 | 47 | 0,00033 |
Calcul de la taille de l’échantillon
Pour calculer la taille de l’échantillon, l’équation de la puissance avec les valeurs de Z peut être utilisée. À titre de rappel, l’équation est :
n = 2 (Zα + Zβ)2 (ET/SCE)2 + 0,25(Zα)2
La racine carrée de l’EQM du modèle d’ANCOVA remplace l’écart-type (ET) dans l’équation de la puissance. Le seuil critique d’effet (SCE) correspond à l’effet ou à la différence de paramètre qu’on souhaite déceler. Aux fins du présent exemple et pour les autres paramètres de l’étude de cas, la taille de l’échantillon a été calculée pour des SCE de 5, 10, 20, 50 et 100 % (c.-à-d. les différences entre les zones).
Bon nombre des paramètres calculés pour l’étude des poissons suivent généralement une distribution log-normale et exigent des transformations logarithmiques. Pour calculer la taille de l’échantillon, l’ET et le SCE doivent être exprimés en logarithmes. Il est à noter qu’aux fins de l’étude des poissons de l’ESEE, il ne faut pas ajouter 1 aux valeurs avant de les transformer en logarithmes, car cela a des effets indésirables sur les variances calculées lorsqu’on change les unités de mesure. L’expression d’une différence en logarithme équivaut à multiplier ou à diviser cette différence par un certain facteur. Par exemple, si la différence dans le log de la longueur entre deux zones est de 0,301, les poissons d’une zone ont alors une longueur deux fois supérieure (antilog de 0,301 = 2) aux poissons de l’autre zone. Dans le tableau suivant, le SCE a été exprimé en logarithme avec l’antilog correspondant; ces valeurs de SCE correspondent en gros à celles utilisées pour des données non transformées :
| Seuil critique d’effet (logarithme) | 0,0212 | 0,0414 | 0,0792 | 0,176 | 0,301 |
| Seuil critique d’effet(antilog) | 1,05 | 1,10 | 1,20 | 1,50 | 2,00 |
| % d’augmentation* | 5 | 10 | 20 | 50 | 100 |
| % de diminution† | 5 | 9 | 17 | 33 | 50 |
* Dans la zone exposée comparativement à la zone de référence.
† Dans la zone exposée comparativement à la zone de référence.
Par conséquent, dans le cas de la longueur selon l’âge (log10 des données) :
- ET = (EQM)0,5 = (0,00033)0,5 = 0,01817
- Zα (test bilatéral) = 1,96
- Zβ (test unilatéral) = 1,282
- SCE = 5 % (voir tableau ci-dessus)
n = 2 (1,96+1,28)2 (0,01817/0,0212)2 + 0,25(1,96)2
n = 16,4 (ou, arrondi, n=17)
De même, pour les autres SCE, les tailles de l’échantillon estimées (c.-à-d. le nombre de poissons à prélever par zone) seraient :
| SCE | 5 % | 10 % | 20 % | 50 % |
| n | 17 | 5 | 3 | 2 |
L’estimation de la variabilité et les calculs de la taille de l’échantillon pour le poids des gonades, le poids du foie et la condition des mâles et des femelles de meuniers sont effectués de la même façon que celle décrite pour la longueur selon l’âge (tableau A3-3). Dans tous les cas, sauf un, les pentes des droites de régression de la zone de référence et de la zone exposée rapprochée étaient égales, et l’EQM du modèle d’ANCOVA a été employée pour estimer la variabilité. En ce qui concerne les Meuniers noirs mâles, les pentes des régressions du log(poids) en fonction du log(longueur) (c.-à-d. la condition) n’étaient pas égales d’une zone à l’autre (p = 0,0068). Pour déterminer si la seule valeur aberrante (mâle, zone exposée rapprochée) a pu influer sur l’ANCOVA, les calculs ont été refaits en omettant cette donnée. Cette fois, les régressions étaient homogènes entre les zones. Ces résultats découlent partiellement du fait que la taille de l’échantillon était petite (c.-à-d. un effet accru de la valeur aberrante sur la régression) et cela devrait être signalé dans le rapport sur les données.
Dans le cas de l’âge moyen, l’EQM de l’ANOVA unilatérale a été utilisée pour estimer la variabilité (tableau A3-3).
Les résultats finaux des calculs de la taille des échantillons (tableau A3-3) indiquent que le nombre maximal de poissons qu’il faut prélever dans chaque zone était d’environ 703 mâles et de 738 femelles pour déceler une différence entres les zones (SCE) de 5 %; de 185 mâles et de 194 femelles, pour déceler une différence de 10 %; de 52 mâles et de 54 femelles pour déceler une différence de 20 % et de 12 mâles et de 12 femelles pour déceler une différence de 50 %. Parmi tous les paramètres, l’âge moyen était le plus variable et nécessitait la plus grande taille d’échantillon pour déceler des différences.
| Critère | Sexe | Modèle | Log | Taille de l’échantillon estimée (nombre de poissons/zone) | |||
|---|---|---|---|---|---|---|---|
| EQM | SCE 5 % | SCE 10 % | SCE 20 % | SCE 50 % | |||
| Longueur selon l’âge | Mâle | ANCOVA | 0,00014 | 8 | 3 | 2 | 2 |
| Femelle | ANCOVA | 0,00033 | 17 | 5 | 3 | 2 | |
| Poids selon l’âge | Mâle | ANCOVA | 0,00211 | 100 | 27 | 9 | 3 |
| Femelle | ANCOVA | 0,00295 | 139 | 38 | 11 | 3 | |
| Condition | Mâle | ANCOVA1 | s.o. | - | - | - | - |
| Femelle | ANCOVA | 0,00100 | 48 | 14 | 5 | 2 | |
| Poids du foie | Mâle | ANCOVA | 0,00994 | 466 | 123 | 35 | 8 |
| Femelle | ANCOVA | 0,00626 | 294 | 78 | 22 | 6 | |
| Poids des gonades | Mâle | ANCOVA | 0,00881 | 413 | 110 | 31 | 7 |
| Femelle | ANCOVA | 0,01013 | 475 | 126 | 35 | 8 | |
| Âge moyen | Mâle | ANOVA | 0,01499 | 703 | 185 | 52 | 12 |
| Femelle | ANOVA | 0,01574 | 738 | 194 | 54 | 12 | |
1 L’analyse préliminaire (test des pentes), première étape de l’ANCOVA, était significative (soit pentes non parallèles).
Figures et tableaux
Le tableau 8-1 présente le degré de précision attendu et les statistiques sommaires des valeurs exigées pour l’étude des poissons. Les valeurs devant être évaluées sont la longueur, le poids corporel total, l’âge, le poids des gonades, le poids des œufs, la fécondité, le poids du foie ou de l’hépatopancréas, les anomalies et le sexe. Pour chaque valeur exigée, le degré de précision attendu et les statistiques sommaires à fournir sont indiqués.
Le tableau 8-2 présente les indicateurs et les critères d’effets pour différents plans d’étude s’appliquant à l’étude de la population de poissons. Les principaux indicateurs d’effets comprennent la croissance, la reproduction, la condition et la survie. Chaque indicateur d’effet est accompagné par la liste des critères d’effets pour chacun des trois plans d’étude : échantillonnage létal, échantillonnage non létal et étude fondée sur les mollusques sauvages.
Le tableau 8-3 présente les critères d’appui à utiliser pour les analyses complémentaires. Les indicateurs d’effets, soit l’utilisation de l’énergie et le stockage de l’énergie, sont associés aux critères d’appui et aux méthodes statistiques nécessaires.
Le tableau 8-4 présente un résumé des critères d’effets analysés au moyen de l’ANCOVA. Les principaux critères d’effets comprennent la condition, le poids relatif du foie, le poids relatif des gonades, le poids selon l’âge, la taille selon l’âge et la fécondité relative. Chaque critère d’effet correspond à une variable dépendante et à une covariable.
Le tableau 8-5 présente les critères d’effets et les critères d’appui pour l’exploitabilité des poissons, ainsi que les méthodes statistiques. Les variables et les méthodes statistiques des critères d’effets et des critères d’appui sont fournies.
Le tableau 8-6 illustre la méthode statistique utilisée pour déterminer la présence d’un effet pour chacun des sept plans d’étude. Chaque plan d’étude correspond à une méthode statistique.
Le tableau 8-7 présente les tailles d’échantillon nécessaires pour détecter une différence de ± 2 ET relativement aux valeurs indiquées de a (0,01, 0,05 et 0,10) et 1-b (0,99, 0,95, 0,90 et 0,80).
La figure A1-1 est un diagramme de dispersion illustrant le poids des gonades en fonction du poids corporel de Catostomus macrocheilus femelles. L’axe des x représente le poids corporel, alors que l’axe des y représente le poids des gonades. La ligne du graphique représente un indice gonadosomatique = 1 %.
La figure A1-2 est un diagramme de dispersion illustrant le poids des gonades en fonction du poids corporel de Lota lota femelles. L’axe des x représente le poids corporel, alors que l’axe des y représente le poids des gonades. La ligne du graphique représente un indice gonadosomatique = 1 %.
La figure A1-3 présente des diagrammes en rectangles et moustaches de femelles de Catostomus commersoni par sites. L’image A illustre une valeur aberrante détectée sur le site exposé, tandis que sur l’image B, cette valeur a été supprimée.
Le tableau A1-1 présente les statistiques sommaires de la « longueur ». Chaque espèce est associée à différents facteurs, notamment le sexe, le site, le nombre, la longueur moyenne, l’écart-type, l’erreur type, la longueur minimale et la longueur maximale.
La figure A1-4 est un diagramme de dispersion illustrant les résidus studentisés en fonction de l’ordre des observations pour l’ANOVA de la longueur de Catostomus commersoni femelles. L’axe des x représente l’ordre des observations, tandis que l’axe des y représente les résidus studentisés.
La figure A1-5 est un diagramme de dispersion illustrant le poids corporel en fonction de la longueur de Rhinichthys cataractae mâles. L’axe des x représente la longueur, tandis que l’axe des y représente le poids corporel. Les données sont ajustées à deux droites de régression distinctes; une pour chaque site.
La figure A1-6 est un diagramme de dispersion illustrant le poids des gonades en fonction du poids corporel de Catostomus commersoni mâles. L’axe des x représente le poids corporel, alors que l’axe des y représente le poids des gonades. Les données sont ajustées à deux droites de régression distinctes, une pour chaque site.
La figure A1-7 est un diagramme de dispersion illustrant les résidus studentisés en fonction du poids corporel de Catostomus commersoni mâles; les données sont ajustées au modèle d’interaction y = β0 + β1x1 + β2x2 + β3(x1 · x2). L’axe des x représente le poids corporel, alors que l’axe des y représente les résidus studentisés.
La figure A1-8 est un diagramme de dispersion illustrant la distance de Cook par rapport au poids corporel de Catostomus commersoni mâles; les données sont ajustées au modèle d’interaction y = β0 + β1x1 + β2x2 + β3(x1 · x2). L’axe des x représente le poids corporel, alors que l’axe des y représente la distance de Cook.
La figure A1-9 est un diagramme de dispersion illustrant le poids corporel en fonction de la longueur de Catostomus catostomus mâles. L’axe des x représente la longueur, tandis que l’axe des y représente le poids corporel. Les données sont ajustées à deux droites de régression distinctes; une pour chaque site.
La figure A1-10a est un diagramme de dispersion illustrant le poids des gonades en fonction du poids corporel de Catostomus catostomus mâles. L’axe des x représente le poids corporel, alors que l’axe des y représente le poids des gonades. Les données sont ajustées à deux droites de régression distinctes; une pour chaque site.
La figure A1-10b est un diagramme de dispersion illustrant les mêmes données que celles de la figure A1-10a, auxquelles s’ajoutent les valeurs minimales et maximales de la plage de chevauchement des valeurs de la covariable entre les sites établis.
La figure A1-11 est un diagramme de dispersion illustrant le poids des gonades en fonction du poids corporel de Catostomus commersoni femelles. L’axe des x représente le poids corporel, alors que l’axe des y représente le poids des gonades. Les données sont ajustées à deux droites de régression distinctes, une pour chaque site.
La figure A1-12a est un diagramme de dispersion illustrant le poids corporel en fonction de la longueur de Pleuronectes americanus mâles. L’axe des x représente la longueur, tandis que l’axe des y représente le poids corporel. Les données sont ajustées à deux droites de régression distinctes, une pour chaque site.
La figure A1-12b est un diagramme de dispersion illustrant le poids corporel en fonction de la longueur de Pleuronectes americanus mâles, et présentant un sous-ensemble des données de la figure A1-12a où seuls les poissons dont la longueur est supérieure à 1,375 sont conservés. L’axe des x représente la longueur, tandis que l’axe des y représente le poids corporel.
La figure A1-13 est un diagramme de dispersion illustrant le poids corporel en fonction de l’âge de Fundulus heteroclitus femelles. L’axe des x représente l’âge, tandis que l’axe des y représente le poids corporel. Les données sont ajustées à deux droites de régression distinctes, une pour chaque site.
La figure A2-1 est un diagramme décisionnel présentant les divers traitements des données des critères d’effets pour le poisson et le benthos. Ce diagramme indique les tableaux et les graphiques de l’annexe en lien avec ces méthodes.
La figure A2-2 présente des diagrammes en rectangles et moustaches sur les statistiques descriptives de l’âge selon l’espèce de poisson et le sexe. La plage des rectangles se situe entre le 30e et le 70e centiles, tandis que la plage des barres d’erreur, entre le 10e et le 90e centiles. L’âge moyen est représenté par une ligne pointillée, et l’âge médian est représenté par une ligne continue.
La figure A2-3 est un graphique illustrant les résultats de l’analyse de variance (ANOVA) de l’âge moyen des poissons prélevés dans les zones de référence et exposée. Les barres verticales représentent l’âge moyen, tandis que les barres horizontales représentent l’erreur type.
La figure A2-4 est un graphique illustrant la régression linéaire du poids du foie du poisson en fonction du poids corporel, comme exemple de résumé des effets sur le poids du foie ou la taille des gonades, au moyen de l’exemple d’un Catostomus mâle. L’axe des x représente le poids des poissons, tandis que l’axe des y représente le poids du foie.
La figure A2-5 est un graphique illustrant les statistiques descriptives de la densité totale des invertébrés benthiques provenant d’un plan contrôle-impact. La plage des diagrammes en rectangles se situe entre le 30e et le 70e centiles, tandis que la plage des barres d’erreur, entre le 10e et le 90e centiles. La densité moyenne est représentée par une ligne pointillée, et la densité médiane, par une ligne continue.
La figure A2-6 est un graphique illustrant les résultats de l’analyse de variance de la densité totale des invertébrés benthiques au moyen d’un plan contrôle-impact. Les valeurs indiquées sont les moyennes et les erreurs types correspondantes.
La figure A2-7 est un diagramme de dispersion illustrant la densité totale des invertébrés benthiques en fonction de la distance du diffuseur provenant d’un plan d’échantillonnage par gradient linéaire. L’axe des x représente la distance du diffuseur (en kilomètres), alors que l’axe des y représente la densité totale (le nombre d’individus par mètre carré).
Le tableau A2-1 présenteles statistiques descriptives de l’âge selon l’espèce de poisson et le sexe. À l’aide de l’exemple de femelles de Cottus sp., des renseignements sur la zone, l’âge moyen, l’écart-type, l’erreur type, le nombre de spécimens, l’âge maximal et l’âge minimal sont fournis.
Le tableau A2-2 présente les résultats de l’analyse de variance de l’âge selon l’espèce de poisson et le sexe. Les sources de variation comprennent les sources intergroupes, les sources intragroupes et le total. D’autres renseignements, comme la somme des carrés, les degrés de liberté, le carré moyen, le rapport F, la valeur p et la signification lorsque p est inférieure à 0,05 sont inclus.
Le tableau A2-3 présente les résultats de l’analyse de covariance du poids du foie par rapport au poids corporel selon le sexe et l’espèce. À l’aide de l’exemple de mâles de Catostomus sp., les résultats de l’ANCOVA pour la zone de référence et la zone exposée sont indiqués. Pour chaque zone, le nombre de spécimens, la pente de la droite de régression (données transformées en log), l’écart-type et le coefficient de détermination (R2) sont fournis. Pour répondre à la question « les pentes sont-elles différentes? », la signification de la valeur p indiquée est comparée à une valeur p de 0,05. De même, le moyenne des moindres carrés (MMC) et l’écart-type de chacune des deux zones sont indiqués, tout comme l’antilog des MMC et, enfin, l’ampleur de la différence sous forme de pourcentage. Pour la deuxième question : « les moyennes sont-elles différentes? », la réponse est fournie par une comparaison entre la valeur p indiquée et une valeur p de 0,05.
Le tableau A2-4 est un tableau sommaire des résultats sur les poissons. Les renseignements fournis comprennent notamment le niveau trophique (poissons), l’espèce, le sexe, le type de réponse, le critère d’effet, la présence d’effet, la direction et l’ampleur.
Le tableau A2-5 présente les statistiques descriptives de la densité totale des invertébrés benthiques. Les principales statistiques descriptives comprennent la zone, la moyenne, l’écart-type, l’erreur type, le nombre d’échantillons, la densité maximale et la densité minimale.
Le tableau A2-6 présente les résultats de l’analyse de variance de la densité totale des invertébrés benthiques. Les sources de variation comprennent les sources intergroupes, les sources intragroupes et le total. D’autres renseignements, comme la somme des carrés, les degrés de liberté, le carré moyen, le rapport F, la valeur p et la signification lorsque la valeur p indiquée est inférieure à 0,05 sont inclus.
Le tableau A2-7 présente un sommaire de toutes les statistiques descriptives sur les invertébrés benthiques. Les principales statistiques descriptives comprennent le critère d’effet, la zone, l’écart-type, l’erreur type et le nombre d’échantillons. Les moyennes, les valeurs maximales et les valeurs minimales sont indiquées par rapport aux taxons, à la densité, à l’indice de régularité de Simpson et à l’indice de Bray-Curtis.
Le tableau A2-8 illustre un sommaire de tous les résultats relatifs aux invertébrés benthiques. Le niveau trophique (benthos), le critère d’effet, la présence d’effet, la direction et l’ampleur sont fournis. Les critères d’effets comprennent notamment la densité, le nombre de taxons, l’indice de régularité de Simpson et l’indice de Bray-Curtis.
Le tableau A2-9 présente un sommaire global des effets sur les sites. Le niveau trophique (poissons d’abord, benthos ensuite) est indiqué; ensuite, pour les poissons : l’espèce, le sexe, le type de réponse, le critère d’effet, la présence d’effet, la direction et l’ampleur sont fournis; et pour le benthos : le critère d’effet, la présence d’effet, la direction et l’ampleur sont fournis.
Le tableau A3-1 présente la moyenne, l’écart-type et la taille de l’échantillon (n) pour les mesures effectuées sur le Meunier noir (Catostomus commersoni) au cours de l’étude. Les mesures consignées sont exprimées selon le sexe et la zone, et comprennent notamment la longueur à la fourche, le poids corporel, le poids des gonades, le poids du foie et l’âge.
Le tableau A3-2 illustre la taille selon l’âge(longueur) en fonction de l’âge du Meunier noir femelle au moyen d’une analyse de covariance. Les renseignements sont présentés dans deux tableaux. Le tableau (a) présente une analyse préliminaire de l’égalité des pentes. Les sources comprennent la zone, le log(âge), la zone multipliée par le log(âge) et l’erreur. Les renseignements établis pour chacune des sources comprennent la somme des carrés, les degrés de liberté, le carré moyen, le rapport F et la valeur p. Le tableau (b) est la table du modèle d’ANCOVA (test des moyennes ajustées). Les sources comprennent notamment la zone, le log(âge) et l’erreur. Comme dans le cas du tableau (a), pour chacune des sources du tableau (b), la somme des carrés, les degrés de liberté, le carré moyen, le rapport F et la valeur p sont indiqués.
Le tableau A3-3 présente un exemple d’étude du nombre de poissons requis pour déceler des différences significatives dans les critères reliés aux poissons entre les zones; l’erreur quadratique moyenne (EQM) du modèle a été utilisée comme estimation de la variabilité. Les tailles de l’échantillon ont été calculées selon un seuil critique d’effet = 0,90 et a = 0,05. Toutes les données ont été transformées en log.
Retournez à la table des matières
Chapitre 9
9. Autres méthodes de suivi
9.2 Utilisation de mésocosmes comme autre méthode de suivi biologique
- 9.2.1 Renseignements généraux sur l’aménagement de systèmes de bassins artificiels et sur leur utilisation
- 9.2.2 Applicabilité dans le cadre du Programme d’ESEE
- 9.2.3 Technologie des mésocosmes
- 9.2.4 Facteurs à considérer pour le choix du site
- 9.2.5 Plans d’études de suivi biologique
- 9.2.6 Évaluation des effets sur les poissons
- 9.2.7 Évaluation des effets sur la communauté d’invertébrés benthiques
- 9.2.8 Mesures complémentaires
9.3 Utilisation de bivalves en cage comme méthode de suivi de rechange
- 9.3.1 Introduction
- 9.3.2 Contexte
- 9.3.3 Approche
- 9.3.4 Choix de l’espèce
- 9.3.5 Plan d’étude
- 9.3.6 Configuration des cages
- 9.3.7 Méthodes pour débuter l’essai, déployer et récupérer les cages et terminer l’essai
- 9.3.8 Indicateurs d’effets
- 9.3.9 Assurance de la qualité et contrôle de la qualité
- 9.3.10 Analyses des données
- 9.3.11 Mercure
- 9.3.12 Rapports
Liste des tableaux
Tableau 9-4 : Taxons suggérés pour les études de bivalves en cage menées dans le cadre des ESEE
Tableau 9-6 : Différences observées entre les unionidés et les sphaeriidés
Liste des figures
Figure 9-3 : Représentation schématique (non à l’échelle) du système de mésocosmes sur remorque
Figure 9-4 : Photographie de l’installation d’un mésocosme modulaire
Figure 9-5 : Schéma de circulation du mésocosme modulaire
Figure 9-7 : Installation sur le terrain de mésocosmes modulaires
Figure 9-10 : Moule avec lobe du manteau à maturité.
Figure 9-12 : Impressions musculaires dans une coquille de Mytilus spp.
Figure 9-13 : Cadre utilisé pour les essais d’exposition des bivalves
Figure 9-14 : Éléments du système modulaire de mésocosmes
Figure 9-15 : Schéma d’assemblage du système modulaire de mésocosmes
9.1 Aperçu
Dans certains sites miniers, il peut arriver qu’on ne puisse procéder aux études de suivi standard sur les poissons et les communautés d’invertébrés benthiques. Et bien que les raisons de cette impossibilité varient en fonction de chaque site, les plus fréquentes sont la présence de conditions dangereuses (p. ex., débit élevé), un habitat inapproprié pour l’échantillonnage, la présence de facteurs de confusion, tel le rejet d’autres effluents dans la zone d’exposition, faisant en sorte qu’il est difficile, voire impossible, d’attribuer un effet précis à l’effluent à l’étude.
Lorsque la mine ne peut concevoir une étude sur les poissons ou les communautés d’invertébrés benthiques de façon à éliminer les problèmes dus aux facteurs de confusion présents dans le milieu, elle fournira les raisons scientifiques et proposera d’autres méthodes de suivi efficientes, techniquement réalisables et conformes au plan de l’étude. Le présent chapitre traite d’un certain nombre de méthodes de suivi de remplacement recommandées.
D’autres méthodes scientifiquement défendables peuvent aussi être choisies, à la condition qu’elles produisent des résultats qui permettent de déterminer si l’effluent a une incidence sur les populations de poissons (croissance, reproduction, condition et survie), les tissus des poissons (mercure) ou la communauté d’invertébrés benthiques (densité des invertébrés benthiques, richesse des taxons, indice de régularité de Simpson et indice de Bray-Curtis). Les études en mésocosmes (systèmes de bassins artificiels, aussi appelés cours d’eau artificiels) ou sur les bivalves en cage sont les méthodes recommandées pour remplacer les études sur les poissons. Dans le cas des invertébrés benthiques, l’étude en mésocosmes est la méthode recommandée.
Il peut exister d’autres méthodes scientifiquement défendables pour les études du poisson et du benthos effectuées sur le terrain. Les mines peuvent proposer dans leur plan d’étude d’autres méthodes. Les nouvelles méthodes de remplacement seront évaluées par l’agent d’autorisation, avec l’appui du Comité aviseur technique et du Comité scientifique des études de suivi des effluents sur l’environnement (ESEE). Pour évaluer la méthode de remplacement suggérée, certains éléments particuliers à sa conception seront considérés comme essentiels afin d’atteindre l’objectif du programme, notamment, qu’elle soit pertinente sur le plan environnemental, que les résultats soient interprétables et qu’elle soit scientifiquement défendable et réalisable.
La section 9.2 vise à définir des critères devant guider la conception et la mise en œuvre des études en mésocosmes (système de bassins artificiels) proposées comme méthodes de remplacement dans le cadre du Programme d’ESEE pour évaluer les effets des effluents des mines de métaux sur les invertébrés benthiques et le poisson. Le présent guide a pour objet de préciser les normes recommandées pour assurer une démarche scientifique rigoureuse et ainsi satisfaire aux exigences du Programme d’ESEE. En 2002, le premier guide technique portant sur l’utilisation de systèmes de bassins artificiels, ou mésocosmes, a été publié. Ce guide a été mis à jour en 2011 pour tenir compte des résultats des travaux de recherche et de développement en cours, en vue d’améliorer cette méthode d’ESEE.
La section 9.3 contient des instructions techniques pour la conduite d’expériences contrôlées à l'aide de bivalves en cage, en suspension dans la colonne d’eau, afin de vérifier la présence d’effets associés aux rejets industriels par une comparaison des mesures relevées dans une zone exposée avec celles prises dans des zones de référence. Cette approche constitue une solution de remplacement aux études de poissons et doit être envisagée par les mines lorsque les études de poissons se sont révélées infructueuses ou peu pratiques au cours des dernières phases d’ESEE, ou lorsqu’il y a des problèmes méthodologiques (p. ex., facteurs de confusion) ou des préoccupations liées à la sécurité.
9.2.1 Renseignements généraux sur l’aménagement de systèmes de bassins artificiels et sur leur utilisation
La recommandation de recourir à des systèmes de bassins artificiels comme cours d’eau artificiels dans une méthode de suivi de remplacement s’appuie sur des années de recherche et de développement qui ont démontré que ces mésocosmes peuvent produire des données sur les effets des effluents qui sont de bonne qualité et qui répondent au cadre réglementaire (tableau 9-1). Depuis 1991, des systèmes de bassins artificiels ont été utilisés sur place pour évaluer les effets d’effluents de sources ponctuelles sur les écosystèmes aquatiques. Au Canada, de telles études en mésocosme ont été menées 14 fois en huit ans, de 1993 à 2008, en vertu du Programme d’ESEE (tableau 9-1). Toutes ces études et tous ces travaux de mise au point de la méthode de remplacement ont été conduits en collaboration par les secteurs privé et public, les universités et les experts-conseils. Le financement de la recherche a été obtenu par le biais de mécanismes indépendants du Programme d’ESEE. Les diverses utilisations de la méthode sont présentées en détail ci-après afin de montrer les progrès accomplis à ce jour. Le tableau 9-1 résume ces études et énumère les sources de référence appropriées qui devraient être consultées si le recours à ces types d’études et de protocoles expérimentaux est envisagé.
Étude des bassins des rivières du Nord (EBRN) en Alberta, 1991-1996
Une des premières utilisations du système de mésocosmes a servi à évaluer les effets des effluents de fabriques de pâtes et papiers (EFPP) sur les communautés d’invertébrés benthiques et d’algues périphytiques de la rivière Athabasca (tableau 9-1) (Culp et Podemski, 1996; Culp et al., 1996; Podemski et Culp, 1996; Podemski, 1999; Culp et al., 2001). Des systèmes de bassins artificiels ont été utilisés pour distinguer les effets des nutriants des EFPP de ceux des contaminants, en s’appuyant sur les différences observées dans les réactions biologiques. En effet, un apport modéré de nutriants stimulerait la productivité primaire et secondaire, tandis que des contaminants entraîneraient une réduction de la croissance et de la reproduction et conduiraient ultimement à la mort des organismes (Culp et Podemski, 1996; Podemski et Culp, 1996; Culp et Lowell, 1998; Culp et al., 2001). Pour atteindre cet objectif, trois traitements ont été mis à l’essai au printemps 1993 : eau de la rivière Athabasca (témoin); EFPP traités à 1 % (v/v); nutriants à 1 % (v/v) (azote + phosphore) aux concentrations mesurées dans les EFPP. L’hypothèse émise était qu’une exposition aux EFPP et aux nutriants se traduirait par un effet d’enrichissement dans le réseau trophique benthique, et qu’il n’y aurait pas de différence entre les effets des deux traitements. Ceci porterait à conclure que les effets des EFPP aux concentrations mesurées dans la rivière Athabasca sont dus à un apport en nutriants plutôt qu’à la toxicité des contaminants.
Un grand système non mobile de mésocosmes a été utilisé près de la fabrique de pâte à papier de Hinton (Alberta). Ce système consistait en 16 bassins circulaires de 0,9 m2 disposés sur des tables (modèle I, figure 9-1A). De l’eau de rivière était pompée dans chacun de ces bassins à un débit contrôlé, et les effluents et nutriants étaient ajoutés selon le protocole décrit par Culp et Podemski (1996) et par Podemski (1999). Une communauté benthique normalisée, endémique de la rivière Athabasca, a été ensemencée dans chaque bassin et exposée aux EFPP pendant 28 jours. À la fin de la période d’exposition, une augmentation de la biomasse des algues, de la croissance des nymphes d’éphémères (Ephemeroptera : Siphloneuridae, Baetidae) et de plécoptères (Plecoptera : Capniidae) et de l’abondance des insectes dans les bassins expérimentaux par rapport au traitement de référence a été constatée (Culp et Podemski, 1996; Podemski et Culp, 1996; Culp et al., 1996). En outre, il n’y avait pas de différence entre les effets du traitement à 1 % d’EFPP et celui à 1 % de nutriants, ce qui corroborait l’hypothèse selon laquelle les effets des EFPP sur le réseau trophique benthique sont dus à un enrichissement en nutriants.
Plan d’action du Fraser (PAF), en Colombie-Britannique, 1991-1998
Le PAF a été mis en œuvre entre 1991 et 1997 afin d’évaluer la santé de l’écosystème du bassin du fleuve Fraser et, notamment, de mesurer les incidences de huit effluents de fabriques de pâtes et papiers (Gray et Tuominen, 1998; McGreer et Belzer, 1998).
Rivière Thompson, Kamloops (Colombie-Britannique), 1993-1994
La rivière Thompson affichait des signes d’enrichissement en nutriants dus à des rejets d’EFPP à Kamloops. Ce problème faisait l’objet d’études depuis le début des années 1970, époque au cours de laquelle des accumulations anormales d’algues périphytiques avaient été observées dans la rivière, en aval de la fabrique de pâte (Federal-Provincial Thompson River Task Force, 1976). Bothwell et Daley (1981), Bothwell (1985), Bothwell et al. (1992) et Bothwell et Culp (1993) ont montré comment le phosphore biodisponible présent dans les EFPP stimule la croissance des algues périphytiques.
Des circuits de circulation d’eau ont été utilisés pour distinguer les effets des nutriants des EFPP de ceux des contaminants sur les algues et les invertébrés benthiques (tableau 9-1). La méthode employée était différente de celle retenue pour l’EBRN, puisqu’elle s’est appuyée sur une relation dose-effet et sur l’hypothèse qu’on observerait les effets des nutriants aux faibles concentrations d’effluents et les effets des contaminants aux concentrations d’effluents plus élevées. En 1993 et 1994, des algues périphytiques et des chironomidés ont été exposés à une série de dilutions d’EFPP (0,25 à 10 %, v/v) (Dubé et Culp, 1996; Culp et Lowell, 1998). Des systèmes de bassins artificiels plus petits ont servi à tester les effets des EFPP sur des espèces particulières d’insectes (Lowell et al., 1995, 1996) et sur des réseaux trophiques benthiques simplifiés (Dubé et Culp, 1996). L’approche fondée sur une espèce unique mettait l’accent sur les effets observés sur des taxons sentinelles clés et visait à améliorer la connaissance des réactions propres à des espèces particulières (Culp et al., 2000b).
Le système de bassins artificiels a été aménagé sur les rives de la rivière Thompson, à Kamloops, tout juste en amont du point de rejet de l’effluent. Il était constitué d’un système d’approvisionnement en eau, de réservoirs de traitement pour la préparation des diverses dilutions d’effluent avec apport continu d’eau de rivière, et de petits bassins circulaires de 0,33 L (superficie de 45 cm2) (Dubé, 1995; Lowell et al., 1995) (figure 9-2A). Des algues et des larves de chironomidés (Diptères : Orthocladiinae) prélevées dans une zone de référence ont été placées dans les bassins, et les variations de la biomasse de ces deux organismes ont été mesurées après deux à trois semaines d’exposition à l’effluent (Dubé et Culp, 1996). Dubé et Culp (1996) ont observé une augmentation de la biomasse algale (chlorophylle a) due à l’enrichissement en nutriants à toutes les concentrations d’effluent. La biomasse totale des chironomidés et les poids individuels ont également augmenté aux faibles concentrations d’effluent (< 5 %). Les concentrations plus élevées (5 % et 10 %) ont entraîné une réduction de la biomasse des chironomidés qui était peut-être due aux effets des contaminants.
| Année | Pro- gramme1 | Type d’effluent2 | Objectif de la recherche | Lieu | Système de bassins artificiels | Références |
|---|---|---|---|---|---|---|
| 1993-1994 | EBRN | EFPP | Déterminer les effets des nutriants et des contaminants contenus dans les EFPP sur les algues périphytiques et les communautés d’invertébrés benthiques. | Rivière Athabasca, Hinton (Alberta) | Modèle I : Grand système fixe de mésocosmes Benthos. Étude sur le terrain. | Podemski (1999) Culp et Podemski (1996) Podemski et Culp (1996) Culp et al. (1996) Culp et al. (2001) |
| 1993-1994 | PAF | EFPP | Évaluer les effets des EFPP de plus en plus concentrés (0,25 %-10 %) sur le périphyton et les chironomidés (Diptères : Orthocladiinae). | Rivière Thompson, Kamloops (C.‑B.) | Petit système de microcosmes. Benthos. Étude sur le terrain. | Dubé (1995) Dubé et Culp (1996) Dubé et al. (1997) Lowell et al. (2000) |
| 1993 | PAF | EFPP | Déterminer les effets liés à la teneur en nutriants des EFPP sur l’éphéméroptère Baetis tricaudatus. | Rivière Thompson, Kamloops (C.‑B.) | Petit système de microcosmes. Benthos. Étude sur le terrain. | Lowell et al. (1995) Lowell et al. (1996) Culp et al. (1996) Lowell et al. (2000) |
| 1994 | PAF | EFPP | Déterminer les effets des EFPP (1 % et 3 %) sur le périphyton et les communautés d’invertébrés benthiques. | Fleuve Fraser, Prince George (C.-B.) | Modèle II : Grand système mobile de mésocosmes. Benthos. Étude sur le terrain. | Culp et Cash (1995) Culp et al. (1996) Culp et al. (2000a) |
| 1997 | ESEE – pâtes et papiers | EFPP | Évaluer les effets des EFPP (3 %) sur un poisson de petite taille, le Choquemort (Fundulus heteroclitus), en milieu marin. | Port de Saint John, Saint John (N.-B.) | Modèle II : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Cash et al. (2003) |
| 1997-1998 | ESEE – pâtes et papiers | EFPP | Déterminer les effets de l’EFPP final, des différents circuits d’eaux de procédé en usine et d’une modification des procédés sur un poisson de petite taille, le Choquemort, en milieu estuarien. | Fleuve Saint-Jean, Saint John (N.-B.) | Modèle II : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Dubé (2000) Dubé et MacLatchy (2000a) Cash et al., (2003) |
| 1999 | IRST | EFPP | Déterminer les effets des EFPP soumis à des traitements primaire et secondaire sur un poisson de petite taille, le Choquemort, en milieu estuarien. | Rivière Miramichi, Miramichi (N.‑B.) | Modèle III : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Dubé et al. (2002) |
| 2000 | IRST | EMM | Déterminer les effets des EMM (20 %, 80 %) sur les Saumons atlantiques juvéniles (Salmo salar). | Rivière Little, Mines Brunswick, Miramichi (N.‑B.) | Modèle III : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Dubé et al. (2005) |
| 2001 | IRST | EFPP EEM | Évaluer les impacts individuels et combinés des EEM et des EFPP sur le Naseux des rapides (Rhinichthys cataractae). | Rivière Wapiti (Alberta) | Modèle III : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Dubé et al. (2004) |
| 2001 | IRST | EFPP EEM | Évaluer les impacts individuels et combinés des EEM et des EFPP sur le réseau trophique benthique. | Rivière Wapiti, Grande Prairie (Alberta) | Modèle III : Grand système mobile de mésocosmes. Benthos. Étude sur le terrain. | Culp et al. (2004) |
| 2001-2002 | Industrie | EMM | Évaluer les effets des EMM traités provenant de trois mines et déversés dans le ruisseau Junction, à Sudbury, sur le Mulet à cornes (Semotilus atromaculatus) et le Mulet perlé (Margariscus margarita). | Ruisseau Junction, Sudbury (Ontario) | Modèle III : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Dubé et al. (2006) |
| 2002 | Industrie | EMM | Évaluer les effets d’un EMM (45 %) sur le cycle vital partiel du chironomidé Chironomus tentans. | Ruisseau Junction, Sudbury (Ontario) | Système modulaire de mésocosmes. Benthos. Étude sur le terrain. | Hruska et Dubé (2004) |
| 2003 | CRSNG | EMM | Comparer les résultats d’un bioessai sur le cycle vital partiel effectué en cours d’eau artificiels à ceux d’un bioessai normalisé effectué en laboratoire, afin d’évaluer les effets d’un EMM (45 %) sur le chironomidé C. tentans. | Ruisseau Junction, Sudbury (Ontario) | Système modulaire de mésocosmes. Benthos. Étude en laboratoire. | Hruska et Dubé (2005) |
| 2003 | CRSNG/ industrie | EFPP | Déterminer les effets d’un EFPP final (1 %, 100 %) et de divers circuits d’eaux de procédé sur le cycle vital partiel du Méné à grosse tête (Pimephales promelas) en conditions environnementales réalistes (c.-à-d. qualité de l’eau ambiante et de l’effluent). | Terrace Bay (Ontario) | Bioessai sur remorque. Poisson. Étude sur le terrain. | Rickwood et al. (2006a; 2006b) |
| 2004 | CRSNG/ industrie | EMM | Élaborer un bioessai multitrophique auto-entretenu afin d’évaluer comparativement les effets d’une exposition aux EMM (45%) par le biais de l’eau (Méné à grosse tête seulement) et par transfert trophique (C. tentans et Méné à grosse tête) sur la reproduction du Méné à grosse tête (cycle vital partiel) | Ruisseau Junction, Sudbury (Ontario) | Système modulaire de mésocosmes. Multi-trophique. Étude en laboratoire. | Rickwood et al. (2006c) |
| 2005 | CRSNG/ industrie | EMM | Élaborer un bioessai multitrophique auto-entretenu afin d’évaluer comparativement les effets d’une exposition aux EMM (45%) par le biais de l’eau (Méné à grosse tête seulement) et par transfert trophique (C. tentans et Méné à grosse tête) sur la reproduction du Méné à grosse tête (cycle vital partiel) | Ruisseau Junction, Sudbury (Ontario) | Système modulaire de mésocosmes. Multi-trophique. Étude sur le terrain. | Rickwood et al. (2008) |
| 2006 | CRSNG/ industrie | EFPP | Évaluer les effets des EFPP (20 %, 40 %, 60 %) sur le Méné à grosse tête (cycle vital partiel). | Rivière Wabigoon, Dryden (Ontario) | Système modulaire de mésocosmes. Poisson. Étude sur le terrain. | Pollock et al. (2009) |
| 2007 | CRSNG/ industrie | EMM et métal (agent causal possible) | Évaluer comparativement les systèmes de réponses du Méné à grosse tête (cycle vital partiel) à un mélange d’EMM (100 %, 25 %, 5 %) et à du sélénium (sous forme de séléniate) à l’aide d’une méthode de bioessai à mésocosmes multitrophique. | Lac Unknown, Key Lake (Saskat- chewan) | Système modulaire de mésocosmes. Poisson. Étude en laboratoire. | Pollock et al. (inédit) |
| 2008 | CRSNG/ industrie | EMM | Évaluer comparativement les voies d’exposition du Méné à grosse tête (cycle vital partiel) à l’effluent (rejet actuel; 25 %) et aux sédiments (contamination historique). | Lac Unknown, Key Lake (Saskat- chewan) | Système modulaire de mésocosmes. Poisson. Étude sur le terrain. | Driessnack, Dubé et al. (inédit) |
| 2008 | CRSNG/ industrie | EMM | Évaluer les effets de trois types de rejets d’EMM sur le Méné à grosse tête (cycle vital partiel). | Ruisseau Junction, Sudbury (Ontario) | Système modulaire de mésocosmes. Multi-trophique. Étude sur le terrain. | Ramilo, Dubé et al. (inédit) |
1 EBRN : Étude des bassins des rivières du Nord; PAF : Plan d’action du Fraser; ESEE : Études de suivi des effets sur l’environnement; IRST : Initiative de recherche sur les substances toxiques, CRSNG : Conseil de recherches en sciences naturelles et en génie du Canada.
2 EFPP : Effluent des fabriques de pâtes et papiers. EEM : Effluent d’égout municipal. EMM : Effluent des mines de métaux.
En 1993, Lowell et al. (1995; 1996) ont procédé à des essais en systèmes de bassins artificiels à échelle réduite sur la rivière Thompson, parallèlement à ceux de Dubé et Culp (1996). Ils ont utilisé l’éphémère Baetis tricaudatus pour mesurer les effets des EFPP (1 % et 10 %, v/v) sur la survie, la croissance, la mue et le développement morphologique sous deux régimes d’alimentation distincts (faible et élevé). Ainsi, l’exposition aux effluents a sensiblement stimulé la croissance et le développement des insectes, entraînant des augmentations de 20 à 50 % du poids corporel sec par rapport aux témoins. Bien que la fréquence des mues ait affiché une hausse chez les insectes exposés à une concentration faible (1 %); elle a diminué chez ceux exposés à une concentration plus élevée (10 %), laissant ainsi deviner l’intervention d’un mécanisme d’action des contaminants (Lowell et al., 1996). Les résultats de ces expériences en systèmes de bassins artificiels utilisant des éphémères en guise d’espèces sentinelles concordent avec ceux des essais réalisés par Dubé et Culp (1996) avec des chironomidés, qui montraient un effet d’enrichissement aux concentrations d’EFPP plus faibles et l’apparition d’effets inhibiteurs aux concentrations plus élevées.
En plus de concorder entre eux, les résultats des essais effectués en systèmes de bassins artificiels s’accordent également avec ceux des études sur le terrain (Culp et Lowell, 1998). L’analyse des tendances à long terme a montré que plusieurs familles de plécoptères, de tricoptères et d’éphémères étaient plus abondantes durant les années où les rejets de matières en suspension et de phosphore des fabriques de pâtes étaient les plus élevés (Lowell et al., 1996, 2000). Par ailleurs, une surveillance effectuée sur le terrain par Dubé et al. (1997) a également montré que les tendances temporelles et spatiales du phosphore, de la biomasse du périphyton et de la biomasse des chironomidés (Diptères : Orthocladiinae) dans la colonne d’eau étaient stables dans les conditions normales de fonctionnement des fabriques. Les effets des effluents de la fabrique sur le réseau trophique benthique de la rivière Thompson se limitaient donc à un enrichissement en nutriants. Toutefois, Dubé (1995) a également observé que les effets toxiques des contaminants rejetés par la fabrique avaient réduit la densité des chironomidés dans la rivière Thompson dans des zones peu exposées à l’effluent (zones éloignées) en aval du point de rejet lorsque le système de traitement de l’effluent secondaire de la fabrique a cessé de fonctionner en 1992.
Fleuve Fraser, Prince George (Colombie-Britannique), 1994
Des études des effets des effluents des fabriques de pâtes et papiers sur les réseaux trophiques benthiques à l’aide de systèmes de bassins artificiels ont également été réalisées à Prince George (Colombie-Britannique), sur une portion de 100 km du fleuve Fraser recevant les effluents de quatre fabriques de pâte (Culp et Lowell, 1998). En 1994, des communautés benthiques ont été exposées à des concentrations d’EFPP de 1 % et de 3 % (v/v) pendant 35 jours afin de déterminer si les faibles concentrations d’EFPP provoquaient un enrichissement en nutriants et si des concentrations plus élevées entraînaient des effets toxiques (tableau 9-1) (Culp et Cash, 1995; Culp et al., 2000a). Cette étude a porté sur un plus grand nombre de variables, dont le nombre de bactéries, la biomasse du périphyton, l’accumulation et la composition des contaminants cibles d’EFPP et la structure de la communauté d’invertébrés benthiques. Par ailleurs, outre les réactions propres aux espèces, les réactions propres aux communautés ont également été mesurées afin d’accroître la pertinence écologique de l’étude (Culp et al., 2000b).
De plus, le système de grands bassins artificiels a été modifié pour en accroître la souplesse, la mobilité et la rentabilité. Les bassins et les tables ont été montés sur deux remorques à plate-forme (Culp et al., 1996) (modèle II, figure 9-1B). Chaque remorque a par ailleurs été équipée d’un laboratoire pour les réservoirs d’effluent et d’eau, d’un espace d’entreposage des pompes et d’un espace pour le traitement des échantillons. La conception et l'exploitation des bassins artificiels, y compris l’ensemencement d’organismes benthiques, les débits et les protocoles d’échantillonnage, étaient celles décrites antérieurement par Culp et Cash (1995), Culp et Lowell (1998) et Culp et al., (2000a).
En outre, les résultats des études effectuées sur le fleuve Fraser sont venus corroborer ceux obtenus lors des études sur la rivière Thompson et les bassins des rivières du Nord (EBRN), démontrant que les effets des EFPP sur les réseaux trophiques benthiques étaient causés par l’enrichissement en nutriants. Pour leur part, Culp et al., (2000a) ont signalé que le nombre de bactéries, la biomasse du périphyton et la biomasse des taxons d’insectes dominants (chironomidés et plécoptères) augmentaient avec la durée d’exposition à l’effluent. Il convient cependant de noter que malgré l’observation d’un rapport dose-effet pour les contaminants des fabriques de pâte (p. ex., acides résiniques et composés phénoliques chlorés) mesurés dans le périphyton, ces accumulations dans les tissus ne se traduisaient pas par un ralentissement de la croissance des algues, ni par un changement de la variété des espèces. Enfin, les résultats concordaient également avec ceux des études réalisées sur le terrain et en laboratoire, ajoutant ainsi un poids à la preuve ayant trait aux effets des EFPP sur la structure des réactions des organismes benthiques dans le fleuve Fraser (Culp et al., 2000a).
Projets pilotes d’ESEE pour le secteur industriel au Nouveau-Brunswick, 1997-1998
Les travaux effectués dans le cadre de l’EBRN et du PAF ont montré l’utilité des systèmes de bassins artificiels pour l’évaluation des effets des EFPP sur les bactéries, le périphyton et les communautés d’invertébrés benthiques. Ces systèmes permettent de mesurer les réactions de biotes endémiques à des concentrations connues d’effluents dans des conditions ambiantes de lumière, de température et de qualité de l’eau qui correspondent aux conditions naturelles (Culp et al., 1996). Ces caractéristiques font également des systèmes de bassins artificiels une solution de rechange utile pour l’évaluation des effets des EFPP sur les poissons (Courtenay et al., 1998; Parker et Smith, 1997). Trois projets pilotes d’ESEE pour le secteur industriel ont été réalisés dans des milieux marins et estuariens en 1997 et en 1998, afin de développer des systèmes de bassins artificiels capables d’évaluer les effets des EFPP sur les poissons.
Port de Saint John, Saint John (Nouveau-Brunswick), 1997
Le premier projet pilote a été réalisé dans le port de Saint John (Nouveau-Brunswick) à l’aide d’un grand système mobile de mésocosmes (modèle II, figure 9-1B) afin d’évaluer les effets de l’effluent d’une fabrique de pâte thermomécanique soumis à un traitement secondaire sur un cyprinodontidé d’eau salée : le Choquemort (Fundulus heteroclitus) (tableau 9-1) (Cash et al., 2003; Dubé et al., 2002). La fabrique rejetait son effluent dans un milieu marin complexe, caractérisé par des marées extrêmes, une contamination historique des sédiments et la présence d’autres effluents (p. ex., eaux d’égout traitées et non traitées, eaux pluviales, l’effluent d’une autre fabrique de pâte et l’effluent d’une raffinerie de pétrole).
Le système de bassins artificiels était installé sur la rive, à l’extrémité d’une digue. De l’eau réceptrice, non exposée à l’EFPP, était pompée dans chaque bassin à chaque échange de marée comme l’ont décrit Cash et al. (2003) et Dubé et al, (2002). Deux traitements ont été testés : eau réceptrice témoin et eau à concentration d’effluent de 3 % (v/v). La concentration d’effluent à 3 % représentait celle observée sur la plus vaste étendue spatiale de la masse d’eau réceptrice déterminée par les études de délimitation du panache. L’effluent a par la suite été injecté pendant 28 jours dans chaque bassin à concentration de 3 % en même temps que les échanges d’eaux réceptrices, simulant ainsi les conditions d’exposition de l’espèce sentinelle, le Choquemort, qui vit dans les cuvettes de marée pendant la marée descendante ainsi qu’à marée basse (Kneib, 1986). Des poissons juvéniles (120 juvéniles par traitement) et des poissons adultes (60 adultes par sexe et par traitement) ont été répartis entre le groupe témoin et le groupe d’essai (à 3 % d’effluent) et nourris quotidiennement d’artemias congelées, et ce, à raison de 3 % de la biomasse totale du mésocosme. Le Choquemort a été choisi comme espèce sentinelle, parce que c’est une espèce bien connue, endémique au port de Saint John, d’une taille propice pour les circuits d’eau et sexuellement dimorphe (ce qui élimine le problème du contrôle du rapport des sexes) (Kneib et Stiven, 1978; Atz, 1986; Scott et Scott, 1988). Par ailleurs, les taux de croissance des juvéniles sont suffisamment élevés pour permettre la détection des effets liés aux effluents pour la durée de la période d’exposition aux températures expérimentales ambiantes (Kneib et Stiven, 1978). Les critères incluaient les critères d’effets étudiés dans le Programme d’ESEE sur les poissons sauvages (p. ex., croissance, taille des gonades et du foie, coefficient de condition) ainsi que des critères physiologiques d’appui (induction de l’oxygénase à fonction mixte [OFM], concentrations d’hormones sexuelles) (Cash et al., 2003; Dubé et al., 2002).
Cette étude a fourni de l’information sur les effets des EFPP sur une espèce de poisson endémique. Les taux de survie mesurés étaient proches de 100 % dans tous les groupes de traitement, et l’exposition à l’effluent n’a pas influé sur la croissance, ni sur l’activité de l’OFM (Cash et al., 2003). Toutefois, l’exposition à l’effluent a réduit significativement la taille des gonades et du foie chez les mâles et augmenté la production de certains stéroïdes sexuels chez les deux sexes.
Fleuve Saint-Jean, Saint John (Nouveau-Brunswick), 1997-1998
En 1997 et 1998, Dubé (2000) a utilisé des systèmes de bassins artificiels pour mesurer les effets d’un EFPP sur le Choquemort dans le fleuve Saint-Jean et évaluer les effets d’un changement apporté au processus de l’usine sur la qualité de l’effluent final (tableau 9-1). Il a utilisé, à cette fin, le grand système de mésocosmes (modèle II, figure 9-1B) et l’espèce sentinelle, tous deux retenus pour l’expérience précédente. Ainsi, cette étude se distinguait par la portée des hypothèses testées, le type de processus examiné (pâte kraft blanchie) et le type de milieu récepteur (estuaire).
En 1997, avant la modification du processus de la fabrique, des Choquemorts adultes ont été exposés à l’effluent final (1 %, v/v) pendant 27 jours (Dubé et MacLatchy, 2000a). En 1998, après la modification du processus, des Choquemorts juvéniles et adultes ont été exposés à trois concentrations d’EFPP (0,5 %, 1,0 % ou 5,0 %, v/v) pendant 30 jours et 60 jours. Le grand système de bassins artificiels était installé au bord du fleuve Saint-Jean, à l’extérieur de la zone d’effet de l’effluent. L’eau de référence était pompée en continu dans chaque bassin pour simuler les conditions d’exposition particulières au site. Les variables à l’étude incluaient la croissance des juvéniles, la taille des organes des adultes (foie, gonades), la condition, l’induction de l’OFM et les concentrations d’hormones reproductives.
Dans les deux études, les taux de survie sont restés supérieurs à 95 %, et la biomasse des poissons de tous les groupes de traitement a augmenté pendant toute la durée de la période d’exposition, laissant conclure à un taux d’alimentation adéquat (Dubé, 2000). L’exposition à une concentration d’effluent final de 1 % est restée sans effet sur la taille des organes des adultes (gonades et foie) dans les deux études. Toutefois, pour illustrer la réaction observée des Choquemorts à l’EFPP et pour corroborer la conclusion selon laquelle les poissons adultes restaient largement insensibles à une exposition à des concentrations équivalentes à celles prévalant dans l’effluent de cette fabrique, Dubé (2000) a utilisé en 1998 un plan d’étude basé sur la relation dose-effet. L’exposition à une concentration de 5 % d’EFPP pendant 60 jours a provoqué une augmentation significative de la taille du foie chez les deux sexes et une réduction significative de la longueur et du poids des poissons juvéniles (Cash et al., 2003; Dubé et al., 2002).
Le système de mésocosmes a également servi dans cette étude à évaluer les effets d’une modification du procédé de l’usine sur la qualité de l’effluent final (Dubé et MacLatchy, 2000a, Dubé et al., 2002). Aucun changement de la taille du foie et des gonades ou de la condition des Choquemorts adultes n’a été observé entre 1997 et 1998. Cependant, les tendances des concentrations d’hormones sexuelles ont varié d’une année à l’autre, laissant constater des diminutions significatives de la teneur en testostérone du plasma chez les deux sexes en 1997, mais pas en 1998. Des études ultérieures utilisant des essais de toxicité (Dubé et MacLatchy, 2000b) et l’exposition de Choquemorts en laboratoire à des EFPP (Dubé et MacLatchy, 2001) en appliquant la méthode du poids de la preuve ont confirmé que le changement de procédé avait éliminé la toxicité aiguë de l’effluent final et réduit la toxicité subaiguë de manière significative, y compris les effets sur les fonctions reproductrices d’une espèce locale de poisson.
Initiative de recherche sur les substances toxiques (IRST), 1999-2001
Durant cette période, quatre principaux domaines se sont développés dans les systèmes de bassins artificiels, dont le perfectionnement et l’optimisation du concept technologique; l’utilisation avec d’autres types d’effluents (mines de métaux); l’utilisation avec d’autres espèces de poissons; et l’utilisation dans le cadre de programmes d’évaluation biologique des effets cumulatifs d’effluents multiples (tableau 9-1).
Rivière Miramichi, Miramichi (Nouveau-Brunswick), 1999
Cette étude a servi à évaluer les effets d’effluents primaires et secondaires d’usines de pâte kraft blanchie (1 %, v/v) sur le Choquemort après 23 jours d’exposition à l’aide d’un grand système modifié de bassins artificiels (tableau 9-1) (Dubé et al., 2002). Le système consistait en 16 bassins circulaires (0,42 m2) montés sur une seule remorque pour faciliter les déplacements (modèle III, figure 9-1C). Une meilleure maîtrise de la dilution de l’effluent et des taux d’oxygène dissous a également été obtenue en modifiant la tuyauterie et en ajoutant un système d’aspiration pneumatique (Cash et al., 2003). AMEC Earth & Environmental Ltd. (anciennement Washburn & Gillis Associates Ltd.) a construit ce système et en est actuellement le propriétaire.
Le taux de survie des adultes était élevé dans tous les groupes de traitement (> 90 %), et les effluents n’ont pas eu d’effet sur la longueur, le poids, la condition, l’indice hépatosomatique (IHS) et l’indice gonadosomatique (IGS) après 23 jours d’exposition. Toutefois, les Choquemorts des deux sexes exposés à l’effluent secondaire ont présenté une réduction cinq fois plus importante des concentrations de testostérone du plasma comparativement aux poissons témoins. Ces concentrations étaient également sensiblement réduites par rapport à celles mesurées chez les poissons exposés à une concentration de 1 % d’effluent primaire. Ces résultats suggèrent que le traitement secondaire des effluents de certaines usines de pâte kraft blanchie ne peut éliminer les composés responsables de la dépression des hormones de reproduction chez certains poissons.
Rivière Little, Bathurst (Nouveau-Brunswick), 2000
Dans cette étude, des systèmes de bassins artificiels ont servi à évaluer les effets d’un effluent de mines de métaux (EMM). En 2000, des études en bassins artificiels ont été réalisées par Culp et al., (inédit) pour évaluer les effets d’un EMM sur les communautés d’invertébrés benthiques et d’algues. Dubé et al., (2005) ont mesuré simultanément les effets sur des Saumons atlantiques (Salmo salar)juvéniles d’une exposition à un EMM dans le milieu aquatique ambiant et dans un réseau multitrophique cultivé en conditions naturelles (algues + invertébrés benthiques + poissons). Les études ont été effectuées sur un site minier près de Bathurst (Nouveau-Brunswick). Dans la première de ces études, le grand système de bassins artificiels (modèle III) (figure 9-1C) a servi à évaluer les effets de concentrations d’EMM de 20 % et de 80 % (v/v) sur les saumons. Les niveaux de traitement de cette étude ont été choisis afin de reproduire les rejets actuels d’effluent (80 %) dans la rivière Little (Nouveau-Brunswick), et ceux prévus après la fermeture de la mine (20 %). L’exposition a duré 37 jours, et les variables à l’étude incluaient la croissance, la taille du foie, la condition, l’accumulation de métaux dans les tissus et les indices de stress, y compris la teneur en glycogène musculaire (Dubé et al., 2005). Dans la deuxième série d’études, le système de bassins artificiels (figure 9-2B) a servi à mesurer les réactions des invertébrés benthiques à des concentrations d’EMM de 20 % et 80 % après 24 jours d’exposition. Les variables à l’étude incluaient les variations de la densité totale d’invertébrés, la diversité des espèces, l’indice de diversité de Simpson, l’indice de Bray-Curtis et l’émergence des insectes (Culp et al., inédit). Dans la troisième série d’études, le système de bassins artificiels (figure 9-2B) a une fois de plus servi à exposer un réseau multitrophique auto-entretenu à des concentrations d’EMM de 20 % et de 80 % pendant 26 jours (Dubé et al., 2005). Des jeunes Chabots visqueux (Cottus cognatus) de l’année ont été placés dans des bassins artificiels préalablement ensemencés avec des communautés d’algues et d’invertébrés benthiques issus d’un cours d’eau témoin. On a ainsi été en mesure d’évaluer les effets de l’EMM sur des poissons en utilisant une voie d’exposition à un contaminant qui correspond plus aux conditions naturelles (c.-à-d., en utilisant un réseau trophique au lieu d’une source de nourriture non exposée).
Rivière Wapiti, Grande Prairie (Alberta), 2001
Des mésocosmes ont servi à distinguer les effets de confusion reliés à l’effluent secondaire d’une usine de pâte kraft blanchie des effets d’un effluent d’égout municipal sur le taux de survie, la croissance, la condition et le taux de reproduction du Naseux des rapides (Rhinichthys cataractae) adultes et juvéniles (Dubé et al., 2004), exposés aux traitements suivants pendant 42 jours : eau de cours d’eau de référence; EFPP (3 %), EFPP (10 %), EEM (1 %), et EEM (1 %) + EFPP (3 %). L’objectif des essais effectués avec l’EFPP consistait à examiner les effets, à des concentrations faibles et élevées, d’une exposition à l’effluent de l’usine de pâte seulement. Le traitement avec l’EEM seul et le traitement mixte étaient représentatifs des conditions existant en amont (EEM 1 %) et en aval (EEM 1 % + EFPP 3 %) du point de rejet des EFPP dans la rivière Wapiti. Les résultats ont montré qu’une concentration de 10 % d’EFPP avait altéré légèrement la condition des juvéniles et la production de certaines hormones sexuelles chez les adultes. L’exposition à 3 % d’EFPP a augmenté légèrement la condition des juvéniles, suggérant un effet d’enrichissement en nutriants aux concentrations plus faibles d’effluent. L’exposition aux EFPP est restée sans effet sur le taux de survie, la croissance, la taille des gonades ou le stade de développement des gonades. L’EEM a affecté les paramètres de la reproduction, dont la taille des gonades mâles, la fécondité des femelles et la concentration de certaines hormones chez les mâles et les femelles. Après une exposition à 10 % d’EFPP, les changements hormonaux observés étaient d’une ampleur comparable à ceux mesurés après une exposition à 1 % d’EEM. En résumé, cette étude a examiné de manière précise les effets par voie d’exposition hydrique d’un EFPP et d’un EEM sur une espèce de poisson fourragère après une exposition de 42 jours dans un mésocosme sur le terrain.
Culp et al., (2004) ont examiné les effets cumulés des EFPP et des EEM sur les communautés d’invertébrés benthiques et d’algues. Pour y parvenir, quatre groupes de traitement ont été constitués comme plus haut (témoin, 1 % EEM, 3 % EFPP, 1 % EEM + 3 % EFPP). Ensuite, des réseaux trophiques benthiques ont été établis en plusieurs exemplaires pour chaque groupe de traitement en ensemençant chacun des mésocosmes avec un substrat, les microorganismes et les algues associées et les invertébrés obtenus d’une zone de référence. Puis, les insectes adultes ont été capturés tous les deux ou trois jours dans des cages d’émergence installées sur chaque circuit d’eau (figure 9-2B), alors que les invertébrés benthiques et la biomasse d’algues ont été échantillonnés à la fin de l’expérience. Les résultats indiquent que les EEM et les EFPP constituent d’importantes sources de nutriants dans la rivière. Plus particulièrement, les EEM ont semblé constituer une source principale d’azote, tandis que les EFPP semblaient être une source importante de phosphore et de carbone. La biomasse d’algues a augmenté sous l’effet de l’exposition à l’effluent et elle était plus étroitement liée à la présence d’azote qu’à celle de phosphore ou de carbone. Les données sur l’émergence des insectes indiquent que l’effet de l’exposition aux deux effluents complexes serait plutôt synergique qu’additif (Culp et al., 2004).
Applications par les partenariats université-industrie, 2001-2008
Ruisseau Junction, Sudbury (Ontario), 2001 et 2002
Le ruisseau Junction à Sudbury (Ontario), exposé historiquement à une contamination des sédiments pendant des décennies d’exploitation minière, reçoit trois effluents miniers traités, un effluent d’égout municipal et subit les impacts de plusieurs autres sources diffuses. Les effets des EEM traités de trois mines distinctes qui rejetaient leurs effluents dans le ruisseau Junction ont été évalués en 2001 et 2002, à l’aide de deux espèces de poissons, le Mulet à cornes (Semotilus atromaculatus) et le Mulet perlé (Semotilus margarita) (Dubé et al., 2006). Divers traitements ont été testés sur une période de 35 à 41 jours : eau de référence, EMM no 1 (30 %), EMM no 2 (20 %), EMM no 3 (45 %). Au cours de la première année (2001), les effets observés sur les mulets comprenaient une réduction du taux de survie (statistiquement non significatif) et une baisse des concentrations de testostérone. L’année suivante (2002), le taux de survie des mulets a été réduit à moins de 60 % par les traitements EMM no 1 et no 3, et l’exposition à ces mêmes effluents a provoqué une baisse du poids corporel total des mâles et des femelles. Pendant ces deux années, les effets étaient plus fréquents aux traitements de l’effluent minier no 1 et no 3, avec des augmentations régulières des teneurs des eaux de traitement et des tissus en nickel, rubidium, strontium, fer, lithium, thallium et sélénium. Ces études ont montré que l’exposition aux effluents miniers entraînait des changements des paramètres mesurés chez les poissons endémiques du ruisseau Junction distincts de ceux provoqués par la contamination historique des sédiments.
Après plusieurs années d’étude des effets de l’exposition des poissons aux effluents rejetés dans le milieu ambiant, il devenait nécessaire de perfectionner les systèmes de mésocosmes afin d’étudier les transferts trophiques. En effet, l’exposition aux contaminants par voie alimentaire est plus pertinente, sur le plan environnemental, que l’exposition aux contaminants présents dans l’eau ambiante (même si cette dernière retient davantage l’attention des chercheurs en toxicologie aquatique). Par ailleurs, les résultats des évaluations nationales des EEM réalisées dans le cadre du Programme d’ESEE pour le secteur des pâtes et papiers suggèrent que les effets des effluents sur les fonctions reproductrices des poissons jouent un rôle dominant à l’échelle nationale. De ce fait, l’élaboration de méthodes fondées sur des mésocosmes de poissons devrait être axée sur l’exposition par voie alimentaire ainsi que sur une évaluation plus approfondie des fonctions reproductrices.
En 2002, un bioessai sur le cycle vital in situ a été conçu avec le chironomidé Chironomus tentans,dans des systèmes de bassins artificiels afin d’évaluer les effets d’un effluent minier dans les conditions ambiantes du ruisseau Junction, en Ontario (Hruska et Dubé 2004). Les chironomidésont été exposés pendant toute la durée de leur cycle vital au traitement EMM no 3, qui correspond aux concentrations moyennes d’effluent mesurées dans le ruisseau. Une réduction du taux de survie, de l’émergence totale et du succès d’éclosion ainsi qu’une émergence plus tardive ont pu être observées chez les insectes du groupe expérimental. Cette étude a montré comment un bioessai sur le cycle vital pouvait servir in situ pour évaluer les effets des effluents miniers sur un invertébré benthique. Nous avons en outre recueilli des informations sur les taux de croissance du C. tentans, son succès d’éclosion et sa survie dans les mésocosmes, qui sont requises pour l’amélioration des systèmes de mésocosmes multitrophiques fondés sur des milieux de culture.
En 2003, les travaux de perfectionnement du mésocosme à C. tentans aux fins de l’évaluation des effluents des mines de métaux, se sont poursuivis (Hruska et Dubé 2005). L’utilité de cet essai a été comparée à un bioessai standard existant sur le cycle vital réalisé en laboratoire. Pour ce faire, les larves de C. tentans ont été exposées au milieu EMM no 3 traité à 45 % (v/v) du 11e jour jusqu’à l’éclosion de la deuxième génération. La structure des réponses a été cohérente pour deux des paramètres mesurés, soit le succès d’éclosion et le temps écoulé jusqu’à l’émergence, mais erratique pour les autres. Des effets significatifs de l’effluent sur la croissance, le taux de survie, le nombre d’adultes émergés et le nombre d’œufs par oothèque ont été constatés grâce au bioessai en bassins artificiels, contrairement à celui réalisé en laboratoire. Par contre, ce dernier a permis de constater des effets significatifs sur le rapport des sexes et le nombre d’oothèques par femelle, que le bioessai en bassins artificiels n’avait pas relevés. On pense que ces différences pourraient découler du nombre d’organismes utilisés par répétition dans chacun des bioessais et qui pourraient influer sur la puissance statistique des plans d’étude. Ainsi, des coefficients de variation et une ampleur des effets plus importants ont été observés dans les bioessais en laboratoire en comparaison des bioessais en bassins artificiels pour presque tous les paramètres. Ces résultats ont fourni la preuve que le système de mésocosmes constitue un outil efficace pour évaluer les effets des effluents miniers sur les paramètres du cycle vital du C. tentans. Il est reconnu que le Programme d’ESEE est axé sur la structure des communautés d’invertébrés benthiques et non sur les espèces benthiques individuelles. Toutefois, ces études ont été nécessaires pour définir les bases scientifiques de l’élaboration de mésocosmes multitrophiques en milieu contrôlé ainsi que pour offrir des solutions de rechange pouvant s’avérer utiles lorsque les programmes parviendront à l’étape de la recherche des causes qui pourrait exiger des données plus détaillées, en particulier dans les cas où les communautés benthiques sont dominées par les chironomidés.
Le système de mésocosmes à C. tentans constituait une source de nourriture auto-entretenue utile pour un mésocosme de poissons. Cela permettrait d’accroître la pertinence des mésocosmes de poissons pour l’étude des conditions d’exposition plus naturelles. C’est-à-dire des conditions où les poissons sont exposés à des effluents à la fois par l’eau ambiante et par leur régime alimentaire. Sachant que plusieurs métaux sont connus pour affecter les poissons par voie alimentaire, ce système constitue une amélioration importante. Il convenait également d’apporter une autre amélioration aux mésocosmes de poissons : accroître la pertinence et l’importance des paramètres examinés.
Terrace Bay (Ontario), 2003
L’exposition des poissons à un contaminant pendant une partie de leur cycle vital offre l’occasion d’étudier les effets directs de l’effluent sur la reproduction des adultes et sur leur progéniture. Elle permet en outre d’examiner les critères d’effets d’ESEE (condition, taille relative du foie, taille relative des gonades). Le Méné à grosse tête (Pimephales promelas) est l’espèce par excellence des études toxicologiques effectuées à travers le monde afin d’évaluer et de classer les contaminants en fonction de leur teneur en perturbateurs endocriniens. Pour ce faire, des essais à court (sept jours), moyen (21 jours) ou long terme (cycle vital entier) ont été mis au point. Ces essais permettent d’évaluer directement les effets sur la reproduction (nombre d’œufs, taille des œufs, nombre de fraies), mais aussi les effets indirects (p. ex., taille des gonades). Toutefois, presque toutes les études décrites dans la documentation spécialisée et utilisant le Méné à grosse tête portent sur l’exposition aux contaminants présents dans le milieu aquatique et visent à détecter les substances toxiques, et ce, au détriment d’une analyse plus réaliste des conditions du milieu. Le premier objectif consistait à vérifier s’il était possible de réaliser un essai d’exposition des poissons pendant 21 jours sur le terrain, avec de l’eau de référence comme eau de dilution, aux fins de l’évaluation des EFPP dans des conditions de température de l’eau et de photopériode constantes. Le second objectif consistait à combiner le bioessai sur le cycle vital du chironomidé C. tentans au bioessai sur le cycle vital partiel du Méné à grosse tête afin d’élaborer un système de mésocosmes multitrophiques.
En 2003, un essai d’exposition de 21 jours de Ménés à grosse tête a été réalisé sur le site d’une usine de pâte de Terrace Bay où les effets sur les fonctions reproductrices de poissons sauvages avaient déjà été étudiés. Le premier objectif consistait à déterminer les effets des EFPP sur le Méné à grosse tête à des concentrations de 1 % et de 100 % (Rickwood et al., 2006a). Le second objectif était d’utiliser l’essai sur le Méné à grosse tête pour déterminer les sources des contaminants dans la fabrique qui influaient sur les indicateurs des fonctions reproductrices (Rickwood et al., 2006b). Pour y parvenir, différents circuits d’eaux de procédé ont été choisis et caractérisés en fonction de la composition chimique de l’effluent et de la toxicité aiguë, et un sous-ensemble a fait l’objet d’un bioessai sur place. Un système mobile fermé (monté sur remorque) de bioessai (photographie non incluse) a été installé sur le site d’une fabrique de pâte kraft blanchie pendant 60 jours afin de profiter d’une source d’eau ambiante (lac Supérieur, Canada) et d’un EFPP final. Il ne s’agissait pas d’un système extérieur de mésocosmes exposé aux conditions ambiantes puisqu’on cherchait uniquement à déterminer s’il était possible d’utiliser le bioessai avec le Méné à grosse tête (21 jours) avec de l’eau de référence ambiante, en maintenant constants d’autres facteurs (température et photopériode). Les résultats ont montré un effet de stimulation à la concentration d’EFPP de 1 % (production d’œufs accrue, cumul des périodes de fraie) comparativement aux témoins. Dans le cas de l’exposition à une concentration d’EFPP de 100 %, la fraie a été retardée, ce qui a résulté en une production réduite d’œufs au cours des deux premières semaines d’exposition. Cette exposition a également entraîné le développement d’un ovipositeur chez les mâles, et l’apparition de caractères sexuels secondaires mâles chez les femelles. Les résultats du second objectif montrent que l’effluent d’usine combiné (avant le traitement secondaire) et l’effluent alcalin combiné causaient tous deux une réduction du nombre de fraies (~55 % pour les deux effluents) et de la production d’œufs (28 % et 74 % respectivement), et que l’effluent alcalin engendrait un développement important de l’ovipositeur chez les mâles. Une comparaison des systèmes de réponses a permis de déterminer que l’effluent alcalin combiné constituait à cette usine la source des composés qui influaient sur les indicateurs des fonctions reproductrices chez le Méné à grosse tête.
Ruisseau Junction, Sudbury (Ontario), 2004-2005
La mise au point du bioessai en mésocosmes sur le cycle vital du chironomidé C. tentans et du bioessai sur le cycle vital partiel (21 jours) du Méné à grosse tête avec de l’eau de référence naturelle en guise d’eau de dilution ont jeté les bases d’un bioessai multitrophique en mésocosmes. L’objectif consistait à mettre au point un bioessai de transfert trophique auto-entretenu utilisant C. tentans et le Méné à grosse tête qui permettrait d’évaluer non seulement les effets d’une exposition aux effluents dans le milieu aquatique ambiant (Méné à grosse tête seulement), mais également l’exposition aux EMM par voie alimentaire et par le biais du milieu ambiant (transfert trophique). Ainsi, le succès de reproduction du Méné à grosse tête a été évalué pendant 21 jours dans des conditions contrôlées de laboratoire afin d’obtenir des données de base sur divers paramètres, y compris la production d’œufs et le succès d’éclosion (Rickwood et al., 2006c). On a ensuite procédé à un essai d’exposition au traitement EMM no 3 (voir ci-dessus) en laboratoire pendant 21 jours supplémentaires. Tant dans le système d’exposition limitée à l’eau ambiante que dans le système à transfert trophique, la réduction du succès de reproduction par rapport au groupe témoin était évidente. Ce n’est que dans le système de transfert trophique qu’une réduction significative de l’éclosion des larves et une augmentation des malformations ont eu lieu après l’exposition à l’EMM, ce qui suggère que la nourriture contaminée était une voie d’exposition entraînant des effets sur la progéniture.
Le système de mésocosmes multitrophiques a par la suite été mis à l’essai sur le terrain en 2005 (Rickwood et al., 2007). Les objectifs consistaient à évaluer : 1) les effets d’un mélange d’effluents miniers et d’eaux usées municipales sur la reproduction du Méné à grosse tête dans un système de bassins artificiels installé sur place et 2) l’importance de l’exposition par voie alimentaire (avec C. tentans) en utilisant un système à transfert trophique. L’exposition au mélange d’effluents dans l’eau ambiante a entraîné une réduction significative de la production d’œufs et du nombre de fraies. Par contre, l’exposition combinée par voie alimentaire et par l’eau ambiante à l’aide du système à transfert trophique a engendré une augmentation significative de la production d’œufs et du nombre de fraies. Les embryons produits dans le système à transfert trophique ont affiché un succès d’éclosion comparable, mais des difformités plus fréquentes et plus graves après l’exposition au mélange. Il a été conclu que les effets du mélange d’effluents sur le Méné à grosse tête étaient plus évidents lorsque le poisson était exposé par contact avec l’eau ambiante. Par ailleurs, l’exposition combinée par voie alimentaire et par contact avec l’eau ambiante s’est avérée moins toxique, possiblement à cause d’une augmentation de la teneur du milieu en nutriants et en matières organiques qui a pu réduire la biodisponibilité des métaux.
Rivière Wabigoon, Dryden (Ontario), 2006
Cette étude s’est penchée sur les liens existant entre l’exposition aux EFPP et les perturbations endocriniennes, afin de chercher à expliquer la présence de poissons intersexués dans la rivière Wabigoon, en Ontario (tableau 9-1; Pollock et al., 2009). Une étude réalisée sur le terrain dans la rivière Wabigoon, près de Dryden (Ontario), en automne 2000, a révélé la présence de Dorés jaunes (Sander vitreus vitreus) intersexués présentant des concentrations d’hormones sensiblement modifiées et des gonades de taille réduite. Or, la rivière Wabigoon reçoit les effluents d’une usine de pâte kraft blanchie et de papier et d’un système d’égout municipal (EEM). Son lit a par ailleurs été recouvert d’une nappe de fibres cellulosiques qui provoque de longues périodes de faibles concentrations d’oxygène dissous en conditions de débit réduit ou de sécheresse. Un essai sur le cycle vital partiel de Ménés à grosse tête a exposé les poissons en mésocosmes sur le terrain à quatre traitements : eau de référence et EFPP à 20 %, 40 % et 60 %. Une étude des dorés prélevés sur le terrain a également été effectuée dans la rivière Wabigoon. Résultats : les teneurs en testostérone avaient diminué chez les mâles avec l’augmentation de la concentration de l’effluent, et l’exposition des mâles à 60 % d’EFPP a induit la production de vitellogénine. Toutefois, ces résultats ne reflétaient pas l’ampleur de la perturbation endocrinienne observée lors de l’étude des poissons sur le terrain. Plusieurs hypothèses ont été avancées pour expliquer cette divergence. Selon certaines études publiées, l’hypoxie ou la présence d’EEM, seules ou combinées à la présence d’EFPP, pourraient expliquer les différences entre l’étude menée sur le terrain et l’essai sur le cycle vital partiel. Des études menées ultérieurement à cet endroit ont examiné les effets d’une faible teneur en oxygène dissous sur le Méné à grosse tête ainsi que les effets interactifs d’une faible teneur en oxygène dissous (6,0 mg/L, concentration à effet nul) et de la présence d’EFPP (40 %, concentration à effet nul) (Dubé, inédit).
Mise au point de mésocosmes, travaux en cours en 2007-2009
Les travaux de mise au point de mésocosmes de poissons se sont poursuivis régulièrement et de manière continue, et chacune des applications s’est soldée par une amélioration de la méthodologie. Il est désormais facile d’évaluer les effets sur les petites espèces de poissons endémiques dans l’écosystème étudié ou d’utiliser un essai sur le cycle vital partiel du Méné à grosse tête dans des systèmes de mésocosmes extérieurs (exposition dans l’eau ambiante ou transfert trophique). Dorénavant, les recherches qui seront effectuées dans le cadre du Programme d’ESEE pour les mines de métaux s’intéresseront davantage à la recherche des causes.
Ruisseau Junction, Sudbury (Ontario), 2008-2011
Étant donné la complexité des écosystèmes aquatiques, la compréhension des effets des métaux et des mélanges métalliques sur les réseaux trophiques des cours d’eau est limitée. De plus, l’évaluation de ces effets n’est que la première étape des efforts d’atténuation et, ultimement, de développement durable. L’élucidation des causes (p. ex., métaux responsables) et des facteurs qui modifient cette toxicité constitue l’étape suivante dans la recherche de solutions. Les recherches en cours sur les mésocosmes à Sudbury (Ontario) a) confirmeront les réactions du Méné à grosse tête aux EMM sur le terrain à l’aide des bioessais multitrophiques auto-entretenus; b) permettront d’évaluer comparativement les structures de réponses des Ménés à grosse tête à des mélanges d’effluents entiers et à des doses équivalentes de chaque métal potentiellement préoccupant (cuivre [Cu], sélénium [Se] et thallium [Tl]); c) permettront de mesurer l’importance relative de l’eau ambiante et du régime alimentaire comme voie d’exposition entraînant une réaction toxique aux métaux chez le Méné à grosse tête; et d) permettront d’examiner les facteurs qui pourraient influer sur la toxicité (pH/alcalinité et matières organiques naturelles, et qualité et quantité de la nourriture) des mélanges d’effluents et de chaque métal dominant (Cu, Se et Tl) pour le Méné à grosse tête (Dubé et al., inédit).
Key Lake (Saskatchewan), 2007-2011
Cette étude est menée sur une période de quatre ans et s’appuie elle aussi sur une combinaison d’études en mésocosmes effectuées sur le terrain ou en laboratoire (Driessnack et al., inédit; Dubé et al., inédit). L’étude en mésocosmes réalisée en laboratoire a pour objectif d’évaluer les effets d’une exposition à un effluent de mine d’uranium sur un réseau trophique aquatique (mésocosme multitrophique), y compris sur la reproduction du Méné à grosse tête. En outre, une évaluation comparative des structures de réponses du Méné à grosse tête au mélange d’effluent et au sélénium (Se) (sous forme de séléniate) permet d’isoler la contribution du Se de celle des autres composantes du mélange d’effluents. Les résultats indiquent que les structures des réponses relatives à la production d'œufs n'ont pas pu être expliquées par le Se dans la comparaison des réponses aux différents traitements et à l’eau de référence. L’étude en mésocosmes sur le terrain vise à mesurer l’effet relatif et cumulatif de la contamination par le Se présent dans l’eau ambiante (contamination actuelle) et dans les sédiments (contamination historique) sur le succès de reproduction et le taux de survie du Méné à grosse tête et de sa progéniture. Les résultats indiquent que les effets sur le Méné à grosse tête proviennent exclusivement des effluents et que les contributions des sédiments contaminés ne sont pas significatives. Les sédiments testés dans l'étude étaient composés de sable, car c’est le type de sédiments le plus commun dans le bassin de Key Lake. Des travaux supplémentaires sont nécessaires pour déterminer l'importance des sédiments organiques dans les réponses et particulièrement de leur distribution spatiale et temporelle sur le site.

Figure 9-1 : A) Grand système de mésocosmes à bassins artificiels installés sur des tables (modèle I), utilisé pour l’étude sur la rivière Athabasca (Alberta); B) Grand système mobile de mésocosmes à bassins artificiels montés sur deux remorques (modèle II), utilisé pour les études sur le fleuve Fraser (Colombie-Britannique), le fleuve Saint-Jean (Nouveau-Brunswick) et le port de Saint John (Nouveau-Brunswick); C) Grand système mobile de mésocosmes à bassins artificiels montés sur une seule remorque (modèle III), utilisé pour les études sur les rivières Miramichi et Little (Nouveau-Brunswick), la rivière Wapiti (Alberta) et le ruisseau Junction (Ontario).

Figure 9-2 : A) Petit système de microcosmes à bassins artificiels installés sur des tables surplombant les réservoirs de mélange, utilisé pour l’étude sur la rivière Thompson (Colombie-Britannique); B) Système de mésocosmes modulaire à bassins artificiels installés sur des tables surplombant les réservoirs de mélange, utilisé pour les études sur la rivière Little (Nouveau-Brunswick), le ruisseau Junction (Ontario), la rivière Wabigoon (Ontario) et à Key Lake (Saskatchewan).
Figure 9-3 : Représentation schématique (non à l’échelle) du système de mésocosmes sur remorque.

Figure 9-4 : Photographie de l’installation d’un mésocosme modulaire (texte description)
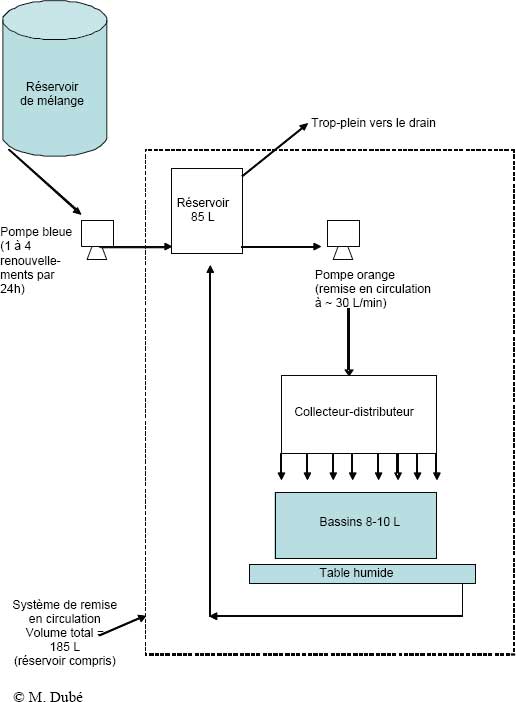
Figure 9-5 : Schéma de circulation du mésocosme modulaire.

Figure 9-6 : Bioessai multitrophique de la reproduction du Méné à grosse tête et barrière d’alimentation.

Figure 9-7 : Installation sur le terrain de mésocosmes modulaires.
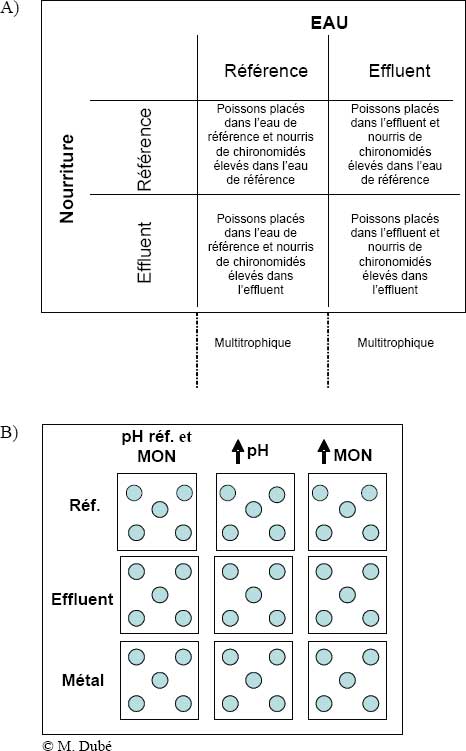
Figure 9-8 : A) Protocole expérimental factoriel visant à examiner l’importance relative du milieu aquatique et du régime alimentaire en ce qui a trait aux réactions du Méné à grosse tête aux effluents miniers dans des mésocosmes modulaires; B) Protocole expérimental servant à examiner l’incidence du pH et des matières organiques naturelles (MON) sur les réactions du Méné à grosse tête exposé à un mélange d’effluents miniers et à un seul métal dans des mésocosmes multitrophiques modulaires.
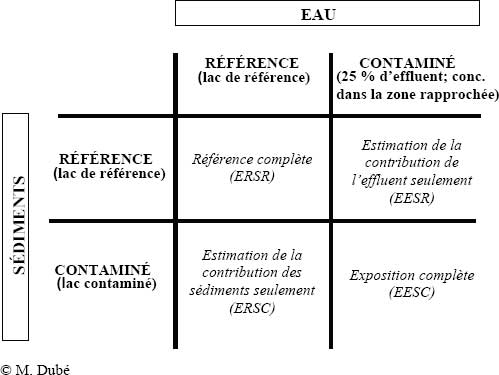
Figure 9-9 : Protocole expérimental factoriel visant à étudier les effets d’un EMM et de la contamination historique des sédiments séparément ou en combinaison sur le Méné à grosse tête dans des mésocosmes modulaires. Légende : ERSR : Eau de référence et sédiments de référence; EESR : Eau d’effluent et sédiments de référence; ERSC : Eau de référence et sédiments contaminés; EESC : Eau d’effluent et sédiments contaminés.
9.2.2 Applicabilité dans le cadre du Programme d’ESEE
Il convient d’insister sur le fait que même si le système de mésocosmes figure parmi les méthodes de remplacement recommandées, il ne doit être utilisé que lorsque les études sur le terrain ne permettent pas de répondre clairement à l’hypothèse, ou sont simplement impossibles à réaliser. Le recours à des mésocosmes peut notamment être indiqué lorsque des facteurs de confusion compliquent l’étude du milieu récepteur ou que les conditions rendent l’échantillonnage dangereux. Par exemple, ils peuvent être utiles s’il n’y a pas de zone de référence adéquate pour servir de base de comparaison, ou s’il existe une contamination historique, ou encore en présence du rejet d’autres effluents ou de changements dans les types d’habitat appropriés qui ne peuvent être exclus de l’élaboration d’une étude de terrain. Les mésocosmes peuvent également servir à l’évaluation de l’ampleur des effets (séries de dilution) et à la recherche de causes. Les études de cas décrites dans la section précédente illustrent bien les différents types de questions et de manipulations expérimentales qui peuvent s’appliquer aux diverses étapes du Programme d’ESEE.
Il est également possible d’utiliser l’espèce de poisson d’une étude en mésocosme pour la composante du Programme d’ESEE ayant trait à l’exploitabilité des ressources halieutiques, à condition que le critère d’effet retenu soit valide pour l’ensemble de la période d’exposition typique des études en mésocosmes. Dans un tel cas, le critère d’effet et les méthodes statistiques seraient ceux décrits au chapitre 3.
L’utilisation de mésocosmes comporte à la fois des avantages et des inconvénients qu’il importe d’évaluer par rapport à ceux des autres méthodes de suivi de remplacement avant d’arrêter son choix sur une méthode précise.
9.2.3 Technologie des mésocosmes
9.2.3.1 Conception des mésocosmes
Afin de conserver la qualité des données et d’assurer l’application uniforme de la technologie des mésocosmes aux fins du Programme d’ESEE, il faut examiner la conception physique du système utilisé et le plan d’étude, y compris les modes opératoires normalisés. Cette section définit les exigences en matière de conception physique et présente des recommandations relatives au plan d’étude expérimental à la fois pour l’utilisation du grand système mobile de mésocosmes et du plus petit système modulaire.
Peu importe le système utilisé, le fonctionnement général est le même. Les bassins contiennent le biote (poissons, invertébrés benthiques), les algues ou le substrat à étudier. On juge que l’utilisation de cinq à huit bassins répétés par traitement est adéquate. De plus, ces systèmes ne sont pas statiques; ils fonctionnent en circulation ouverte (mésocosmes sur remorque) ou en recirculation partielle (mésocosmes modulaires). Idéalement, l’eau de référence et l’eau de dilution sont pompées d’un site de référence et acheminées dans un réservoir de tête. L’effluent traité, quant à lui, est prélevé chaque jour, ou au moins une fois par semaine, et conservé sur place dans un réservoir de tête. D’ailleurs c’est dans les réservoirs de tête que sont conservés les liquides, qui peuvent être chauffés ou refroidis selon les circonstances. Les réservoirs de mélange servent à mélanger l’eau de référence et l’effluent à la concentration d’essai voulue. L’« eau de traitement » ainsi obtenue est pompée de chaque réservoir de mélange jusqu’aux systèmes de bassins artificiels (mésocosmes) à un débit réglé pour obtenir le temps de renouvellement souhaité (minimum d’un renouvellement complet toutes les 24 heures, et jusqu’à six renouvellements par 24 heures). L’essai dure d’ordinaire de 30 à 65 jours, avec des mesures quotidiennes et hebdomadaires des paramètres physiques et chimiques, du débit, de la mortalité des poissons et de la reproduction (p. ex., collecte quotidienne des œufs). À la fin de la période d’exposition, les poissons sont examinés, et d’autres mesures sont prises.
9.2.3.2 Description et fonctionnement général d’un grand système mobile de mésocosmes
Le grand système de mésocosmes recommandé ici a été conçu par l’Institut national de recherche sur les eaux (INRE) d’Environnement Canada et a servi à évaluer les effets des EFPP et des EMM sur les réseaux trophiques benthiques (invertébrés benthiques et algues) (Culp et Podemski, 1996; Culp et al., 1996, 2000a, 2001; Cash et al., 2003) et sur un poisson de petite taille (Dubé, 2000; Dubé et MacLatchy, 2000a; Cash et al., 2003; Dubé et al., 2002). Ce système a été utilisé pour évaluer les communautés d’invertébrés benthiques ainsi que l’exposition des poissons dans le milieu aquatique ambiant. Il est toujours valable, mais la plupart des recherches utilisent aujourd’hui le mésocosme modulaire décrit dans la section suivante.
Le grand système mobile de mésocosmes consiste en 16 bassins circulaires d’une superficie de 0,9 m2, disposés par paires sur des tables d’une hauteur de 74 cm (figures 9-1 et 9-3). L’eau puisée d’une zone de référence est pompée dans un réservoir de tête en polyéthylène d’une capacité de 378 L, placé sur une plate-forme de 1,2 m de hauteur, d’où elle s’écoule dans les bassins par gravité, à travers un réseau de canalisations. On peut aussi utiliser une pompe d’admission, par exemple une pompe terrestre (c.-à-d. une pompe d’irrigation ou une pompe de piscine commerciale), ou bien une pompe submersible (Hydro-Matic modèle no SPD50-H de 0,5 HP), selon le volume à pomper, la distance de pompage et la hauteur d’élévation requise. L’eau de référence peut également être puisée d’une prise d’eau de l’usine. Ensuite, des robinets-vannes servent à régler et à étalonner le débit de l’eau dans chaque bassin. Ainsi, l’eau est acheminée à chaque bassin selon un débit de 2 L/min, résultant en un débit total de 32 L/min pour alimenter les 16 bassins.
L’eau dans chaque bassin est maintenue à une hauteur de 26,9 ± 0,1 cm (![]() ± 1 erreur type) au moyen d’un tuyau de trop-plein qui rejette toutes les eaux usées dans la rivière (figure 8-3b). Ce tuyau est muni d’une grille pour éviter la perte de poissons et limiter l’émigration des insectes. Étant donné que chaque bassin contient 227 L d’eau; le temps de séjour de l’eau est d’environ deux heures. En augmentant à quatre heures le temps de séjour de l’eau dans les bassins, on réduit au minimum le volume d’effluents et d’eau de référence requis pour l’étude. La détermination finale du temps de séjour dans un système donné dépend de la taille du réservoir utilisé et des besoins des espèces à l’étude concernant le taux d’oxygène et la température. Si les études en mésocosmes sont réalisées à la fin de l’automne, le réservoir de tête et les conduites d’alimentation en eau peuvent être enveloppés de ruban chauffant et isolés, afin que le système puisse être utilisé même si la température descend sous le point de congélation (–5 °C). Par ailleurs, une toile de protection peut être utilisée durant l’été pour réduire la chaleur due au soleil.
± 1 erreur type) au moyen d’un tuyau de trop-plein qui rejette toutes les eaux usées dans la rivière (figure 8-3b). Ce tuyau est muni d’une grille pour éviter la perte de poissons et limiter l’émigration des insectes. Étant donné que chaque bassin contient 227 L d’eau; le temps de séjour de l’eau est d’environ deux heures. En augmentant à quatre heures le temps de séjour de l’eau dans les bassins, on réduit au minimum le volume d’effluents et d’eau de référence requis pour l’étude. La détermination finale du temps de séjour dans un système donné dépend de la taille du réservoir utilisé et des besoins des espèces à l’étude concernant le taux d’oxygène et la température. Si les études en mésocosmes sont réalisées à la fin de l’automne, le réservoir de tête et les conduites d’alimentation en eau peuvent être enveloppés de ruban chauffant et isolés, afin que le système puisse être utilisé même si la température descend sous le point de congélation (–5 °C). Par ailleurs, une toile de protection peut être utilisée durant l’été pour réduire la chaleur due au soleil.
Les bassins artificiels du grand système de mésocosmes consistent en des cuves en fibre de verre-polyester de 107 cm de diamètre. Ces cuves sont placées sur huit tables d’une hauteur de 74 cm, à raison de deux par table. Un tuyau d’évacuation traverse la colonne montante et se raccorde aux canalisations en dessous et à la conduite principale qui rejette l’eau dans la rivière, en aval du point de prise d’eau.
Pour les études sur les invertébrés, un courant peut être créé dans chaque bassin à l’aide d’un système à hélices (Podemski, 1999). Ce système engendre une vitesse d’écoulement, à mi-hauteur environ de la colonne d’eau, qui est normalement maintenue à 20 cm/s; elle doit toutefois être déterminée en fonction des conditions propres à chaque site. Il existe également d’autres mécanismes générateurs de courant qui peuvent être utilisés, à condition qu’ils produisent la vitesse désirée. Le système d’hélices peut aussi servir pour les études sur le poisson, bien que des rampes d’arrosage fixées au système d’alimentation en eau de chaque bassin aient aussi été utilisées dans le cadre d’études sur des espèces pour lesquelles la vitesse d’écoulement n’était pas un facteur déterminant.
Les échantillons d’effluent sont prélevés chaque jour ou tous les deux jours et sont conservés dans des contenants de polyéthylène. Le site de prélèvement des échantillons dépend du plan d’étude. Par exemple, dans le cas d’une première étude de suivi d’une mine de métaux, il faut analyser l’effluent final représentatif de ce qui est rejeté dans le milieu aquatique. L’introduction des effluents dans chaque bassin se fait de manière indépendante et continue, à l’aide de pompes péristaltiques (têtes de pompe à cartouches et contrôleurs d’écoulement L/S Masterflex® L/S, type Nema 13). Les débits d’effluents varieront en fonction des concentrations propres au site à évaluer. À titre d’exemple, si les études sur la délimitation du panache menées sur le terrain ont révélé que la concentration de l’effluent était de 1 %, alors le débit dans chaque bassin doit être réglé à 20 ml/min (1 % de 2 L/min). Si la remorque compte 16 bassins répartis entre deux traitements (8 bassins témoins; 8 bassins d’analyse d’une concentration de 1 %), le calcul du volume d’effluent requis sur une base quotidienne se fera comme suit : 20 ml/min × 60 min/h × 24 h/jour = ~29 L/jour/bassin × 8 bassins = ~231 L/jour. Alors, ce volume pourrait être contenu à l’intérieur d’un petit contenant de polyéthylène.
Après avoir étalonné les débits d’eau et d’effluent pour chaque système, on procède à l’ensemencement de chaque bassin en y introduisant le substrat naturel, les algues, les invertébrés benthiques et/ou les espèces de poissons endémiques du milieu récepteur à l’étude. Les méthodes d’ensemencement du biote sont décrites ci-après pour les poissons et les invertébrés. Enfin, de plus amples détails concernant la construction de ce système sur remorque figurent dans les documents de référence.
9.2.3.3 Description et fonctionnement général du système de mésocosmes modulaires
Chaque unité ou table de mésocosmes modulaires est constituée d’une palette d’expédition, d’un châssis métallique, d’une table humide, de bassins circulaires en polyéthylène (jusqu’à huit), d’un réservoir destiné à contenir la solution d’exposition, d’un collecteur pour la distribution égale de la solution entre les bassins, d’une pompe Viking bleue servant à pomper la solution du réservoir de mélange au réservoir, et d’une pompe March orange qui assure la remise en circulation de la solution du réservoir au collecteur et au groupe de bassins (figures 9-4 et 9-5).
Chaque mésocosme peut contenir au total 185 L d’eau (réservoir de 85 L; huit bassins de 10,3 L chacun = 82,4 L; ~15 L dans le collecteur, les canalisations et les pompes), et consomme 3,0 ampères pour fonctionner sans chauffage, refroidissement ou aération de l’eau. Les bassins circulaires peuvent contenir 10,3 L de liquide et sont chacun munis d’un tube vertical central non fonctionnel. Les bassins faits en polyéthylène haute densité sont installés sur une table qui recueille le liquide (trop-plein) et l’achemine dans un réservoir de dilution de 85 L. Chaque bassin est muni d’un couvercle qui empêche les poissons de s’échapper et interdit l’accès à d’autres organismes (p. ex., des oiseaux). Ce couvercle est fait d’une moustiquaire ou d’un grillage en Nytex et est retenu en place par des tendeurs élastiques. Chaque table reçoit huit bassins en polyéthylène de 10,3 L faits et moulés sur mesure. Les réservoirs en plastique de 85 L sont également faits et moulés sur mesure. Le collecteur-distributeur à huit orifices de raccord a également été fait sur mesure pour répartir le liquide dans chacun des huit bassins, sans avoir recours à huit pompes. Pour ce faire, deux types de canalisations acheminent l’eau qui entre dans le collecteur-distributeur (diamètre intérieur de 3/8 po) et qui en sort (diamètre intérieur de ¾ po).
Une pompe doseuse électronique (Viking/Pulsatron bleue, série E 240 GPD LEH 75A-PHC3-XXX) sert à régler le temps de séjour de l’eau ou de l’effluent dans le réservoir. La pompe March « série 3 » centrifuge à entraînement magnétique étanche (orange) sert, quant à elle, à régler la circulation de l’eau ou de l’effluent du réservoir jusqu’aux bassins. Les pompes sont les éléments les plus coûteux de ce système et les composantes les plus critiques de l’étude. En effet, un débit incorrect entraînera une dilution incorrecte de l’effluent pour les organismes d’essai.
Chaque unité ou table de mésocosmes représente un traitement comprenant huit répétitions. Il est à noter, et ce point a été débattu, que le réservoir de chacun des systèmes constitue une pseudorépétition. Ce problème a été débattu avec succès et défendu par le biais du processus d’examen par les pairs. Dans le cas des mésocosmes de poissons, les bassins peuvent être équipés de barrières d’alimentation pour les études multitrophiques. Ces barrières grillagées permettent aux cultures d’invertébrés benthiques de se développer dans les conditions expérimentales tout en contrôlant l’accès des poissons qui se trouvent au-dessus (figure 9-6).
Les chercheurs ont fait l’essai de plusieurs systèmes différents de circulation, y compris avec des pompes de mélange en ligne. L’expérience acquise en cette matière et les impératifs de coûts ont amené les chercheurs à utiliser de préférence un réservoir de mélange pour la préparation des solutions de traitement et l’acheminement de ces solutions dans chacun des bassins de mésocosme à l’aide d’une pompe, au lieu de recourir au mélange en ligne de l’eau et du contaminant. L’eau est acheminée du réservoir de mélange au bassin d’un mésocosme à l’aide d’une pompe bleue Viking à raison de un à quatre renouvellements par 24 heures (figure 9-5). Chaque bassin est muni, à l’arrière, d’un tuyau de trop-plein et, à l’intérieur, d’un séparateur empêchant l’eau d’arrivée de passer directement dans le tuyau de trop-plein.
La pompe March est la pompe de recirculation. L’eau passe de cette pompe dans le collecteur, et de là dans les bassins. La table sert à recueillir le trop-plein des bassins qui s’écoule ensuite dans le réservoir par un orifice. Le collecteur doit être à niveau et exempt de bulles d’air pour fonctionner efficacement. Toutes les canalisations doivent avoir la même longueur pour maintenir une pression identique et permettre au collecteur-distributeur un débit uniforme de répartition de l’eau dans chacun des bassins. L’eau pénètre dans les bassins par un tuyau d’arrivée qui débouche dans un orifice pratiqué dans leur paroi. L’angle de raccordement du tuyau d’arrivée crée dans les bassins un léger courant circulaire. L’eau remplit les bassins et déborde sur la table, d’où elle est acheminée dans le réservoir. Les bassins sont enveloppés d’une gaine métallique isolante.
9.2.4 Facteurs à considérer pour le choix du site
Peu importe le mésocosme choisi, il convient de respecter certaines exigences de base. Ainsi, le système est habituellement installé dans une zone de référence qui donne accès à de l’eau de référence. Si l’étude porte sur une rivière, l’eau de référence doit être puisée en amont du point de rejet de l’effluent dans le milieu et doit être rejetée dans la rivière en aval du point de prélèvement. Il s’agit du scénario le plus simple pour l’usage de mésocosmes. La distance par rapport à la source d’eau de référence est un autre facteur à considérer dans le choix du site, car des besoins de pompage élevés, imputables à la distance de pompage ou à la charge hydraulique (hauteur de chute), risquent d’être supérieurs aux caractéristiques de la pompe, laquelle ne pourra pas générer le débit requis. Parmi les autres points à considérer, mentionnons la présence d’un espace suffisant, la facilité d’accès au site, les sources d’alimentation en électricité et la sécurité.
L’accès à une source d’énergie est un des principaux critères qui influent sur le choix du site. L’exploitant fournit habituellement une ligne électrique que ses électriciens installent à cette fin sur la remorque ou sur la palette d’expédition dans le coffret de branchement du mésocosme. En régions éloignées, des génératrices ont été utilisées pour alimenter le système en l’absence de source d’énergie, mais cette approche n’est pas recommandée, car l’entretien et la surveillance des génératrices risquent de rendre le coût de cette méthode prohibitif.
Au moment venu d’installer le système, le processus consiste à choisir le site, décharger l’équipement et installer les réservoirs de tête et de mélange à l’extrémité opposée du coffret de branchement électrique (dans le cas des systèmes modulaires). Les mésocosmes modulaires sont d’ordinaire installés sous une tente qui les protégera du soleil et de la poussière et permettra d’assurer une meilleure sécurité. Les réservoirs de tête et de mélange et le coffret de branchement électrique s’installent à l’extérieur de la tente (). Les mésocosmes modulaires ou les remorques sont orientés dans un axe nord-sud, c’est-à-dire perpendiculairement au lever et au coucher du soleil. On procède dans l’ordre à l’installation des équipements, au branchement électrique, à la mise à niveau des tables à mésocosmes, à la connexion des tuyaux des réservoirs de tête et de mélange aux bassins, au remplissage des réservoirs, à la mise sous tension et à l’étalonnage des pompes, au montage des tentes (pour les mésocosmes modulaires) et au transfert des animaux.
Il est essentiel de calculer les besoins du système en énergie électrique en fonction du protocole expérimental retenu et d’évaluer le site pour vérifier la présence d’une source d’alimentation électrique adéquate. La fiabilité des sources d’électricité sur les sites industriels est un point important.
9.2.5 Plans d’études de suivi biologique
9.2.5.1 Vue d’ensemble
Le plan d’étude doit préciser les études en mésocosmes et les analyses de laboratoire connexes qui seront réalisées pour compléter le volet du Programme d’ESEE axé sur le suivi biologique. Bon nombre des composantes de l’étude sont similaires à celles définies dans les divers chapitres du présent guide technique.
Un plan d’étude est soumis à l’agent d’autorisation au moins six mois avant le début des échantillonnages qui serviront à effectuer l’étude de suivi biologique. Ce plan doit inclure ce qui suit :
- une caractérisation du site;
- les précisions voulues sur le déroulement des études sur la population de poissons et les tissus de poissons et la façon dont ces études fourniront les renseignements permettant de déterminer si l’effluent a un effet sur la population de poissons et les tissus de poissons;
- les espèces de poissons, les zones d’échantillonnage et les tailles d’échantillons sélectionnées;
- un calendrier détaillé des différentes étapes de l’étude en mésocosmes;
- les précisions voulues sur le déroulement de l’étude sur la communauté d’invertébrés benthiques et la façon dont cette étude fournira les renseignements permettant de déterminer si l’effluent a un effet sur la communauté d’invertébrés benthiques;
- les date et heure de prélèvement de tous les échantillons;
- les méthodes de terrain et de laboratoire;
- une description des mesures d’assurance de la qualité et de contrôle de la qualité (AQ/CQ) prévues pour assurer la validité des données;
- un sommaire des résultats de toutes études de suivi biologique présentés précédemment.
Parmi les autres renseignements qu’il est recommandé d’inclure dans le plan d’étude, mentionnons les suivants :
- la définition des buts et des objectifs de l’ESEE;
- la description de la démarche globale, y compris les raisons à l’appui de l’utilisation d’une méthode de remplacement (qui peuvent s’appuyer sur les résultats d’études de suivi antérieures);
- l’établissement de critères à l’appui du protocole statistique : formulation d’hypothèses, choix de méthodes statistiques, détermination des besoins en matière de données (analyse de la signification et de la puissance statistiques);
- l’élaboration de plans et de procédures de fonctionnement : procédures d’échantillonnage, protocole d’analyses en laboratoire, méthodes d’assurance de la qualité et de contrôle de la qualité, stockage et extraction des données, analyse des données;
- la description d’un plan pour l’interprétation des données et l’évaluation du programme.
9.2.5.2 Traitements à l’étude
Dans les études en mésocosmes, les effets d’un effluent sur les poissons sont évalués en comparant divers indicateurs d’effets (croissance, reproduction, condition et survie) de poissons en conditions contrôlées (eau de référence) à ceux des poissons exposés aux effluents. Dans l’étude des invertébrés benthiques, l’effet est déterminé en comparant les indicateurs d’effets (densité totale des invertébrés benthiques, richesse des taxons, indice de régularité et indice de similarité) entre les invertébrés benthiques du milieu témoin et les invertébrés exposés. Il est essentiel que les études en mésocosmes soient conçues de manière à maximiser la possibilité de déceler les effets, s’il en est. Il importe donc de choisir avec soin les traitements, le nombre de répétitions, les espèces sentinelles et les variables réponses, et de réaliser les études à la bonne période de l’année.
Les études en mésocosmes permettent de procéder à des manipulations expérimentales contrôlées qui sont en même temps écologiquement pertinentes (qualité de l’eau naturelle, photopériode, température de l’eau et de l’air). La souplesse du plan expérimental est un des avantages les plus importants et créatifs offerts par l’utilisation des mésocosmes. Plusieurs plans d’étude peuvent être utilisés, selon les exigences propres au site et la phase du programme de suivi (c.-à-d. détermination de l’ampleur et de la portée géographique, recherche de causes). Dans les cas les plus simples, deux traitements (groupe témoin et groupe exposé à l’effluent) sont comparés. Pour déterminer la concentration écologiquement pertinente, il est recommandé de se baser sur une étude de délimitation du panache réalisée durant la caractérisation du site (chapitre 2); par conséquent, la concentration doit être représentative de l’effluent rejeté dans la zone à proximité, après mélange complet.
Dans certains cas, des traitements additionnels pourraient être nécessaires. Les plans d’étude basés sur la relation dose-effet, qui prévoient l’utilisation d’un autre effluent plus concentré, sont utiles pour confirmer la sensibilité du biote et l’absence d’effets (voir Dubé et MacLatchy, 2000a; Culp et al., 2000a). D’autres traitements pourraient aussi être souhaitables lorsque plusieurs mines rejettent leurs effluents dans la même zone d’échantillonnage. Le cas échéant, chaque rejet peut représenter un traitement d’exposition dans le protocole expérimental et les effets de chaque effluent peuvent être examinés, séparément ou globalement. À titre d’exemple, si une mine rejette trois effluents dans le même plan d’eau récepteur, les effets de ces effluents peuvent être évalués au moyen des traitements suivants : témoin, effluent 1 (concentration caractéristique de l’environnement), effluent 2, effluent 3, effluent 1+2+3 (concentration caractéristique de l’environnement) (voir tableau 9-1).
Plus récemment, des mésocosmes modulaires ont servi à comparer l’exposition dans l’eau ambiante et l’exposition par voie alimentaire du Méné à grosse tête à des EMM. Cette méthode était utile pour l’étude des différents métaux présents dans les effluents et de leurs incidences sur les types de réponses des poissons. Les poissons répartis en deux groupes -- eau de référence ou effluent -- ont été nourris de chironomidés C. tentans cultivés dans de l’eau de référence ou exposés à l’effluent (figure 9-8A). Les résultats obtenus ont été comparés à ceux de traitements en mésocosmes multitrophiques effectués simultanément. D’autres études ont également été réalisées pour évaluer les effets de diverses variables chimiques de l’eau sur l’atténuation de la toxicité d’un métal et d’un EMM pour le Méné à grosse tête, en particulier les effets d’une augmentation du pH et de la teneur en matières organiques naturelles en utilisant des mésocosmes multitrophiques (figure 9-8B).
9.2.5.3 Répétitions
Dans les systèmes à mésocosmes modulaires avec benthos ou poissons, on utilise d’ordinaire de cinq à huit répétitions. Dans le cas des systèmes à mésocosmes mobiles utilisant un plan d’étude contrôle-impact à deux traitements (référence contre exposition), huit répétitions seront utilisées, puisque le système de mésocosmes comprend 16 bassins. Si un nombre additionnel de traitements est préféré, alors le nombre minimal de répétitions aux fins du Programme d’ESEE devrait être de cinq bassins répétés par traitement pour obtenir la puissance statistique nécessaire à l’évaluation des effets, lorsque les bassins constituent l’unité de répétition et qu’il n’existe aucune donnée de suivi préalable. Cette approche est conforme à la méthode recommandée pour déterminer le nombre de stations d’échantillonnage, d’après la puissance statistique des plans d’étude sur le terrain (chapitres 3 et 4).
L’unité de répétition est moins évidente lorsqu’on veut utiliser le système pour mesurer des variables individuelles chez le poisson. Il faut alors quantifier l’importance de l’effet imputable au bassin (c.-à-d. l’effet d’un bassin par rapport à un autre, à l’intérieur d’un même traitement). Dans bon nombre d’études en laboratoire pour lesquelles les poissons sont placés dans un aquarium, on présume qu’il n’y a pas de raison biologique pour qu’il y ait des différences entre les bassins, et toutes les mesures individuelles d’un même traitement sont donc mises en commun (c.-à-d. qu’on ignore souvent la variabilité imputable à l’effet du bassin). Toutefois, dans le cas des études en mésocosmes, il est possible qu’un effet de bassin existe et qu’il faille tenir compte de la variation imputable à cet effet dans le plan statistique, notamment dans le cas d’expositions à plus long terme (p. ex., 60 jours). Il serait alors possible de procéder à une analyse de variance (ANOVA) hiérarchique, où l’effet du bassin est intégré au facteur à effet fixe (traitement de l’effluent). S’il existe un effet de bassin, le nombre de répétitions devrait être ajusté en fonction du système de bassins artificiels. S’il n’existe pas d’effet de bassin, le poisson peut être choisi comme unité de répétition, et tous les résultats d’un même traitement peuvent être mis en commun, ce qui aura pour effet d’augmenter sensiblement le nombre de répétitions. Pour les analyses de régression (analyse de covariance [ANCOVA]), il est probable que toute différence entre les bassins apparaîtra dans l’analyse comme une valeur aberrante.
9.2.5.4 Tailles des échantillons et rôle de l’ampleur de l’effet
9.2.5.4.1 Absence de données préalables (historiques)
Système de mésocosmes sur remorque : Les systèmes mobiles de mésocosmes offrent la possibilité de conserver les poissons plus longtemps que les systèmes modulaires de mésocosmes. En l’absence de données de suivi de base, l’échantillon minimal recommandé pour une étude sur le terrain est de 20 mâles et 20 femelles parvenus à maturité sexuelle de deux espèces de poissons prélevés dans chacune des zones de référence et d’exposition. Si l’une ou les deux espèces sont des poissons de petite taille, 20 poissons sexuellement immatures devraient aussi être prélevés. La décision d’utiliser 20 poissons de chaque sexe s’appuie sur le fait que les limites de confiance au seuil de 95 % varient peu en augmentant la taille de l’échantillon au-delà de 20 poissons. Dans les mésocosmes mobiles, il s’agit de répartir de 15 à 20 mâles et de 15 à 20 femelles sexuellement matures d’une espèce sentinelle de petite taille dans chaque bassin, et d’y ajouter de 20 à 30 poissons juvéniles. Il s’agit de la taille recommandée pour les échantillons, laquelle peut être augmentée ou réduite selon l’espèce sélectionnée, la puissance statistique du plan d’étude et la variabilité du poisson. Si le bassin est l’unité de répétition choisie pour un traitement, alors le recours à 20 poissons de chaque sexe par bassin permet d’obtenir une moyenne d’un bon degré de précision (les limites de confiance à 95 % varient peu au-delà de 20 poissons). S’il n’y a pas d’effet de bassin et que les termes d’erreurs sont combinés de manière à ce que le poisson devienne l’unité de répétition, on obtiendra un niveau de répétition beaucoup plus élevé en utilisant de 15 à 20 poissons de chaque sexe par bassin, pour chaque traitement. Dans le cas par exemple d’un plan d’étude ayant pour but de comparer un témoin à un effluent d’une concentration de 1 % en utilisant huit bassins par traitement, l’utilisation de 20 mâles, 20 femelles et 20 juvéniles par bassin peut donner en fait 160 mâles, 160 femelles et 160 juvéniles par traitement, si le poisson est l’unité de répétition.
Système modulaire de mésocosmes : Pour les études en mésocosmes modulaires utilisant des invertébrés benthiques ou des poissons, la taille de l’échantillon correspond au nombre de bassins répétés par traitement, puisque le bassin est l’unité de répétition. Dans un plan contrôle-impact, on utilise huit bassins (répétitions) par traitement. Chaque table de mésocosmes représente un traitement, et ce plan d’étude -- le plus simple -- n’exige donc que deux tables. Le nombre de traitements à l’étude peut être plus élevé, mais il doit y avoir au moins cinq répétitions ou échantillons par traitement pour satisfaire au critère de puissance en l’absence de données préalables (voir ci-après). On peut utiliser dans chaque circuit des couples ou des trios reproducteurs, selon l’objectif de l’étude. Le protocole mis au point par Ankley et al. (2001) utilise deux mâles pour quatre femelles par répétition. Toutefois, ce ratio de reproducteurs est trop élevé pour les mésocosmes, et ce nombre de poissons est certainement trop élevé pour un essai en mésocosmes multitrophiques auto-entretenus à durée d’exposition de 21 jours. Il est donc recommandé d’utiliser une paire ou un trio (un mâle pour deux femelles). Si on opte pour des trios de Ménés à grosse tête reproducteurs dans un plan à mésocosmes modulaires, il convient d’évaluer les données correspondant aux deux femelles à l’aide d’une mesure de tendance centrale en utilisant le bassin comme niveau de répétition.
Il importe de tenir compte des objectifs de l’étude des poissons lorsqu’on choisit le système de mésocosmes à utiliser. Le système de mésocosmes sur remorque utilise un nombre de poissons plus grand dans chaque répétition, mais il ne permet d’évaluer que les effets de l’exposition dans l’eau ambiante, et les critères d’effets mesurés sont la condition, le taux de survie, la taille des organes des adultes et la croissance des juvéniles, ce dernier paramètre étant un substitut de la taille selon l’âge. Les mésocosmes modulaires utilisent moins de poissons par répétition, mais permettent d’évaluer l’exposition multitrophique et/ou l’exposition dans l’eau ambiante, et permettent en outre de limiter l’analyse à une portion du cycle vital, de l’accouplement à la production des petits en fonction du temps avec une espèce à fraies répétées comme le Méné à grosse tête. Les paramètres servant à évaluer la reproduction, comme le nombre cumulatif d’œufs pondus par femelle et par jour, peuvent être répétés dans le temps, et les distributions de la production d’œufs peuvent être évaluées pour chaque traitement à l’aide de tests statistiques basés sur la distribution comme le test de Kolmorogov-Smirnov.
9.2.5.4.2 Données préalables (historiques) disponibles
Lorsque les données sont disponibles, on peut calculer la taille de l’échantillon requis pour mesurer l’ampleur de l’effet dans un paramètre donné au niveau de puissance statistique visé, car on connaît la variabilité de l’échantillonnage. Ainsi, il faudra utiliser un grand nombre d’échantillons si les paramètres sont très variables, si l’on cherche à déceler de petites différences entre les échantillons témoins et exposés (faible ampleur de l’effet) ou si l’on veut obtenir un niveau de puissance élevé. Pour déterminer la taille de l’échantillon à partir des données existantes, il faut d’abord déterminer l’ampleur de l’effet et le niveau de puissance statistique acceptable aux fins du processus de prise de décisions, cette étape ayant pour but d’établir à quel moment le programme d’échantillonnage fournit suffisamment de données pour étayer la prise de décisions. La taille de l’échantillon peut être calculée à partir des méthodes décrites aux chapitres 3 et 4. L’annexe 1 du document d’Environnement Canada (1997) décrit en détail les rapports de puissance, l’ampleur de l’effet et les avantages de réduire la variabilité en augmentant la puissance. Pour calculer la puissance, il est recommandé de fixer les valeurs de α et β à 0,10.
9.2.6 Évaluation des effets sur les poissons
9.2.6.1 Plan d’étude
9.2.6.1.1 Choix des espèces
Les principaux facteurs qui influent sur le choix des espèces de poissons pour les études en mésocosmes sont la pertinence de l’espèce par rapport au milieu étudié, l’abondance de l’espèce aux fins de l’échantillonnage, la disponibilité d’adultes et de juvéniles, le dimorphisme sexuel, la période de fraie et la sensibilité de l’espèce à l’effluent. La méthode recommandée pour évaluer les effets d’un effluent lors d’études en mésocosmes réalisées avec le système mobile de mésocosmes consiste à surveiller les adultes avant la période de fraie (poissons sexuellement matures), ainsi que les juvéniles d’une espèce de petite taille (p. ex., dards, ménés, chabots) présents dans le milieu récepteur. Le suivi des adultes permet d’évaluer les effets de l’effluent sur la survie, les paramètres liés à la reproduction (utilisation de l’énergie) et la condition (stockage d’énergie). De même, le suivi des juvéniles renseigne sur les effets de l’effluent sur la survie, la consommation d’énergie (c.-à-d. la croissance comme substitut de la taille selon l’âge) et le stockage d’énergie (c.-à-d. l’état et la taille du foie).
La sélection des espèces pour les études en mésocosmes est limitée par des facteurs reliés à la taille (le nombre de poissons par bassin diminue à mesure que leur taille augmente) et au dimorphisme sexuel (s’il est impossible de distinguer les mâles des femelles par leur apparence, il faut en utiliser davantage pour s’assurer que la taille de l’échantillon est suffisante). Les mésocosmes sont les systèmes les mieux adaptés aux études portant sur les espèces de poissons de petite taille. Les espèces échantillonnées doivent également convenir à l’évaluation des variables recommandées. Les espèces de poissons qui ont été utilisées jusqu’à maintenant pour des études en mésocosmes incluent le Choquemort, le Saumon atlantique juvénile, le Chabot visqueux, le Mulet à cornes, le Naseux des rapides et le Méné à grosse tête (tableau 9-1).
Les avantages et les inconvénients liés à l’utilisation d’espèces de petite taille pour les études sur le terrain sont décrits dans Gibbons et al., (1998a, 1998b), un poisson de petite taille faisant référence à une espèce mesurant au plus 150 mm de longueur. On peut trouver de l’information sur la croissance maximale des espèces de poissons dans la documentation scientifique, notamment dans Scott (1967), Scott et Crossman (1974), Fritz et al. (1975), Roberts (1988), Nelson et Paetz (1992), Jenkins et Burkhead (1993), Coad (1995) et Leblanc et Couillard (1995). Les espèces de petite taille sont habituellement plus abondantes, plus faciles à capturer et plus sédentaires que les espèces plus grosses. Il est souhaitable d’utiliser des espèces dont l’aire de répartition est plus restreinte, puisque cela contribue à accroître la probabilité et la régularité de l’exposition aux effluents comparativement à la situation des espèces plus grosses et plus mobiles qui peuvent migrer.
Cependant, l’utilisation de poissons de petite taille peut aussi comporter des inconvénients. Ainsi, on en connaît souvent moins sur leur biologie de base, en particulier sur leurs habitudes de fraie, d’où la difficulté de déterminer les meilleures zones, périodes et méthodes d’échantillonnage. Toutefois, grâce aux données très nombreuses recueillies sur les espèces de poissons de petite taille dans le cadre du Programme d’ESEE et aux nombreuses recherches effectuées au Canada, nos connaissances sur les stratégies de survie et les caractéristiques biologiques fondamentales de ces espèces se sont sensiblement enrichies (K. Munkittrick, Université du Nouveau-Brunswick, inédit). Certaines espèces sont des reproducteurs à pontes multiples (plus d’une ponte d’œufs matures par année) (Heins et Rabito, 1986; Burt et al., 1988; Paine, 1990), ce qui peut être un inconvénient pour les études sur le terrain, car il est difficile d’estimer l’effort de reproduction chez ces espèces à partir d’un seul échantillon. Il peut y avoir renouvellement presque complet des tissus reproducteurs entre les pontes (c.-à-d. il y aura ponte de la majeure partie de la masse d’œufs produite dans l’ovaire, puis formation d’une nouvelle masse d’œufs matures). Le nombre de pontes durant la saison de fraie devient la variable de reproduction déterminante, qu’il est toutefois difficile d’estimer pour une femelle donnée sur le terrain, même en procédant à de fréquents échantillonnages. Malgré tout, des poissons à pontes multiples comme le Choquemort ont été utilisés avec succès dans des études en mésocosmes visant à évaluer les effets d’un effluent sur les critères d’effets d’ESEE, y compris sur la taille des gonades (Dubé et MacLatchy, 2000a; Cash et al., 2003; Dubé et al., 2001). Un des avantages des études en mésocosmes avec exposition contrôlée est qu’il est possible de surveiller l’état des reproducteurs à ponte fractionnée tout au long de la période d’exposition.
Les progrès les plus récents de la technologie des mésocosmes et de ses applications en systèmes modulaires ont été réalisés avec le Méné à grosse têtedans des essais d’exposition du cycle vital partiel d’une durée de 21 à 30 jours (tableau 9-1). Les systèmes mobiles de mésocosmes (sur remorque) se sont montrés utiles pour l’évaluation des effets des effluents. Toutefois, ces systèmes sont limités à l’étude de l’exposition dans le milieu aquatique ambiant, ce qui en réduit la pertinence écologique. Il est d’usage courant de mesurer l’exposition dans l’eau ambiante pour les évaluations toxicologiques de poissons exposés à un seul contaminant, mais étant donné la nature des mélanges complexes d’effluents, il convient de tenir compte également des voies d’exposition alimentaires. Par exemple, de nombreux travaux ont examiné l’importance du transfert trophique des métaux (Ni et al., 2000; Chen et al., 2000; Mason et al., 2000; Xu et Wang, 2002) dans les milieux aquatiques. Ainsi, il serait souhaitable de perfectionner les systèmes de mésocosmes pour tenir compte également de l’exposition par voie alimentaire. En outre, il pourrait également s’avérer souhaitable de pouvoir évaluer directement la reproduction (nombre d’œufs produits, nombre de fraies et survie des jeunes, taux d’éclosion et difformités) après une exposition aux effluents en plus de la mesure des critères d’effets d’ESEE aux fins de l’étude des causes.
Le Méné à grosse tête est l’espèce par excellence des études toxicologiques en laboratoire, parce qu’il constitue un représentant écologiquement important de la famille des Cyprinidés, et comme il a fait l’objet de très nombreux essais, il existe une vaste quantité de données concernant son élevage et son cycle vital (Panter et al., 2002; Ankley et al., 2001; Jensen et al., 2001). Cette espèce est aussi utilisée dans les études d’évaluation des risques et de surveillance menées par les autorités publiques et l’industrie à l’échelle internationale (U.S. EPA, 1982, 1996, 1999, 2002; OCDE, 2001; Shaw et al., 1995a, 1995b). De plus, le Méné à grosse tête est une espèce de petite taille (longueur moyenne de 6 cm et largeur de 1 cm), à ponte fractionnée effectuée sur le substrat et qui, dans des conditions précises, peut être facilement manipulée en captivité pour produire des masses de 50 à 150 œufs tous les trois à cinq jours. Il s’agit par ailleurs d’une espèce pertinente sur le plan écologique, qui est abondante dans les milieux d’eau douce d’un bout à l’autre du Canada. Ainsi, la mise au point d’un système de mésocosmes fondé sur le Méné à grosse tête capable de mesurer les critères d’effets d’ESEE et de permettre une évaluation directe des effets des mélanges d’effluents sur la reproduction peut s’avérer extrêmement utile dans les cas où les études sur le terrain sont irréalisables. En outre, des mésocosmes auto-entretenus (indépendants des sources de nourriture de l’extérieur), dans lesquels les poissons et leur nourriture sont cultivés simultanément, permettant d’étudier l’exposition des poissons par voie alimentaire, en plus de l’exposition dans le milieu aquatique ambiant (c.-à-d. mésocosmes multitrophiques), pourraient s’avérer hautement pertinents.
Ankley et al. (2001) ont élaboré un bioessai à court terme basé sur le Méné à grosse tête, qui permet d’évaluer la reproduction et certains aspects des premières étapes du développement dans un délai plus court que les bioessais classiques. La durée de l’essai portant sur le cycle vital partiel (21 jours) se prête bien aux études en mésocosmes. Plusieurs chercheurs ont utilisé le bioessai de 21 jours pour étudier les effets des substances œstrogènes (Harries et al., 2000; Ankley et al., 2001; Sohoni et al., 2001), androgènes (Ankley et al., 2003) et anti-androgènes (Jensen et al., 2004). Ces études ont surtout mis l’accent sur des contaminants uniques qui ne représentent pas la complexité des effluents. Quelques chercheurs ont porté leur attention sur les effets d’effluents industriels en utilisant le bioessai de 21 jours (Martel et al., 2003; Parrott, 2005), mais ces études ont utilisé des méthodes différentes (p. ex., nombre de répétitions indépendantes, nombres et types de variables mesurées) et ont été réalisées en laboratoire, avec exposition au milieu aquatique ambiant.
L’utilisation du bioessai de 21 jours avec le Méné à grosse tête en mésocosmes pour les ESEE nécessitait d’abord une installation sur le terrain avec un approvisionnement en eau réceptrice naturelle, tout en pouvant régler la température et la photopériode (Rickwood et al., 2006a; 2006b). Comme le bioessai du cycle vital de C. tentans avait déjà été élaboré pour le système modulaire de mésocosmes (Hruska et Dubé 2004; 2005), il ne s’agissait plus que de combiner ces essais en un seul test multitrophique en mésocosmes, utilisable dans le système modulaire de mésocosmes. Ceci a d’abord été réalisé en laboratoire dans des conditions contrôlées de température de l’eau (Rickwood et al., 2006c), puis transposé sur le terrain dans des conditions de température et de photopériode ambiantes, en utilisant l’eau de référence ambiante (Pollock et al., 2009; Rickwood et al., 2008). Les Ménés à grosse tête utilisés pour ces études avaient été élevés en laboratoire et transportés sur le site, afin d’assurer une maîtrise adéquate de la qualité des poissons, de leur âge, de l’état de développement de leur système reproducteur et du degré (ou de l’absence) d’exposition.
9.2.6.1.2 Indicateurs d’effets
Système de mésocosmes sur remorque : Les indicateurs d’effets mesurés sur le poisson sont les mêmes, que l’étude soit menée sur le terrain ou en mésocosmes. Les effets sur la croissance, la reproduction, la condition et la survie de la population servent à évaluer si l’effluent a une incidence sur la population de poissons. La survie, la croissance et la reproduction (utilisation de l’énergie) et la condition (stockage d’énergie) sont des mesures qui peuvent permettre de déceler un effet relié à l’effluent, et toutes ces mesures peuvent être prises sur des poissons exposés aux effluents dans le cadre d’études en mésocosmes (tableau 9-2).
La croissance est la variation de la taille (poids ou longueur) en fonction du temps ou de l’âge. Les études en mésocosmes menées sur une période d’exposition plus longue (45 à 60 jours) peuvent évaluer les effets de l’effluent sur la croissance des juvéniles, et plus particulièrement les changements du poids corporel total et de la longueur par rapport aux poissons témoins. Pour les études en mésocosmes, la croissance est mesurée chez les jeunes de l’année ou les juvéniles, du début à la fin de l’étude, soit pendant six à huit semaines selon la température durant l’étude. Si les effets sur la croissance doivent être déterminés à partir d’une période d’exposition plus courte, les études doivent alors être réalisées lorsque la température de l’eau est chaude, sur une espèce-sentinelle à taux de croissance élevé. Kneib et Stiven (1978) ont démontré que les juvéniles du Choquemort, par exemple, ont un taux de croissance très élevé après l’éclosion (gain de 15 mm en deux mois), ce qui en fait une espèce idéale pour évaluer les effets d’un effluent sur la croissance. Selon des études réalisées sur des jeunes de l’année du Chabot visqueux, les effets sur la croissance peuvent être mesurés après 26 jours seulement d’exposition aux effluents (Dubé et al., 2005), et bien que l’on mesure également la longueur et le poids des adultes, il est peu probable que les sujets adultes grossissent pendant la courte durée des études en mésocosmes.
| Indicateurs d’effets | Critères d’effets et critères d’appui | Test statistique |
|---|---|---|
| Croissance |
| ANOVA |
| Reproduction |
| ANCOVA |
| Condition | Condition des juvéniles et des adultes :
| ANCOVA |
| Survie | Survie des juvéniles et des adultes
| ANOVA |
© M. Dubé
* Critères d’effets des études en mésocosmes utilisés pour établir la présence ou non d’effets, un effet étant défini comme une différence statistiquement significative entre les données des zones exposées et celles des zones de référence. Des critères d’appui peuvent aussi être utilisés pour appuyer les analyses.
| Type de réponse | Variable réponse | Variable dépen- dante (Y) | Variable indépen-dante (X) | Cova-riable (X) | Méthode statis- tique à un facteur | Méthode statis- tique à deux facteurs |
|---|---|---|---|---|---|---|
| Étape de l’essai : avant l’exposition (poissons répondant aux critères de sélection) | ||||||
| Utilisation d’énergie (adultes) | Production totale moyenne d’œufs (nombre) | Nombre total moyen d’œufs par groupe de reproduc- teurs | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Production moyenne d’œufs (nombre) | Nombre moyen d’œufs/ femelle/ jour | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Nombre cumulé d’œufs/ femelle/ jour | Nombre cumulé d’œufs/ femelleJours | Jours | S.O. | Kolmogorov-Smirnov | Kolmogorov-Smirnov | |
| Nombre total moyen de fraies | Nombre total moyen de fraies par groupe de reproducteurs | Traite- ment | S.O. | Khi-carré | Khi-carré | |
| Jeunes | Taux de fécondation (%) | Nombre d’œufs fécondés/ œufs pondus × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Étape de l’essai : exposition | ||||||
| Survie des adultes | Taux moyen de survie des adultes (%) | Nombre d’adultes vivants/ nombre d’adultes au départ × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Stockage d’énergie (adultes) | Condition (g/cm) | Poids corporel total (log) | S.O. | Lon- gueur (log) | ANCOVA | ANCOVA (deux critères de class.) |
| Taille relative du foie (g) | Poids du foie (log) | S.O. | Poids corporel total (log) | ANCOVA | ANCOVA (deux critères de class.) | |
| Poids du foie (log) | S.O. | Lon- gueur (log) | ANCOVA | ANCOVA (deux critères de class.) | ||
| Taille relative des œufs (µm) | Taille moyenne des œufs (log) | S.O. | Poids corporel total (log) | ANCOVA | ANCOVA (deux critères de class.) | |
| Taille moyenne des œufs (log) | S.O. | Lon- gueur (log) | ANCOVA | ANCOVA (deux critères de class.) | ||
| Stockage d’énergie (adultes) (Si l’ANCOVA est irréalisable à cause d’un étalement insuffisant sur l’abscisse) | Coefficient de condition moyen (%) | Poids corporel total/ (longueur)3 * 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Indice hépato- somatique (%) | Poids du foie/ poids corporel * 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Indice gonado- somatique (%) | Poids des gonades/ poids corporel * 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Utilisation de l’énergie (adultes) | Poids corporel total (g) | S.O. | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Longueur à la fourche (cm) | S.O. | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Taille relative des gonades (g) | Poids des gonades (log) | S.O. | Poids corporel total (log) | ANCOVA | ANCOVA (deux critères de class.) | |
| Poids des gonades (log) | S.O. | Lon- gueur (log) | ANCOVA | ANCOVA (deux critères de class.) | ||
| Nombre cumulé d’œufs/ groupe de reproduc-teurs/ jour | Nombre cumulé d’œufs/ groupe de reproducteurs | Jour | S.O. | Kolmogorov-Smirnov | Kolmogorov-Smirnov | |
| Production totale moyenne d’œufs/ jour | Nombre total moyen d’œufs/ femelle/jour | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Production moyenne d’œufs/ jour | Nombre moyen d’œufs/ femelle/jour | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Nombre cumulé de fraies/ groupe de reproduc-teurs/ jour | Nombre cumulé de fraies/ groupe de reproduc- teurs | Jour | S.O. | Kolmogorov-Smirnov | Kolmogorov-Smirnov | |
| Nombre total moyen de fraies/ jour | Nombre total moyen de fraies/ femelle/jour | Traite- ment | S.O. | Khi-carré | Khi-carré | |
| Fécondité relative (nombre) | Nombre d’œufs/ femelle (log) | S.O. | Poids corporel total (log) | ANCOVA | ANCOVA | |
| Nombre d’œufs/ femelle (log) | S.O. | Lon- gueur (log) | ANCOVA | ANCOVA | ||
| Autres paramètres de la reproduction des adultes | Dévelop-pement des caractères sexuels secondaires | Présence/ absence de tubercules; bandes; taches sur nageoires; coussinet | Traite- ment | S.O. | Khi-carré | Khi-carré |
| Rang de la taille de l’ovipositeur | Traite- ment | S.O. | Khi-carré | Khi-carré | ||
| Hormones reproduc-trices | Testostérone M/F (ng/g) | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Œstrogène F (ng/g) | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | ||
| Vitellogenine M (ng/g) | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | ||
| Histologie des gonades | Nombre et stade des cellules | Traite- ment | S.O. | Khi-carré | Khi-carré | |
| Jeunes | Taux moyen d’éclosion (%) | Nombre d’œufs éclos/ nombre d’œufs fécondés × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Taux moyen de difformités (%) | Nombre total de difformités à l’éclosion/ nombre total de larves × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Taux moyen de fécondité (%) | Nombre d’œufs fécondés/ œufs pondus × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Taux moyen de survie des larves (%) | Nombre de larves survivantes après 5 jours/nombre total de larves × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Nombre moyen de jours à l’éclosion | Nombre moyen de jours à l’éclosion | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Paramètres chimiques de l’eau | Mesures in situ | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Tissus des poissons – charge corporelle | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Tissus des poissons – gonades | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Tissus des poissons – branchies | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Tissus des poissons – foie | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Tissus des chironomidés | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Tissus des algues | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Analyses des sédiments | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
© M. Dubé
Légende : F : femelle; M : mâle; S.O : sans objet; class.: classification.
La reproduction peut être exprimée en fonction de l’effort de reproduction, de la fécondité, de la taille des œufs ou du poids des gonades par rapport à la taille corporelle. Jusqu’à maintenant, les effets des effluents sur la fonction reproductrice ont été évalués en mésocosmes en fonction des variations de la taille des gonades. La fécondité et la taille des œufs sont également faciles à mesurer lorsque la période d’échantillonnage est choisie avec soin. Idéalement, les études d’exposition devraient commencer de six à huit semaines avant la fraie, pour évaluer les effets de l’effluent sur le poids des gonades.
L’état physique du poisson est également évalué durant une étude en mésocosmes. Il est ainsi requis de faire une estimation visuelle des malformations physiques, y compris des lésions à la surface du corps comme les nageoires érodées, effilées ou qui saignent, la présence de parasites ou autres malformations physiques.
Système de mésocosmes modulaire : Les variables réponses mesurées dans le système modulaire, qui a été principalement utilisé avec le Méné à grosse tête, sont résumées -- avec les méthodes d’analyse statistique suggérées -- au tableau 9-3. Les variables recommandées sont surlignées en gris. Les autres sont variables qui ont été mesurées dans le cadre de divers plans d’études et qui pourraient être inclues à titre complémentaire. Il importe de noter que l’utilisation de la méthode normalisée de bioessai de la reproduction sur 21 jours d’Ankley et al. (2001) a été modifiée afin de mieux s’adapter au contexte du Programme d’ESEE, notamment pour pouvoir servir de méthode de remplacement du suivi des poissons. Les méthodes décrites ci-dessous sont toujours en voie de validation et de normalisation par le Comité scientifique des ESEE. Les mines qui comptent utiliser cette méthode de remplacement devraient s’attendre à évaluer les variables réponses à mesurer et à inclure des variables d’appui pour adapter et améliorer cette méthode afin de l’utiliser dans leur Programme d’ESEE.
9.2.6.1.3 Période et durée de l’exposition aux effluents
Il est important de choisir avec soin la période de l’étude en mésocosmes, en tenant compte de l’espèce retenue pour l’étude. La température de l’eau influe sur le plan expérimental. Si l’étude se déroule au printemps, alors que l’eau est froide, le temps d’exposition risque d’être plus long, en particulier pour la mesure d’une réponse comme la croissance. Les essais ne sauraient être effectués à une température inférieure à –5 °C à cause du gel des conduites d’eau.
Les études en mésocosmes devraient tendre vers un équilibre entre la durée et la rentabilité. Les durées d’exposition de 21 à 45 jours sont monnaie courante pour les communautés d’invertébrés benthiques dans l’un ou l’autre des systèmes de mésocosmes. Des périodes d’exposition de 21 jours sont habituelles pour l’essai fondé sur le cycle vital partiel avec le Méné à grosse tête en guise d’espèce-sentinelle dans le système de mésocosmes modulaire. Les essais d’exposition dans le milieu aquatique ambiant en système mobile prennent souvent une période d’exposition de 30 jours en été et en automne et servent notamment à mesurer les changements de la taille des organes adultes (foie et gonades) et du taux de croissance des jeunes de l’année du Chabot visqueux, après exposition à un effluent.
Toutes les études en mésocosmes devraient être réalisées durant les périodes d’exploitation normales de l’entreprise. Les effluents devraient être représentatifs de conditions d’exploitation normales. De même, les études en mésocosmes ne devraient pas être menées s’il n’y a pas eu de rejet d’effluent pendant une longue période, ni durant une période de perturbation du système de traitement des eaux usées. Il convient de veiller à ce que les périodes de fermeture prévues soient annoncées longtemps à l’avance et à ce qu’elles ne nuisent pas aux études.
Système de mésocosmes sur remorque : Il est important de choisir avec soin la période de l’étude en mésocosmes, en tenant compte du cycle de fraie de l’espèce de poisson. Pour en savoir plus sur les cycles de fraie et l’échantillonnage saisonnier, consulter le chapitre 3. Idéalement, pour les reproducteurs du printemps, les études commenceront de six à huit semaines avant le début de la fraie. Si l’espèce fraye tôt au printemps et donc qu’il est impossible de l’étudier aussi longtemps avant la période de la fraie, les études doivent être menées le plus tard possible durant l’année pour permettre la sénescence et la recrudescence des gonades. Pour les reproducteurs de l’automne, l’étude peut être menée au printemps ou à l’été, sauf peut-être pour les espèces dont les œufs arrivent à maturité rapidement. Par exemple, certains cyprins qui frayent à la fin du printemps devraient être étudiés au début du printemps, plutôt qu’à l’automne, lorsque leurs œufs peuvent encore être immatures. La température de l’eau est un autre facteur à considérer pour déterminer la période de l’étude, si le taux de croissance des juvéniles est plus élevé durant les mois d’été.
Système modulaire de mésocosmes : Lorsque ce système est utilisé avec le Méné à grosse tête, il doit être installé sur place de 10 à 14 jours avant la période d’exposition (cette période dépend du temps qu’il faut au poisson pour répondre aux critères de sélection de base appropriés) et y reste pendant la période d’exposition de 21 à 30 jours. Les études devraient être effectuées de mai à la fin de septembre, lorsque la température de l’eau et de l’air se situe entre 15 et 28 °C.
9.2.6.2 Méthodologie relative au poisson
9.2.6.2.1 Installation générale - Système de mésocosmes sur remorque
Après que le système de mésocosmes a été amené sur les lieux de l’étude et qu’il a été branché aux réseaux d’alimentation en eau de référence et en électricité, le substrat peut être introduit dans les bassins, et le débit d’eau, étalonné. Selon les caractéristiques du substrat propre au site, une couche de 5 cm de gravier concassé ou de sable lavé peut être ajoutée dans chaque bassin. Lors d’études précédentes, de grosses roches lavées ont aussi été ajoutées dans chaque bassin pour servir de refuge aux poissons.
Les poissons sont prélevés d’une zone de référence, non exposée à l’effluent à l’étude. La collecte doit bien sûr se faire par des méthodes de prélèvement non létales, par exemple à l’aide de pièges à ménés ou de trappes en filet ou par la pêche à l’électricité avec filets de retenue (Portt et al., 2006). Les poissons sont habituellement triés sur le terrain pour s’assurer que l’on a prélevé un nombre suffisant de juvéniles ainsi que d’adultes de chaque sexe (si l’espèce est dimorphe), et que les poissons recueillis sont de classe de taille similaire. Si l’espèce choisie n’est pas sexuellement dimorphe, les rapports des sexes sur le terrain sont supposés égaux, et les poissons sont répartis de façon aléatoire entre les bassins. Les poissons sont transportés dans la zone d’étude dans des contenants munis de couvercles et suffisamment aérés. S’il n’existe aucune zone de référence, des poissons d’élevage peuvent être utilisés si leur espèce est présente dans la zone à l’étude.
Sur les lieux de l’étude – de préférence le même jour – les poissons sont mesurés (longueur et poids), puis sont répartis de façon aléatoire entre les bassins. Le degré de précision des mesures doit être conforme aux exigences définies dans le chapitre 3, le niveau de précision étant plus élevé pour les espèces de petite taille. Le nombre optimal de poissons par bassin est de 20 adultes de chaque sexe et de 20 à 30 juvéniles. Pour assurer une répartition aléatoire des poissons entre les bassins, 16 seaux aérés contenant de l’eau de référence sont installés. Chaque poisson est mesuré puis déposé dans un des seaux, jusqu’à ce que chaque seau contienne un poisson. Ce processus est répété jusqu’à ce que tous les seaux renferment chacun cinq poissons. Les seaux sont alors répartis de façon aléatoire entre les bassins, et la procédure est répétée jusqu’à ce que l’on ait atteint le nombre voulu d’échantillons par bassin. Il est essentiel de suivre cette procédure pour s’assurer, par exemple, que les poissons les plus gros ne se retrouvent pas tous dans les premiers bassins.
La répartition des poissons peut se faire selon l’un des deux scénarios suivants. Les adultes et les juvéniles peuvent être placés dans les mêmes bassins, si le taux de croissance des juvéniles est déterminé uniquement en fonction de la longueur et du poids mesurés au début et à la fin de l’étude et que les adultes ne sont pas cannibales. Cependant, si le taux de croissance des juvéniles doit être évalué tout au long de l’étude (les juvéniles sont peut-être marqués en vue de la prise de mesures répétées durant l’étude), il est recommandé de placer les adultes et les juvéniles dans des bassins différents (ou dans des zones différentes à l’intérieur d’un même bassin si ces zones peuvent être séparées physiquement), afin de réduire au minimum le stress des adultes dû à la capture. Les bassins des mésocosmes sont assignés à chaque traitement (contrôle/effluent) de manière aléatoire, de même que la répartition des poissons dans chacun des bassins. Cela assure une distribution aléatoire minimisant ainsi les différences entre les bassins dues à des facteurs, comme leur emplacement sur la remorque.
Après l’ensemencement, les poissons s’adaptent aux conditions dans le système de bassins artificiels pendant au moins 72 heures, ou jusqu’au moment où les poissons commencent à s’alimenter, avant d’y ajouter l’effluent. Les bassins doivent être recouverts d’un filet pour réduire au minimum la perte de poissons qui s’échapperaient ou qui seraient la proie des oiseaux. Durant la période d’exposition (de 30 à 60 jours), les poissons sont nourris de granulés pour truites à raison de 4 à 6 % du poids corporel total par bassin, par jour, la grosseur des granulés variant en fonction de la taille de l’espèce à l’étude. Lors d’études antérieures, les granulés ont été broyés avant d’être servis aux poissons.
9.2.6.2.2 Installation générale – Système modulaire de mésocosmes
Chacun des systèmes modulaire à mésocosmes est constitué d’une table (une par traitement) sur laquelle sont installés cinq à huit (de préférence) bassins circulaires en polyéthylène haute densité de 10,3 L. L’eau de trop-plein qui s’écoule sur la table se vide dans un réservoir de dilution de 85 L comme décrit précédemment. Si un système à transfert trophique est utilisé, chaque bassin contient une couche de sédiment (sable siliceux lavé), une culture de chironomidés C. tentans, une barrière d’alimentation, un lit de fraie et une paire ou un trio de Ménés à grosse tête reproducteurs (figure 9-6) (Rickwood et al., 2006c, 2008). Les barrières d’alimentation servent à contrôler l’accès des Ménés à grosse tête aux C. tentans qui se sont établis dans le substrat pendant la période de l’étude préalable à l’exposition. Ces barrières sont faites d’un grillage à mailles carrées de 1/8 po (0,32 cm) percé d’une ouverture en pointe de tarte dont la superficie correspond au dixième de la superficie totale du bassin (environ 71 cm2), et qui se déplace tous les deux jours pour permettre aux poissons d’accéder à une quantité appropriée de nourriture (1 g de C. tentans/jour) (voir ci-dessous pour des détails sur la production de quantités appropriées de C. tentans).
Période préalable à l’exposition : Des Ménés à grosse tête de six mois, sexuellement matures mais jamais accouplés, sont obtenus auprès d’un laboratoire d’élevage réputé. Les poissons sont d’ordinaire transportés sur le site par voie terrestre ou aérienne en moins de 24 heures, dans des sacs d’eau oxygénée, emballés dans des boîtes isolantes. À leur arrivée, les sacs sont ouverts et laissés suffisamment de temps pour prendre la température de l’air ambiant. L’eau de référence est ajoutée lentement pour permettre aux poissons de s’acclimater. Les poissons acclimatés doivent être placés dans un réservoir approprié pour une période de stimulation sexuelle préalable à l’essai d’accouplement qui précède l’exposition. Cette période de stimulation devrait durer environ trois jours.
La méthode d’essai en mésocosmes modulaires de Ménés à grosse tête comporte une période préalable à l’exposition et une période d’exposition. La période préalable utilise normalement le double du nombre requis de groupes reproducteurs placés dans des bassins exempts d’effluents afin d’établir le niveau de référence de la performance de reproduction. Au début de la période de reproduction, il faut noter le poids corporel total (g), la longueur à la fourche (mm) et les caractères sexuels secondaires -- bandes, tubercules nuptiaux, coussinet dorsal et taches sur les nageoires chez les mâles, et taille de l’ovipositeur chez les femelles (Parrot et Wood, 2001). Les Ménés à grosse tête femelles sont appariés dans la mesure du possible avec des mâles dont la longueur est similaire (± 25 %) (Pollock et al., 2008). Chaque paire de reproducteurs reçoit deux fois par jour 0,5 g de vers de vase congelés pendant toute la période préalable à l’exposition. Chaque jour avant la distribution de nourriture et l’enregistrement de la qualité de l’eau, les lits de fraie de chaque bassin sont inspectés pour déceler la présence d’œufs. Le cas échéant, les œufs sont délicatement transférés dans des boîtes de Pétri remplies d’eau de référence et photographiés aux fins du comptage numérique. À la fin de l’essai de reproduction, les groupes destinés à la phase d’exposition sont choisis. Les groupes choisis (paires ou trios, selon l’étude) sont ceux qui ont affiché un taux de survie de 100 % des adultes, qui ont produit des œufs au moins une fois dans les sept jours précédents, et qui ont affiché un taux de fécondation des œufs supérieur à 80 % (OCDE, 2006; U.S. EPA, 2007). Un autre critère pouvant être pris en considération est d’exclure les groupes reproducteurs extrêmes (celui qui a produit le plus d’œufs et celui qui en a produit le moins). Les groupes retenus doivent être répartis parmi les traitements et les bassins de manière à minimiser la variance entre les traitements. Des analyses statistiques sont effectuées avant la sélection finale pour vérifier qu’il n’y a pas de différence significative entre les traitements et au sein de chacun d’eux avant le début de l’exposition. L’unité de répétition s’établit à n = 5 à 8 par traitement.
Système de transfert trophique : Le système de transfert trophique et les cultures du chironomidé C. tentans dans les sédimentssont établis pendant la période préalable à l’exposition. Les densités cibles d’invertébrés dans chaque bassin sont fondées sur une quantité optimale quotidienne de nourriture de 1 g/couple reproducteur/jour (Rickwood et al., 2006a, 2006b). Des larves agées de sept jours de C. tentans sont expédiées au site une fois par semaine pendant trois semaines afin d’établir les cultures dans les mésocosmes, avant l’ajout des poissons. Ces larves, fournies par un éleveur réputé, sont exposées aux effluents au moins sept jours avant l’arrivée des poissons pour assurer une exposition par voie alimentaire adéquate. Cette précaution permet en outre d’assurer la présence dans les bassins des divers stades de développement de C. tentans (œufs, larves, pupes, adultes) et de maintenir ainsi un cycle de reproduction sain. Le nombre d’invertébrés requis dans chaque bassin pour assurer la subsistance des poissons pendant 21 jours est calculé à partir du nombre moyen de chironomidés émergeant d’une oothèque (~ 300) et en déterminant le nombre de larves de troisième et de quatrième stade dont le poids combiné atteint 1 g (~ 50). Une fois déterminé le nombre de chironomidés nécessaire pour obtenir 1 g, on calcule le nombre total qu’il faudra pour la période d’exposition entière de 21 jours (50 C. tentans/g × 21 jours = 1050 C. tentans, ou 350 larves de sept jours par bassin et par semaine, pendant trois semaines).
À la livraison, les larves doivent être acclimatées en ajoutant dans les contenants individuels 25 % d’eau de traitement à quatre reprises sur une période de 12 heures. L’acclimatation des larves se fait graduellement à la température ambiante (réduction maximale de 1 °C toutes les une ou deux heures) en plaçant leur contenant dans un bain d’eau froide. Les larves acclimatées à la température ambiante et à l’eau d’effluent sont distribuées dans les bassins et nourries d’une bouillie de Tetramin™ (100 g de flocons Tetramin™ dans 1000 ml d’eau de référence) à raison de 10 ml la première semaine, de 20 ml la seconde semaine, et de 30 ml à partir de la troisième semaine, trois fois par semaine. Il est recommandé de prélever trois carottes de sédiments (superficie de l’échantillonneur d’environ 9 cm2) dans chaque bassin à la fin de la période préalable à l’exposition, avant l’ajout des poissons, afin de pouvoir calculer la densité d’invertébrés.
Plan d’exposition : Après que les Ménés à grosse tête ont été répartis entre les bassins, les solutions de traitement sont distribuées dans les mésocosmes, et la période d’exposition débute.
9.2.6.2.3 Entretien et surveillance
L’entretien quotidien pendant la durée de l’étude inclut l’étalonnage des débits dans chaque bassin, pour s’assurer que l’on obtient les dilutions voulues, ainsi que le nettoyage des grilles et l’alimentation des poissons. Les conduites d’évacuation d’eau de chaque bassin sont grillagées pour éviter la perte de poissons, et ces grilles pourraient avoir besoin d’un nettoyage quotidien.
Il faut vérifier chaque jour s’il y a des poissons morts dans chaque bassin et mesurer divers paramètres physiques et chimiques de l’eau incluant la température, la concentration d’oxygène dissous, la conductivité et le pH. Ces mesures peuvent être prises à l’aide d’instruments YSI Inc. ou d’appareils de lecture continue comme un hydrolab ou une thermistance. L’oxygène dissous est un critère d’une importance vitale, en particulier dans les études sur des effluents à forte teneur en matières organiques (p. ex., les effluents des fabriques de pâtes). Dans tous les bassins, le taux d’oxygène dissous doit être maintenu à au moins 60 % et, de préférence, au-dessus de 80 %, en utilisant, au besoin, un système d’aération.
Dans le cas des systèmes à mésocosmes modulaires, les observations et mesures quotidiennes peuvent inclure la production d’œufs, le succès d’éclosion et la survie des larves (tableau 9-3). Les lits de fraie sont vérifiés chaque jour à la même heure, avant la distribution de nourriture et les mesures de la qualité de l’eau. Les œufs sont retirés et photographiés. On peut également prélever des sous-échantillons réguliers de chaque groupe d’œufs aux fins des analyses futures, en tenant compte de ce prélèvement lors de la détermination de la production d’œufs totale. Les œufs qui restent sont ensuite transférés dans un récipient et placés dans les bassins de culture aérés appropriés remplis d’eau de traitement. Vingt-quatre heures après la fraie, les œufs sont une fois de plus photographiés aux fins du calcul du taux de fécondation. Ils sont ensuite laissés en place jusqu’à l’éclosion ou la mort (~4-5 jours). Les larves écloses sont préservées dans une solution de formol à 10 % afin de les compter et les examiner pour la détection de difformités, s’il s’agit d’un paramètre souhaité pour les évaluations d’appoint.
9.2.6.2.4 Échantillonnage et analyse des poissons
À la fin de la période d’exposition, les poissons sont anesthésiés pour la mesure de la longueur à la fourche (mm), du poids corporel total (g) et pour l’observation des caractères sexuels secondaires. Les poissons sont ensuite euthanasiés par rupture de la colonne vertébrale aux fins de la mesure du poids des gonades, du foie et de la carcasse éviscérée. Il convient d’échantillonner tous les bassins le même jour, et de terminer l’échantillonnage de tous les poissons d’un même bassin, avant de passer au suivant.
Les mesures requises et leur niveau de précision doivent être conformes aux normes prescrites dans le chapitre 3. Les procédures relatives à la préparation des échantillons, aux analyses en laboratoire et à l’AQ/CQ sont les mêmes, pour les études en mésocosmes et sur le terrain.
9.2.6.3 Évaluation et interprétation des données
9.2.6.3.1 Exigences générales
Lors des études en mésocosmes, il doit y avoir évaluation et interprétation des données après chaque étape de suivi ou d’évaluation, comme cela se fait pour les études sur le terrain. L’étape d’évaluation et d’interprétation des données vise à répondre aux questions suivantes :
- y a-t-il un effet?
- l’effet est-il relié à la mine?
- connaît-on l’ampleur et l’étendue de l’effet?
- connaît-on la cause de l’effet relié à la mine?
La section qui suit présente un aperçu de la méthode proposée pour l’analyse et l’interprétation des données pour les études en mésocosmes.
9.2.6.3.2 Analyse statistique des paramètres
Des analyses statistiques des variables biologiques, comme l’indiquent les tableaux 9-2 (pour le système sur remorque) et 9-3 (pour le système modulaire avec le Méné à grosse tête), sont effectuées afin de déterminer s’il y a ou non un effet sur les poissons exposés aux effluents dans le système de mésocosmes. Le tableau 9-3 présente les méthodes d’analyse typiques utilisées dans le cadre de deux types de plans expérimentaux : l’ANOVA à un facteur (c.-à-d. l’effet de l’effluent) ou l’ANOVA à deux facteurs (c.-à-d. l’effet de l’effluent et des sédiments contaminés).
Il est fréquent que des différences entre les sexes du taux de croissance, du poids corporel, du coefficient de condition, de la taille des gonades et de la taille du foie soient observées, car les besoins énergétiques globaux des mâles et des femelles diffèrent. Il faut donc évaluer les deux sexes séparément pour estimer la variabilité de chaque paramètre. De même, les poissons immatures ou juvéniles devraient eux aussi être analysés séparément. Les analyses indiquées aux tableaux 9-2 et 9-3 sont préférables, bien que d’autres analyses portant sur des paramètres précis peuvent aussi être réalisées, selon la variabilité de l’ensemble de données. À titre d’exemple, les sujets utilisés pour l’ensemencement des bassins, dans les études en mésocosmes, sont de taille similaire. Par conséquent, la variabilité des paramètres mesurés est moindre que lors des études sur le terrain. Ainsi, l’étendue des valeurs sur laquelle porte la régression comme l’analyse de covariance est suffisamment étroite pour justifier le recours à une analyse de variance sur les valeurs originales du poids des organes (taille du foie et des gonades) et les mesures de rapport (IHS ou IGS) ou des coefficients de condition.
Nous présentons ci-dessous des détails sur l’analyse statistique des données des mésocosmes. Pour en savoir plus, consulter les documents cités dans le tableau 9-1.
9.2.6.3.3 Analyses de variance hiérarchiques
Pour toute variable mesurée une seule fois sur l’ensemble d’un système de bassins répétés, l’analyse statistique consiste en un simple test t qui compare les traitements (exposition/témoin). Les mésocosmes ou bassins sont les unités de répétition des traitements. Cependant, tous les paramètres biologiques et biochimiques sont mesurés sur des échantillons répétés à un niveau inférieur, c’est-à-dire sur des poissons individuels ou des groupes composés de plusieurs poissons à l’intérieur des bassins. Ces variables peuvent être analysées par l’analyse de variance hiérarchique. Si la variance entre les circuits répétés d’un même traitement (erreur de type I) est élevée par rapport à la variance entre des échantillons uniques ou composites à l’intérieur d’un même bassin (erreur de type II), l’analyse de variance hiérarchique consiste en fait en un test t qui compare les traitements, les moyennes des bassins servant d’observations répétées. Cependant, si l’erreur I est faible par rapport à l’erreur II (p. ex., p > 0,25), alors les deux termes d’erreur peuvent être regroupés pour accroître la puissance du test de comparaison des traitements (en d’autres mots, le poisson individuel ou l’échantillon composite devient maintenant l’unité de répétition, au lieu du bassin).
9.2.6.3.4 Analyses de covariance
La plupart des paramètres sont habituellement analysés à l’aide de l’analyse de covariance, comme le décrit le chapitre 8. Cette méthode est souvent inutile dans les études en mésocosmes, comme il est mentionné précédemment, à moins qu’une disponibilité restreinte de poissons n’empêche la standardisation de la taille et de l’âge.
9.2.6.3.5 Assurance et contrôle de la qualité et analyse des données
On n’insistera jamais assez sur l’importance d’assurer la qualité des données. Il y a certains éléments fondamentaux à respecter relativement au plan d’étude, à la cohérence des méthodes et des mesures, ainsi qu’à la définition des protocoles et des marches à suivre, et ces exigences sont définies en détail dans le chapitre 8.
9.2.7 Évaluation des effets sur la communauté d’invertébrés benthiques
9.2.7.1 Plan d’étude
9.2.7.1.1 Choix des espèces
La communauté benthique constituée pour l’étude en mésocosmes doit être représentative de celle que l’on retrouve dans les zones de référence sur le terrain. Des échantillons de benthos sont prélevés dans la rivière, puis l’ensemble de la communauté est ensemencée dans chacun des bassins du système de mésocosmes. Après avoir comparé la structure de la communauté d’invertébrés benthiques dans les mésocosmes et les zones de référence, Culp et al., (1996, 2001), Podemski (1999) et Culp et al., (2000a) n’ont observé aucune différence écologiquement significative entre les deux structures, ce qui témoigne de l’efficacité de la technique d’ensemencement et de l’utilité du système de mésocosmes pour évaluer les effets d’un effluent sur des communautés d’invertébrés benthiques écologiquement pertinentes.
9.2.7.1.2 Critères d’effets
Tous les critères d’effets (densité totale des invertébrés benthiques, richesse des taxons, indice de régularité de Simpson, indice de similarité [Bray-Curtis]) servant à mesurer les effets d’un effluent sur les invertébrés benthiques dans le cadre des ESEE sur le terrain peuvent aussi être mesurés dans un système de mésocosmes. La diversité, la densité, la proportion ou la présence/absence des taxons sont recommandées pour appuyer l’interprétation des résultats. Ces critères d’effets sont des mesures sommaires choisies pour englober l’éventail des réactions susceptibles d’être causées par l’effluent, y compris des changements de la productivité, la composition des espèces et la biodiversité. La documentation fait état d’un grand nombre d’autres paramètres descriptifs des invertébrés benthiques (pour un examen, voir Resh et McElravy, 1993) qui peuvent être utilisés, s’il y a lieu, dans des conditions particulières au site pour faciliter l’interprétation des effets déterminés à l’aide des critères d’effets précités.
9.2.7.1.3 Période et durée de l’exposition aux effluents
Les études en mésocosmes sur les invertébrés benthiques peuvent être réalisées à n’importe quel moment, entre le début du printemps et la fin de l’automne. La température de l’air est le principal facteur limitant, l’utilisation des mésocosmes étant impossible à une température inférieure à –5 °C à cause du gel des conduites d’eau. Les études devraient toutefois être réalisées à des périodes où l’exposition aux effluents est maximale, afin de reproduire les conditions environnementales les plus réalistes qui soient. De plus, les études devraient être menées à une période de l’année où la diversité des invertébrés benthiques est maximale et où la température de l’eau est propice à leur croissance. S’il existe des données historiques, il serait utile de les examiner et, s’il y a lieu, de réaliser l’étude à une période similaire, afin de pouvoir établir des comparaisons. De même, les études de suivi subséquentes devraient être réalisées à des périodes similaires de l’année, là encore pour assurer la comparabilité des données.
La durée des études en mésocosmes sur les invertébrés benthiques est en général de 30 à 45 jours, ce qui comprend une période d’ensemencement de 7 à 12 jours pour les producteurs primaires et une période d’exposition de 25 à 30 jours aux effluents. Les effluents sont prélevés chaque jour ou tous les deux jours durant les études et doivent être représentatifs des conditions normales d’exploitation de l’usine.
9.2.7.2 Protocole relatif aux invertébrés benthiques
9.2.7.2.1 Système de mésocosmes sur remorque – Installation générale
Les exigences générales précisées aux sections 9.2.3.2 et 9.2.3.3 s’appliquent également aux études sur les invertébrés benthiques. Le débit total recommandé pour l’eau de référence ou l’eau de dilution et l’effluent dans chaque système de bassins artificiels est de 2 L/min. Avec un tel débit, le temps de renouvellement est de deux heures dans chaque bassin (volume du système : 227 L). Un temps de renouvellement de quatre heures a aussi été utilisé pour réduire la quantité d’effluent requis, mais il s’agit du maximum. En effet, il n’est pas recommandé d’avoir un temps de renouvellement plus long à cause des effets qui en résultent sur la température et le taux d’oxygène dissous dans les bassins. Pour les applications sur les invertébrés, la vitesse du courant dans chaque bassin peut être maintenue à l’aide d’un système à hélices entraîné par courroie. Le courant dans chaque bassin est fixé en fonction des conditions propres au site, mais il varie habituellement entre 10 et 20 cm/s.
Avant d’ajouter le substrat, cinq sacs d’échantillonnage (0,1 m2, maille de 500 mm) sont déposés dans le fond de chaque bassin. Ces sacs sont retirés à la fin de l’expérience, ce qui donne cinq sous-échantillons par bassin. Un milieu benthique standard est reproduit à l’intérieur de chaque bassin pour simuler l’habitat dominant dans l’environnement. Jusqu’à maintenant, les études en mésocosmes sur les invertébrés benthiques ont porté principalement sur des habitats fluviaux dominés par des rapides. Le fond de chaque bassin et les sacs d’échantillonnage sont recouverts d’une couche de 8 cm de gravier lavé (pierres d’un diamètre de 1 à 2 cm). Une période de colonisation de 7 à 12 jours est ensuite allouée pour favoriser une croissance algale et microbienne suffisante sur le gravier. Seul un apport en eau est assuré dans les mésocosmes (2 L/min) durant cette période de colonisation. Elle varie en fonction des conditions propres au milieu et elle dépend de la température et de la colonisation des algues de la rivière dans le système.
À l’issue de la période de colonisation, les communautés benthiques sont transférées dans les mésocosmes, ce protocole étant lui aussi propre au site. Nous présentons ci-après un exemple d’un protocole d’ensemencement pour un habitat caractérisé par des rapides sur substrat composé essentiellement de grosses pierres et de gravier (Podemski, 1999; Podemski et Culp, 1996; Culp et Cash, 1995; Culp et al., 1996) (tableau 9-1) :
- De grosses pierres (superficie ~ 535 cm2) sont choisies au hasard dans la zone de référence de la rivière et sont déposées dans les mésocosmes avec le périphyton et les invertébrés qui s’y trouvent. Ces roches ajoutent au substrat et favorisent l’ensemencement des bassins par une communauté naturelle de périphyton et d’invertébrés benthiques.
- Lors du prélèvement, les pierres sont entourées d’un filet en U de 0,1 m2 (maille de 500 mm) (Scrimgeour et al., 1993), puis soulevées avec soin du lit de la rivière et déposées dans un seau contenant de l’eau de la rivière. Le substrat de gravier sous les roches est ensuite remué doucement (jusqu’à une profondeur de 5 cm) pour recueillir tout invertébré qui serait présent sous et autour de la base des roches. Le seau est ensuite transporté avec soin jusqu’au système de mésocosmes, en évitant de déloger le périphyton et les invertébrés présents sur les roches. Par la suite, les pierres sont réparties au hasard entre les bassins et sont placées de manière à ce que leur orientation par rapport à l’écoulement de l’eau rappelle leur orientation dans le milieu naturel. Ce processus se poursuit jusqu’à ce que l’on obtienne la densité voulue de pierres (p. ex., 10 grosses pierres par bassin artificiel), d’après la composition du substrat en milieu naturel. D’autres appareils d’échantillonnage peuvent aussi être utilisés pour ensemencer les bassins avec les communautés benthiques (voir le chapitre 4). Toutefois, l’objectif visé est de reproduire la densité du milieu ambiant dans les mésocosmes. Pour ce faire, il faut déterminer le nombre d’échantillons de la rivière devant être placés dans chaque bassin en divisant la superficie du système de mésocosmes (0,9 m2) par la superficie de l’échantillonneur choisi. Cette répartition aléatoire des sous-échantillons prélevés à partir d’échantillons regroupés permet de s’assurer que la composition des communautés d’invertébrés est similaire dans chaque bassin, et elle limite la variabilité de la composition entre les différents mésocosmes attribuable au mode d’introduction des espèces (Wrona et al., 1982).
- Une autre série d’échantillons benthiques (biote seulement) est prélevée dans la zone de référence et placée dans un contenant commun, pour estimer la composition et la densité initiales. Des sous-échantillons sont ensuite prélevés et ensemencés au hasard dans chaque bassin, jusqu’à ce que la densité des invertébrés dans les bassins se rapproche de la densité en milieu ambiant.
Il est important d’appliquer des protocoles d’ensemencement uniformisés, car la séquence utilisée pour répartir les échantillons prélevés d’une source commune entre les différents mésocosmes peut donner lieu à de grandes différences dans la structure de la communauté, différences qui ne sont aucunement liées aux traitements de l’étude (Drake et al., 1996). La communauté d’essai est constituée de multiples niveaux trophiques établis à partir d’échantillons aléatoires prélevés du cours d’eau à l’étude. Il est donc possible de mesurer des paramètres à l’échelle de la communauté, comme la composition des espèces, le rapport entre la production et la respiration de la communauté et la décomposition. Ces mesures reflètent les effets directs des facteurs de stress et, plus important encore, les effets écologiques indirects qui ne peuvent être simulés par un système à espèce unique ou à chaîne trophique simple (p. ex., changements dans la structure de la communauté dus à la compétition; bioamplification) (Carlisle, 2000).
Après l’ensemencement du biote, une période d’adaptation de 24 à 48 heures est prévue (apport d’eau seulement dans les mésocosmes) avant de commencer l’introduction de l’effluent dans les bassins de traitement.
9.2.7.2.2 Système modulaire de mésocosmes – Installation générale
Le système modulaire décrit plus haut pour les poissons sert également souvent pour les invertébrés benthiques. Il est constitué de tables humides (une par traitement) sur lesquelles sont placés les bassins à circulation partielle et sous lesquelles sont installés les réservoirs de l’eau de traitement pompée dans les bassins. L’eau de rivière, quant à elle, est pompée dans un réservoir de tête, puis pompée dans chacun des réservoirs de tables humides (Culp et al., 2004). L’eau et l’effluent sont pompés dans un collecteur qui en assure la distribution dans les systèmes de bassins artificiels. Les effluents traités sont livrés au système de mésocosmes tous les jours, ou tous les deux à trois jours par camion. Le temps de séjour de l’eau dans chaque réservoir de table s’établit d’ordinaire à une heure pour les études avec invertébrés benthiques; l’eau séjourne environ quatre à cinq minutes dans les bassins. Ce temps de séjour peut varier en fonction de la disponibilité de l’effluent et de l’eau de référence. La vitesse de circulation de l’eau dans les bassins du système modulaire peut être réglée à l’aide de roues à aubes qui génèrent un courant de 11-12 cm/s typique de l’interface substrat-eau dans les rivières. Des cages d’émergence d’insectes sont installées dans chaque bassin, et les tables humides sont abritées sous une toile qui réduit l’intensité lumineuse d’environ 60 % pour mieux simuler l’intensité de lumière que reçoit le substrat dans le cours d’eau.
Les systèmes de bassins artificiels sont conçus pour simuler les communautés d’eau courante typiques des zones de référence. Les réseaux trophiques benthiques sont établis dans tous les traitements et toutes les répétitions en ajoutant dans chaque bassin du substrat prélevé dans une zone de référence non exposée aux effluents. Le substrat est manipulé avec soin de manière à ne pas perturber les microorganismes et les algues qu’il contient. Cette technique permet ainsi d’obtenir dans chaque bassin une croissance algale suffisante pour permettre l’ensemencement des invertébrés en moins de sept jours. Des communautés d’invertébrés benthiques semblables sont établies dans tous les mésocosmes par ensemencement de chaque bassin avec des biotes provenant de la zone de référence située en amont. La superficie échantillonnée permet d’établir dans les mésocosmes des densités initiales d’invertébrés correspondant à environ 1,2 à 1,4 fois les densités naturelles, afin de compenser pour une possible mortalité initiale due à la manipulation. Il faut laisser les communautés d’invertébrés s’acclimater aux conditions expérimentales pendant 24 heures avant d’injecter l’effluent.
9.2.7.2.3 Entretien et surveillance
Système de mésocosmes sur remorque : L’entretien et la surveillance se font conformément au protocole défini pour le poisson à la section 9.2.6.2.3.
Système de mésocosmes modulaire : L’entretien quotidien du système comprend l’étalonnage régulier de toutes les pompes et systèmes d’approvisionnement afin d’assurer un réglage adéquat du débit et du courant. Il convient également de nettoyer fréquemment les grilles des drains et d’éliminer les algues qui poussent sur les parois des bassins pour éviter l’encrassement.
Chaque semaine, des échantillons d’effluent, d’eau de référence et d’eau de traitement sont prélevés aux fins des dosages des substances chimiques, des nutriants et des métaux. Les insectes adultes sont recueillis chaque jour dans les cages d’émergence à l’aide d’un aspirateur et conservés dans une solution d’éthanol à 80 % en prévision d’une identification ultérieure à la famille.
9.2.7.3 Échantillonnage et analyse des invertébrés benthiques
Pour le prélèvement des invertébrés benthiques, les bassins sont également échantillonnés de façon aléatoire pour réduire au minimum les différences dues à la période d’échantillonnage entre les différents bassins répétés d’un même traitement.
Système de mésocosmes sur remorque : Le prélèvement des échantillons d’invertébrés se fait en soulevant les sacs d’échantillonnage déposés au fond de chaque bassin, ce qui résulte en cinq sous-échantillons par bassin. Les sous-échantillons sont ensuite lavés dans un tamis à maille de 500 mm. Le tamisage sur le terrain doit se faire immédiatement après le prélèvement de l’échantillon et avant sa conservation. La taille recommandée du tamis ou des mailles pour toutes les applications du système de mésocosmes en eau douce est de 500 mm. En eau douce, les macroinvertébrés se définissent comme ceux retenus par des mailles de 200 à 500 µm (Slack et al., 1973; Weber, 1973; Wiederholm, 1980; Suess, 1982), bien que les organismes immatures de certains taxons puissent être plus petits et que certains puissent être plus gros au stade adulte. À noter que ce maillage s’applique à l’ensemble du matériel utilisé sur le terrain et en laboratoire (c.-à-d. filet de Nitex des échantillonneurs et série de tamis). Dans certaines circonstances propres au milieu, il peut être souhaitable d’utiliser un tamis de plus petit calibre pour recueillir des organismes plus petits. Voici quelques cas où l’utilisation d’un maillage plus petit (moins de 500 mm) pourrait être indiquée :
- pour établir des comparaisons, si des tamis de maillage plus petit ont été utilisés dans le cadre d’études antérieures sur les invertébrés benthiques du système à l’étude;
- si, pour des raisons d’ordre pratique, l’échantillonnage doit être fait à une période de l’année où les organismes sont très petits. Rees (1984) et Barber et Kevern (1974) fournissent plus de précisions sur les variations saisonnières de l’efficacité du tamisage.
Dans les cas précités, il est fortement recommandé d’utiliser une série de tamis superposés dont le maillage satisfait tout au moins au calibre obligatoire et d’utiliser tout autre maillage plus petit, s’il y a lieu. De cette façon, on tient compte non seulement des enjeux particuliers au milieu, mais aussi des objectifs du Programme d’ESEE, car l’utilisation de tamis de maillage normalisé permet d’effectuer des comparaisons nationales ou régionales.
Système modulaire de mésocosmes : Les invertébrés benthiques sont récupérés à la fin de l’expérience par rinçage du contenu entier de chaque bassin dans un tamis à mailles de 250 mm, et les échantillons sont conservés dans une solution de formol à 10 %. Au laboratoire, les invertébrés benthiques sont triés sous grossissement 12X, identifiés à la famille et comptés.
Toutes les statistiques sommaires et mesures descriptives doivent être calculées et présentées au niveau de la famille, en vue de la production des rapports d’interprétation exigés aux fins du Programme d’ESEE (voir section 4.6.2 du chapitre 4). Les organismes qui ne peuvent être identifiés au niveau taxonomique voulu sont classés dans une catégorie distincte, dans l’ensemble de données de base. Il est recommandé que les chercheurs utilisent les clés taxonomiques qui conviennent à la région géographique à l’étude; une liste détaillée des références taxonomiques pour les divers groupes d’organismes dulcicoles est présentée au chapitre 4.
9.2.7.4 Évaluation et interprétation des données
L’étude en mésocosmes utilisée comme méthode de suivi de rechange pour l’évaluation des effets d’un effluent sur la communauté d’invertébrés benthiques suit essentiellement le protocole défini dans le chapitre 8 pour l’évaluation et l’interprétation des données obtenues lors des études sur le terrain, puisque les critères d’effets sont les mêmes. La seule différence au niveau de l’évaluation des données a trait au nombre de répétitions par traitement : pour les études en mésocosmes, n = 8 selon le protocole contrôle-impact, alors que n = 5 pour les études sur le terrain.
Durant l’évaluation des effets, toute différence significative entre la zone de référence et la zone d’exposition, en regard de l’un ou l’autre des critères d’effets suivants, doit être interprétée comme un effet sur la communauté d’invertébrés benthiques : densité totale des invertébrés benthiques, richesse des taxons, indice de régularité et indice de similarité (REMM, Annexe 5, article 1).
La diversité, la densité, la proportion ou la présence ou l’absence des taxons sont recommandées pour appuyer l’interprétation des résultats. Le calcul de ces paramètres est décrit en détail dans le chapitre 4 portant sur l’étude des communautés d’invertébrés benthiques. Les analyses statistiques, les méthodes d’AQ/CQ des données et les exigences en matière de production de rapports sont les mêmes que pour les études sur le terrain, l’hypothèse étant qu’un traitement en mésocosmes équivaut à une zone exposée, tandis que chaque bassin artificiel répété correspond à une station répétée sur le terrain.
9.2.8 Mesures complémentaires
9.2.8.1 Paramètres physicochimiques de l’eau
Dans les études en mésocosmes, il est essentiel de réduire au minimum les différences de paramètres physiques et chimiques de l’eau entre les bassins, afin que les effets attribués à l’effluent ne soient pas dus à des facteurs de confusion. La température, le taux d’oxygène dissous, le pH et le débit d’entrée de l’eau et de l’effluent sont donc vérifiés tous les jours. Il faut aussi mesurer la vitesse du courant au début et à la fin de chaque étude, en particulier dans les études sur les invertébrés benthiques. La distribution de la vitesse du courant entre les bassins est caractérisée en utilisant une des nombreuses marques de courantomètres. Lors d’études précédentes, la vitesse moyenne dans les mésocosmes (au-dessus du substrat rocailleux) (x = 0,26 ± 0,01 m/s, n = 150) a été réglée de manière à être similaire à la vitesse du courant mesurée au-dessus des pierres, à une profondeur similaire sur le terrain (vitesse du courant : x = 0,26 ± 0,01 m/s; profondeur de l’eau : x = 24,8 ± 0,72 cm, n = 30) durant la période pendant laquelle l’étude a été effectuée (Podemski, 1999).
La température de l’eau peut être mesurée avec un enregistreur de données en continu. Pour ce faire, on place des enregistreurs dans un bassin et dans le réservoir de tête, la température dans le réservoir de tête correspondant à la température de l’eau puisée de la rivière. Selon les données recueillies à l’aide de thermographes placés à ces deux endroits lors d’études précédentes, un temps de séjour de deux heures dans les bassins provoque un léger refroidissement ou réchauffement de l’eau, selon les températures de l’air ambiant (Culp et Podemski, 1996). Par exemple, sur une période de trois jours, l’eau dans les bassins était plus froide la nuit et plus chaude le jour que l’eau de la rivière, l’écart maximal instantané entre la température de l’eau dans la rivière et les bassins étant < 5 °C.
9.2.8.2 Paramètres complémentaires de la qualité de l’eau
En plus d’évaluer les variations quotidiennes des paramètres physiques et chimiques de l’eau entre tous les bassins, il faut prélever d’autres échantillons d’eau – bien qu’à une fréquence moindre – pour l’analyse des paramètres chimiques généraux. Il est recommandé de prélever des échantillons du réservoir de tête qui contient l’eau de référence, de l’effluent non dilué et de chaque mésocosme, une fois à la fin de l’étude. Les échantillons devraient être analysés pour les paramètres définis dans le chapitre 5. Cette information s’avère souvent d’une valeur inestimable pour confirmer la dilution de l’effluent dans les systèmes de traitement. Par exemple, dans des systèmes d’eau douce exposés à des effluents de fabriques de pâtes et papiers, le sodium est un ion relativement persistant qui est présent en fortes concentrations. En comparant les concentrations de Na+ dans les bassins de référence et les bassins d’exposition, il est possible de vérifier la concentration de l’effluent dans les systèmes de bassins artificiels.
9.3 Utilisation de bivalves en cage comme méthode de suivi de rechange
9.3.1 Introduction
La présente section décrit les méthodes utilisées au cours des études de bivalves en cage et fournit des renseignements détaillés sur les éléments suivants :
- contexte et approche générale des études de bivalves en cage;
- choix de l’espèce;
- plan d’étude;
- variables à mesurer;
- méthodes de mise en œuvre de l’étude;
- analyses des données;
- concentrations dans les tissus;
- exigences en matière de rapports.
9.3.2 Contexte
En octobre 2000, le Comité scientifique national des études de suivi des effets sur l’environnement (ESEE) a recommandé le recours à des études de bivalves en cage comme méthode de suivi biologique de rechange scientifiquement valable, lorsqu’il n’est ni pratique ni techniquement possible de mener des études de poissons sur le terrain. Le Sous-groupe sur les poissons pour le secteur des mines de métaux a également recommandé l’utilisation de bivalves en cage comme méthode de remplacement durant le processus de consultation multilatérale sur les ESEE des mines de métaux. Pour en savoir plus, voir Courtenay et al. (1998), Andrews et Parker (1999) et Applied Biomonitoring (2000).
En novembre 2000, l’American Society for Testing and Materials (ASTM) a approuvé une méthode pour la conduite d’études environnementales utilisant des bivalves en cage (Salazar et Salazar, 2000). Le présent guide repose sur cette méthode. D’autres études utilisant des bivalves sauvages et en cage ont également été prises en considération au moment d’élaborer ce guide, qui vise à appliquer cette approche dans le cadre du Programme d’ESEE. Le format du guide suit celui qui est utilisé pour les études de poissons. Les bivalves, comme les huîtres et les moules, sont utilisés depuis le milieu des années 1970 dans le cadre de programmes de surveillance des moules, lesquels visent à suivre les tendances de la contamination chimique et à évaluer les effets des activités humaines sur les zones côtières et estuariennes. Ces programmes ont vu le jour aux États-Unis (Goldberg et al., 1978) et ont depuis acquis une portée internationale (Jernelov, 1996). Voici certaines des raisons pour lesquelles les bivalves constituent des espèces d’essai propices :
- ils sont relativement immobiles, de sorte que l’exposition aux contaminants est assurée et représentative de la zone d’exposition;
- ils sont abondants dans bon nombre de milieux marins, estuariens et dulcicoles, et il est relativement facile de les manipuler et de les échantillonner tout au long de l’année;
- la biologie de bon nombre de mollusques et de crustacés est bien connue, et un nombre considérable de recherches ont été menées sur les effets de l’exposition à différents facteurs d’agression environnementale anthropiques et naturels sur ces organismes;
- on a montré que plusieurs espèces de bivalves accumulent facilement bon nombre de produits chimiques par différentes voies (eau, sédiments, nourriture) et présentent des effets sublétaux associés à l’exposition;
- la croissance des bivalves est relativement facile à mesurer et s’est révélée aussi sensible, sinon plus, que la mortalité chez des espèces d’essai standards comme Daphnia, le Méné à grosse tête et la Truite arc-en-ciel (voir Salazar et Salazar, 2000);
- les bivalves sont une ressource halieutique importante, et les régions de l’Atlantique et du Pacifique soutiennent toutes deux une industrie conchylicole qui présente un intérêt commercial; on y pratique aussi la récolte de mollusques et de crustacés à des fins commerciales et récréatives.
9.3.3 Approche
L’approche des bivalves en cage offre un certain nombre d’avantages au chercheur qui mène une étude de suivi, notamment le contrôle et le réalisme expérimentaux, l’utilisation d’organismes naturellement présents dans le milieu d’étude et la connaissance de la période d’exposition (Crane et al., 2007). En utilisant des bivalves en cage plutôt que des populations résidantes, il est possible de réduire la variabilité des mesures biologiques en choisissant des individus de taille similaire qui possèdent la même histoire environnementale, ce qui augmente le pouvoir discriminant du test (Crane et al., 2007; Salazar et Salazar, 1995). Un nombre considérable d’études utilisant des bivalves en cage ont été menées au Canada, aux États-Unis et dans d’autres pays (voir Salazar, dans Stewart et Malley, 1997; St-Jean et al., 2003, 2005; Crane et al., 2007).
Les indicateurs d’effets d’ESEE utilisant des bivalves en cage sont la survie, la croissance, la condition, la reproduction et le stockage d’énergie. Une analyse des tissus (teneurs en mercure) peut être nécessaire, et des bivalves en cage peuvent être utilisés à cette fin. Il est également possible d’évaluer la bioaccumulation d’autres produits chimiques ou métaux pour faciliter l’interprétation des résultats ou pour la recherche de causes.
Une des difficultés posées par les essais d’exposition des bivalves en cage réalisés aux fins du Programme d’ESEE tient aux problèmes de comparaison des réponses obtenues avec celles des études de poissons adultes. La difficulté réside dans les hypothèses suivantes :
- Les bivalves utilisés pour les études de bivalves en cage proviennent de milieux sains ou de sites de référence, tandis que les poissons utilisés dans les études de poissons adultes sont en général des résidants de longue date, ce qui fait qu’il ne faut pas s’attendre qu’ils réagissent de la même façon.
- Dans la plupart des sites au Canada, le cycle reproducteur des moules (Moules bleues [Mytilus edulis]) dure au minimum neuf mois, tandis que les gamètes produits au printemps sont dérivés d’une énergie (principalement le glycogène) accumulée au cours de l’automne. Il sera donc difficile de mettre en lumière les effets de l’effluent sur l’effort de reproduction à l’aide d’un essai d’exposition de 60 ou 90 jours effectué au printemps.
- Chez les bivalves, le stockage de l’énergie et la reproduction sont assurés par le même organe. En automne, le manteau (figure 9-10) est principalement composé de glycogène (énergie) qui servira à assurer le développement des œufs au printemps. La figure 9-11 montre le rapport qui existe entre l’énergie stockée et le développement des œufs dans une population de Moules bleues de Colombie-Britannique.

Figure 9-10 : Moule avec lobe du manteau à maturité.
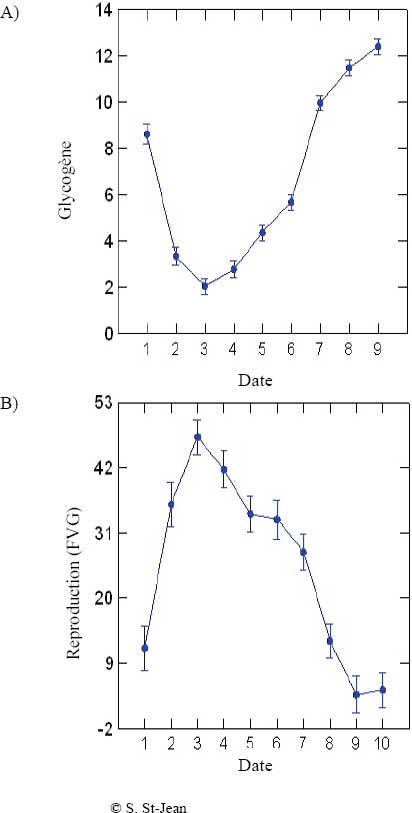
Figure 9-11 : Cycle reproducteur de la Moule bleue de Colombie-Britannique : A) stockage de l’énergie dans le manteau en automne; B) teneur en matériel de reproduction au printemps.
Notes : Les chiffres en abscisse représentent les mois de l’année de février (1) à novembre (10); A) teneur en glycogène exprimée en mg/g; B) reproduction exprimée en fractions volumétriques de gamètes (FVG).
Par conséquent, pour maximiser les résultats de l’étude de bivalves en cage ainsi que leur comparabilité avec les résultats de l’étude des poissons adultes et pour faciliter l’interprétation des résultats de reproduction et d’énergie, il convient d’exposer les bivalves adultes à partir du début de la période d’accumulation d’énergie, en automne, jusqu’à la libération des gamètes au printemps.
9.3.4 Choix de l’espèce
Bon nombre d’espèces de bivalves ont été utilisées pour évaluer la biodisponibilité ou les effets de produits chimiques dans des milieux marins, estuariens et dulcicoles. Idéalement, une espèce qui présente une distribution géographique étendue devrait être utilisée, afin de comparer les résultats des essais entre les études. Il convient ainsi de choisir soigneusement l’espèce à utiliser dans les études de bivalves en cage et de tenir compte de sa biologie et des conditions locales :
- Les zones d’exposition et de référence présentent-elles des conditions similaires à celles de l’habitat naturel de l’espèce en ce qui concerne les limites de tolérance pour des facteurs naturels tels que la température, la salinité, la teneur en oxygène dissous et le pH? L’espèce est-elle naturellement présente dans la zone d’étude?
- Existe-t-il de la documentation indiquant que l’espèce peut accumuler le contaminant en question ou être sensible à celui-ci?
- Le cycle vital de l’espèce est-il bien connu en ce qui a trait à son cycle de reproduction et ses besoins aux différents stades?
- L’espèce est-elle menacée ou en voie de disparition?
- Dispose-t-on de stocks abondants facilement accessibles?
- L’espèce est-elle facile à manipuler sur le terrain?
Dans le cas de chaque bivalve individuel, il faut prendre soin de vérifier :
- si la coquille est anormalement épaisse;
- si la coquille indique la présence de vers (souvent révélée par des trous);
- si la coquille est fendillée;
- si le réflexe de fermeture des valves est lent.
9.3.4.1 Taxons utilisés le plus fréquemment
Les espèces utilisées le plus fréquemment dans les essais de toxicité sur le terrain en eaux canadiennes et considérées comme pertinentes pour les ESEE sont décrites ci-dessous et présentées dans le tableau 9-4. En outre, le tableau indique les limites de tolérance de chaque espèce à la température et à la salinité et fournit des données sur l’âge à la maturité, les périodes de fraie et la répartition générale au Canada. D’autres espèces, telles que les myes (Mya arenaria, Macoma balthica) et les pétoncles peuvent également être utilisées pour certaines applications. Il faut toutefois établir les conditions environnementales nécessaires et la sensibilité de ces autres espèces d’essai avant de les utiliser dans les ESEE. En ce qui concerne les besoins particuliers des diverses espèces, Salazar et Salazar (2000) décrivent les besoins en matière de salinité et de température ainsi que la répartition de plusieurs espèces de bivalves du Canada.
| Espèces et références | Plage de températures (°C) | Plage de salinité (parties par millier) | Données sur la reproduction | Répartition générale au Canada |
|---|---|---|---|---|
| Bivalves marins et estuariens | ||||
| Mytilus edulis (Moule bleue) (Freeman et al., 1994; Grout et Levings, 2000; Mucklow, 1996; Stewart, 1994; Salazar et Salazar, 2000; Newell, 1989; Toro et al., 2002). | –1,5 à 25 | 5 à 33 | La plus grande partie de l’énergie est utilisée pour la fraie à une longueur supérieure à 3,5 cm, environ entre 2,5 et 4 ans. Généralement, une fraie brusquesur la côte Est : pas plus de trois semaines, entre le milieu de juin et le milieu de juillet, mais la fraie peut varier d’une population à l’autre. Elle peut être faible pendant toute l’année, surtout dans les zones d’influence anthropique ou dans le cas de reproducteurs à fraies répétées; la première a lieu au début de l’été, et la deuxième, à l’automne, surtout sur la côte Ouest. | Côte de l’Atlantique |
| Mytilus trossulus (Moule bleue du Pacifique ou foolish mussel) (Freeman et al., 1994; Salazar et Salazar, 2000; Skidmore et Chew, 1985; Toro et al., 2002). | 0 à 29 | 4 à 33 | La plus grande partie de l’énergie est utilisée pour la fraie à une longueur supérieure à 3,5 cm. La fraie dure généralement de12 à 13 semaines, de juin à septembre. | Côtes de l’Atlantique et du Pacifique |
| Crassostrea gigas (Huître creuse du Pacifique) (Virginia Tech, 2000; Waldock et al., 1996). | 4 à 24 | 25 à 35 | Fraie de juillet à août. | Côte du Pacifique |
| Bivalves dulcicoles | ||||
| Elliptio complanata (Elliptio maigre de l’Est) (Beckvar et al., 2000; Day et al., 1990; Hinch et al., 1989; McMahon, 1991; Metaclfe-Smith et al., 1996). | 0 à 30 | 0 à 3 | Maturité entre 6 et 12 ans. Fraie essentiellement en juin et juillet; parfois de mai à septembre. | Est du Canada |
| Pyganodon (Anodonta) grandis (Anodonte commune) (Clarke, 1973; Couillard et al., 1995a, 1995b; Malley et al., 1996). | 0 à 30 | 0 à 3 | Fraie essentiellement en avril et mai; parfois jusqu’en août. | Intérieur et Est du Canada |
| Anodonta kennerlyi (Anodonte de l’Ouest) (Clarke, 1981; Stewart et Malley, 1997; Williams et al., 1993). | 0 à 30 | Eau douce | Début de la fraie en août. | Alberta et Colombie-Britannique |
| Sphaeriidés (p. ex., Musculium securis, Sphaerium rhomboideum, S. striatinum) (Hornbach et al., 1982; Mackie, 1978a, 1978b; Mackie et Flippance, 1983; Mackie et al., 1974; Stephenson et Mackie, 1981). | 10 à 25 (plage optimale pour la croissance) | Eau douce | Cycle de vie généralement inférieur à un an; le cycle biologique de bon nombre d’espèces est bien documenté; l’effort de reproduction peut être quantifié. | Répartition étendue au Canada |
Source : Format modifié de Salazar et Salazar, 2000.
9.3.4.2 Bivalves marins et estuariens
L’Huitre creuse du Pacifique est une espèce d’huître qui a été utilisée dans des études de transplantation en milieux marins et estuariens (Waldock et al., 1996). Sa coquille est habituellement plus difficile à mesurer en raison de sa forme irrégulière et de ses protubérances.
Le genre Mytilus a beaucoup été utilisé dans le cadre de l’International Mussel Watch Project, qui vise à suivre les tendances de la contamination chimique et à évaluer les effets des activités humaines sur les zones côtières et estuariennes d’Amérique du Nord et d’ailleurs dans le monde (O’Connor, 1992; Jernelov, 1996). On trouve la Moule bleue (M. edulis) et la Moule bleue du Pacifique (M. trossulus) sur la côte Atlantique du Canada, mais cette dernièrese trouveen majoritésur la côte Ouest. Ces deux espèces peuvent facilement être confondues dans les zones de la côte Atlantique, étant donné qu’elles y coexistent (Freeman et al., 1994; Mucklow, 1996). Comme leur biologie et leur cycle reproducteur diffèrent, il est essentiel d’en faire une identification à l’espèce. Le groupe Mytilus spp., auquel on donne souvent le nom de « complexe M. edulis » afin de tenir compte des différences biochimiques (Varvio et al., 1988) peut comprendre les espèces M. edulis, M. galloprovincialis et M. trossulus. Plusieurs différences fondamentales ont été observées entre M. edulis et M. trossulus, y compris une incompatibilité des gamètes (Rawson et al., 2003), la séparation temporelle et la durée de la fraie chez les populations de l’Atlantique (Toro et al., 2002) ainsi que la production totale et la taille des œufs (Toro et al., 2002). À ce titre, M. trossulus pond des œufs plus petits, présente une période de fraie plus longue et produit moins de gamètes que M. edulis, qui en revanche affiche un taux de croissance plus rapide que M. trossulus sur la côte Est canadienne (Penny et al., 2002). Les travaux effectués sur les côtes du Pacifique et de l’Atlantique avec des bivalves en cage ont confirmé les différences du taux de croissance et du cycle reproducteur entre ces deux espèces : M. trossulus est plus sensible, plus petit, et ses œufs sont plus petits et moins nombreux (Metro Vancouver, données inédites). Le tableau 9-5 présente plusieurs des différences observées entre ces deux espèces au cours de cinq années d’analyses.
| Mytilus edulis | Mytilus trossulus |
|---|---|
| Croissance plus rapide | Croissance plus lente |
| Taux de survie plus élevé | Taux de survie plus faible |
| Œufs plus nombreux et plus gros | Œufs moins nombreux et moins gros |
| Reproduction durant 2 à 3 semaines | Reproduction durant 9 à 14 semaines |
| Séparation plus claire entre la production d’œufs et le stockage d’énergie | Séparation moins claire entre la production d’œufs et le stockage d’énergie |
| Moins sensible à la leucémie | Plus sensible à la leucémie |
| Globalement plus utile pour les essais | Globalement moins utile pour les essais |
| Pas toujours présent (côte Ouest) | Coexiste parfois avec M. edulis (côte Est) |
9.3.4.3 Bivalves dulcicoles
Les bivalves d’eau douce de la famille des unionidés ont été utilisés dans plusieurs études de bivalves en cage pour examiner l’exposition dans la colonne d’eau et dans les sédiments. Certains de ces bivalves (p. ex., Elliptio complanata, Anodonta kennerlyi et Pyganodon grandis [anciennement Anodonta grandis]) ou certains sphaeriidés peuvent être considérés utiles pour l’évaluation des différences dans la survie, la croissance, la condition et le taux de reproduction des bivalves dans les milieux récepteurs dulcicoles. Les chercheurs suivants ont examiné les cycles vitaux de ces espèces : Mackie (1978b), Sandusky et Sparks (1979), Stephenson et Mackie (1981), Stewart et Malley (1997). Les bivalves d’eau douce sont des bivalves appartenant à la superfamille des Unionoidea et font partie d’un des groupes d’organismes les plus menacés de disparition en Amérique du Nord (Wolfe et al., 2009). Les unionidés se distinguent par le fait que leurs glochidies (larves) ont besoin d’une période d’incubation dans un hôte vertébré pour survivre jusqu’au stade adulte. C’est ainsi que les glochidies parasites libérées dans l’eau par les bivalves adultes se fixent aux poissons qui leur servent d’hôte. Elles y demeurent jusqu’à la fin de leur métamorphose, dont la durée varie en fonction de la température de l’eau. En outre, les glochidies de genres différents sont libérées dans le milieu ambiant à des périodes différentes de l’année (Bauer, 1994). Les taxons du genre Pisidium (famille des sphaeriidés) peuvent s’avérer difficiles à manipuler en raison de leur petite taille et poser par surcroît des problèmes de taxonomie aux non-spécialistes. Par ailleurs, d’autres recherches pourraient être nécessaires pour démontrer l’utilité des bivalves de la famille des sphaeriidés pour l’ESEE. Contrairement aux bivalves marines, les bivalves dulcicoles possèdent des gonades distinctes et non fusionnées. En outre, ils présentent des cycles saisonniers distincts de la teneur biochimique des tissus qui sont principalement liés au cycle reproducteur. Comme chez les bivalves marins et estuariens, les concentrations de protéines, de glycogène et de lipides atteignent un sommet pendant le développement des gonades et la gamétogenèse et sont minimales à l’époque de la libération des glochidies. Comme chez les bivalves marins, c’est la teneur en glycogène qui présente la plus grande variabilité (Jadhav et Lomte, 1982). Le tableau 9-6 présente les différences entre les unionidés et les sphaeriidés.
| Unionidés | Sphaeriidés |
|---|---|
| Croissance rapide jusqu’à la maturité, puis plus lente | Croissance plus lente; ces bivalves peuvent être très petits |
| Durée de vie : < 6 à > 100 ans | Durée de vie : 1 à 4 ans |
| Fécondité : 200 000 à 17 000 000 œufs par femelle; petits œufs | 3 à 24 œufs par femelle; gros œufs |
| Reproduction : une fois l’an | Reproduction : 3 fois l’an, parfois en continu |
| Séparation plus claire entre la production d’œufs et le stockage d’énergie | Séparation moins claire entre la production d’œufs et le stockage d’énergie |
| Gonochoristique | Hermaphrodite |
| Maturité entre 6 et 12 ans | Maturité entre 0,2 et 1 an |
| Moins propices aux études : gonochoristiques, vivant longtemps, itéropares, souvent rares, difficiles à prélever, à cycle vital complexe (stade parasite) | Plus propices aux études : plus abondants, plus faciles à prélever, faciles à élever, à cycle vital relativement simple, à durée de vie plus courte |
9.3.4.4 Provenance des bivalves
Le choix d’utiliser des bivalves d’élevage ou des bivalves indigènes locaux constituera une question importante. Selon le paramètre mesuré, les deux sources présentent chacune des avantages et des inconvénients, et le choix devrait être fait en fonction des circonstances décrites ci-après.
Il convient d’obtenir les bivalves d’un fournisseur commercial lorsque le paramètre à mesurer est le taux de croissance ou l’accumulation de substances chimiques. S’il s’agit d’évaluer la reproduction ou le stockage de l’énergie, il faudrait choisir des bivalves indigènes en utilisant autant que possible un gradient naturel ou un plan contrôle-impact lorsque la période d’exposition est courte, ou des bivalves commerciaux lorsque la période d’exposition est plus longue. La croissance devrait être mesurée à l’aide de juvéniles obtenus d’un aquaculteur. Les bivalves obtenus dans une installation commerciale possèdent une histoire environnementale bien connue, et il y a de meilleures garanties d’absence de contaminants que dans le cas des spécimens sauvages. Toute étude devrait confirmer une forme quelconque d’identification des espèces, puisque les résultats peuvent varier largement d’une espèce à l’autre, comme le montre le tableau 9-6. Tous les sujets utilisés dans une étude de bivalves en cage pour la mesure d’un paramètre donné doivent provenir de la même population. Si les populations sauvages constituent la seule source d’approvisionnement possible, les spécimens doivent être prélevés dans une zone non contaminée. Il convient de retirer doucement à la main ou à l’aide d’une brosse à poils doux ou d’un racloir tous les organismes épiphytes des coquilles des bivalves. Pêches et Océans Canada exige la possession d’un permis pour la récolte de spécimens sur le terrain ou leur transplantation, et certains organismes locaux ou provinciaux pourraient avoir la même exigence. De plus, si les cages risquent de faire obstacle à la navigation, il pourrait être nécessaire d’obtenir un permis de la Garde côtière canadienne et de publier un avis aux navigateurs. Le processus d’obtention de permis doit être considéré dès les premières étapes de la planification de l’étude. Le traitement des demandes peut prendre de plusieurs semaines à quelques mois, et il pourrait également devenir nécessaire de faire une évaluation environnementale, comme l’exige l’Agence canadienne d’évaluation environnementale.
9.3.4.5 Identification des espèces
Deux méthodes sont envisageables pour l’identification des bivalves : l’analyse d’alloenzymes et la morphométrie combinée à l’analyse statistique (McDonald et al., 1991; Mallet et Carver, 1995). Aux fins des mesures morphométriques, des coquilles vides sont nettoyées et laissées à sécher pendant quatre à cinq heures (60 °C). Les mesures doivent porter au minimum sur cinq caractéristiques (présentées ci-dessous) et devraient être réalisées à l’aide d’un stéréomicroscope (6,4 X) :
- longueur de l’impression du muscle adducteur antérieur;
- longueur de la charnière;
- distance entre le bord antérieur de l’impression du muscle adducteur postérieur et le bord de la coquille;
- distance entre le bord ventral de l’impression du muscle adducteur postérieur et le bord ventral de la coquille;
- distance entre la ligne palléale et le bord ventral de la coquille, à mi-distance de la longueur de la coquille (figure 9-12).
Trois dimensions supplémentaires devraient également être mesurées à l’aide d’un pied à coulisse :
- longueur de la coquille;
- largeur de la coquille;
- hauteur de la coquille.
Chaque caractéristique devrait être normalisée par conversion log10 et divisée par le log10 de la longueur de la coquille. Ces variables morphométriques (log-transformées et normalisées en fonction de la longueur, le cas échéant) doivent ensuite être multipliées par leurs coefficients canoniques bruts et additionnées pour produire, pour chaque individu, une variable canonique (Mallet et Carver, 1995). M. edulis présente d’ordinaire une impression du muscle adducteur antérieur plus longue, une charnière plus longue et une coquille plus haute que M. trossulus,ce qui conduit à des valeurs positives des coefficients canoniques normalisés.
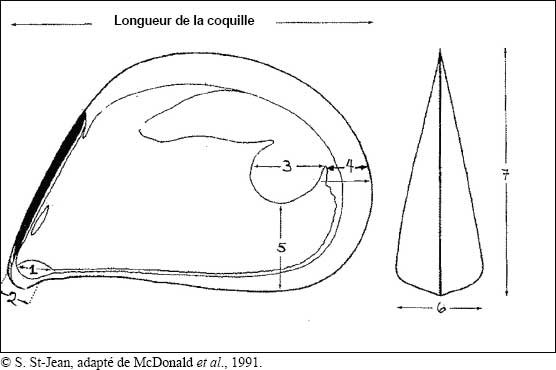
Figure 9-12 : Impressions musculaires dans une coquille de Mytilus spp.
Notes : 1) longueur de l’impression du muscle adducteur antérieur; 2) longueur de la charnière; 3) longueur de l’impression du muscle adducteur postérieur; 4) distance entre le bord postérieur de l’impression du muscle adducteur postérieur et le bord postérieur de la coquille; 5) distance entre le bord ventral de l’impression du muscle adducteur postérieur et le bord ventral de la coquille; 6) largeur de la coquille; 7) hauteur de la coquille.
9.3.4.6 Taille et âge
Tous les sujets utilisés dans une étude de bivalves en cage devraient être de même classe d’âge, et leur taille devrait être aussi uniforme que possible. D’ordinaire, les juvéniles destinés à la mesure de la croissance ne devraient pas montrer une différence de longueur de plus de 5 mm au début de la période d’exposition. C’est ainsi qu’on peut limiter le nombre de sujets requis pour obtenir la puissance statistique nécessaire. Les juvéniles constituent les meilleurs candidats pour la mesure de ce paramètre, puisque la plus grande partie de leur énergie sert à la croissance. Chez les bivalves -- et les moules en particulier -- il y a un rapport inverse entre l’énergie utilisée pour la croissance et l’énergie utilisée pour la reproduction. Cela provient du fait que les moules juvéniles consacrent la plus grande partie de leur énergie à la croissance, mais à mesure qu’elles vieillissent, elles consacrent de plus en plus d’énergie à la reproduction, et le rapport s’inverse chez les adultes. Les moules commencent généralement à produire des gamètes dès l’âge d’un an. À trois ou quatre ans, elles consacrent la majeure partie de leur énergie à la reproduction, et leur taux de croissance devient beaucoup plus faible. Il est donc recommandé d’utiliser des moules de plus de trois ans (dont la longueur atteint en règle générale au moins 4 cm) pour l’étude de l’utilisation d’énergie pour la reproduction et des juvéniles (de 2,0 à 2,5 cm) pour l’étude de l’utilisation d’énergie pour la croissance.
L’âge des bivalves peut être déterminé à l’aide d’une combinaison des techniques décrites par Ramon et Richardson (1992) et par Sejr et al. (2002). La technique fondée sur les stries de croissance annuelles a été validée à l’aide d’études de marquage et de recapture (Sejr et al., 2002). Cette tâche devrait être confiée à un biologiste d’expérience.
9.3.4.7 Nombre d’organismes
Une analyse de puissance (analyse exponentielle) devrait être effectuée pour déterminer le nombre minimal de bivalves nécessaires pour détecter un effet d’une ampleur donnée. Il est recommandé d’élaborer le plan d’étude de façon à détecter une différence de 20 % dans la croissance. Il est possible de se procurer des ensembles de données destinés à faciliter la prévision du nombre d’organismes nécessaires auprès d’Environnement Canada. Toutefois, lorsque les longueurs des bivalves se situent à l’intérieur d’une gamme étroite de tailles (en moyenne, écart de 5 mm), 100 bivalves suffiront pour obtenir la puissance statistique voulue et pour assurer qu’un nombre adéquat de bivalves survivent à l’exposition.
Pour la mesure de la croissance, le nombre d’animaux requis par cage est fonction du plan d’étude (p. ex., nombre de cages par station; cette question est traitée plus en détail dans les sections suivantes), de l’espèce utilisée, de l’âge des animaux ainsi que de la variabilité des réponses et des conditions de croissance à la station. Le nombre de bivalves nécessaires pour remplir les cages est fonction du plan d’étude, notamment :
- du nombre de zones (zone d’exposition et zones de référence);
- du nombre de stations par zone;
- du nombre de cages par point d’ancrage (si l’étude vise à déterminer l’exposition à différentes profondeurs dans la colonne d’eau);
- du nombre recommandé de bivalves par cage.
En outre, si des échantillons tissulaires sont requis à des fins d’analyse, il faut déterminer le nombre de sujets requis pour obtenir un échantillon suffisant pour les analyses chimiques.
9.3.4.8 Conditions de manipulation et de conservation
On trouvera ci-après un résumé des renseignements détaillés que donnent Salazar et Salazar (2000) sur les conditions de manipulation et de conservation des bivalves. Les organismes d’essai devraient être manipulés le moins possible et déployés le plus rapidement possible après leur collecte. Lorsque la manipulation est nécessaire, elle devrait être faite avec soin, doucement et rapidement de façon que les bivalves ne subissent pas de stress inutile. Les animaux devraient être conservés dans une eau courante, propre et bien aérée aussi longtemps que possible entre la collecte, le tri et le déploiement. S’il faut les transporter sur une grande distance, il importe de les garder humides et au frais en les plaçant dans une glacière avec des cryosacs ou de la glace humide (au fond de la glacière). Utiliser du varech ou des serviettes pour isoler les bivalves des cryosacs ou de la glace; il faut éviter le papier journal puisque l’encre qu’il contient peut être toxique pour les bivalves.
9.3.5 Plan d’étude
Il est essentiel d’élaborer un plan d’étude approprié si l’on veut que les résultats soient probants. La méthodologie des études de bivalves en cage comprend un certain nombre d’éléments :
- plan d’échantillonnage;
- sélection des zones et des stations;
- répétition des stations et des cages à une même station;
- moment et durée de l’étude;
- facteurs de confusion ou de modification;
- mesures supplémentaires;
- configuration des cages;
- systèmes d’ancrage.
9.3.5.1 Plan d’échantillonnage
Six principaux plans d’échantillonnage sont recommandés pour les évaluations dans les milieux marins et dulcicoles :
- plan contrôle-impact (C-I);
- plan contrôle-impact multiple (C-IM);
- plan par gradient linéaire (GL);
- plan par gradient radial (GR);
- plan par gradients multiples (GM);
- plan contrôle-gradient linéaire (C-GL).
Les plans C-I et C-IM permettent de déterminer l’ampleur de la différence entre des zones homogènes exposées et non exposées, tandis que les plans GL, GR et GM permettent d’examiner les modifications d’un effet le long d’un gradient de concentration d’effluent. Les plans C-I et C-IM sont utilisés lorsqu’il y a peu de degrés d’exposition différents sur le plan qualitatif. Il est recommandé d’utiliser plusieurs zones de référence plutôt que d’augmenter la taille des échantillons dans une seule zone. Les plans GL, GR et GM peuvent être utilisés lorsqu’il y a plusieurs degrés d’exposition quantitativement différents (Paine, 2000); ils peuvent également être utiles pour distinguer les effets provenant d’autres sources qu’une mine. Des conseils pour le choix du plan d’échantillonnage approprié sont présentés aux chapitres 2 et 4.
Par exemple, dans les estuaires caractérisés par des régimes de marées et de courants complexes, l’approche C-IM pourrait être la plus appropriée. Une approche par gradient linéaire (GL) pourrait s’appliquer à un milieu récepteur fluvial, où l’écoulement est unidirectionnel.
Les plans C-I, C-GL et C-IM nécessitent un certain degré de répétition dans les zones de référence et d’exposition. Le plan C-GL combine les plans C-I et GL. Ce qui peut parfois être utile lorsqu’on souhaite utiliser plus d’un site de référence. Dans ce cas, un contrôle -- ou zone de référence -- est ajouté à un gradient linéaire, d’ordinaire lorsque le site très peu exposé à l’effluent (site très éloigné) ne présente pas de conditions semblables à celles de la zone exposée quant à la profondeur ou à d’autres facteurs biotiques importants. Pour les plans par gradient, il n’est pas nécessaire d’effectuer une répétition à chaque station, mais il importe d’établir un nombre approprié de stations pour distinguer les configurations spatiales associées au rejet d’effluents et les autres configurations spatiales dans l’environnement. La section 9.3.5.2 traite de la répétition plus en détail. En bout de ligne, il incombe aux chercheurs d’élaborer des plans d’étude qui conviennent au site et qui soient scientifiquement valables, robustes et suffisamment sensibles.
9.3.5.1.1 Choix des zones et des stations
Le chapitre 2 fournit des conseils pour le choix de zones de référence multiples dans divers milieux récepteurs, qui peuvent s’appliquer aux études faisant appel à des bivalves en cage. Les zones de référence doivent être aussi similaires que possible aux zones d’étude en ce qui concerne les éléments suivants :
- la profondeur;
- les conditions hydrodynamiques;
- la température;
- la salinité;
- la teneur en oxygène dissous;
- la disponibilité et la qualité de la nourriture.
L’utilisation de zones de référence multiples peut faciliter la reconnaissance des différences et de la variabilité naturelles entre des zones non contaminées. Une combinaison d’un gradient linéaire et de zones de contrôle multiples -- par exemple, C-GL -- permet souvent une étude plus robuste.
La zone d’exposition est définie par les caractéristiques du panache d’effluent. Le profil du panache, comme le décrit le chapitre 2, devrait fournir suffisamment de données pour permettre la modélisation des concentrations moyennes d’effluents en fonction de la distance par rapport à la source, et la détermination du degré de mélange vertical dans la colonne d’eau. Cette information facilitera le choix des stations et de la profondeur du déploiement dans la colonne d’eau. Les sections qui suivent offrent plus d’information à ce sujet.
9.3.5.2 Répétition
9.3.5.2.1 Nombre de stations
L’emplacement des stations et les profondeurs auxquelles sont déployées les cages dans la zone exposée doivent être choisis de façon qu'un gradient d’exposition au panache d’effluent soit représenté. Au moment de choisir les stations, il faut considérer avec attention un certain nombre de facteurs d’interférence potentiels, dont les suivants :
- Dans les milieux marins et estuariens, le panache peut être flottant, de sorte qu’une mince couche d’effluent non salé surmonte une couche d’eau salée plus dense.
- Dans les zones soumises à l’action des marées, le mélange de l’effluent aux masses d’eaux peut obéir à des mécanismes assez complexes, et on ne peut être certain des concentrations moyennes auxquelles les bivalves sont exposés. Dans ces situations, il faut envisager de répartir les stations dans la zone d’exposition à la fois en amont et en aval du point de rejet.
- Dans l’embouchure des cours d’eau, le panache d’effluent peut être assez long et étroit, de sorte qu’il est difficile d’obtenir une répétition valable des stations à l’intérieur du panache (c.-à-d. dans sa section transversale).
Pour ces raisons et pour d’autres, il peut être préférable d’élaborer les études de bivalves en cage en tenant compte simplement de la distance par rapport au point de rejet plutôt que des concentrations d’effluent. Cette approche demeure conforme à l’un des objectifs de l’ESEE qui est d’évaluer l’ampleur et l’étendue géographique des effets qui peuvent être associés au rejet d’effluents.
Le nombre de stations répétées doit être déterminé en fonction du plan d’échantillonnage et des objectifs de l’ESEE. Ce nombre, et le nombre de sous-échantillons dans ces stations, seront déterminés par une analyse de puissance. La répartition et la distribution des stations répétées sont tributaires du plan d’échantillonnage. Le chapitre 8 contient des renseignements sur l’utilisation de l’analyse de puissance. Les lecteurs devraient faire en sorte d’éviter la pseudorépétition et de planifier plutôt une véritable répétition. Hurlbert (1984) fournit de plus amples informations sur le sujet.
9.3.5.2.2 Application de la répétition au plan d’étude
Il est suggéré de mesurer plusieurs paramètres dans les études de bivalves en cage : la survie, la croissance (modification de la longueur ou du poids humide), le poids frais des tissus mous, la condition, la reproduction et le stockage d’énergie. Afin de mesurer ces paramètres sur une série de sujets déployés à différents endroits sur le terrain, plusieurs configurations différentes de cages et de bivalves peuvent être utilisées. Pour l’ESEE, il peut être avantageux de déployer des cages répétées contenant plusieurs bivalves à chaque station et de considérer seulement le rendement moyen à l’intérieur de chaque cage. Cette approche permet en outre de compenser la perte éventuelle d’une ou de plusieurs cages et peut simplifier la construction et le déploiement des cages. Tant que la portée du test de l’hypothèse statistique demeure limitée à la vérification de différences significatives entre les zones (sans attribuer uniquement les effets à l’exposition à l’effluent), la répétition et l’analyse statistique sont valides.
Il est suggéré, en règle générale, de déployer des cages contenant 20 sujets pour mesurer la survie et au moins cinq cages par station pour mesurer la croissance. Il convient d’utiliser une seule cage, et non cinq, par point d’ancrage, car celui-ci constitue l’unité de répétition statistique la plus appropriée. Il faut toutefois que les intervenants explorent la puissance et la robustesse des plans d’étude potentiels en utilisant des données de synthèse (ou des données empiriques lorsqu’elles sont disponibles) comme partie intégrante du processus de planification de l’étude afin de déterminer le nombre minimal de sujets nécessaires.
9.3.5.3 Moment et durée de l’étude
Le moment choisi pour effectuer les études doit répondre aux caractéristiques suivantes :
- Il coïncide avec une période de forte croissance dans les populations naturelles, de sorte que la croissance soit maximale et que les différences du taux de croissance observées entre les traitements soient plus faciles à mesurer.
- Il ne coïncide pas avec une période de fraie si les bivalves d’essai sont des adultes.
Pour la mesure de la croissance, de la survie et de l’accumulation de substances chimiques, la durée d’exposition devrait être de 60 à 90 jours (voir ce point dans Salazar et Salazar, 2000). Cette durée devrait être suffisante pour que les effets sur la survie et la croissance puissent se manifester. Toutefois, il pourrait devenir nécessaire d’utiliser une période minimale de neuf mois pour mesurer l’énergie ou la reproduction. Sur la côte Est, il faudrait d’ordinaire déployer les cages en été pour s’assurer que l’énergie accumulée à l’automne (celle mesurée) provient des sites étudiés et que la production d’œufs reflète bien les effets potentiels de l’effluent. Même s’il faut procéder à trois échantillonnages (déploiement, énergie et reproduction), le coût n’est généralement pas prohibitif puisqu’il n’est pas nécessaire de procéder à des mesures avant le déploiement comme c’est le cas pour la croissance et la survie.
9.3.5.4 Facteurs de confusion ou de modification et mesures supplémentaires
Les résultats des études de bivalves en cage seront tributaires, au moins en partie, de facteurs naturels comme la température, la disponibilité de la nourriture, d’autres propriétés physiques et chimiques du milieu d’essai, l’espèce choisie, la condition des organismes d’essai, la méthode d’exposition et les manipulations subies par ces organismes. Les zones d’exposition et de référence devraient être aussi similaires que possible en ce qui concerne les facteurs énumérés ci-après pour réduire le plus possible les différences portant à confusion. Il peut être utile de mesurer certains des facteurs pour faciliter l’interprétation des résultats. Ces facteurs peuvent inclure le cycle vital, le comportement, la température, le manque d’acclimatation, la disponibilité de la nourriture, la vitesse des courants, la salinité, l’encrassement, et la concentration chimique. Ces questions sont examinées plus en détails par Salazar et Salazar (2000).
9.3.6 Configuration des cages
Pour les études sur la croissance et la survie, il est suggéré d’utiliser des cages munies de compartiments individuels pour pouvoir suivre chacun des bivalves tout au long de l’étude. La largeur de maille devrait être aussi grande que possible pour permettre une circulation maximale de l’eau, mais suffisamment petite pour contenir les animaux d’essai. Les sujets sont placés dans des compartiments de façon qu’il soit possible de suivre la survie, la croissance et la condition de chacun. Les organismes d’essai seront placés dans des filets et séparés à l’aide d’attaches de plastique ou de tout autre matériau approprié. Il faudrait laisser suffisamment d’espace dans chaque compartiment pour permettre aux sujets de croître durant la période d’exposition.
Pour les mesures de la reproduction et de l’énergie, il n’est pas nécessaire de mesurer les bivalves au préalable, les compartiments individuels sont donc inutiles. Toutefois, les bivalves devraient être exposés à des conditions relativement uniformes, et il est recommandé de les disposer en boudins de trois ou quatre individus chacun (figure 9-13). Cette configuration des cages réduit sensiblement le niveau d’effort requis.
Salazar et Salazar (2000) décrivent diverses configurations de cages. Il est suggéré d’utiliser des cages plates (c.-à-d. à deux dimensions), comme l’illustre la figure 9-13, car elles présentent un certain nombre d’avantages pratiques. Les tubes en PVC conviennent bien pour la fabrication des cages. À cet égard, le PVC devrait être de très bonne qualité et utilisable dans l’eau, et les tubes devraient être trempés dans l’eau courante, douce ou salée, pendant au moins 24 heures avant leur utilisation pour retirer les produits chimiques volatils ou solubles dans l’eau qui pourraient être présents. D’autres matériaux sont décrits dans Salazar et Salazar (2000; section 9).
Les dimensions finales des cages sont tributaires de la taille des organismes d’essai et du nombre de bivalves par cage. Habituellement, les boudins destinées aux espèces comme les moules et les myes mesurent de 10 à 15 cm de diamètre, avec une largeur de maille de 5 mm. Chaque sac en filet devrait être suffisamment long pour contenir le nombre désiré de bivalves et pour permettre la fixation au cadre de PVC. Pour les déploiements de bivalves d’eau douce, les chercheurs ont utilisé une grande variété de configurations de cages. Il incombe au responsable de l’étude de s’assurer que la configuration des cages convient à l’espèce choisie et au milieu récepteur.
9.3.6.1 Systèmes d’ancrage
Pour suspendre les cages dans la colonne d’eau, il est possible de les attacher à des lignes munies d’ancres ou de poids à l’extrémité inférieure (p. ex., des maillons de chaîne en fer) et de bouées de surface ou de subsurface à l’extrémité supérieure (figures 9-14 et 9-15). Salazar et Salazar (2000) traitent des facteurs dont il convient de tenir compte pour le déploiement des cages.

Figure 9-13 : Cadre utilisé pour les essais d’exposition des bivalves.
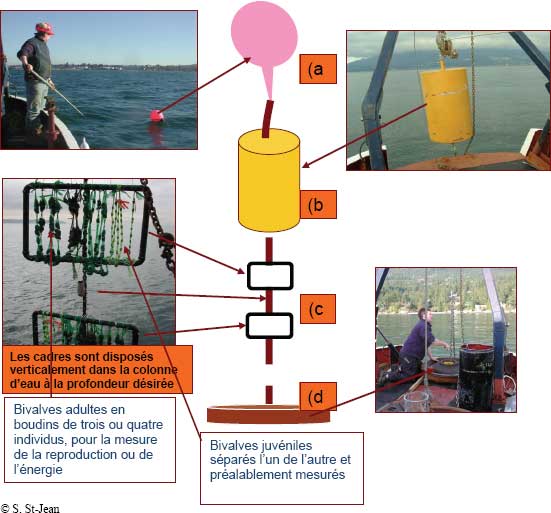
Figure 9-14 : Éléments du système modulaire de mésocosmes.
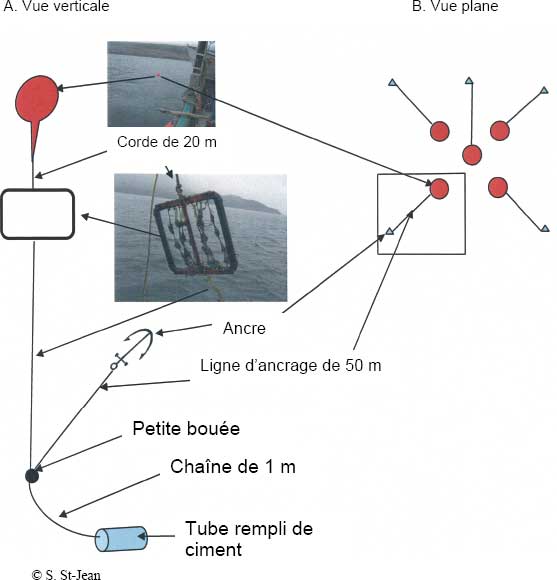
Figure 9-15 : Schéma d’assemblage du système modulaire de mésocosmes.
9.3.7 Méthodes pour débuter l’essai, déployer et récupérer les cages et terminer l’essai
9.3.7.1 Début de l’essai
La première étape consiste à trier les bivalves en fonction des gammes de tailles désirées. En choisissant des sujets à l’intérieur d’une gamme étroite de tailles ou d’âges, les chercheurs peuvent être relativement confiants que ceux-ci présenteront un potentiel de croissance similaire. La détermination de l’âge de spécimens prélevés dans la nature peut s’avérer difficile, voire impossible, pour certaines espèces. Il faut donc avoir recours à la longueur pour choisir des bivalves qui présentent un taux de croissance similaire. Les conchyliculteurs commerciaux peuvent souvent fournir des bivalves d’un âge connu. La gamme de tailles retenue pour les organismes d’essai est fonction de l’espèce choisie, des stocks disponibles pour l’approvisionnement en animaux et de l’âge ciblé. Il faudrait choisir des organismes d’essai à l’intérieur d’une gamme étroite de tailles. Il importe de conserver les organismes d’essai frais et humides au cours du tri pour éviter le stress, les dommages et les mortalités (voir la section 9.3.4.8). Pour les études de croissance et de survie, il faut noter la longueur, la hauteur et la largeur de la coquille et le poids humide de l’animal entier (PHAE) de chaque individu qui devra être placé dans un contenant de stockage temporaire (p. ex., un plateau à glaçons), étiqueté en fonction de l’emplacement particulier qu’il occupera dans la cage. Cette procédure permet la répétition de la prise de mesure de chacun des spécimens à la fin de l’essai. Enfin, il faudra mesurer la longueur des coquilles, le PHAE, le poids des tissus et le poids des coquilles d’un sous-échantillon d’organismes d’essai sacrifiés (composé d’un nombre d’animaux approprié du point de vue statistique). Pour les autres paramètres, il n’est pas nécessaire de mesurer les bivalves de taille similaire, il suffit de les placer en boudins de trois à quatre individus, ce qui reproduit leur comportement naturel dans la nature et réduit leur stress.
Aux fins du contrôle de la qualité, environ 20 % des mesures devraient être répétées et enregistrées par un chercheur différent. Il est préférable d’utiliser un tableur électronique pour l’enregistrement des mesures afin de réduire les erreurs de transcription. Il est également possible de brancher des instruments de mesure (p. ex., un pied à coulisse et une balance de précision) au tableur électronique pour un contrôle de qualité plus poussé.
Tous les organismes d’essai nécessaires pour remplir les cages, ainsi qu’un sous-échantillon sacrifié destiné à la pesée des tissus mous, devraient être triés et mesurés avant le déploiement. Les organismes d’essai sont alors répartis en boudins, avant d’être attachés aux cages. Salazar et Salazar (2000; section 11) fournissent un exemple de plan d’étiquetage et de répartition.
9.3.7.2 Déploiement des cages
Il faudrait s’assurer de disposer d’un bateau approprié pour transporter et déployer toutes les cages, leurs lignes d’ancrage et leurs bouées en toute sécurité. Les lignes d’ancrage et les bouées peuvent être attachées aux cages à bord, durant le transport vers le site. Une fois sur place, il faudrait repérer l’emplacement des cages à l’aide d’un système GPS ou de toute autre méthode fiable (p. ex., en utilisant des repères sur la rive à proximité). Des inspections régulières peuvent être effectuées durant la période d’exposition (p. ex., par des plongeurs) pour vérifier la présence des cages, leur condition et leur propreté.
9.3.7.3 Récupération des cages et fin de l’essai
Pour récupérer les cages, divers outils de repérage peuvent être utilisés (p. ex., des systèmes GPS ou des sondeurs) et un grappin, si elles ont été munies d’une ligne de récupération.
Salazar et Salazar (2000; section 11) fournissent des détails sur la fin de l’essai, qui sont résumés ici. Une fois les cages récupérées, tous les bivalves devront être mesurés. Pour les mesures de la croissance et de la survie, il est essentiel de conserver l’ordre et l’orientation de chaque bivalve durant la prise des mesures de fin d’essai. Les sujets peuvent être retirés des boudins et placés dans des contenants étiquetés (p. ex., des plateaux à glaçons) pour faciliter la prise des mesures.
Cinq ou dix minutes avant la mesure des longueurs et des poids, il faut placer les plateaux dans un bac rempli d’eau propre. Si les animaux flottent, cela indique la présence d’air entre les valves des coquilles. Lorsque tous les animaux dans les plateaux ont légèrement ouvert leurs valves et ne flottent plus (après cinq à dix minutes), on peut débuter la prise des mesures. La mesure du PHAE et de la longueur des coquilles se fait en premier, puis il faut décoquiller soigneusement chaque individu et enlever l’excédent d’eau à l’aide d’un papier buvard avant de procéder à la mesure des poids frais. Il convient de noter que si l’on prévoit d’analyser les tissus pour déceler la présence de produits chimiques, il faut prendre garde de ne pas introduire de contaminants provenant du papier buvard. Le protocole du programme de surveillance des moules (Gulf of Maine Council, 1997) est le plus approprié pour la dissection effectuée aux fins de l’analyse chimique.
9.3.8 Indicateurs d’effets
Les indicateurs d’effets devant être mesurés au cours des études de bivalves en cage menées dans le cadre de l’ESEE sont la survie, la croissance, la reproduction et la condition. Le tableau 9-7 présente les critères d’effets et d’appui pour une étude de bivalves en cage. Les méthode statistiques sont également répertoriées et sont décrites de manière plus explicite à la section 9.3.10. Enfin, un modèle de rapport pour l’enregistrement des données brutes et des résultats relatifs à la survie et à la croissance figure au tableau 9-8.
| Indicateurs d’effets | Critères d’effets et d’appui | Tests statistiques |
|---|---|---|
| Croissance |
| ANOVA (analyse de régression pour les plans d’étude le long d’un gradient) |
| Reproduction |
| ANOVA ou ANCOVA |
| Condition |
| ANOVA ou ANCOVA |
| Survie |
| ANOVA |
*Critères d’effets utilisés pour déterminer les effets lors d’études de bivalves en cage. Les autres critères d’appui peuvent être utilisés pour étayer les analyses.
† Présentement, seuls des conseils concernant l’indice somatique du manteau (similaire à l’indice gonadosomatique) sont fournis (voir la section 9.3.8.5).
9.3.8.1 Survie
La survie n’est pas un indicateur particulièrement sensible des effets sur les bivalves en cage, mais elle constitue un paramètre important à surveiller. Elle peut facilement être déterminée et quantifiée, bien qu’il soit possible que certains spécimens soient manquants à la fin de l’essai en raison de la décomposition des coquilles. Les coquilles des bivalves morts sont grandes ouvertes et ne se ferment pas en réaction au toucher ou au tapotement. La survie s’exprime en pourcentage de sujets vivants par cage à la fin de la période d’exposition.
9.3.8.2 Croissance
La croissance est une mesure d’utilisation d’énergie et constitue un indicateur sensible des effets facile à mesurer. Il faut effectuer plusieurs types de mesures de la croissance; se limiter à une seule pourrait produire des résultats trompeurs. Les mesures de la croissance, accompagnées d’une indication du degré prévu d’exactitude, doivent être prises au début et à la fin de l’essai comme ci-dessous :
La croissance peut s’exprimer de plusieurs manières :
- croissance absolue : changement de valeur en termes absolus entre le début et la fin de l’essai;
- taux de croissance : changement de valeur en termes absolus par unité de temps (habituellement, des intervalles d’une semaine sont utilisés);
- croissance relative : (poids final – poids initial)/poids initial; on peut utiliser la croissance relative lorsqu’il existe une différence significative entre les poids initiaux des sujets dans plusieurs cages. La croissance relative est exprimée comme une proportion, de sorte qu’il peut être approprié de procéder à une transformation des valeurs en racine carrée de l’arc-sinus avant d’effectuer les tests statistiques. Green (1979) fournit des conseils utiles sur cette transformation en faisant remarquer que celle-ci n’est habituellement pas nécessaire pour les données de proportions qui se situent entre 0,3 et 0,7, et que si elle n’est pas toujours utile, elle ne nuit probablement pas non plus aux résultats.
Il convient d’utiliser l’expression de la croissance la plus appropriée en fonction du plan d’étude et des caractéristiques propres à chaque site.
9.3.8.3 Condition
La condition est une mesure de la façon dont l’animal stocke son énergie; elle peut être mesurée chez les adultes ou chez les juvéniles. Il existe plus d’une option pour calculer la condition. Il convient de noter que certaines de ces méthodes nécessitent la mesure de variables additionnelles à celles qui ont été énumérées à la section 9.3.8.2. Le choix de la méthode la plus appropriée pour calculer la condition est laissé à la discrétion des chercheurs.
Poids (poids sec de l’animal entier, poids de la coquille sèche ou poids des tissus mous) par rapport à la longueur de la coquille – Ce rapport est analogue à l’indice de condition de Fulton (Ricker, 1975; Anderson et Neumann, 1996) utilisé en biologie des pêches. Il peut être caractérisé selon la formule classique d’une ligne droite (p. ex., dans Mackie et Flippance, 1983) avec une pente (C) et une ordonnée à l’origine (b) :
log poids = b + (C × log longueur)
Les valeurs élevées de C signifient que le bivalve en cause possède un poids tissulaire relativement important pour une longueur donnée, tandis que les valeurs basses peuvent indiquer que le sujet n’obtient pas suffisamment de nourriture ou a été soumis à des conditions de stress chronique qui l’ont empêché de se développer. Cette méthode de caractérisation convient à l’évaluation de la condition des bivalves sauvages, chez lesquels la longueur des coquilles peut présenter des variations assez importantes. Elle n’est toutefois pas fiable dans le cas des bivalves en cage, car les animaux ont été triés au début de l’essai pour l’obtention d’une longueur uniforme. Elle peut également ne pas convenir dans le cas des bivalves, car plusieurs facteurs environnementaux influent sur la longueur des coquilles et le poids des tissus (M. Salazar, comm. pers.).
Poids des tissus mous par rapport au poids de la coquille – Cette méthode de caractérisation utilise le poids des tissus mous et le poids de la coquille. On peut effectuer une analyse de variance ou, plus simplement, diviser le poids des tissus mous par le poids de la coquille. Grout et Levings (2000) ont mesuré la condition de Moules bleues en calculant le ratio entre le poids des tissus et le poids de la coquille. Leurs résultats indiquent que la condition permet de distinguer des moules en cage situées dans une zone caractérisée par un taux de survie élevé (indice de condition variant de 1,1 à 1,42) de moules en cage situées dans une zone marquée par un faible taux de survie (indice de condition variant de 0,82 à 0,96).
Poids des tissus mous par rapport au volume de la coquille – Mucklow (1996; d’après Seed, 1968) a utilisé cette méthode pour calculer la condition en divisant le poids sec des tissus mous par le volume de la coquille, lequel est le produit de la longueur, de la largeur et de la hauteur. Dans une étude de populations de Moules bleues sauvages, il a conclu que les variations saisonnières de l’indice de condition fluctuent et sont tributaires d’un certain nombre de facteurs naturels, notamment la disponibilité de la nourriture et les besoins physiologiques en énergie (Mucklow, 1996).
9.3.8.4 Mesure de l’énergie
Comme l’indique la figure 9-11, l’énergie peut également s’accumuler dans le manteau et obéit à un cycle annuel. En règle générale, les Moules bleues atteignent leur teneur maximale en énergie à la fin de l’automne. À ce stade, le poids du manteau correspond principalement au glycogène stocké qui servira plus tard à la reproduction. Avant de procéder à la dissection, il convient de mesurer le poids humide de l’animal entier (PHAE) et les dimensions de la coquille (longueur, poids, hauteur et impressions musculaires). Les lobes du manteau doivent être séparés du corps et pesés (poids humide du manteau), et le poids du reste du corps est ensuite ajouté pour déterminer le poids total du corps. Les échantillons doivent être séchés à 55 oC jusqu’à ce que leur poids devienne constant (environ deux à trois jours). Le poids sec du manteau et le poids sec du corps doivent tous deux être mesurés pour servir au calcul d’indices comme l’IHS, qui correspond chez les bivalves au ratio du poids sec du manteau par rapport au poids sec de l’animal entier.

Figure 9-16 : A) Échantillon de manteau avec les instruments nécessaires pour son prélèvement; B) échantillon de manteau homogénéisé et prêt à l’analyse.
9.3.8.5 Effort de reproduction
Des recherches récentes ont permis de constater que l’indice somatique du manteau (ISM) des bivalves est semblable à l’indice gonadosomatique (IGS) des poissons et peut servir à déterminer l’investissement reproductif. La plupart des gamètes produits par le bivalve se trouvent dans les lobes du manteau. Voici un résumé des étapes à suivre pour déterminer l’indice somatique du manteau des bivalves :
- Mesurer la longueur, la largeur, la hauteur et le poids de l’animal entier.
- Disséquer chaque bivalve.
- Déterminer le sexe.
- Enlever et peser chaque lobe du manteau et déterminer la masse corporelle de chaque individu.
- Dans le cas d’une femelle, un lobe du manteau devrait servir à calculer le poids sec et l’IGS(le rapport entre la masse corporelle [moins la gonade] et la gonade); dans le cas d’un mâle, les deux lobes sont utilisés, et le calcul pour la femelle devrait être extrapolé pour les deux lobes.
- Le deuxième lobe devrait servir à évaluer l’effort de reproduction en mesurant et en comptant les œufs.
- Calculer l’indice somatique du manteau (le rapport entre la masse corporelle [moins la gonade] et la gonade).
L’indice somatique du manteau devrait être calculé lorsque 90 % du lobe du manteau contiennent des gonades. De nombreux facteurs à prendre en compte influent sur la période de la fraie : la profondeur de l’eau, la température saisonnière, les systèmes de réponses et la prévalence des différentes espèces. Boudreau et al. (en préparation) et St-Jean et al. (2008) ont effectué des études faisant appel à l’indice somatique du manteau sur les côtes canadiennes de l’Atlantique et du Pacifique en utilisant diverses espèces. Ils ont constaté que, dans le cas de Mytilus trossulus (côte du Pacifique), la production de gamètes précédant la fraie ne présentait pas le pic caractéristique observé chez Mytilus edulis (côte de l’Atlantique). Boudreau et al., (en préparation) ont aussi évalué l’effort de reproduction en comptant et en pesant les œufs contenus dans chaque manteau.
Pour en savoir plus sur l’indice somatique du manteau, consulter St-Jean (2003) ou contacter le coordonnateur régional du Programme d’ESEE pour plus de renseignements et les descriptions complètes des techniques.
En résumé, la technique supplémentaire (figure 9-16) comprend les étapes suivantes :
- Mesure du poids du lobe de la gonade sur une balance de précision.
- Extraction d’un échantillon de tissu à l’aide des pailles fournies.
- Mesure du poids de l’échantillon de tissu.
- Homogénéisation de l’échantillon de tissu.
- À l’aide d’un micromètre oculaire à grossissement 400X, mesure de 20 œufs (mesurer l’œuf entier et le noyau).
- Dénombrement des sous-échantillons représentatifs dans une cellule à numération.
- Répétition de l’étape 6 deux autres fois pour arriver à un total de trois dénombrements.
| Site Station Biologiste Observations : | Date de réception Date de traitement Analyses chimiques requises? Date d’expédition Poids de l’échant. (chimie) | Entreposage À : | ||||||
| Animal No | Lon- gueur (L) (mm) | Hau- teur (H) (mm) | Lar- geur (W) (mm) | Poids humide de l’ani- mal entier (g) | Man- teau (poids humide) (g) | Poids sec de l'animal entier (g) | Man- teau (poids sec) (g) | Poids sec de la coquille (g) |
|---|---|---|---|---|---|---|---|---|
| 1 | ||||||||
| 2 | ||||||||
| 3 | ||||||||
| 4 | ||||||||
| 5 | ||||||||
| 6 | ||||||||
| 7 | ||||||||
| 8 | ||||||||
| 9 | ||||||||
| 10 | ||||||||
| 11 | ||||||||
| 12 | ||||||||
| 13 | ||||||||
| 14 | ||||||||
| 15 | ||||||||
| 16 | ||||||||
| 17 | ||||||||
| 18 | ||||||||
| 19 | ||||||||
| 20 | ||||||||
| QA/QC | ||||||||
Nombre de mollusques vivants à la fin de l’essai _________
Taux de survie en % _________
| Date | Heure | Température (°C ) | Concentration d’oxygène dissous (mg/L) | Salinité (‰) | Vitesse du courant (cm/s) | Direction du courant (degrés) |
|---|---|---|---|---|---|---|
Travail exécuté par : _____________________________________________
Notes :
* Fiche de terrain fournie par SSJ Environmental Limited.
9.3.9 Assurance de la qualité et contrôle de la qualité
Tout le travail devrait être confié à des personnes compétentes (biologistes et techniciens). Les entrepreneurs devraient être choisis en fonction de leur expertise. Tout le travail sur le terrain devrait être effectué conformément aux modes opératoires normalisés pour assurer la cohérence globale et faire en sorte que les méthodes appropriées sont utilisées. Toutes les mesures effectuées sur le terrain ou en laboratoire devraient être faites à l’aide d’instruments correctement étalonnés. Toutes les données de terrain devraient être consignées sur des formulaires normalisés pour faire en sorte que toutes les données requises soient recueillies dans un format reproductible et standard.
Vingt pour cent de toutes les mesures prises devraient être reprises pour assurer l’exactitude et la reproductibilité des mesures prises sur le terrain et des résultats des analyses en laboratoire. Pour les bivalves en boudins, reprendre les mesures sur au moins deux bivalves par boudin.
La première étape de l’analyse des données consiste à éliminer les valeurs aberrantes. Un moyen rapide consiste à établir des diagrammes de dispersion de paires de variables et d’y superposer des ellipses correspondant à l’intervalle de confiance de 95 %. Les valeurs aberrantes potentielles sont celles qui se trouvent à l’extérieur de l’ellipse. Ces valeurs peuvent être dues à diverses causes, y compris les erreurs de saisie ou de transcription. Lorsque des valeurs aberrantes sont détectées, il convient d’examiner l’ensemble des données pour tenter d’en déceler la source et, si possible, de la supprimer. Lorsque cela n’est pas possible, l’analyse devrait être effectuée avec et sans les valeurs aberrantes afin d’évaluer l’incidence de ces dernières sur les résultats de l’analyse.
Les données statistiques doivent être examinées pour évaluer dans quelle mesure elles sont conformes aux hypothèses sous-jacentes (p. ex., normalité et homogénéité des variances ou égalité des pentes dans l’analyse de covariance). Le cas échéant, des transformations pourraient être requises pour réduire les écarts par rapport aux hypothèses de base.
9.3.10 Analyses des données
Les analyses des données et l’interprétation des résultats devraient être adaptées au plan d’étude. Les études de bivalves en cage menées dans le cadre de l’ESEE visent à déterminer s’il existe des effets significatifs sur le biote à proximité des points de rejet des effluents. Il est possible d’atteindre ce but en utilisant un plan contrôle-impact (référence – exposition) ou encore un plan par gradient (régression). Les méthodes statistiques appropriées pour chaque indicateur d’effet (c.-à-d. la survie, la croissance, la condition, la reproduction et l’énergie) sont résumées dans le tableau 9-7.
Il convient de procéder à une ANCOVA pour tester l’IGS (poids sec de la gonade) et la condition (poids corporel sec) avec des covariables, pour enlever les influences, dont le poids corporel sec pour l’IGS et la longueur de la coquille pour la condition. Lorsqu’une interaction entre le traitement et la covariable interdit l’utilisation d’une ANCOVA, comparer les sous-ensembles stratifiés de la covariable à l’aide d’une ANOVA à un facteur. Lorsque les groupes témoins ne sont pas significativement différents, ils devraient être combinés aux fins des analyses. Toutefois, si on observe une différence significative entre les groupes, tous les témoins devraient être pris en compte dans les analyses. Un test de comparaisons multiples de Tukey peut être utilisé lorsque des différences significatives sont constatées entres les groupes. Les cas de non-normalité (graphique de probabilité) ou d’hétéroscédasticité (test Fmax) qui ne peuvent être résolus par des méthodes appropriées de transformation des données devraient faire l’objet d’une analyse non paramétrique (test de Kruskal-Wallis), suivie d’un test de comparaisons multiples de Noether (Scherrer, 1984; Zar, 1999). Une analyse par la méthode des probits peut être utilisée pour la survie. Le seuil de signification devrait être p < 0,05, et les moyennes rétrotransformées devraient s’accompagner de leur intervalle de confiance à 95 %.
La première étape consiste à produire des statistiques sommaires pour chaque paramètre (c.-à-d. le PHAE, la longueur des coquilles, le poids frais des tissus mous), pour chaque cage et chaque station.
La deuxième étape vise à déterminer s’il existe des différences significatives entre les cages répétées pour chacun des paramètres mesurés avant le déploiement (s’ils n’ont pas été mesurés après la répartition et avant le déploiement). Pour ce faire, on évalue la normalité des données et l’homogénéité des variances.
La dernière étape consiste à appliquer le test statistique approprié au plan d’étude. En général, des ANOVA et des tests de comparaisons multiples servent à vérifier l’hypothèse et à effectuer des comparaisons entre les stations. Pour les plans d’échantillonnage C-I et C-IM auxquels sont associées respectivement des ANOVA et des ANCOVA, des indications détaillées sont présentées au chapitre 8 du présent guide. S’il existe une différence statistiquement significative, un test de comparaisons multiples, ou son équivalent pour des données non paramétriques, peut être employé pour déterminer quelles stations sont différentes des autres. En général, les analyses de régression linéaire et multiple (en effectuant la régression des variables en fonction de la distance) servent à établir les relations entre les variables le long du gradient d’exposition. Pour les analyses de covariance de la condition, les covariables seront fonction de la formule de calcul de la condition choisie.
9.3.11 Mercure
Si une mine doit mesurer les concentrations de mercure dans les tissus des poissons, il est possible de le faire chez des bivalves en cage. Cette approche nécessite toutefois certaines précautions, notamment :
- Établir la durée d’exposition de sorte que le mercure puisse s’accumuler dans les tissus des bivalves à des concentrations décelables.
- Tenir compte de la récolte éventuelle (commerciale ou récréative) de bivalves pour la consommation humaine dans la zone en question.
- S’assurer d’inclure, dans le plan d’étude, un nombre suffisant de bivalves pour obtenir la quantité de tissus nécessaire aux analyses.
Il est possible que, pour certaines mines, l’utilisation de bivalves en cage pour mesurer l’assimilation de mercure ne soit pas appropriée. Toute proposition visant à utiliser cette méthode pour la mesure des concentrations de mercure devrait recevoir l’approbation de l’agent régional d’autorisation.
9.3.12 Rapports
Les exigences relatives à l’AQ/CQ pour les études de bivalves en cage sont les mêmes que celles exposées dans le chapitre 3 du présent guide traitant des études des poissons. Les mesures d’AQ/CQ s’appliquent aux composantes suivantes des études de bivalves en cage :
- plan d’étude;
- échantillonnage sur le terrain;
- traitement des échantillons et analyses en laboratoire;
- analyses des données;
- rapports.
9.4 Références
Anderson, R.O., et R.M. Neumann. 1996. « Length, weight, and associated structural indices », dans B.R. Murphy et D.W. Willis (éd.), Fisheries Techniques. 2nd Edition. Bethesda (MD), American Fisheries Society. Pp. 447-482.
Andrews, S., et R. Parker. 1999. Draft Report (II). An Environmental Quality Evaluation of Pictou Harbour, Nova Scotia, Using Caged Bivalves, Mytilus edulis. Darthmout (N.-É.), Environnement Canada, Direction de la protection de l’environnement, pour The Pictou Harbour Environmental Protection Project, New Glasgow (N.-É.).
Ankley, G.T., K.M. Jensen, M.D. Kahl, J.J. Korte et E.A. Makynen. 2001. « Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas) », Environmental Toxicology and Chemistry, 20 : 1276-1290.
Ankley, GT, K.M. Jensen, E.A. Makynen, M.D. Kahl, J.J. Korte, M.W. Hornung, T.R. Henry, J.S. Denny, R.L. Leino, V.S. Wilson, M.C. Cardon, P.C. Hartig et L.E. Gray. 2003. « Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow », Environmental Toxicology and Chemistry, 22 : 1350-1360.
Applied Biomonitoring. 2000. Caged Mussel Pilot Study, Port Alice Mill, Vancouver Island. Programme d’ESEE, Environnement Canada, Direction de la protection de l’environnement, Région du Pacifique et du Yukon. Rapport manuscrit régional MS 00-01.
Atz, J.W. 1986. « Fundulus heteroclitus in the laboratory: A history », American Zoologist, 26 :111-120.
Barber, W.E., et N.R. Kevern. 1974. « Seasonal variation of sieving efficiency in a lotic habitat », Freshwater Biology, 4 : 293-300.
Bauer G. 1994. « The adaptive value of offspring size among freshwater mussels (Bivalvia; Unionoidea) », Journal of Animal Ecology, 63 : 933–944.
Beckvar, N., S. Salazar, M. Salazar et K. Finkelstein. 2000. « An in situ assessment of mercury contamination in the Sudbury River, Massachusetts, using transplanted freshwater mussels (Elliptio complanata) », Canadian Journal of Fishery and Aquatic Sciences, 57 : 1103-1112.
Bothwell, M.L. 1985. « Phosphorus limitation of lotic periphyton growth rates: An intersite comparison using continuous-flow troughs (Thompson River system, British Columbia) », Limnology and Oceanography, 30 : 527-542.
Bothwell, M.L., et R.J. Daley. 1981. Determination of Phosphorus Sufficiency and Growth Rates of Benthic Algae in the Thompson River, BC, Using Experimental Flowing Troughs. Vancouver (C.-B.), Environnement Canada, Direction générale des eaux intérieures. IWD Regional Report.
Bothwell, M.L., G. Derksen, R.N. Nordin et J.M. Culp. 1992. « Nutrient and grazer control of algal biomass in the Thompson River, British Columbia: A case history of water quality management » dans R.D. Robarts et M.L. Bothwell (éd.), Aquatic Ecosystems in Semi-arid Regions: Implications for Resource Management. Saskatoon (Sask.), Environnement Canada, Institut national de recherche en hydrologie. National Hydrology Research Institute Symposium Series 7, pp. 253-266.
Bothwell, M.L., et J.M. Culp. 1993. Sensitivity of the Thompson River to Phosphorus: Studies on Trophic Dynamics. Saskatoon (Sask.), Environnement Canada, Institut national de recherche en hydrologie. NHRI Contribution No. 93006.
Burt, A., D.L. Kramer, K. Nakasuru et C. Spry. 1988. « The tempo of reproduction in Hyphessobrycon pulchripinnis (Characidae), with a discussion on the biology of "multiple spawning" », Environmental Biology of Fish, 22 : 15-27.
Carlisle, D.M. 2000. « Bioenergetic food webs as a means of linking toxicological effects across scales of ecological organization ». Journal of Aquatic Ecosystem Stress and Recovery, 7 : 155‑165.
Cash, K.J., J.M. Culp, M.G. Dubé, R.B. Lowell, N.E. Glozier et R.B. Brua. 2003. « Integrating mesocosm experiments with field and laboratory studies to generate weight-of-evidence risk assessments for ecosystem health », Aquatic Ecosystem Health and Management. 6: 177-183.
Chen, C.Y., R.S. Stemberger, B. Klaue, J.D. Blum, P.C. Pickhardt et C.L. Folt. 2000. « Accumulation of heavy metals in food web components across a gradient of lakes », Limnology and Oceanography. 45, 1525-1536.
Clarke, A. 1973. « The freshwater molluscs of the Canadian Interior Basin », Malacologia, 13 : 1‑509.
Clarke, A. 1981. Les mollusques d’eau douce du Canada. Ottawa (Ont.), Musée national des sciences naturelles/Musées nationaux du Canada. 447 pages.
Coad, B.W. 1995. Encyclopedia of Canadian Fishes. Waterdown (Ont.), Canada Museum of Nature and Canadian Sportfishing Productions Inc. 928 pages.
Couillard Y., P.G.C. Campbell, A. Tessier, J. Pellerin-Massicotte et J.C. Auclair. 1995 a. « Field transplantation of a freshwater bivalve, Pyganodon grandis, across a metal contamination gradient. I. Temporal changes in metallothionein and metal (Cd, Cu, and Zn) concentrations in soft tissues », Canadian Journal of Fisheries and Aquatic Sciences, 52 : 690-702.
Couillard Y., P.G.C. Campbell, A. Tessier, J. Pellerin-Massicotte et J.C. Auclair. 1995b. « Field transplantation of a freshwater bivalve, Pyganodon grandis, across a metal contamination gradient. II. Metallothionein response to Cd and Zn exposure, evidence for cytotoxicity, and links to effects at higher levels of biological organization », Canadian Journal of Fisheries and Aquatic Sciences, 52 : 703-715.
Courtenay, S.C., W.R. Parker et G.P. Rawn. 1998. Proceedings of a Workshop to Assess Alternatives to the Fish Survey Component of the Environmental Effects Monitoring Program for Canadian Pulp and Paper Mills. Canadian Technical Report of Fisheries and Aquatic Sciences No. 2233, viii + 108 pages.
Crane, M., G.A. Burton, J.M. Culp, M.S. Greenberg, K.R. Munkittrick, R. Ribeiro, M. Salazar et S. St-Jean. 2007. « In situ approaches for stressor and effect diagnosis », Integrated Environmental Assessment and Managment, 3 : 234-245.
Culp, J.M., et K.J. Cash. 1995. Potential Impacts of Effluent on the Thompson and Upper Fraser Rivers. Vancouver (C.-B.), Environnement Canada, Direction de la conservation de l’environnement, Plan d’action du fleuve Fraser. DOE FRAP 1995-10.
Culp, J.M., et R.B. Lowell. 1998. « Pulp mill effluent impacts on benthic communities and selected fish species in the Fraser River Basin », dans C. Gray et T. Tuominen (éd.), Health of the Fraser River Aquatic Ecosystem, Vol. II. Ottawa (Ont.), Environnement Canada. DOE FRAP 1998-11, pp.13-34.
Culp, J.M., et C.L. Podemski. 1996. « Design and application of a novel stream microcosm system for assessing effluent impacts to large rivers », dans M.R. Servos, K.R. Munkittrick, J.H. Carey et G.J. Van Der Kraak (éd.), Environmental Fate and Effects of Pulp and Paper Mill Effluents. Delray Beach (FL), St. Lucie Press. Pp. 549-555.
Culp, J.M., C.L. Podemski, K.J. Cash et R.B. Lowell. 1996. « Utility of field-based artificial streams for assessing effluent effects on riverine ecosystems »,Journal of Aquatic Ecosystem Health, 5 : 117-124.
Culp, J.M., R.B. Lowell et K.J. Cash. 2000a. « Integrating mesocosm experiments with field and laboratory studies to generate weight-of-evidence risk assessments for large rivers », Environmental Toxicology and Chemistry, 19 : 1167-1173.
Culp, J.M., C.L. Podemski, K.J. Cash et R.B. Lowell. 2000b. « A research strategy for using stream microcosms in ecotoxicology: Integrating experiments at different levels of biological organization with field data », Journal of Aquatic Ecosystem Stress and Recovery, 7 : 167-176.
Culp, J.M., C.L. Podemski et K.J. Cash. 2001. « Interactive effects of nutrients and contaminates from pulp mill effluents on riverine benthos », Journal of Aquatic Ecosystem Stress and Recovery, 8 (1) : 67-75.
Culp, J.M., N.E. Glozier, K.J. Cash, M.G. Dubé, M. Waiser, D.L. MacLatchy, B. Brua, B. Firth et G. Wilson. 2004. « Cumulative effects investigation of pulp mill and sewage effluent impacts on benthic food webs: A mesocosm example », dans D.L. Borton, T.J. Hall, R.P. Fisher et J.F. Thomas, Pulp and Paper Mill Effluent Environmental Fate and Effects. Lancaster (PA), DEStech Publications. Proceedings of the Fifth International Conference on Fate and Effects of Pulp and Paper Mill Effluents, June 1-4, 2003, Seattle, Washington, USA. Pp. 464-472.
Day, K.E., J.L. Metcalfe et S.P. Batchelor. 1990. « Changes in intracellular free amino acids in tissues of the caged mussel (Elliptio complanata), exposed to contaminated environments », Archives of Environmental Contamination and Toxicology, 19 : 816-827.
Drake, J.A., G.R. Huxel et C.L. Hewitt. 1996. « Microcosms as models for generating and testing community theory », Ecology, 77 : 670-677.
Dubé, M.G. 1995. « Effects of bleached kraft pulp mill effluent on periphyton and chironomid abundance in the Thompson River, British Columbia ». , Saskatoon (Sask.), Université de la Saskatchewan. Mémoire de maîtrise en sciences, 129 pages.
Dubé, M.G. 2000. « Sources of contaminants in the bleached kraft pulping process and their effect on the mummichog (Fundulus heteroclitus). Saint John (N.-B.), Université du Nouveau-Brunswick. Mémoire.
Dubé, M.G., et J.M. Culp. 1996. « Growth responses of periphyton and chironomids exposed to biologically treated bleached kraft pulp mill effluent », Environmental Toxicology and Chemistry, 15 : 2019-2027.
Dubé, M.G., et D.L. MacLatchy. 2000a. « Endocrine responses of an estuarine fish Fundulus heteroclitus to final effluent from a bleached kraft pulp mill before and after installation of reverse osmosis treatment of a waste stream ». Environmental Toxicology and Chemistry, 19 :2788-2796.
Dubé, M.G., et D.L. MacLatchy. 2000b. « Reverse osmosis treatment of condensates from a bleached kraft pulp mill: Effects on acute and chronic toxicity of process streams and final effluent », dans M.Ruoppa, J. Paasivirta, K.-J. Lehtinen et S. Ruonala (éd.), Proceedings of the Fourth International Conference on Environmental Impacts of the Pulp and Paper Industry. Helsinki, Finlande. Pp. 270-276.
Dubé, M.G., et D.L. MacLatchy. 2001. « Identification and treatment of a waste stream at a bleached kraft pulp mill that depresses a sex steroid in the mummichog (Fundulus heteroclitus) », Environmental Toxicology and Chemistry, 20 : 985-995.
Dubé, M.G., J.M. Culp et G.J. Scrimgeour. 1997. « Nutrient limitation and herbivory: Processes influenced by bleached kraft pulp mill effluent », Canadian Journal of Fisheries and Aquatic Sciences, 54 : 2584-2595.
Dubé,M.G., J.M. Culp, K.J. Cash, N.E. Glozier, D.L. MacLatchy, C.L. Podemski et R.B. Lowell. 2001. « Artificial streams for environmental effects monitoring (EEM): Development and application in Canada over the past decade », Water Quality Research Journal of Canada, 37 (1) : 155-180.
Dubé, M.G., J.M. Culp, D.L. MacLatchy, G. Gillis, R. Parker, S. Courtenay et C. Gilman. 2002. « Utility of mobile, field-based artificial streams for assessing effects of pulp mill effluents on fish in the Canadian Environmental Effects Monitoring (EEM) program », Journal of Aquatic Ecosystem Stress and Recovery, 9 : 85-102.
Dubé M.G., D.L. MacLatchy, B.K. Firth, J.M. Culp, N.E. Glozier et K.J. Cash. 2004. « Using mesocosms to explore confounding factors influencing longnose dace (Rhinichthys cataractae) responses to kraft mill effluent on the Wapiti River, AB, Canada », dans D.L. Borton, T.J. Hall, R.P. Fisher et J.F. Thomas (éd.), Pulp and Paper Mill Effluent Environmental Fate and Effects. Proceedings of the Fifth International Conference on Fate and Effects of Pulp and Paper Mill Effluents, June 1-4, 2003, Seattle, Washington, USA. Lancaster, (PA), DEStech Publications, pp. 481-490.
Dubé M.G., D.L. MacLatchy, J.D. Kieffer, N.E. Glozier, J.M. Culp et K.J. Cash. 2005. « Effects of metal mining effluent on Atlantic salmon (Salmo salar) and slimy sculpin (Cottus cognatus): Using mesocosms to assess existing effects and predict future consequences », Science of the Total Environment, 343 : 135-154.
Dubé M.G., D.L. MacLatchy, K.A. Hruska et N.E. Glozier. 2006. « Assessing the responses of creek chub (Semotilus atromaculatus) and pearl dace (Semotilus margarita) to metal mine effluents using in situ artificial streams in Sudbury, Ontario, Canada ». Environmental Toxicology and Chemistry, 25 (1) : 18-28.
Environment Canada. 1997. Fish Survey Working Group Final Report. Recommendations from Cycle 1 Review. Ottawa (ON): National EEM Office, Science Policy and Environmental Quality Branch, Environment Canada. EEM/1997/6.
Federal-Provincial Thompson River Task Force. 1976. Sources and Effects of Algal Growth, Colour, Foaming and Fish Tainting in the Thompson River System. Victoria (C.-B.), British Columbia Ministry of Environment, Lands and Parks, Environmental Protection Division.
Freeman, K.R., K.L. Perry, T.G. DiBacco et D.J. Scarratt. 1994. Observations on Two Mytilid Species from a Nova Scotian Mussel Rarm. Rapport technique canadien des sciences halieutiques et aquatiques, no 1969.
Fritz, E.S., W.H. Meredith et V.A. Lotrich. 1975. « Fall and winter movements and activity level of the mummichog Fundulus heteroclitus, in a tidal creek », Chesapeake Science, 16 : 211-215.
Gibbons, W.N., K.R. Munkittrick et W.D. Taylor. 1998a « Suitability of small fish species for monitoring the effects of pulp mill effluent on fish. 1. Response of spoonhead sculpin exposed to bleached kraft mill effluent », Environmental Toxicology and Chemistry, 17 (11) : 2227-2237.
Gibbons, W.N., K.R. Munkittrick, M.E. McMaster et W.D. Taylor. 1998b. « Suitability of small fish species for monitoring the effects of pulp mill effluent on fish. 2. Comparison of trout perch responses to white sucker exposed to bleached kraft mill effluent », Environmental Toxicology and Chemistry, 17 (11) : 2238-2245.
Goldberg, E.D., V.T. Bowen, J.W. Farrington, G. Harvey, J.H. Martin, P.L. Parker, R.W. Risebrough, W. Robertson, E. Schneider et E. Gamble. 1978. « The Mussel Watch », Environmental Conservation, 5 (2) : 101-125.
Gray, C., et T. Tuominen. 1998. Health of the Fraser River Aquatic Ecosystem. Vancouver (C.‑B.), Environnement Canada. DOE FRAP 1998-11, vol. I.
Green, R.H. 1979. Sampling Design and Statistical Methods for Environmental Biologists. Toronto (Ont.), John Wiley & Sons. 257 pages.
Grout, J.A., et C.D. Levings. 2000. « Effects of acid mine drainage from an abandoned copper mine, Britannia Mines, Howe Sound, British Columbia, Canada, on transplanted blue mussels (Mytilus edulis) », Marine Environmental Research, 51 (3) : 265-288.
Gulf of Maine Counccil on the Marine Environment. 1997. Gulfwatch Project: Standard Procedures – Filed and Laboratory. Gulfwatch Implementation Period 1993-2001. 115 pages.
Harries, J.E., T. Runnals, E. Hill, C.A. Harris, S. Maddix, J.P. Sumpter et C.R. Tyler. 2000. « Development of a reproductive performance test for endocrine disrupting chemicals using pair breeding fathead minnows (Pimephales promelas) », Environmental Science & Technology,34 : 3003-3011.
Heins, D.C., et F.G. Rabito Jr. 1986. « Spawning performance in North American minnows: Direct evidence of the occurrence of multiple clutches in the genus Notropis », Journal of Fish Biology, 28 : 343-357.
Hinch, S.G., L.J. Kelly et R.H. Green.1989. « Morphological variation of Elliptio complanata (Bivalvia: Unionidae) in differing substrata of soft-water lakes exposed to acidic deposition », Canadian Journal of Zoology, 67 :1895-1899.
Hornbach, D.J., T.H. Wissing et A.J. Burky. 1982. « Life-history characteristics of a stream population of the freshwater clam Sphaerium striatinum Lamarck (Bivalvia: Pisidiidae) », Canadian Journal of Zoology, 60 : 249‑260.
Hruska, K., et M.G. Dubé. 2004. « Using artificial streams to assess the effects of metal-mining effluent on the life-cycle of the freshwater midge (Chironomus tentans) in situ », Environmental Toxicology and Chemistry, 23 (11) : 2709-2718.
Hruska, K., et M.G. Dubé. 2005. « Comparison of a partial life cycle bioassay in artificial streams to a standard beaker bioassay to assess effects of metal mine effluent on Chironomus tentans », Environmental Toxicology and Chemistry, 24 (9) : 2325-2335.
Hurlbert, S.H. 1984. « Pseudoreplication and the design of ecological field experiments », Ecological Monographs, 54 : 187-211.
Jadhav, M.L., et V.S. Lomte. 1982. « Seasonal variation in biochemical composition of the freshwater bivalve, Lamellidens corrianus ». Rivista di Idrobiologia, 21 : 1-7.
Jenkins, R.E., et N.M. Burkhead. 1993. Freshwater Fishes of Virginia. Bethesda (ML), American Fisheries Society. 1079 pages.
Jensen, K.M., J.J. Korte, M.D. Kahl, M.S. Pasha et G.T. Ankley. 2001. « Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas) », Comparative Biochemistry and Physiology – Part C, 128 : 127-141.
Jensen, K.M., M.D. Kahl, E.A. Makynen, J.J. Korte, R.L. Leino, B.C. Butterworth et G.T. Ankley. 2004. « Characterization of responses to the antiandrogen flutamide in a short-term reproduction assay with the fathead minnow », Aquatic Toxicology, 70 : 99-110.
Jernelov, A. 1996. « The International Mussel Watch: A global assessment of environmental levels of chemical contaminants », Science of the Total Environment, 188 (Suppl. 1) : 37-44.
Kneib, R.T. 1986. « The role of Fundulus heteroclitus in salt marsh trophic dynamics », American Zoologist,26 : 259-269.
Kneib, R.T., et A.E. Stiven. 1978. « Growth, reproduction, and feeding of Fundulus heteroclitus (L.) on a North Carolina salt marsh », Journal of Experimental Marine Biology and Ecology,31 : 121-140.
Leblanc, J., et C.M. Couillard. 1995. Description de la période de reproduction d'un poisson sentinelle : le choquemort (Fundulus heteroclitus) de l'estuaire de la Miramichi. Rapport technique canadien des sciences halieutiques et aquatiques, no 2057, vii + 32 pages.
Lowell, R.B., J.M. Culp et F.J. Wrona. 1995. « Stimulation of increased short-term growth and development of mayflies by pulp mill effluent », Environmental Toxicology and Chemistry, 14 : 1529-1541.
Lowell, R.B., J.M. Culp, F.J. Wrona et M.L. Bothwell. 1996. « Effects of pulp mill effluent on benthic freshwater invertebrates: Food availability and stimulation of increased growth and development », dans M.R. Servos, K.R. Munkittrick, J.H. Carey et G.J. Van Der Kraak (éd.), Environmental Fate and Effects of Pulp and Paper Mill Effluents. Delay Beach (FL),St. Lucie Press. Pp.525-532.
Lowell, R.B., J.M. Culp et M.G. Dubé. 2000. « A weight-of-evidence approach for northern river risk assessment: integrating the effects of multiple stressors », Environmental Toxicology and Chemistry, 19 : 1182-1190.
Mackie, G.L. 1978a. « Shell structure in freshwater Sphaeriaceae. (Bivalvia: Heterondonta) ». Canadian Journal of Zoology, 56 : 1-6.
Mackie, G.L. 1978b. « Are sphaeriid clams ovoviviparous or viviparous? », The Nautilus, 92 : 145-147.
Mackie, G.L., et L.A. Flippance. 1983. « Growth dynamics in Sphaerium rhomboideum (Bivalvia: Pisidiidae) », Canadian Journal of Zoology, 61 : 868-873.
Mackie, G.L., S.U. Quadri et A.H. Clarke. 1974. « Development of brood sacs in Musculium securis Bivalvia: Sphaeriidae », Nautilus, 88 : 109-111.
Mallet, A.L., et C.E. Carver. 1995. « Comparative growth and survival patterns of Mytilus trossulus and Mytilus edulis in Atlantic Canada », Journal canadien des sciences halieutiques et aquatiques, 52 : 1873-1880.
Malley, D.F., A.R. Stewart et B.D. Hall. 1996. « Uptake of methyl mercury by the floater mussel, Pyganodon grandis (Bivalvia, Unionidae), caged in a flooded wetland », Environmental Toxicology and Chemistry, 15 : 928-936.
Martel, P., T. Kovacs et R. Voss. 2003. « Survey of pulp and paper mill effluents for their potential to affect fish reproduction ». Proceedings of the Fifth International Conference on the Fate and Effects of Pulp and Paper Mill Effluents, Seattle, Washington, USA, June 1-4. Pp. 78‑91.
Mason, R.P., J.M. Laporte et S. Andres. 2000. « Factors controlling the bioaccumulation of mercury, methylmercury, arsenic, selenium and cadmium by freshwater invertebrates and fish ». Archives of Environmental Contamination and Toxicology, 38 : 283-297.
McDonald, J.H., R. Seed et R.K. Koehn. 1991. « Allozymes and morphometric characteristics of three species of Mytilus in the northern and southern hemispheres », Marine Biology, 11 : 323‑333.
McGreer, E.R., et W. Belzer. 1998. « Contaminant sources », dans C. Gray et T. Tuominen (éd.), Health of the Fraser River Aquatic Ecosystem. Ottawa (Ont.), Environnement Canada. Vol. I. DOE FRAP 1998-11, vol. I, pp. 7-22.
McMahon, R.F. 1991. « Mollusca: Bivalvia », dans J.H. Thorp et A.P. Covich (éd.), Ecology and Classification of North American Freshwater Invertebrates. San Diego (CA), Academic Press. Pp. 315-399.
Metcalfe-Smith, J.L., R.H. Green et L.C. Grapentine. 1996. « Influence of biological factors on concentrations of metals in the tissues of freshwater mussels (Elliptio complanata and Lampsilis radiata radiata) from the St. Lawrence River », Journal canadien des sciences halieutiques et aquatiques, 53 : 205-219.
Mucklow, L.C. 1996. « Effects of season and species on physiological condition and contaminant burdens in mussels (Mytilus edulis L. and Mytilus trossulus G.): Implications for mussel watch programs ». Halifax (N.-É.), Université de Dalhousie, School for Resource and Environmental Studies. Mémoire de maîtrise.
Nelson, J.S., et M.J. Paetz. 1992. The Fishes of Alberta. Calgary (Alb.), The University of Calgary Press.
Newell, R.I.E. 1989. Species Profile of the Blue Mussel, Mytilus edulis. U.S. Fish and Wildlife Service Biological Report 82(11), 40 pages.
Ni, I.H., W.X. Wang et Y.K. Tam. 2000. « Transfer of Cd, Cr and Zn from zooplankton prey to mudskipper Periophthalmus cantonensis and glassy Ambassis urotaenia fishes », Marine Ecology Progress Series,194 : 203-210
O’Connor, T.P. 1992. Recent Trends in Coastal Environmental Quality: Results from the First Five Years of the NOAA Mussel Watch Project. Washington, DC. U.S. Department of Commerce, National Oceanic and Atmospheric Administration (NOAA), National Ocean Service.
OCDE – Organisation de coopération et de développement économiques. 2001. Detailed Review Paper: Appraisal of Test Methods for Sex Hormone Disrupting Chemicals. OECD Series on Testing and Assessment No. 21. ENV/JM/MONO(2002)8.
OCDE – Organisation de coopération et de développement économiques . 2006. Report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances (Phase 1B). OECD Series on Testing and Assessment No. 61:ENV/JM/MONO(2006)29.
Paine, M.D. 1990. « Life history tactics of darters (Percidae: Etheostomatiini) and their relationship with body size, reproductive behaviour, latitude and rarity », Journal of Fish Biology, 37 : 473-488.
Paine, M.D. 2000. « EEM Design ». Bref cours présenté au 27th Annual Aquatic Toxicity Workshop, du 1er au 4 octobre, St. John’s, Terre-Neuve.
Panter, G.H., T.H. Hutchinson, R. Lange, C.M. Lye, J.P. Sumpter, M. Zerulla et C.R. Tyler. 2002. « Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances », Environmental Toxicology and Chemistry, 21 (2) : 319-326.
Parker, R., et N. Smith. 1997. « A synopsis of the results of environmental effects monitoring studies at 19 pulp and paper mills in Atlantic Canada », Proceedings of the Third International Conference on Environmental Effects of Pulp and Paper Mill Effluents. Rotorua, Nouvelle-Zélande. Pp. 432-441.
Parrott, J.L. 2005. « Overview of methodology and endpoints in fathead minnow lifecycle tests assessing pulp and paper mill effluents », Water Quality Research Journal of Canada, 40 : 334‑346.
Parrott, J.L., et C.S. Wood. 2001. « Fathead minnow lifecycle tests for detection of endocrine disrupting substances in effluents », Water Quality Research Journal of Canada,37 : 651-667.
Penney, R.W., M.J. Hart et N. Templeman. 2002. « Comparative growth of cultured blue mussels, Mytilus edulis, M. trossulus and their hybrids, in naturally occurring mixed-species stocks », Aquaculture Research, 33 : 693-702.
Podemski, C.L. 1999. « Ecological effects of a bleached kraft pulp mill effluent on benthic biota of the Athabasca River ». Saskatoon (Sask.), Université de Saskatchewan. Thèse de doctorat, 292 pages.
Podemski C.L., et J.M. Culp. 1996. « Nutrient and contaminant effects of bleached kraft mill effluent on benthic algae and insects of the Athabasca River »dans M.R. Servos, K.R. Munkittrick, J.H. Carey et G.J. Van Der Kraak (éd.), Environmental Fate and Effects of Pulp and Paper Mill Effluents. Delay Beach (FL), St. Lucie Press. Pp. 571-580.
Pollock, M.S., S.E. Fisher, A.J. Squires, R.J. Pollock, D.P. Chivers et M.G. Dubé. 2008. « Relative body size influences breeding propensity in fathead minnows: Implication for ecotoxicology testing procedures », Water Quality Research Journal of Canada, 43 (4) : 257‑264.
Pollock, M.S., M.G. Dubé, J. LaPorte, L. Clarke et R. Schryer. 2009. « Investigating the link between pulp mill effluent and endocrine disruption: Attempts to explain the presence of male and female hermaphrodites in the Wabigoon River, Ontario », Environmental Toxicology and Chemistry, 29 (4) : 952-965.
Portt, C.B., G.A. Coker, D.L. Ming et R.G. Randall. 2006. A Review of Fish Sampling Methods Commonly Used in Canadian Freshwater Habitats. Rapport technique canadien des sciences halieutiques et aquatiques no 2604. Ottawa (Ont.), Pêches et Océans Canada. Cat. no Fs97-6/2604E.
Ramón, M., et C.A. Richardson. 1992. « Age determination and shell growth of Chamelea gallina (Bivalvia: Veneridae) in the western Mediterranean », Marine Ecology Progress Series, 89 : 15‑23.
Rawson, P.D., C. Slaughter et P.O. Yund. 2003. « Patterns of gamete incompatibility between the blue mussels Mytilus edulis and M. trossulus », Marine Biology, 143 : 317-325.
Rees, H.L. 1984. « A note on mesh selection and sampling efficiency in benthic studies », Marine Pollution Bulletin, 15 : 225-229.
Resh, V.H., et E.P. McElravy. 1993. « Contemporary quantitative approaches to biomonitoring using benthic macroinvertebrates », dans D.M. Rosenberg et V.H. Resh (éd.), Freshwater Biomonitoring and Benthic Invertebrates. New York (NY), Chapman & Hall. Pp.159-194.
Ricker, W.E. 1980. Calcul et interprétation des statistiques biologiques des populations de poissons. Bulletin 191F. Ottawa (Ont.), Ministère des Pêches et des Océans, Office des recherches sur les pêcheries du Canada.
Rickwood, C.J., M.D. Dubé, L.M. Hewitt, T. Kovacs, J.L. Parrott et D.L. MacLatchy. 2006a. « Use of paired fathead minnow (Pimephales promelas) reproductive test: Part I. Assessing biological effects of final bleached kraft pulp mill effluent using a mobile bioassay trailer system », Environmental Toxicology and Chemistry, 25 : 191-201.
Rickwood, C.J., M.D. Dubé, L.M. Hewitt, T. Kovacs, J.L. Parrott et D.L. MacLatchy. 2006b. « Use of paired fathead minnow (Pimephales promelas) reproductive test: Part II. Source identification of biological effects at a bleached kraft pulp mill », Environmental Toxicology and Chemistry, 25 : 202-211.
Rickwood, C.J., M.D. Dubé, L.P. Weber, K. Driedger et D.M. Janz. 2006c. « Assessing effects of metal mining effluent on fathead minnow (Pimephales promelas) reproduction in a trophic-transfer system », Environmental Science & Technology, 40 : 6489-6497.
Rickwood, C.J., M.D. Dubé, L.P. Weber, S. Lux et D.M. Janz. 2007. « Assessing effects of a mining and municipal sewage effluent mixture on fathead minnow (Pimephales promelas) reproduction using a novel, field-based trophic-transfer artificial stream », Aquatic Toxicology, 86 (2) : 272-286.
Roberts, W.E. 1988. « The sculpins of Alberta », Alberta Naturalist, 18 : 121-127.
Salazar, M.H., et S.M. Salazar. 1995. « In situ bioassays using transplanted mussels: I. Estimating chemical exposure and bioeffects with bioaccumulation and growth », dans J.S. Hughes, G.R. Biddinger et E. Mones (éd.), Environmental Toxicology and Risk Assessment – Third Volume. Philadephia (PA), American Society for Testing and Materials (ASTM). Pp. 216‑241.
Salazar, M.H., et S.M. Salazar. 2000. Standard Guide for Conducting In-Situ Field Bioassays with Caged Marine, Estuarine and Freshwater Bivalves. Philadephia (PA), American Society for Testing and Materials (ASTM).
Sandusky, M.J., et R.E. Sparks. 1979. « Investigations of declines in fingernail clam (Musculium transversum) populations in the Illinois River and Pool 19 of the Mississippi River », Bulletin of the American Malacological Union Inc., 1979 : 11-16.
Scherrer, B. 1984. Biostatistique. Québec (Qué.), Gaëtan Morin.
Scott, W.B. 1967. Freshwater Fishes of Eastern Canada. Toronto (Ont.), University of Toronto Press. 137 pages.
Scott, W.B., et E.J. Crossman. 1974. Les poissons d’eau douce du Canada. Ottawa (Ont.), Environnement Canada, Service des pêches et des sciences de la mer. Bulletin de l’Office des recherches sur les pêcheries du Canada, no 184, 966 pages.
Scott, W.B., et M.G. Scott. 1988. « Atlantic fishes of Canada », Bulletin canadien des sciences halieutiques et aquatiques, 219 : 314-316.
Scrimgeour, G.J., J.M. Culp et N.E. Glozier. 1993. « An improved technique for sampling lotic invertebrates », Hydrobiologia, 254 : 65-71.
Seed, R. 1968. « Factors influencing shell shape in Mytilus edulis L. », Journal of the Marine Biological Association of the United Kingdom, 48 : 561-584
Sejr, M., K.T. Jensen et S. Rysgaard. 2002. « Annual growth bands in the bivalve Hiatella arctica validated by a mark-recapture study in NE Greenland », Polar Biology, 25 : 794-796.
Shaw, J.L., S.J. Maund, S.J. Marshall et I.R. Hill. 1995a. « Fathead Minnow (Pimephales promelas) reproduction in outdoor microcosms: an assessment of the ecological effects of fish density », Environmental Toxicology and Chemistry, 14 (10) : 1763-1772.
Shaw, J.L., S.J. Maund et I.R. Hill. 1995b. « Fathead Minnow reproduction in outdoor microcosms: A comparison to bluegill sunfish reproduction in large mesocosms », Environmental Toxicology and Chemistry, 14 (10) : 1753-1762.
Skidmore, D.A., et K.K. Chew. 1985. Mussel Aquaculture in Puget Sound. Seattle (WA), Washington Sea Grant Report. WSG 85-4.
Slack, K.V., R.C. Averett, P.E. Geeson et R.G. Lipscomb. 1973. « Methods for collection and analysis of aquatic biological and microbiological samples », Techniques of Water-resources Investigations of the United States Geological Survey. Washington (DC), U.S. Department of the Interior, Geological Survey. Chapter 4A, Book 5, pp. 1-165.
Sohoni, P., C.R. Typer, K. Hurd, J. Caunter, M. Hetheridge, T. Williams, M. Evans, R. Toy, M. Gargas et J.P. Sumpter. 2001. « Reproductive effects of long-term exposure to bisphenol a in the fathead minnow (Pimephales promelas) », Environmental Science & Technology,35 : 2917‑2925.
Stephenson, M., et G.L. Mackie. 1981. « Effects of 2, 4-D treatment on growth and survival of fingernail clams (Bivalvia: Pisidiidae) in artificial pond ecosystems », American Malacological Union Bulletin, 1981 : 19-22.
Stewart, P. L. 1994. Environmental requirements of the Blue Mussel (Mytilus edulis) in eastern Canada and its response to human impacts. Canadian Technical Report of Fisheries and Aquatic Science, 2004.
Stewart, R., et D.F. Malley. 1997. Technical Evaluation of Molluscs as a Biomonitoring Tool for the Canadian Mining Industry. Aquatic Effects Technology Evaluation (AETE) Program Project 2.3.1. Subventionné par le Centre canadien de la technologie des minéraux et de l’énergie (CANMET) et l’Association minière du Canada (AMC).
St-Jean, S.D. 2003. Supplemental Techniques for Cage Bivalve. Contribution No. 03‑422. Burlington (Ont.), Environnement Canada, Institut national de recherche sur les eaux.
St-Jean, S.D., S.C. Courtenay et R.W. Parker. 2003. « Immunomodulation in blue mussels (Mytilus edulis) exposed to a pulp and paper mill effluent in Eastern Canada », Water Quality Research Journal of Canada, 38 (4) : 647-666.
St-Jean, S.D., R.E. Stephens, S.C. Courtenay et C.L. Reinisch. 2005. « Detecting p53 family proteins in hemocytic leukemia cells of Mytilus edulis from Pictou Harbour, Nova Scotia », Journal canadien des sciences halieutiques et aquatiques, 62 : 2055-2066.
St-Jean, S.D., S.C. Courtenay, C. Coomber et F. Bishay. 2008. « Responses to environmental stressors of wild vs. caged mussels », EEM Science Symposium, Gatineau, Quebec, 29-30 April, 2008.
Suess, M.J. 1982. Examination of Water for Pollution Control. A Reference Handbook. Vol. 3. Biological, Bacteriological and Virological Examination. Oxford, Angleterre, Permagon Press.
Toro, J.E., R.J. Thompson et D.J. Innes. 2002. « Reproductive isolation and reproductive output in two sympatric mussels species (Mytilus edulis, M. trossulus) and their hybrids from Newfoundland », Marine Biology, 141 : 897-909.
U.S.EPA – United States Environmental Protection Agency. 1982. User’s Guide for Conducting Life-cycle Chronic Toxicity Tests with Fathead Minnows (Pimephales promelas). Duluth (MN), Environmental Research Laboratory. EPA/600/8-81/011.
U.S.EPA – United States Environmental Protection Agency. 1996. Prehatching Development of the Fathead Minnow Pimephales promelas. Washington (DC). EPA/600/R-96/079.
U.S.EPA – United States Environmental Protection Agency. 1999. Screening Level Reproduction Assay with the Fathead Minnow (Pimephales promelas). Duluth (MN), Environmental Research Laboratory. EPA-NEERL-DUL 3544.
U.S.EPA – United States Environmental Protection Agency. 2002. Comparative Evaluation of Fathead Minnow Assays for Detecting Endocrine Disrupting Chemicals. Washington (DC), Endocrine Disruptor Screening Program. EPA/68/W-01/023.
U.S.EPA – United States Environmental Protection Agency. 2007. Short Term Test Method for Assessing the Reproductive Toxicity of Endrocrine-Disrupting Chemicals Using the Fathead Minnow (Pimephales promelas). Report No. 600R01067.
Varvio S.-L., R.K. Koehn et R. Vkinola. 1988. « Evolutionary genetics of the Mytilus edulis complex in the North Atlantic region », Marine Biology, 98 : 51-60.
Waldock, M.J., J.E. Thain et M.E. Waite. 1996. « An assessment of the value of shell thickening in Crassostrea gigas as an indicator of exposure to tributyltin », dans M.A. Champ et P.F. Seligman (éd.), Tributyltin: Environmental Fate and Effects. Londres, Angleterre, Chapman and Hall. Pp. 219-237.
Weber, C.I. 1973. Biological Field and Laboratory Methods for Measuring the Quality of Surface Waters and Effluents. Cincinnati (OH), United States Environmental Protection Agency. EPA-670/4-73-001.
Wiederholm, T. 1980. « Use of benthos in lake monitoring », Journal Water Pollution Control Federation, 52 : 537-547.
Williams, J.D., M.L. Warren Jr, K.S. Cummings, J.L.Harris et R.J. Neves. 1993. « Conservation status of freshwater mussels of the United States and Canada ». Fisheries, 18 (9) : 6-22.
Wolfe, B.A., M.J. Burkhard, S. Leavell, R.B. Weiss, K. Kuehnl, H. Valentine et G.T. Watters. 2009. « Health and stress assessment in freshwater mussels following translocation to a captive setting », Proceedings of the International Symposium of the Freshwater Mollusk Conservation Society, 19-24 April 2009, Baltimore, Maryland. p. 37.
Wrona, F.J.,J.M. Culp et R.W. Davies. 1982. « Macroinvertebrate subsampling: A simplified apparatus and approach », Journal canadien des sciences halieutiques et aquatiques, 39 : 1051‑1054.
Xu, Y., et W.X. Wang. 2002. « Exposure and potential food chain transfer factor of Cd, Se and Zn in marine fish Lutjanus argentimaculatus », Marine Ecology Progress Series, 238 : 173-186.
Zar, J.H. 1999. Biostatistical Analysis. Fourth Edition. Upper Saddle River (NJ), Prentice Hall.
Figures et tableaux
Le tableau 9-1 présente un sommaire des applications de systèmes de bassins artificiels ayant servi à l’évaluation des effets des effluents des fabriques de pâtes et papiers et des effluents miniers sur les écosystèmes aquatiques, conformément au programme canadien de suivi des effets sur l’environnement. Le sommaire comprend des renseignements sur l’année, le programme, le type d’effluent, l’objectif de la recherche, le lieu, le système de bassins artificiels et les références.
La figure 9-1 est une série de trois photographies. L’image A illustre un grand système de mésocosmes à bassins artificiels installés sur des tables (modèle I), utilisé pour l’étude sur la rivière Athabasca (Alberta). L’image B présente un grand système mobile de mésocosmes à bassins artificiels montés sur deux remorques (modèle II), utilisé pour les études sur le fleuve Fraser (Colombie-Britannique), le fleuve Saint-Jean (Nouveau-Brunswick) et le port de Saint John (Nouveau-Brunswick). L’image C présente un grand système mobile de mésocosmes à bassins artificiels montés sur une seule remorque (modèle III), utilisé pour les études sur les rivières Miramichi et Little (Nouveau-Brunswick), la rivière Wapiti (Alberta) et le ruisseau Junction (Ontario).
La figure 9-2 comporte deux séries de photographies. L’image A illustre un petit système de microcosmes à bassins artificiels installés sur des tables surplombant les réservoirs de mélange, utilisé pour l’étude sur la rivière Thompson (Colombie-Britannique). L’image B présente un système de mésocosmes modulaire à bassins artificiels installés sur des tables surplombant les réservoirs de mélange, utilisé pour les études sur la rivière Little (Nouveau-Brunswick), le ruisseau Junction (Ontario), la rivière Wabigoon (Ontario) et à Key Lake (Saskatchewan).
La figure 9-3 est une représentation schématique d’un grand système de mésocosmes sur remorque.
La figure 9-4 est une photographie de l’installation d’un mésocosme modulaire.
La figure 9-5 représente le schéma de circulation d’un mésocosme modulaire.
La figure 9-6 est une photographie d’un bioessai multitrophique de la reproduction du Méné à grosse tête. Une barrière d’alimentation permet aux cultures d’invertébrés benthiques de se développer dans des conditions expérimentales, tout en contrôlant l’accès des poissons qui se trouvent au-dessus.
La figure 9-7 est une série de trois photographies qui illustrent l’installation sur le terrain de mésocosmes modulaires.
La figure 9-8 est un modèle conceptuel composé de deux images (images A et B). L’image A présente le protocole expérimental factoriel visant à examiner l’importance relative du milieu aquatique et du régime alimentaire en ce qui a trait aux réactions du Méné à grosse tête aux effluents miniers dans des mésocosmes modulaires. L’image B présente le protocole expérimental servant à examiner l’incidence du pH et des matières organiques naturelles (MON) sur les réactions du Méné à grosse tête exposé à un mélange d’effluents miniers et à un seul métal dans des mésocosmes multitrophiques modulaires.
La figure 9-9 est un modèle conceptuel illustrant un protocole expérimental factoriel visant à étudier les effets d’un effluent minier et de la contamination historique des sédiments séparément ou en combinaison sur le Méné à grosse tête dans des mésocosmes modulaires.
Le tableau 9-2 présente les indicateurs et les critères d’effets des études de poissons en mésocosmes, ainsi que les tests statistiques associés. Les principaux indicateurs d’effets comprennent la croissance, la reproduction, la condition et la survie.
Le tableau 9-3 présente les variables réponses recommandées, les informations complémentaires utiles et les analyses statistiques suggérées pour les systèmes à mésocosmes modulaires utilisant le Méné à grosse tête. Les principaux renseignements présentés comprennent le type de réponse, la variable réponse, la variable dépendante, la variable indépendante, la covariable, la méthode statistique à un facteur et la méthode statistique à deux facteurs.
La figure 9-10 est une photographie d’une moule présentant un lobe du manteau à maturité.
La figure 9-11 présente deux graphiques illustrant le cycle reproducteur de la Moule bleue de Colombie-Britannique (graphiques A et B). Le graphique A montre la teneur en glycogène (en mg/g) pour illustrer le stockage de l’énergie dans le manteau, en fonction de la date (de février à octobre). Le graphique B présente les fractions volumétriques de gamètes comme mesure de la teneur en matériel de reproduction, en fonction de la date (de février à novembre).
Le tableau 9-4 présente les taxons suggérés pour les études de bivalves en cage menées dans le cadre des études de suivi des effets sur l’environnement. Les principaux renseignements présentés comprennent les espèces et les références, la plage de températures (en Celsius), la plage de salinité (en parties par millier), les données sur la reproduction et la répartition générale au Canada.
Le tableau 9-5 présente les différences observées entre deux espèces de moules au cours d’une étude de cinq ans menées dans l’inlet Burrard, à Vancouver (Colombie-Britannique). Les principaux renseignements indiqués comprennent les différences en lien avec la croissance, la survie, la fécondité, la reproduction, la relation entre la production d’œufs et le stockage d’énergie, la vulnérabilité à la leucémie et l’utilité dans les essais.
Le tableau 9-6 présente les différences observées entre les unionidés et les sphaeriidés. Les principaux renseignements présentés comprennent les différences en lien avec la croissance, la durée de vie, la fécondité, la reproduction, la relation entre la production d’œufs et le stockage d’énergie, l’âge à maturité et l’utilité dans les études.
La figure 9-12 illustre les impressions musculaires dans une coquille de Mytilus spp. Les marques sont identifiées par des chiffres. Le chiffre 1 représente la longueur de l’impression du muscle adducteur antérieur, le chiffre 2 représente la longueur de la charnière, le chiffre 3 représente la longueur de l’impression du muscle adducteur postérieur, le chiffre 4 représente la distance entre le bord postérieur de l’impression du muscle adducteur postérieur et le bord postérieur de la coquille, le chiffre 5 représente la distance entre le bord ventral de l’impression du muscle adducteur postérieur et le bord ventral de la coquille, le chiffre 6 représente la largeur de la coquille et le chiffre 7 représente la hauteur de la coquille.
La figure 9-13 est une photographie d’un cadre utilisé pour les essais d’exposition des bivalves. Le cadre en PVC, le cadre d’aluminium en « H » et un groupe de bivalves disposés en boudins sont identifiés sur l’image.
La figure 9-14 est un diagramme des éléments du système modulaire de mésocosmes.
La figure 9-15 représente le schéma d’assemblage du système modulaire de mésocosmes. L’image présente une vue verticale et une vue plane de l’assemblage.
Le tableau 9-7 présente les indicateurs et les critères d’effets pour les études de bivalves en cage et les tests statistiques associés. Les principaux indicateurs d’effets comprennent la croissance, la reproduction, la condition et la survie.
La figure 9-16 comporte deux photographies. La photographie A présente un échantillon de manteau et les outils nécessaires pour son prélèvement, alors que la photographie B présente l’échantillon de manteau homogénéisé et prêt à l’analyse.
Le tableau 9-8 présente un exemple de fiche de données de terrain pour consigner les données brutes sur la survie et la croissance. Les renseignements requis comprennent le numéro de l’animal, la longueur, la hauteur, la largeur, le poids humide de l’animal entier, le poids humide du manteau, le poids sec de l’animal entier, le poids sec du manteau et le poids sec de la coquille.
Retournez à la table des matières
Chapitre 10
10. Gestion de l'information et rapports d'interprétation
10.1 Transmission électronique
10.2 Rapports d’interprétation
10. Gestion de l'information et rapports d'interprétation
Des rapports sur les études de suivi des effets sur l’environnement (ESEE) doivent être soumis électroniquement, selon le modèle fourni par Environnement Canada, conformément à l’article 23 du Règlement sur les effluents des mines de métaux (REMM). Les rapports doivent être soumis par écrit à l’agent d’autorisation si aucun modèle électronique n’est fourni ou s’il est impossible de l’utiliser. Les sections du présent chapitre procurent des renseignements additionnels sur la présentation des différents rapports d’ESEE.
Le REMM indique les dates prescrites pour la soumission des données et des rapports, et le chapitre 1 du présent guide contient des informations additionnelles sur les exigences entourant la production de rapports. Les coordonnées des agents d’autorisation ainsi que des coordonnateurs des ESEE sont affichées sur le site Web suivant : http://www.ec.gc.ca/esee-eem/default.asp?lang=Fr&n=92476010-1.
10.1 Transmission électronique
10.1.1 Suivi de l’effluent et de la qualité de l’eau
Environnement Canada a instauré le Système informatique de transmission des données réglementaires (SITDR) permettant la production et la transmission électroniques de rapports sur les études de suivi de l’effluent et de la qualité de l’eau (caractérisation de l’effluent, essais de toxicité sublétale et suivi de la qualité de l’eau). Le SITDR se trouve sur Internet à la page Web suivante : https://www.riss-sitdr.ec.gc.ca/riss/Global/Index.aspx. Pour les exigences en matière de rapports qui ne sont pas prises en charge par le SITDR, il faut soumettre une copie papier à Environnement Canada. Ces exigences incluent les méthodologies utilisées pour effectuer la caractérisation de l’effluent et le suivi de la qualité de l’eau, ainsi que les mesures d’assurance et de contrôle de la qualité mises en œuvre et les données correspondant à ces mesures.
Le rapport des études de suivi de l’effluent et de la qualité de l’eau doit être soumis à l’agent d’autorisation au plus tard le 31 mars de chaque année (annexe 5, article 8 du REMM). Le chapitre 5 donne de l’information sur le contenu du rapport des études de suivi de l’effluent et de la qualité de l’eau.
10.1.2 Suivi biologique
Actuellement, les données des études de suivi biologique doivent être soumises à Environnement Canada à l’aide d’un modèle standard en format Excel. Le fichier Excel contenant le modèle standard dûment rempli devra être transmis au Bureau national des ESEE (eem-esee@ec.gc.ca) ainsi qu’au coordonnateur régional attitré. Les données de suivi biologique provenant des études standard et les données issues des volets des études portant sur l’ampleur et la portée géographique des effets ou sur la recherche des causes qui peuvent être intégrées au modèle standard en format Excel devront être soumises par voie électronique. Par exemple, si une étude sur des populations adultes de poissons est réalisée dans le cadre d’une étude sur la recherche des causes, les données de cette étude devront être transmises par voie électronique au moyen du modèle standard en format Excel. Le logiciel auparavant utilisé pour la saisie électronique des données de suivi biologique des ESEE (c’est-à-dire la version 2.1 du logiciel de saisie des données de suivi biologique des ESEE des mines de métaux) est présentement mis à niveau. En attendant que la mise à niveau du logiciel de production de rapports soit terminée, le modèle standard en format Excel, ainsi que les instructions de saisie de données, se trouvent à l’adresse : http://www.ec.gc.ca/esee-eem/default.asp?lang=Fr&n=2EEF6671-1.
10.2 Rapports d’interprétation
Des rapports d’interprétation sont soumis à l’agent d’autorisation. Comme certains des renseignements à intégrer aux rapports d’interprétation ne sont pas pris en charge par le modèle électronique fourni par Environnement Canada (p. ex., les cartes), ces rapports devraient être soumis en format papier.
Le premier rapport d’interprétation doit être soumis au plus tard 30 mois après la date à laquelle la mine est assujettie au REMM, ou au plus tard 42 mois après la date à laquelle la mine est assujettie au REMM si des données ont déjà été soumises (annexe 5, article 18 du REMM). Les rapports d’interprétation suivants doivent être soumis 24, 36 ou 72 mois après la journée à laquelle le plus récent rapport d’interprétation devait être soumis, selon les résultats des études précédentes (annexe 5, article 22 du REMM). Le rapport d’interprétation final doit être soumis à l’agent d’autorisation au plus tard 36 mois après le jour où l’avis de fermeture de la mine a été fourni (annexe 5, article 26 du REMM). Des renseignements supplémentaires concernant la fréquence de présentation des rapports se trouvent au chapitre 1.
10.2.1 Contenu du rapport d’interprétation
Les renseignements à inclure dans les rapports d’interprétation varient selon le type d’étude de suivi biologique réalisée (annexe 5, articles 17, 21 et 25 du REMM). Les exigences en matière de rapports pour les divers types d’études de suivi biologique sont indiquées ci-dessous.
Il se peut qu’une mine réalise différents types d’études sur des poissons et des invertébrés benthiques en même temps (consulter le chapitre 1 pour de plus amples détails). Le rapport d’interprétation fournirait alors des renseignements concernant ces différentes études.
10.2.1.1 Rapport d’interprétation des études de suivi biologique standard pour évaluer les effets
Le rapport d’interprétation d’une étude de suivi biologique standard visant à évaluer les effets doit contenir les renseignements suivants (annexe 5, article 17 du REMM) :
- une description des écarts par rapport au plan d’étude qui se sont produits durant les études de suivi biologique et l’incidence de ces écarts sur les études;
- la latitude et la longitude des zones d’échantillonnage exprimées en degrés, en minutes et en secondes, et une description des zones d’échantillonnage permettant de les localiser;
- les dates et les heures de prélèvement des échantillons;
- la taille des échantillons;
- les résultats de l’analyse des données des études sur la communauté d’invertébrés benthiques ainsi que les données brutes à l’appui, incluant la moyenne, la médiane, l’écart-type, l’erreur-type ainsi que les valeurs minimales et les valeurs maximales pour les indicateurs suivants :
- la densité totale des invertébrés benthiques,
- la richesse des taxons,
- l’indice de régularité (de Simpson),
- l’indice de similarité (Bray-Curtis),
- la teneur en carbone organique total des sédiments et la distribution granulométrique des sédiments (seulement si l’étude sur la communauté d’invertébrés benthiques est effectuée dans un secteur où il est possible de prendre des échantillons de sédiments);
- les résultats de l’évaluation des données ainsi que les données brutes à l’appui de l’étude sur les populations de poissons, incluant la moyenne, la médiane, l’écart-type, l’erreur-type ainsi que les valeurs minimales et les valeurs maximales pour les indicateurs de la croissance, de la reproduction, de la condition et de la survie incluant, le cas échéant, les mesures de la longueur, le poids corporel total et l’âge des poissons, le poids du foie ou de l’hépatopancréas et, dans le cas de poissons ayant atteint la maturité sexuelle, le poids des œufs, la fécondité, ainsi que le poids des gonades de poissons;
- les résultats de l’évaluation des données ainsi que les données brutes à l’appui de l’analyse des tissus de poissons, incluant la moyenne, la médiane, l’écart-type, l’erreur-type ainsi que les valeurs minimales et les valeurs maximales pour la concentration totale de mercure dans les tissus de poissons (poids frais);
- l’indication du sexe des poissons et de la présence de lésions, de tumeurs, de parasites ou d’autres anomalies;
- les résultats de l’analyse statistique réalisée afin de déterminer s’il existe une différence statistiquement significative entre les zones d’échantillonnage pour les indicateurs mentionnés précédemment, ainsi que la probabilité de détection correcte d’un effet d’une ampleur prédéterminée, incluant le degré de confiance pouvant être accordé aux calculs;
- l’indication de tout effet :
- sur les populations de poissons,
- sur les tissus de poissons,
- sur la communauté d’invertébrés benthiques;
- un résumé des résultats de la caractérisation de l’effluent, des essais de toxicité sublétale et du suivi de la qualité de l’eau;
- les conclusions des études de suivi biologique, qui tiennent compte :
- des résultats de l’analyse statistique des données sur les populations de poissons et sur la communauté d’invertébrés benthiques;
- de la probabilité de détection correcte d’un effet d’une ampleur prédéterminée (analyse de puissance) et du degré de confiance pouvant être accordé aux calculs;
- des résultats de toute étude de suivi biologique antérieure;
- de la présence de facteurs anthropiques, naturels ou autres, non liés à l’effluent à l’étude, mais qui sont susceptibles de contribuer à l’un des effets observés;
- d’une description des mesures d’assurance et de contrôle de la qualité qui ont été mises en œuvre et des données correspondant à la mise en œuvre de ces mesures;
- l’incidence des résultats sur le plan d’étude des études de suivi biologique subséquentes;
- la date de la prochaine étude de suivi biologique.
10.2.1.2 Rapports d’interprétation d’une étude sur l’ampleur et la portée géographique et d’une étude de recherche des causes
Si les deux derniers rapports d’interprétation indiquent un effet semblable sur la population de poissons, sur les tissus de poissons ou sur la communauté d’invertébrés benthiques, le rapport d’interprétation devrait contenir, en plus de l’information mentionnée à la section 10.2.1.1, l’ampleur et la portée géographique de l’effet sur la population de poissons, les tissus de poissons ou la communauté d’invertébrés benthiques (annexe 5, paragraphe 21(1) du REMM). Un effet semblable est défini comme une différence statistiquement significative des mêmes paramètres évoluant dans la même direction dans deux études consécutives.
Un rapport d’interprétation soumis dans le cadre d’une étude de recherche des causes par une mine ne comprend pas nécessairement tous les mêmes renseignements que les rapports d’interprétation d’études de suivi biologique standard (comme le décrit la section 10.2.1.1) ou d’études sur l’ampleur et la portée géographique. Le rapport d’interprétation d’une étude de recherche des causes comprend une description de la cause de l’effet sur les populations de poissons, les tissus de poissons ou la communauté d’invertébrés benthiques et, dans le cas où la cause n’a pu être déterminée, les raisons de l’échec et une description des mesures à prendre pour déterminer la cause lors de la prochaine étude (annexe 5, paragraphe 21(2) du REMM).
10.2.2 Structure du rapport d’interprétation
Cette section présente tous les renseignements génériques qu’il est recommandé d’inclure dans un rapport d’interprétation, peu importe le type d’étude de suivi biologique réalisée. Ces renseignements peuvent être classés dans les catégories suivantes :
Description du site et mise à jour des données sur la mine : Tout rapport d’interprétation doit contenir un sommaire et une mise à jour des informations présentées dans le plan d’étude, principalement celles portant sur l’historique de la mine et de ses opérations, ainsi que sur les aspects écologiques de la zone à l’étude. Il est aussi important d’indiquer toute déviation ou tout écart par rapport au plan d’étude initial. Les renseignements recommandés pour cette section se classent parmi les trois catégories suivantes (il pourrait être nécessaire d’inclure d’autres informations selon les particularités du site) :
Sommaire de l’historique de la mine et de ses opérations
- changements importants apportés aux installations ou aux opérations de la mine (p. ex., modification des procédés, nouveau procédé de traitement des effluents);
- aperçu de toute violation des exigences du REMM durant l’ESEE;
- informations historiques pertinentes concernant le REMM et les ESEE.
Sommaire des aspects écologiques de la zone à l’étude
- changements survenus sur le plan écologique dans la zone d’étude depuis la soumission du plan d’étude, comme :
- tout nouveau facteur, d’origine naturelle ou anthropique, qui peut influer sur la zone à l’étude, incluant de nouveaux facteurs de confusion;
- des évènements particuliers importants qui se sont produits (p. ex., inondations, déversements, etc.);
- tout nouveau renseignement qui n’était pas connu au moment de la soumission du plan d’étude.
Sommaire du plan d’étude
- une description et la justification des changements apportés ou des déviations par rapport au plan d’étude initial.
Localisation : Inclure toute information concernant la localisation de la mine ainsi que des zones d’échantillonnage et des stations, comme :
- des cartes détaillées illustrant l’emplacement des zones d’échantillonnage et des stations;
- les coordonnées géographiques (latitude et longitude) et une description des zones et des stations d’échantillonnage, assez précise pour permettre de bien les localiser;
- une justification du choix des zones et des stations d’échantillonnage;
- des photographies des zones et des stations d’échantillonnage.
Méthodes : Inclure une description des méthodes et techniques utilisées dans le cadre de l’étude, des problèmes survenus et des solutions apportées, ainsi qu’une justification des changements apportés aux méthodes par rapport au plan d’étude initial. Si l’étude a comporté l’utilisation de traceur(s) pour délimiter le panache de l’effluent dans l’environnement récepteur, préciser le type de traceur chimique ou biochimique utilisé ainsi que la méthode employée, tout en justifiant ce(s) choix.
Données : Inclure toutes les données brutes sous forme de tableaux en annexe du rapport et s’assurer aussi de les soumettre par voie électronique comme l’explique la section 10.1.2. Les données sur les invertébrés benthiques devraient être classées par niveau taxinomique (p. ex., ordre, famille, genre, espèce). Inclure également toutes les données et tous les résultats des évaluations d’assurance de la qualité et de contrôle de la qualité (AQ/CQ) (p. ex., les matériaux de référence étalons, les copies, les échantillons-témoins, les graphiques d’étalonnage, les résultats des tests de validation de l’âge des poissons, et, dans le cas des procédures de sous‑échantillonnage des invertébrés benthiques en laboratoire, l’exactitude et la fidélité des résultats et le taux de récupération des organismes).
Statistiques : Indiquer les méthodes et les tests utilisés pour l’analyse statistique, incluant une justification de ces choix. Inclure également de l’information sur l’analyse de la variabilité des données, les transformations de données, les valeurs aberrantes ou extrêmes (le rapport devrait comprendre les diagrammes de dispersion pour les études des poissons et de la communauté d’invertébrés benthiques, afin de repérer les valeurs aberrantes ou autres données inhabituelles), les résultats de tout tri des données (dans le cas des données sur les invertébrés benthiques) et la présence d’interactions (pour l’analyse de covariance [ANCOVA]). De plus amples détails sur la manière d’effectuer des analyses statistiques sont fournis au chapitre 8.
Résultats : Inclure des statistiques sommaires sur les données brutes (comprenant la moyenne, la médiane, l’écart‑type, l’erreur-type ainsi que les valeurs minimales et les valeurs maximales) et les résultats des analyses statistiques (incluant la valeur p et l’ampleur de l’effet) sous forme de tableaux ou figures pour les études des populations de poissons et des communautés d’invertébrés benthiques. Évaluer l’effet des valeurs aberrantes ou extrêmes sur les résultats, le cas échéant. Inclure une comparaison des habitats d’une zone d’échantillonnage à l’autre. On devrait aussi inclure les résultats de l’analyse de puissance réalisée afin d’évaluer la capacité de déceler une différence d’une ampleur donnée pour un degré de confiance donné.
Un résumé des résultats de la caractérisation de l’effluent, des essais de toxicité sublétale et du suivi de la qualité de l’eau, indiqués annuellement dans le SITDR, doit également être inclus dans le rapport d’interprétation pour faciliter l’interprétation des résultats biologiques.
Discussion : Analyser les similarités et les différences observées entre les zones d’échantillonnage; analyser l’incidence de tout facteur influant sur l’interprétation des résultats comme la présence de facteurs de confusion, la validité des zones de référence sélectionnées ainsi que des méthodes utilisées, les résultats de l’analyse de puissance, la présence de tendances (interactions), les problèmes survenus durant l’étude, le cas échéant, et la façon dont ils pourraient influer sur les résultats; résumer dans quelle mesure les modes opératoires normalisés et les objectifs fixés relativement à la qualité des données ont été respectés, et mentionner tout problème en lien avec l’AQ/CQ; comparer les résultats actuels avec ceux d’études antérieures réalisées dans la même zone ou avec ceux d’études publiées sur d’autres mines; et enfin analyser l’incidence des résultats obtenus sur les phases subséquentes en tenant compte des problèmes qui se sont posés, le cas échéant, et proposer des solutions ou autres approches propres au site qui pourraient être adoptées dans le cadre des phases subséquentes.
Conclusions : Présenter une évaluation globale des résultats de l’ensemble des études de suivi biologique et des discussions. Inclure des suggestions sur la manière d’améliorer les ESEE à venir. L’information contenue dans cette section devrait contribuer à l’élaboration des études lors des phases suivantes.
Retournez à la table des matières
Chapitre 11
11. Participation du public aux ESEE des mines des métaux
11.2 Objectif et portée potentielle de la participation du public aux ESEE
11.3 Mécanismes de participation du public
11.4 Plan de participation du public
- 11.4.1 Communication de l’information sur les ESEE au public
- 11.4.2 Mécanismes proposés pour la participation du public
- 11.4.3 Mécanismes proposés pour donner suite aux opinions du public
11. Participation du public aux ESEE des mines des métaux
11.1 Vue d’ensemble
Le présent chapitre a pour but d’aider à faciliter la participation du public au Programme d’études de suivi des effets sur l’environnement (ESEE), particulièrement en fonction d’un site donné. Les mines sont fortement encouragées à donner l’occasion au public de participer à tous les aspects du Programme d’ESEE. Les membres de la collectivité peuvent jouer un rôle important à tous les stades d’exécution du programme : planification précédant la mise en œuvre des ESEE, préparation de la caractérisation du site et de la conception du plan d’étude, interprétation des données résultant de chaque ESEE menée sur un site donné et prises de décisions relatives aux étapes ultérieures du Programme d’ESEE pour un site.
Conformément aux recommandations des responsables de l’Initiative minière de Whitehorse et d’AQUAMIN (évaluation des effets de l’exploitation minière sur le milieu aquatique au Canada), la participation du public est une composante importante du Programme d’ESEE pour les mines de métaux. Les responsables de l’Initiative minière de Whitehorse ont proposé que la participation du public repose sur le principe suivant : les approches en gestion de l’environnement seront plus efficaces et la population aura davantage confiance en l’industrie minière si les citoyens et les autres intervenants sont bien renseignés et qu’ils participent aux prises de décisions d’intérêt public à tous les stades des activités minières. Ils ont également recommandé la mise en place de comités de liaison avec le public (voir la section 11.3.1) pour encourager sa participation.
Le présent chapitre porte particulièrement sur le public, en tant que « groupe d’intervenants », car souvent le public ne participe pas activement à des programmes comme celui des ESEE, même si sa contribution peut s’avérer importante. Il faut cependant reconnaître que le public ne représente qu’un groupe d’intervenants parmi plusieurs qui partagent un intérêt pour le Programme d’ESEE des mines de métaux. Aux fins de ce guide, le terme « intervenant » désigne toute personne ou tout groupe qui a des intérêts dans un bassin versant où se situe une mine, ou qui en subit les effets, ou sur lequel il exerce un effet, ou encore qui prend part à la prise de décisions relatives à ce bassin. Le public englobe tous les intervenants à l’exception des sociétés minières ou des associations de sociétés minières, des ministères et des organismes fédéraux, provinciaux et territoriaux, et des administrations municipales et autochtones.
Il est important de garder en tête que le public n’est pas un groupe homogène, et qu’il peut comprendre plusieurs intervenants ayant des préoccupations et des intérêts divers. Ces groupes d’intérêt peuvent inclure, par exemple, les groupes autochtones, les groupes environnementaux non gouvernementaux, les groupes communautaires, les pêcheurs commerciaux et sportifs, et les citoyens intéressés.
11.2 Objectif et portée potentielle de la participation du public aux ESEE
La participation du public aux ESEE est une composante qui vise à ce que les décisions à l’égard des ESEE des mines de métaux soient prises à la suite d’une consultation publique éclairée, inclusive et équitable. Cette démarche présente plusieurs avantages :
- amélioration du plan d’étude des ESEE;
- amélioration du processus décisionnel dans le cadre des ESEE;
- pertinence accrue des ESEE;
- confiance accrue entre tous les intervenants, et établissement ou amélioration des relations de travail entre ceux-ci;
- meilleure éducation du public entraînant une plus grande sensibilisation aux enjeux des ESEE et une meilleure compréhension de ceux‑ci;
- amélioration des communications entre tous les intervenants.
Les mines sont fortement encouragées à promouvoir la participation du public à plusieurs étapes des ESEE de façon à atteindre cet objectif et d’en tirer le maximum d’avantages. Le public peut notamment participer aux étapes suivantes :
Examen préalable à l’ESEE : Avant qu’une ESEE soit amorcée, le public pourrait faire connaître son avis concernant les objectifs et les questions en lien avec les ESEE réalisées sur un site en particulier, ce qui contribuerait à donner une orientation générale au Programme d’ESEE.
Caractérisation du site : L’apport du public peut être de très grande valeur à l’étape de la préparation de la caractérisation du site. En effet, ses connaissances des conditions locales pourraient contribuer de façon considérable à la description de la zone à l’étude et des facteurs de confusion, particulièrement en ce qui a trait aux pêches. En outre, la population peut être en mesure d’aider à cerner des composantes valorisées de l’écosystème, qui sont des éléments de l’environnement comportant une valeur sur le plan biologique, scientifique, socioéconomique, esthétique ou culturel. Ces composantes peuvent servir à préciser les objectifs et les enjeux propres au site. Il peut s’agir d’une espèce de poisson importante sur le plan culturel ou économique, d’un tronçon d’un cours d’eau important pour la pratique de loisirs, ou de la beauté d’un paysage. Lorsque de telles informations sont connues, il importe de les intégrer à la conception de l’étude.
Plan d’étude : Le public peut participer au plan d’étude en contribuant à l’établissement d’objectifs de qualité de l’environnement propres au site, à l’élaboration de procédures relatives à la présentation de rapports et à la délimitation de la zone exposée et de la zone de référence appropriées. De plus, il peut participer à l’examen des plans d’études avant le début du suivi.
Activités de suivi :Le public peut participer activement à certains aspects des activités de suivi, particulièrement au prélèvement d’échantillons. Par exemple, l’Environmental Protection Agency des États‑Unis a élaboré un protocole de prélèvement d’échantillons d’eau à l’intention des groupes communautaires. En Colombie‑Britannique, la Pacific Streamkeepers Federation a produit un manuel portant sur des sujets comme la collecte d’échantillons d’eau et les relevés d’habitats et d’invertébrés dans les cours d’eau. L’existence de tels programmes montre qu’avec la formation appropriée, les membres du public peuvent participer à des activités de suivi. Sur le terrain, la présence de ces personnes bonifie le travail des experts en suivi environnemental. Par ailleurs, cette participation permet une rentabilité accrue des opérations tout en augmentant la sensibilisation et les connaissances des participants du public. En faisant participer le public à leurs activités de suivi, les mines ont l’occasion de le former et de l’informer sur les ESEE, et de mieux lui faire connaître les différents volets des ESEE.
Évaluation et interprétation des données : Le public peut réviser les rapports d’interprétation des ESEE et participer à la prise de décisions sur les étapes ultérieures du programme de suivi. Les participants devront alors reconnaître que certains aspects du programme ne peuvent subir de modifications substantielles.
11.3 Mécanismes de participation du public
Les mines sont encouragées à établir des mécanismes de participation du public le plus tôt possible dans le processus des ESEE, en tenant compte que ces mécanismes peuvent évoluer à mesure que les relations avec la population changent. Il existe une gamme d’options pour faire participer le public aux ESEE des mines de métaux. Les responsables de l’Initiative minière de Whitehorse et d’AQUAMIN ont fortement recommandé que des comités de liaison avec le public soient formés pour faciliter le processus. Toutefois, le choix du mécanisme correspondant à un endroit en particulier dépend en partie de la portée prévue de la participation du public et du degré de participation attendu à cet endroit.
Une mine pourrait avoir recours à plus d’un mécanisme pour faciliter la participation du public. Cette façon de faire serait particulièrement utile lorsque la mine souhaite utiliser un mécanisme complémentaire pour atteindre un plus vaste segment de la population. Elle pourrait également s’avérer utile lorsqu’une mine souhaite utiliser plus d’un mécanisme pour rejoindre différents segments de la population ayant des intérêts très divergents ou encore une communauté où l’on parle plus d’une langue.
Il est très important de souligner que dans les endroits où des mécanismes efficaces de participation du public sont déjà en place, les mines sont encouragées à utiliser ceux-ci pour régler les questions entourant les ESEE plutôt que d’en établir de nouveaux.
Il est essentiel que les mines apportent un appui financier et en main‑d’œuvre suffisant pour la mise en œuvre des mécanismes de participation. Sans ces ressources, les mécanismes ne seront probablement pas efficaces. Ainsi, pour faciliter la participation du public, il sera peut‑être nécessaire de prévoir des ressources pour les membres du public afin que les dépenses associées à leur participation aux activités des ESEE leur soient payées. Cette pratique peut être d’une importance particulière dans les régions éloignées où les déplacements engendrent des frais.
Différents mécanismes de participation du public sont présentés ci‑après. Il est à noter qu’il ne s’agit pas des seuls mécanismes possibles, et que les responsables des mines peuvent employer d’autres moyens.
11.3.1 Mécanismes permanents
Comité de liaison avec le public
Les responsables de l’Initiative minière de Whitehorse et d’AQUAMIN ont recommandé que le public participe le plus activement possible aux ESEE, et selon eux, il est souhaitable que les citoyens partagent l’autorité sur certaines questions. De plus, les responsables d’AQUAMIN ont recommandé qu’Environnement Canada, en consultation avec d’autres intervenants, élabore des lignes directrices pour la formation de comités de liaison avec le public, dont une des attributions serait de diffuser de l’information à la population.
Il est fortement recommandé que de tels comités soient créés pour faciliter la participation du public lorsque le public manifeste suffisamment d’intérêt. De tels comités peuvent contribuer à faire en sorte que les décisions concernant les ESEE soient prises dans un contexte d’ouverture et de transparence et avec un souci d’universalité. Les facteurs suivants devraient être considérés lorsque la formation d’un comité de liaison avec le public est envisagée :
- Les intervenants devraient être mobilisés le plus tôt possible et être invités à participer à la conception du processus, c’est‑à‑dire :
- établir le mandat du comité de liaison avec le public;
- déterminer les questions à débattre, dans le cadre fixé par l’exploitant de la mine;
- cerner les besoins financiers des participants et déterminer les frais qui pourront être payés.
- Tous les intervenants devraient bien comprendre le processus, à savoir :
- l’objectif des ESEE;
- la façon dont le public sera appelé à participer;
- l’objectif du processus de participation du public;
- la portée de cette participation et le genre de décisions auxquelles les gens pourront participer;
- l’identité des responsables des décisions finales et le fait que le comité de liaison et le grand public seront informés des décisions prises, justifications à l’appui;
- les conséquences d’une éventuelle absence de consensus.
- L’admissibilité au comité de liaison avec le public est déterminée au cas par cas. Outre des représentants de la mine et des membres du public, ce comité peut compter :
- des représentants du gouvernement fédéral;
- des représentants de ministères ou d’organismes provinciaux, territoriaux ou autochtones concernés;
- des employés de la mine.
- Des informations exactes et crédibles devraient être diffusées en temps opportun à tous les participants.
- Le comité de liaison avec le public devrait avoir comme but ultime d’obtenir un consensus. Faute de consensus, le comité informera l’organe décisionnel de la situation en exposant intégralement tous les points de vue dissidents, pour que celui‑ci ait un tableau clair de l’état des choses et des différentes options présentées et puisse prendre une décision finale.
Agent de liaison avec le public
Lorsque les membres du public ne manifestent pas suffisamment d’intérêt pour former un comité, la mine peut demander à un citoyen de faire office d’agent de liaison avec le public. Ce citoyen ne devrait pas être relié à l’entreprise, ni comme employé ou entrepreneur, ni comme parent d’un employé ou d’un entrepreneur. Bien qu’il puisse être difficile de trouver la personne pouvant remplir cette fonction, il faut s’assurer que la nomination soit acceptable pour le public.
L’agent de liaison avec le public devrait recevoir des copies de toute correspondance relative aux ESEE échangée entre la mine et l’agent d’autorisation ainsi que toute documentation pertinente, y compris l’information spécialement destinée au public produite par la mine. Cette personne serait le premier point de contact avec le public et assurerait une diffusion plus large de la documentation pertinente dans la population. De plus, l’agent de liaison pourrait aider la mine à planifier et à mettre en place des mécanismes complémentaires de participation du public ou des mécanismes destinés à être utilisés à court terme.
11.3.2 Autres mécanismes
Portes ouvertes. Le public peut se présenter à cet événement au moment qui lui convient afin d’obtenir de l’information et des réponses à ses questions. Il peut s’agir, par exemple, d’un présentoir ou d’un kiosque où des membres du personnel de l’entreprise distribuent de la documentation, répondent aux questions et demandent le point de vue des gens.
Réunions publiques. Ces réunions fournissent l’occasion d’informer les gens, et ceux‑ci peuvent y prendre la parole de façon formelle ou non, ainsi qu’y échanger des commentaires. Pour que les réunions soient efficaces, il faut établir un ordre du jour. Le président de ces réunions publiques devrait être un représentant de la mine ou une personne neutre.
Ateliers. Il s’agit de tribunes soigneusement planifiées qui ont pour but de discuter de questions particulières et d’échanger des points de vue. Les ateliers sont généralement limités à un petit nombre de participants sur invitation. Ils peuvent être présidés par un animateur, dont la fonction consiste à susciter le dialogue, orienter les délibérations en fonction des objectifs visés et à présenter le sommaire des résultats.
Visites de groupes communautaires. Des membres du personnel de la mine visitent des groupes communautaires dans le but d’interagir directement avec les citoyens dans leur milieu, favorisant un libre dialogue constructif. Ce mécanisme peut être très utile dans les régions éloignées.
Visites du site. Les personnes intéressées peuvent visiter le site de la mine pour obtenir des renseignements de première main et se familiariser avec les lieux. Il s’agit d’une occasion pour la mine d’avoir un contact direct et d’échanger de l’information avec le public, tout en permettant à ce dernier d’acquérir une meilleure compréhension du projet.
Communications électroniques. La mine peut se servir de sites Internet ou d’autres moyens électroniques pour diffuser de l’information et recevoir une rétroaction. La communication électronique est un moyen peu coûteux de mettre de grandes quantités d’information à la disposition du public; de plus, la logistique s’en trouve simplifiée, étant donné qu’il n’est pas nécessaire de dresser des listes de diffusion, ni de copier et de poster des documents. La mine doit cependant disposer de spécialistes en communications électroniques à l’interne. De plus, la mine ne devrait pas utiliser uniquement les communications électroniques, car les personnes n’ayant pas d’ordinateur ou les logiciels nécessaires ne pourront pas participer.
11.4 Plan de participation du public
Les mines sont encouragées à établir un plan de participation du public, qui facilitera l’élaboration et la mise en œuvre du processus de participation. La première version du plan devrait être préparée le plus tôt possible dans le Programme d’ESEE, et des mises à jour devraient être effectuées régulièrement au gré de l’évolution du programme et des activités de participation du public. Les mines sont également encouragées à fournir des exemplaires de ce plan à l’agent d’autorisation, qui les conservera à titre d’archives publiques.
Le plan de participation du public a pour objet d’exposer les moyens que la mine entend prendre pour renseigner le public sur les ESEE, pour inciter sa participation et pour répondre aux préoccupations et aux questions des citoyens.
Le plan de participation du public devrait indiquer quel employé de la mine est responsable des activités de participation.
11.4.1 Communication de l’information sur les ESEE au public
La communication de l’information au public au moment opportun est un élément essentiel du processus de participation du public. Les mines devraient à tout le moins mettre à la disposition du public le sommaire ou la version intégrale de leur plan de participation du public, du plan d’étude de l’ESEE et du rapport d’interprétation de l’ESEE. De plus, elles sont encouragées à diffuser toute autre information qui pourrait être utile.
Le plan de participation du public devrait comprendre :
- une description des moyens proposés pour informer le public de l’existence de renseignements sur le Programme d’ESEE et pour diffuser ces renseignements, par exemple;
- des annonces dans les médias locaux, dont les journaux et la radio;
- des avis publiés sur le site Web de la mine;
- des avis adressés à des groupes communautaires, à des administrations locales, à des utilisateurs de ressources et à des syndicats;
- des kiosques d’information installés dans des centres communautaires ou des lieux publics (p. ex., centres commerciaux, hôtels de ville);
- diffusion d’information dans des bibliothèques ou dans d’autres établissements propices.
- une description des moyens qui pourraient être pris pour diffuser l’information sous une forme compréhensible au public. Pour aider le public à comprendre l’information fournie, tels les plans d’étude et les rapports d’interprétation et d’autres documents, il faut tenir compte des facteurs suivants :
- les langues des collectivités visées;
- le niveau d’instruction du public ciblé par les communications;
- les styles de communication en fonction des divers groupes culturels;
- le degré de sensibilité des différents segments de la population.
11.4.2 Mécanismes proposés pour la participation du public
Le plan de participation du public devrait contenir les informations suivantes :
- Une description des conditions existantes sur le site. Il est important de décrire les aspects énumérés ci‑dessous par rapport aux conditions existantes sur le site pour établir le contexte du plan de participation du public. La collecte de cette information peut être très utile à la mine dans la planification des activités de participation du public, car elle aide à établir des objectifs réalistes à cet égard.
- Degré de participation courante ou passée du public;
- Emplacement et taille des communautés qui pourraient être touchées;
- Âge, ampleur et historique des opérations de la mine;
- Nature des préoccupations courantes ou passées en matière d’environnement;
- Utilisation humaine des ressources aquatiques dans le bassin versant touché.
- Objectifs et buts proposés concernant la participation du public. L’objectif global de participation du public dans le cadre des ESEE des mines de métaux consiste à ce que les décisions soient prises à la suite d’une consultation approfondie, universelle et équitable du public. Des objectifs et des buts propres au site peuvent aussi être fixés. L’établissement d’objectifs et de buts clairs permettra de rendre plus efficaces les relations avec la population. L’indication des résultats escomptés de la participation du public facilite non seulement la conception et la mise en œuvre du plan de participation du public, mais aussi l’évaluation de l’efficacité de cette participation.
De plus, le plan de participation du public devrait énoncer les attentes de la mine en ce qui touche les activités proposées de participation et exposer de façon claire et transparente les mesures qui pourraient être prises dans l’éventualité où ces attentes ne seraient pas comblées.
- Portée proposée de la participation du public. Il faudrait définir quelles sont les activités des ESEE auxquelles le public peut participer et quelles sont les décisions susceptibles d’être influencées par l’apport des gens. Le moment de la préparation du plan de participation du public devrait être choisi en fonction de la portée prévue de la participation, surtout si la mine envisage de faire appel au public pour l’examen préalable à l’ESEE ou la caractérisation du site.
- Énoncé des principes qui sous‑tendent la participation du public. La participation du public aux ESEE devrait reposer sur les principes suivants, qui peuvent varier d’un endroit à l’autre selon la portée de la participation et le degré de participation.
- Ouverture et transparence. Une fois que le processus de participation du public est amorcé, toutes les décisions relatives à la portée de ce processus devraient être prises dans un contexte d’ouverture et de transparence de sorte que tous les intervenants, dont le grand public, connaissent les décisions prises et sachent comment celles‑ci ont été prises. Si le processus n’est pas ouvert et équitable, il serait quand même possible d’arriver à une entente, mais celle-ci serait vraisemblablement temporaire.
- Démarche axée sur les objectifs. Les participants doivent bien comprendre les objectifs et la portée du processus de participation du public. Il importe qu’ils saisissent la raison pour laquelle leur contribution est nécessaire. Pour être constructif, le processus de participation devrait s’enclencher alors que les options pour les décisions sont encore envisagées. L’objectif des ESEE devrait être compris de la même façon par tous les intervenants, y compris le public. Ceux-ci devraient également convenir qu’un processus de participation du public est un bon moyen d’atteindre cet objectif.
- Universalité. L’occasion de participer au processus et d’influer sur son déroulement devrait être offerte à tous les intervenants, y compris le public. La mine devrait déterminer les groupes d’intervenants, y compris les groupes publics, qui ont un grand intérêt envers le résultat, notamment ceux qui seront touchés par les résultats, ceux qui seront chargés de la mise en application et ceux qui pourraient nuire aux résultats s’ils ne sont pas consultés.
- Participation volontaire. Les intervenants participent sur une base volontaire. Tous les intervenants, y compris les membres du public, devraient appuyer le processus de participation et consacrer le temps nécessaire pour qu’il soit efficace.
- Souplesse. Le processus devrait être souple. Tout en respectant les exigences et les lignes directrices des ESEE des mines de métaux, les intervenants devraient pouvoir agir de concert à la conception des modalités de la participation du public en fonction du site concerné. Les modalités initiales peuvent évoluer à mesure que les intervenants connaîtront mieux les enjeux et la démarche et se connaîtront mieux les uns les autres. Enfin, il est nécessaire d’intégrer la rétroaction des participants dans une évaluation continue du processus.
- Égalité des chances. Tous les intervenants, dont les simples citoyens, devraient profiter des mêmes occasions d’accéder à l’information pertinente et de participer efficacement à tous les stades du processus. Dans la mesure du possible, ils devraient pouvoir choisir leurs représentants.
- Respect des divers intérêts. L’acceptation des valeurs, des intérêts et des connaissances des divers intervenants, y compris du public, est essentielle. La mine devrait donner le temps aux intervenants de rechercher et de créer des points d’intérêt commun malgré leurs valeurs différentes. Une meilleure compréhension favorise la confiance et l’ouverture, et permet aux différentes parties d’aller au‑delà des positions arrêtées en vue d’explorer les intérêts et les besoins sous‑jacents.
- Imputabilité. Les participants, y compris le public, sont tenus de rendre compte aux groupes qu’ils représentent et ont une responsabilité à remplir vis‑à‑vis du processus de participation du public qu’ils ont accepté d’établir.
- Coût-efficacité. Les activités de participation du public devraient se dérouler avec un bon rapport coût-efficacité. Néanmoins, un échéancier réaliste devrait être établi pour permettre aux participants de communiquer avec les groupes qu’ils représentent, de les consulter et de les informer de manière efficace.
- Mise en œuvre. L’engagement à mettre en œuvre les recommandations et les décisions découlant de la participation du public, et à informer le public à cet effet, constitue un élément essentiel de toute entente concernant la participation du public. Dans l’éventualité où des recommandations ou des décisions ne seraient pas mises en œuvre, les intervenants concernés devraient en être informés avec des explications.
- Ouverture et transparence. Une fois que le processus de participation du public est amorcé, toutes les décisions relatives à la portée de ce processus devraient être prises dans un contexte d’ouverture et de transparence de sorte que tous les intervenants, dont le grand public, connaissent les décisions prises et sachent comment celles‑ci ont été prises. Si le processus n’est pas ouvert et équitable, il serait quand même possible d’arriver à une entente, mais celle-ci serait vraisemblablement temporaire.
- Calendrier proposé pour les activités. Pour que le public puisse participer aux ESEE, il importe d’établir des calendriers réalistes. Le plan de participation du public devrait indiquer les échéanciers et les étapes relatives aux principales décisions sur lesquelles cette participation peut avoir une influence. Les calendriers devraient offrir une latitude optimale pour permettre au public de participer, tout en permettant à la mine de respecter les échéanciers requis et de franchir les étapes établies. Cette dernière devrait être au courant des contraintes temporelles et financières que comporte la participation du public. Au moment de l’établissement du calendrier des activités comportant la participation du public, il peut être utile de déterminer les disponibilités des principaux intervenants dans un premier temps, puis des autres intervenants, s’il y a lieu. Lorsque des échéances strictes sont imposées par une loi ou un règlement et qu’elles ne laissent pas suffisamment de temps au public pour participer, il importe d’en informer la population.
- Degré proposé de participation du public. Conformément aux recommandations des responsables d’AQUAMIN et de l’Initiative minière de Whitehorse, le public devrait participer dans la plus grande mesure possible, et ce, à tous les sites miniers. Plus la participation augmente, plus les attentes et les besoins augmentent quant aux aspects suivants :
- niveau de compétence et d’expertise nécessaire pour tous les participants;
- besoins en ressources (temps et argent);
- attentes relativement à la prise en considération de l’apport du public tout au long du processus des ESEE;
- attentes relativement à l’influence de l’apport du public sur les décisions finales prises par les mines ou les instances dirigeantes.
- Autorité partagée. Le public participe à la prise de décisions, et tous les intervenants conviennent des limites de cette participation. Selon les conditions d’une telle entente, le public est considéré comme un participant à part entière au processus décisionnel. Le public est formellement engagé par la formation de comités de liaison avec le public. Il demeure toutefois que ce sont les autorités gouvernementales et les entreprises réglementées et non ces comités qui veillent au respect des exigences posées par la réglementation.
- Planification conjointe.La population est consultée à toutes les phases des ESEE, de l’établissement des objectifs à l’examen des résultats. La consultation s’effectue en partie par le biais des comités de liaison avec le public, dont le mandat est établi par l’ensemble des intervenants. En outre, une consultation publique plus large peut être tenue en utilisant d’autres mécanismes. Tous les intervenants ont une responsabilité à l’égard du processus de consultation, et les mines et les organismes de réglementation sont tenus de prendre en considération les vues des personnes et des groupes consultés.
- Consultation publique permanente. Des tribunes publiques ou des activités de sensibilisation permanentes destinées aux groupes communautaires locaux sont organisées dans le but de tenir régulièrement la population au courant des faits nouveaux (dont les suites données à des points de vue exprimés lors de tribunes antérieures) et de susciter régulièrement la rétroaction. C’est à la mine qu’il revient d’établir le calendrier et la fréquence de ces activités, sans qu’elle entretienne de rapports formels avec la population, bien que des relations informelles puissent s’établir.
- Consultation publique. Les tribunes publiques et les activités de sensibilisation dont il vient d’être question permettent de tâter le pouls du public sur divers aspects des ESEE, dont le plan d’étude. Les gens ont également l’occasion d’examiner les résultats des activités de suivi. Cette forme de participation ne comporte pas de relations de travail permanentes avec la population.
- Rétroaction. De l’information sur l’état d’avancement du Programme d’ESEE, y compris les résultats des activités de suivi, est fournie au public lors de tribunes publiques ou par d’autres moyens. Les gens ont alors la possibilité de formuler des commentaires.
- Information. De l’information sur l’état d’avancement du Programme d’ESEE, y compris les résultats des activités de suivi, est fournie au public sans l’existence d’un mécanisme formel de rétroaction ou de participation du public.
- Ressources nécessaires au déroulement des activités de participation du public proposées. Il est essentiel que la mine veille à ce qu’il y ait des ressources suffisantes pour mener les activités de participation du public proposées. Autrement, même le meilleur plan pourrait rester lettre morte. La mine est libre de garder les questions liées aux ressources de l’entreprise confidentielles. Par contre, il importe qu’elle assure aux intervenants, y compris le public, que suffisamment de ressources sont engagées pour qu’ils puissent participer aux activités proposées.
Le plan de participation du public devrait indiquer le type de ressources financières pouvant servir à favoriser cette participation et, le cas échéant, quels frais seront payés, jusqu’à quel montant et selon quelles modalités.
11.4.3 Mécanismes proposés pour donner suite aux opinions du public
Pour assurer aux gens que leurs opinions seront prises en considération, il est essentiel que le plan de participation du public propose des façons d’y donner suite. Plus la portée proposée des activités de participation du public sera grande, et plus le degré proposé de participation sera élevé, plus les citoyens s’attendront à ce qu’on tienne compte des recommandations qu’ils auront formulées et des décisions auxquelles ils auront participé. Les mécanismes proposés à cet égard devraient donc être suffisamment détaillés pour répondre aux attentes du public.
Les moyens proposés devraient comprendre des mécanismes décisionnels basés sur la participation des gens ainsi que des moyens de les informer des décisions prises ou de justifier le rejet de recommandations qu’ils auront formulées.
Retournez à la table des matières
Chapitre 12
12. Recherche des causes
12.2 Objectif et attentes relatifs à la recherche des causes
12.3 Élaboration d'hypothèses et d'une étude de recherche des causes
12.4 Utilisation des profils de réponse et de la dynamique des populations
- 12.4.1 Aperçu des résultats du Programme d'études de suivi des effets sur l’environnement des mines de métaux
- 12.4.2 Profils de réponse des poissons
- 12.4.3 Profils des effets possibles sur les poissons
- 12.4.4 Profils de réponse de la communauté benthique
- 12.4.5 Profils des effets possibles sur le benthos
12.5 Approche progressive (élimination)
- 12.5.1 Évaluation des données sur la réduction de la toxicité et évaluation des données sur la toxicité
- 12.5.2 Exemple d'un cadre de recherche des causes pour l'évaluation des données sur la réduction de la toxicité et l'évaluation des données sur la toxicité
12.6 Méthode intégrée (poids de la preuve)
- 12.6.1 Utilisation de la méthode du poids de la preuve
- 12.6.2 La triade de la qualité des sédiments à titre d'exemple du poids de la preuve
12.7 Toxicologie des métaux et bioaccumulation
- 12.7.1 Écotoxicité des métaux
- 12.7.2 Toxicité du sélénium
- 12.7.3 Biomarqueurs (métallothionéine)
- 12.7.4 Utilisation de méthodes de bioaccumulation
- 12.7.5 Méthodes pour mettre la bioaccumulation et la toxicité en corrélation
12.8 Approches pour les études sur le terrain portant sur les poissons et le benthos
- 12.8.1 Plan d'étude sur le terrain
- 12.8.2 Organismes en captivité
- 12.8.3 Mésocosmes (poissons et invertébrés)
- 12.8.4 Dispositifs pour la transplantation de communautés benthiques
- 12.8.5 Macrophytes, périphyton, phytoplancton et chlorophylle
12.9 Méthodes de laboratoire et essais de toxicité
- 12.9.1 Paramètres histologiques et physiologiques
- 12.9.2 Essais de toxicité
- 12.9.3 Essai de toxicité sur les poissons : cycle de vie du méné à grosse tête
- 12.9.4 Essai de toxicité sur les sédiments entiers
- 12.9.5 Métaux dans l'eau sus-jacente dans le cadre d'essais de toxicité sur les sédiments entiers
- 12.9.6 Essais de toxicité de l'eau interstitielle des sédiments
12.10 Outils pour l'analyse des effluents et de la qualité de l'eau
- 12.10.1 Mesure des métaux dissous pendant la recherche des causes
- 12.10.2 Spéciation des métaux pour les métaux d'intérêt
- 12.10.3 Mesure des réactifs et des sous-produits réactifs utilisés dans le traitement
- 12.10.4 Surveillance du débit et des charges dans la zone exposée
12.11 Outils à prendre en compte pour l'analyse des sédiments
- 12.11.1 La surveillance des sédiments en tant qu'outil de recherche des causes
- 12.11.2 Transport des matières en suspension
- 12.11.3 Taux de sédimentation des matières en suspension et datation des sédiments pour obtenir les tendances historiques
- 12.11.4 Carottage de sédiments
- 12.11.5 Composition chimique des sédiments
- 12.11.5.1 Concentrations partielles des métaux dans les sédiments (extraction partielle), extraction séquentielle des métaux, rapports entre les métaux simultanément extractibles et les sulfures volatils en milieu acide (MTA/SVMA)
- 12.11.5.2 Rapport carbone-azote (rapport C/N) pour les sédiments marins
12.12 Analyse de l'eau interstitielle des sédiments
Liste des tableaux
- Tableau 12-1: Exemples de méthodes qui peuvent être utilisées pour déterminer les causes possibles pendant la recherche des causes
- Tableau 12-2 : Ensemble officialisé de critères de causalité formant une partie de la méthode du poids de la preuve pour l'évaluation des effets des effluents des mines
Liste des figures
12. Recherche des causes
12.1 Introduction
Le présent chapitre est une compilation de toutes les sections portant sur la recherche des causes qui étaient incluses dans les différents chapitres de la version de 2002 du Document d'orientation pour l'étude de suivi des effets sur l'environnement (ESEE) des mines de métaux. Plusieurs méthodes et concepts ont été mis à jour avec de nouveaux renseignements.
Un atelier sur la recherche des causes du Programme d'ESEE des mines de métaux a été organisé conjointement par l'Association minière du Canada et Environnement Canada en décembre 2009. L'objectif de cet atelier était d'explorer différents aspects et enjeux liés à la phase de recherche des causes du Programme d'ESEE des mines de métaux. Des renseignements généraux sur la recherche des causes, les études environnementales, les causes potentielles des effets, les études de cas ainsi que les outils et les méthodes utilisés pour la recherche des causes ont été présentés. L'atelier a fourni une occasion de discuter et de développer la recherche des causes des mines de métaux, et a permis l'identification des besoins en matière de recherche. Le compte rendu de l'atelier a été utilisé pour étoffer le présent chapitre qui porte sur la recherche des causes dans le cadre du Programme d'ESEE des mines de métaux, et d'autres détails sont inclus dans le compte rendu publié en 2012 et accessible sur le site Web du Programme d'études de suivi des effets sur l’environnement, au http://www.ec.gc.ca/esee-eem.
12.2 Objectif et attentes relatifs à la recherche des causes
L'objectif d'une étude de recherche des causes est de déterminer la cause des effets confirmés, c’est-à-dire ce qui est responsable des effets (se référer au chapitre 1, section 1.3.2.1 pour obtenir de l'information au sujet des effets confirmés). Les directives présentées dans le présent chapitre visent à permettre plus de flexibilité dans la conception des études de recherche des causes afin de répondre aux besoins propres à un site, et elles devraient être complétées par tous les renseignements disponibles, notamment des publications scientifiques accessibles au public. Comme dans le cas de toutes les ESEE, des études sur la recherche des causes doivent utiliser les méthodes validées et de bonnes pratiques scientifiques.
Les méthodes validées acceptables comprennent celles dont la rigueur a été établie sur un fondement crédible, comme les méthodes ou procédures normalisées préparées par des organismes reconnus à l'échelle internationale (à titre d'exemple, Environnement Canada, l'Organisation de coopération et de développement économiques (OCDE), l'Environmental Protection Agency (EPA) des États-Unis, l'American Society for Testing and Materials (ASTM), l'Organisation internationale de normalisation (ISO), l'Union européenne (UE) et l'Organisation mondiale de la santé (OMS) de même que celles publiées dans des revues scientifiques évaluées par des pairs et acceptées à titre de protocoles scientifiquement valables. De plus, des méthodes qui ne font pas autorité et qui n'ont pas été évaluées par des pairs peuvent être utilisées si la preuve de leur bien-fondé est faite.
Les éléments d'une pratique scientifique saine incluent l'intégrité scientifique, le concept expérimental, la sécurité en laboratoire, l'analyse des erreurs, l'assurance et le contrôle de la qualité, l'interprétation de données essentielles et la tenue précise de dossiers (c.-à-d., documentation de la méthode et de la collecte de données, documentation, conservation et accès) (OCDE, 2007; CIRC, 2008; Deutsch Forschungsgemeinshaft, 1998). Il est attendu que les ESEE soient fondées sur des principes scientifiques éprouvés, c.-à-d. « des enquêtes et des observations organisées effectuées par du personnel qualifié au moyen de méthodes documentées donnant des résultats et des conclusions vérifiables » (SETAC, 1999). Des principes scientifiques éprouvés signifient que les données et les conclusions sont appuyées par les normes élevées de la méthode scientifique, laquelle comprend la formulation d'une ou de plusieurs hypothèses facilement vérifiables, l'utilisation de méthodes expérimentales ou analytiques bien documentées (tailles d'échantillonnage appropriées, témoins appropriés), l'utilisation d'outils d'analyse des données pertinents (statistiques ou modèles) et la formulation de conclusions qui tiennent compte d'une ou de plusieurs hypothèses et qui sont fondées sur les résultats (SETAC, 1999). La Society of Environmental Toxicology and Chemistry (SETAC, 1999) soulève d'importantes mises en garde en ce qui a trait à l'interprétation des données, notamment en ce qui concerne les déclarations de certitude par rapport aux déclarations d'incertitude, la causalité par rapport à la corrélation, l'absence de preuve par rapport à la preuve d'absence et l'interprétation erronée possible (ne pas tenir compte de certaines variables, utiliser des tailles d'échantillons inadéquates, le manque de témoins appropriés, les biais, les anecdotes). De plus, Bosker et Munkittrick (2009) émettent une mise en garde au sujet de l'assurance de la qualité/contrôle de la qualité générique et des enjeux statistiques des ESEE suivants : taille insuffisante de l'échantillon, omission de supprimer les valeurs aberrantes, exposition incertaine, mauvais choix du site de référence, rapports incomplets ou mauvais, erreur de saisie des données et mauvaises données déclarées.
12.3 Élaboration d'hypothèses et d'une étude de recherche des causes
Pendant l'élaboration du plan d'étude de recherche des causes (se reporter au chapitre 2, 2.2 et au chapitre 1, 1.4.2.2), les mines sont encouragées à mentionner plusieurs hypothèses possibles qui pourraient expliquer les causes des effets confirmés, en tenant compte de tout schéma de réponse identifiable. Plusieurs effets peuvent avoir une même cause et peuvent être identifiés par la formulation d'une hypothèse principale. Dans d'autres cas, plusieurs hypothèses peuvent être formulées pour examiner plusieurs effets confirmés. Des outils pertinents pour examiner les hypothèses établies peuvent alors être proposés. La portée des travaux peut varier. Il peut s'avérer suffisant d'examiner et de présenter des preuves solides à l'aide des données existantes, seules ou jumelées à de nouvelles données (méthode du poids de la preuve) ou d'un examen de la documentation scientifique. Par ailleurs, il peut s'avérer nécessaire d'effectuer des études complètes sur le terrain ou en laboratoire.
Le tableau ci-dessous présente des exemples de méthodes différentes de recherche des causes visant à examiner différentes hypothèses de causes possibles. Les sections suivantes du présent document suggèrent différentes façons de déterminer la cause des effets.
| Hypothèses (Cause possible) | Approche | Exemple |
|---|---|---|
| Habitat, éléments nutritifs | Collecte de données biologiques avec les mesures à l'appui pour caractériser l'habitat, la qualité de l'eau et la chimie des sédiments qui permettrait d'élargir les analyses statistiques (p. ex. approches corrélatives et à plusieurs variables). Des échantillons pour l'étude de la chimie de l'effluent (plusieurs échantillons si cela est nécessaire) recueillis simultanément peuvent permettre d'établir des liens entre les conditions dans le milieu récepteur et les composants possibles de causalité dans l'effluent des mines. La caractérisation de conditions ou d'événements inhabituels peut fournir d'autres connaissances. | 1) Étude normalisée des invertébrés benthiques portant sur l'eau, les sédiments et la chimie de l'effluent pour explorer les relations avec l'habitat, les éléments nutritifs et les mesures des contaminants.2) Collecte de données sur la température, les éléments nutritifs et la productivité primaire (chlorophylle a, périphyton) dans le milieu récepteur avec les mesures correspondantes des éléments nutritifs dans l'effluent afin d'examiner la cause des effets liée aux éléments nutritifs, comme l'eutrophisation, et peut inclure la modélisation ou le bilan massique. |
| Variabilité naturelle | Voir les chapitres 2, 3, 4, 6, 7, 8 et 9. | |
| Contaminants | Analyse de la charge corporelle de métaux, seule ou jumelée à d'autres mesures (p. ex. gonades des poissons ou histologie du foie) à la recherche de signes d'un développement anormal (gonades) ou de signes de pathologie (p. ex. lésions hépatiques). | 1) Analyse des éléments traces dans les amphipodes recueillis dans la zone de référence et la zone exposée, et comparaison des niveaux avec les « concentrations corporelles critiques » publiées.2) Approche fondée sur les biomarqueurs pour les poissons, p. ex. mesure de la concentration de métallothionéine ou d'autres protéines à faible masse moléculaire qui sont connues pour être induites par une exposition aux métaux.3) Analyse des éléments traces dans les tissus (p. ex. foie, viscères, corps entier et muscle, selon ce qui est approprié pour l'effet identifié ou le contaminant préoccupant) des poissons recueillis dans la zone de référence et la zone d'exposition; cela permet de déterminer si les contaminants sont biodisponibles et accumulés.4) Utilisation d'une approche progressive (évaluation des données sur la réduction de la toxicité/évaluation des données sur la toxicité) pour déterminer la source des contaminants dans les flux de déchets. |
| Quantité limitée de nourriture | Examen de la documentation scientifique sur le régime alimentaire des poissons afin de comprendre les préférences et examen des données existantes sur les invertébrés benthiques pour évaluer la disponibilité de nourriture, seule ou de pair avec d'autres renseignements, dont les isotopes stables. | Mesures du contenu de l'estomac, des types de proies pertinentes (p. ex. invertébrés benthiques, proies planctoniques) ou de paramètres de la qualité de l'eau, comme la turbidité ou la température. |
12.4 Utilisation des profils de réponse et de la dynamique des populations
12.4.1 Aperçu des résultats du Programme d'études de suivi des effets sur l’environnement des mines de métaux
Les analyses nationales des données du Programme d'ESEE des mines de métaux (Lowell, 2007; Environnement Canada, 2012) laissent entendre que les profils de réponse des poissons (les poissons étaient plus âgés, plus maigres [condition réduite] et leurs foies et leurs gonades étaient plus petits) peuvent être liés à la toxicité ou à l'altération de l'habitat. Les données laissent entendre également que les profils de réponse (diminution significative de la richesse taxonomique, changements dans la structure de la communauté dans les zones exposées mesurés à l'aide des valeurs plus élevées de l'indice de Bray-Curtis et de l'indice de régularité de Simpson, et une densité accrue) peuvent être liés à la toxicité ou à l’altération de l'habitat ou à l'eutrophisation de certaines mines. À ce jour, les effets signalés des effluents des mines sur le potentiel d'utilisation des poissons (mesuré par la teneur en mercure dans les tissus des poissons) semblent être minimes.
12.4.2 Profils de réponse des poissons
Il est important de comprendre que la réponse de la population de poissons échantillonnée est un aperçu ponctuel, et il ne devrait pas être supposé que cette réponse représente une étape dans une série de réponses qui peuvent mener d'un état d'équilibre à un nouveau (Environnement Canada, 2010). La réponse est également un reflet de la manière dont les poissons se portent et non une indication du mécanisme d'impact. Par exemple, une augmentation de la quantité ou de la qualité de la nourriture ou de l'habitat devrait se traduire par une augmentation de la croissance, de la taille, de l'investissement dans la reproduction (taille des gonades) et de la condition. Un taux de croissance plus rapide se traduit généralement par une reproduction des poissons à un plus jeune âge et par conséquent, l'âge de la maturité (âge auquel les poissons commencent à se reproduire) est abaissé. Une fois regroupés, ces changements dans la population contribuent normalement à abaisser l'âge moyen de la population. Lorsque la population s'adapte à sa nouvelle capacité de charge, les paramètres devraient revenir aux niveaux de référence, mais pour une densité plus importante de poissons. De même, un déversement accidentel à létalité aiguë peut se traduire plus tard dans le temps par une augmentation des ressources alimentaires étant donné qu'il y a une densité de poissons plus faible pour la même quantité de nourriture disponible. Par conséquent, les effets peuvent ne pas entraîner de changements à long terme dans la communauté piscicole puisque la population maintient son équilibre et que des mesures correctives peuvent ne pas être efficaces sur le plan écologique ou des coûts.
Ce ne sont pas toutes les espèces qui répondront directement au stress, mais certaines peuvent répondre indirectement en raison de changements observés dans la pression exercée par la prédation ou dans la disponibilité de la nourriture. Le profil de réponse observé peut toutefois servir à interpréter les résultats et à concevoir les études pour la prochaine phase. Il est important de consulter les données de soutien pour aider à l'interprétation et à la conception de l'étude. Gibbons et Munkittrick (1994) et Munkittrick et al. (2000) ont regroupé les caractéristiques des poissons en fonction de la structure d'âge (âge moyen ou répartition par âge), de la dépense énergétique (taux de croissance et taux de reproduction) et de l'emmagasinage d'énergie (condition, poids du foie). Ils ont attribué la mention « augmentation », « diminution » ou « aucun changement » à chaque caractéristique afin d'obtenir un profil de réponse général qui pourrait être utilisé pour fournir une orientation à la recherche des facteurs de causalité. De plus, la nature du profil de réponse au cours des phases de surveillance permet la caractérisation de l’état du système en question, et permet par la suite la prise de décisions en matière de gestion au sujet de l'efficacité des règlements actuels (Environnement Canada, 2010). Le chapitre du Guide pour l'ESEE pour le secteur des pâtes et papiers portant sur la recherche des causes et la recherche de solutions (Environnement Canada, 2010) et Munkittrick et al. (2000) fournit des renseignements détaillés sur les profils des effets et les profils de réponse interprétables. Les profils de réponse interprétables possibles dont les mines pourraient tenir compte sont, par exemple, la limitation des éléments nutritifs, la toxicité, l'eutrophisation et la perturbation du métabolisme. D'autres profils de réponse existent et peuvent s'appliquer.
12.4.3 Profils des effets possibles sur les poissons
Trois profils d'effets sont décrits ci-dessous; d'autres existent et peuvent s'appliquer.
12.4.3.1 Limitation des éléments nutritifs/toxicité
Les limitations d'éléments nutritifs qui ont une incidence sur la santé des poissons (laquelle peut être caractérisée par une diminution du coefficient de condition, de la taille du foie ou de la taille des gonades) peuvent initialement se traduire par une diminution de la croissance et de la reproduction des poissons. Au fil du temps, cela peut mener à une augmentation de l'âge de la population étant donné que le nombre de jeunes produits est moins grand (Gibbons et Munkittrick, 1994). Un problème de longue durée de disponibilité de nourriture et de rendement mènera en définitive à une diminution de la taille de la population sous la capacité de charge du système, et les paramètres de rendement des poissons (croissance, condition) pourront alors commencer à récupérer à mesure que l'âge de la population augmente, mais que le nombre d'individus diminue.
La toxicité chimique peut causer une augmentation du poids du foie, de même qu'une détérioration de la condition et une diminution du poids des gonades. Il a été suggéré que l'augmentation de la taille du foie est associée à une augmentation de l'activité des processus de détoxification. Toutefois, il est important de noter que la toxicité chimique peut causer une augmentation des enzymes de détoxification du foie sans que la taille du foie augmente, et inversement. L'augmentation du volume du foie peut être un indicateur de l'emmagasinage modifié de l'énergie en fonction de la toxicité, mais cette augmentation peut ne pas être directement liée à une augmentation des enzymes de détoxification (Munkittrick et al., 1994, 2000).
12.4.3.2 Perturbation du métabolisme
Tel qu'il a été mentionné dans Hewitt et Servos (2001), le gouvernement du Canada (dans le cadre de la Loi canadienne sur la protection de l'environnement (1999)) a défini les substances perturbatrices du système endocrinien comme étant des substances qui ont la capacité de nuire à la synthèse, à la sécrétion, au transport, à la fixation, à l'action ou à l'élimination des hormones, et qui peuvent avoir des effets sur le maintien de l'homéostasie, la reproduction, le développement ou le comportement d'un organisme. Les effets sur la reproduction peuvent être caractérisés par une taille réduite des gonades et des indicateurs plus élevés de l'utilisation d'énergie (croissance, taille du foie et condition), lesquels indiquent que de l'énergie est disponible, mais que les poissons n'utilisent pas cette énergie aux fins de reproduction (Munkittrick et al., 1991). Les métaux lourds sont particulièrement reconnus pour être des substances perturbatrices du métabolisme et du système endocrinien, y compris le cadmium, le cuivre, le plomb, le fer, le mercure et le sélénium (Hewitt et Servos, 2001; Fajreaus-Van Ree, 2004). Ces métaux lourds ont été associés à des réactions de stress et à une fonction des surrénales des poissons altérées en laboratoire et à l'état sauvage (Brodeur et al., 1998; Brodeur et al., 1997). Hontela et al. (1992) ont démontré que les poissons présentent une diminution liée à l’exposition du coefficient de condition et de l'efficacité de la croissance de même qu'une capacité réduite d'élever le cortisol sanguin.
12.4.3.3 Eutrophisation
L'eutrophisation (caractérisée par une augmentation du poids des gonades et du foie, et par une amélioration de la condition) peut découler d'une diminution de la taille de la population ou d'une augmentation de l'habitat et des ressources alimentaires. La diminution de la taille de la population peut être liée à l'augmentation de la prédation en raison d'une plus grande abondance de prédateurs, ou encore, à l'augmentation de la mortalité en raison du vieillissement de la population. Toutefois, une augmentation du taux de reproduction pourrait se traduire à long terme par une augmentation de jeunes poissons, ce qui pourrait tôt ou tard mener à la limitation des ressources alimentaires (Gibbons et Munkittrick, 1994) si la population de jeunes poissons n'est pas contrôlée par la prédation.
12.4.4 Profils de réponse de la communauté benthique
Les indicateurs d'effet (et les critères d'effet) du Programme d'ESEE de la communauté benthique sont la densité (le nombre d'animaux par unité de surface), la richesse taxonomique (nombre de taxons), l'indice de similarité (indice de Bray-Curtis) (mesure des différences dans la structure de la communauté entre deux assemblages) et l'indice de régularité (indice de régularité de Simpson) (régularité avec laquelle les individus sont répartis entre les taxons). En comparant ces critères d'effet entre une zone exposée et une zone de référence, ou le long d'un gradient, il est possible de déceler des différences structurelles dans la communauté benthique. Cette information peut servir à déterminer la quantité d'énergie disponible pour les poissons, et de ce fait, elle constitue une mesure de la santé de l'habitat des poissons. Le chapitre du Guide pour l'ESEE pour le secteur des pâtes et papiers portant sur la recherche des causes et la recherche de solutions (Environnement Canada, 2010) et Munkittrick et al. (2000) fournit certains renseignements détaillés sur les profils des effets et quelques profils de réponse interprétables. Les profils de réponse interprétables possibles dont les mines pourraient tenir compte sont, par exemple, la limitation des éléments nutritifs, la toxicité et l'eutrophisation. D'autres profils de réponse existent et peuvent s'appliquer.
12.4.5 Profils des effets possibles sur le benthos
Deux profils d'effets sont décrits ci-dessous; d'autres existent et peuvent également s'appliquer.
12.4.5.1 Eutrophisation/étouffement
L'eutrophisation, ou l'enrichissement en éléments nutritifs, est un processus de surfertilisation d'un plan d'eau par des éléments nutritifs qui se traduit par la production d'une quantité de matière organique plus importante que ce que les réactions d'auto-épuration peuvent traiter (Chambers et al., 2001). Le degré d'eutrophisation qui a une incidence sur les invertébrés benthiques peut varier de léger à modéré ou prononcé. Dans le cas d'une eutrophisation légère à modérée, la réponse type est une augmentation de l'abondance et du nombre de taxons d'invertébrés benthiques (richesse taxonomique) relativement aux conditions de référence. Une eutrophisation prononcée (richesse taxonomique réduite, densité accrue) commencera à modifier la composition de la communauté benthique. L'hypereutrophisation ou l'eutrophisation prononcée peut être observée lorsque l'abondance1 et la richesse taxonomique des organismes benthiques déclinent; à cette étape, les répercussions négatives sur les stocks de poissons et les végétaux sont généralement observées lorsque l'oxygène est consommé par la matière organique en décomposition (Environnement Canada, 2007; Lowell et al., 2000).
Certaines études dans la documentation scientifique laissent entendre que le phosphore forme des complexes avec les métaux dans la colonne d'eau (solides en suspension); ces complexes se déposent ensuite dans les sédiments (Ledo et al., 2004; Pereira et al., 2008). Dans certaines conditions (milieu réducteur, saisonnalité (automne/hiver), lumière du jour), le phosphore est libéré, ce qui cause l'eutrophisation (Ledo et al., 2004; Pereira et al., 2008). L'ammoniac et les nitrates sont généralement élevés en raison des matériaux de dynamitage, de la décomposition du cyanure ou de l'apport en eaux usées (CCME, 2009); ces deux produits peuvent agir comme substances toxiques, mais elles peuvent également contribuer à l'enrichissement.
L'eutrophisation prononcée est généralement associée à l'augmentation du nombre et du type de taxons (benthiques) qui résistent aux polluants (p. ex. oligochètes, chironomidés ou nématodes) et à la diminution du nombre et du type d'espèces sensibles (p. ex. les éphéméroptères, les plécoptères ou les trichoptères). L'eutrophisation sévère masque fréquemment les effets toxiques qui auraient pu être mesurés (Lowell et al., 2000).
12.4.5.2 Toxicité/étouffement
Les métaux-traces sont potentiellement toxiques pour les organismes et peuvent avoir une incidence sur le rendement individuel et de la population. Des diminutions de la richesse taxonomique et de l'abondance constituent généralement un signe d'effets inhibiteurs globaux, comme la toxicité ou l'étouffement (Lowell et al., 2000). De tels changements au niveau de la population sont observés dans la structure de la communauté benthique, avec des variations vers une composition des espèces de plus en plus simple et souvent prévisible puisque les taxons sensibles se raréfient ou disparaissent et que les taxons qui tolèrent mieux les métaux dominent (Clements, 2004; Pollard et Yuan, 2006; Courtney et Clements, 2002; Canfield et al., 1994).
Des conditions aquatiques anoxiques ou hypoxiques peuvent être observées lorsque l'oxygène est consommé par la matière organique en décomposition. Si les courants sont faibles et ne parviennent pas à entraîner les matières organiques, ces conditions peuvent donner lieu à la formation de composés réduits potentiellement toxiques, comme le méthane, l'ammoniac et le sulfure d'hydrogène (Pearson et Rosenberg, 1978). Les conditions toxiques et anoxiques peuvent abaisser les taux d'alimentation des invertébrés, ce qui pourrait réduire la croissance et la biomasse des invertébrés (ce qui, à son tour, a une incidence sur la communauté de poissons) (Lowell et al., 2000).
12.4.5.3 Conditions méromictiques/hypoxiques
L'effluent des mines peut produire une stratification dans certains lacs profonds, ce qui donne lieu à des conditions méromictiques dans ces lacs. Le mélange saisonnier généralement observé n'a pas lieu, ce qui donne lieu à des différences verticales et temporelles des métaux dissous, et au cycle méromictique de certains métaux. L'oxygène dissous à des profondeurs sous la chemocline du lac n'est pas renouvelé, ce qui se traduit par un appauvrissement en oxygène (Sánchez et al., 2008; Szarek-Gwiazda et Żurek, 2006; Campbell et Torgersen, 1980). Ceci mène ultimement à des conditions toxiques et à la perte de l'habitat.
12.5 Approche progressive (élimination)
12.5.1 Évaluation des données sur la réduction de la toxicité et évaluation des données sur la toxicité
12.5.1.1 Évaluation des données sur la réduction de la toxicité
Une évaluation des données sur la réduction de la toxicité est une méthode de diagnostic par étape propre à un site visant à régler les problèmes de toxicité (Novak et Holtze, 2012). Des protocoles visant à étudier les causes probables de la toxicité ont été mis au point par l'EPA des États-Unis (1989) et sont connus en tant qu'études d'évaluation des données sur la réduction de la toxicité et d'évaluation des données sur la toxicité.
Les objectifs généraux des processus d'évaluation des données sur la réduction de la toxicité et d'évaluation des données sur la toxicité (EPA des États-Unis, 1989) doivent dicter les interventions nécessaires pour réduire la toxicité de l'effluent à des niveaux acceptables. Une approche en six étapes fondée sur l'EPA des États-Unis (1989), (1991a), (1991b), (1993a) et (1993b) et Novak et Holtze (2012) a été mise au point et est axée sur la réduction de la toxicité de l'ensemble de l'effluent au lieu d'éléments précis de l'effluent. Les six étapes sont les suivantes :
- Information et acquisition de données
- Évaluation des mesures correctives utilisées pour réduire la toxicité de l'effluent
- Évaluation des données sur la toxicité de l'effluent :
- Phase I : Caractérisation de la toxicité au moyen de traitements variés
- Phase II : Identification des substances toxiques soupçonnées
- Phase III : Confirmation des substances toxiques
- Recherche et identification des sources de toxicité dans l'installation
- Évaluation de la traitabilité de la toxicité aux fins de réduction de la toxicité dans l'effluent terminal
- Confirmation et élimination de la toxicité
12.5.1.2 Évaluation des données sur la toxicité
L'approche relative à l'évaluation des données sur la toxicité utilise les réponses des organismes qui ont été obtenues dans le cadre d'un essai biologique approprié pour déceler la présence d'agents actifs. Cette approche permet de caractériser les substances actives d'intérêt dans une matrice complexe qui comprend trois phases : la caractérisation, l'identification et la confirmation des substances toxiques.
- Les méthodes d'évaluation des données sur la toxicité aquatique de la phase 1 ont initialement été mises au point pour être utilisées conjointement avec les essais de toxicité aiguë chez les ménés à grosse tête ou Ceriodaphnia dubia (EPA des É.‑U., 1991a), mais elles ont été adaptées aux essais de toxicité sublétale (EPA des É.‑U., 1991b).
- L'identification de la toxicité aquatique à la phase II est décrite dans le document de l'EPA des États-Unis (1993a).
- La confirmation de la toxicité aquatique à la phase III est décrite dans le document de l'EPA des États-Unis (1993b).
Des protocoles d'évaluation des données sur la toxicité existent également pour la toxicité des sédiments et de l'eau interstitielle (EPA des É.‑U., 1991c et 1997) et la toxicité marine (phase I uniquement) (EPA des É.‑U., 1996).
Dans le cadre de traitements normalisés de caractérisation de l'effluent de la phase I de l'EPA des États-Unis, l'effluent ou l'eau est soumis à différents traitements qui séparent les catégories chimiques précises (par exemple, filtration, aération, extraction, chélation). Ce processus d'élimination sert à déterminer la façon dont sa chimie et sa toxicité sont modifiées après un tel traitement. Une part importante de la toxicité observée dans les effluents industriels est souvent attribuable aux effets du pH. Par conséquent, l'ajustement de pH est utilisé tout au long de la phase I afin de fournir de plus amples renseignements sur la nature des substances toxiques. Dans tous les cas, la toxicité d'échantillons traités est comparée à celle d'échantillons non traités pour déterminer quelle approche, s'il y a lieu, réduit la toxicité.
L'un des principaux avantages du processus d'évaluation des données sur la réduction de la toxicité et d'évaluation des données sur la toxicité est qu'il intègre les réponses des organismes dans l'évaluation de mélanges complexes afin de déterminer l'identité d'une ou plusieurs substances responsables de la toxicité. Les tentatives d'utilisation du dépistage chimique seul pour identifier les substances responsables de la toxicité sont généralement infructueuses.
L'identification de la cause de la toxicité transitoire ou non persistante peut être difficile et nécessiter le traitement et l'analyse d'un grand nombre d'échantillons.
Des études de cas utilisant l'évaluation des données sur la réduction de la toxicité et l'évaluation des données sur la toxicité ont été présentées par Novak et Holtze (2012) lors de l'atelier de 2009 sur la recherche des causes.
12.5.2 Exemple d'un cadre de recherche des causes pour l'évaluation des données sur la réduction de la toxicité et l'évaluation des données sur la toxicité
Le cadre de recherche des causes est une application de l'approche d'évaluation des données sur la réduction de la toxicité et d'évaluation des données sur la toxicité dans le contexte de la recherche des causes. Ce cadre a été mis au point par Hewitt et al. (2003) et il est décrit plus en détail dans le chapitre du Guide pour l'ESEE pour le secteur des pâtes et papiers portant sur la recherche des causes (Environnement Canada, 2010). Le cadre comprend des questions étape par étape qui suivent une approche progressive (figure 12-1). Les questions sont définies par un continuum de phases d'enquête, chacune fournissant plus de renseignements au sujet de la cause de l'effet avec des investissements concomitants de temps et de ressources. Un examen des renseignements pertinents au sujet de l'histoire de la mine, du type de processus, des modifications du processus ou du fonctionnement, de l'étendue et de l'ampleur des effets, de même que des profils de réponse observés dans les phases de suivi des effets sur l'environnement est essentiel avant de prendre des décisions au sujet des étapes initiales et de l'orientation de la recherche des causes. Les lignes directrices pour répondre à ces questions ont évolué en réponse à l'examen de la documentation publiée et des résultats en cours du programme de suivi des effets sur l'environnement pour le secteur des pâtes et papiers (Hewitt et al., 2003).
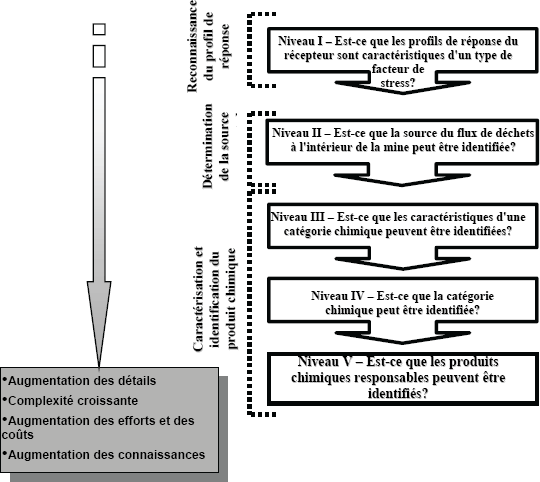
Figure 12-1: Cadre de travail par niveau pour la recherche des causes dans le suivi des effets sur l'environnement (Hewitt et al., 2003) (description longue).
12.5.2.1 Définition des profils de réponse
La première étape consiste à définir les profils de réponse. La caractérisation d'un ou de plusieurs types de facteur de stress fondée sur les profils de réponse sera très avantageuse pour toute recherche des causes dès le début, en précisant où porter attention et en permettant la meilleure utilisation des ressources possiblement limitées. Une fois que le profil de réponse a été défini, le cadre de travail (figure 12-1) est divisé par niveau pour identifier le facteur de stress pour ce type de profil.
12.5.2.2 Identification de la source et fonctionnement sélectif des processus en usine
L'objet de l'identification de la source est de tenter de préciser ou d'isoler des flux de déchets spécifiques dans le processus de fabrication ou de traitement qui sont responsables des effets observés mesurés dans le milieu récepteur. Les études devraient commencer par un examen systématique de chaque flux à traiter lors de la recherche de la source des effets dans la mine.
La détermination d'une ou plusieurs sources de l'effet a plusieurs résultats potentiellement importants, dont 1) concentrer les enquêtes supplémentaires dans un secteur donné de la mine pour effectuer un inventaire plus détaillé des sources du flux à traiter, des quantités, et des qualités et toxicités du flux de déchets; 2) identifier un secteur de la mine où les opérations peuvent être examinées pour assurer que les « activités normales » se déroulent et pour éliminer les anomalies; 3) évaluer la possibilité de traitement de la source et des conséquences en ce qui a trait à la qualité de l'effluent terminal; 4) concentrer les enquêtes détaillées subséquentes sur une ou plusieurs sources du flux de déchets, y compris l'identification des produits chimiques.
En général, des essais de toxicité aiguë sont effectués sur différents flux de déchets de l'usine. À l'aide de données sur la toxicité aiguë, il est possible d'isoler les flux de déchets qui pourraient servir à effectuer des essais de toxicité sublétale à plus long terme. L'attention devrait être portée sur les constituants de l'effluent qui seraient transportés par le traitement primaire et qui auraient une incidence sur la qualité de l'effluent terminal. De plus amples renseignements sont disponibles dans Environnement Canada (2010), Rickwood et al. (2006) and Martel et al. (1997). Des essais à plus long terme peuvent être effectués à l'aide d'une variété d'approches, incluant des mésocosmes, des essais biologiques en laboratoire, des essais du cycle de vie partiel ou complet, etc.
12.5.2.3 Isolation et caractérisation du produit chimique
Cette étape représente une évaluation des données sur la toxicité. Si l'identification des flux de déchets n'a pas fourni suffisamment de renseignements pour caractériser l'effet, les procédures ci-dessous peuvent être utilisées pour isoler et identifier les substances responsables.
La caractérisation et l'identification du produit chimique peuvent être très complexes. Les caractéristiques du composé, les catégories de composé ou les composés eux-mêmes peuvent être déterminés; cependant, chaque étape devient plus coûteuse et plus complexe. Les approches décrites dans cette section sont conçues pour déterminer les caractéristiques particulières des produits chimiques qui sont responsables des effets faisant l'objet d'une enquête. Les renseignements provenant d'études sur le terrain, de l'identification de la source, d'études de laboratoire et du profil d'exposition peuvent fournir des indications sur la catégorie chimique.
La phase I de l'évaluation des données sur la toxicité comprend la caractérisation de la catégorie chimique : 1) déterminer les caractéristiques des agents actifs et 2) déterminer si l'effet est causé par les mêmes substances. Cette étape utilise des méthodes spécifiques pour isoler les produits chimiques actifs et proposer des structures aux fins d'identification. Les propriétés physicochimiques des substances actives peuvent être décrites à l'aide de manipulations de l'effluent couplées à un essai biologique qui reproduit les effets sur le terrain ou qui est mécaniquement lié à ces effets (voir la section 1.2.6.2.6 du chapitre portant sur la recherche des causes du Guide pour l'ESEE) (Environnement Canada, 2010). Chaque essai est conçu pour modifier les substances ou leur biodisponibilité afin que l'information sur la nature des substances puisse être obtenue.
La phase II de l'évaluation des données sur la toxicité comprend l'identification de la catégorie chimique. Les composants actifs sont isolés ou séparés davantage des substances inactives aux fins d'identification et de confirmation. Ces méthodes sont propres aux catégories de produits chimiques et elles utilisent les réponses à l'essai biologique (voir la section 1.2.6.2.6 du chapitre portant sur la recherche des causes du Guide pour l'ESEE) (Environnement Canada, 2010) pour évaluer la réussite ou d'échec de l'extraction, de la séparation et de la concentration des substances bioactives. Les étapes de l'isolation du produit chimique s'effectuent de manière itérative, en fonction des réponses à l'essai biologique, jusqu'à ce que d'autres isolations ne soient plus possibles ou que les produits chimiques potentiels soient identifiés. Une fois qu'il existe des preuves solides indiquant qu'un ou plusieurs produits chimiques potentiels sont associés à la réponse, la troisième phase de l'évaluation des données sur la toxicité (ci-dessous) peut être entreprise.
La phase III de l'évaluation des données sur la toxicité comprend l'identification du produit chimique responsable. Cette étape comprend les techniques pour confirmer que les substances proposées sont réellement responsables de la toxicité observée. Ceci est généralement accompli par un regroupement des renseignements obtenus à l'aide de la méthode du poids de la preuve qui établit collectivement l'identité des composés actifs et la cause de l'effet de façon continue au fil du temps afin que les efforts d'amélioration puissent traiter adéquatement l'effet. Les approches de confirmation comprennent les éléments suivants :
- Approche de corrélation : une relation solide et cohérente entre les concentrations des agents soupçonnés et la réponse à l'essai biologique peut être établie.
- Approche fondée sur les symptômes : différentes substances actives produisent souvent des symptômes différents en réponse à un essai. En comparant les expositions de l'échantillon d'effluent à ceux des substances actives pures soupçonnées, une personne peut obtenir des preuves supplémentaires à savoir si les agents soupçonnés sont responsables. Des exemples de symptômes incluent la sensibilité des espèces, les formes des courbes dose-réponse et le temps nécessaire pour que l'effet se produise.
- Approche par ajout connu : les agents soupçonnés sont ajoutés à l'effluent afin de déterminer si une réponse proportionnelle est obtenue pendant l'essai biologique.
12.6 Méthode intégrée (poids de la preuve)
12.6.1 Utilisation de la méthode du poids de la preuve
Faire la distinction entre les effets cumulatifs de plusieurs facteurs de stress (qui parfois ont des effets confusionnels) nécessite d'établir un lien de causalité définitif avec l'effluent de la mine qui est évalué. La surveillance environnementale des écosystèmes aquatiques est particulièrement susceptible à ces obstacles puisque ces écosystèmes reçoivent souvent plusieurs rejets d'effluents agissant ensemble. Les évaluations des résultats de surveillance dépendent souvent, en grande partie, de données de surveillance sur le terrain qui ne peuvent montrer que la corrélation (au lieu d'un lien cause à effet clair) entre l'effluent de la mine et l'effet observé. L’établissement d’un lien de causalité fort peut, toutefois, être avantagé par l'utilisation de la méthode du poids de la preuve, laquelle consiste à regrouper l'information provenant de plusieurs sources différentes, c.‑à-d. plusieurs éléments de preuve. La force du lien de causalité peut être évaluée en utilisant un ensemble officialisé de critères initialement mis au point dans le domaine de l'épidémiologie. Ces critères sont présentés dans le tableau 12-2, lequel est fondé sur les travaux de Fox (1991), Suter (1993), Gilbertson (1997), Beyers (1998), Culp (1999), Culp et al. (2000) et Lowell et al. (2000). Dans plusieurs cas, tous les critères ne peuvent pas être satisfaits ou les résultats de certains critères peuvent être incompatibles avec ceux d'autres critères. Dans ces cas, il peut s'avérer utile d'attribuer un poids à chaque critère en fonction de son importance relative pour une évaluation donnée. En particulier, les évaluations qui comprennent des preuves provenant d'expériences sur le terrain et en laboratoire seront plus robustes que celles uniquement fondées sur la surveillance sur le terrain. Souvent, il n'est pas nécessaire de satisfaire à tous les critères pour fournir un argument de causalité fort (p. ex. voir Beyers, 1998). Les avantages d'appliquer des critères officialisés aux évaluations de données générées par un programme de suivi des effets sur l'environnement comprennent, notamment : 1) aider à lier les différents regroupements de données sur les effets de facteurs de stress multiples; 2) attribuer plus précisément la causalité et 3) identifier les importantes lacunes en matière d'information (c.-à-d., critères qui n'ont pas encore été abordés). Ce type d'approche peut contribuer à rendre les évaluations des effets de l'effluent d'une mine plus rigoureux et robuste en regroupant des approches de rechange et des méthodes de recherche des causes.
Tableau 12-2 : Ensemble officialisé de critères de causalité formant une partie de la méthode du poids de la preuve pour l'évaluation des effets des effluents des mines. (description longue)
Critères de causalité pour la méthode du poids de la preuve
Corrélation spatiale du facteur de stress et effet le long d'un gradient allant des zones les plus exposées vers les zones les moins exposées
Corrélation temporelle d'un facteur de stress et effet en fonction de la durée d'exposition
Mécanisme plausible liant le facteur de stress à l'effet
Vérification expérimentale des effets d'un facteur de stress dans des conditions contrôlées et concordance des résultats expérimentaux avec les données de terrain
Force : courbe de l'exposition prononcée par réponse
Spécificité : diagnostic de l'effet de l'exposition à un facteur de stress particulier
Preuve d'exposition (contaminants ou autres indicateurs) dans le corps des organismes touchés
Uniformité de l'association facteur de stress/effet dans différentes études au sein de la région à l'étude
Cohérence avec les connaissances existantes d'autres régions où les mêmes facteurs de stress et effets ont été étudiés, de même que ceux qui sont analogues
12.6.2 La triade de la qualité des sédiments à titre d'exemple du poids de la preuve
L'utilisation de l'approche de la triade de la qualité des sédiments est recommandée pendant la recherche des causes des effets sur les communautés d'invertébrés benthiques (Parker et Dumaresq, 2002). Le Programme d'évaluation des techniques de mesure d'impact en milieu aquatique appuie l'utilisation de la triade de la qualité des sédiments à chaque site, mais non pour la surveillance de « routine » (ESG, 1999).
Initialement, la triade de la qualité des sédiments intégrait trois composants (éléments de preuve) : la chimie des sédiments pour déterminer la contamination chimique, les essais biologiques de toxicité des sédiments et la structure de la communauté benthique afin de déterminer l'état des biotes résidents (Chapman, 1992). À l'aide des différents éléments de preuve, des corrélations statistiques peuvent être formulées et intégrées dans une analyse du poids de la preuve (qualitative et quantitative), rendant les données plus puissantes que si chaque composant était interprété individuellement (voir Alden, 1992; Chapman, 1992; Warwick et Clarke, 1991).
La triade classique de la qualité des sédiments, qui est fondée sur la corrélation, peut permettre de tirer des conclusions définitives au sujet de l'état de pollution des sédiments contaminés (p. ex. l'exposition et les effets). Elle fournit le niveau minimal de renseignements nécessaires, c.-à-d., une évaluation préalable des risques en fonction de laquelle des hypothèses relatives à la cause peuvent être proposées. Dans le paradigme d'évaluation des risques fourni par Chapman et Hollert (2006), la causalité est abordée après la triade de la qualité des sédiments, dans laquelle les études initiales sont relativement simples et servent à fournir des conclusions définitives ou à indiquer des lacunes où d'autres renseignements sont nécessaires. Des conclusions définitives au sujet de la causalité ne peuvent pas être tirées sans effectuer d'autres études. La recherche des causes est examinée à un niveau plus élevé, c.-à-d., une évaluation plus détaillée. Chapman et Hollert suggèrent d'ajouter quatre catégories supplémentaires d'éléments de preuve à la triade de la qualité des sédiments :
- Remplacements directs ou ajouts à la modification existante des éléments de preuve : histopathologie des poissons de fond, exposition du crabe et santé.
- Variations des éléments de preuve existants : essais de toxicité in situ ou par contact des sédiments (éléments de preuve de la toxicité); expériences de colonisation (modification des éléments de preuve).
- Éléments de preuve supplémentaires : exposition du crabe et santé; eau de surface; communauté de bactéries; bioamplification/empoisonnement secondaire; biomarqueurs.
- Éléments de preuve pour déterminer la causalité : morphologie de l'habitat (évaluations des données sur la toxicité); analyses guidées par les effets; résidus corporels critiques; essais in situ par contact des sédiments et essais de toxicité en laboratoire; biomarqueurs et paramètres propres au mécanisme.
Aperçu de la méthode d'étude à l'aide de la triade de la qualité des sédiments
- collecte d'échantillons;
- chimie des sédiments;
- essai en laboratoire de la toxicité des sédiments;
- identification et dénombrement des invertébrés benthiques dans les échantillons de sédiments;
- collecte de poissons pour l'analyse des tissus;
- analyse supplémentaire;
- analyse des données et préparation du rapport.
1) Prélèvement d'échantillons
Des échantillons sont prélevés dans les zones de référence et dans les zones d'exposition ou le long d'un gradient d'exposition afin d'aider à délimiter l'étendue géographique de l'effet. Le nombre total de sites d'échantillonnage devrait être d'au moins dix, ce qui devrait fournir suffisamment de données pour effectuer une analyse statistique rigoureuse. Les échantillons recueillis à chaque emplacement devraient servir à l'analyse de la composition chimique, du benthos et de la toxicité des sédiments.
2) Composition chimique des sédiments
L'analyse de la composition chimique des sédiments devrait inclure les caractéristiques physiques (taille des particules et contenu organique total), les éléments nutritifs (p. ex. nitrate, nitrite, phosphore, ammoniac, azote total Kjehldahl (TKN)), la composition chimique générale (p. ex. potassium, chlore, sulfate) et les métaux (extractibles en totalité ou en partie) (ESG, 1999). Les paramètres chimiques pertinents au site devraient être analysés en fonction des renseignements obtenus préalablement du site, dont notamment la composition chimique de l'eau et de l'effluent. Des analyses du potentiel d'oxydoréduction devraient également être envisagées.
3) Essai en laboratoire de la toxicité des sédiments
Un ensemble de trois essais est idéal pour l'approche de la triade et nécessite l'utilisation de trois espèces différentes soumises à des essais (MEEO, 1997; ESG, 1999) (anciennement le ministère de l'Environnement et de l'Énergie de l'Ontario [MEEO], maintenant le ministère de l'Environnement de l'Ontario [MEO]). Ceci fournit une mesure de protection pour s'assurer qu'un effet biologique n'est pas manqué parce que l'espèce soumise à l'essai est insensible aux produits chimiques présents dans les sédiments. Il fournit également des organismes d'essai de différents niveaux trophiques de l'écosystème de sorte que les principaux groupes trophique pertinents (et leurs niveaux respectifs de complexité avec des capacités divergentes de métabolisation et de dépuration des produits chimiques) soient représentés. Les essais recommandés utilisent des invertébrés benthiques et des poissons et ils intègrent différents paramètres biologiques (p. ex. survie et croissance). Tout essai avec des organismes qui peut intégrer la reproduction devrait également être envisagé (p. ex. Ceriodaphnia dubia).
Les trois essais recommandés sont les suivants :
- Hyalella azteca, un essai de survie et de croissance de cet amphipode après 14 jours (Environnement Canada, 1997a)
- C. dilutus (anciennement Chironomus tentans (Shobanov et al., 1999)), un essai de survie et de croissance de cet organisme après 14 jours (Environnement Canada, 1997b)
- un essai de toxicité (Bedard, 1992; Van Geest et al., 2011a, 2011b) et de bioaccumulation (Van Geest et al., 2011a et 2011b) chez le méné à grosse tête après 28 jours
4) Identification et dénombrement des invertébrés benthiques dans les échantillons de sédiments
L'identification et le dénombrement des invertébrés benthiques devraient être effectués de la façon décrite au chapitre 4 du présent document d'orientation.
5) Prélèvements sur les poissons aux fins d'analyse des tissus
Cette étape est facultative et utile, surtout dans les zones où il existe un doute au sujet de la possibilité d'utiliser les poissons pour la consommation humaine. Le prélèvement de tissus sur les poissons pour effectuer des analyses des métaux fournirait de l'information à savoir si les produits chimiques présents dans les biotes résidents ont une incidence sur la possibilité d'utiliser les poissons pour la consommation humaine. Les tissus peuvent être congelés aux fins d'analyses futures (MEEO, 1997).
6) Analyse supplémentaire
Afin d'obtenir suffisamment d'éléments de preuve pour déterminer la causalité, Chapman et Hollert (2006) recommandent d'autres études provenant de leurs quatre catégories (ayant fait l'objet d'une discussion dans la section 12.6.2 ci-dessus). Le choix des espèces à utiliser dans les essais de toxicité et des éléments de preuve à examiner devrait être fait en fonction des contaminants, des récepteurs et des facteurs de stress potentiellement préoccupants.
Dans le modèle proposé par Chapman et Hollert (2006), la causalité peut être déterminée à l'aide des éléments de preuve suivants : la composition chimique des sédiments in situ, la colonisation benthique, l'évaluation des données sur la toxicité, l'analyse guidée par les effets ou le fractionnement guidé par les essais biologiques (pour identifier les contaminants organométalliques), la bioaccumulation/résidus corporels critiques, la morphologie de l'habitat et la dynamique sédimentaire. Les choix relatifs à ces éléments de preuve dépendront des résultats de la triade de la qualité des sédiments de l'évaluation préalable standard (analyse chimique, de la toxicité et des invertébrés benthiques).
7) Analyse des données et préparation du rapport
Cette dernière étape dans l'approche de la triade de la qualité des sédiments consiste à analyser statistiquement les données obtenues de l'étude des invertébrés benthiques, de l'analyse chimique et des essais de toxicité, de même que d'intégrer les résultats de cette analyse dans une méthode du poids de la preuve.
12.7 Toxicologie des métaux et bioaccumulation
Lors de l'atelier de recherche des causes associées aux mines de métaux de 2009, deux publications particulières sur la toxicité des métaux (EPA des É.-U., 2007 et Adams et al., 2011, et les références qu'elles contiennent) ont fait l'objet de discussions et elles devraient être consultées pour obtenir de plus amples renseignements. Le cadre de travail pour l'évaluation des risques associés aux métaux (EPA des É.-U, 2007) fournit des lignes directrices concernant les propriétés des métaux, comme la chimie de l'environnement, la biodisponibilité et la bioaccumulation. Dans le contexte de ce cadre de travail, divers articles liés aux métaux ont été rédigés, dont un par McGeer et al. (2004) qui traite de la biodisponibilité et de la bioaccumulation des métaux. La définition de la bioaccumulation, telle qu'elle est définie dans McGeer et al. (2004) et l'EPA des États-Unis (2007), est l'accumulation nette d'un métal dans un tissu ou dans un organisme entier qui résulte de l'exposition environnementale dans un milieu comme l'air, l'eau, le sol et les sédiments, de même que l'alimentation. La biodisponibilité est définie comme la mesure dans laquelle les métaux bioaccessibles sont absorbés sur, dans ou au travers des membranes biologiques des organismes (McGeer et al., 2004; EPA des É.-U, 2007). Les mesures de la bioaccumulation sont habituellement un indicateur efficace de la biodisponibilité des métaux. Une accumulation excessive de certaines formes dissoutes (espèces) de métaux est potentiellement toxique pour les organismes. Toutefois, il est important de noter que différents types d'organismes accumuleront les métaux à des degrés différents (Adams et al., 2011).
12.7.1 Écotoxicité des métaux
Dans la version de 2002 du Document d'orientation sur le Programme d'études de suivi des effets sur l’environnement des mines de métaux, il était présumé que la bioaccumulation pourrait servir à déduire directement la cause de la toxicité en fonction de la recherche sur les invertébrés (Borgmann et Norwood 1997, 1997a, 1997b) et des modèles de produits chimiques organiques (Campbell, 2012). Plusieurs progrès ont été réalisés sur le sujet de la bioaccumulation des métaux relativement à la toxicité et l'état actuel des connaissances scientifiques indique que la relation entre la bioaccumulation et la toxicité est confondue par la physiologie (Adams et al., 2011; EPA des É.-U, 2007). Il est maintenant reconnu que ce ne sont pas tous les métaux qui s'accumulent dans un organisme qui interagissent aux sites (p. ex. récepteurs biochimiques, organites, cellules, organes et tissus) de l'action toxique (McGeer et al., 2010). Les corrélations entre la toxicité et la bioaccumulation de métaux n'indiquent pas toujours une relation de cause à effet, notamment lorsque la relation subit une influence, comme cela est le cas pour la bioaccumulation de métaux et la toxicité. De plus, l'extrapolation des corrélations déduites des expositions en laboratoire à un seul métal aux effluents complexes où il peut y avoir un mélange de contaminants nécessiterait une validation complète. Une corrélation directe entre l'accumulation et la toxicité a été observée uniquement chez les invertébrés pour quelques métaux (des métaux non essentiels et non réglementés, comme le cadmium et le thallium) et formes organométalliques (McGeer et al., 2012; Borgmann et Norwood 1997a, 1997b, 1999; Borgmann, 2000). La bioaccumulation de cuivre et de zinc dans les tissus des invertébrés est moins utile, car ces éléments sont réglementés à différents degrés, bien que leurs concentrations naturelles peuvent être élevées (McGeer et al., 2012).
Pour obtenir une réaction biologique ou s'accumuler dans un organisme, les métaux doivent d'abord interagir avec une membrane cellulaire. Contrairement aux contaminants organiques, les métaux se trouvant dans le milieu aquatique (à l'exception des complexes organométalliques et métalliques neutres) sont incapables de traverser la membrane cellulaire par simple diffusion; au contraire, ils sont transportés (transport facilité) à travers la membrane cellulaire (Campbell, 1995, 2012). La physiologie des organismes séquestre ou détoxique des quantités importantes de métaux toxiques. La portion active des métaux du point de biologique ou métabolique qui est disponible pour contribuer à la toxicité doit le faire au site d'action et, de plus, les métaux totaux sont au mieux un substitut pour la fraction de métaux actifs sur le plan métabolique au site d'action (McGeer et al., 2010).
Puisque les métaux sont détoxiqués une fois qu'ils entrent dans l'environnement intracellulaire (Vijver et al., 2004; Luoma et Rainbow 2008), les prévisions simples de la toxicité associée aux métaux sur la base de quotas ou de charges de métaux (approche portant sur les résidus dans les tissus), comme c'est souvent fait dans le cas des contaminants organiques, sont rarement applicables (Campbell, 2012). Les métaux qui se lient à des protéines inductibles capables de liaison avec les métaux comme les métallothionéines, ou qui sont précipités dans des concrétions insolubles composés de granules riches en métaux, peuvent être considérés comme étant des métaux détoxiqués biologiquement, comparativement aux métaux dans des fractions sensibles aux métaux comme les organites et les protéines thermosensibles (Campbell, 2012). Un corollaire de ce modèle d’accumulation des métaux est le suivant : la tolérance ou la résistance des métaux se rattachera à la capacité d’un organisme de prévenir la liaison de métaux « inappropriés » à des sites sensibles. La liaison d’un métal « inapproprié » à un site sensible aux métaux, souvent appelée « débordement » ou détoxification incomplète, pourrait annoncer le début du stress induit par les métaux (Campbell et Hare, 2009).
12.7.2 Toxicité du sélénium
Le sélénium est un métal-trace qui présente un risque potentiel élevé en tant que substance toxique. Le sélénium, un nutriment essentiel, peut s'accumuler dans les tissus des poissons ovipares à la suite d'une exposition alimentaire (Palace, 2012). Bien que cet élément ne soit pas toxique pour les poissons adultes, à des concentrations légèrement élevées, il se dépose dans les œufs et peut provoquer la tératogénicité (Holm et al., 2005). Puisque la biogéochimie du sélénium est complexe, les critères basés sur les tissus (par opposition à la concentration aqueuse) sont généralement acceptés comme étant les indicateurs les plus fiables de toxicité potentielle du sélénium chez les poissons (EPA des É.‑U, 2004). L'indicateur le plus fiable de toxicité potentielle du sélénium est la mesure de la concentration dans les œufs ou les ovaires, bien que des courbes de toxicité propres aux espèces soient nécessaires pour obtenir une évaluation exacte du risque (Holm et al., 2005). Les muscles peuvent être utilisés comme substitut aux œufs et aux ovaires; toutefois, les corrélations entre ces tissus dépendent du partage du sélénium entre les muscles et les œufs, lequel varie en fonction du cycle reproducteur et entre les espèces (NAMC, 2008). En raison de l'incertitude liée au séjour des poissons très mobiles dans la zone étudiée et en raison du cycle reproducteur plus court de certaines espèces de poissons, la toxicité pour la reproduction peut ne pas être détectée adéquatement entre les phases de suivi des effets sur l'environnement (Palace, 2012). Par conséquent, la toxicité du sélénium peut être un important facteur à étudier en tant que source de toxicité lors de la recherche des causes. Beaucoup de renseignements sur la toxicité du sélénium ont été présentés dans les volets Toxicité des métaux et Toxicité aquatique générale de l'Atelier sur la toxicité aquatique de 2011.
12.7.3 Biomarqueurs (métallothionéine)
Les biomarqueurs sont des outils utilisés pour évaluer l'exposition propre à un métal. Des augmentations importantes des réponses du biomarqueur (soit au fil du temps ou relativement aux sites de référence) pourraient indiquer que des métaux sont biodisponibles dans le milieu récepteur. La métallothionéine, une protéine à faible masse moléculaire capable de se lier aux métaux (EPA des É.‑U, 2007), est considérée comme un biomarqueur de la pollution par des métaux lourds dans les environnements aquatiques et elle a reçu beaucoup d'attention. Dans le domaine des biomarqueurs pour les métaux, cette protéine se conforme à la majorité des critères définis pour de tels outils. Par exemple, la métallothionéine répond spécifiquement de façon proportionnelle à la dose aux modifications des niveaux ambiants d'un métal-trace ou d'un groupe de métaux-traces (Cd, Cu, Zn et Ag). De plus, des niveaux élevés de métallothionéine pourraient être associés aux effets nocifs sur les organismes et les populations puisque ces concentrations élevées indiquent l'échec de la détoxification des métaux, cependant lorsque cette capacité est dépassée, cela peut se traduire par la liaison non spécifique des métaux aux cibles cellulaires de la toxicité.
À ce jour, il n'y a pas de preuves recueillies sur le terrain à l'effet que les concentrations de métallothionéine répondent aux métaux comme As, Ni, Pb et Hg. De plus, le biomarqueur métallothionéine n'assurera pas le suivi de l'exposition à des produits chimiques non métalliques, comme l'ammoniac et le cyanure. La métallothionéine constitue un excellent biomarqueur des effets induits par les métaux; toutefois, l'extrapolation des données de laboratoire est déconseillée (EPA des É.‑U, 2007).
Des renseignements supplémentaires sur le métallothionéine se trouvent dans Couillard, 1997; Couillard et al., 1999; Giguère et al., 1999; Gillis et al., 1999; Laflamme et al., 1998; Perceval et al., 1999; Pinel-Alloul et al., 1999; Wang et al., 1999 et EPA des É.‑U, 2007.
12.7.4 Utilisation de méthodes de bioaccumulation
Pour évaluer la toxicité du métal, le cadre de travail pour l'évaluation des risques associés aux métaux (EPA des É.‑U, 2007) devrait être consulté puisqu'il traite de questions liées aux méthodes ou aux outils utilisés pour indiquer la biodisponibilité du métal, de même que des approches scientifiques pour déterminer la bioaccumulation des métaux (EPA des É.‑U, 2007). De plus, Adams et al. (2011) résume les travaux du sous-groupe d'experts de la Society of Environmental Toxicology and Chemistry (SETAC) sur la bioaccumulation des contaminants métalliques. Ce sous-groupe a évalué l'utilisation potentielle des résidus métalliques dans les tissus pour prévoir les effets dans les organismes aquatiques (Adams et al., 2011).
L'approche hiérarchique suivante pour évaluer si les métaux sont responsables des effets confirmés dans les milieux récepteurs des mines de métaux a été présentée par Peter Campbell lors de l'atelier de recherche des causes associées aux mines de métaux de 2009 (Campbell, 2012) (l'approche tient compte des interactions entre le métal et l'organisme qui ont été présentées précédemment et elle peut s'appliquer aux métaux non essentiels) :
- Déterminer les organismes bioindicateurs appropriés qui vivent dans les zones d'exposition et les zones de référence. Les critères pour la sélection des organismes bioindicateurs sont bien établis (Phillips et Rainbow, 1993). Si des organismes indigènes ne sont pas disponibles, des organismes en cage peuvent être envisagés.
- Pour chaque espèce de bioindicateur, choisir l'organe cible approprié (p. ex. les branchies ou le foie, ou pour certaines petites espèces, les concentrations dans l'ensemble de l'organisme) (approche du fractionnement cellulaire).
- Comparer les concentrations de métaux bioaccumulés dans les spécimens prélevés dans la zone de référence et la zone d'exposition. L'observation de concentrations de métaux considérablement plus élevées chez les spécimens exposés représente une preuve suffisante qu'au moins un de ces métaux est responsable des effets confirmés. Il faut noter qu'en se fiant à la bioaccumulation des métaux (plutôt qu'à la détermination des concentrations de métaux et à la spéciation des métaux dans le milieu récepteur), cela pourrait permettre d'éviter de devoir estimer la biodisponibilité des métaux observés dans le plan d'eau recevant l'effluent minier.
- Pour améliorer l'interprétation des concentrations de métaux bioaccumulés, déterminer le partage cellulaire (fractionnement cellulaire) des métaux dans les organismes cibles (Campbell et Hare, 2009). Cependant, cette distinction entre les métaux détoxiqués du point de vue biologique et les métaux ayant « débordé » sur des sites sensibles aux métaux serait uniquement justifiée pour les espèces de bioindicateurs qui démontrent une réponse-seuil claire à une exposition accrue aux métaux (voir la discussion dans Campbell et al. (2008) et Campbell et Hare (2009)).
Campbell (2012) a également décrit une méthode pour départager l'importance relative des différents métaux dans un mélange. Cette méthode compare la transcription génétique entre les organismes exposés et les organismes de référence. Cette méthode semble prometteuse en tant qu'outil discriminateur de biosurveillance pour détecter et différencier les contaminants métalliques (Pierron et al., 2009; Walker et al., 2008).
12.7.5 Méthodes pour mettre la bioaccumulation et la toxicité en corrélation
Trois méthodes pour mettre la bioaccumulation et la toxicité en corrélation sont présentées brièvement ci-dessous.
12.7.5.1 Approche portant sur les résidus dans les tissus
L'utilisation de la bioaccumulation en tant qu'indicateur de la toxicité est connue comme étant l'approche portant sur les résidus dans les tissus, et cette approche mise sur l'établissement d'une relation dose-réponse afin de faire le lien entre les résidus présents dans les tissus et les effets toxiques. Le principe est que les concentrations dans les tissus sont un meilleur substitut que les concentrations d'exposition externe (eau, sédiment/sol ou régime alimentaire) pour caractériser la toxicité. Meador et al. (2011) indiquent que cinq mesures fondées sur l'exposition peuvent être utilisées dans l'approche portant sur les résidus dans les tissus, et qu'elles ont toutes des relations proportionnelles entre elles : concentration d'exposition externe, concentration dans l'organisme entier, concentration dans les organes, concentration cible et concentration dans le milieu récepteur. Les approches portant sur les résidus dans les tissus, établissant un lien entre l'accumulation et la toxicité, ont été mises au point pour certains métaux (p. ex. sélénium, cuivre, méthylmercure, cadmium, zinc, arsenic, cobalt, chrome et manganèse) dans certains poissons et invertébrés (Borgmann 2000; Tessier et al., 1993), y compris Hyalella (Adams et al., 2011; Borgmann et al., 2001; Norwood et al., 2007; Borgmann et al., 1991; Borgmann et Norwood, 1997a, 1997b; Borgmann et Norwood, 1999; Holm et al., 2005; Hodson, 1990; Ridal et al., 2010; Meador et al., 2011). L'utilisation de l'approche portant sur les résidus dans les tissus pour les métaux peut toutefois s'avérer problématique (Meador et al., 2011). Des études ont démontré que les relations avec la bioaccumulation pour Hyalella peuvent être uniques (Adams et al., 2011) et l'interprétation des données obtenues à partir des études sur Hyalella peut ne pas être claire (Wang et al., 2004). Adams et al. (2011) ont conclu que les approches portant sur les résidus dans les tissus pour les métaux autres que les organométaux ne sont pas prises en charge puisqu'elles n'ont pas permis de développer une approche généralisée pour estimer les effets, et dans les circonstances, la détermination de l'applicabilité peut nécessiter une validation sur le terrain. Sappington et al. (2011) discutent des avantages et des limites de l'intégration d'une approche portant sur les résidus dans les tissus dans une évaluation écologique. Par conséquent, une certaine prudence est de rigueur lorsque l'utilisation des approches portant sur les résidus dans les tissus pour la recherche des causes est envisagées, et l’Environmental Protection Agency des États-Unis (2007), Adams et al. (2011), Sappington et al. (2011) et les références citées dans le présent document devraient être consultés pour obtenir des renseignements supplémentaires. Bien que les approches portant sur les résidus dans les tissus sont un moyen complexe pour déterminer les relations relatives à la toxicité, il est toujours possible de les utiliser pour comprendre les causes des effets nocifs dans certains scénarios (p. ex. indication de l'exposition aux métaux pour déterminer quels métaux sont assimilés par les organismes).
12.7.5.2 Modèle du ligand biotique
Les métaux dans le milieu aquatique (à l'exception des espèces comme les complexes organométalliques et métalliques neutres) sont transportés à travers les membranes respiratoires ou digestives par transport facilité, à l'aide de systèmes de transport précis ou de canaux à l'intérieur des membranes (une liaison ionique aux ligands cellulaires ou un ligand assimilable comme le thiosulfate). Un tel déplacement est habituellement une fonction non pas des métaux dissous totaux mais plutôt de la concentration de fer métallique libre. Il s'agit du fondement du modèle du ligand biotique (Campbell, 2005, 2012). Le modèle du ligand biotique est un outil qui peut être utilisé pour évaluer quantitativement la façon dont plusieurs paramètres de la composition chimique de l'eau influencent la spéciation et la biodisponibilité des métaux dans le milieu aquatique (Niyogi et Wood, 2004; CCME 2007). Le modèle du ligand biotique fournit un exemple sur le moment où la bioaccumulation des métaux peut être appliquée avec succès en tant qu'indicateur d'un effet. Le modèle du ligand biotique est fondé sur des prédictions relatives à la liaison d'un métal au site d'action toxique, et cette approche intègre les interactions métalliques tout au long de la voie de toxicité exposition-absorption-accumulation (Di Toro et al., 2000, 2001; McGeer et al., 2010; McGeer et al., 2012). L'absorption de métaux dans le modèle du ligand biotique est fondée sur des estimations de la biodisponibilité relative de différentes formes dissoutes (espèces) de métaux. Ces interactions entre les espèces de métaux et le ligand biotique sont intégrées dans le cadre de modélisation en équilibre. La force des modèles du ligand biotique réside dans le fait qu'ils tiennent compte simultanément de la spéciation géochimique et de la liaison relative des espèces de métaux (ou de l'absence de liaison) au site de toxicité. D'autres renseignements sur le modèle du ligand biotique se trouvent dans Paquin et al. (1999, 2002a, 2002b), CCME (2007), USEPA (2003), Santore et al. (2001, 2002), Niyogi et Wood (2004) et McGeer et al. (2010).
12.7.5.3 Fractionnement cellulaire
Les méthodes de fractionnement cellulaire caractérisent la bioaccumulation dans un tissu ou un organisme entier. À l'aide des processus suivants, soit l'homogénéisation, la centrifugation et le traitement thermique, il est possible de faire une distinction entre les formes détoxiquées et les formes actives sur le plan métabolique à l'intérieur d'une cellule (Campbell et al., 2008; Campbell et Hare, 2009). Le fractionnement cellulaire de métaux bioaccumulés a le potentiel de fournir de l'information utile sur la toxicité des métaux. Les fractions comprennent des granules riches en métaux, des débris cellulaires, des organites (p. ex. mitochondries, microsomes et lysosomes), des protéines thermosensibles et des protéines non thermosensibles.
Les études ont groupé les parcelles cellulaires en groupes sensibles aux métaux, comme les mitochondries, et les protéines thermosensibles (où la toxicité du métal peut survenir), et en groupe inactif sur le plan métabolique, comme les granules et les protéines non thermosensibles (où l'accumulation de métaux est bénigne).
12.8 Approches pour les études sur le terrain portant sur les poissons et le benthos
Plusieurs outils peuvent être utilisés pour réaliser les études de recherche des causes à l'aide des poissons et du benthos. La rentabilité et la disponibilité des laboratoires indépendants, universitaires ou gouvernementaux devraient être prises en compte.
12.8.1 Plan d'étude sur le terrain
Les plans par gradient peuvent être utilisés pour associer le niveau d'un facteur de stress à la distance géographique entre les exutoires. La cooccurrence de la contamination avec les effets des métaux est un élément de preuve pour la détermination des effets des métaux. Les gradients de contamination offrent la possibilité de déterminer la cooccurrence des métaux avec des profils de réponse prévus (Luoma et Rainbow, 2008). Les plans d'étude sur le terrain, comme les plans par gradient et les plans de contrôle-impact sont traités dans d'autres chapitres. Les plans par gradient sont traités plus en détail dans les chapitres 2, 3, 4 et 9. D'autres plans d'étude sur le terrain, comme les plans de contrôle-impact sont traités aux chapitres 2 et 4.
12.8.2 Organismes en captivité
Les bivalves en cage sont traités au chapitre 9 (Autres méthodes) du présent document d'orientation technique.
Les études de recherche des causes peuvent avoir recours à des poissons ou des invertébrés sédentaires, ou à des techniques relatives à la captivité. Les essais biologiques à l'aide de cages sont souvent utilisés avec des individus plus vieux (taille plus grande) et moins sensibles puisque la taille des mailles de la cage doit être suffisamment grande pour permettre un échange d'eau adéquat afin d'empêcher des effets de cage, comme le salissage, la sédimentation et une faible concentration d'oxygène dissous.
Les poissons ont été utilisés en captivité in situ (Muir et al., 1991). Des discussions ont eu lieu au sujet de l'utilisation de poissons en cage en raison des préoccupations relatives aux effets interactifs du stress sur les poissons en cage (Courtenay, 2002). Il a été suggéré que les poissons de petite taille dont le domaine vital est plus restreint pouvaient être moins susceptibles de ressentir le stress et qu'ils conviendraient donc mieux à des études en captivité (Palace et al., 2005; Bandler et al., 2012). Cette méthode peut s'avérer utile dans la recherche des causes, notamment lorsque les effets des déversements doivent être résolus à une petite échelle spatiale, si cette méthode est optimisée pour réduire le stress (vérification de l'effet de la captivité sur le poids des poissons).
La mise en cage d'amphipodes pour des évaluations in situ des réponses biologiques aux conditions environnementales est une méthode établie (Grapentine 2012; Borgmann et al., 2007; Couillard et al., 2008; Mulliss et al., 1996; Muir et al., 1991; VanWingaarden et al., 1996; Henry et al., 1994). Les expériences peuvent être conçues a) pour évaluer les effets directs d'effluents ou de sédiments contaminés, b) pour faire le lien entre certains métaux et une toxicité ou une anomalie de la communauté benthique, c) pour établie les voies importantes d'exposition et d'absorption pour les contaminants, d) pour quantifier la relation entre les facteurs de stress et la réponse, et e) pour examiner les effets des facteurs naturels et autres facteurs de stress anthropiques.
La méthodologie est bien développée, elle n'est pas compliquée du point de vue technique, elle examine plusieurs voies d'exposition aux contaminants, elle se prête à une grande répétition expérimentale, elle incorpore de multiples facteurs biologiques, et son coût est faible à modéré. Les amphipodes sont maintenus dans des cages grillagées en plastique à des endroits sélectionnés à l'avance dans le milieu récepteur, cette étape étant suivie par la récupération et l'analyse en vue de déterminer la survie, la croissance ou les concentrations de métaux dans les tissus. Les cages peuvent être conçues pour une exposition à une colonne d'eau, à des sédiments et à une colonne d'eau, ainsi qu'à de l'eau interstitielle et elles sont déployées sur la majorité des substrats. Chaque cage peut contenir au moins 15 amphipodes sans entraîner un taux de mortalité significatif après le déploiement. La nourriture peut être ajoutée au départ ou au cours de l'expérience si elle ne constitue pas un facteur expérimental. Les amphipodes placés dans les cages peuvent être maintenus dans des seaux pendant plusieurs heures ou plusieurs jours sans qu'il y ait de décès associé à la manipulation ou au transport. Les paramètres suivants peuvent être mesurés : le nombre de survivants, la croissance individuelle moyenne durant la période d'exposition, l'estimation de la reproduction et des concentrations des éléments pertinents dans le corps entier. Une analyse de ces paramètres peut déterminer : les effets de l'emplacement ou du degré d'agression sur la santé des amphipodes et les populations; la bioaccumulation et la biodisponibilité des métaux; et si les concentrations de métaux dans les tissus sont associées à des effets nocifs pour l'organisme d'essai ou les espèces qui se nourrissent des amphipodes. La force de cette méthode est qu'elle peut faire la différence entre les effets des sédiments et de l'eau. La normalisation peut être nécessaire pour les essais sur des amphipodes autres que Hyalella azteca.
D'autres invertébrés aquatiques qui ont été utilisés dans des cages sur le terrain incluent les moucherons, les sangsues, les escargots (Henry et al., 1994) et la puce d'eau (Daphnia magna) (van Wingaarden et al., 1996).
12.8.3 Mésocosmes (poissons et invertébrés)
Les mésocosmes sont utiles pour déterminer les facteurs contributifs propres à l'effluent et ils sont traités en détail au chapitre 9.
12.8.4 Dispositifs pour la transplantation de communautés benthiques
Le dispositif pour la transplantation d'organismes benthiques découle de méthodes par gradient spatial utilisées dans le cadre de nombreuses ESEE dans les secteurs des mines et des pâtes et papiers menées sur des rivières, des ruisseaux, des réservoirs et des milieux marins complexes (Thomas, 2012). L'approche mise sur l'utilisation et la relocalisation (transplantation) de populations indigènes d'organismes benthiques et du substrat ou de l'habitat connexe, et elle a permis d'établir avec succès des tendances comparatives pour les communautés benthiques et la qualité du substrat sur les plans spatial et temporel (Thomas, 2012). Une caractéristique clé de cette approche est la capacité de faire ressortir de petites différences entre les sites (différences biophysiques, chimiques ou sur le plan des organismes benthiques), notamment : les changements liés à la distance mesurée par rapport à la zone d'exposition; l'abondance et la diversité de la communauté benthique; la qualité des sédiments (mesures chimiques et physiques, apparence); les changements touchant la biomasse; la présence et la compositions bactériennes; ainsi que les malformations et la symétrie liées aux organismes benthiques. De plus, cette méthode peut contribuer à séparer les effets historiques et liés à l'effluent actuel des autres sources de confusion et de variabilité d'origine naturelle et anthropique, de même qu'à déterminer le scénario d'exposition de l'effluent.
12.8.5 Macrophytes, périphyton, phytoplancton et chlorophylle
En plus des invertébrés benthiques, le phytoplancton, les macrophytes et le périphyton peuvent être évalués dans le cadre de la recherche des causes. AETE (1997) a évalué chacune de ces catégories biotiques en fonction de la sensibilité, la pertinence sur le plan écologique, la validité et la reproductibilité, la spécificité du site, et l'applicabilité.
12.8.5.1 Macrophytes
AETE (1997) a examiné plusieurs études qui ont montré une diminution de la diversité des espèces et l'abondance de macrophytes exposés à des eaux polluées par les métaux. L'absence de macrophytes des régions touchées où il devrait normalement y en avoir peut être perçue comme une indication de pollution (AETE, 1997). Les répercussions sur la densité et la biomasse des macrophytes pourraient toucher grandement les autres membres de la communauté d'eau douce puisqu'ils peuvent fournir un habitat aux organismes des niveaux trophiques plus élevés de la communauté. Les macrophytes sont sédentaires et fournissent une mesure de l'impact de la fraction biodisponible des métaux à l'aide d'une image intégrée dans le temps (Whitton et al., 1981). La composition de la communauté de macrophytes semble être plus un indicateur de stress environnemental à long terme qu'un outil de détection précoce des effets possibles. Kelly (1988), Haslam (1982), Small et al. (1996) et Sortkjaer (1984) ont élaboré des méthodes de surveillance des macrophytes pour l'évaluation de la pollution. Il y a plusieurs espèces de macrophytes fréquemment rencontrés dans les environnements canadiens qui sont recommandés en tant que candidats possibles pour la biosurveillance : Leptodictyum riparium, Potomogeton epihydrus v. nuttallii, Potomogeton sp., Fontinalis spp., Potomogeton richardsonii, Ericaulon esotangulare, Elocharis acicularis (AETE, 1997; Whitton et al., 1981; Crawford et Luoma, 1993). En même temps, il ne faut pas oublier que les populations de macrophytes varient de façon saisonnière dans la majorité des rivières et des lacs, des variations marquées de la biomasse, et qu'elles ne sont disponibles en tant qu'espèces pour la biosurveillance que pendant une saison de croissance relativement courte (Hellawell, 1986). L'utilisation de macrophytes dans le milieu marin n'est possible que dans les régions intertidales à substrat dur. Si cela est considéré être un habitat important qui est potentiellement touché par les effluents des mines, des études de quadrats du littoral pour examiner le pourcentage de couverture et la biomasse par unité de surface, les espèces majeures et l'épifaune connexe, comme les amphipodes, peuvent être des indicateurs complémentaires appropriés (AETE, 1997).
12.8.5.2 Périphyton
Le périphyton est généralement sédentaire et il intègre les effets des variables environnementales dans un délai assez court. Les microalgues faisant partie du périphyton sont importantes en tant que producteurs primaires dans les rivières et les zones littorales des lacs (Cattaneo et Kalff, 1980) et en tant que source de nourriture disponible pour les invertébrés (Whitton, 1984). En tant que source alimentaire pour les niveaux trophiques supérieurs, le périphyton joue potentiellement un rôle important dans le transfert de contaminants entre les niveaux trophiques. De plus, en raison de sa nature sédentaire, le périphyton est un bon indicateur des conditions locales et il joue un rôle clé à l'interface entre le substrat et les eaux environnantes, peut-être en exerçant une influence sur les voies biogéochimiques et la dynamique. Les organismes du tapis de périphyton peuvent avoir des taux de roulement relativement élevés. Par conséquent, ils sont parmi les premiers organismes à réagir au stress environnemental et parmi les premiers à se rétablir. Les espèces sensibles sont souvent remplacées par des espèces plus tolérantes (Austin 1983; Austin et al., 1985). Par conséquent, le périphyton reflète souvent les conditions environnementales actuelles (Lowe et Pan, 1996) et pourrait servir d'indicateur d'alerte rapide.
Le périphyton a été utilisé en tant qu'indicateur dans les évaluations de la qualité de l'eau de différents systèmes par un grand nombre de chercheurs (Chessman, 1985; Clements et Kiffney, 1994). Différentes méthodes d'échantillonnage ont été utilisées, incluant le grattage, le brossage ou l'aspiration. Les mesures structurelles du périphyton comprennent généralement le dénombrement des organismes, ce qui fournit des renseignements sur l'abondance, la diversité des espèces et la structure de la communauté, alors que les mesures fonctionnelles étudient les modifications dans la production primaire, la respiration et le traitement des déchets (Clements, 1991). Les communautés de périphyton comprennent souvent plusieurs espèces et elles occupent un petit espace géographique comparativement aux autres groupes aquatiques; des échantillons représentatifs peuvent être prélevés d'une surface de quelques centimètres carrés de substrat (Lowe et Pan, 1996). Toutefois, certains auteurs ont mentionné qu'il est difficile d'obtenir des échantillons représentatifs et uniformes en raison de l'hétérogénéité spatiale et de la difficulté à échantillonner les organismes (Weitzel et al., 1979; Kutka et Richards, 1986; St-Cyr, 2000). Peu importe les problèmes d'échantillonnage possible, plusieurs études ont caractérisé des communautés d'algues dans des cours d'eau et elles ont établi un lien entre l'abondance de taxons spécifiques et la présence de métaux (Clements, 1991; Whitton, 1984). Des études dans les lacs ont identifié des changements semblables dans la composition des espèces avec des pertes d'espèces sensibles aux métaux (Austin et Deniseger, 1985; Austin et al., 1985; Roch et al., 1985). Lowe et Pan (1996) ont conclu que les données de surveillance des algues benthiques seraient très intéressantes si elles étaient jumelées avec un ensemble de données de surveillance supplémentaires, y compris des mesures physiques et chimiques et l'analyse d'autres biotes de communautés aquatiques, comme les invertébrés.
12.8.5.3 Phytoplancton
La structure des communautés de phytoplancton peut être modifiée en réponse aux facteurs de stress environnementaux qui ont une incidence sur certaines espèces sensibles et pas sur d'autres. Cette approche a été largement utilisée pour étudier les effets de la pollution par les métaux et elle a été appliquée à la surveillance à long terme de la progression de la pollution aux sites des mines. La récolte sur pied et la biomasse (habituellement mesurées à l'aide de la chlorophylle a) des communautés de phytoplancton sont habituellement évaluées dans toute étude où les producteurs primaires sont pris en compte, et ces mesures ont été utilisées à titre d'indicateurs dans les programmes environnementaux à long terme aux sites des mines (AETE, 1997). Des tendances constantes de tolérance ou d'intolérance à la pollution par les métaux sont identifiées chez certaines espèces et elles peuvent servir d'avertissement précoce de la pollution par les métaux (AETE, 1997). À long terme, la biomasse ne semble pas être une mesure utile des effets de la contamination par des métaux sur les producteurs primaires, étant donné que les changements à long terme dans la composition des espèces ou la réduction de la pression exercée par le broutage peuvent contrebalancer toute réduction à court terme de la biomasse des algues (Yan, 1979). De plus, la biomasse se disperse, et la densité et la biomasse ont tendance à être semblables entre les zones d'impact et les zones de référence (AETE, 1997).
12.8.5.4 Indicateurs pour le phytoplancton et le périphyton
La mesure de la chlorophylle a, de la chlorophylle b et de la biomasse du phytoplancton et du périphyton peut s'avérer utile dans les cas où les rejets d'éléments nutritifs en amont représentent des influences confusionnelles, ou lorsqu'un enrichissement en éléments nutritifs provenant des effluents des mines est soupçonné. La concentration des pigments photosynthétiques est souvent utilisée pour estimer la biomasse du phytoplancton.
La biomasse du phytoplancton et du périphyton tend à avoir une distribution irrégulière et elle varie au fil du temps alors que les fleurs d'eau se développent et que l'eau se stratifie. Cette méthode est plus appropriée pour les lacs que les rivières, bien que les preuves d'une importante biomasse phytoplanctonique dans les échantillons riverains soit néanmoins un indicateur que les éléments nutritifs reflètent l'état trophique en amont et peuvent être, et sont probablement, pertinents dans l'évaluation des influences des éléments nutritifs (par opposition aux contaminants) sur la structure en aval des communautés benthiques, du zooplancton et probablement des poissons. Des critères ont été établis afin de classer l'eutrophisation en fonction du périphyton et du phytoplancton (Dodds et Welch, 2000; Dodds, 2006). Les éléments nutritifs et plusieurs autres facteurs dont la lumière, la température, la vitesse, les solides en suspension et les perturbations physiques peuvent avoir une incidence sur la composition et la biomasse de la communauté de périphyton (Culp et al., 1996; Chambers et al., 2006; Azim et Asaeda, 2005; Biggs et Kilroy, 2000). Les relations entre les éléments nutritifs et la biomasse du périphyton ont fait l'objet d'études (Dodds et Welch, 2000; Chambers et al., 2001).
Souvent, deux mesures courantes de la biomasse sont utilisées : la chlorophylle a, qui est utilisée comme indicateur de la quantité totale des organismes autotrophes dans l'échantillon, et la masse sèche sans cendre, laquelle est une mesure de la quantité totale de matières organiques dans l'échantillon. La masse sèche sans cendre comprend les microorganismes autotrophes et hétérotrophes vivants, le périphyton et les micro-invertébrés morts, et possiblement les débris terrestres. Il est recommandé d'analyser ces deux paramètres, car ils fournissent des renseignements complémentaires et qu'ils peuvent être jumelés afin de former un indice appelé « indice d'autotrophie » (Weber, 1973). D'autres renseignements sur l'utilisation de la chlorophylle a à titre d'indicateur de la biomasse se trouvent dans Weitzel (1979). Des méthodes pour déterminer la masse sèche sans cendre sont décrites dans Ridley Thomas et al. (1989) et dans Aloi (1990).
La chlorophylle a peut être mesurée à l'aide de la spectrophotométrie, de la fluorométrie ou de la chromatographie liquide, et en tenant compte de la chlorophylle b et c, des produits de dégradation de la chlorophylle (p. ex. chlorophyllides, phaéophorbides et phéophytines) et de la turbidité. De plus amples renseignements peuvent être obtenus sur les méthodes analytiques dans la Standard Methods for the Examination of Water and Wastewater (méthode 10200 H) (American Public Health Association (APHA), American Water Works Association (AWWA) et Water Environment Federation (WEF), 2001).
12.9 Méthodes de laboratoire et essais de toxicité
12.9.1 Paramètres histologiques et physiologiques
Les effets de la contamination peuvent être constatés non seulement à l'échelle de l'écosystème, de la communauté, de la population et de l'individu, mais également à l'échelle cellulaire, infracellulaire et moléculaire (Peplow et Edwards, 2005). Lors de l'atelier de recherche des causes associées aux mines de métaux (2009) (Environnement Canada, 2012), des travaux ont été présentés relativement à l'étude des paramètres et histologiques et physiologiques pour déterminer la cause de l'augmentation de la taille et du poids du foie et des gonades chez les poissons (Sharpe et al., 2012). L'histologie des gonades a été utilisée pour identifier le sexe et le niveau de maturité des poissons (en raison de la petite taille des poissons) de même que pour observer le développement asynchrone ou anormal. L'histologie du foie a été utilisée pour évaluer la pathologie clinique (difformités, anomalies et parasites), l'index mitotique du foie (indicateur de la prolifération cellulaire en réponse à des tumeurs ou à l'arsenic, par exemple), la vacuolisation lipidique et le contenu en glycogène. De plus, les paramètres physiologiques comme la teneur en glycogène et en triglycérides du foie ont été mesurés. Ces indices regroupés fournissent une indication de la fonction des gonades et du foie. Certains indicateurs et méthodes incluent : des méthodes de diagnostic de la toxicité hépatique (Wolf et Wolfe, 2005), des méthodes histopathologiques (Hinton et al., 1990, 2005; Costa et al., 2009; Werner et al., 2003) et des indicateurs physiologiques et biochimiques (Taylor, 2004; Weber et al., 2003; Werner et al., 2003).
12.9.2 Essais de toxicité
Des essais de toxicité létale et sublétale en laboratoire à l'aide de poissons et d'espèces benthiques à titre d'organismes d'essai, et de sédiments entiers, d'eau interstitielle des sédiments, d'effluents et d'eau à titre de milieu d'essai, peuvent permettre une détermination directe de la toxicité. Des essais de toxicité peuvent être utilisés conjointement avec plusieurs outils de surveillance et d'autres essais sur le terrain décrits ailleurs dans le présent chapitre pour aider à interpréter les résultats dans des situations où il y a des facteurs confusionnels, des rejets multiples ou des modifications de l'habitat découlant de rejets d'effluents de longue date. Ces méthodes d'essai de toxicité peuvent également être utiles pour identifier la cause de l'absence de taxons aux sites d'exposition.
Il y a un ensemble de méthodes d'essai en laboratoire; ce chapitre fait référence à certaines méthodes pertinentes, mais de nombreuses autres sont disponibles au Canada et dans d'autres organismes internationaux, tels que la Division des méthodes biologiques d'Environnement Canada de même que l'Environmental Protection Agency des États‑Unis, l'Organisation de coopération et de développement économiques, l'Union européenne, l'Organisation mondiale de la santé, etc. Il est recommandé que les essais de toxicité soient effectués par des laboratoires accrédités qui respectent les protocoles normalisés reconnus.
Les essais de toxicité létale et sublétale ont plusieurs limites qui doivent être prises en considération. Étant donné que les méthodes d'essai de toxicité en laboratoire ne permettent pas de déterminer la toxicité in situ, elles pourraient ne pas tenir compte de la toxicité liée aux eaux sus-jacentes, ou des effets de la composition chimique des eaux sus-jacentes sur la toxicité des contaminants lors de l'essai des sédiments ou de l'eau interstitielle des sédiments. Ces problèmes seront plus marqués lorsque la composition chimique de l'eau sus-jacente utilisée dans l’essai de toxicité diffère considérablement de l'eau in situ, ou lorsque les conditions sur le terrain ou pendant les essais de toxicité sont telles que les concentrations de contaminants dans l'eau sus-jacente sont loin d'être en équilibre avec les sédiments (Parker et Dumaresq, 2002).
12.9.3 Essai de toxicité sur les poissons : cycle de vie du méné à grosse tête
L'essai en laboratoire sur l'ensemble du cycle de vie du méné à grosse tête peut être utilisé pour évaluer les effets sur les poissons de l'exposition à long terme aux effluents (Parrott et al., 2012; Parrott, 2005; Parrott et Bennie, 2009). Cet essai sur l'ensemble du cycle de vie couvre toutes les « phases critiques » d'exposition pendant le cycle de vie des poissons, soit les œufs, le stade larvaire, le développement au stade juvénile, la période de reproduction des poissons adultes et le taux de survie de la première génération.
Les essais sur l'ensemble du cycle de vie sont longs et coûteux. Toutefois, ces essais permettent de simuler les effets d'expositions environnementales réelles et ils offrent des données qu'il serait impossible à obtenir en utilisant l'exposition des poissons en laboratoire sur de plus courtes durées. La méthode pourrait fournir des données utiles dans les cas où la capture de poissons sauvages est difficile (Parrott et al., 2012).
12.9.4 Essai de toxicité sur les sédiments entiers
Des essais de toxicité des sédiments peuvent servir à évaluer la contamination potentielle dans les milieux aquatiques (Parker et Dumaresq, 2002). Ces essais fournissent une méthode directe pour déterminer la disponibilité chimique des contaminants dans les sédiments, et ils peuvent être utilisés comme outil d'évaluation conjointement avec des données chimiques et l'analyse d'autres contaminants, l'analyse de la communauté benthique et d'autres outils de surveillance des sédiments, comme l'analyse en triade de la qualité des sédiments (voir la section 12.6.2). Les essais de toxicité sur les sédiments entiers fournissent une mesure directe de la toxicité en évaluant les effets des sédiments sur les organismes d'essai dans la zone d'exposition relativement aux effets associés aux sédiments du site de contrôle ou de référence. Les résultats des essais sont exprimés en termes de survie, de croissance et de reproduction comparativement à un site de référence. Les effets peuvent également être exprimés en tant que différence (en pourcentage) de la réponse dans les sédiments de contrôle ou de référence.
Les essais de toxicité sur les sédiments entiers peuvent être utilisés pour confirmer que les modifications dans les communautés d'invertébrés benthiques sont liées à la toxicité des sédiments et non à d'autres facteurs physiques ou biologiques. Les effets nocifs sur la structure de la communauté d'invertébrés benthiques pourraient être dus à la toxicité des sédiments, mais ils pourraient également être attribuables à d'autres facteurs (la prédation, les différences d'habitat, etc.). L'altération simultanée de la structure de la communauté d'invertébrés benthiques et de la toxicité des sédiments met les sédiments en cause en tant que responsables des effets sur la communauté d'invertébrés benthiques. Ces essais fournissent également des renseignements importants pour l'interprétation des effets sur le terrain dans des situations où les données sur la communauté d'invertébrés benthiques ne sont pas concluantes, ou lorsque seules les espèces tolérantes à la pollution sont présentes dans la zone d'exposition et dans la zone de référence.
Une série d'essais peut être effectuée pour démontrer la toxicité des sédiments pour plus d'une espèce. L'utilisation d'une batterie de tests aide à démontrer l'importance et le caractère universel de la réponse d'organismes de complexité variable (c.-à-d., nombre d'espèces réagissant) à la toxicité des sédiments. Les réponses relatives observées lors d'essais sur les sédiments avec différentes espèces peuvent contribuer à la détermination de la cause de la toxicité des sédiments si l'information sur la sensibilité relative des différentes espèces aux différents métaux est disponible dans la documentation. Les essais visant plusieurs espèces peuvent également aider à expliquer le lien entre la structure de la communauté d'invertébrés benthiques et la toxicité des sédiments. L'utilisation de plusieurs espèces lors d'essais de la toxicité permet de faire des comparaisons plus directes entre l'abondance/absence d'espèces d'invertébrés benthiques et les résultats des essais de toxicité avec les mêmes espèces, ou des espèces étroitement liées. Des procédures d'essai normalisées sont disponibles (Bedard et al., 1992; ASTM, 1997, 2010; Environnement Canada, 1997a, 1997b).
La limite des essais de toxicité sur les sédiments entiers est qu'il s'agit d'essais en laboratoire qui ne permettent pas de déterminer la toxicité in situ directement. De plus, si de l'eau sus-jacente régulière est utilisée (ce qui est généralement le cas), au lieu d'eau recueillie du site d'étude, les effets des différences de qualité de l'eau sus-jacente sur la toxicité des sédiments, s'il y a lieu, ne sont pas pris en compte.
12.9.4.1 Survie et croissance de Hyalella azteca
Hyalella azteca est un amphipode habitant dans les sédimentsqui estutilisé régulièrement dans les études menées sur le terrain et en laboratoire pour recherche la source et la cause de la toxicité des sédiments (Shuhaimi-Othman et al., 2006; Borgmann et al., 2004; Borgmann et al., 2005a, 2005b; Couillard et al., 2008; Ingersoll et al., 2000; Borgmann et Norwood 2002; Nowierski et al., 2005). Environnement Canada possède une méthode normalisée (SPE 1/RM/33 : Essai de survie et de croissance de l'amphipode dulcicole H. azteca dans les sédiments) (Environnement Canada, 1997a). Les paramètres de la méthode SPE 1/RM/33 sont la survie (toxicité létale) et la croissance (par masse sèche) après un essai de toxicité de 14 jours pour les sédiments dans l'effluent et dans l'eau. L'essai peut être exécuté à l'aide d'une ou de plusieurs concentrations (Environnement Canada, 1997a).
Taylor et al. (2012) ont modifié la méthode SPE 1/RM/33 afin de pouvoir utiliser un essai de toxicité dans les sédiments et un essai de toxicité dans l'eau seulement afin de distinguer les effets des rejets actuels de l'effluent de ceux de l'accumulation historique de métaux et d'autres substances toxiques dans les sédiments. L'essai de toxicité des sédiments comprend la préparation de différentes combinaisons de mélange sédiments/eau : trois types de sédiments (site d'exposition, référence sur le terrain et référence en laboratoire) sont chacun combinés à l'un des trois types d'eau (eau de dilution de laboratoire, eau de référence et eau du milieu récepteur) (maximum de neuf combinaisons possibles). En utilisant les combinaisons ci-dessus, il est possible de déterminer la toxicité de l'effluent ou dans les sédiments de façon indépendante. En utilisant une combinaison d'échantillons de sédiments et d'eau prélevés sur le terrain et en laboratoire, le plan d'étude tient également compte de l'influence que la composition chimique de l'eau propre à un site (p. ex. carbone organique dissous dans le milieu récepteur) peut avoir sur la toxicité (Taylor et al., 2012) (Borgmann et al., 2005c; Borgmann, 2002; Environnement Canada, 1997a; Ingersoll et al., 2000). L'essai avec l'eau seulement est fondé sur la méthode SPE 1/RM/33 et une méthode provisoire mise au point par Borgmann et al. (2005) pour une méthode à l'eau seulement. La conception de l'essai est fondée sur une exposition statique d'une durée de 14 jours avec renouvellement de l'eau pour examiner la survie et la croissance des organismes d'essai. Les essais effectués sur un échantillon d'eau du site de référence sur le terrain, un échantillon prélevé sur le terrain et un échantillon d'eau de dilution de laboratoire en l'absence de sédiments, mais en présence d'un substrat artificiel pour les organismes d'essai.
Les résultats combinés de l'étude présentée lors de l'atelier de recherche des causes associées aux mines de métaux (Taylor et al., 2012) indiquent que la méthode d'essai portant sur H. azteca (SPE 1/RM/33) est un outil rapide, rentable et facilement accessible lorsqu'il est combiné à des relevés sur les communautés benthiques et à des analyses chimiques (approche de la triade de la qualité des sédiments). Cette méthode peut être utilisée pour distinguer les effets biologiques de la contamination historique des sédiments de la qualité actuelle de l'effluent, en tant compte de la variabilité temporelle et de la toxicité des métaux dans l'eau et les sédiments. Cependant, la variabilité temporelle sur le plan des constituants de l'effluent doit être prise en considération au moment de décider si la qualité actuelle de l'effluent peut avoir une incidence sur la communauté d'invertébrés benthiques.
12.9.4.2 Survie et croissance des larves dulcicoles de chironomes Chironomus dilutus ou Chironomus riparius
Les chironomes ont été grandement utilisés dans les essais de toxicité des sédiments aux États-Unis et au Canada. La méthode d'essai normalisée par Environnement Canada est décrite dans SPE 1/RM/32 (Environnement Canada 1997b) : Essai de survie et de croissance des larves dulcicoles de chironomes (Chironomus tentans ou Chironomus riparius) dans les sédiments. Un sommaire et des références supplémentaires se rapportant aux procédures d'essai sur les chironomidés sont disponibles dans Environnement Canada (1997b). La méthode SPE 1/RM/32 expose dix organismes du deuxième stade larvaire de (C. dilutus anciennement C. tentans) ou du premier stade larvaire de (C. riparius) à un échantillon contenant des sédiments et de l'eau dans le cadre d'un essai biologique. À la fin de l'essai, les sédiments sont tamisés et les organismes (morts et vivants) sont récupérés. Les animaux survivants sont dénombrés, séchés et pesés. Les deux paramètres calculés sont le pourcentage moyen d'organismes qui ont survécu à l'exposition et le poids sec moyen par animal ayant survécu (Environnement Canada, 1997b).
12.9.4.3 Survie et reproduction de l'oligochète Tubifex tubifex
Cet essai est décrit dans ASTM (2010).
Les spécimens de Tubifex sont exposés à des quantités égales de sédiments et d'eau dans le cadre de l'essai biologique. Les individus matures sexuellement (âgés de huit semaines) sont introduits et incubés pendant 28 jours. La production de cocons indique la reproduction des organismes. À la fin de l'essai, l'échantillon est tamisé et nombre d'adultes survivants, le nombre de cocons pleins et vides, le nombre de jeunes de taille inférieure à 500 mm et le nombre de jeunes dont la taille est supérieure à 500 mm sont dénombrés à titre de mesures de la survie et de la reproduction.
12.9.4.4 Survie et croissance de l'éphémère Hexagenia limbata
Cet essai est décrit dans le « Laboratory Sediment Biological Testing Protocol » du ministère de l'Environnement de l'Ontario (Bedard et al., 1992) et dans ASTM (2010).
L'essai utilise de jeunes nymphes d'éphémère Hexagenia limbata qui ont de trois à quatre mois et qui sont élevées en laboratoire à partir d'œufs recueillis sur le terrain. De 10 à 15 spécimens de H. limbata sont exposés pendant 21 jours à de l'eau et des sédiments dans le cadre d'un essai biologique. Les animaux ne sont pas nourris au cours de cette période. À la fin de l'essai, le nombre d'animaux survivants est dénombré et les animaux sont séchés et pesés pour déterminer leur poids sec et ainsi obtenir une indication de leur croissance. La survie et la croissance dans les sédiments à l'étude sont comparées statistiquement à la survie et à la croissance dans le groupe témoin.
12.9.5 Métaux dans l'eau sus-jacente dans le cadre d'essais de toxicité sur les sédiments entiers
La mesure des métaux dans l'eau sus-jacente dans le cadre d'essais de toxicité sur les sédiments entiers peut être utilisée pour la quantification des métaux biodisponibles ou l'identification de la cause de la toxicité des sédiments. La mesure des métaux dissous dans l'eau sus-jacente peut fournir des renseignements sur la biodisponibilité relative des métaux dans les sédiments et, par conséquent, de leur la toxicité potentielle. Toutefois, la toxicité des métaux dans les sédiments n'est pas proportionnelle aux concentrations totales en métaux dans les sédiments, et la biodisponibilité peut varier grandement d'un sédiment à l'autre. La biodisponibilité des métaux, notamment pour H. azteca, semble souvent être principalement due aux métaux dissous dans l'eau sus-jacente (Deaver et Rodgers, 1996; Warren et al., 1998; Borgmann, 2000; Borgmann et Norwood, 1999a). Si des données sur la toxicité des métaux dans l'eau sont disponibles, et s'il est reconnu que la toxicité est principalement due aux métaux dissous pour les espèces d'invertébrés benthiques en question, les concentrations dans l'eau peuvent parfois être utilisées pour déduire la cause de la toxicité. L'utilisation des concentrations de métaux dans l'eau sus-jacente est limitée à des essais de toxicité statique pour lesquels l'eau sus-jacente n’est pas renouvelée.
La principale limite de ce type de mesure est que la toxicité des métaux peut être réduite considérablement par la complexation avec le carbone organique dissous qui s'écoule des sédiments par lixiviation. Les concentrations dans l'eau résultant d'un niveau donné de toxicité peuvent, par conséquent, être plus élevées dans les essais de toxicité des sédiments que dans les essais avec de l'eau seulement (Borgmann, 2000). Cet effet peut être réduit en utilisant un grand rapport eau/sédiment dans l'essai de toxicité (Borgmann et Norwood, 1999b). La composition chimique de l’eau peut également avoir une incidence sur la toxicité des métaux, et les concentrations de métaux dans l'eau sus-jacente doivent être comparées aux concentrations de métaux causant de la toxicité dans les essais avec de l'eau seulement si la composition en ions principaux de l'eau utilisée pour ces essais est semblable. Cette technique ne permettra pas de déterminer la cause de la toxicité si la phase solide du sédiment contribue considérablement à la toxicité.
12.9.6 Essais de toxicité de l'eau interstitielle des sédiments
Les concentrations de contaminants dans l'eau interstitielle peuvent être plus fortement corrélées à la toxicité pour les organismes aquatiques (Liber et al., 2011; Cairns et al., 1984; Nebeker et al., 1984; Schuytema et al., 1984; Knezovich et Harrison, 1988; Giesy et Hoke, 1990) que celles dans les sédiments en vrac (Patrick et al., 1977; Adams et al., 1985; Shaner et Knight, 1985; van de Guchte et Mass-Diepeveen, 1988; Di Toro, 1989; Ankley et al., 1991; Carr et Chapman, 1992). Par conséquent, les essais de toxicité au moyen de l'eau interstitielle des sédiments peuvent être un complément important aux essais de toxicité sur les sédiments entiers. L'importance relative de l'eau interstitielle et des sédiments entiers en tant que sources de contaminants toxiques pour les organismes aquatiques semble dépendre de l'espèce de l'organisme d'essai et du type de contaminant (Knezovich et Harrison, 1987; Giesy et Hoke, 1990; Harkey et al., 1994).
Il y a une quantité relativement importante de documents qui décrivent les essais de toxicité avec l'eau interstitielle (Burton 1992, 1998). Toutefois, il n'y en a pas autant que pour les essais sur les sédiments entiers, et il existe peu de méthodes normalisées pour les essais de toxicité avec l'eau interstitielle pour les organismes d'eau douce. Environnement Canada (1992) offre deux méthodes normalisées utilisant l'eau interstitielle pour étudier les échinides (oursins verts et oursins plats) et les bactéries luminescentes.
Les essais qui peuvent être utilisés pour les essais de toxicité de l'eau interstitielle sont décrits brièvement ci-dessous. Il est à noter qu'il s'agit d'essais normalisés pour l'essai de toxicité de l'eau et des effluents et qu'ils ne sont pas réservés aux essais avec l'eau interstitielle.
12.9.6.1 Essai biologique sur la fécondation chez les oursins verts
L'essai sur la fécondation des oursins verts est décrit dans le chapitre portant sur la toxicité sublétale (chapitre 6, tableau 6.2).
12.9.6.2 Essai de toxicité aiguë Microtox
L'essai de toxicité aiguë Microtox est utilisé pour évaluer l'effet de l'exposition aux effluents sur la production de lumière par les bactéries marines naturellement luminescentes Vibrio fischeri. Le résultat est exprimé comme la concentration où la production de lumière est réduite de 25 % ou 50 % (CI25, CI50).
L'essai Microtox est fréquemment utilisé sur place par plusieurs industries. L'essai est décrit dans le manuel du fabricant Microtox Manual: A Toxicity Testing Handbook (Microbics Corp.). L'essai Microtox est une trousse d'essai biologique de dépistage rapide qui mesure les effets toxiques sur la production de lumière d'une culture normalisée de bactéries luminescentes. La principale limite de cette méthode est que le diluant (eau de dilution) est une solution saline, alors que l'organisme d'essai est une bactérie marine ayant peu de pertinence avec les milieux miniers canadiens, étant donné que la majorité des effluents miniers se déversent dans des milieux dulcicoles.
12.9.6.3 Létalité aiguë avec Daphnia magna
Cet essai vise à déterminer la concentration d'eau d'essai qui cause une mortalité de 50 % pour Daphnia magna pendant une période d'exposition de 48 heures. Cet essai normalisé utilise des groupes de nouveau-nés de D. magna âgés de moins de 24 heures dans une gamme de concentrations d'eau d'essai. L'essai de létalité de D. magna est décrit en détail dans SPE 1/RM/11 (Environnement Canada 1990, 1996).
12.9.6.4 Reproduction et survie de Ceriodaphnia dubia
Cet essai est décrit dans le chapitre portant sur la toxicité sublétale (chapitre 6, tableau 6.2).
12.9.6.5 Inhibition de la croissance de l'algue Pseudokirchneriella subcapitata
Cet essai est décrit dans le chapitre portant sur la toxicité sublétale (chapitre 6, tableau 6.2).
12.9.6.6 Essai de toxicité de l'eau interstitielle des sédiments à l'aide de Hyalella azteca et Chironomus dilutus
Les essais normalisés pour Hyalella azteca (Environnement Canada, 1997) et Chironomus dilutus (Environnement Canada, 1997a), décrits dans les sections 12.9.4.1 et 12.9.4.2, respectivement, ont récemment été utilisés pour l'essai de l'eau interstitielle des sédiments. Liber et al. (2011) ont évalué l'hypothèse voulant que les concentrations de métaux dans l'eau interstitielle soient mieux corrélées avec la toxicité des sédiments dans les organismes benthiques qu'avec les concentrations de métaux dans les sédiments entiers. À l'aide de H. azteca et C. dilutus, ils ont découvert que, dans certains cas pour les métaux spécifiques examinés, leur approche permet de prédire la toxicité des sédiments à l'aide des données sur les métaux dans l'eau interstitielle des sédiments (Liber et al., 2011).
12.10 Outils pour l'analyse des effluents et de la qualité de l'eau
Aux sites où il y a des effets sur les poissons ou la communauté d'invertébrés benthiques, il existe plusieurs techniques de caractérisation des effluents et de surveillance de la qualité de l'eau qui peuvent aider à comprendre la nature et la cause des effets. De plus, la caractérisation des effluents comprenant d'autres contaminants des mines provenant d'autres sources, notamment les sources non ponctuelles, peut s'avérer appropriée à certains sites dans le cadre de la recherche des causes. Dans certains cas, ces techniques pourraient également fournir de précieux renseignements pendant la surveillance de la recherche des causes, dont des données environnementales complémentaires, lors de la détermination de l'étendue et de l'ampleur des effets observés sur les poissons ou la communauté d'invertébrés benthiques. Les techniques décrites ci-dessous sont recommandées, et les mines peuvent utiliser des techniques individuelles ou des combinaisons de techniques, le cas échéant, pour répondre aux questions propres à un site. De plus amples renseignements sur la caractérisation des effluents et la surveillance de la qualité de l'eau peuvent être consultés au chapitre 5.
12.10.1 Mesure des métaux dissous pendant la recherche des causes
La mesure des métaux totaux et dissous dans les échantillons de qualité de l'eau de l'effluent et de la zone d'exposition pendant la recherche des causes aiderait à déterminer quels métaux causent ou contribuent aux effets observés (Parker et Dumaresq, 2002). La justification pour mesurer les métaux dissous pendant la recherche des causes est fondée sur la théorie que ce sont les métaux dans la fraction dissoute, notamment les ions métalliques libres, qui sont les plus biodisponibles pour les organismes aquatiques. Il existe des preuves qualitatives à l'appui de cette théorie, notamment pour les milieux synthétiques définis (c.-à-d., essais biologiques en laboratoire). Toutefois, cette relation semble se détériorer dans les eaux naturelles, notamment en présence de matières organiques dissoutes naturelles (ESG, 1999).
La procédure normale pour mesurer les concentrations de métaux dissous comprend la filtration immédiate de l'échantillon d'eau brute à l'aide d'un filtre de 0,45 micron et ensuite de conserver l'échantillon filtré avec de l'acide nitrique à un pH inférieur à 2,0 afin de conserver les métaux dissous en solution jusqu'au moment de l'analyse. Il existe des différences de la taille du filtre utilisé, mais le filtre de 0,45 micron est le plus couramment utilisé. Des préoccupations sont soulevées selon lesquelles certains métaux liés aux colloïdes, qui ne sont pas réellement dissous, peuvent passer à travers cette taille de membrane de filtration, et certains chercheurs recommandent des tailles de filtre aussi petites que 0,1 micron pour réduire cette préoccupation (EVS, 1997).
Dans un rapport par Hall (1998), trois systèmes de filtre ont été évalués (filtres à seringue, intégrés et à vide). Les recommandations de cette étude sont fondées sur la contamination recueillie par ces filtres et leur facilité d'utilisation. Avant de choisir un système, il est important d'évaluer sa propension à être bouché par l'échantillon d'eau. Toute personne qui prévoit effectuer des analyses des métaux dissous est fortement encouragée à consulter Hall (1998) avant le prélèvement de l'échantillon.
Un « peeper », un échantillonneur à membrane de dialyse, et un gradient de diffusion en couches minces peuvent être utilisés pour mesurer les métaux biodisponibles dans l'eau sus-jacente (Liber et Doig, 2000). Les métaux biodisponibles peuvent être comparés aux concentrations de métaux dissous, ce qui permet une meilleure prédiction de la toxicité.
12.10.2 Spéciation des métaux pour les métaux d'intérêt
Les métaux ne sont ni créés ni détruits par les processus biologiques ou chimiques. Cependant, ces processus sont capables de transformer les métaux d'une espèce à l'autre (USEPA, 2007). La forme dans laquelle le métal (ou métalloïde) se produit (c.-à-d., la spéciation du métal) peut avoir un effet important sur la biodisponibilité, la bioaccessibilité et la toxicité de ce métal pour les organismes aquatiques (Tessier et Turner, 1995; Stumm et Morgan, 1996; EPA des É.-U., 2007). Par conséquent, la compréhension de la spéciation des contaminants d'intérêt peut être importante pour comprendre la nature et les causes des effets sur les écosystèmes aquatiques (Parker et Dumaresq, 2002). Langmuir et al. (2004) discutent de la chimie de l'environnement des métaux et fournissent des exemples de la façon dont la spéciation influence le comportement et les effets.
La spéciation des métaux peut être mesurée par une analyse directe ou être estimée à l'aide d'outils de modélisation. Deux des plus importants facteurs ayant une incidence sur la spéciation des métaux sont le pH et l'état d'oxydation. Par conséquent, peu importe la méthode utilisée pour évaluer la spéciation des métaux, il est important de prendre des mesures précises sur le terrain du pH et de l'oxygène dissous. De plus, si des échantillons doivent être analysés pour la spéciation des métaux, il est important de veiller à ce que les procédures appropriées de prélèvement, de préservation et d'entreposage des échantillons soient respectées.
La spéciation, ou du moins la détermination de la valence, de certains métaux dans l'eau peut être déterminée de façon analytique, bien qu'un tel service puisse être limité. Des méthodes analytiques comprennent des méthodes utilisant l'échange d'ions, l'électrochimie, la chromatographie d'exclusion stérique, la voltampérométrie, la spectrométrie d'absorption des rayons X (pour structure fine), la spectrométrie de masse à source à plasma inductif, le gradient de diffusion en couche mince, la chromatographie liquide à haute performance en phase inverse par formation de paires d'ions, les mini-électrodes intégrées dans le gel, la perméabilité liquide par membrane à fibres creuses, de même que plusieurs méthodes présentées dans la section 12.11.5.1 (concentrations partielles de métaux dans les sédiments). Les techniques de mesure de la spéciation des métaux dans les solutions aqueuses ont été minutieusement examinées par Tessier et Turner (1995), Unsworth et al. (2006) et Ekberg et al. (2011). Si des échantillons sont acheminés aux fins d'analyse de la spéciation, il faut faire preuve d'une grande prudence lors de la collecte, de la manipulation et de l'entreposage des échantillons. Il faut être très prudent, car des changements dans des facteurs tels que la teneur en oxygène dissous de l'échantillon pourraient se traduire par la spéciation de l'échantillon qui changerait considérablement entre le moment de sa collecte et celui de son analyse. Il est fortement recommandé de communiquer avec le laboratoire qui effectuera les analyses avant d'effectuer la collecte d'échantillons afin de déterminer les procédures appropriées.
Un certain nombre de programmes informatiques sont disponibles pour la modélisation de la spéciation chimique des métaux dans l'eau, comme les suivants :
- MINTEQA2 (Allison et al., 1991)
- MINEQL+ (Schecher et McAvoy, 1992, 1994)
- Windermere Humic Aqueous Model (WHAM) (Tipping, 1994, 1998)
- VMINTEQ (Gustafson, 2004)
- Modèle Chemical Equilibria in Soils and Solutions (CHESS) (Santore et al., 1998; Meyer et al., 1999)
- MINEQL+ dans le modèle du ligand biotique par McGeer et al. (2000) (Paquin et al., 2002a, 2002b)
- BIOCHEM ORCHESTRA (Vink et Meeussen, 2007)
- TRANSPEC (Bhavsar et al., 2008)
- PHREEQCI (Parkhurst et Appelo, 2000)
- FITEQL (Herbelin et Westall, 1999)
- TICKET (Farley et al., 2008)
Étant donné que la spéciation des métaux dépend de plusieurs facteurs, tous ces programmes ont besoin de données sur les éléments suivants : pH, alcalinité, dureté, cations et anions principaux, force ionique, matières dissoutes totales, carbone organique dissous, métaux totaux dissous, sulfure, apports d'origine anthropique uniques, comme l'EDTA, et concentration d'aluminium et de fer (III) (EVS, 1997). Ces programmes peuvent être utilisés pour prédire les formes et les concentrations de métaux dans l'effluent ou l'eau, et pour prévoir la toxicité (EVS, 1997). Les sources possibles d'erreur sont décrites dans EVS (1997).
12.10.3 Mesure des réactifs et des sous-produits réactifs utilisés dans le traitement
Une vaste gamme de réactifs chimiques est utilisée dans le traitement du minerai, et ces réactifs, ou les sous-produits de la décomposition de ces réactifs, peuvent être présents dans les effluents des mines. Par conséquent, les réactifs et les sous-produits des réactifs peuvent être présents dans les milieux récepteurs. Les analyses des réactifs et des sous-produits des réactifs peuvent s'avérer utiles dans les cas où les effets observés ne peuvent pas être attribués aux métaux et aux autres paramètres contrôlés régulièrement dans le cadre du programme d'ESEE à un site. Plusieurs réactifs et sous-produits particuliers qui ont fait été abordés au cours de l'atelier de recherche des causes des mines de métaux de 2009 (Environnement Canada, 2012) sont présentés brièvement ci-dessous.
Des espèces de cyanure peuvent être présentes dans les effluents ou sous forme de résidus solides contaminés. La toxicité du cyanure est liée à sa spéciation. Le cyanure libre (HCN, CN-) est classé comme étant la forme la plus toxique en raison de son potentiel d'inhibition métabolique élevé, alors que les complexes métal-cyanure (p. ex. [Fe(CN)6]3-, [Fe(CN)6]4-) sont considérés être moins toxiques (Shifrin et al., 1996). Zagury (2012) a démontré que les espèces plus réactives de cyanure qui sont initialement associées à des résidus solides se dégradent principalement en raison de la volatilisation, de la lixiviation et de la dégradation bactérienne. La plus grande proportion d'espèces stables de cyanure observées dans les résidus vieillis découle probablement de la dissociation précoce de complexes faibles à modérément forts, probablement lors de l'altération atmosphérique (p. ex. décomposition en présence de lumière ultraviolette).
Les xanthates sont souvent utilisés comme collecteurs durant le traitement des minerais sulfurés par flottation. La présence de xanthates a été observée dans les effluents et les eaux réceptrices à des concentrations pouvant atteindre 4,0 mg/L. Ces concentrations sont suffisantes pour causer une toxicité potentielle, étant donné que les xanthates présentent une toxicité (selon des mesures à la CI25) à des concentrations allant de 0,5 mg/L à 3 mg/L (Vigneault et al., 2012).
Les sulfosels (thiosulfate, trithionate, tétrathionate et d'autres polythionates) sont produits par la flottation de minerais sulfurés. Vigneault et al. (2012) ont déclaré que le thiosulphate était généralement plus toxique que le tétrathionate. La sensibilité aux sulfosels variait d'aucune réponse pour la Truite arc-en-ciel à une CI25 de 59,4 mg S2O3/L pour C. dubia (reproduction). La toxicité aiguë du thiosulphate pour D. magna (létalité) était également supérieure à celle du tétrathionate (CE50 à environ 300 et 750 mg/L, respectivement) (Vigneault et al., 2012). Des concentrations de thiosulphate de 700 mg/L ont été signalées dans des effluents miniers, donc en quantité suffisante pour causer de la toxicité (Vigneault et al., 2012).
Le sélénium est libéré dans les bassins versants avoisinants pendant l'extraction et la fonte des minerais de cuivre, de plomb, de mercure, d'argent, d'uranium et de zinc. Le sélénium est tératogène à des teneurs élevées. La détermination de la concentration aqueuse de sélénium dans les effluents, les eaux usées et les eaux réceptrices peut permettre de déterminer si le sélénium est présent à des concentrations élevées. La biogéochimie du sélénium est complexe et des études plus approfondies de la toxicité du sélénium dans les tissus des poissons pourraient donner des résultats plus utiles (Palace, 2012).
D'autres réactifs de procédé et de traitement des eaux usées susceptibles d'être rejetés en concentrations suffisantes pour causer la toxicité incluent le Magnafloc, le Nalmet et la chaux (Vigneault et al., 2012).
12.10.4 Surveillance du débit et des charges dans la zone exposée
Pendant l'étude de recherche des causes, la mesure du débit d'eau dans la zone exposée pourrait aider à interpréter les données et à comprendre le taux de dilution, le mélange, le bilan massique, le devenir et les effets des contaminants ainsi que les relations de cause à effet. Il peut être utile d'évaluer le degré d'exposition des communautés aux effluents des mines et à leurs contaminants sur une période plus longue et dans une variété de conditions.
Les évaluations des taux de charge sont essentielles aux calculs du bilan massique. En supposant un mélange complet, le principal énoncé pour le bilan massique à un point de rejet est :
Masse ou taux de charge de la substance en amont + taux massique ajouté par le point de rejet = Taux massique de la substance immédiatement en aval du point de rejet
Étant donné que le taux de charge est le produit du débit et de la concentration, le bilan massique est obtenu par :
Q0s0 + Qese = Qs
où Q0 , Qe et Q = le débit en aval, le taux de rejet de l'effluent et le taux en amont, respectivement;
s0 , se et s = concentration en amont, dans l'effluent et en aval, respectivement.
Un énoncé semblable peut être formulé pour la modulation des débits :
Q0 + Qe = Q
Le débit et les concentrations en amont sont souvent connus ou peuvent être mesurés aisément. Les caractéristiques de l'effluent sont généralement connues plus en détail. La résolution de l'équation pour trouver la concentration en aval, s, donne ce qui suit :
![]()
Par conséquent, la concentration en aval dépend des débits en amont et en aval, de même que de la concentration en amont et des intrants chimiques dans l'effluent. Si la concentration en amont est de zéro, la concentration en aval, s, sera égale à la concentration de l'effluent réduite par le taux du débit de l'effluent sur le débit total de la rivière. Ceci est communément appelé l'effet de dilution.
Les équations ci-dessus s'appliquent au scénario le plus simple, soit immédiatement en aval du point de rejet. Les calculs du bilan massique deviennent plus complexes à mesure que l'on s'éloigne en aval du point de rejet et que les facteurs contributifs des affluents, les sources ponctuelles multiples, les sources distribuées, de même que la dispersion, la décantation chimique et les effets de la décomposition chimique sont pris en compte. Des références utiles pour la formulation appropriée d'équations du bilan massique incluent Thomann et Mueller (1987), McCutcheon et French (1989) et Henderson-Sellers et French (1991).
12.11 Outils à prendre en compte pour l'analyse des sédiments
12.11.1 La surveillance des sédiments en tant qu'outil de recherche des causes
Dans les sites où l'on observe des effets au sein de la communauté d'invertébrés benthiques, il existe un certain nombre de techniques de surveillance des sédiments pouvant aider à comprendre la nature et la cause des effets (Parker et Dumaresq, 2002). Les techniques décrites ci-dessous sont recommandées. Il n'est pas nécessaire d'utiliser toutes ces techniques. Il est possible qu'une ou quelques-unes soient suffisantes pour rechercher la cause d'un effet.
12.11.2 Transport des matières en suspension
Dans certains réseaux hydrographiques, une compréhension des caractéristiques du transport des matières en suspension peut être importante, notamment pour comprendre l'origine et le devenir des sédiments. La morphologie des cours d'eau alluviaux et des chenaux de rivière mobiles est probablement déterminée par les événements pluvio-hydrologiques. Par conséquent, la séquence de nappes d'eau dormante et de rapides qui est caractéristique de ces lits de rivière, et les distributions granulométriques correspondantes de sédiments dans les canaux, peuvent avoir des durées de résidence qui sont courtes par rapport au programme d'études de suivi des effets sur l'environnement. Dans ces circonstances, la caractérisation appropriée de la morphologie du chenal du cours d'eau, et notamment de ses éléments plus dynamiques, peut être une source d'information importante pour déterminer la cause des effets sur les communautés d'invertébrés benthiques. Par exemple, il peut être important de savoir si les dépôts annuels et le retrait subséquent des matières à grains fins est une caractéristique régulière de la zone d'étude, et si des mouvements importants sur le plan écologique de matières à grains grossiers (gravier et galets) se déroulent sur des échelles de temps de quelques années ou moins.
La majorité des preuves liant la morphologie du chenal au transport des sédiments et à l'hydrologie du bassin ont été recueillies dans des bassins fluviaux aux États-Unis qui contenaient des quantités importantes de matières en suspension. Dans les régions englacées qui sont typiques d'une grande partie du Canada, les sédiments alluviaux dans les cours d'eau comprenant beaucoup de matières d'origine glaciaire peuvent être plus stables lors d'événements pluvio-hydrologiques. De plus, dans le Bouclier canadien en particulier, l'abondance de lacs et de terres humides, en particulier dans les bassins versants de premier et de second ordre, peut aider à compenser les effets des événements pluvio-hydrologiques. Donc, une comparaison des résultats avec les résultats des études menées aux États-Unis n'est peut-être pas très utile.
Les observations directes du transport de sédiments en suspension et du mouvement de la charge de fond sont difficiles à effectuer puisque ces événements clés sont de courte durée et surviennent à des moments où le débit du cours d'eau empêche la mesure directe à cause des conditions dangereuses. Toutefois, il existe un certain nombre d'indicateurs qualitatifs de la nature dynamique des chenaux de rivière qui peuvent être utilisés. Des archives photographiques d'écoulements maximaux qui comprennent un débordement (p. ex. avec une période de retour d'un an ou plus) peuvent être utilisées pour fournir des preuves qualitatives de l'importance du transport et du dépôt des sédiments en suspension. Une autre méthode consiste à identifier les rochers ou les galets à l'aide d'un code de couleur et d'observer régulièrement l'étendue de leur déplacement. Il est suggéré que l'exploitant d'une mine utilise une combinaison de méthodes pour décrire l'emplacement physique de tels réseaux hydrographiques dynamiques
12.11.3 Taux de sédimentation des matières en suspension et datation des sédiments pour obtenir les tendances historiques
Une compréhension des taux de sédimentation des matières en suspension peut être importante pour comprendre les influences sur la chimie des sédiments et, en particulier, l'influence relative d'une exploitation minière.
Les taux de sédimentation peuvent être estimés quantitativement à l'aide de pièges à sédiments, mais il peut s'avérer difficile d'effectuer un échantillonnage représentatif et il peut même être impossible, à l'aide de cette méthode, de tenir compte de l'effet des tempêtes ou d'autres événements hydrologiques importants. En raison de ces difficultés, on considère que la mesure directe des taux de sédimentation des matières en suspension devrait être réservée à des circonstances exceptionnelles. Les taux de sédimentation à long terme peuvent également être estimés quantitativement à l'aide du carottage de sédiments.
L'influence relative de l'exploitation minière peut également être estimée de façon plus qualitative dans les cours d'eau au lit de graviers ou dans les sédiments des lacs dominés par de la matière organique molle. Dans de tels cas, la présence de sédiments minéraux fins indiquerait une certaine influence de la mine. Dans d'autres types d'environnement, cette méthode peut ne pas être efficace, étant donné que le dépôt de sédiments minéraux naturels fins masquerait toute influence de la mine. Voir Håkanson et Jansson (1983) pour de plus amples renseignements sur la sédimentologie des lacs.
La datation précise des sédiments, jumelée à un inventaire des restes de certains organismes et matériel végétal (p. ex. diatomées, zooplancton, insectes), fournit une chronologie des changements qui peuvent souvent être liés à la période d'influence anthropique (Frey, 1998). La datation de carottes de sédiments à l'aide d'isotopes a été utilisée pour évaluer la géochronologie du taux de dépôt de sédiments année après année (Weech et al., 2012) (et de plusieurs années à plusieurs décennies) pour éliminer les facteurs de confusion, comme les effets historiques. Les isotopes comme le carbone 14, l'uranium 234/238, le plomb 210, le césium 137 et le béryllium 10 peuvent être évalués (Cohen, 2003; Ritchie et McHenry, 1990; Zapata, 2003; Bierman et Nicols, 2004; Mabit et al., 2008). Consulter Frey (1998) et Cohen (2003) pour des renseignements détaillés sur la paléolimnologie.
12.11.4 Carottage de sédiments
Les carottiers prélèvent souvent des échantillons verticaux pour la détermination de la répartition verticale des caractéristiques des sédiments (Parker et Dumaresq, 2002). On préfère généralement les carottiers lorsqu'il est essentiel de maintenir l'intégrité du profil des sédiments, parce qu'il s'agit des dispositifs les moins perturbateurs. Favorisant le moins l'oxydation, les carottiers devraient être privilégiés lorsqu'il importe de maintenir un milieu exempt d'oxygène sous les couches sédimentaires superficielles (SPE 1/RM/29 : Environnement Canada, 1994). Plusieurs types de dispositifs de carottage de sédiments sont disponibles. Même si les carottiers possèdent l'avantage de prélever des échantillons de sédiments de surface (les 15 à 30 cm supérieurs) et de sédiments profonds (> 30 cm) qui sont intacts et ont subi une perturbation minimale, peu d'entre eux sont efficaces dans les substrats où se trouvent du sable, du gravier, de l'argile ou du till. Il est à noter que le document d'Environnement Canada intitulé Document d'orientation sur le prélèvement et la préparation de sédiments en vue de leur caractérisation physicochimique et d'essais biologiques (SPE 1/RM/29 : Environnement Canada, 1994) et ASTM (1992) contiennent des directives complètes sur le carottage de sédiments, y compris les procédures de carottage des sédiments, les avantages et les désavantages des carottiers de même que le transport et la manipulation des échantillons prélevés.
12.11.5 Composition chimique des sédiments
12.11.5.1 Concentrations partielles des métaux dans les sédiments (extraction partielle), extraction séquentielle des métaux, rapports entre les métaux simultanément extractibles et les sulfures volatils en milieu acide (MTA/SVMA)
Bien que les concentrations totales des métaux puissent ne pas être directement liées à la disponibilité biologique et à la toxicité, plusieurs recommandations pour la qualité des sédiments sont actuellement basées sur les concentrations totales de métaux (Parker et Dumaresq, 2002). Une variété de méthodes a été utilisée pour prédire les effets biologiques des métaux dans des sédiments contaminés par des métaux. Ces méthodes comprennent la normalisation des sédiments pour la granulométrie, le contenu organique ou la fraction extractible de métaux à l'aide des sulfures volatils en milieu acide (sulfures volatiles en milieu acide) et des métaux simultanément extractible (métaux simultanément extractibles) (Parker et Dumaresq, 2002).
On pense généralement que la forme chimique particulière d'un élément détermine son comportement, sa disponibilité biologique et sa toxicité potentielle, au lieu de la concentration totale dans les sédiments. Des formes chimiques particulières peuvent être mesurées des façons ci-dessous :
- à l'aide de techniques de mesure directe;
- directement par la digestion séquentielle des sédiments;
- en prédisant les niveaux par la modélisation thermodynamique.
Les techniques de mesure directe incluent : spectrométrie photoélectronique à rayons X; microscopie à balayage électronique/microanalyse aux rayons X, spectrométrie de masse à émission ionique secondaire et spectrométrie à électrons Auger (Parker et Dumaresq, 2002). Ces méthodes ont été appliquées aux études géochimiques et à l'exploration minérale.
La force relative de l'association entre les métaux et les particules peut être évaluée à l'aide d'une extraction unique ou séquentielle ou à l'aide de méthodes de digestion des sédiments. Les acides faibles ou chélateurs (p. ex. EDTA) et les agents réducteurs peuvent être utilisés pour établir les différences entre les différentes formes chimiques. Les fractions de sédiments peuvent être définies du point de vue opérationnel (p. ex. oxyhydrides de ferromanganèse) selon la méthode de digestion utilisée. Le récent concept des sulfures volatils en milieu acide suppose que les concentrations de métaux dans l'eau interstitielle des sédiments anoxiques sont contrôlées par les sulfures. Les sulfures volatils en milieu acide sont extraits à l'aide de la technique de purge et de piégeage à l'acide froid. Les métaux simultanément extractibles représentent la portion des métaux totaux libérés pendant la dissolution des sulfures volatils en milieu acide. Le ratio métaux simultanément extractible/sulfures volatils en milieu acide est parfois utilisé pour caractériser la disponibilité des métaux. Lorsque la fraction de métaux simultanément extractibles dépasse la fraction de sulfures volatils en milieu acide (p. ex. le rapport métaux simultanément extractibles/sulfures volatils en milieu acide est supérieur à 1), les métaux libres peuvent être présents dans l'eau interstitielle à des niveaux adéquats pour causer une toxicité aiguë. Toutefois, la toxicité ne peut pas être prédite, seulement la non-toxicité peut l'être (Parker et Dumaresq, 2002).
La limite de ces analyses est que les échantillons de sédiments anoxiques doivent être prélevés et entreposés soigneusement pour empêcher l'oxydation. Une description des méthodes de collecte des sédiments se trouve dans Warren et al. (1998).
12.11.5.2 Rapport carbone-azote (rapport C/N) pour les sédiments marins
Les effets sur la communauté d'invertébrés benthiques peuvent se produire en réponse à un enrichissement organique dans des sédiments. Afin de déterminer si un enrichissement organique contribue aux effets, une combinaison de techniques de mesure devrait être utilisée dans l'environnement marin. La mesure du carbone organique total fournit une indication de l'enrichissement organique. La mesure du potentiel d'oxydo-réduction (Eh) fournit une indication des teneurs en oxygène dans les sédiments marins. La mesure des sulfures dans les sédiments fournit une indication à savoir si la décomposition de matières organiques dans les sédiments se produit (Environnement Canada, 1994).
La mesure du rapport carbone-azote (rapport C/N) dans les sédiments marins devrait fournir une indication de la source de l'enrichissement organique. Si l'enrichissement organique est attribuable à des sources terrestres (p. ex. eaux usées municipales et des effluents des fabriques de pâtes et papiers), le rapport C/N sera plus élevé (Hargrave et al., 1995). Si l'enrichissement organique est attribuable à des sources naturelles, telles que la décomposition de plantes aquatiques marins, le rapport C/N sera beaucoup plus faible. Par conséquent, si une étude sur la communauté d'invertébrés benthiques indique un effet sur la communauté d'invertébrés benthiques, et il existe des preuves selon lesquelles l'effet pourrait être dû à un enrichissement organique (carbone organique total élevé, Eh élevé), la détermination des rapports C/N des sédiments marins peut aider à identifier la source de la charge organique de cet écosystème.
12.12 Analyse de l'eau interstitielle des sédiments
Les sédiments lacustres fins de surface renferment ordinairement de 90 à 95 % d'eau (Adams, 1991). Une partie de cette eau est liée aux réseaux cristallins de minéraux présents dans les sédiments, mais la plus grande partie ne fait qu'occuper les interstices entre les particules sédimentaires. Cette eau est appelée eau de porosité ou eau interstitielle. L'association intime de cette eau avec les particules à la surface des sédiments aboutit à des réactions qui tendent vers l'équilibre. Le partage des contaminants entre les particules sédimentaires et la phase aqueuse dépend dans une grande mesure de la quantité de carbone organique, de la granulométrie des sédiments, de la forme chimique des contaminants et des propriétés physicochimiques du milieu (p. ex. pH, température, potentiel d'oxydoréduction, capacité de sorption et de désorption des sédiments ou équilibre entre les phases solide et liquide (Parker et Dumaresq, 2002). On ne connaît pas très bien la dynamique de ces processus; toutefois, on pense généralement que les concentrations de la plupart des substances dans l'eau de porosité tendent vers l'équilibre avec la phase solide et ses contaminants connexes, et que les métaux dans l'eau de porosité représentent en grande partie la fraction biologiquement disponible dans les sédiments (Parker et Dumaresq, 2002). C'est pourquoi on prélève de l'eau de porosité en vue d'essai de toxicité, pour se faire une idée de la toxicité relative des sédiments contaminés ou pour évaluer les concentrations des contaminants.
La nature des sédiments au site de l'étude peut influencer grandement l'utilité des mesures de l'eau interstitielle. Les sédiments d'argile compactée à grains très grossiers ou durs n'auront probablement pas d'eau interstitielle fortement contaminée (Burton et Pitt, 2002). Par conséquent, l'échantillonnage des eaux interstitielles devraient se limiter aux sédiments allant d'argile sablonneux à non compacté.
Si les sédiments sont anoxiques (la majorité des sédiments déposés se trouvent à une profondeur supérieure à 2 cm), toutes les étapes de la collecte et du traitement des échantillons devraient se dérouler dans une atmosphère inerte ou à exposition limitée afin de prévenir l'oxydation et la sorption/précipitation subséquente des espèces de métaux réduits si la spéciation des métaux est d'intérêt. Lorsque des sédiments anoxiques sont exposés à l'air, les sulfures volatiles peuvent être perdus, ce qui peut augmenter la disponibilité (et la toxicité) des métaux liés aux sulfures. Finalement, les échantillons d'eau interstitielle subissent des changements chimiques rapides, se traduisant par une durée d'entreposage variant de quelques heures à quelques jours. Un dispositif commun pour l'échantillonnage de l'eau interstitielle des sédiments est la cellule de dialyse, également connu sous le nom de « dialysis cell », également connue sous le nom de « peeper » (Doig et Liber, 2000). Les prélèvements sur le terrain à l'aide de « peepers » ou de dispositifs d'aspiration sont les méthodes les plus précises pour obtenir des échantillons représentatifs, puisqu'elles sont moins susceptibles de modifier la chimie in situ de l'eau interstitielle et elles sont recommandées pour les études géochimiques (Burton et Pitt, 2002; EPA des États-Unis, 2001). Les méthodes de laboratoire qui permettent l'extraction de plus grands volumes d'eau sont privilégiées lorsque les échantillons sont prélevés aux fins d'essais de toxicité, y compris la centrifugation, la pressurisation ou l'aspiration. L'utilisation et les avantages de « minipeepers » pour les essais en laboratoire de toxicité des sédiments sont discutés dans Doig et Liber (2002).
Pour de plus amples renseignements sur les méthodes de collecte d'eau interstitielle sur le terrain (in situ) et en laboratoire, veuillez consulter la publication d'Environnement Canada intitulé Document d'orientation sur le prélèvement et la préparation de sédiments en vue de leur caractérisation physicochimique et d'essais biologiques (SPE 1/RM/29), Environnement Canada (1994), EPA des États-Unis (2001), Doig et Liber (2002) et Burton et Pitt (2002).
Pour les essais de toxicité sur l'eau interstitielle, veuillez consulter la section 12.9.6.
>12.13 Références
Adams, D.D. 1991. Sampling Sediment Pore Water. In: Mudroch, A., MacKnight, S.D. (éd.) CRC Handbook of Techniques for Aquatic Sediments Sampling, p. 202-203. Boca Raton (FL) : CRC Press, Inc. 210 p.
Adams, W.U., Kimerle, R.A., Mosher, R.G. 1985. Aquatic Safety Assessment of Chemicals Sorbed to Sediments. In: Cardwell, R.D., Purdy, R., Bahner, R.C. (éd.) Aquatic Toxicology and Hazard Assessment. Philadelphia (PA) : American Society for Testing and Materials. p. 429-453.
Adams, W.J., Blust, R., Borgmann, U., Brix, K.V., DeForest, D.K., Green, A.S., Meyer, J.S., McGeer, J.C., Paquin, P.R., Rainbow, P.S., et al. 2011. Utility of tissue residues for predicting effects of metals on aquatic organisms. Integr. Environ. Assess. Manag. 7(1):75-98.
Alden, R.W. III. 1992. Uncertainty and Sediment Quality Assessments: I. Confidence limits for the triad. Env. Tox. Chem. 11:637-644.
Allison, J.D., Brown, D.S., Novo-Gradac, K.J. 1991. MINTEQA2/PRODEFA2, A geochemical assessment model for environmental systems: version 3.0 user’s manual. Athens (GA) : Environmental Protection Agency des États-Unis. EPA/600/3-91/021.
Aloi, J.E. 1990. A critical review of freshwater periphyton field methods. Journal canadien des sciences halieutiques et aquatiques 47(3):656-670.
Ankley, G.T., Schubauer-Berigan, M.K., Dierkes, J.R. 1991. Predicting the Toxicity of Bulk Sediments to Aquatic Organisms with Aqueous Test Fractions: Pore Water Versus Elutriate. Environ. Toxicol. Chem. 10:1359-1366.
[APHA/AWWA/WEF] American Public Health Association, American Water Works Association, Water Environment Federation. 2001. Standard Methods for the Examination of Water and Wastewater, Method 10200H (Chlorophyll).
[ASTM] American Society for Testing and Materials. 1992. E 1391-90, Standard Guide for Collection, Storage, Characterization and Manipulation of Sediments for Toxicological Testing. In: 1992 Annual Book of ASTM Standards, Vol. II.04, Section 11. Philadelphie (PA). p. 1134-1153.
[ASTM] American Society for Testing and Materials. 1997. Standard test methods for measuring the toxicity of sediment-associated contaminants with fresh water invertebrates (Annex 3, Hexagenia spp., and Annex 4, Tubifex tubifex). Vol. 11.05, Standard E1706-95b.
[ASTM] American Society for Testing and Materials. 2010. Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates. ASTM Method E 1706-05(2010).
[ATA] Atelier sur la toxicité aquatique, du 2 au 5 octobre 2011, Winnipeg (Man.), Canada.
Austin, A. 1983. Evaluation of changes in a large oligotrophic wilderness park lake exposed to mine tailings effluent for 14 years: The periphyton. Natur. Can. 110:119-134.
Austin, A. 1993. Evaluation of changes in a large oligotrophic wilderness park lake exposed to mine tailing effluent for 14 years: The periphyton. Natur. Can. 110:119-134.
Austin, A., Deniseger, J. 1985. Periphyton community changes along a heavy metal gradient in a long narrow lake. Environ. Exp. Bot. 25:41-52.
Austin, A., Deniseger, J., Clark, M.J.R. 1985. Lake algal populations and physico-chemical changes after 14 years input of metallic mining wastes. Water Res. 19:299-308.
Azim, M.E., Verdegem, M.C.J., van Dam, A.A., Beveridge, M.C.M. 2005. Periphyton. Ecology, Exploitation and Management. Cambridge (MA) : CABI Publishing.
Bandler, C., Baron, C.L., Palace, V.P. 2012. An update on the use of caged fish for Environmental Effects Monitoring. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Bedard, D., Hayton, A., Persaud, D. 1992. Ontario Ministry of Environment laboratory sediment biological testing protocol. Toronto (Ont.) : Direction des ressources en eau, Ministère de l'Environnement de l'Ontario. 26 p.
Beyers, D.W. 1998. Causal inference in environmental impact studies. J. N. Am. Benthol. Soc. 17:367-373.
Bhavsar, S.P., Gandhi, N., Diamond, M.L. 2008. Extension of coupled multispecies metal transport and speciation (TRANSPEC) model to soil. Chemosphere 70(5):914-924.
Bierman, P.R., Nichols, K.K. 2004. Rock to sediment – slope to sea with 10Be – rates of landscape change. Annual Review of Earth and Planetary Sciences 32:215-255. Palo Alto (CA) : Annual Reviews Inc.
Biggs, B.J.F., Kilroy, C. 2000. Stream Periphyton Monitoring Manual. Préparé pour le ministère de l'Environnement de la Nouvelle-Zélande par le National Institute of Water and Atmospheric Research, Christchurch (Nouvelle-Zélande).
Borgmann, U., Norwood, W.P., Babirad, I.M. 1991. Relationship between chronic toxicity and bioaccumulation of cadmium in Hyalella azteca. J. Can. Sci. Halieut. Aquat. 48:1055-1060.
Borgmann, U., Norwood, W.P. 1997a. Toxicity and accumulation of zinc and copper in Hyalella azteca exposed to metal-spiked sediments. J. Can. Sci. Halieut. Aquat. 54:1046-1054.
Borgmann, U., Norwood, W.P. 1997b. Identification of the toxic agent in metal-contaminated sediments from Manitouwadge Lake, Ontario, using toxicity-accumulation relationships in Hyalella azteca. J. Can. Sci. Halieut. Aquat. 54:1055-1063.
Borgmann, U., Norwood, W.P. 1999. Assessing the toxicity of lead in sediments to Hyalella azteca: the significance of bioaccumulation and dissolved metal. J. Can. Sci. Halieut. Aquat. 56:1494-1503.
Borgmann, U. 2000. Methods for assessing the toxicological significance of metals in aquatic ecosystems: Bioaccumulation-toxicity relationships, water concentrations, and sediment spiking approaches. Aquat. Ecosyst. Health Management 3(3):277-289.
Borgmann, U., Norwood, W.P. 1999a. Predicting the toxicity of lead in sediments to Hyalella azteca: the significance of bioaccumulation and dissolved metal. J. Can. Sci. Halieut. Aquat. 56:1494-1503.
Borgmann, U., Norwood, W.P. 1999b. Sediment toxicity testing using large water-sediment ratios: an alternative to water renewal. Environ. Poll. 106:333-339.
Borgmann, U. 2002. Toxicity test methods and observations using the freshwater amphipod, Hyalella. Burlington (Ont.), Saskatoon (Sask.) : Environnement Canada, Institut national de recherche sur les eaux (INRE). Collection de l'INRE no 02-332.
Borgmann, U., Norwood, W.P., Reynoldson, T.B., Rosa, F. 2001. Identifying cause in sediment assessments: Bioavailability and the sediment quality triad. J. Can. Sci. Halieut. Aquat. 58:950-960.
Borgmann, U., Norwood, W.P., Dixon, D.G. 2004. Re-evaluation of metal bioaccumulation and chronic toxicity in Hyalella azteca using saturation curves and the biotic ligand model. Environ. Pollut. 131(3):469-484.
Borgmann, U., Grapentine, L., Norwood, W.P., Bird, G., Dixon, D.G., Lindeman, D. 2005a. Sediment toxicity testing with the freshwater amphipod Hyalella azteca: relevance and application. Chemosphere 61(11):1740-1743.
Borgmann, U., Ingersoll, C.G., Mathyk, S., Lennie-Misgeld, P. 2005b. Draft biological test method: Test for survival in 10-day water-only exposures using the freshwater amphipod, H. azteca, with emphasis on detection of toxicity due to ammonia.
Borgmann, U., Ingersoll, C.G., Mathyk, S., Lennie-Misgeld, P. 2005c. Draft biological test method: Test for survival in 10-day water-only exposures using the freshwater amphipod, H. azteca, with emphasis on detection of toxicity due to ammonia.
Borgmann, U., Couillard, Y., Grapentine, L.C. 2007. Relative contribution of food and water to 27 metals and metalloids accumulated by caged Hyalella azteca in two rivers affected by metal mining. Environmental Pollution 145:753-765.
Bosker, T., Munkittrick, K. 2009. Often overlooked: Biological QA/QC. Integrated Environmental Assessment and Management 5(3):489-91.
Brodeur, J.C., Sherwood, G., Hontela, A. 1997. Impaired cortisol secretion in yellow perch (Perca flavescens) from lakes contaminated by heavy metals: in vivo and in vitro assessment. J. Can. Sci. Halieut. Aquat. 54:2752-2758.
Brodeur, J.C., Daniel, C., Ricard, A.C., Hontela, A.1998. In vitro response to ACTH of the interrenal tissue of rainbow trout (Oncorhynchus mykiss) exposed to cadmium. Aquat. Toxicol. 42:103-113.
Burton, G.A. Jr. (éd.) 1992. Sediment Toxicity Assessment. Chelsea (MI) : Lewis Publishers Inc. 457 p.
Burton, G.A. 1998. Assessing aquatic ecosystems using pore water and sediment chemistry. Rapport préparé pour le Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique (ÉTIMA), Centre canadien de la technologie des minéraux et de l'énergie (CANMET), Ressources naturelles Canada, Ottawa (Ont.)
Burton, G.A., Pitt, R.E. 2002. Stormwater Effects Handbook. A Toolbox for Watershed Managers, Scientists, and Engineers. Boca Raton (FL) : CRC Press. 875 p.
Cairns, M.A., Nebeker, A.V., Gakstatter, J.H., Griffis, W.L. 1984. Toxicity of Copper-spiked Sediments to Freshwater Invertebrates. Environ. Toxicol. Chem. 3:435-445.
Campbell, P., Torgerson, T. 1980. Maintenance of iron meromixis by iron redeposition in a rapidly flushed monimolimnion. J. Can. Sci. Halieut. Aquat. 37(8):1303-1313.
Campbell, P.G.C. 1995. Interactions between trace metals and organisms: a critique of the free-ion activity model. In: Tessier, A., Turner, D.J. (éd.) Metal Speciation and Bioavailability in Aquatic Systems. Chichester (Royaume-Uni) : Wiley & Sons p. 45-102.
Campbell, P.G.C. 2012. Ecotoxicology of trace metals in the aquatic environment. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Campbell, P.G.C., Kraemer, L.D., Giguère, A., Hare, L., Hontela, A. 2008. Subcellular distribution of cadmium and nickel in chronically exposed wild fish: inferences regarding metal detoxification strategies and implications for setting water quality guidelines for dissolved metals. Human Ecol. Risk Assess. 14:290-316.
Campbell, P.G.C., Hare, L. 2009. Metal detoxification in freshwater animals. Roles of metallothioneins. In: Sigel, A., Sigel, H., Sigel, R.K.O. (éd.) Metallothioneins and Related Chelators. Cambridge (Royaume-Uni) : Royal Society of Chemistry. p. 239-277.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, ch. 33.
Canfield, T.J., Kemble, N.E., Brumbaugh, W.G., Dwyer, F.J., Ingersoll, C.G., Fairchild, J.F. 1994. Use of Benthic Invertebrate Community Structure and the Sediment Quality Triad to Evaluate Metal-Contaminated Sediment in the Upper Clark Fork River, Montana. Environmental Toxicology and Chemistry 13(12):1999-2012.
Carr, R.S., Chapman, D.C. 1992. Comparison of Solid-phase and Pore-water Approaches for Assessing the Quality of Marine and Estuarine Sediments. Chem. Ecol. 7:19-30.
Cattaneo, A., Kalff, J. 1980. The relative contribution of aquatic macrophytes and their epiphytes to the production of macrophyte beds. Limnol. Oceanogr. 25:280-289.
[CCME] Conseil canadien des ministres de l'environnement. 1999. Recommandations canadiennes pour la qualité de l'environnement. Chapitre 4 : Recommandations canadiennes pour la qualité des eaux : protection de la vie aquatique. Hull (Qc) : Conseil canadien des ministres de l'environnement. Accès : http://ceqg-rcqe.ccme.ca/?lang=fr
[CCME] Conseil canadien des ministres de l'environnement. 2007. Protocole d'élaboration des recommandations pour la qualité des eaux en vue de protéger la vie aquatique. Winnipeg (Man.) : Conseil canadien des ministres de l'environnement.
Chambers, P.A., Guy, M.A., Roberts, E.S., Charlton, M.N., Kent, R., Gagnon, C., Grove, G., Foster, N. 2001. Les éléments nutritifs et leurs effets sur l'environnement au Canada. Ottawa (Ont.) : Agriculture et Agroalimentaire Canada, Environnement Canada, Pêches et Océans Canada, Santé Canada, Ressources naturelles Canada. 271 p.
Chambers, P.A., Culp, J.M., Glozier, N.E., Cash, K.J., Wrona, F.J., Norton, L. 2006. Northern Rivers Ecosystem Initiative: Nutrients and Dissolved Oxygen – issues and impacts. Environmental Monitoring and Assessment 113(1-3):117-142.
Chapman, P.M. 1992. Sediment Quality Triad Approach. US EPA Sediment Classification Methods Compendium. Washington (DC) : Office of Science and Technology. 10-1-10-18.
Chapman, P.M., Hollert, H. 2006. Should the Sediment Quality Triad become a tetrad, a pentad, or possibly even a hexad? Journal of Soils and Sediments 6(1):4-8.
Chessman, B.C. 1985. Artificial-substratum periphyton and water quality in the lower La Trobe River, Victoria. Aust. J. Mar. Freshwater. Res. 36:855-871.
Clements, W.H. 1991. Community responses of stream organisms to heavy metals: a review of observational and experimental approaches. In: Newman, M.C., McIntosh, A.W. (éd.) Metal Ecotoxicology. Concepts and applications. Chelsea (MI) : Lewis Publ. p. 363-391.
Clements, W.H. 2004. Small-scale experiments support causal relationships between metal contamination and macroinvertebrate community responses. Ecological Applications 14:954-957.
Clements, W.H., Kiffney, D.M. 1994. Integrated laboratory and field approach for assessing impacts of heavy metals at the Arkansas River, Colorado. Environ. Toxicol. Chem. 13:397-404.
Cohen, A.S. 2003. Paleolimnology: The history and Evolution of Lake Systems. New York (NY) : Oxford University Press. 509 p.
Costa, P.M., Diniz, M.S., Caeiro, S., Lobo, J., Martins, M., Ferreira, A.M., Caetano, M., Vale, C., DelValls, T.A., Costa, M.H. 2009. Histological biomarkers in liver and gills of juvenile Solea senegalensis exposed to contaminated estuarine sediments: a weighted indices approach. Aquatic Toxicology 92(3):202-212.
Couillard, Y., St-Cyr, L. 1997. Technical evaluation of metallothionein as a biomarker for the mining industry. Rapport technique préparé dans le cadre du Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique (ÉTIMA). Projet de l'ÉTIMA no 2.2.1. Préparé pour Ressources naturelles Canada, Centre canadien de la technologie des minéraux et de l'énergie (CANMET). 191 p.
Couillard, Y., Giguère, A., Campbell, P.G.C., Perceval, O., Pinel-Alloul, B., Hare, L. 1999. Field evaluation of the use of metallothionein as a biomarker for metal contamination and toxic effects in the freshwater bivalve Pyganodon grandis: Subcellular metal partitioning. 20e réunion annuelle de la Society of Environmental Toxicology and Chemistry, du 14 au 18 novembre 1999, Philadelphie (PA).
Couillard, Y., Grapentine, L.C., Borgmann, U., Doyle, P., Masson, S. 2008. The amphipod Hyalella azteca as a biomonitor in field deployment studies for metal mining. Environmental Pollution 156:1314-1324.
Courtenay, L.A. 2002. Quantifying impacts of pulp mill effluent on fish in Canadian marine and estuarine environments: problems and progress. Water Qual. Res. J. Can. 37:79-99.
Courtney, L.A., Clements, W.H. 2002. Assessing the influence of water and substratum quality on benthic macroinvertebrate communities in a metal-polluted stream: an experimental approach. Freshwater Biology 47(9):1766-1779.
Crawford, J.K., Luoma, S.N. 1993. Guidelines for studies of contaminants in biological tissues for the National Water Quality Assessment Program. Denver (CO) : U.S. Geological Service. Open-File Rep. No. 92-494.
Culp, J.M. 1999. Weight-of-Evidence Assessments for Large Rivers: Linking Community Bioassays with Field and Laboratory Studies. Workshop on Integrated Approaches for Interpreting Environmental Effects Monitoring Data. DOE EEM/1999/1.
Culp, J.M., Podemski, C.L., Cash, K.J., Lowell, R.L. 1996. Utility of field-based artificial streams for assessing effluent effects on riverine ecosystems. J. Aquat. Ecosystem Health 5:117-124.
Culp, J.M., Lowell, R.B., Cash, K.J. 2000. Integrating in situ community experiments with field studies to generate weight-of-evidence risk assessments for large rivers. Environ. Toxicol. Chem. 19(4):1167-1173.
Deaver, E., Rodgers, J.H. Jr. 1996. Measuring bioavailable copper using anodic stripping voltammetry. Environ. Toxicol. Chem. 15:1925-1996.
Deutsch Forschungsgemeinshaft (German Research Council). 1998. Proposals for Safeguarding Good Scientific Practice. D-69469 Weinheim (République fédérale d'Allemagne) : Wiley-VCH Verlag GmbH. 85 p.
Di Toro, D.M. 1989. A Review of the Data Supporting the Equilibrium Partitioning Approach to Establishing Sediment Quality Criteria. Rapport présenté au National Research Council. [cité dans Baudo, 1990].
Di Toro, D.M., Allen, H.E., Bergman, H.L., Meyer, J.S., Paquin, P.R., Santore, R.C. 2000. The Biotic Ligand Model: A Computational Approach for Assessing the Ecological Effects of Metals in Aquatic Systems. Publié par l'Environmental Program de l'Association internationale pour le cuivre, dans le cadre de sa série « Copper in the Environment and Health ».
Di Toro, D.M., Allen, H.E., Bergman, H.L., Meyer, J.S., Paquin, P.R., Santore, R.C. 2001. A Biotic Ligand Model of the Acute Toxicity of Metals. I. Technical Basis. Environmental Toxicology and Chemistry 20(10):2383-2396.
Dodds, W.K. 2006. Eutrophication and trophic state in rivers and streams. Limnology and Oceanography 51(1, partie 2):671-680.
Dodds, W.K., Welch, E.B. 2000. Establishing nutrient criteria in streams. J. N. Am. Benthol. Soc. 19(1):186-196.
Doig, L., Liber, K. 2000. Dialysis minipeeper for measuring pore-water metal concentrations in laboratory sediment toxicity and bioavailability tests. Environmental Toxicology and Chemistry 19(12):2882-2889.
Ekberg, C., Ödegaard-Jensen, A. 2011. Uncertainties in chemical modelling of solubility, speciation and sorption. Accreditation and Quality Assurance 16(4/5):207-214. Heidelberg (Allemagne) : Springer Berlin.
Environnement Canada. 1990 [modifié en 1996]. Méthode d’essai biologique : essai de létalité aiguë sur Daphnia spp. Série de la Protection de l'environnement, Rapport SPE 1/RM/11. Ottawa (Ont.) 59 p.
Environnement Canada. 1992. Méthode d'essai biologique : Essai sur la fécondation chez les échinides (oursins globuleux et oursins plats). Série de la Protection de l'environnement, Rapport SPE
1/RM/27. Ottawa (Ont.) 124 p.
Environnement Canada. 1994. Document d'orientation sur le prélèvement et la préparation de sédiments en vue de leur caractérisation physicochimique et d'essais biologiques. Série de la Protection de l'environnement, Rapport SPE 1/RM/29. Ottawa (Ont.)
Environnement Canada. 1996. Méthode d'essai biologique : essai de létalité aiguë sur Daphnia spp. Série de la Protection de l'environnement, Rapport SPE 1/RM/11 (avec les modifications de mai 1996). Ottawa (Ont.) 78 p.
Environnement Canada. 1997a. Méthode d’essai biologique : essai de survie et de croissance de l'amphipode dulcicole Hyalella azteca. Série de la Protection de l'environnement, Rapport SPE 1/RM/33. Ottawa (Ont.) 122 p.
Environnement Canada. 1997b. Méthode d'essai biologique. Essai de survie et de croissance des larves dulcicoles chironomes (Chironomus tentans ou Chironomus riparius) dans les sédiments. Série de la Protection de l'environnement, Rapport SPE 1/RM/32. Ottawa (Ont.) 133 p.
Environnement Canada. 2007. Critères et directives pour la détermination de l'eutrophisation prononcée. Bureau national des études de suivi des effets sur l'environnement, Environnement Canada.
Environnement Canada. 2010. Guide technique pour l'Étude de suivi des effets sur l'environnement (ESEE) des pâtes et papiers – Chapitre 11 : Recherche des causes et des solutions. Environnement Canada. 40 p.
Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc), Canada. ISBN: 978-1-100-19968-9.
Environnement Canada. 2012. Second National Assessment of Environmental Effects Monitoring Data From Metal Mines subjected to the Metal Mining Effluent Regulations. Environnement Canada. 66 p.
[ESG] ESG International Inc. 1999. AETE Synthesis Report of Selected Technologies for Cost-Effective Environmental Monitoring of Mine Effluent Impacts in Canada. Projet de l'ÉTIMA no 4.1.4. Mars 1999. Ottawa (Ont.) : Centre canadien de la technologie des minéraux et de l'énergie (CANMET), Ressources naturelles Canada.
[ÉTIMA] Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique. 1997. Technical Evaluation of Monitoring Methods using Macrophytes, Phytoplankton, and Periphyton to Assess the Impacts of Mine Effluents on the Aquatic Environment. Projet de l'ÉTIMA no 2.3.2.
EVS Environmental Consultants. 1997. Technical evaluation: water quality and biological effects. Rapport préparé pour le Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique (ÉTIMA), Centre canadien de la technologie des minéraux et de l'énergie (CANMET), Ressources naturelles Canada, Ottawa (Ont.)
Fåhræus-van Ree, G.E., Payne, J.F. 2005. Endocrine disruption in the pituitary of white sucker (Catostomus commersoni) caged in a lake contaminated with iron-ore mine tailings. Hydrobiologia 532:221-224.
Farley, K.J., Rader, K.J., Miller, B.E. 2008. Tableau Input Coupled Kinetic Equilibrium Transport (TICKET) Model. Environmental Science & Technology 42(3):838-847.
Fox, G.A. 1991. Practical causal inference for ecoepidemiologists. J. Toxicol. Environ. Health 33:359-379.
Frey, D.G. 1998. What is paleolimnology? J. Paleolimnology 1:5-8.
Gibbons, W.N., Munkittrick, K.R. 1994. A sentinel monitoring framework for identifying fish population responses to industrial discharges. J. Aquat. Eco. Health 3:227-237.
Giesy, J.P., Hoke, R.A. 1990. Freshwater Sediment Quality Criteria: Toxicity Bioassessment. In: Baudo, R., Giesy, J.P., Muntau, H. (éd.) Sediments: Chemistry and Toxicity of In-place Pollutants, p. 265-348. Chelsea (MI) : Lewis Publishers, Inc. 405 p.
Giguère, A., Couillard, Y., Perceval, O., Campbell, P.G.C., Pellerin-Massicotte, J., Pinel-Alloul, B. 1999. Field evaluation of the use of metallothionein as a biomarker for metal contamination and toxic effects in the freshwater bivalve Pyganodon grandis: Responses at the organism level. 20e réunion annuelle de la Society of Environmental Toxicology and Chemistry, du 14 au 18 novembre 1999, Philadelphie (PA).
Gilbertson, M. 1997. Advances in forensic toxicology for establishing causality between Great Lakes epizootics and specific persistent toxic chemicals. Environ. Toxicol. Chem. 16:1771-1778.
Gillis, P.L., Dixon, D.G., Reynoldson, T.B., Diener, L.C. 1999. Metallothionein as a biomarker for trace metal exposure and effects in Tubifex tubifex and Chironomus riparius. 20e réunion annuelle de la Society of Environmental Toxicology and Chemistry, du 14 au 18 novembre 1999, Philadelphie (PA).
Grapentine, L.C. 2012. In situ measurements of toxicity and contaminant bioaccumulation with caged amphipods exposed to water and sediment for Investigation of Cause in metal mining Environmental Effects Monitoring studies. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Gustafson, J.P. 2004. Visual MINTEQ, version 2.30 [version Windows de MINTEQA2, version 4.0].
Håkanson, L., Jansson, M. 1983. Principles of Lake Sedimentology. Berlin (Allemagne) : Springer-Verlag. 316 p.
Hall, G.E.M. 1998. Cost-effective protocols for the collection, filtration and preservation of surface waters for detection of metals and metalloids at ppb ad ppt levels. Rapport préparé pour le Programme d'évaluation des techniques de mesure d'impacts en milieu aquatique (ÉTIMA), Centre canadien de la technologie des minéraux et de l'énergie (CANMET), Ressources naturelles Canada, Ottawa (Ont.)
Hargrave, B.T., Phillips, G.A., Doucette, L.I., White, M.J., Milligan, T.G., Wildish, D.J., Cranston, R.E. 1995. Biogeochemical observations to assess benthic impacts of organic enrichment from marine aquaculture in the Western Isles region of the Bay of Fundy. Rapp. tech. can. sci. halieut. aquat. 2062. 159 p.
Harkey, G.A., Landrum, P.F., Kaine, S.J. 1994. Comparison of Whole-sediment, Elutriate and Pore-water Exposures for Use in Assessing Sediment-associated Organic Contaminants in Bioassays. Environ. Toxicol. Chem. 13(8):1315-1329.
Haslam, S.M. 1982. A proposed method for monitoring river pollution using macrophytes. Environ. Technol. Letters 3:19-34.
Hellawell, J.M. 1986. Biological indicators of freshwater pollution and environmental management. Londres (Royaume-Uni) : Elsevier Applied Science Publishers. 546 p.
Henderson-Sellers, B., French, R.H. 1991. Water Quality Modelling Volume IV:
Decision Support Techniques for Lakes and Reservoirs. Boca Raton (FL) : CRC Press.
Henry, C.J., Higgins, K.F., Buhl, K.J. 1994. Acute toxicity and hazard assessment of Rodeo®, X-77 Spreader®, and Chem-Trol® to aquatic invertebrates. Arch. Environ. Contam. Toxicol. 27:392-399.
Herbelin, A.L., Westall, J.C. 1999. FITEQL, A Computer Program for Determination of Chemical Equilibrium Constants from Experimental Data. Report 99-01, version 4.0. Corvallis (OR) : Oregon State University.
Hewitt, M.L., Servos, M.R. 2001. An Overview of Substances Present in Canadian Aquatic Environments Associated with Endocrine Disruption. Water Qual. Res. J. Canada 36(2):191-213.
Hewitt, M.L., Dube, M.G., Culp, J.M., MacLatchy, D.L., Munkittrick, K.R. 2003. A proposed framework for investigation of cause for environmental effects monitoring. Human and Ecological Risk Assessment 9(1):195-211.
Hinton, D.E., David, E., Darrel, J.L., Adams, S.M. 1990. Integrative histopathological approaches to detecting effects of environmental stressors on fishes. American Fisheries Society Symposium: Biological indicators of stress in fish 8:51-66. FR 36(1).
Hinton, D.E., Kullman, S.W., Bencic, D.C., Hardman, R.C., Chen, P.J., Carney, M., Volz, D.C. 2005. Resolving mechanisms of toxicity while pursuing ecotoxicological relevance. Marine Pollution Bull. 51:635-648.
Hodson, P.V. 1990. Indicators of ecosystem health at the species level and the example of selenium affects on fish. Environmental Monitoring and Assessment 15(3):241-255.
Holm, J., Palace, V.P., Siwik, P., Sterling, G., Evans, R.E., Baron, C.L., Werner, J., Wautier, K. 2005. Developmental effects of bioaccumulated selenium in eggs and larvae of two salmonid species. Environ. Toxicol. Chem. 24:2373-2381.
Hontela, A., Ramussen, J.B., Audet, C., Chevalier, G. 1992. Impaired cortisol stress response in fish from environments polluted by PAHs, PCB, and mercury. Arch. Environ. Contam. Toxicol. 22:278-283.
Ingersoll, C.G., Ivey, C.D., Brunson, E.L., Hardesty, D.K., Kemble, N.E. 2000. Evaluation of toxicity: Whole-sediment versus overlying-water exposures with amphipod H. azteca. Environmental Toxicology and Chemistry 19:2906-2910.
Centre international de recherche sur le cancer. 2008. Code of Good Scientific Practice. Genève (Suisse) : Organisation mondiale de la santé. 11 p.
Kelly, M. 1988. Mining and the freshwater environment. Londres (Royaume-Uni) : Elsevier Applied Science. 231 p.
Knezovich, J.P., Harrison, F.L. 1987. The Bioavailability of Sediment-sorbed Organic Chemicals: A Review. Water Air Soil Pollut. 32:233-245.
Knezovich, J.P., Harrison, F.L. 1988. The Bioavailability of Sediment-sorbed Chlorobenzenes to Larvae of the Midge, Chironomous decorus. Ecotoxicol. Environ. Safety 15:226-241.
Kutka, F.J., Richards, C. 1996. Relating diatom assemblage structure to stream habitat quality. J. N. Am. Benthol. Soc. 15:469-480.
Laflamme, J.S., Couillard, Y., Campbell, P.G.C., Hontela, A. 1998. Impaired physiological response to stress and high levels of metallothionein in perch (Perca flavescens) from lakes contaminated by heavy metals. 25e atelier annuel sur la toxicité aquatique, du 18 au 21 octobre 1998, à Québec (Qc).
Langmuir, D., Chrostowski, P., Vigneault, B., Chaney, R. Issue Paper on the Environmental Chemistry of Metals. Présenté au Risk Assessment Forum de l'Environmental Protection Agency des États-Unis. Présenté par ERG, 110, Hartwell Avenue, Lexington (MA).
Ledo, H., Rivas, Z., Gutierrez, J., Gutierrez, E., Ojeda, J., Avila, H. 2004. Baseline of Ca, Mg, Fe, Mn, and Al concentrations in Catatumbo River Surficial sediments. Water, Air, and Soil Pollution 155:117-135.
Liber, D., Liber, K. 2000. Dialysis minipeeper for measuring pore-water metal concentrations in laboratory sediment toxicity and bioavailability tests. Environ. Toxicol. Chem. 19(1):2882-2889.
Liber, K., Doig, L.E., White-Sobey, S.L. 2011. Toxicity of uranium, molybdenum, nickel, and arsenic to Hyalella azteca and Chrionomus dilutus in water-only and spiked-sediment toxicity tests. Ecotox. Environ. Saf. 74:1171-1179.
Lowe, R.L., Pank, Y. 1996. Benthic algal communities as biological monitors. In: Stevenson, R.J., Bothwell, M.L., Lowe, R.L. (éd.) Algal ecology. Freshwater benthic ecosystem. San Diego (CA) : Academic Press.
Lowell, R.B., Culp, J.M., Dube, M.G. 2000. A weight-of evidence approach for northern river risk assessment: integrating the effects of multiple stressors. Environ. Toxicol. Chem. 19(4):1182-1190.
Lowell, R.B., Tessier, C., Walker, S.L., Willsie, A., Bowerman, M., Gautron, D. 2007. Évaluation nationale des données de la phase 1 du Programme d'étude de suivi des effets sur l'environnement des mines de métaux. Gatineau (Qc) : Bureau national des études de suivi des effets sur l'environnement, Environnement Canada. 45 p.
Luoma, S.N., Rainbow, P.S. 2008. Metal contamination in aquatic environments: science and lateral management. Cambridge (Royaume-Uni) : Cambridge University Press.
Mabit, L., Benmansour, M., Walling, D.E. 2008. Comparative advantages and limitations of the fallout radionuclides 137Cs, 210Pbex and 7Be for assessing soil erosion and sedimentation. Journal of Environmental Radioactivity 99(12):1799-1807.
Martel, P.H., Kovacs, T.G., O’Connor, B.L., Voss, R.H. 1997. Source and identity of compounds in a thermomechanical pulp mill effluent inducing hepatic mixed-function oxidase activity in fish. Environ Toxicol. Chem. 16:2375-2383.
McCutcheon, S.C., French, R.H. 1989. Water Quality Modelling Volume I: Transport
and Surface Exchange in Rivers. Boca Raton (FL) : CRC Press.
McGeer, J.C., Playle, R.C., Wood, C.M., Galvez, F. 2000. A Physiologically Based Biotic Ligand Model for Predicting the Acute Toxicity of Waterborne Silver to Rainbow Trout in Freshwaters. Environmental Science and Technology 34:4199-4207.
McGeer, J., Henningsen, G., Lanno, R., Fisher, N., Sappington, K., Drexler, J. 2004. Issue paper on the bioavailability and bioaccumulation of metals.
McGeer, J.C., Clifford, M., Janssen, C.R., De Schamphelaere, K.A.C. 2010. Modeling the toxicity of metals to aquatic biota using the biotic ligand approach. In: Bury, N.R., Handy, R.D. (éd.) Essential Reviews in Experimental Biology Vol. 2. Surface Chemistry, Bioavailability and Metal Homeostasis in Aquatic Organisms: an Integrated Approach. Londres (Royaume-Uni) : SEB Press. p. 205-231.
McGeer, J., Clifford, M., Ng, T., Wood, C. 2012. Using bioaccumulation models for predicting dissolved metal toxicity. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Meador, J., Parkerton, T., McElroy, A. 2011. Tissue residue approach to toxicity assessment: A step forward. Society of Environmental Toxicology and Chemistry.
Meyer, J.S., Santore, R.C., Bobbitt, J.P., DeBrey, L.D., Boese, C.J., Paquin, P.R., Allen, H.E., Bergman, H.L., Di Toro, D.M. 1999. Binding of nickel and copper to fish gills predicts toxicity but free ion activity does not. Environ. Sci. Tech. 33:913-916.
Muir, D.C.G., Kenny, D.F., Grift, N., Robinson, R.D., Titman, R.D., Murkin, H.R. 1991. Fate and acute toxicity of bromoxynil esters in an experimental prairie wetland. Environ. Toxicol. Chem. 10:395-406.
Mulliss, R.M., Revitt, D.M., Shutes, R.B.E. 1996. A statistical approach for the assessment of the toxic influences on Gammarus pulex (Amphipoda) and Asellus aquaticus (Isopoda) exposed to urban discharges. Wat. Res. 30:1237-1243.
Munkittrick, K.R., Portt, C.B., Van Der Kraak, G.J., Smith, I.R., Rokosh, D.A. 1991. Impact of bleached kraft mill effluent on population characteristics, liver MFO activity, and serum steroid levels of a Lake Superior white sucker (Catostomus commersoni) population. J. Can. Sci. Halieut. Aquat. 48:1371-1380.
Munkittrick, K.R., Van Der Kraak, G.J., McMaster, M.E., Portt, C.B., van den Heuvel, M.R., Servos, M.R. 1994. Survey of receiving-water environmental impacts associated with discharges from pulp mills. 2. Gonad size, liver size, hepatic EROD activity and plasma sex steroid levels in white sucker. Environ. Toxicol. Chem. 13:1089-1101.
Munkittrick, K.R., McMaster, M.E., Van Der Kraak, G., Portt, C., Gibbons, W.N., Farwell, A., Gray, M. 2000. Development of Methods for Effects-Driven Cumulative Effects Assessment Using Fish Populations: Moose River Project. Pensacola (FL) : The Society of Environmental Toxicology and Chemistry. 236 p.
Nebeker, A.V., Cairns, M.A., Gakstatter, J.H., Malueg, K.W., Schuytema, G.S., Krawczyk, D.R. 1984. Biological Methods for Determining Toxicity of Contaminated Freshwater Sediments to Invertebrates. Environ. Toxicol. Chem. 3:617-630.
Niyogi, S., Wood, C.M. 2004. The Biotic Ligand Model, a flexible tool for developing site-specific water quality guidelines for metals. Environ. Sci. Technol. 38(23):6177-6192.
North American Metals Council. 2008. Selenium Tissue Thresholds: Tissue Selection Criteria, Threshold Development Endpoints, and Potential to Predict Population or Community Effects in the Field. 178 p.
Norwood, W.P., Borgmann, U., Dixon, D.G. 2007. Chronic toxicity of arsenic, cobalt, chromium and manganese to Hyalella azteca in relation to exposure and bioaccumulation. Environmental Pollution 147:262-272.
Novak, L.J., Holtze, L.E. 2012. Toxicity Reduction Evaluations (TREs) as a Tool for Investigation of Cause – Mining Case Studies. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Nowierski, M., Dixon, D.G., Borgmann, U. 2005. Effects of water chemistry on the bioavailability of metals in sediment to Hyalella azteca: Implications for sediment quality guidelines. Arch. Environ. Contam. Toxicol. 49:322-332.
[OCDE] Organisation de coopération et de développement économiques, Forum mondial de la science. 2007. Best Practices for Ensuring Scientific Integrity and Preventing Misconduct. Paris (FR) : Organisation de coopération et de développement économiques. 13 p.
Ontario. Ministère de l'Environnement et de l'Énergie. 1997. Sediment and biological assessment of Canagaigue Creek at the Uniroyal Chemical Ltd. Plant, Elmira, Ontario. 1995-1996. Ministère de l'Environnement et de l'Énergie. 37 p. + annexes.
Palace, V.P., Doebel, C., Baron, C.L., Evans, R.E., Wauiter, K.G., Klaverkamp, J.F., Werner, J., Kollar, S. 2005. Caging small bodied fish as an alternative method for environmental effects monitoring (EEM). Can. Wat. Qual. Res. J. 40:328-333.
Palace, V.P. 2012. Investigating Selenium Toxicity Using an Environmental Effects Monitoring Approach. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Paquin, P.R., Di Toro, D.M., Santore, R.C., Trivedi, D., Wu, K.B. 1999. A Biotic Ligand Model of the Acute Toxicity of Metals. III. Application to Fish and Daphnia Exposure to Silver. Section 3, in: Integrated Approach to Assessing the Bioavailability and Toxicity of Metals in Surface Waters and Sediments, a submission to the EPA Science Advisory Board. Washington (DC) : Office of Water, Office of Research and Development. US EPA-822-E-99-001. p. 3-59 à 3-102.
Paquin, P.R., Gorsuch, J.W., Apte, S., Batley, G.E., Bowles, K.C., Campbell, P.G.C., Delos, C.G., Di Toro, D.M., Dwyer, R.L., Galvez, F., et al. 2002a. The Biotic Ligand Model: A Historical Overview, Special Issue: The Biotic Ligand Model for Metals – Current Research, Future Directions, Regulatory Implications. Comparative Biochemistry and Physiology C 133(1-2):3-35.
Paquin, P.R., Zoltay, V., Winfield, R.P., Wu, K.B., Mathew, R., Santore, R., Di Toro, D.M. 2002b. Extension of the Biotic Ligand Model of Acute Toxicity to a Physiologically-based Model of the Survival Time of Rainbow Trout (Oncorhynchus mykiss) Exposed to Silver, Special Issue: The Biotic Ligand Model for Metals – Current Research, Future Directions, Regulatory Implications. Comparative Biochemistry and Physiology C 133(1-2):305-343.
Parker, R., Dumaresq, C. 2002. Effluent characterization, water quality monitoring, and sediment monitoring in the metal mining EEM program. Water Qual. Res. J. Canada 37(1):219-228.
Parkhurst, D.L., Appelo, C.A. 2000. User's guide to PHREEQC (Version 2) – A computer program for speciation, hatch-reaction, one-dimensional transport, and inverse geochemical calculations. U.S. Geological Survey, Water-Resources Investigations Report 99-4259. 112 p.
Parrott, J.L. 2005. Overview of methodology and endpoints in fathead minnow lifecycle tests assessing pulp mill effluents. Water Qual. Res. J. Can. 40(3):334-346.
Parrott, J.L., Bennie, D.T. 2009. Lifecycle exposure of Fathead minnows to a mixture of six common pharmaceuticals and triclosan. J. Toxicol. Environ. Health B 9:297-317.
Parrott, J.P., Hewitt, L.M., McMaster, M.E. 2012. Fathead Minnow Lifecycle Assays for Assessment of Complex Effluents. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Patrick, W.H. Jr, Gambrell, R.P., Khalid, R.A. 1977. Physicochemical Factors Regulating Solubility and Bioavailability of Toxic Heavy Metals in Contaminated Dredged Sediment. J. Environ. Sci. Health A 12:475-492.
Pearson, T.H., Rosenberg, R. 1978. Macrobenthic succession in relation to organic enrichment and pollution of the marine environment. Oceanography and Marine Biology Annual Review 163:229-311.
Peplow, D., Edmonds, R. 2005. The effects of mine waste contamination at multiple levels of biological organization. Ecological Engineering 24(1/2):101-119.
Perceval, O., Couillard, Y., Giguère, A., Pinel-Alloul, B., Campbell, P.G.C. 1999. Field evaluation of the use of metallothionein as a biomarker for metal contamination and toxic effects in the freshwater bivalve Pyganodon grandis: Responses at the population level. 20e réunion annuelle de la Society of Environmental Toxicology and Chemistry, du 14 au 18 novembre 1999, Philadelphie (PA).
Pereira, P., de Pablo, H., Vale, C., Rosa-Santos, F., Cesário, R. 2009. Metal and nutrient dynamics in a eutrophic coastal lagoon (Óbidos, Portugal): the importance of observations at different time scales. Environ. Monit. Assess. 158:405-418.
Phillips, D.J.H., Rainbow, P.S. 1993. Biomonitoring of trace aquatic contaminants. Londres (Royaume-Uni) : Elsevier Applied Science Publishers.
Pierron, F., Bourret, V., St-Cyr, J., Campbell, P.G.C., Bernatchez, L., Couture, P. 2009. Transcriptional responses to environmental metal exposure in wild yellow perch (Perca flavescens) collected in lakes with differing environmental metal concentrations (Cd, Cu, Ni). Ecotoxicol. 18:620-631.
Pinel-Alloul, B., Campbell, P.G.C., Hare, L., Couillard, Y., Giguère, A., Perceval, O. 1999. Field evaluation of the use of metallothionein as a biomarker for metal contamination and toxic effects in the freshwater bivalve Pyganodon grandis: Overview. 20e réunion annuelle de la Society of Environmental Toxicology and Chemistry, du 14 au 18 novembre 1999, Philadelphie (PA).
Pollard, A.I., Yuan, L. 2006. Community response patterns: evaluating benthic invertebrate composition in metal-polluted streams. Ecological Applications 16(2):645-655.
Rickwood, C.J., Dubé, M.G., Hewitt, M., Kovacs, T.G., MacLatchy, D.L. 2006. Use of paired fathead minnow (Pimephales promelas) reproductive test. Part 2: Source identification of biological effects at a bleached kraft pulp mill. Env. Toxicol. Chem. 25:1847-1856.
Ridal, J.J., Yanch, L.E., Fowlie, A.R., Razavi, N.R., Delongchamp, T.M., Choy, E.S., Fathi, M., Hodson, P.V., Campbell, L., Blais, J.M., et al. 2010. Potential causes of enhanced transfer of mercury to St. Lawrence River Biota: implications for sediment management strategies at Cornwall, Ontario, Canada. Hydrobiologia 2010:81-98.
Ridley-Thomas, C.I., Austin, A., Lucey, W.P., Clark, M.J.R. 1989. Variability in the determination of ash free dry weight for periphyton communities: a call for a standard method. Water Research 23(6):667-670.
Ritchie, J.C., McHenry, J.R. 1990. Application of radioactive fallout cesium-137 for measuring soil erosion and sediment accumulation rates and patterns: a review. Journal of Environmental Quality 19(2):215-233.
Roch, M., Nordin, R.N., Austin, A., McKean, C.J.P., Deniseger, J., Kathman, R.D., McCarter, J.A., Clark, M.J.R. 1985. The effects of heavy metal contamination on the aquatic biota of Buttle Lake and the Cambpell River drainage (Canada). Arch. Environ. Contam. Toxicol. 14:347-362.
Sánchez España, J., López Pamo, E., Santofimia Pastor, E., Diez Ercilla, M. 2008. The acidic mine pit lakes of the Iberian Pyrite Belt: an approach to their physical limnology and hydrogeochemistry. Applied Geochemistry 23(5):1260-1287.
Santore, R.C., McGrath, J., Brix, K., Paquin, P.R., Di Toro, D.M. 1998. Use of a biotic ligand model to calculate site-specific water effect ratios for metals. Conférence annuelle de 1998 de la Society of Environmental Toxicology and Chemistry, Charlotte (NC).
Santore, R.C., Di Toro, D.M., Paquin, P.R., Allen, H.E., Meyer, J.S. 2001. A Biotic Ligand Model of the Acute Toxicity of Metals. II. Application to Acute Copper Toxicity in Freshwater Fish and Daphnia. Environmental Toxicology and Chemistry 20(10):2397-2402.
Santore, R.C., Mathew, R., Paquin, P.R., Di Toro, D.M. 2002. Development of a Biotic Ligand Model of Acute Toxicity for Zinc, Special Issue: The Biotic Ligand Model for Metals – Current Research, Future Directions, Regulatory Implications. Comparative Biochemistry and Physiology C 133(1-2):271-285.
Sappington, K.G., Bridges, T.S., Bradbury, S.P., Erickson, R.J., Hendriks, A.J., Lanno, R.P., Meador, J.P., Mount, D.R., Salazar, M.H., Spry, D.J. 2011. Application of the tissue residue approach in ecological risk assessment. Integrated Environmental Assessment and Management 7(1):116-140 (Special Issue: Tissue Residue Approach Special Series).
Schecher, W.D., McAvoy, D.C. 1992. MINEQL+: a software environment for chemical equilibrium modelling. Comput. Environ. Urban Systems 16:65-76.
Schecher, W.D., McAvoy, D.C. 1994. MINEQL+: A Chemical Equilibrium Program for Personal Computers (Version 3.01). Hallowell (ME) : Environmental Research Software. 107 p.
Schuytema, G.S., Nelson, P.O., Malueg, K.W., Nebeker, A.V., Krawczyk, D.F., Ratcliff, A.K., Gakstatter, J.H. 1984. Toxicity of Cadmium in Water and Sediment to Daphnia magna. Environ. Toxicol. Chem. 3:293-308.
[SETAC] Society of Environmental Toxicology and Chemistry. 1999. SETAC Technical Issue Paper. Sound Science. Pensacola (FL) : Society of Environmental Toxicology and Chemistry.
Shaner, S.W., Knight, A.W. 1985. The Role of Alkalinity in the Mortality of Daphnia magna in Bioassays of Sediment-bound Copper. Comp. Biochem. Physiol. 82C:273-277.
Sharpe, R.L., Machtans, H., Crowe, J., Smith, P., Patrick, H., Chapman, P.M., Connell, R., Daniels, E. 2012. Con Mine: Investigation of Cause Study on fish livers – Challenges to designing a new Investigation of Cause study. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Shifrin, N.S., Beck, B.D., Gauthier, T.D., Chapnick, S.D., Goodman, G. 1996. Chemistry, toxicology and human health risk of cyanide compounds in soils at former manufactured gas plant sites. Regul. Toxicol. Pharmacol. 23:106-116.
Shobanov, N.A., Kiknadze, I.I., Butler, M.G. 1999. Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera, Chironomidae). Ent. Scand. 30:311-322.
Shuhaimi-Othman, M., Pascoe, D., Borgmann, U., Norwood, W.P. 2006. Reduced metals concentrations of water, sediment and Hyalella azteca from lakes in the vicinity of the Sudbury metal smelters, Ontario, Canada. Environmental Monitoring and Assessment 117(1/3):27-44.
Small, A.M., Adey, W.H., Lutz, S.M., Reese, E.G., Roberts, D.L. 1996. A macrophyte-based rapid biosurvey of stream water quality: restoration at the watershed scale. Restoration Ecol. 4:124-145.
Sortkjaer, O. 1984. Macrophytes and macrophyte communities as test systems in ecotoxicological studies of aquatic systems. Ecol. Bull. 36:75-80.
St. Cyr, L., Campbell, P.G.C. 2000. Bioavailability of sediment-bound metals for Vallisneria americana Michx, a submerged aquatic plant, in the St. Lawrence River. Journal canadien des sciences halieutiques et aquatiques 57:1330-1341.
Stumm, W., Morgan, J.J. 1996. Aquatic chemistry: chemical equilibria and rates in natural waters. 3e éd. New York (NY) : Wiley Interscience.
Suter, G.W. II. 1993. Ecological Risk Assessment. Boca Raton (FL) : Lewis Publishers.
Szarek-Gwiazda, E., Zurik, R. 2006. Distribution of Trace Elements in Meromictic Pit Lake. Water, Air & Soil Pollution 174(1-4):181-196.
Taylor, L.N., McFarlane, W.J., Pyle, G.G., Couture, P., McDonald, D.G. 2004. Use of performance indicators in evaluating chronic metal exposure in wild yellow perch (Perca flavescens). Aquatic Toxicology 67:371-385.
Taylor, L.N., Novak, K., Holtze, K., Ali, N., Scroggins, R. 2012. Separating current effluent quality from historical contamination using a laboratory based monitoring tool for investigation of cause. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Tessier, A., Couillard, Y., Cambpell, P.G.C., Auclair, J.C.A. 1993. Modeling of Cd partitioning in oxic lake sediments and Cd concentrations in the freshwater bivalve Anodonta grandis. Limnol. Oceanogr. 38:1-17.
Tessier, A., Turner, D.R (éd.) 1995. Metal speciation and bioavailability in aquatic systems. Chichester (Royaume-Uni) : John Wiley and Sons Ltd.
Thomann, R.T., Mueller, J.A. 1987. Principles of Surface Water Quality Modelling and
Control. New York (NY) : Harper Collins Publishers Inc.
Thomas, G.P. 2012. Use and application of Benthic Transplant Devices (BTDs). In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Tipping, E. 1998. Humic ion-binding Model VI: an improved description of the interactions of protons and metal ions with humic substances. Aq. Geochem. 4:3-48.
Unsworth, E.R., Warnken, K.W., Zhang, H., Davison, W., Black, F., Buffle, J., Cao, J., Cleven, R., Galceran, J., Gunkel, P., et al. 2006. Model predictions of metal speciation in freshwaters compared to measurements by in situ techniques. Environmental Science & Technology 40(6):1942-1949.
[USEPA] Environmental Protection Agency des États-Unis. 1989. Generalized methodology for conducting industrial toxicity reduction evaluations. EPA-600/2-88/070.
[USEPA] Environmental Protection Agency des États-Unis. 1991a. Methods for aquatic toxicity identification evaluations: Phase I toxicity characterization procedures. EPA-600/6-91/003.
[USEPA] Environmental Protection Agency des États-Unis. 1991b. Toxicity identification evaluation: characterization of chronically toxic effluents, Phase I. EPA-600/6-91/005.
[USEPA] Environmental Protection Agency des États-Unis. 1991c. Sediment toxicity identification evaluation: Phase I (Characterization), Phase II (Identification) and Phase III (Confirmation) modifications of effluent procedures. EPA-600/6-91/007.
[USEPA] Environmental Protection Agency des États-Unis. 1993a. Methods for aquatic toxicity identification evaluations: Phase II toxicity identification procedures for samples exhibiting acute and chronic toxicity. EPA-600/R-92/080.
[USEPA] Environmental Protection Agency des États-Unis. 1993b. Methods for aquatic toxicity identification evaluations: Phase III toxicity confirmation procedures for samples exhibiting acute and chronic toxicity. EPA-600/R-92/081.
[USEPA] Environmental Protection Agency des États-Unis. 1996. Marine toxicity identification evaluation (TIE): Phase I guidance document. Duluth (MN) : Environmental Research Laboratory. EPA/600/R-96/054.
[USEPA] Environmental Protection Agency des États-Unis. 1997. Sediment Toxicity Evaluation (TIE) Phases I, II, and III, Guidance Document. EPA/600/R-07/080.
[USEPA] Environmental Protection Agency des États-Unis. 2001. Methods for Collection, Storage and Manipulation of Sediments for Chemical and Toxicological Analyses: Technical Manual. EPA-823-B-01-002.
[USEPA] Environmental Protection Agency des États-Unis. 2003. Biotic Ligand Model: Technical Support Document for its Application to the Evaluation of Water Quality Criteria for Copper. Washington (DC) : Office of Science and Technology, Health and Ecological Criteria Division. EPA Number 822R03027.
[USEPA] Environmental Protection Agency des États-Unis. 2004. Draft Aquatic Life Water Quality Criteria for Selenium – 2004. EPA-822-D-04-001. Washington (DC) : Office of Water.
[USEPA] Environmental Protection Agency des États-Unis. 2007. Framework for Metals Risk Assessment. Washington (DC) : Office of the Science Advisor, Risk Assessment Forum. EPA/120/R-07/001.
van de Guchte, C., Maas-Diepeveen, J.L. 1988. Screening Sediments for Toxicity: A Water-concentration Related Problem. In: Proceedings of the 14th Annual Aquatic Toxicity Workshop, du 1er au 4 novembre 1987, Toronto (Ont.) Rapp. tech. can. sci. halieut. aquat. 1607:81-91.
Van Geest, J.L., Poirier, D.G., Solomon, K.R., Sibley, P.K. 2011. A comparison of the bioaccumulation potential of three freshwater organisms exposed to sediment-associated contaminants under laboratory conditions. Environ. Toxicol. Chem. 30:939-949.
Van Geest, J.L., Poirier, D.G., Sibley, P.K., Solomon, K.R. 2011. Validation of Ontario's new laboratory-based bioaccumulation methods with in situ field data. Environ. Toxicol. Chem. 30:950-958.
van Wijngaarden, R.P.A., van den Brink, P.J., Crum, S.J.H., Voshaar, J.H.O., Brock, T.C.M., Leeuwangh, P. 1996. Effects of the insecticide Dursban® 4E (active ingredient chlorpyrifos) in outdoor experimental ditches: I. Comparison of short-term toxicity between the laboratory and the field. Environ. Toxicol. Chem. 15:1133-1142.
Vigneault, B., Desforges, M., McGeer, J. 2012. Mining Reagents and By-Products (e.g. Thiosalts) As Potential Toxicants in Mine Effluents. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Vijver, M.G., Van Gestel, C.A.M., Lanno, R.P., Van Straalen, N.M., Peijnenburg, W.J.G.M. 2004. Internal metal sequestration and its ecotoxicological relevance: a review. Environ. Sci. Technol. 38:4705-4712.
Vink, J.P.M., Meeussen, J.C.L. 2007. BIOCHEM-ORCHESTRA: a tool for evaluating chemical speciation and ecotoxicological impacts of heavy metals on river flood plain systems. Environmental Pollution 148(3):833-841.
Walker, P.A., Kille, P., Hurley, A., Bury, N.R., Hogstrand, C. 2008. An in vitro method to assess toxicity of waterborne metals to fish. Toxicol. Appl. Pharmacol. 230:67-77.
Wang, D., Couillard, Y., Campbell, P.G.C., Jolicoeur, P. 1999. Changes in subcellular metal partitioning in the gills of freshwater bivalves (Pyganodon grandis) living along an environmental cadmium gradient. J. Can. Sci. Halieut. Aquat. 56:774-784.
Wang, F., Goulet, R.R., Chapman, P.M. 2004. Testing sediment biological effects with the freshwater amphipod Hyalella azteca: the gap between laboratory and nature. Chemosphere 57:1713-1724.
Warren, L.A., Tessier, A., Hare, L. 1998. Modelling cadmium accumulation by benthic invertebrates in situ: The relative contributions of sediment and overlying water reservoirs to organism cadmium concentrations. Limnol. Oceanogr. 43:1442-1454.
Warwick, R.M., Clarke, K.R. 1991. A Comparison of Some Methods for Analysing Changes in Benthic Community. J. Mar. Biol. Ass. U.K. 71:225-244.
Weber, C.I. 1973. Biological field and laboratory methods for measuring the quality of surface waters and effluents. U.S. Environmental Protection Agency Report 670/4/73/001.
Weber, L.P., Higgins, P.S., Carlson, R.I., Janz, D.M. 2003. Development and validation of methods for measuring multiple biochemical indices of condition in juvenile fishes. Journal of Fish Biology 63:637-658.
Weech, S., Orr, P., Russel, C., Fedat, L., Yaschyshyn, D. 2012. Investigation of Cause of Effects on Benthic Invertebrates at the Kidd Metallurgical Site. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Weitzel, R.L., Sanocki, S.L., Holecek, H. 1979. Sample replication of periphyton collected from artificial substrates. In: Weitzel, R.L. (éd.) Methods and Measurements of Periphyton Communities: a Review. Philadelphie (PA) : ASTM STP 690. p. 90-115.
Werner, I., Clar, S.L., Hinton, D.E. 2003. Biomarkers aid understanding of aquatic organism responses to environmental stressors. California Agriculture 57(4):110-115.
Whitton, B.A. 1984. Algae as monitors of heavy metals in freshwaters. In: Shubert, L.E. (éd.) Algae as Ecological Indicators. Londres (Royaume-Uni) : Academic Press. p. 257-280.
Whitton, B.A., Say, P.J., Wher, J.D. 1981. Use of plants to monitor heavy metals in rivers. In: Say, P.J., Whitton, B.A. (éd.) Heavy metals in Northern England: environmental and biological aspects. Département de botanique, Université de Durham, Durham (Royaume-Uni). p. 135-145.
Wolf, J.C., Wolfe, M.J. 2005. A Brief Overview of nonneoplastic hepatic toxicity in fish. Toxicologic Pathology 33:75-85.
Yan, N.D. 1979. Phytoplankton community of an acidified, heavy metal contaminated lake near Sudbury, Ontario: 1973-1977. Water, Air, and Soil Poll. 11:43-45.
Zagury, G.J. 2012. Cyanide speciation and fate in gold mine tailings: A case study. In: Environnement Canada. 2012. Environmental Effects Monitoring Investigation of Cause Workshop for Metal Mining: Proceedings, Gatineau (Qc).
Zapata, F. 2003. The use of environmental radionuclides as tracers in soil erosion and sedimentation investigations: recent advances and future developments. Soil & Tillage Research 69(1/2):3-13.
Tableaux et figures
Le tableau 12-1 décrit les causes possibles susceptibles d’être envisagées au cours de la recherche des causes pour les effets confirmés dont la valeur est inférieure au seuil critique d’effet. Les causes possibles sont notamment les différences d’habitat, les concentrations élevées de nutriants, la réponse causée par la contamination de l’effluent, la variation naturelle, la contamination historique des sédiments et la rareté de la nourriture. Une approche est proposée pour l’étude de chacune des causes. De plus, des exemples illustrent chaque approche proposée.
Le tableau 12-2 définit un ensemble formalisé de critères de causalité faisant partie d’une approche fondée sur le poids de la preuve pour évaluer les effets des effluents des mines. Les principaux critères de causalité comprennent la corrélation spatiale, la corrélation temporelle, le mécanisme plausible, la vérification expérimentale, la force, la spécificité, la preuve d’exposition, l’uniformité et la cohérence.
La figure 12-1 est un diagramme conceptuel qui présente un cadre par étapes pour la recherche des causes dans les études de suivi des effets sur l’environnement. Les niveaux 1 à 5 sont divisés en trois catégories : détermination du profil de réponse, identification de la source dans la mine et caractérisation et identification des substances chimiques. Le passage d’une étape à une autre implique que les résultats augmentent en précision, en complexité, en efforts et en coûts.
1 L'abondance est définie comme le nombre d'invertébrés benthiques. Le terme « densité » est utilisé lorsque l'abondance est exprimée par unité de surface.
Retournez à la table des matières
Chapitre 13
13. Rapport sur les données historiques
13.2 Recommandations pour l’examen des données historiques effectué par la mine
13.3 Recommandations sur le rapport de données historiques
13. Rapport sur les données historiques
13.1 Aperçu
Le présent chapitre vise à donner une orientation aux mines ayant recueilli des données « historiques », c’est-à-dire des données sur des études de suivi biologique menées avant d’être assujetties au Règlement sur les effluents des mines de métaux (REMM). Veuillez consulter l’alinéa 14(b) de l’annexe 5 du REMM pour connaître les clauses reliées aux données historiques et le chapitre 1 pour avoir de l’information additionnelle (sections 1.3.2.2, 1.4.2 et 1.4.5).
13.2 Recommandations pour l’examen des données historiques effectué par la mine
Afin de déterminer la pertinence des études historiques de suivi biologique, la mine devrait procéder à un examen de l’information ou données historiques recueillies pour une autre agence de réglementation. Le groupe de travail AQUAMIN (1994) a donné une orientation permettant d’évaluer la pertinence des études effectuées dans le passé et une de ses principales préoccupations était que les méthodes utilisées devraient être des protocoles validés dans les ouvrages scientifiques révisés par les pairs ou, à tout le moins, être défendables sur le plan scientifique. Le chapitre 12, portant sur la recherche des causes, fournit une orientation mise à jour sur les bonnes pratiques scientifiques et les principes de science éprouvés. De plus, afin de déterminer la pertinence d’une étude menée dans le passé au programme d'études de suivi des effets sur l'environnement des mines de métaux, la mine devrait faire référence aux chapitres appropriés du présent guide technique (p. ex., plan d’étude, étude des populations de poissons, étude des tissus de poissons, étude de la communauté d’invertébrés benthiques, analyse de données).
13.3 Recommandations sur le rapport de données historiques
Outre des détails sur la façon dont les résultats des études historiques de suivi biologique ont été utilisés pour déterminer si l’effluent avait un effet sur les populations de poissons, les tissus de poissons ou la communauté d’invertébrés benthiques, le rapport devrait considérer l’information suivante :
- information sur le plan d’étude, caractérisation du site, description des stations et zones d’échantillonnage;
- facteurs potentiellement confusionnels ou influenceurs à considérer;
- descripteurs des communautés biologiques;
- méthodes utilisées sur le terrain et en laboratoire;
- variables environnementales mesurées;
- évaluation et interprétation des données;
- procédures d’assurance de la qualité et de contrôle de la qualité;
- changements aux conditions d’exploitation de la mine subséquents aux études historiques (p. ex., charges de substances délétères), emplacement des structures affectant potentiellement le milieu aquatique (p. ex., emplacement des barrages, ponts, points de rejet) ou tout autre événement ayant le potentiel de modifier les effets de l’effluent sur le poisson, les tissus de poissons ou la communauté d’invertébrés benthiques. Quelques exemples de ce genre d’événements sont: changement du minerai transformé, changement dans les protocoles de transformation du minerai ou le traitement de l’effluent, changement dans les facteurs hydrologiques, présence de nouveaux facteurs de confusion.
- résumé des données de suivi biologique provenant de l’écorégion retrouvées dans la littérature, des rapports gouvernementaux et des rapports provenant d’autres mines ou industries en tant qu’information additionnelle.
Pour obtenir plus de renseignements sur les points énumérés ci-dessus, veuillez consulter les chapitres pertinents du présent guide technique.
13.4 Références
AQUAMIN – Évaluation des effets de l’exploitation minière sur le milieu aquatique au Canada, 1994, Critères pour évaluer l’information, Document de travail préparé pour le Groupe directeur AQUAMIN par le Groupe de travail 1 d’AQUAMIN.
Retournez à la table des matières
- Date de modification :