Guide technique pour l'étude de suivi des effets sur l’environnement des mines de métaux
Chapitre 9
9. Autres méthodes de suivi
9.2 Utilisation de mésocosmes comme autre méthode de suivi biologique
- 9.2.1 Renseignements généraux sur l’aménagement de systèmes de bassins artificiels et sur leur utilisation
- 9.2.2 Applicabilité dans le cadre du Programme d’ESEE
- 9.2.3 Technologie des mésocosmes
- 9.2.4 Facteurs à considérer pour le choix du site
- 9.2.5 Plans d’études de suivi biologique
- 9.2.6 Évaluation des effets sur les poissons
- 9.2.7 Évaluation des effets sur la communauté d’invertébrés benthiques
- 9.2.8 Mesures complémentaires
9.3 Utilisation de bivalves en cage comme méthode de suivi de rechange
- 9.3.1 Introduction
- 9.3.2 Contexte
- 9.3.3 Approche
- 9.3.4 Choix de l’espèce
- 9.3.5 Plan d’étude
- 9.3.6 Configuration des cages
- 9.3.7 Méthodes pour débuter l’essai, déployer et récupérer les cages et terminer l’essai
- 9.3.8 Indicateurs d’effets
- 9.3.9 Assurance de la qualité et contrôle de la qualité
- 9.3.10 Analyses des données
- 9.3.11 Mercure
- 9.3.12 Rapports
Liste des tableaux
Tableau 9-4 : Taxons suggérés pour les études de bivalves en cage menées dans le cadre des ESEE
Tableau 9-6 : Différences observées entre les unionidés et les sphaeriidés
Liste des figures
Figure 9-3 : Représentation schématique (non à l’échelle) du système de mésocosmes sur remorque
Figure 9-4 : Photographie de l’installation d’un mésocosme modulaire
Figure 9-5 : Schéma de circulation du mésocosme modulaire
Figure 9-7 : Installation sur le terrain de mésocosmes modulaires
Figure 9-10 : Moule avec lobe du manteau à maturité.
Figure 9-12 : Impressions musculaires dans une coquille de Mytilus spp.
Figure 9-13 : Cadre utilisé pour les essais d’exposition des bivalves
Figure 9-14 : Éléments du système modulaire de mésocosmes
Figure 9-15 : Schéma d’assemblage du système modulaire de mésocosmes
9.1 Aperçu
Dans certains sites miniers, il peut arriver qu’on ne puisse procéder aux études de suivi standard sur les poissons et les communautés d’invertébrés benthiques. Et bien que les raisons de cette impossibilité varient en fonction de chaque site, les plus fréquentes sont la présence de conditions dangereuses (p. ex., débit élevé), un habitat inapproprié pour l’échantillonnage, la présence de facteurs de confusion, tel le rejet d’autres effluents dans la zone d’exposition, faisant en sorte qu’il est difficile, voire impossible, d’attribuer un effet précis à l’effluent à l’étude.
Lorsque la mine ne peut concevoir une étude sur les poissons ou les communautés d’invertébrés benthiques de façon à éliminer les problèmes dus aux facteurs de confusion présents dans le milieu, elle fournira les raisons scientifiques et proposera d’autres méthodes de suivi efficientes, techniquement réalisables et conformes au plan de l’étude. Le présent chapitre traite d’un certain nombre de méthodes de suivi de remplacement recommandées.
D’autres méthodes scientifiquement défendables peuvent aussi être choisies, à la condition qu’elles produisent des résultats qui permettent de déterminer si l’effluent a une incidence sur les populations de poissons (croissance, reproduction, condition et survie), les tissus des poissons (mercure) ou la communauté d’invertébrés benthiques (densité des invertébrés benthiques, richesse des taxons, indice de régularité de Simpson et indice de Bray-Curtis). Les études en mésocosmes (systèmes de bassins artificiels, aussi appelés cours d’eau artificiels) ou sur les bivalves en cage sont les méthodes recommandées pour remplacer les études sur les poissons. Dans le cas des invertébrés benthiques, l’étude en mésocosmes est la méthode recommandée.
Il peut exister d’autres méthodes scientifiquement défendables pour les études du poisson et du benthos effectuées sur le terrain. Les mines peuvent proposer dans leur plan d’étude d’autres méthodes. Les nouvelles méthodes de remplacement seront évaluées par l’agent d’autorisation, avec l’appui du Comité aviseur technique et du Comité scientifique des études de suivi des effluents sur l’environnement (ESEE). Pour évaluer la méthode de remplacement suggérée, certains éléments particuliers à sa conception seront considérés comme essentiels afin d’atteindre l’objectif du programme, notamment, qu’elle soit pertinente sur le plan environnemental, que les résultats soient interprétables et qu’elle soit scientifiquement défendable et réalisable.
La section 9.2 vise à définir des critères devant guider la conception et la mise en œuvre des études en mésocosmes (système de bassins artificiels) proposées comme méthodes de remplacement dans le cadre du Programme d’ESEE pour évaluer les effets des effluents des mines de métaux sur les invertébrés benthiques et le poisson. Le présent guide a pour objet de préciser les normes recommandées pour assurer une démarche scientifique rigoureuse et ainsi satisfaire aux exigences du Programme d’ESEE. En 2002, le premier guide technique portant sur l’utilisation de systèmes de bassins artificiels, ou mésocosmes, a été publié. Ce guide a été mis à jour en 2011 pour tenir compte des résultats des travaux de recherche et de développement en cours, en vue d’améliorer cette méthode d’ESEE.
La section 9.3 contient des instructions techniques pour la conduite d’expériences contrôlées à l'aide de bivalves en cage, en suspension dans la colonne d’eau, afin de vérifier la présence d’effets associés aux rejets industriels par une comparaison des mesures relevées dans une zone exposée avec celles prises dans des zones de référence. Cette approche constitue une solution de remplacement aux études de poissons et doit être envisagée par les mines lorsque les études de poissons se sont révélées infructueuses ou peu pratiques au cours des dernières phases d’ESEE, ou lorsqu’il y a des problèmes méthodologiques (p. ex., facteurs de confusion) ou des préoccupations liées à la sécurité.
9.2.1 Renseignements généraux sur l’aménagement de systèmes de bassins artificiels et sur leur utilisation
La recommandation de recourir à des systèmes de bassins artificiels comme cours d’eau artificiels dans une méthode de suivi de remplacement s’appuie sur des années de recherche et de développement qui ont démontré que ces mésocosmes peuvent produire des données sur les effets des effluents qui sont de bonne qualité et qui répondent au cadre réglementaire (tableau 9-1). Depuis 1991, des systèmes de bassins artificiels ont été utilisés sur place pour évaluer les effets d’effluents de sources ponctuelles sur les écosystèmes aquatiques. Au Canada, de telles études en mésocosme ont été menées 14 fois en huit ans, de 1993 à 2008, en vertu du Programme d’ESEE (tableau 9-1). Toutes ces études et tous ces travaux de mise au point de la méthode de remplacement ont été conduits en collaboration par les secteurs privé et public, les universités et les experts-conseils. Le financement de la recherche a été obtenu par le biais de mécanismes indépendants du Programme d’ESEE. Les diverses utilisations de la méthode sont présentées en détail ci-après afin de montrer les progrès accomplis à ce jour. Le tableau 9-1 résume ces études et énumère les sources de référence appropriées qui devraient être consultées si le recours à ces types d’études et de protocoles expérimentaux est envisagé.
Étude des bassins des rivières du Nord (EBRN) en Alberta, 1991-1996
Une des premières utilisations du système de mésocosmes a servi à évaluer les effets des effluents de fabriques de pâtes et papiers (EFPP) sur les communautés d’invertébrés benthiques et d’algues périphytiques de la rivière Athabasca (tableau 9-1) (Culp et Podemski, 1996; Culp et al., 1996; Podemski et Culp, 1996; Podemski, 1999; Culp et al., 2001). Des systèmes de bassins artificiels ont été utilisés pour distinguer les effets des nutriants des EFPP de ceux des contaminants, en s’appuyant sur les différences observées dans les réactions biologiques. En effet, un apport modéré de nutriants stimulerait la productivité primaire et secondaire, tandis que des contaminants entraîneraient une réduction de la croissance et de la reproduction et conduiraient ultimement à la mort des organismes (Culp et Podemski, 1996; Podemski et Culp, 1996; Culp et Lowell, 1998; Culp et al., 2001). Pour atteindre cet objectif, trois traitements ont été mis à l’essai au printemps 1993 : eau de la rivière Athabasca (témoin); EFPP traités à 1 % (v/v); nutriants à 1 % (v/v) (azote + phosphore) aux concentrations mesurées dans les EFPP. L’hypothèse émise était qu’une exposition aux EFPP et aux nutriants se traduirait par un effet d’enrichissement dans le réseau trophique benthique, et qu’il n’y aurait pas de différence entre les effets des deux traitements. Ceci porterait à conclure que les effets des EFPP aux concentrations mesurées dans la rivière Athabasca sont dus à un apport en nutriants plutôt qu’à la toxicité des contaminants.
Un grand système non mobile de mésocosmes a été utilisé près de la fabrique de pâte à papier de Hinton (Alberta). Ce système consistait en 16 bassins circulaires de 0,9 m2 disposés sur des tables (modèle I, figure 9-1A). De l’eau de rivière était pompée dans chacun de ces bassins à un débit contrôlé, et les effluents et nutriants étaient ajoutés selon le protocole décrit par Culp et Podemski (1996) et par Podemski (1999). Une communauté benthique normalisée, endémique de la rivière Athabasca, a été ensemencée dans chaque bassin et exposée aux EFPP pendant 28 jours. À la fin de la période d’exposition, une augmentation de la biomasse des algues, de la croissance des nymphes d’éphémères (Ephemeroptera : Siphloneuridae, Baetidae) et de plécoptères (Plecoptera : Capniidae) et de l’abondance des insectes dans les bassins expérimentaux par rapport au traitement de référence a été constatée (Culp et Podemski, 1996; Podemski et Culp, 1996; Culp et al., 1996). En outre, il n’y avait pas de différence entre les effets du traitement à 1 % d’EFPP et celui à 1 % de nutriants, ce qui corroborait l’hypothèse selon laquelle les effets des EFPP sur le réseau trophique benthique sont dus à un enrichissement en nutriants.
Plan d’action du Fraser (PAF), en Colombie-Britannique, 1991-1998
Le PAF a été mis en œuvre entre 1991 et 1997 afin d’évaluer la santé de l’écosystème du bassin du fleuve Fraser et, notamment, de mesurer les incidences de huit effluents de fabriques de pâtes et papiers (Gray et Tuominen, 1998; McGreer et Belzer, 1998).
Rivière Thompson, Kamloops (Colombie-Britannique), 1993-1994
La rivière Thompson affichait des signes d’enrichissement en nutriants dus à des rejets d’EFPP à Kamloops. Ce problème faisait l’objet d’études depuis le début des années 1970, époque au cours de laquelle des accumulations anormales d’algues périphytiques avaient été observées dans la rivière, en aval de la fabrique de pâte (Federal-Provincial Thompson River Task Force, 1976). Bothwell et Daley (1981), Bothwell (1985), Bothwell et al. (1992) et Bothwell et Culp (1993) ont montré comment le phosphore biodisponible présent dans les EFPP stimule la croissance des algues périphytiques.
Des circuits de circulation d’eau ont été utilisés pour distinguer les effets des nutriants des EFPP de ceux des contaminants sur les algues et les invertébrés benthiques (tableau 9-1). La méthode employée était différente de celle retenue pour l’EBRN, puisqu’elle s’est appuyée sur une relation dose-effet et sur l’hypothèse qu’on observerait les effets des nutriants aux faibles concentrations d’effluents et les effets des contaminants aux concentrations d’effluents plus élevées. En 1993 et 1994, des algues périphytiques et des chironomidés ont été exposés à une série de dilutions d’EFPP (0,25 à 10 %, v/v) (Dubé et Culp, 1996; Culp et Lowell, 1998). Des systèmes de bassins artificiels plus petits ont servi à tester les effets des EFPP sur des espèces particulières d’insectes (Lowell et al., 1995, 1996) et sur des réseaux trophiques benthiques simplifiés (Dubé et Culp, 1996). L’approche fondée sur une espèce unique mettait l’accent sur les effets observés sur des taxons sentinelles clés et visait à améliorer la connaissance des réactions propres à des espèces particulières (Culp et al., 2000b).
Le système de bassins artificiels a été aménagé sur les rives de la rivière Thompson, à Kamloops, tout juste en amont du point de rejet de l’effluent. Il était constitué d’un système d’approvisionnement en eau, de réservoirs de traitement pour la préparation des diverses dilutions d’effluent avec apport continu d’eau de rivière, et de petits bassins circulaires de 0,33 L (superficie de 45 cm2) (Dubé, 1995; Lowell et al., 1995) (figure 9-2A). Des algues et des larves de chironomidés (Diptères : Orthocladiinae) prélevées dans une zone de référence ont été placées dans les bassins, et les variations de la biomasse de ces deux organismes ont été mesurées après deux à trois semaines d’exposition à l’effluent (Dubé et Culp, 1996). Dubé et Culp (1996) ont observé une augmentation de la biomasse algale (chlorophylle a) due à l’enrichissement en nutriants à toutes les concentrations d’effluent. La biomasse totale des chironomidés et les poids individuels ont également augmenté aux faibles concentrations d’effluent (< 5 %). Les concentrations plus élevées (5 % et 10 %) ont entraîné une réduction de la biomasse des chironomidés qui était peut-être due aux effets des contaminants.
| Année | Pro- gramme1 | Type d’effluent2 | Objectif de la recherche | Lieu | Système de bassins artificiels | Références |
|---|---|---|---|---|---|---|
| 1993-1994 | EBRN | EFPP | Déterminer les effets des nutriants et des contaminants contenus dans les EFPP sur les algues périphytiques et les communautés d’invertébrés benthiques. | Rivière Athabasca, Hinton (Alberta) | Modèle I : Grand système fixe de mésocosmes Benthos. Étude sur le terrain. | Podemski (1999) Culp et Podemski (1996) Podemski et Culp (1996) Culp et al. (1996) Culp et al. (2001) |
| 1993-1994 | PAF | EFPP | Évaluer les effets des EFPP de plus en plus concentrés (0,25 %-10 %) sur le périphyton et les chironomidés (Diptères : Orthocladiinae). | Rivière Thompson, Kamloops (C.‑B.) | Petit système de microcosmes. Benthos. Étude sur le terrain. | Dubé (1995) Dubé et Culp (1996) Dubé et al. (1997) Lowell et al. (2000) |
| 1993 | PAF | EFPP | Déterminer les effets liés à la teneur en nutriants des EFPP sur l’éphéméroptère Baetis tricaudatus. | Rivière Thompson, Kamloops (C.‑B.) | Petit système de microcosmes. Benthos. Étude sur le terrain. | Lowell et al. (1995) Lowell et al. (1996) Culp et al. (1996) Lowell et al. (2000) |
| 1994 | PAF | EFPP | Déterminer les effets des EFPP (1 % et 3 %) sur le périphyton et les communautés d’invertébrés benthiques. | Fleuve Fraser, Prince George (C.-B.) | Modèle II : Grand système mobile de mésocosmes. Benthos. Étude sur le terrain. | Culp et Cash (1995) Culp et al. (1996) Culp et al. (2000a) |
| 1997 | ESEE – pâtes et papiers | EFPP | Évaluer les effets des EFPP (3 %) sur un poisson de petite taille, le Choquemort (Fundulus heteroclitus), en milieu marin. | Port de Saint John, Saint John (N.-B.) | Modèle II : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Cash et al. (2003) |
| 1997-1998 | ESEE – pâtes et papiers | EFPP | Déterminer les effets de l’EFPP final, des différents circuits d’eaux de procédé en usine et d’une modification des procédés sur un poisson de petite taille, le Choquemort, en milieu estuarien. | Fleuve Saint-Jean, Saint John (N.-B.) | Modèle II : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Dubé (2000) Dubé et MacLatchy (2000a) Cash et al., (2003) |
| 1999 | IRST | EFPP | Déterminer les effets des EFPP soumis à des traitements primaire et secondaire sur un poisson de petite taille, le Choquemort, en milieu estuarien. | Rivière Miramichi, Miramichi (N.‑B.) | Modèle III : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Dubé et al. (2002) |
| 2000 | IRST | EMM | Déterminer les effets des EMM (20 %, 80 %) sur les Saumons atlantiques juvéniles (Salmo salar). | Rivière Little, Mines Brunswick, Miramichi (N.‑B.) | Modèle III : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Dubé et al. (2005) |
| 2001 | IRST | EFPP EEM | Évaluer les impacts individuels et combinés des EEM et des EFPP sur le Naseux des rapides (Rhinichthys cataractae). | Rivière Wapiti (Alberta) | Modèle III : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Dubé et al. (2004) |
| 2001 | IRST | EFPP EEM | Évaluer les impacts individuels et combinés des EEM et des EFPP sur le réseau trophique benthique. | Rivière Wapiti, Grande Prairie (Alberta) | Modèle III : Grand système mobile de mésocosmes. Benthos. Étude sur le terrain. | Culp et al. (2004) |
| 2001-2002 | Industrie | EMM | Évaluer les effets des EMM traités provenant de trois mines et déversés dans le ruisseau Junction, à Sudbury, sur le Mulet à cornes (Semotilus atromaculatus) et le Mulet perlé (Margariscus margarita). | Ruisseau Junction, Sudbury (Ontario) | Modèle III : Grand système mobile de mésocosmes. Poisson. Étude sur le terrain. | Dubé et al. (2006) |
| 2002 | Industrie | EMM | Évaluer les effets d’un EMM (45 %) sur le cycle vital partiel du chironomidé Chironomus tentans. | Ruisseau Junction, Sudbury (Ontario) | Système modulaire de mésocosmes. Benthos. Étude sur le terrain. | Hruska et Dubé (2004) |
| 2003 | CRSNG | EMM | Comparer les résultats d’un bioessai sur le cycle vital partiel effectué en cours d’eau artificiels à ceux d’un bioessai normalisé effectué en laboratoire, afin d’évaluer les effets d’un EMM (45 %) sur le chironomidé C. tentans. | Ruisseau Junction, Sudbury (Ontario) | Système modulaire de mésocosmes. Benthos. Étude en laboratoire. | Hruska et Dubé (2005) |
| 2003 | CRSNG/ industrie | EFPP | Déterminer les effets d’un EFPP final (1 %, 100 %) et de divers circuits d’eaux de procédé sur le cycle vital partiel du Méné à grosse tête (Pimephales promelas) en conditions environnementales réalistes (c.-à-d. qualité de l’eau ambiante et de l’effluent). | Terrace Bay (Ontario) | Bioessai sur remorque. Poisson. Étude sur le terrain. | Rickwood et al. (2006a; 2006b) |
| 2004 | CRSNG/ industrie | EMM | Élaborer un bioessai multitrophique auto-entretenu afin d’évaluer comparativement les effets d’une exposition aux EMM (45%) par le biais de l’eau (Méné à grosse tête seulement) et par transfert trophique (C. tentans et Méné à grosse tête) sur la reproduction du Méné à grosse tête (cycle vital partiel) | Ruisseau Junction, Sudbury (Ontario) | Système modulaire de mésocosmes. Multi-trophique. Étude en laboratoire. | Rickwood et al. (2006c) |
| 2005 | CRSNG/ industrie | EMM | Élaborer un bioessai multitrophique auto-entretenu afin d’évaluer comparativement les effets d’une exposition aux EMM (45%) par le biais de l’eau (Méné à grosse tête seulement) et par transfert trophique (C. tentans et Méné à grosse tête) sur la reproduction du Méné à grosse tête (cycle vital partiel) | Ruisseau Junction, Sudbury (Ontario) | Système modulaire de mésocosmes. Multi-trophique. Étude sur le terrain. | Rickwood et al. (2008) |
| 2006 | CRSNG/ industrie | EFPP | Évaluer les effets des EFPP (20 %, 40 %, 60 %) sur le Méné à grosse tête (cycle vital partiel). | Rivière Wabigoon, Dryden (Ontario) | Système modulaire de mésocosmes. Poisson. Étude sur le terrain. | Pollock et al. (2009) |
| 2007 | CRSNG/ industrie | EMM et métal (agent causal possible) | Évaluer comparativement les systèmes de réponses du Méné à grosse tête (cycle vital partiel) à un mélange d’EMM (100 %, 25 %, 5 %) et à du sélénium (sous forme de séléniate) à l’aide d’une méthode de bioessai à mésocosmes multitrophique. | Lac Unknown, Key Lake (Saskat- chewan) | Système modulaire de mésocosmes. Poisson. Étude en laboratoire. | Pollock et al. (inédit) |
| 2008 | CRSNG/ industrie | EMM | Évaluer comparativement les voies d’exposition du Méné à grosse tête (cycle vital partiel) à l’effluent (rejet actuel; 25 %) et aux sédiments (contamination historique). | Lac Unknown, Key Lake (Saskat- chewan) | Système modulaire de mésocosmes. Poisson. Étude sur le terrain. | Driessnack, Dubé et al. (inédit) |
| 2008 | CRSNG/ industrie | EMM | Évaluer les effets de trois types de rejets d’EMM sur le Méné à grosse tête (cycle vital partiel). | Ruisseau Junction, Sudbury (Ontario) | Système modulaire de mésocosmes. Multi-trophique. Étude sur le terrain. | Ramilo, Dubé et al. (inédit) |
1 EBRN : Étude des bassins des rivières du Nord; PAF : Plan d’action du Fraser; ESEE : Études de suivi des effets sur l’environnement; IRST : Initiative de recherche sur les substances toxiques, CRSNG : Conseil de recherches en sciences naturelles et en génie du Canada.
2 EFPP : Effluent des fabriques de pâtes et papiers. EEM : Effluent d’égout municipal. EMM : Effluent des mines de métaux.
En 1993, Lowell et al. (1995; 1996) ont procédé à des essais en systèmes de bassins artificiels à échelle réduite sur la rivière Thompson, parallèlement à ceux de Dubé et Culp (1996). Ils ont utilisé l’éphémère Baetis tricaudatus pour mesurer les effets des EFPP (1 % et 10 %, v/v) sur la survie, la croissance, la mue et le développement morphologique sous deux régimes d’alimentation distincts (faible et élevé). Ainsi, l’exposition aux effluents a sensiblement stimulé la croissance et le développement des insectes, entraînant des augmentations de 20 à 50 % du poids corporel sec par rapport aux témoins. Bien que la fréquence des mues ait affiché une hausse chez les insectes exposés à une concentration faible (1 %); elle a diminué chez ceux exposés à une concentration plus élevée (10 %), laissant ainsi deviner l’intervention d’un mécanisme d’action des contaminants (Lowell et al., 1996). Les résultats de ces expériences en systèmes de bassins artificiels utilisant des éphémères en guise d’espèces sentinelles concordent avec ceux des essais réalisés par Dubé et Culp (1996) avec des chironomidés, qui montraient un effet d’enrichissement aux concentrations d’EFPP plus faibles et l’apparition d’effets inhibiteurs aux concentrations plus élevées.
En plus de concorder entre eux, les résultats des essais effectués en systèmes de bassins artificiels s’accordent également avec ceux des études sur le terrain (Culp et Lowell, 1998). L’analyse des tendances à long terme a montré que plusieurs familles de plécoptères, de tricoptères et d’éphémères étaient plus abondantes durant les années où les rejets de matières en suspension et de phosphore des fabriques de pâtes étaient les plus élevés (Lowell et al., 1996, 2000). Par ailleurs, une surveillance effectuée sur le terrain par Dubé et al. (1997) a également montré que les tendances temporelles et spatiales du phosphore, de la biomasse du périphyton et de la biomasse des chironomidés (Diptères : Orthocladiinae) dans la colonne d’eau étaient stables dans les conditions normales de fonctionnement des fabriques. Les effets des effluents de la fabrique sur le réseau trophique benthique de la rivière Thompson se limitaient donc à un enrichissement en nutriants. Toutefois, Dubé (1995) a également observé que les effets toxiques des contaminants rejetés par la fabrique avaient réduit la densité des chironomidés dans la rivière Thompson dans des zones peu exposées à l’effluent (zones éloignées) en aval du point de rejet lorsque le système de traitement de l’effluent secondaire de la fabrique a cessé de fonctionner en 1992.
Fleuve Fraser, Prince George (Colombie-Britannique), 1994
Des études des effets des effluents des fabriques de pâtes et papiers sur les réseaux trophiques benthiques à l’aide de systèmes de bassins artificiels ont également été réalisées à Prince George (Colombie-Britannique), sur une portion de 100 km du fleuve Fraser recevant les effluents de quatre fabriques de pâte (Culp et Lowell, 1998). En 1994, des communautés benthiques ont été exposées à des concentrations d’EFPP de 1 % et de 3 % (v/v) pendant 35 jours afin de déterminer si les faibles concentrations d’EFPP provoquaient un enrichissement en nutriants et si des concentrations plus élevées entraînaient des effets toxiques (tableau 9-1) (Culp et Cash, 1995; Culp et al., 2000a). Cette étude a porté sur un plus grand nombre de variables, dont le nombre de bactéries, la biomasse du périphyton, l’accumulation et la composition des contaminants cibles d’EFPP et la structure de la communauté d’invertébrés benthiques. Par ailleurs, outre les réactions propres aux espèces, les réactions propres aux communautés ont également été mesurées afin d’accroître la pertinence écologique de l’étude (Culp et al., 2000b).
De plus, le système de grands bassins artificiels a été modifié pour en accroître la souplesse, la mobilité et la rentabilité. Les bassins et les tables ont été montés sur deux remorques à plate-forme (Culp et al., 1996) (modèle II, figure 9-1B). Chaque remorque a par ailleurs été équipée d’un laboratoire pour les réservoirs d’effluent et d’eau, d’un espace d’entreposage des pompes et d’un espace pour le traitement des échantillons. La conception et l'exploitation des bassins artificiels, y compris l’ensemencement d’organismes benthiques, les débits et les protocoles d’échantillonnage, étaient celles décrites antérieurement par Culp et Cash (1995), Culp et Lowell (1998) et Culp et al., (2000a).
En outre, les résultats des études effectuées sur le fleuve Fraser sont venus corroborer ceux obtenus lors des études sur la rivière Thompson et les bassins des rivières du Nord (EBRN), démontrant que les effets des EFPP sur les réseaux trophiques benthiques étaient causés par l’enrichissement en nutriants. Pour leur part, Culp et al., (2000a) ont signalé que le nombre de bactéries, la biomasse du périphyton et la biomasse des taxons d’insectes dominants (chironomidés et plécoptères) augmentaient avec la durée d’exposition à l’effluent. Il convient cependant de noter que malgré l’observation d’un rapport dose-effet pour les contaminants des fabriques de pâte (p. ex., acides résiniques et composés phénoliques chlorés) mesurés dans le périphyton, ces accumulations dans les tissus ne se traduisaient pas par un ralentissement de la croissance des algues, ni par un changement de la variété des espèces. Enfin, les résultats concordaient également avec ceux des études réalisées sur le terrain et en laboratoire, ajoutant ainsi un poids à la preuve ayant trait aux effets des EFPP sur la structure des réactions des organismes benthiques dans le fleuve Fraser (Culp et al., 2000a).
Projets pilotes d’ESEE pour le secteur industriel au Nouveau-Brunswick, 1997-1998
Les travaux effectués dans le cadre de l’EBRN et du PAF ont montré l’utilité des systèmes de bassins artificiels pour l’évaluation des effets des EFPP sur les bactéries, le périphyton et les communautés d’invertébrés benthiques. Ces systèmes permettent de mesurer les réactions de biotes endémiques à des concentrations connues d’effluents dans des conditions ambiantes de lumière, de température et de qualité de l’eau qui correspondent aux conditions naturelles (Culp et al., 1996). Ces caractéristiques font également des systèmes de bassins artificiels une solution de rechange utile pour l’évaluation des effets des EFPP sur les poissons (Courtenay et al., 1998; Parker et Smith, 1997). Trois projets pilotes d’ESEE pour le secteur industriel ont été réalisés dans des milieux marins et estuariens en 1997 et en 1998, afin de développer des systèmes de bassins artificiels capables d’évaluer les effets des EFPP sur les poissons.
Port de Saint John, Saint John (Nouveau-Brunswick), 1997
Le premier projet pilote a été réalisé dans le port de Saint John (Nouveau-Brunswick) à l’aide d’un grand système mobile de mésocosmes (modèle II, figure 9-1B) afin d’évaluer les effets de l’effluent d’une fabrique de pâte thermomécanique soumis à un traitement secondaire sur un cyprinodontidé d’eau salée : le Choquemort (Fundulus heteroclitus) (tableau 9-1) (Cash et al., 2003; Dubé et al., 2002). La fabrique rejetait son effluent dans un milieu marin complexe, caractérisé par des marées extrêmes, une contamination historique des sédiments et la présence d’autres effluents (p. ex., eaux d’égout traitées et non traitées, eaux pluviales, l’effluent d’une autre fabrique de pâte et l’effluent d’une raffinerie de pétrole).
Le système de bassins artificiels était installé sur la rive, à l’extrémité d’une digue. De l’eau réceptrice, non exposée à l’EFPP, était pompée dans chaque bassin à chaque échange de marée comme l’ont décrit Cash et al. (2003) et Dubé et al, (2002). Deux traitements ont été testés : eau réceptrice témoin et eau à concentration d’effluent de 3 % (v/v). La concentration d’effluent à 3 % représentait celle observée sur la plus vaste étendue spatiale de la masse d’eau réceptrice déterminée par les études de délimitation du panache. L’effluent a par la suite été injecté pendant 28 jours dans chaque bassin à concentration de 3 % en même temps que les échanges d’eaux réceptrices, simulant ainsi les conditions d’exposition de l’espèce sentinelle, le Choquemort, qui vit dans les cuvettes de marée pendant la marée descendante ainsi qu’à marée basse (Kneib, 1986). Des poissons juvéniles (120 juvéniles par traitement) et des poissons adultes (60 adultes par sexe et par traitement) ont été répartis entre le groupe témoin et le groupe d’essai (à 3 % d’effluent) et nourris quotidiennement d’artemias congelées, et ce, à raison de 3 % de la biomasse totale du mésocosme. Le Choquemort a été choisi comme espèce sentinelle, parce que c’est une espèce bien connue, endémique au port de Saint John, d’une taille propice pour les circuits d’eau et sexuellement dimorphe (ce qui élimine le problème du contrôle du rapport des sexes) (Kneib et Stiven, 1978; Atz, 1986; Scott et Scott, 1988). Par ailleurs, les taux de croissance des juvéniles sont suffisamment élevés pour permettre la détection des effets liés aux effluents pour la durée de la période d’exposition aux températures expérimentales ambiantes (Kneib et Stiven, 1978). Les critères incluaient les critères d’effets étudiés dans le Programme d’ESEE sur les poissons sauvages (p. ex., croissance, taille des gonades et du foie, coefficient de condition) ainsi que des critères physiologiques d’appui (induction de l’oxygénase à fonction mixte [OFM], concentrations d’hormones sexuelles) (Cash et al., 2003; Dubé et al., 2002).
Cette étude a fourni de l’information sur les effets des EFPP sur une espèce de poisson endémique. Les taux de survie mesurés étaient proches de 100 % dans tous les groupes de traitement, et l’exposition à l’effluent n’a pas influé sur la croissance, ni sur l’activité de l’OFM (Cash et al., 2003). Toutefois, l’exposition à l’effluent a réduit significativement la taille des gonades et du foie chez les mâles et augmenté la production de certains stéroïdes sexuels chez les deux sexes.
Fleuve Saint-Jean, Saint John (Nouveau-Brunswick), 1997-1998
En 1997 et 1998, Dubé (2000) a utilisé des systèmes de bassins artificiels pour mesurer les effets d’un EFPP sur le Choquemort dans le fleuve Saint-Jean et évaluer les effets d’un changement apporté au processus de l’usine sur la qualité de l’effluent final (tableau 9-1). Il a utilisé, à cette fin, le grand système de mésocosmes (modèle II, figure 9-1B) et l’espèce sentinelle, tous deux retenus pour l’expérience précédente. Ainsi, cette étude se distinguait par la portée des hypothèses testées, le type de processus examiné (pâte kraft blanchie) et le type de milieu récepteur (estuaire).
En 1997, avant la modification du processus de la fabrique, des Choquemorts adultes ont été exposés à l’effluent final (1 %, v/v) pendant 27 jours (Dubé et MacLatchy, 2000a). En 1998, après la modification du processus, des Choquemorts juvéniles et adultes ont été exposés à trois concentrations d’EFPP (0,5 %, 1,0 % ou 5,0 %, v/v) pendant 30 jours et 60 jours. Le grand système de bassins artificiels était installé au bord du fleuve Saint-Jean, à l’extérieur de la zone d’effet de l’effluent. L’eau de référence était pompée en continu dans chaque bassin pour simuler les conditions d’exposition particulières au site. Les variables à l’étude incluaient la croissance des juvéniles, la taille des organes des adultes (foie, gonades), la condition, l’induction de l’OFM et les concentrations d’hormones reproductives.
Dans les deux études, les taux de survie sont restés supérieurs à 95 %, et la biomasse des poissons de tous les groupes de traitement a augmenté pendant toute la durée de la période d’exposition, laissant conclure à un taux d’alimentation adéquat (Dubé, 2000). L’exposition à une concentration d’effluent final de 1 % est restée sans effet sur la taille des organes des adultes (gonades et foie) dans les deux études. Toutefois, pour illustrer la réaction observée des Choquemorts à l’EFPP et pour corroborer la conclusion selon laquelle les poissons adultes restaient largement insensibles à une exposition à des concentrations équivalentes à celles prévalant dans l’effluent de cette fabrique, Dubé (2000) a utilisé en 1998 un plan d’étude basé sur la relation dose-effet. L’exposition à une concentration de 5 % d’EFPP pendant 60 jours a provoqué une augmentation significative de la taille du foie chez les deux sexes et une réduction significative de la longueur et du poids des poissons juvéniles (Cash et al., 2003; Dubé et al., 2002).
Le système de mésocosmes a également servi dans cette étude à évaluer les effets d’une modification du procédé de l’usine sur la qualité de l’effluent final (Dubé et MacLatchy, 2000a, Dubé et al., 2002). Aucun changement de la taille du foie et des gonades ou de la condition des Choquemorts adultes n’a été observé entre 1997 et 1998. Cependant, les tendances des concentrations d’hormones sexuelles ont varié d’une année à l’autre, laissant constater des diminutions significatives de la teneur en testostérone du plasma chez les deux sexes en 1997, mais pas en 1998. Des études ultérieures utilisant des essais de toxicité (Dubé et MacLatchy, 2000b) et l’exposition de Choquemorts en laboratoire à des EFPP (Dubé et MacLatchy, 2001) en appliquant la méthode du poids de la preuve ont confirmé que le changement de procédé avait éliminé la toxicité aiguë de l’effluent final et réduit la toxicité subaiguë de manière significative, y compris les effets sur les fonctions reproductrices d’une espèce locale de poisson.
Initiative de recherche sur les substances toxiques (IRST), 1999-2001
Durant cette période, quatre principaux domaines se sont développés dans les systèmes de bassins artificiels, dont le perfectionnement et l’optimisation du concept technologique; l’utilisation avec d’autres types d’effluents (mines de métaux); l’utilisation avec d’autres espèces de poissons; et l’utilisation dans le cadre de programmes d’évaluation biologique des effets cumulatifs d’effluents multiples (tableau 9-1).
Rivière Miramichi, Miramichi (Nouveau-Brunswick), 1999
Cette étude a servi à évaluer les effets d’effluents primaires et secondaires d’usines de pâte kraft blanchie (1 %, v/v) sur le Choquemort après 23 jours d’exposition à l’aide d’un grand système modifié de bassins artificiels (tableau 9-1) (Dubé et al., 2002). Le système consistait en 16 bassins circulaires (0,42 m2) montés sur une seule remorque pour faciliter les déplacements (modèle III, figure 9-1C). Une meilleure maîtrise de la dilution de l’effluent et des taux d’oxygène dissous a également été obtenue en modifiant la tuyauterie et en ajoutant un système d’aspiration pneumatique (Cash et al., 2003). AMEC Earth & Environmental Ltd. (anciennement Washburn & Gillis Associates Ltd.) a construit ce système et en est actuellement le propriétaire.
Le taux de survie des adultes était élevé dans tous les groupes de traitement (> 90 %), et les effluents n’ont pas eu d’effet sur la longueur, le poids, la condition, l’indice hépatosomatique (IHS) et l’indice gonadosomatique (IGS) après 23 jours d’exposition. Toutefois, les Choquemorts des deux sexes exposés à l’effluent secondaire ont présenté une réduction cinq fois plus importante des concentrations de testostérone du plasma comparativement aux poissons témoins. Ces concentrations étaient également sensiblement réduites par rapport à celles mesurées chez les poissons exposés à une concentration de 1 % d’effluent primaire. Ces résultats suggèrent que le traitement secondaire des effluents de certaines usines de pâte kraft blanchie ne peut éliminer les composés responsables de la dépression des hormones de reproduction chez certains poissons.
Rivière Little, Bathurst (Nouveau-Brunswick), 2000
Dans cette étude, des systèmes de bassins artificiels ont servi à évaluer les effets d’un effluent de mines de métaux (EMM). En 2000, des études en bassins artificiels ont été réalisées par Culp et al., (inédit) pour évaluer les effets d’un EMM sur les communautés d’invertébrés benthiques et d’algues. Dubé et al., (2005) ont mesuré simultanément les effets sur des Saumons atlantiques (Salmo salar)juvéniles d’une exposition à un EMM dans le milieu aquatique ambiant et dans un réseau multitrophique cultivé en conditions naturelles (algues + invertébrés benthiques + poissons). Les études ont été effectuées sur un site minier près de Bathurst (Nouveau-Brunswick). Dans la première de ces études, le grand système de bassins artificiels (modèle III) (figure 9-1C) a servi à évaluer les effets de concentrations d’EMM de 20 % et de 80 % (v/v) sur les saumons. Les niveaux de traitement de cette étude ont été choisis afin de reproduire les rejets actuels d’effluent (80 %) dans la rivière Little (Nouveau-Brunswick), et ceux prévus après la fermeture de la mine (20 %). L’exposition a duré 37 jours, et les variables à l’étude incluaient la croissance, la taille du foie, la condition, l’accumulation de métaux dans les tissus et les indices de stress, y compris la teneur en glycogène musculaire (Dubé et al., 2005). Dans la deuxième série d’études, le système de bassins artificiels (figure 9-2B) a servi à mesurer les réactions des invertébrés benthiques à des concentrations d’EMM de 20 % et 80 % après 24 jours d’exposition. Les variables à l’étude incluaient les variations de la densité totale d’invertébrés, la diversité des espèces, l’indice de diversité de Simpson, l’indice de Bray-Curtis et l’émergence des insectes (Culp et al., inédit). Dans la troisième série d’études, le système de bassins artificiels (figure 9-2B) a une fois de plus servi à exposer un réseau multitrophique auto-entretenu à des concentrations d’EMM de 20 % et de 80 % pendant 26 jours (Dubé et al., 2005). Des jeunes Chabots visqueux (Cottus cognatus) de l’année ont été placés dans des bassins artificiels préalablement ensemencés avec des communautés d’algues et d’invertébrés benthiques issus d’un cours d’eau témoin. On a ainsi été en mesure d’évaluer les effets de l’EMM sur des poissons en utilisant une voie d’exposition à un contaminant qui correspond plus aux conditions naturelles (c.-à-d., en utilisant un réseau trophique au lieu d’une source de nourriture non exposée).
Rivière Wapiti, Grande Prairie (Alberta), 2001
Des mésocosmes ont servi à distinguer les effets de confusion reliés à l’effluent secondaire d’une usine de pâte kraft blanchie des effets d’un effluent d’égout municipal sur le taux de survie, la croissance, la condition et le taux de reproduction du Naseux des rapides (Rhinichthys cataractae) adultes et juvéniles (Dubé et al., 2004), exposés aux traitements suivants pendant 42 jours : eau de cours d’eau de référence; EFPP (3 %), EFPP (10 %), EEM (1 %), et EEM (1 %) + EFPP (3 %). L’objectif des essais effectués avec l’EFPP consistait à examiner les effets, à des concentrations faibles et élevées, d’une exposition à l’effluent de l’usine de pâte seulement. Le traitement avec l’EEM seul et le traitement mixte étaient représentatifs des conditions existant en amont (EEM 1 %) et en aval (EEM 1 % + EFPP 3 %) du point de rejet des EFPP dans la rivière Wapiti. Les résultats ont montré qu’une concentration de 10 % d’EFPP avait altéré légèrement la condition des juvéniles et la production de certaines hormones sexuelles chez les adultes. L’exposition à 3 % d’EFPP a augmenté légèrement la condition des juvéniles, suggérant un effet d’enrichissement en nutriants aux concentrations plus faibles d’effluent. L’exposition aux EFPP est restée sans effet sur le taux de survie, la croissance, la taille des gonades ou le stade de développement des gonades. L’EEM a affecté les paramètres de la reproduction, dont la taille des gonades mâles, la fécondité des femelles et la concentration de certaines hormones chez les mâles et les femelles. Après une exposition à 10 % d’EFPP, les changements hormonaux observés étaient d’une ampleur comparable à ceux mesurés après une exposition à 1 % d’EEM. En résumé, cette étude a examiné de manière précise les effets par voie d’exposition hydrique d’un EFPP et d’un EEM sur une espèce de poisson fourragère après une exposition de 42 jours dans un mésocosme sur le terrain.
Culp et al., (2004) ont examiné les effets cumulés des EFPP et des EEM sur les communautés d’invertébrés benthiques et d’algues. Pour y parvenir, quatre groupes de traitement ont été constitués comme plus haut (témoin, 1 % EEM, 3 % EFPP, 1 % EEM + 3 % EFPP). Ensuite, des réseaux trophiques benthiques ont été établis en plusieurs exemplaires pour chaque groupe de traitement en ensemençant chacun des mésocosmes avec un substrat, les microorganismes et les algues associées et les invertébrés obtenus d’une zone de référence. Puis, les insectes adultes ont été capturés tous les deux ou trois jours dans des cages d’émergence installées sur chaque circuit d’eau (figure 9-2B), alors que les invertébrés benthiques et la biomasse d’algues ont été échantillonnés à la fin de l’expérience. Les résultats indiquent que les EEM et les EFPP constituent d’importantes sources de nutriants dans la rivière. Plus particulièrement, les EEM ont semblé constituer une source principale d’azote, tandis que les EFPP semblaient être une source importante de phosphore et de carbone. La biomasse d’algues a augmenté sous l’effet de l’exposition à l’effluent et elle était plus étroitement liée à la présence d’azote qu’à celle de phosphore ou de carbone. Les données sur l’émergence des insectes indiquent que l’effet de l’exposition aux deux effluents complexes serait plutôt synergique qu’additif (Culp et al., 2004).
Applications par les partenariats université-industrie, 2001-2008
Ruisseau Junction, Sudbury (Ontario), 2001 et 2002
Le ruisseau Junction à Sudbury (Ontario), exposé historiquement à une contamination des sédiments pendant des décennies d’exploitation minière, reçoit trois effluents miniers traités, un effluent d’égout municipal et subit les impacts de plusieurs autres sources diffuses. Les effets des EEM traités de trois mines distinctes qui rejetaient leurs effluents dans le ruisseau Junction ont été évalués en 2001 et 2002, à l’aide de deux espèces de poissons, le Mulet à cornes (Semotilus atromaculatus) et le Mulet perlé (Semotilus margarita) (Dubé et al., 2006). Divers traitements ont été testés sur une période de 35 à 41 jours : eau de référence, EMM no 1 (30 %), EMM no 2 (20 %), EMM no 3 (45 %). Au cours de la première année (2001), les effets observés sur les mulets comprenaient une réduction du taux de survie (statistiquement non significatif) et une baisse des concentrations de testostérone. L’année suivante (2002), le taux de survie des mulets a été réduit à moins de 60 % par les traitements EMM no 1 et no 3, et l’exposition à ces mêmes effluents a provoqué une baisse du poids corporel total des mâles et des femelles. Pendant ces deux années, les effets étaient plus fréquents aux traitements de l’effluent minier no 1 et no 3, avec des augmentations régulières des teneurs des eaux de traitement et des tissus en nickel, rubidium, strontium, fer, lithium, thallium et sélénium. Ces études ont montré que l’exposition aux effluents miniers entraînait des changements des paramètres mesurés chez les poissons endémiques du ruisseau Junction distincts de ceux provoqués par la contamination historique des sédiments.
Après plusieurs années d’étude des effets de l’exposition des poissons aux effluents rejetés dans le milieu ambiant, il devenait nécessaire de perfectionner les systèmes de mésocosmes afin d’étudier les transferts trophiques. En effet, l’exposition aux contaminants par voie alimentaire est plus pertinente, sur le plan environnemental, que l’exposition aux contaminants présents dans l’eau ambiante (même si cette dernière retient davantage l’attention des chercheurs en toxicologie aquatique). Par ailleurs, les résultats des évaluations nationales des EEM réalisées dans le cadre du Programme d’ESEE pour le secteur des pâtes et papiers suggèrent que les effets des effluents sur les fonctions reproductrices des poissons jouent un rôle dominant à l’échelle nationale. De ce fait, l’élaboration de méthodes fondées sur des mésocosmes de poissons devrait être axée sur l’exposition par voie alimentaire ainsi que sur une évaluation plus approfondie des fonctions reproductrices.
En 2002, un bioessai sur le cycle vital in situ a été conçu avec le chironomidé Chironomus tentans,dans des systèmes de bassins artificiels afin d’évaluer les effets d’un effluent minier dans les conditions ambiantes du ruisseau Junction, en Ontario (Hruska et Dubé 2004). Les chironomidésont été exposés pendant toute la durée de leur cycle vital au traitement EMM no 3, qui correspond aux concentrations moyennes d’effluent mesurées dans le ruisseau. Une réduction du taux de survie, de l’émergence totale et du succès d’éclosion ainsi qu’une émergence plus tardive ont pu être observées chez les insectes du groupe expérimental. Cette étude a montré comment un bioessai sur le cycle vital pouvait servir in situ pour évaluer les effets des effluents miniers sur un invertébré benthique. Nous avons en outre recueilli des informations sur les taux de croissance du C. tentans, son succès d’éclosion et sa survie dans les mésocosmes, qui sont requises pour l’amélioration des systèmes de mésocosmes multitrophiques fondés sur des milieux de culture.
En 2003, les travaux de perfectionnement du mésocosme à C. tentans aux fins de l’évaluation des effluents des mines de métaux, se sont poursuivis (Hruska et Dubé 2005). L’utilité de cet essai a été comparée à un bioessai standard existant sur le cycle vital réalisé en laboratoire. Pour ce faire, les larves de C. tentans ont été exposées au milieu EMM no 3 traité à 45 % (v/v) du 11e jour jusqu’à l’éclosion de la deuxième génération. La structure des réponses a été cohérente pour deux des paramètres mesurés, soit le succès d’éclosion et le temps écoulé jusqu’à l’émergence, mais erratique pour les autres. Des effets significatifs de l’effluent sur la croissance, le taux de survie, le nombre d’adultes émergés et le nombre d’œufs par oothèque ont été constatés grâce au bioessai en bassins artificiels, contrairement à celui réalisé en laboratoire. Par contre, ce dernier a permis de constater des effets significatifs sur le rapport des sexes et le nombre d’oothèques par femelle, que le bioessai en bassins artificiels n’avait pas relevés. On pense que ces différences pourraient découler du nombre d’organismes utilisés par répétition dans chacun des bioessais et qui pourraient influer sur la puissance statistique des plans d’étude. Ainsi, des coefficients de variation et une ampleur des effets plus importants ont été observés dans les bioessais en laboratoire en comparaison des bioessais en bassins artificiels pour presque tous les paramètres. Ces résultats ont fourni la preuve que le système de mésocosmes constitue un outil efficace pour évaluer les effets des effluents miniers sur les paramètres du cycle vital du C. tentans. Il est reconnu que le Programme d’ESEE est axé sur la structure des communautés d’invertébrés benthiques et non sur les espèces benthiques individuelles. Toutefois, ces études ont été nécessaires pour définir les bases scientifiques de l’élaboration de mésocosmes multitrophiques en milieu contrôlé ainsi que pour offrir des solutions de rechange pouvant s’avérer utiles lorsque les programmes parviendront à l’étape de la recherche des causes qui pourrait exiger des données plus détaillées, en particulier dans les cas où les communautés benthiques sont dominées par les chironomidés.
Le système de mésocosmes à C. tentans constituait une source de nourriture auto-entretenue utile pour un mésocosme de poissons. Cela permettrait d’accroître la pertinence des mésocosmes de poissons pour l’étude des conditions d’exposition plus naturelles. C’est-à-dire des conditions où les poissons sont exposés à des effluents à la fois par l’eau ambiante et par leur régime alimentaire. Sachant que plusieurs métaux sont connus pour affecter les poissons par voie alimentaire, ce système constitue une amélioration importante. Il convenait également d’apporter une autre amélioration aux mésocosmes de poissons : accroître la pertinence et l’importance des paramètres examinés.
Terrace Bay (Ontario), 2003
L’exposition des poissons à un contaminant pendant une partie de leur cycle vital offre l’occasion d’étudier les effets directs de l’effluent sur la reproduction des adultes et sur leur progéniture. Elle permet en outre d’examiner les critères d’effets d’ESEE (condition, taille relative du foie, taille relative des gonades). Le Méné à grosse tête (Pimephales promelas) est l’espèce par excellence des études toxicologiques effectuées à travers le monde afin d’évaluer et de classer les contaminants en fonction de leur teneur en perturbateurs endocriniens. Pour ce faire, des essais à court (sept jours), moyen (21 jours) ou long terme (cycle vital entier) ont été mis au point. Ces essais permettent d’évaluer directement les effets sur la reproduction (nombre d’œufs, taille des œufs, nombre de fraies), mais aussi les effets indirects (p. ex., taille des gonades). Toutefois, presque toutes les études décrites dans la documentation spécialisée et utilisant le Méné à grosse tête portent sur l’exposition aux contaminants présents dans le milieu aquatique et visent à détecter les substances toxiques, et ce, au détriment d’une analyse plus réaliste des conditions du milieu. Le premier objectif consistait à vérifier s’il était possible de réaliser un essai d’exposition des poissons pendant 21 jours sur le terrain, avec de l’eau de référence comme eau de dilution, aux fins de l’évaluation des EFPP dans des conditions de température de l’eau et de photopériode constantes. Le second objectif consistait à combiner le bioessai sur le cycle vital du chironomidé C. tentans au bioessai sur le cycle vital partiel du Méné à grosse tête afin d’élaborer un système de mésocosmes multitrophiques.
En 2003, un essai d’exposition de 21 jours de Ménés à grosse tête a été réalisé sur le site d’une usine de pâte de Terrace Bay où les effets sur les fonctions reproductrices de poissons sauvages avaient déjà été étudiés. Le premier objectif consistait à déterminer les effets des EFPP sur le Méné à grosse tête à des concentrations de 1 % et de 100 % (Rickwood et al., 2006a). Le second objectif était d’utiliser l’essai sur le Méné à grosse tête pour déterminer les sources des contaminants dans la fabrique qui influaient sur les indicateurs des fonctions reproductrices (Rickwood et al., 2006b). Pour y parvenir, différents circuits d’eaux de procédé ont été choisis et caractérisés en fonction de la composition chimique de l’effluent et de la toxicité aiguë, et un sous-ensemble a fait l’objet d’un bioessai sur place. Un système mobile fermé (monté sur remorque) de bioessai (photographie non incluse) a été installé sur le site d’une fabrique de pâte kraft blanchie pendant 60 jours afin de profiter d’une source d’eau ambiante (lac Supérieur, Canada) et d’un EFPP final. Il ne s’agissait pas d’un système extérieur de mésocosmes exposé aux conditions ambiantes puisqu’on cherchait uniquement à déterminer s’il était possible d’utiliser le bioessai avec le Méné à grosse tête (21 jours) avec de l’eau de référence ambiante, en maintenant constants d’autres facteurs (température et photopériode). Les résultats ont montré un effet de stimulation à la concentration d’EFPP de 1 % (production d’œufs accrue, cumul des périodes de fraie) comparativement aux témoins. Dans le cas de l’exposition à une concentration d’EFPP de 100 %, la fraie a été retardée, ce qui a résulté en une production réduite d’œufs au cours des deux premières semaines d’exposition. Cette exposition a également entraîné le développement d’un ovipositeur chez les mâles, et l’apparition de caractères sexuels secondaires mâles chez les femelles. Les résultats du second objectif montrent que l’effluent d’usine combiné (avant le traitement secondaire) et l’effluent alcalin combiné causaient tous deux une réduction du nombre de fraies (~55 % pour les deux effluents) et de la production d’œufs (28 % et 74 % respectivement), et que l’effluent alcalin engendrait un développement important de l’ovipositeur chez les mâles. Une comparaison des systèmes de réponses a permis de déterminer que l’effluent alcalin combiné constituait à cette usine la source des composés qui influaient sur les indicateurs des fonctions reproductrices chez le Méné à grosse tête.
Ruisseau Junction, Sudbury (Ontario), 2004-2005
La mise au point du bioessai en mésocosmes sur le cycle vital du chironomidé C. tentans et du bioessai sur le cycle vital partiel (21 jours) du Méné à grosse tête avec de l’eau de référence naturelle en guise d’eau de dilution ont jeté les bases d’un bioessai multitrophique en mésocosmes. L’objectif consistait à mettre au point un bioessai de transfert trophique auto-entretenu utilisant C. tentans et le Méné à grosse tête qui permettrait d’évaluer non seulement les effets d’une exposition aux effluents dans le milieu aquatique ambiant (Méné à grosse tête seulement), mais également l’exposition aux EMM par voie alimentaire et par le biais du milieu ambiant (transfert trophique). Ainsi, le succès de reproduction du Méné à grosse tête a été évalué pendant 21 jours dans des conditions contrôlées de laboratoire afin d’obtenir des données de base sur divers paramètres, y compris la production d’œufs et le succès d’éclosion (Rickwood et al., 2006c). On a ensuite procédé à un essai d’exposition au traitement EMM no 3 (voir ci-dessus) en laboratoire pendant 21 jours supplémentaires. Tant dans le système d’exposition limitée à l’eau ambiante que dans le système à transfert trophique, la réduction du succès de reproduction par rapport au groupe témoin était évidente. Ce n’est que dans le système de transfert trophique qu’une réduction significative de l’éclosion des larves et une augmentation des malformations ont eu lieu après l’exposition à l’EMM, ce qui suggère que la nourriture contaminée était une voie d’exposition entraînant des effets sur la progéniture.
Le système de mésocosmes multitrophiques a par la suite été mis à l’essai sur le terrain en 2005 (Rickwood et al., 2007). Les objectifs consistaient à évaluer : 1) les effets d’un mélange d’effluents miniers et d’eaux usées municipales sur la reproduction du Méné à grosse tête dans un système de bassins artificiels installé sur place et 2) l’importance de l’exposition par voie alimentaire (avec C. tentans) en utilisant un système à transfert trophique. L’exposition au mélange d’effluents dans l’eau ambiante a entraîné une réduction significative de la production d’œufs et du nombre de fraies. Par contre, l’exposition combinée par voie alimentaire et par l’eau ambiante à l’aide du système à transfert trophique a engendré une augmentation significative de la production d’œufs et du nombre de fraies. Les embryons produits dans le système à transfert trophique ont affiché un succès d’éclosion comparable, mais des difformités plus fréquentes et plus graves après l’exposition au mélange. Il a été conclu que les effets du mélange d’effluents sur le Méné à grosse tête étaient plus évidents lorsque le poisson était exposé par contact avec l’eau ambiante. Par ailleurs, l’exposition combinée par voie alimentaire et par contact avec l’eau ambiante s’est avérée moins toxique, possiblement à cause d’une augmentation de la teneur du milieu en nutriants et en matières organiques qui a pu réduire la biodisponibilité des métaux.
Rivière Wabigoon, Dryden (Ontario), 2006
Cette étude s’est penchée sur les liens existant entre l’exposition aux EFPP et les perturbations endocriniennes, afin de chercher à expliquer la présence de poissons intersexués dans la rivière Wabigoon, en Ontario (tableau 9-1; Pollock et al., 2009). Une étude réalisée sur le terrain dans la rivière Wabigoon, près de Dryden (Ontario), en automne 2000, a révélé la présence de Dorés jaunes (Sander vitreus vitreus) intersexués présentant des concentrations d’hormones sensiblement modifiées et des gonades de taille réduite. Or, la rivière Wabigoon reçoit les effluents d’une usine de pâte kraft blanchie et de papier et d’un système d’égout municipal (EEM). Son lit a par ailleurs été recouvert d’une nappe de fibres cellulosiques qui provoque de longues périodes de faibles concentrations d’oxygène dissous en conditions de débit réduit ou de sécheresse. Un essai sur le cycle vital partiel de Ménés à grosse tête a exposé les poissons en mésocosmes sur le terrain à quatre traitements : eau de référence et EFPP à 20 %, 40 % et 60 %. Une étude des dorés prélevés sur le terrain a également été effectuée dans la rivière Wabigoon. Résultats : les teneurs en testostérone avaient diminué chez les mâles avec l’augmentation de la concentration de l’effluent, et l’exposition des mâles à 60 % d’EFPP a induit la production de vitellogénine. Toutefois, ces résultats ne reflétaient pas l’ampleur de la perturbation endocrinienne observée lors de l’étude des poissons sur le terrain. Plusieurs hypothèses ont été avancées pour expliquer cette divergence. Selon certaines études publiées, l’hypoxie ou la présence d’EEM, seules ou combinées à la présence d’EFPP, pourraient expliquer les différences entre l’étude menée sur le terrain et l’essai sur le cycle vital partiel. Des études menées ultérieurement à cet endroit ont examiné les effets d’une faible teneur en oxygène dissous sur le Méné à grosse tête ainsi que les effets interactifs d’une faible teneur en oxygène dissous (6,0 mg/L, concentration à effet nul) et de la présence d’EFPP (40 %, concentration à effet nul) (Dubé, inédit).
Mise au point de mésocosmes, travaux en cours en 2007-2009
Les travaux de mise au point de mésocosmes de poissons se sont poursuivis régulièrement et de manière continue, et chacune des applications s’est soldée par une amélioration de la méthodologie. Il est désormais facile d’évaluer les effets sur les petites espèces de poissons endémiques dans l’écosystème étudié ou d’utiliser un essai sur le cycle vital partiel du Méné à grosse tête dans des systèmes de mésocosmes extérieurs (exposition dans l’eau ambiante ou transfert trophique). Dorénavant, les recherches qui seront effectuées dans le cadre du Programme d’ESEE pour les mines de métaux s’intéresseront davantage à la recherche des causes.
Ruisseau Junction, Sudbury (Ontario), 2008-2011
Étant donné la complexité des écosystèmes aquatiques, la compréhension des effets des métaux et des mélanges métalliques sur les réseaux trophiques des cours d’eau est limitée. De plus, l’évaluation de ces effets n’est que la première étape des efforts d’atténuation et, ultimement, de développement durable. L’élucidation des causes (p. ex., métaux responsables) et des facteurs qui modifient cette toxicité constitue l’étape suivante dans la recherche de solutions. Les recherches en cours sur les mésocosmes à Sudbury (Ontario) a) confirmeront les réactions du Méné à grosse tête aux EMM sur le terrain à l’aide des bioessais multitrophiques auto-entretenus; b) permettront d’évaluer comparativement les structures de réponses des Ménés à grosse tête à des mélanges d’effluents entiers et à des doses équivalentes de chaque métal potentiellement préoccupant (cuivre [Cu], sélénium [Se] et thallium [Tl]); c) permettront de mesurer l’importance relative de l’eau ambiante et du régime alimentaire comme voie d’exposition entraînant une réaction toxique aux métaux chez le Méné à grosse tête; et d) permettront d’examiner les facteurs qui pourraient influer sur la toxicité (pH/alcalinité et matières organiques naturelles, et qualité et quantité de la nourriture) des mélanges d’effluents et de chaque métal dominant (Cu, Se et Tl) pour le Méné à grosse tête (Dubé et al., inédit).
Key Lake (Saskatchewan), 2007-2011
Cette étude est menée sur une période de quatre ans et s’appuie elle aussi sur une combinaison d’études en mésocosmes effectuées sur le terrain ou en laboratoire (Driessnack et al., inédit; Dubé et al., inédit). L’étude en mésocosmes réalisée en laboratoire a pour objectif d’évaluer les effets d’une exposition à un effluent de mine d’uranium sur un réseau trophique aquatique (mésocosme multitrophique), y compris sur la reproduction du Méné à grosse tête. En outre, une évaluation comparative des structures de réponses du Méné à grosse tête au mélange d’effluent et au sélénium (Se) (sous forme de séléniate) permet d’isoler la contribution du Se de celle des autres composantes du mélange d’effluents. Les résultats indiquent que les structures des réponses relatives à la production d'œufs n'ont pas pu être expliquées par le Se dans la comparaison des réponses aux différents traitements et à l’eau de référence. L’étude en mésocosmes sur le terrain vise à mesurer l’effet relatif et cumulatif de la contamination par le Se présent dans l’eau ambiante (contamination actuelle) et dans les sédiments (contamination historique) sur le succès de reproduction et le taux de survie du Méné à grosse tête et de sa progéniture. Les résultats indiquent que les effets sur le Méné à grosse tête proviennent exclusivement des effluents et que les contributions des sédiments contaminés ne sont pas significatives. Les sédiments testés dans l'étude étaient composés de sable, car c’est le type de sédiments le plus commun dans le bassin de Key Lake. Des travaux supplémentaires sont nécessaires pour déterminer l'importance des sédiments organiques dans les réponses et particulièrement de leur distribution spatiale et temporelle sur le site.

Figure 9-1 : A) Grand système de mésocosmes à bassins artificiels installés sur des tables (modèle I), utilisé pour l’étude sur la rivière Athabasca (Alberta); B) Grand système mobile de mésocosmes à bassins artificiels montés sur deux remorques (modèle II), utilisé pour les études sur le fleuve Fraser (Colombie-Britannique), le fleuve Saint-Jean (Nouveau-Brunswick) et le port de Saint John (Nouveau-Brunswick); C) Grand système mobile de mésocosmes à bassins artificiels montés sur une seule remorque (modèle III), utilisé pour les études sur les rivières Miramichi et Little (Nouveau-Brunswick), la rivière Wapiti (Alberta) et le ruisseau Junction (Ontario).

Figure 9-2 : A) Petit système de microcosmes à bassins artificiels installés sur des tables surplombant les réservoirs de mélange, utilisé pour l’étude sur la rivière Thompson (Colombie-Britannique); B) Système de mésocosmes modulaire à bassins artificiels installés sur des tables surplombant les réservoirs de mélange, utilisé pour les études sur la rivière Little (Nouveau-Brunswick), le ruisseau Junction (Ontario), la rivière Wabigoon (Ontario) et à Key Lake (Saskatchewan).
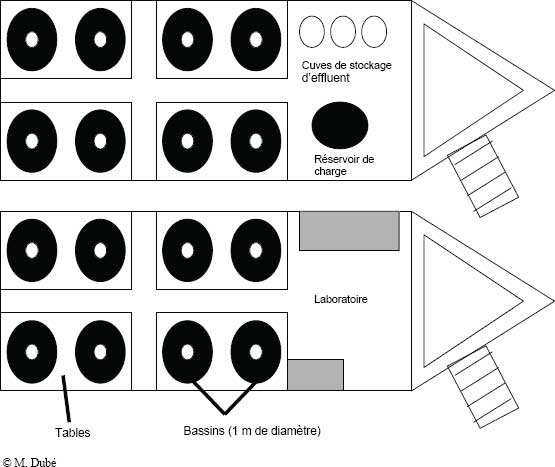
Figure 9-3 : Représentation schématique (non à l’échelle) du système de mésocosmes sur remorque.

Figure 9-4 : Photographie de l’installation d’un mésocosme modulaire (texte description)
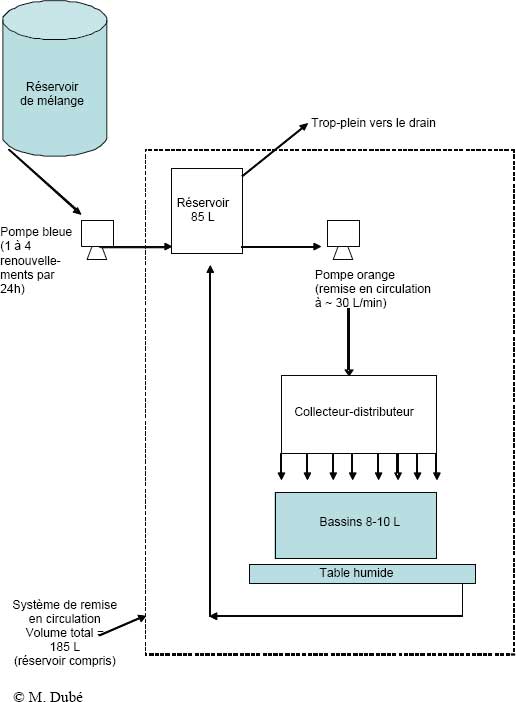
Figure 9-5 : Schéma de circulation du mésocosme modulaire.

Figure 9-6 : Bioessai multitrophique de la reproduction du Méné à grosse tête et barrière d’alimentation.

Figure 9-7 : Installation sur le terrain de mésocosmes modulaires.
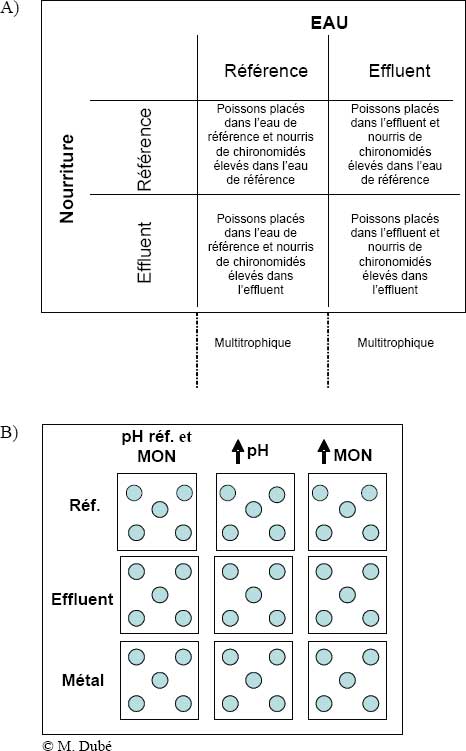
Figure 9-8 : A) Protocole expérimental factoriel visant à examiner l’importance relative du milieu aquatique et du régime alimentaire en ce qui a trait aux réactions du Méné à grosse tête aux effluents miniers dans des mésocosmes modulaires; B) Protocole expérimental servant à examiner l’incidence du pH et des matières organiques naturelles (MON) sur les réactions du Méné à grosse tête exposé à un mélange d’effluents miniers et à un seul métal dans des mésocosmes multitrophiques modulaires.
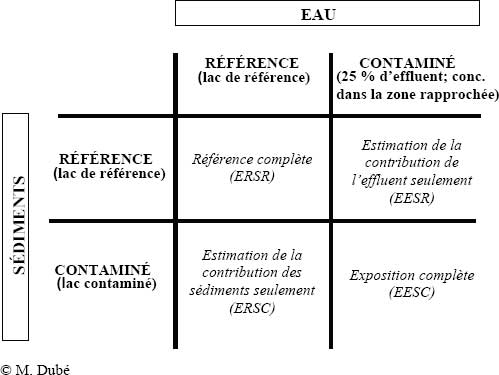
Figure 9-9 : Protocole expérimental factoriel visant à étudier les effets d’un EMM et de la contamination historique des sédiments séparément ou en combinaison sur le Méné à grosse tête dans des mésocosmes modulaires. Légende : ERSR : Eau de référence et sédiments de référence; EESR : Eau d’effluent et sédiments de référence; ERSC : Eau de référence et sédiments contaminés; EESC : Eau d’effluent et sédiments contaminés.
9.2.2 Applicabilité dans le cadre du Programme d’ESEE
Il convient d’insister sur le fait que même si le système de mésocosmes figure parmi les méthodes de remplacement recommandées, il ne doit être utilisé que lorsque les études sur le terrain ne permettent pas de répondre clairement à l’hypothèse, ou sont simplement impossibles à réaliser. Le recours à des mésocosmes peut notamment être indiqué lorsque des facteurs de confusion compliquent l’étude du milieu récepteur ou que les conditions rendent l’échantillonnage dangereux. Par exemple, ils peuvent être utiles s’il n’y a pas de zone de référence adéquate pour servir de base de comparaison, ou s’il existe une contamination historique, ou encore en présence du rejet d’autres effluents ou de changements dans les types d’habitat appropriés qui ne peuvent être exclus de l’élaboration d’une étude de terrain. Les mésocosmes peuvent également servir à l’évaluation de l’ampleur des effets (séries de dilution) et à la recherche de causes. Les études de cas décrites dans la section précédente illustrent bien les différents types de questions et de manipulations expérimentales qui peuvent s’appliquer aux diverses étapes du Programme d’ESEE.
Il est également possible d’utiliser l’espèce de poisson d’une étude en mésocosme pour la composante du Programme d’ESEE ayant trait à l’exploitabilité des ressources halieutiques, à condition que le critère d’effet retenu soit valide pour l’ensemble de la période d’exposition typique des études en mésocosmes. Dans un tel cas, le critère d’effet et les méthodes statistiques seraient ceux décrits au chapitre 3.
L’utilisation de mésocosmes comporte à la fois des avantages et des inconvénients qu’il importe d’évaluer par rapport à ceux des autres méthodes de suivi de remplacement avant d’arrêter son choix sur une méthode précise.
9.2.3 Technologie des mésocosmes
9.2.3.1 Conception des mésocosmes
Afin de conserver la qualité des données et d’assurer l’application uniforme de la technologie des mésocosmes aux fins du Programme d’ESEE, il faut examiner la conception physique du système utilisé et le plan d’étude, y compris les modes opératoires normalisés. Cette section définit les exigences en matière de conception physique et présente des recommandations relatives au plan d’étude expérimental à la fois pour l’utilisation du grand système mobile de mésocosmes et du plus petit système modulaire.
Peu importe le système utilisé, le fonctionnement général est le même. Les bassins contiennent le biote (poissons, invertébrés benthiques), les algues ou le substrat à étudier. On juge que l’utilisation de cinq à huit bassins répétés par traitement est adéquate. De plus, ces systèmes ne sont pas statiques; ils fonctionnent en circulation ouverte (mésocosmes sur remorque) ou en recirculation partielle (mésocosmes modulaires). Idéalement, l’eau de référence et l’eau de dilution sont pompées d’un site de référence et acheminées dans un réservoir de tête. L’effluent traité, quant à lui, est prélevé chaque jour, ou au moins une fois par semaine, et conservé sur place dans un réservoir de tête. D’ailleurs c’est dans les réservoirs de tête que sont conservés les liquides, qui peuvent être chauffés ou refroidis selon les circonstances. Les réservoirs de mélange servent à mélanger l’eau de référence et l’effluent à la concentration d’essai voulue. L’« eau de traitement » ainsi obtenue est pompée de chaque réservoir de mélange jusqu’aux systèmes de bassins artificiels (mésocosmes) à un débit réglé pour obtenir le temps de renouvellement souhaité (minimum d’un renouvellement complet toutes les 24 heures, et jusqu’à six renouvellements par 24 heures). L’essai dure d’ordinaire de 30 à 65 jours, avec des mesures quotidiennes et hebdomadaires des paramètres physiques et chimiques, du débit, de la mortalité des poissons et de la reproduction (p. ex., collecte quotidienne des œufs). À la fin de la période d’exposition, les poissons sont examinés, et d’autres mesures sont prises.
9.2.3.2 Description et fonctionnement général d’un grand système mobile de mésocosmes
Le grand système de mésocosmes recommandé ici a été conçu par l’Institut national de recherche sur les eaux (INRE) d’Environnement Canada et a servi à évaluer les effets des EFPP et des EMM sur les réseaux trophiques benthiques (invertébrés benthiques et algues) (Culp et Podemski, 1996; Culp et al., 1996, 2000a, 2001; Cash et al., 2003) et sur un poisson de petite taille (Dubé, 2000; Dubé et MacLatchy, 2000a; Cash et al., 2003; Dubé et al., 2002). Ce système a été utilisé pour évaluer les communautés d’invertébrés benthiques ainsi que l’exposition des poissons dans le milieu aquatique ambiant. Il est toujours valable, mais la plupart des recherches utilisent aujourd’hui le mésocosme modulaire décrit dans la section suivante.
Le grand système mobile de mésocosmes consiste en 16 bassins circulaires d’une superficie de 0,9 m2, disposés par paires sur des tables d’une hauteur de 74 cm (figures 9-1 et 9-3). L’eau puisée d’une zone de référence est pompée dans un réservoir de tête en polyéthylène d’une capacité de 378 L, placé sur une plate-forme de 1,2 m de hauteur, d’où elle s’écoule dans les bassins par gravité, à travers un réseau de canalisations. On peut aussi utiliser une pompe d’admission, par exemple une pompe terrestre (c.-à-d. une pompe d’irrigation ou une pompe de piscine commerciale), ou bien une pompe submersible (Hydro-Matic modèle no SPD50-H de 0,5 HP), selon le volume à pomper, la distance de pompage et la hauteur d’élévation requise. L’eau de référence peut également être puisée d’une prise d’eau de l’usine. Ensuite, des robinets-vannes servent à régler et à étalonner le débit de l’eau dans chaque bassin. Ainsi, l’eau est acheminée à chaque bassin selon un débit de 2 L/min, résultant en un débit total de 32 L/min pour alimenter les 16 bassins.
L’eau dans chaque bassin est maintenue à une hauteur de 26,9 ± 0,1 cm (![]() ± 1 erreur type) au moyen d’un tuyau de trop-plein qui rejette toutes les eaux usées dans la rivière (figure 8-3b). Ce tuyau est muni d’une grille pour éviter la perte de poissons et limiter l’émigration des insectes. Étant donné que chaque bassin contient 227 L d’eau; le temps de séjour de l’eau est d’environ deux heures. En augmentant à quatre heures le temps de séjour de l’eau dans les bassins, on réduit au minimum le volume d’effluents et d’eau de référence requis pour l’étude. La détermination finale du temps de séjour dans un système donné dépend de la taille du réservoir utilisé et des besoins des espèces à l’étude concernant le taux d’oxygène et la température. Si les études en mésocosmes sont réalisées à la fin de l’automne, le réservoir de tête et les conduites d’alimentation en eau peuvent être enveloppés de ruban chauffant et isolés, afin que le système puisse être utilisé même si la température descend sous le point de congélation (–5 °C). Par ailleurs, une toile de protection peut être utilisée durant l’été pour réduire la chaleur due au soleil.
± 1 erreur type) au moyen d’un tuyau de trop-plein qui rejette toutes les eaux usées dans la rivière (figure 8-3b). Ce tuyau est muni d’une grille pour éviter la perte de poissons et limiter l’émigration des insectes. Étant donné que chaque bassin contient 227 L d’eau; le temps de séjour de l’eau est d’environ deux heures. En augmentant à quatre heures le temps de séjour de l’eau dans les bassins, on réduit au minimum le volume d’effluents et d’eau de référence requis pour l’étude. La détermination finale du temps de séjour dans un système donné dépend de la taille du réservoir utilisé et des besoins des espèces à l’étude concernant le taux d’oxygène et la température. Si les études en mésocosmes sont réalisées à la fin de l’automne, le réservoir de tête et les conduites d’alimentation en eau peuvent être enveloppés de ruban chauffant et isolés, afin que le système puisse être utilisé même si la température descend sous le point de congélation (–5 °C). Par ailleurs, une toile de protection peut être utilisée durant l’été pour réduire la chaleur due au soleil.
Les bassins artificiels du grand système de mésocosmes consistent en des cuves en fibre de verre-polyester de 107 cm de diamètre. Ces cuves sont placées sur huit tables d’une hauteur de 74 cm, à raison de deux par table. Un tuyau d’évacuation traverse la colonne montante et se raccorde aux canalisations en dessous et à la conduite principale qui rejette l’eau dans la rivière, en aval du point de prise d’eau.
Pour les études sur les invertébrés, un courant peut être créé dans chaque bassin à l’aide d’un système à hélices (Podemski, 1999). Ce système engendre une vitesse d’écoulement, à mi-hauteur environ de la colonne d’eau, qui est normalement maintenue à 20 cm/s; elle doit toutefois être déterminée en fonction des conditions propres à chaque site. Il existe également d’autres mécanismes générateurs de courant qui peuvent être utilisés, à condition qu’ils produisent la vitesse désirée. Le système d’hélices peut aussi servir pour les études sur le poisson, bien que des rampes d’arrosage fixées au système d’alimentation en eau de chaque bassin aient aussi été utilisées dans le cadre d’études sur des espèces pour lesquelles la vitesse d’écoulement n’était pas un facteur déterminant.
Les échantillons d’effluent sont prélevés chaque jour ou tous les deux jours et sont conservés dans des contenants de polyéthylène. Le site de prélèvement des échantillons dépend du plan d’étude. Par exemple, dans le cas d’une première étude de suivi d’une mine de métaux, il faut analyser l’effluent final représentatif de ce qui est rejeté dans le milieu aquatique. L’introduction des effluents dans chaque bassin se fait de manière indépendante et continue, à l’aide de pompes péristaltiques (têtes de pompe à cartouches et contrôleurs d’écoulement L/S Masterflex® L/S, type Nema 13). Les débits d’effluents varieront en fonction des concentrations propres au site à évaluer. À titre d’exemple, si les études sur la délimitation du panache menées sur le terrain ont révélé que la concentration de l’effluent était de 1 %, alors le débit dans chaque bassin doit être réglé à 20 ml/min (1 % de 2 L/min). Si la remorque compte 16 bassins répartis entre deux traitements (8 bassins témoins; 8 bassins d’analyse d’une concentration de 1 %), le calcul du volume d’effluent requis sur une base quotidienne se fera comme suit : 20 ml/min × 60 min/h × 24 h/jour = ~29 L/jour/bassin × 8 bassins = ~231 L/jour. Alors, ce volume pourrait être contenu à l’intérieur d’un petit contenant de polyéthylène.
Après avoir étalonné les débits d’eau et d’effluent pour chaque système, on procède à l’ensemencement de chaque bassin en y introduisant le substrat naturel, les algues, les invertébrés benthiques et/ou les espèces de poissons endémiques du milieu récepteur à l’étude. Les méthodes d’ensemencement du biote sont décrites ci-après pour les poissons et les invertébrés. Enfin, de plus amples détails concernant la construction de ce système sur remorque figurent dans les documents de référence.
9.2.3.3 Description et fonctionnement général du système de mésocosmes modulaires
Chaque unité ou table de mésocosmes modulaires est constituée d’une palette d’expédition, d’un châssis métallique, d’une table humide, de bassins circulaires en polyéthylène (jusqu’à huit), d’un réservoir destiné à contenir la solution d’exposition, d’un collecteur pour la distribution égale de la solution entre les bassins, d’une pompe Viking bleue servant à pomper la solution du réservoir de mélange au réservoir, et d’une pompe March orange qui assure la remise en circulation de la solution du réservoir au collecteur et au groupe de bassins (figures 9-4 et 9-5).
Chaque mésocosme peut contenir au total 185 L d’eau (réservoir de 85 L; huit bassins de 10,3 L chacun = 82,4 L; ~15 L dans le collecteur, les canalisations et les pompes), et consomme 3,0 ampères pour fonctionner sans chauffage, refroidissement ou aération de l’eau. Les bassins circulaires peuvent contenir 10,3 L de liquide et sont chacun munis d’un tube vertical central non fonctionnel. Les bassins faits en polyéthylène haute densité sont installés sur une table qui recueille le liquide (trop-plein) et l’achemine dans un réservoir de dilution de 85 L. Chaque bassin est muni d’un couvercle qui empêche les poissons de s’échapper et interdit l’accès à d’autres organismes (p. ex., des oiseaux). Ce couvercle est fait d’une moustiquaire ou d’un grillage en Nytex et est retenu en place par des tendeurs élastiques. Chaque table reçoit huit bassins en polyéthylène de 10,3 L faits et moulés sur mesure. Les réservoirs en plastique de 85 L sont également faits et moulés sur mesure. Le collecteur-distributeur à huit orifices de raccord a également été fait sur mesure pour répartir le liquide dans chacun des huit bassins, sans avoir recours à huit pompes. Pour ce faire, deux types de canalisations acheminent l’eau qui entre dans le collecteur-distributeur (diamètre intérieur de 3/8 po) et qui en sort (diamètre intérieur de ¾ po).
Une pompe doseuse électronique (Viking/Pulsatron bleue, série E 240 GPD LEH 75A-PHC3-XXX) sert à régler le temps de séjour de l’eau ou de l’effluent dans le réservoir. La pompe March « série 3 » centrifuge à entraînement magnétique étanche (orange) sert, quant à elle, à régler la circulation de l’eau ou de l’effluent du réservoir jusqu’aux bassins. Les pompes sont les éléments les plus coûteux de ce système et les composantes les plus critiques de l’étude. En effet, un débit incorrect entraînera une dilution incorrecte de l’effluent pour les organismes d’essai.
Chaque unité ou table de mésocosmes représente un traitement comprenant huit répétitions. Il est à noter, et ce point a été débattu, que le réservoir de chacun des systèmes constitue une pseudorépétition. Ce problème a été débattu avec succès et défendu par le biais du processus d’examen par les pairs. Dans le cas des mésocosmes de poissons, les bassins peuvent être équipés de barrières d’alimentation pour les études multitrophiques. Ces barrières grillagées permettent aux cultures d’invertébrés benthiques de se développer dans les conditions expérimentales tout en contrôlant l’accès des poissons qui se trouvent au-dessus (figure 9-6).
Les chercheurs ont fait l’essai de plusieurs systèmes différents de circulation, y compris avec des pompes de mélange en ligne. L’expérience acquise en cette matière et les impératifs de coûts ont amené les chercheurs à utiliser de préférence un réservoir de mélange pour la préparation des solutions de traitement et l’acheminement de ces solutions dans chacun des bassins de mésocosme à l’aide d’une pompe, au lieu de recourir au mélange en ligne de l’eau et du contaminant. L’eau est acheminée du réservoir de mélange au bassin d’un mésocosme à l’aide d’une pompe bleue Viking à raison de un à quatre renouvellements par 24 heures (figure 9-5). Chaque bassin est muni, à l’arrière, d’un tuyau de trop-plein et, à l’intérieur, d’un séparateur empêchant l’eau d’arrivée de passer directement dans le tuyau de trop-plein.
La pompe March est la pompe de recirculation. L’eau passe de cette pompe dans le collecteur, et de là dans les bassins. La table sert à recueillir le trop-plein des bassins qui s’écoule ensuite dans le réservoir par un orifice. Le collecteur doit être à niveau et exempt de bulles d’air pour fonctionner efficacement. Toutes les canalisations doivent avoir la même longueur pour maintenir une pression identique et permettre au collecteur-distributeur un débit uniforme de répartition de l’eau dans chacun des bassins. L’eau pénètre dans les bassins par un tuyau d’arrivée qui débouche dans un orifice pratiqué dans leur paroi. L’angle de raccordement du tuyau d’arrivée crée dans les bassins un léger courant circulaire. L’eau remplit les bassins et déborde sur la table, d’où elle est acheminée dans le réservoir. Les bassins sont enveloppés d’une gaine métallique isolante.
9.2.4 Facteurs à considérer pour le choix du site
Peu importe le mésocosme choisi, il convient de respecter certaines exigences de base. Ainsi, le système est habituellement installé dans une zone de référence qui donne accès à de l’eau de référence. Si l’étude porte sur une rivière, l’eau de référence doit être puisée en amont du point de rejet de l’effluent dans le milieu et doit être rejetée dans la rivière en aval du point de prélèvement. Il s’agit du scénario le plus simple pour l’usage de mésocosmes. La distance par rapport à la source d’eau de référence est un autre facteur à considérer dans le choix du site, car des besoins de pompage élevés, imputables à la distance de pompage ou à la charge hydraulique (hauteur de chute), risquent d’être supérieurs aux caractéristiques de la pompe, laquelle ne pourra pas générer le débit requis. Parmi les autres points à considérer, mentionnons la présence d’un espace suffisant, la facilité d’accès au site, les sources d’alimentation en électricité et la sécurité.
L’accès à une source d’énergie est un des principaux critères qui influent sur le choix du site. L’exploitant fournit habituellement une ligne électrique que ses électriciens installent à cette fin sur la remorque ou sur la palette d’expédition dans le coffret de branchement du mésocosme. En régions éloignées, des génératrices ont été utilisées pour alimenter le système en l’absence de source d’énergie, mais cette approche n’est pas recommandée, car l’entretien et la surveillance des génératrices risquent de rendre le coût de cette méthode prohibitif.
Au moment venu d’installer le système, le processus consiste à choisir le site, décharger l’équipement et installer les réservoirs de tête et de mélange à l’extrémité opposée du coffret de branchement électrique (dans le cas des systèmes modulaires). Les mésocosmes modulaires sont d’ordinaire installés sous une tente qui les protégera du soleil et de la poussière et permettra d’assurer une meilleure sécurité. Les réservoirs de tête et de mélange et le coffret de branchement électrique s’installent à l’extérieur de la tente (). Les mésocosmes modulaires ou les remorques sont orientés dans un axe nord-sud, c’est-à-dire perpendiculairement au lever et au coucher du soleil. On procède dans l’ordre à l’installation des équipements, au branchement électrique, à la mise à niveau des tables à mésocosmes, à la connexion des tuyaux des réservoirs de tête et de mélange aux bassins, au remplissage des réservoirs, à la mise sous tension et à l’étalonnage des pompes, au montage des tentes (pour les mésocosmes modulaires) et au transfert des animaux.
Il est essentiel de calculer les besoins du système en énergie électrique en fonction du protocole expérimental retenu et d’évaluer le site pour vérifier la présence d’une source d’alimentation électrique adéquate. La fiabilité des sources d’électricité sur les sites industriels est un point important.
9.2.5 Plans d’études de suivi biologique
9.2.5.1 Vue d’ensemble
Le plan d’étude doit préciser les études en mésocosmes et les analyses de laboratoire connexes qui seront réalisées pour compléter le volet du Programme d’ESEE axé sur le suivi biologique. Bon nombre des composantes de l’étude sont similaires à celles définies dans les divers chapitres du présent guide technique.
Un plan d’étude est soumis à l’agent d’autorisation au moins six mois avant le début des échantillonnages qui serviront à effectuer l’étude de suivi biologique. Ce plan doit inclure ce qui suit :
- une caractérisation du site;
- les précisions voulues sur le déroulement des études sur la population de poissons et les tissus de poissons et la façon dont ces études fourniront les renseignements permettant de déterminer si l’effluent a un effet sur la population de poissons et les tissus de poissons;
- les espèces de poissons, les zones d’échantillonnage et les tailles d’échantillons sélectionnées;
- un calendrier détaillé des différentes étapes de l’étude en mésocosmes;
- les précisions voulues sur le déroulement de l’étude sur la communauté d’invertébrés benthiques et la façon dont cette étude fournira les renseignements permettant de déterminer si l’effluent a un effet sur la communauté d’invertébrés benthiques;
- les date et heure de prélèvement de tous les échantillons;
- les méthodes de terrain et de laboratoire;
- une description des mesures d’assurance de la qualité et de contrôle de la qualité (AQ/CQ) prévues pour assurer la validité des données;
- un sommaire des résultats de toutes études de suivi biologique présentés précédemment.
Parmi les autres renseignements qu’il est recommandé d’inclure dans le plan d’étude, mentionnons les suivants :
- la définition des buts et des objectifs de l’ESEE;
- la description de la démarche globale, y compris les raisons à l’appui de l’utilisation d’une méthode de remplacement (qui peuvent s’appuyer sur les résultats d’études de suivi antérieures);
- l’établissement de critères à l’appui du protocole statistique : formulation d’hypothèses, choix de méthodes statistiques, détermination des besoins en matière de données (analyse de la signification et de la puissance statistiques);
- l’élaboration de plans et de procédures de fonctionnement : procédures d’échantillonnage, protocole d’analyses en laboratoire, méthodes d’assurance de la qualité et de contrôle de la qualité, stockage et extraction des données, analyse des données;
- la description d’un plan pour l’interprétation des données et l’évaluation du programme.
9.2.5.2 Traitements à l’étude
Dans les études en mésocosmes, les effets d’un effluent sur les poissons sont évalués en comparant divers indicateurs d’effets (croissance, reproduction, condition et survie) de poissons en conditions contrôlées (eau de référence) à ceux des poissons exposés aux effluents. Dans l’étude des invertébrés benthiques, l’effet est déterminé en comparant les indicateurs d’effets (densité totale des invertébrés benthiques, richesse des taxons, indice de régularité et indice de similarité) entre les invertébrés benthiques du milieu témoin et les invertébrés exposés. Il est essentiel que les études en mésocosmes soient conçues de manière à maximiser la possibilité de déceler les effets, s’il en est. Il importe donc de choisir avec soin les traitements, le nombre de répétitions, les espèces sentinelles et les variables réponses, et de réaliser les études à la bonne période de l’année.
Les études en mésocosmes permettent de procéder à des manipulations expérimentales contrôlées qui sont en même temps écologiquement pertinentes (qualité de l’eau naturelle, photopériode, température de l’eau et de l’air). La souplesse du plan expérimental est un des avantages les plus importants et créatifs offerts par l’utilisation des mésocosmes. Plusieurs plans d’étude peuvent être utilisés, selon les exigences propres au site et la phase du programme de suivi (c.-à-d. détermination de l’ampleur et de la portée géographique, recherche de causes). Dans les cas les plus simples, deux traitements (groupe témoin et groupe exposé à l’effluent) sont comparés. Pour déterminer la concentration écologiquement pertinente, il est recommandé de se baser sur une étude de délimitation du panache réalisée durant la caractérisation du site (chapitre 2); par conséquent, la concentration doit être représentative de l’effluent rejeté dans la zone à proximité, après mélange complet.
Dans certains cas, des traitements additionnels pourraient être nécessaires. Les plans d’étude basés sur la relation dose-effet, qui prévoient l’utilisation d’un autre effluent plus concentré, sont utiles pour confirmer la sensibilité du biote et l’absence d’effets (voir Dubé et MacLatchy, 2000a; Culp et al., 2000a). D’autres traitements pourraient aussi être souhaitables lorsque plusieurs mines rejettent leurs effluents dans la même zone d’échantillonnage. Le cas échéant, chaque rejet peut représenter un traitement d’exposition dans le protocole expérimental et les effets de chaque effluent peuvent être examinés, séparément ou globalement. À titre d’exemple, si une mine rejette trois effluents dans le même plan d’eau récepteur, les effets de ces effluents peuvent être évalués au moyen des traitements suivants : témoin, effluent 1 (concentration caractéristique de l’environnement), effluent 2, effluent 3, effluent 1+2+3 (concentration caractéristique de l’environnement) (voir tableau 9-1).
Plus récemment, des mésocosmes modulaires ont servi à comparer l’exposition dans l’eau ambiante et l’exposition par voie alimentaire du Méné à grosse tête à des EMM. Cette méthode était utile pour l’étude des différents métaux présents dans les effluents et de leurs incidences sur les types de réponses des poissons. Les poissons répartis en deux groupes -- eau de référence ou effluent -- ont été nourris de chironomidés C. tentans cultivés dans de l’eau de référence ou exposés à l’effluent (figure 9-8A). Les résultats obtenus ont été comparés à ceux de traitements en mésocosmes multitrophiques effectués simultanément. D’autres études ont également été réalisées pour évaluer les effets de diverses variables chimiques de l’eau sur l’atténuation de la toxicité d’un métal et d’un EMM pour le Méné à grosse tête, en particulier les effets d’une augmentation du pH et de la teneur en matières organiques naturelles en utilisant des mésocosmes multitrophiques (figure 9-8B).
9.2.5.3 Répétitions
Dans les systèmes à mésocosmes modulaires avec benthos ou poissons, on utilise d’ordinaire de cinq à huit répétitions. Dans le cas des systèmes à mésocosmes mobiles utilisant un plan d’étude contrôle-impact à deux traitements (référence contre exposition), huit répétitions seront utilisées, puisque le système de mésocosmes comprend 16 bassins. Si un nombre additionnel de traitements est préféré, alors le nombre minimal de répétitions aux fins du Programme d’ESEE devrait être de cinq bassins répétés par traitement pour obtenir la puissance statistique nécessaire à l’évaluation des effets, lorsque les bassins constituent l’unité de répétition et qu’il n’existe aucune donnée de suivi préalable. Cette approche est conforme à la méthode recommandée pour déterminer le nombre de stations d’échantillonnage, d’après la puissance statistique des plans d’étude sur le terrain (chapitres 3 et 4).
L’unité de répétition est moins évidente lorsqu’on veut utiliser le système pour mesurer des variables individuelles chez le poisson. Il faut alors quantifier l’importance de l’effet imputable au bassin (c.-à-d. l’effet d’un bassin par rapport à un autre, à l’intérieur d’un même traitement). Dans bon nombre d’études en laboratoire pour lesquelles les poissons sont placés dans un aquarium, on présume qu’il n’y a pas de raison biologique pour qu’il y ait des différences entre les bassins, et toutes les mesures individuelles d’un même traitement sont donc mises en commun (c.-à-d. qu’on ignore souvent la variabilité imputable à l’effet du bassin). Toutefois, dans le cas des études en mésocosmes, il est possible qu’un effet de bassin existe et qu’il faille tenir compte de la variation imputable à cet effet dans le plan statistique, notamment dans le cas d’expositions à plus long terme (p. ex., 60 jours). Il serait alors possible de procéder à une analyse de variance (ANOVA) hiérarchique, où l’effet du bassin est intégré au facteur à effet fixe (traitement de l’effluent). S’il existe un effet de bassin, le nombre de répétitions devrait être ajusté en fonction du système de bassins artificiels. S’il n’existe pas d’effet de bassin, le poisson peut être choisi comme unité de répétition, et tous les résultats d’un même traitement peuvent être mis en commun, ce qui aura pour effet d’augmenter sensiblement le nombre de répétitions. Pour les analyses de régression (analyse de covariance [ANCOVA]), il est probable que toute différence entre les bassins apparaîtra dans l’analyse comme une valeur aberrante.
9.2.5.4 Tailles des échantillons et rôle de l’ampleur de l’effet
9.2.5.4.1 Absence de données préalables (historiques)
Système de mésocosmes sur remorque : Les systèmes mobiles de mésocosmes offrent la possibilité de conserver les poissons plus longtemps que les systèmes modulaires de mésocosmes. En l’absence de données de suivi de base, l’échantillon minimal recommandé pour une étude sur le terrain est de 20 mâles et 20 femelles parvenus à maturité sexuelle de deux espèces de poissons prélevés dans chacune des zones de référence et d’exposition. Si l’une ou les deux espèces sont des poissons de petite taille, 20 poissons sexuellement immatures devraient aussi être prélevés. La décision d’utiliser 20 poissons de chaque sexe s’appuie sur le fait que les limites de confiance au seuil de 95 % varient peu en augmentant la taille de l’échantillon au-delà de 20 poissons. Dans les mésocosmes mobiles, il s’agit de répartir de 15 à 20 mâles et de 15 à 20 femelles sexuellement matures d’une espèce sentinelle de petite taille dans chaque bassin, et d’y ajouter de 20 à 30 poissons juvéniles. Il s’agit de la taille recommandée pour les échantillons, laquelle peut être augmentée ou réduite selon l’espèce sélectionnée, la puissance statistique du plan d’étude et la variabilité du poisson. Si le bassin est l’unité de répétition choisie pour un traitement, alors le recours à 20 poissons de chaque sexe par bassin permet d’obtenir une moyenne d’un bon degré de précision (les limites de confiance à 95 % varient peu au-delà de 20 poissons). S’il n’y a pas d’effet de bassin et que les termes d’erreurs sont combinés de manière à ce que le poisson devienne l’unité de répétition, on obtiendra un niveau de répétition beaucoup plus élevé en utilisant de 15 à 20 poissons de chaque sexe par bassin, pour chaque traitement. Dans le cas par exemple d’un plan d’étude ayant pour but de comparer un témoin à un effluent d’une concentration de 1 % en utilisant huit bassins par traitement, l’utilisation de 20 mâles, 20 femelles et 20 juvéniles par bassin peut donner en fait 160 mâles, 160 femelles et 160 juvéniles par traitement, si le poisson est l’unité de répétition.
Système modulaire de mésocosmes : Pour les études en mésocosmes modulaires utilisant des invertébrés benthiques ou des poissons, la taille de l’échantillon correspond au nombre de bassins répétés par traitement, puisque le bassin est l’unité de répétition. Dans un plan contrôle-impact, on utilise huit bassins (répétitions) par traitement. Chaque table de mésocosmes représente un traitement, et ce plan d’étude -- le plus simple -- n’exige donc que deux tables. Le nombre de traitements à l’étude peut être plus élevé, mais il doit y avoir au moins cinq répétitions ou échantillons par traitement pour satisfaire au critère de puissance en l’absence de données préalables (voir ci-après). On peut utiliser dans chaque circuit des couples ou des trios reproducteurs, selon l’objectif de l’étude. Le protocole mis au point par Ankley et al. (2001) utilise deux mâles pour quatre femelles par répétition. Toutefois, ce ratio de reproducteurs est trop élevé pour les mésocosmes, et ce nombre de poissons est certainement trop élevé pour un essai en mésocosmes multitrophiques auto-entretenus à durée d’exposition de 21 jours. Il est donc recommandé d’utiliser une paire ou un trio (un mâle pour deux femelles). Si on opte pour des trios de Ménés à grosse tête reproducteurs dans un plan à mésocosmes modulaires, il convient d’évaluer les données correspondant aux deux femelles à l’aide d’une mesure de tendance centrale en utilisant le bassin comme niveau de répétition.
Il importe de tenir compte des objectifs de l’étude des poissons lorsqu’on choisit le système de mésocosmes à utiliser. Le système de mésocosmes sur remorque utilise un nombre de poissons plus grand dans chaque répétition, mais il ne permet d’évaluer que les effets de l’exposition dans l’eau ambiante, et les critères d’effets mesurés sont la condition, le taux de survie, la taille des organes des adultes et la croissance des juvéniles, ce dernier paramètre étant un substitut de la taille selon l’âge. Les mésocosmes modulaires utilisent moins de poissons par répétition, mais permettent d’évaluer l’exposition multitrophique et/ou l’exposition dans l’eau ambiante, et permettent en outre de limiter l’analyse à une portion du cycle vital, de l’accouplement à la production des petits en fonction du temps avec une espèce à fraies répétées comme le Méné à grosse tête. Les paramètres servant à évaluer la reproduction, comme le nombre cumulatif d’œufs pondus par femelle et par jour, peuvent être répétés dans le temps, et les distributions de la production d’œufs peuvent être évaluées pour chaque traitement à l’aide de tests statistiques basés sur la distribution comme le test de Kolmorogov-Smirnov.
9.2.5.4.2 Données préalables (historiques) disponibles
Lorsque les données sont disponibles, on peut calculer la taille de l’échantillon requis pour mesurer l’ampleur de l’effet dans un paramètre donné au niveau de puissance statistique visé, car on connaît la variabilité de l’échantillonnage. Ainsi, il faudra utiliser un grand nombre d’échantillons si les paramètres sont très variables, si l’on cherche à déceler de petites différences entre les échantillons témoins et exposés (faible ampleur de l’effet) ou si l’on veut obtenir un niveau de puissance élevé. Pour déterminer la taille de l’échantillon à partir des données existantes, il faut d’abord déterminer l’ampleur de l’effet et le niveau de puissance statistique acceptable aux fins du processus de prise de décisions, cette étape ayant pour but d’établir à quel moment le programme d’échantillonnage fournit suffisamment de données pour étayer la prise de décisions. La taille de l’échantillon peut être calculée à partir des méthodes décrites aux chapitres 3 et 4. L’annexe 1 du document d’Environnement Canada (1997) décrit en détail les rapports de puissance, l’ampleur de l’effet et les avantages de réduire la variabilité en augmentant la puissance. Pour calculer la puissance, il est recommandé de fixer les valeurs de α et β à 0,10.
9.2.6 Évaluation des effets sur les poissons
9.2.6.1 Plan d’étude
9.2.6.1.1 Choix des espèces
Les principaux facteurs qui influent sur le choix des espèces de poissons pour les études en mésocosmes sont la pertinence de l’espèce par rapport au milieu étudié, l’abondance de l’espèce aux fins de l’échantillonnage, la disponibilité d’adultes et de juvéniles, le dimorphisme sexuel, la période de fraie et la sensibilité de l’espèce à l’effluent. La méthode recommandée pour évaluer les effets d’un effluent lors d’études en mésocosmes réalisées avec le système mobile de mésocosmes consiste à surveiller les adultes avant la période de fraie (poissons sexuellement matures), ainsi que les juvéniles d’une espèce de petite taille (p. ex., dards, ménés, chabots) présents dans le milieu récepteur. Le suivi des adultes permet d’évaluer les effets de l’effluent sur la survie, les paramètres liés à la reproduction (utilisation de l’énergie) et la condition (stockage d’énergie). De même, le suivi des juvéniles renseigne sur les effets de l’effluent sur la survie, la consommation d’énergie (c.-à-d. la croissance comme substitut de la taille selon l’âge) et le stockage d’énergie (c.-à-d. l’état et la taille du foie).
La sélection des espèces pour les études en mésocosmes est limitée par des facteurs reliés à la taille (le nombre de poissons par bassin diminue à mesure que leur taille augmente) et au dimorphisme sexuel (s’il est impossible de distinguer les mâles des femelles par leur apparence, il faut en utiliser davantage pour s’assurer que la taille de l’échantillon est suffisante). Les mésocosmes sont les systèmes les mieux adaptés aux études portant sur les espèces de poissons de petite taille. Les espèces échantillonnées doivent également convenir à l’évaluation des variables recommandées. Les espèces de poissons qui ont été utilisées jusqu’à maintenant pour des études en mésocosmes incluent le Choquemort, le Saumon atlantique juvénile, le Chabot visqueux, le Mulet à cornes, le Naseux des rapides et le Méné à grosse tête (tableau 9-1).
Les avantages et les inconvénients liés à l’utilisation d’espèces de petite taille pour les études sur le terrain sont décrits dans Gibbons et al., (1998a, 1998b), un poisson de petite taille faisant référence à une espèce mesurant au plus 150 mm de longueur. On peut trouver de l’information sur la croissance maximale des espèces de poissons dans la documentation scientifique, notamment dans Scott (1967), Scott et Crossman (1974), Fritz et al. (1975), Roberts (1988), Nelson et Paetz (1992), Jenkins et Burkhead (1993), Coad (1995) et Leblanc et Couillard (1995). Les espèces de petite taille sont habituellement plus abondantes, plus faciles à capturer et plus sédentaires que les espèces plus grosses. Il est souhaitable d’utiliser des espèces dont l’aire de répartition est plus restreinte, puisque cela contribue à accroître la probabilité et la régularité de l’exposition aux effluents comparativement à la situation des espèces plus grosses et plus mobiles qui peuvent migrer.
Cependant, l’utilisation de poissons de petite taille peut aussi comporter des inconvénients. Ainsi, on en connaît souvent moins sur leur biologie de base, en particulier sur leurs habitudes de fraie, d’où la difficulté de déterminer les meilleures zones, périodes et méthodes d’échantillonnage. Toutefois, grâce aux données très nombreuses recueillies sur les espèces de poissons de petite taille dans le cadre du Programme d’ESEE et aux nombreuses recherches effectuées au Canada, nos connaissances sur les stratégies de survie et les caractéristiques biologiques fondamentales de ces espèces se sont sensiblement enrichies (K. Munkittrick, Université du Nouveau-Brunswick, inédit). Certaines espèces sont des reproducteurs à pontes multiples (plus d’une ponte d’œufs matures par année) (Heins et Rabito, 1986; Burt et al., 1988; Paine, 1990), ce qui peut être un inconvénient pour les études sur le terrain, car il est difficile d’estimer l’effort de reproduction chez ces espèces à partir d’un seul échantillon. Il peut y avoir renouvellement presque complet des tissus reproducteurs entre les pontes (c.-à-d. il y aura ponte de la majeure partie de la masse d’œufs produite dans l’ovaire, puis formation d’une nouvelle masse d’œufs matures). Le nombre de pontes durant la saison de fraie devient la variable de reproduction déterminante, qu’il est toutefois difficile d’estimer pour une femelle donnée sur le terrain, même en procédant à de fréquents échantillonnages. Malgré tout, des poissons à pontes multiples comme le Choquemort ont été utilisés avec succès dans des études en mésocosmes visant à évaluer les effets d’un effluent sur les critères d’effets d’ESEE, y compris sur la taille des gonades (Dubé et MacLatchy, 2000a; Cash et al., 2003; Dubé et al., 2001). Un des avantages des études en mésocosmes avec exposition contrôlée est qu’il est possible de surveiller l’état des reproducteurs à ponte fractionnée tout au long de la période d’exposition.
Les progrès les plus récents de la technologie des mésocosmes et de ses applications en systèmes modulaires ont été réalisés avec le Méné à grosse têtedans des essais d’exposition du cycle vital partiel d’une durée de 21 à 30 jours (tableau 9-1). Les systèmes mobiles de mésocosmes (sur remorque) se sont montrés utiles pour l’évaluation des effets des effluents. Toutefois, ces systèmes sont limités à l’étude de l’exposition dans le milieu aquatique ambiant, ce qui en réduit la pertinence écologique. Il est d’usage courant de mesurer l’exposition dans l’eau ambiante pour les évaluations toxicologiques de poissons exposés à un seul contaminant, mais étant donné la nature des mélanges complexes d’effluents, il convient de tenir compte également des voies d’exposition alimentaires. Par exemple, de nombreux travaux ont examiné l’importance du transfert trophique des métaux (Ni et al., 2000; Chen et al., 2000; Mason et al., 2000; Xu et Wang, 2002) dans les milieux aquatiques. Ainsi, il serait souhaitable de perfectionner les systèmes de mésocosmes pour tenir compte également de l’exposition par voie alimentaire. En outre, il pourrait également s’avérer souhaitable de pouvoir évaluer directement la reproduction (nombre d’œufs produits, nombre de fraies et survie des jeunes, taux d’éclosion et difformités) après une exposition aux effluents en plus de la mesure des critères d’effets d’ESEE aux fins de l’étude des causes.
Le Méné à grosse tête est l’espèce par excellence des études toxicologiques en laboratoire, parce qu’il constitue un représentant écologiquement important de la famille des Cyprinidés, et comme il a fait l’objet de très nombreux essais, il existe une vaste quantité de données concernant son élevage et son cycle vital (Panter et al., 2002; Ankley et al., 2001; Jensen et al., 2001). Cette espèce est aussi utilisée dans les études d’évaluation des risques et de surveillance menées par les autorités publiques et l’industrie à l’échelle internationale (U.S. EPA, 1982, 1996, 1999, 2002; OCDE, 2001; Shaw et al., 1995a, 1995b). De plus, le Méné à grosse tête est une espèce de petite taille (longueur moyenne de 6 cm et largeur de 1 cm), à ponte fractionnée effectuée sur le substrat et qui, dans des conditions précises, peut être facilement manipulée en captivité pour produire des masses de 50 à 150 œufs tous les trois à cinq jours. Il s’agit par ailleurs d’une espèce pertinente sur le plan écologique, qui est abondante dans les milieux d’eau douce d’un bout à l’autre du Canada. Ainsi, la mise au point d’un système de mésocosmes fondé sur le Méné à grosse tête capable de mesurer les critères d’effets d’ESEE et de permettre une évaluation directe des effets des mélanges d’effluents sur la reproduction peut s’avérer extrêmement utile dans les cas où les études sur le terrain sont irréalisables. En outre, des mésocosmes auto-entretenus (indépendants des sources de nourriture de l’extérieur), dans lesquels les poissons et leur nourriture sont cultivés simultanément, permettant d’étudier l’exposition des poissons par voie alimentaire, en plus de l’exposition dans le milieu aquatique ambiant (c.-à-d. mésocosmes multitrophiques), pourraient s’avérer hautement pertinents.
Ankley et al. (2001) ont élaboré un bioessai à court terme basé sur le Méné à grosse tête, qui permet d’évaluer la reproduction et certains aspects des premières étapes du développement dans un délai plus court que les bioessais classiques. La durée de l’essai portant sur le cycle vital partiel (21 jours) se prête bien aux études en mésocosmes. Plusieurs chercheurs ont utilisé le bioessai de 21 jours pour étudier les effets des substances œstrogènes (Harries et al., 2000; Ankley et al., 2001; Sohoni et al., 2001), androgènes (Ankley et al., 2003) et anti-androgènes (Jensen et al., 2004). Ces études ont surtout mis l’accent sur des contaminants uniques qui ne représentent pas la complexité des effluents. Quelques chercheurs ont porté leur attention sur les effets d’effluents industriels en utilisant le bioessai de 21 jours (Martel et al., 2003; Parrott, 2005), mais ces études ont utilisé des méthodes différentes (p. ex., nombre de répétitions indépendantes, nombres et types de variables mesurées) et ont été réalisées en laboratoire, avec exposition au milieu aquatique ambiant.
L’utilisation du bioessai de 21 jours avec le Méné à grosse tête en mésocosmes pour les ESEE nécessitait d’abord une installation sur le terrain avec un approvisionnement en eau réceptrice naturelle, tout en pouvant régler la température et la photopériode (Rickwood et al., 2006a; 2006b). Comme le bioessai du cycle vital de C. tentans avait déjà été élaboré pour le système modulaire de mésocosmes (Hruska et Dubé 2004; 2005), il ne s’agissait plus que de combiner ces essais en un seul test multitrophique en mésocosmes, utilisable dans le système modulaire de mésocosmes. Ceci a d’abord été réalisé en laboratoire dans des conditions contrôlées de température de l’eau (Rickwood et al., 2006c), puis transposé sur le terrain dans des conditions de température et de photopériode ambiantes, en utilisant l’eau de référence ambiante (Pollock et al., 2009; Rickwood et al., 2008). Les Ménés à grosse tête utilisés pour ces études avaient été élevés en laboratoire et transportés sur le site, afin d’assurer une maîtrise adéquate de la qualité des poissons, de leur âge, de l’état de développement de leur système reproducteur et du degré (ou de l’absence) d’exposition.
9.2.6.1.2 Indicateurs d’effets
Système de mésocosmes sur remorque : Les indicateurs d’effets mesurés sur le poisson sont les mêmes, que l’étude soit menée sur le terrain ou en mésocosmes. Les effets sur la croissance, la reproduction, la condition et la survie de la population servent à évaluer si l’effluent a une incidence sur la population de poissons. La survie, la croissance et la reproduction (utilisation de l’énergie) et la condition (stockage d’énergie) sont des mesures qui peuvent permettre de déceler un effet relié à l’effluent, et toutes ces mesures peuvent être prises sur des poissons exposés aux effluents dans le cadre d’études en mésocosmes (tableau 9-2).
La croissance est la variation de la taille (poids ou longueur) en fonction du temps ou de l’âge. Les études en mésocosmes menées sur une période d’exposition plus longue (45 à 60 jours) peuvent évaluer les effets de l’effluent sur la croissance des juvéniles, et plus particulièrement les changements du poids corporel total et de la longueur par rapport aux poissons témoins. Pour les études en mésocosmes, la croissance est mesurée chez les jeunes de l’année ou les juvéniles, du début à la fin de l’étude, soit pendant six à huit semaines selon la température durant l’étude. Si les effets sur la croissance doivent être déterminés à partir d’une période d’exposition plus courte, les études doivent alors être réalisées lorsque la température de l’eau est chaude, sur une espèce-sentinelle à taux de croissance élevé. Kneib et Stiven (1978) ont démontré que les juvéniles du Choquemort, par exemple, ont un taux de croissance très élevé après l’éclosion (gain de 15 mm en deux mois), ce qui en fait une espèce idéale pour évaluer les effets d’un effluent sur la croissance. Selon des études réalisées sur des jeunes de l’année du Chabot visqueux, les effets sur la croissance peuvent être mesurés après 26 jours seulement d’exposition aux effluents (Dubé et al., 2005), et bien que l’on mesure également la longueur et le poids des adultes, il est peu probable que les sujets adultes grossissent pendant la courte durée des études en mésocosmes.
| Indicateurs d’effets | Critères d’effets et critères d’appui | Test statistique |
|---|---|---|
| Croissance |
| ANOVA |
| Reproduction |
| ANCOVA |
| Condition | Condition des juvéniles et des adultes :
| ANCOVA |
| Survie | Survie des juvéniles et des adultes
| ANOVA |
© M. Dubé
* Critères d’effets des études en mésocosmes utilisés pour établir la présence ou non d’effets, un effet étant défini comme une différence statistiquement significative entre les données des zones exposées et celles des zones de référence. Des critères d’appui peuvent aussi être utilisés pour appuyer les analyses.
| Type de réponse | Variable réponse | Variable dépen- dante (Y) | Variable indépen-dante (X) | Cova-riable (X) | Méthode statis- tique à un facteur | Méthode statis- tique à deux facteurs |
|---|---|---|---|---|---|---|
| Étape de l’essai : avant l’exposition (poissons répondant aux critères de sélection) | ||||||
| Utilisation d’énergie (adultes) | Production totale moyenne d’œufs (nombre) | Nombre total moyen d’œufs par groupe de reproduc- teurs | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Production moyenne d’œufs (nombre) | Nombre moyen d’œufs/ femelle/ jour | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Nombre cumulé d’œufs/ femelle/ jour | Nombre cumulé d’œufs/ femelleJours | Jours | S.O. | Kolmogorov-Smirnov | Kolmogorov-Smirnov | |
| Nombre total moyen de fraies | Nombre total moyen de fraies par groupe de reproducteurs | Traite- ment | S.O. | Khi-carré | Khi-carré | |
| Jeunes | Taux de fécondation (%) | Nombre d’œufs fécondés/ œufs pondus × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Étape de l’essai : exposition | ||||||
| Survie des adultes | Taux moyen de survie des adultes (%) | Nombre d’adultes vivants/ nombre d’adultes au départ × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Stockage d’énergie (adultes) | Condition (g/cm) | Poids corporel total (log) | S.O. | Lon- gueur (log) | ANCOVA | ANCOVA (deux critères de class.) |
| Taille relative du foie (g) | Poids du foie (log) | S.O. | Poids corporel total (log) | ANCOVA | ANCOVA (deux critères de class.) | |
| Poids du foie (log) | S.O. | Lon- gueur (log) | ANCOVA | ANCOVA (deux critères de class.) | ||
| Taille relative des œufs (µm) | Taille moyenne des œufs (log) | S.O. | Poids corporel total (log) | ANCOVA | ANCOVA (deux critères de class.) | |
| Taille moyenne des œufs (log) | S.O. | Lon- gueur (log) | ANCOVA | ANCOVA (deux critères de class.) | ||
| Stockage d’énergie (adultes) (Si l’ANCOVA est irréalisable à cause d’un étalement insuffisant sur l’abscisse) | Coefficient de condition moyen (%) | Poids corporel total/ (longueur)3 * 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Indice hépato- somatique (%) | Poids du foie/ poids corporel * 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Indice gonado- somatique (%) | Poids des gonades/ poids corporel * 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Utilisation de l’énergie (adultes) | Poids corporel total (g) | S.O. | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Longueur à la fourche (cm) | S.O. | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Taille relative des gonades (g) | Poids des gonades (log) | S.O. | Poids corporel total (log) | ANCOVA | ANCOVA (deux critères de class.) | |
| Poids des gonades (log) | S.O. | Lon- gueur (log) | ANCOVA | ANCOVA (deux critères de class.) | ||
| Nombre cumulé d’œufs/ groupe de reproduc-teurs/ jour | Nombre cumulé d’œufs/ groupe de reproducteurs | Jour | S.O. | Kolmogorov-Smirnov | Kolmogorov-Smirnov | |
| Production totale moyenne d’œufs/ jour | Nombre total moyen d’œufs/ femelle/jour | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Production moyenne d’œufs/ jour | Nombre moyen d’œufs/ femelle/jour | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Nombre cumulé de fraies/ groupe de reproduc-teurs/ jour | Nombre cumulé de fraies/ groupe de reproduc- teurs | Jour | S.O. | Kolmogorov-Smirnov | Kolmogorov-Smirnov | |
| Nombre total moyen de fraies/ jour | Nombre total moyen de fraies/ femelle/jour | Traite- ment | S.O. | Khi-carré | Khi-carré | |
| Fécondité relative (nombre) | Nombre d’œufs/ femelle (log) | S.O. | Poids corporel total (log) | ANCOVA | ANCOVA | |
| Nombre d’œufs/ femelle (log) | S.O. | Lon- gueur (log) | ANCOVA | ANCOVA | ||
| Autres paramètres de la reproduction des adultes | Dévelop-pement des caractères sexuels secondaires | Présence/ absence de tubercules; bandes; taches sur nageoires; coussinet | Traite- ment | S.O. | Khi-carré | Khi-carré |
| Rang de la taille de l’ovipositeur | Traite- ment | S.O. | Khi-carré | Khi-carré | ||
| Hormones reproduc-trices | Testostérone M/F (ng/g) | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Œstrogène F (ng/g) | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | ||
| Vitellogenine M (ng/g) | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | ||
| Histologie des gonades | Nombre et stade des cellules | Traite- ment | S.O. | Khi-carré | Khi-carré | |
| Jeunes | Taux moyen d’éclosion (%) | Nombre d’œufs éclos/ nombre d’œufs fécondés × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Taux moyen de difformités (%) | Nombre total de difformités à l’éclosion/ nombre total de larves × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Taux moyen de fécondité (%) | Nombre d’œufs fécondés/ œufs pondus × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Taux moyen de survie des larves (%) | Nombre de larves survivantes après 5 jours/nombre total de larves × 100 | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Nombre moyen de jours à l’éclosion | Nombre moyen de jours à l’éclosion | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Paramètres chimiques de l’eau | Mesures in situ | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) | |
| Tissus des poissons – charge corporelle | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Tissus des poissons – gonades | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Tissus des poissons – branchies | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Tissus des poissons – foie | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Tissus des chironomidés | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Tissus des algues | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
| Analyses des sédiments | Analyses en laboratoire | Diverses | Traite- ment | S.O. | ANOVA (un critère de class.) | ANOVA (deux critères de class.) |
© M. Dubé
Légende : F : femelle; M : mâle; S.O : sans objet; class.: classification.
La reproduction peut être exprimée en fonction de l’effort de reproduction, de la fécondité, de la taille des œufs ou du poids des gonades par rapport à la taille corporelle. Jusqu’à maintenant, les effets des effluents sur la fonction reproductrice ont été évalués en mésocosmes en fonction des variations de la taille des gonades. La fécondité et la taille des œufs sont également faciles à mesurer lorsque la période d’échantillonnage est choisie avec soin. Idéalement, les études d’exposition devraient commencer de six à huit semaines avant la fraie, pour évaluer les effets de l’effluent sur le poids des gonades.
L’état physique du poisson est également évalué durant une étude en mésocosmes. Il est ainsi requis de faire une estimation visuelle des malformations physiques, y compris des lésions à la surface du corps comme les nageoires érodées, effilées ou qui saignent, la présence de parasites ou autres malformations physiques.
Système de mésocosmes modulaire : Les variables réponses mesurées dans le système modulaire, qui a été principalement utilisé avec le Méné à grosse tête, sont résumées -- avec les méthodes d’analyse statistique suggérées -- au tableau 9-3. Les variables recommandées sont surlignées en gris. Les autres sont variables qui ont été mesurées dans le cadre de divers plans d’études et qui pourraient être inclues à titre complémentaire. Il importe de noter que l’utilisation de la méthode normalisée de bioessai de la reproduction sur 21 jours d’Ankley et al. (2001) a été modifiée afin de mieux s’adapter au contexte du Programme d’ESEE, notamment pour pouvoir servir de méthode de remplacement du suivi des poissons. Les méthodes décrites ci-dessous sont toujours en voie de validation et de normalisation par le Comité scientifique des ESEE. Les mines qui comptent utiliser cette méthode de remplacement devraient s’attendre à évaluer les variables réponses à mesurer et à inclure des variables d’appui pour adapter et améliorer cette méthode afin de l’utiliser dans leur Programme d’ESEE.
9.2.6.1.3 Période et durée de l’exposition aux effluents
Il est important de choisir avec soin la période de l’étude en mésocosmes, en tenant compte de l’espèce retenue pour l’étude. La température de l’eau influe sur le plan expérimental. Si l’étude se déroule au printemps, alors que l’eau est froide, le temps d’exposition risque d’être plus long, en particulier pour la mesure d’une réponse comme la croissance. Les essais ne sauraient être effectués à une température inférieure à –5 °C à cause du gel des conduites d’eau.
Les études en mésocosmes devraient tendre vers un équilibre entre la durée et la rentabilité. Les durées d’exposition de 21 à 45 jours sont monnaie courante pour les communautés d’invertébrés benthiques dans l’un ou l’autre des systèmes de mésocosmes. Des périodes d’exposition de 21 jours sont habituelles pour l’essai fondé sur le cycle vital partiel avec le Méné à grosse tête en guise d’espèce-sentinelle dans le système de mésocosmes modulaire. Les essais d’exposition dans le milieu aquatique ambiant en système mobile prennent souvent une période d’exposition de 30 jours en été et en automne et servent notamment à mesurer les changements de la taille des organes adultes (foie et gonades) et du taux de croissance des jeunes de l’année du Chabot visqueux, après exposition à un effluent.
Toutes les études en mésocosmes devraient être réalisées durant les périodes d’exploitation normales de l’entreprise. Les effluents devraient être représentatifs de conditions d’exploitation normales. De même, les études en mésocosmes ne devraient pas être menées s’il n’y a pas eu de rejet d’effluent pendant une longue période, ni durant une période de perturbation du système de traitement des eaux usées. Il convient de veiller à ce que les périodes de fermeture prévues soient annoncées longtemps à l’avance et à ce qu’elles ne nuisent pas aux études.
Système de mésocosmes sur remorque : Il est important de choisir avec soin la période de l’étude en mésocosmes, en tenant compte du cycle de fraie de l’espèce de poisson. Pour en savoir plus sur les cycles de fraie et l’échantillonnage saisonnier, consulter le chapitre 3. Idéalement, pour les reproducteurs du printemps, les études commenceront de six à huit semaines avant le début de la fraie. Si l’espèce fraye tôt au printemps et donc qu’il est impossible de l’étudier aussi longtemps avant la période de la fraie, les études doivent être menées le plus tard possible durant l’année pour permettre la sénescence et la recrudescence des gonades. Pour les reproducteurs de l’automne, l’étude peut être menée au printemps ou à l’été, sauf peut-être pour les espèces dont les œufs arrivent à maturité rapidement. Par exemple, certains cyprins qui frayent à la fin du printemps devraient être étudiés au début du printemps, plutôt qu’à l’automne, lorsque leurs œufs peuvent encore être immatures. La température de l’eau est un autre facteur à considérer pour déterminer la période de l’étude, si le taux de croissance des juvéniles est plus élevé durant les mois d’été.
Système modulaire de mésocosmes : Lorsque ce système est utilisé avec le Méné à grosse tête, il doit être installé sur place de 10 à 14 jours avant la période d’exposition (cette période dépend du temps qu’il faut au poisson pour répondre aux critères de sélection de base appropriés) et y reste pendant la période d’exposition de 21 à 30 jours. Les études devraient être effectuées de mai à la fin de septembre, lorsque la température de l’eau et de l’air se situe entre 15 et 28 °C.
9.2.6.2 Méthodologie relative au poisson
9.2.6.2.1 Installation générale - Système de mésocosmes sur remorque
Après que le système de mésocosmes a été amené sur les lieux de l’étude et qu’il a été branché aux réseaux d’alimentation en eau de référence et en électricité, le substrat peut être introduit dans les bassins, et le débit d’eau, étalonné. Selon les caractéristiques du substrat propre au site, une couche de 5 cm de gravier concassé ou de sable lavé peut être ajoutée dans chaque bassin. Lors d’études précédentes, de grosses roches lavées ont aussi été ajoutées dans chaque bassin pour servir de refuge aux poissons.
Les poissons sont prélevés d’une zone de référence, non exposée à l’effluent à l’étude. La collecte doit bien sûr se faire par des méthodes de prélèvement non létales, par exemple à l’aide de pièges à ménés ou de trappes en filet ou par la pêche à l’électricité avec filets de retenue (Portt et al., 2006). Les poissons sont habituellement triés sur le terrain pour s’assurer que l’on a prélevé un nombre suffisant de juvéniles ainsi que d’adultes de chaque sexe (si l’espèce est dimorphe), et que les poissons recueillis sont de classe de taille similaire. Si l’espèce choisie n’est pas sexuellement dimorphe, les rapports des sexes sur le terrain sont supposés égaux, et les poissons sont répartis de façon aléatoire entre les bassins. Les poissons sont transportés dans la zone d’étude dans des contenants munis de couvercles et suffisamment aérés. S’il n’existe aucune zone de référence, des poissons d’élevage peuvent être utilisés si leur espèce est présente dans la zone à l’étude.
Sur les lieux de l’étude – de préférence le même jour – les poissons sont mesurés (longueur et poids), puis sont répartis de façon aléatoire entre les bassins. Le degré de précision des mesures doit être conforme aux exigences définies dans le chapitre 3, le niveau de précision étant plus élevé pour les espèces de petite taille. Le nombre optimal de poissons par bassin est de 20 adultes de chaque sexe et de 20 à 30 juvéniles. Pour assurer une répartition aléatoire des poissons entre les bassins, 16 seaux aérés contenant de l’eau de référence sont installés. Chaque poisson est mesuré puis déposé dans un des seaux, jusqu’à ce que chaque seau contienne un poisson. Ce processus est répété jusqu’à ce que tous les seaux renferment chacun cinq poissons. Les seaux sont alors répartis de façon aléatoire entre les bassins, et la procédure est répétée jusqu’à ce que l’on ait atteint le nombre voulu d’échantillons par bassin. Il est essentiel de suivre cette procédure pour s’assurer, par exemple, que les poissons les plus gros ne se retrouvent pas tous dans les premiers bassins.
La répartition des poissons peut se faire selon l’un des deux scénarios suivants. Les adultes et les juvéniles peuvent être placés dans les mêmes bassins, si le taux de croissance des juvéniles est déterminé uniquement en fonction de la longueur et du poids mesurés au début et à la fin de l’étude et que les adultes ne sont pas cannibales. Cependant, si le taux de croissance des juvéniles doit être évalué tout au long de l’étude (les juvéniles sont peut-être marqués en vue de la prise de mesures répétées durant l’étude), il est recommandé de placer les adultes et les juvéniles dans des bassins différents (ou dans des zones différentes à l’intérieur d’un même bassin si ces zones peuvent être séparées physiquement), afin de réduire au minimum le stress des adultes dû à la capture. Les bassins des mésocosmes sont assignés à chaque traitement (contrôle/effluent) de manière aléatoire, de même que la répartition des poissons dans chacun des bassins. Cela assure une distribution aléatoire minimisant ainsi les différences entre les bassins dues à des facteurs, comme leur emplacement sur la remorque.
Après l’ensemencement, les poissons s’adaptent aux conditions dans le système de bassins artificiels pendant au moins 72 heures, ou jusqu’au moment où les poissons commencent à s’alimenter, avant d’y ajouter l’effluent. Les bassins doivent être recouverts d’un filet pour réduire au minimum la perte de poissons qui s’échapperaient ou qui seraient la proie des oiseaux. Durant la période d’exposition (de 30 à 60 jours), les poissons sont nourris de granulés pour truites à raison de 4 à 6 % du poids corporel total par bassin, par jour, la grosseur des granulés variant en fonction de la taille de l’espèce à l’étude. Lors d’études antérieures, les granulés ont été broyés avant d’être servis aux poissons.
9.2.6.2.2 Installation générale – Système modulaire de mésocosmes
Chacun des systèmes modulaire à mésocosmes est constitué d’une table (une par traitement) sur laquelle sont installés cinq à huit (de préférence) bassins circulaires en polyéthylène haute densité de 10,3 L. L’eau de trop-plein qui s’écoule sur la table se vide dans un réservoir de dilution de 85 L comme décrit précédemment. Si un système à transfert trophique est utilisé, chaque bassin contient une couche de sédiment (sable siliceux lavé), une culture de chironomidés C. tentans, une barrière d’alimentation, un lit de fraie et une paire ou un trio de Ménés à grosse tête reproducteurs (figure 9-6) (Rickwood et al., 2006c, 2008). Les barrières d’alimentation servent à contrôler l’accès des Ménés à grosse tête aux C. tentans qui se sont établis dans le substrat pendant la période de l’étude préalable à l’exposition. Ces barrières sont faites d’un grillage à mailles carrées de 1/8 po (0,32 cm) percé d’une ouverture en pointe de tarte dont la superficie correspond au dixième de la superficie totale du bassin (environ 71 cm2), et qui se déplace tous les deux jours pour permettre aux poissons d’accéder à une quantité appropriée de nourriture (1 g de C. tentans/jour) (voir ci-dessous pour des détails sur la production de quantités appropriées de C. tentans).
Période préalable à l’exposition : Des Ménés à grosse tête de six mois, sexuellement matures mais jamais accouplés, sont obtenus auprès d’un laboratoire d’élevage réputé. Les poissons sont d’ordinaire transportés sur le site par voie terrestre ou aérienne en moins de 24 heures, dans des sacs d’eau oxygénée, emballés dans des boîtes isolantes. À leur arrivée, les sacs sont ouverts et laissés suffisamment de temps pour prendre la température de l’air ambiant. L’eau de référence est ajoutée lentement pour permettre aux poissons de s’acclimater. Les poissons acclimatés doivent être placés dans un réservoir approprié pour une période de stimulation sexuelle préalable à l’essai d’accouplement qui précède l’exposition. Cette période de stimulation devrait durer environ trois jours.
La méthode d’essai en mésocosmes modulaires de Ménés à grosse tête comporte une période préalable à l’exposition et une période d’exposition. La période préalable utilise normalement le double du nombre requis de groupes reproducteurs placés dans des bassins exempts d’effluents afin d’établir le niveau de référence de la performance de reproduction. Au début de la période de reproduction, il faut noter le poids corporel total (g), la longueur à la fourche (mm) et les caractères sexuels secondaires -- bandes, tubercules nuptiaux, coussinet dorsal et taches sur les nageoires chez les mâles, et taille de l’ovipositeur chez les femelles (Parrot et Wood, 2001). Les Ménés à grosse tête femelles sont appariés dans la mesure du possible avec des mâles dont la longueur est similaire (± 25 %) (Pollock et al., 2008). Chaque paire de reproducteurs reçoit deux fois par jour 0,5 g de vers de vase congelés pendant toute la période préalable à l’exposition. Chaque jour avant la distribution de nourriture et l’enregistrement de la qualité de l’eau, les lits de fraie de chaque bassin sont inspectés pour déceler la présence d’œufs. Le cas échéant, les œufs sont délicatement transférés dans des boîtes de Pétri remplies d’eau de référence et photographiés aux fins du comptage numérique. À la fin de l’essai de reproduction, les groupes destinés à la phase d’exposition sont choisis. Les groupes choisis (paires ou trios, selon l’étude) sont ceux qui ont affiché un taux de survie de 100 % des adultes, qui ont produit des œufs au moins une fois dans les sept jours précédents, et qui ont affiché un taux de fécondation des œufs supérieur à 80 % (OCDE, 2006; U.S. EPA, 2007). Un autre critère pouvant être pris en considération est d’exclure les groupes reproducteurs extrêmes (celui qui a produit le plus d’œufs et celui qui en a produit le moins). Les groupes retenus doivent être répartis parmi les traitements et les bassins de manière à minimiser la variance entre les traitements. Des analyses statistiques sont effectuées avant la sélection finale pour vérifier qu’il n’y a pas de différence significative entre les traitements et au sein de chacun d’eux avant le début de l’exposition. L’unité de répétition s’établit à n = 5 à 8 par traitement.
Système de transfert trophique : Le système de transfert trophique et les cultures du chironomidé C. tentans dans les sédimentssont établis pendant la période préalable à l’exposition. Les densités cibles d’invertébrés dans chaque bassin sont fondées sur une quantité optimale quotidienne de nourriture de 1 g/couple reproducteur/jour (Rickwood et al., 2006a, 2006b). Des larves agées de sept jours de C. tentans sont expédiées au site une fois par semaine pendant trois semaines afin d’établir les cultures dans les mésocosmes, avant l’ajout des poissons. Ces larves, fournies par un éleveur réputé, sont exposées aux effluents au moins sept jours avant l’arrivée des poissons pour assurer une exposition par voie alimentaire adéquate. Cette précaution permet en outre d’assurer la présence dans les bassins des divers stades de développement de C. tentans (œufs, larves, pupes, adultes) et de maintenir ainsi un cycle de reproduction sain. Le nombre d’invertébrés requis dans chaque bassin pour assurer la subsistance des poissons pendant 21 jours est calculé à partir du nombre moyen de chironomidés émergeant d’une oothèque (~ 300) et en déterminant le nombre de larves de troisième et de quatrième stade dont le poids combiné atteint 1 g (~ 50). Une fois déterminé le nombre de chironomidés nécessaire pour obtenir 1 g, on calcule le nombre total qu’il faudra pour la période d’exposition entière de 21 jours (50 C. tentans/g × 21 jours = 1050 C. tentans, ou 350 larves de sept jours par bassin et par semaine, pendant trois semaines).
À la livraison, les larves doivent être acclimatées en ajoutant dans les contenants individuels 25 % d’eau de traitement à quatre reprises sur une période de 12 heures. L’acclimatation des larves se fait graduellement à la température ambiante (réduction maximale de 1 °C toutes les une ou deux heures) en plaçant leur contenant dans un bain d’eau froide. Les larves acclimatées à la température ambiante et à l’eau d’effluent sont distribuées dans les bassins et nourries d’une bouillie de Tetramin™ (100 g de flocons Tetramin™ dans 1000 ml d’eau de référence) à raison de 10 ml la première semaine, de 20 ml la seconde semaine, et de 30 ml à partir de la troisième semaine, trois fois par semaine. Il est recommandé de prélever trois carottes de sédiments (superficie de l’échantillonneur d’environ 9 cm2) dans chaque bassin à la fin de la période préalable à l’exposition, avant l’ajout des poissons, afin de pouvoir calculer la densité d’invertébrés.
Plan d’exposition : Après que les Ménés à grosse tête ont été répartis entre les bassins, les solutions de traitement sont distribuées dans les mésocosmes, et la période d’exposition débute.
9.2.6.2.3 Entretien et surveillance
L’entretien quotidien pendant la durée de l’étude inclut l’étalonnage des débits dans chaque bassin, pour s’assurer que l’on obtient les dilutions voulues, ainsi que le nettoyage des grilles et l’alimentation des poissons. Les conduites d’évacuation d’eau de chaque bassin sont grillagées pour éviter la perte de poissons, et ces grilles pourraient avoir besoin d’un nettoyage quotidien.
Il faut vérifier chaque jour s’il y a des poissons morts dans chaque bassin et mesurer divers paramètres physiques et chimiques de l’eau incluant la température, la concentration d’oxygène dissous, la conductivité et le pH. Ces mesures peuvent être prises à l’aide d’instruments YSI Inc. ou d’appareils de lecture continue comme un hydrolab ou une thermistance. L’oxygène dissous est un critère d’une importance vitale, en particulier dans les études sur des effluents à forte teneur en matières organiques (p. ex., les effluents des fabriques de pâtes). Dans tous les bassins, le taux d’oxygène dissous doit être maintenu à au moins 60 % et, de préférence, au-dessus de 80 %, en utilisant, au besoin, un système d’aération.
Dans le cas des systèmes à mésocosmes modulaires, les observations et mesures quotidiennes peuvent inclure la production d’œufs, le succès d’éclosion et la survie des larves (tableau 9-3). Les lits de fraie sont vérifiés chaque jour à la même heure, avant la distribution de nourriture et les mesures de la qualité de l’eau. Les œufs sont retirés et photographiés. On peut également prélever des sous-échantillons réguliers de chaque groupe d’œufs aux fins des analyses futures, en tenant compte de ce prélèvement lors de la détermination de la production d’œufs totale. Les œufs qui restent sont ensuite transférés dans un récipient et placés dans les bassins de culture aérés appropriés remplis d’eau de traitement. Vingt-quatre heures après la fraie, les œufs sont une fois de plus photographiés aux fins du calcul du taux de fécondation. Ils sont ensuite laissés en place jusqu’à l’éclosion ou la mort (~4-5 jours). Les larves écloses sont préservées dans une solution de formol à 10 % afin de les compter et les examiner pour la détection de difformités, s’il s’agit d’un paramètre souhaité pour les évaluations d’appoint.
9.2.6.2.4 Échantillonnage et analyse des poissons
À la fin de la période d’exposition, les poissons sont anesthésiés pour la mesure de la longueur à la fourche (mm), du poids corporel total (g) et pour l’observation des caractères sexuels secondaires. Les poissons sont ensuite euthanasiés par rupture de la colonne vertébrale aux fins de la mesure du poids des gonades, du foie et de la carcasse éviscérée. Il convient d’échantillonner tous les bassins le même jour, et de terminer l’échantillonnage de tous les poissons d’un même bassin, avant de passer au suivant.
Les mesures requises et leur niveau de précision doivent être conformes aux normes prescrites dans le chapitre 3. Les procédures relatives à la préparation des échantillons, aux analyses en laboratoire et à l’AQ/CQ sont les mêmes, pour les études en mésocosmes et sur le terrain.
9.2.6.3 Évaluation et interprétation des données
9.2.6.3.1 Exigences générales
Lors des études en mésocosmes, il doit y avoir évaluation et interprétation des données après chaque étape de suivi ou d’évaluation, comme cela se fait pour les études sur le terrain. L’étape d’évaluation et d’interprétation des données vise à répondre aux questions suivantes :
- y a-t-il un effet?
- l’effet est-il relié à la mine?
- connaît-on l’ampleur et l’étendue de l’effet?
- connaît-on la cause de l’effet relié à la mine?
La section qui suit présente un aperçu de la méthode proposée pour l’analyse et l’interprétation des données pour les études en mésocosmes.
9.2.6.3.2 Analyse statistique des paramètres
Des analyses statistiques des variables biologiques, comme l’indiquent les tableaux 9-2 (pour le système sur remorque) et 9-3 (pour le système modulaire avec le Méné à grosse tête), sont effectuées afin de déterminer s’il y a ou non un effet sur les poissons exposés aux effluents dans le système de mésocosmes. Le tableau 9-3 présente les méthodes d’analyse typiques utilisées dans le cadre de deux types de plans expérimentaux : l’ANOVA à un facteur (c.-à-d. l’effet de l’effluent) ou l’ANOVA à deux facteurs (c.-à-d. l’effet de l’effluent et des sédiments contaminés).
Il est fréquent que des différences entre les sexes du taux de croissance, du poids corporel, du coefficient de condition, de la taille des gonades et de la taille du foie soient observées, car les besoins énergétiques globaux des mâles et des femelles diffèrent. Il faut donc évaluer les deux sexes séparément pour estimer la variabilité de chaque paramètre. De même, les poissons immatures ou juvéniles devraient eux aussi être analysés séparément. Les analyses indiquées aux tableaux 9-2 et 9-3 sont préférables, bien que d’autres analyses portant sur des paramètres précis peuvent aussi être réalisées, selon la variabilité de l’ensemble de données. À titre d’exemple, les sujets utilisés pour l’ensemencement des bassins, dans les études en mésocosmes, sont de taille similaire. Par conséquent, la variabilité des paramètres mesurés est moindre que lors des études sur le terrain. Ainsi, l’étendue des valeurs sur laquelle porte la régression comme l’analyse de covariance est suffisamment étroite pour justifier le recours à une analyse de variance sur les valeurs originales du poids des organes (taille du foie et des gonades) et les mesures de rapport (IHS ou IGS) ou des coefficients de condition.
Nous présentons ci-dessous des détails sur l’analyse statistique des données des mésocosmes. Pour en savoir plus, consulter les documents cités dans le tableau 9-1.
9.2.6.3.3 Analyses de variance hiérarchiques
Pour toute variable mesurée une seule fois sur l’ensemble d’un système de bassins répétés, l’analyse statistique consiste en un simple test t qui compare les traitements (exposition/témoin). Les mésocosmes ou bassins sont les unités de répétition des traitements. Cependant, tous les paramètres biologiques et biochimiques sont mesurés sur des échantillons répétés à un niveau inférieur, c’est-à-dire sur des poissons individuels ou des groupes composés de plusieurs poissons à l’intérieur des bassins. Ces variables peuvent être analysées par l’analyse de variance hiérarchique. Si la variance entre les circuits répétés d’un même traitement (erreur de type I) est élevée par rapport à la variance entre des échantillons uniques ou composites à l’intérieur d’un même bassin (erreur de type II), l’analyse de variance hiérarchique consiste en fait en un test t qui compare les traitements, les moyennes des bassins servant d’observations répétées. Cependant, si l’erreur I est faible par rapport à l’erreur II (p. ex., p > 0,25), alors les deux termes d’erreur peuvent être regroupés pour accroître la puissance du test de comparaison des traitements (en d’autres mots, le poisson individuel ou l’échantillon composite devient maintenant l’unité de répétition, au lieu du bassin).
9.2.6.3.4 Analyses de covariance
La plupart des paramètres sont habituellement analysés à l’aide de l’analyse de covariance, comme le décrit le chapitre 8. Cette méthode est souvent inutile dans les études en mésocosmes, comme il est mentionné précédemment, à moins qu’une disponibilité restreinte de poissons n’empêche la standardisation de la taille et de l’âge.
9.2.6.3.5 Assurance et contrôle de la qualité et analyse des données
On n’insistera jamais assez sur l’importance d’assurer la qualité des données. Il y a certains éléments fondamentaux à respecter relativement au plan d’étude, à la cohérence des méthodes et des mesures, ainsi qu’à la définition des protocoles et des marches à suivre, et ces exigences sont définies en détail dans le chapitre 8.
9.2.7 Évaluation des effets sur la communauté d’invertébrés benthiques
9.2.7.1 Plan d’étude
9.2.7.1.1 Choix des espèces
La communauté benthique constituée pour l’étude en mésocosmes doit être représentative de celle que l’on retrouve dans les zones de référence sur le terrain. Des échantillons de benthos sont prélevés dans la rivière, puis l’ensemble de la communauté est ensemencée dans chacun des bassins du système de mésocosmes. Après avoir comparé la structure de la communauté d’invertébrés benthiques dans les mésocosmes et les zones de référence, Culp et al., (1996, 2001), Podemski (1999) et Culp et al., (2000a) n’ont observé aucune différence écologiquement significative entre les deux structures, ce qui témoigne de l’efficacité de la technique d’ensemencement et de l’utilité du système de mésocosmes pour évaluer les effets d’un effluent sur des communautés d’invertébrés benthiques écologiquement pertinentes.
9.2.7.1.2 Critères d’effets
Tous les critères d’effets (densité totale des invertébrés benthiques, richesse des taxons, indice de régularité de Simpson, indice de similarité [Bray-Curtis]) servant à mesurer les effets d’un effluent sur les invertébrés benthiques dans le cadre des ESEE sur le terrain peuvent aussi être mesurés dans un système de mésocosmes. La diversité, la densité, la proportion ou la présence/absence des taxons sont recommandées pour appuyer l’interprétation des résultats. Ces critères d’effets sont des mesures sommaires choisies pour englober l’éventail des réactions susceptibles d’être causées par l’effluent, y compris des changements de la productivité, la composition des espèces et la biodiversité. La documentation fait état d’un grand nombre d’autres paramètres descriptifs des invertébrés benthiques (pour un examen, voir Resh et McElravy, 1993) qui peuvent être utilisés, s’il y a lieu, dans des conditions particulières au site pour faciliter l’interprétation des effets déterminés à l’aide des critères d’effets précités.
9.2.7.1.3 Période et durée de l’exposition aux effluents
Les études en mésocosmes sur les invertébrés benthiques peuvent être réalisées à n’importe quel moment, entre le début du printemps et la fin de l’automne. La température de l’air est le principal facteur limitant, l’utilisation des mésocosmes étant impossible à une température inférieure à –5 °C à cause du gel des conduites d’eau. Les études devraient toutefois être réalisées à des périodes où l’exposition aux effluents est maximale, afin de reproduire les conditions environnementales les plus réalistes qui soient. De plus, les études devraient être menées à une période de l’année où la diversité des invertébrés benthiques est maximale et où la température de l’eau est propice à leur croissance. S’il existe des données historiques, il serait utile de les examiner et, s’il y a lieu, de réaliser l’étude à une période similaire, afin de pouvoir établir des comparaisons. De même, les études de suivi subséquentes devraient être réalisées à des périodes similaires de l’année, là encore pour assurer la comparabilité des données.
La durée des études en mésocosmes sur les invertébrés benthiques est en général de 30 à 45 jours, ce qui comprend une période d’ensemencement de 7 à 12 jours pour les producteurs primaires et une période d’exposition de 25 à 30 jours aux effluents. Les effluents sont prélevés chaque jour ou tous les deux jours durant les études et doivent être représentatifs des conditions normales d’exploitation de l’usine.
9.2.7.2 Protocole relatif aux invertébrés benthiques
9.2.7.2.1 Système de mésocosmes sur remorque – Installation générale
Les exigences générales précisées aux sections 9.2.3.2 et 9.2.3.3 s’appliquent également aux études sur les invertébrés benthiques. Le débit total recommandé pour l’eau de référence ou l’eau de dilution et l’effluent dans chaque système de bassins artificiels est de 2 L/min. Avec un tel débit, le temps de renouvellement est de deux heures dans chaque bassin (volume du système : 227 L). Un temps de renouvellement de quatre heures a aussi été utilisé pour réduire la quantité d’effluent requis, mais il s’agit du maximum. En effet, il n’est pas recommandé d’avoir un temps de renouvellement plus long à cause des effets qui en résultent sur la température et le taux d’oxygène dissous dans les bassins. Pour les applications sur les invertébrés, la vitesse du courant dans chaque bassin peut être maintenue à l’aide d’un système à hélices entraîné par courroie. Le courant dans chaque bassin est fixé en fonction des conditions propres au site, mais il varie habituellement entre 10 et 20 cm/s.
Avant d’ajouter le substrat, cinq sacs d’échantillonnage (0,1 m2, maille de 500 mm) sont déposés dans le fond de chaque bassin. Ces sacs sont retirés à la fin de l’expérience, ce qui donne cinq sous-échantillons par bassin. Un milieu benthique standard est reproduit à l’intérieur de chaque bassin pour simuler l’habitat dominant dans l’environnement. Jusqu’à maintenant, les études en mésocosmes sur les invertébrés benthiques ont porté principalement sur des habitats fluviaux dominés par des rapides. Le fond de chaque bassin et les sacs d’échantillonnage sont recouverts d’une couche de 8 cm de gravier lavé (pierres d’un diamètre de 1 à 2 cm). Une période de colonisation de 7 à 12 jours est ensuite allouée pour favoriser une croissance algale et microbienne suffisante sur le gravier. Seul un apport en eau est assuré dans les mésocosmes (2 L/min) durant cette période de colonisation. Elle varie en fonction des conditions propres au milieu et elle dépend de la température et de la colonisation des algues de la rivière dans le système.
À l’issue de la période de colonisation, les communautés benthiques sont transférées dans les mésocosmes, ce protocole étant lui aussi propre au site. Nous présentons ci-après un exemple d’un protocole d’ensemencement pour un habitat caractérisé par des rapides sur substrat composé essentiellement de grosses pierres et de gravier (Podemski, 1999; Podemski et Culp, 1996; Culp et Cash, 1995; Culp et al., 1996) (tableau 9-1) :
- De grosses pierres (superficie ~ 535 cm2) sont choisies au hasard dans la zone de référence de la rivière et sont déposées dans les mésocosmes avec le périphyton et les invertébrés qui s’y trouvent. Ces roches ajoutent au substrat et favorisent l’ensemencement des bassins par une communauté naturelle de périphyton et d’invertébrés benthiques.
- Lors du prélèvement, les pierres sont entourées d’un filet en U de 0,1 m2 (maille de 500 mm) (Scrimgeour et al., 1993), puis soulevées avec soin du lit de la rivière et déposées dans un seau contenant de l’eau de la rivière. Le substrat de gravier sous les roches est ensuite remué doucement (jusqu’à une profondeur de 5 cm) pour recueillir tout invertébré qui serait présent sous et autour de la base des roches. Le seau est ensuite transporté avec soin jusqu’au système de mésocosmes, en évitant de déloger le périphyton et les invertébrés présents sur les roches. Par la suite, les pierres sont réparties au hasard entre les bassins et sont placées de manière à ce que leur orientation par rapport à l’écoulement de l’eau rappelle leur orientation dans le milieu naturel. Ce processus se poursuit jusqu’à ce que l’on obtienne la densité voulue de pierres (p. ex., 10 grosses pierres par bassin artificiel), d’après la composition du substrat en milieu naturel. D’autres appareils d’échantillonnage peuvent aussi être utilisés pour ensemencer les bassins avec les communautés benthiques (voir le chapitre 4). Toutefois, l’objectif visé est de reproduire la densité du milieu ambiant dans les mésocosmes. Pour ce faire, il faut déterminer le nombre d’échantillons de la rivière devant être placés dans chaque bassin en divisant la superficie du système de mésocosmes (0,9 m2) par la superficie de l’échantillonneur choisi. Cette répartition aléatoire des sous-échantillons prélevés à partir d’échantillons regroupés permet de s’assurer que la composition des communautés d’invertébrés est similaire dans chaque bassin, et elle limite la variabilité de la composition entre les différents mésocosmes attribuable au mode d’introduction des espèces (Wrona et al., 1982).
- Une autre série d’échantillons benthiques (biote seulement) est prélevée dans la zone de référence et placée dans un contenant commun, pour estimer la composition et la densité initiales. Des sous-échantillons sont ensuite prélevés et ensemencés au hasard dans chaque bassin, jusqu’à ce que la densité des invertébrés dans les bassins se rapproche de la densité en milieu ambiant.
Il est important d’appliquer des protocoles d’ensemencement uniformisés, car la séquence utilisée pour répartir les échantillons prélevés d’une source commune entre les différents mésocosmes peut donner lieu à de grandes différences dans la structure de la communauté, différences qui ne sont aucunement liées aux traitements de l’étude (Drake et al., 1996). La communauté d’essai est constituée de multiples niveaux trophiques établis à partir d’échantillons aléatoires prélevés du cours d’eau à l’étude. Il est donc possible de mesurer des paramètres à l’échelle de la communauté, comme la composition des espèces, le rapport entre la production et la respiration de la communauté et la décomposition. Ces mesures reflètent les effets directs des facteurs de stress et, plus important encore, les effets écologiques indirects qui ne peuvent être simulés par un système à espèce unique ou à chaîne trophique simple (p. ex., changements dans la structure de la communauté dus à la compétition; bioamplification) (Carlisle, 2000).
Après l’ensemencement du biote, une période d’adaptation de 24 à 48 heures est prévue (apport d’eau seulement dans les mésocosmes) avant de commencer l’introduction de l’effluent dans les bassins de traitement.
9.2.7.2.2 Système modulaire de mésocosmes – Installation générale
Le système modulaire décrit plus haut pour les poissons sert également souvent pour les invertébrés benthiques. Il est constitué de tables humides (une par traitement) sur lesquelles sont placés les bassins à circulation partielle et sous lesquelles sont installés les réservoirs de l’eau de traitement pompée dans les bassins. L’eau de rivière, quant à elle, est pompée dans un réservoir de tête, puis pompée dans chacun des réservoirs de tables humides (Culp et al., 2004). L’eau et l’effluent sont pompés dans un collecteur qui en assure la distribution dans les systèmes de bassins artificiels. Les effluents traités sont livrés au système de mésocosmes tous les jours, ou tous les deux à trois jours par camion. Le temps de séjour de l’eau dans chaque réservoir de table s’établit d’ordinaire à une heure pour les études avec invertébrés benthiques; l’eau séjourne environ quatre à cinq minutes dans les bassins. Ce temps de séjour peut varier en fonction de la disponibilité de l’effluent et de l’eau de référence. La vitesse de circulation de l’eau dans les bassins du système modulaire peut être réglée à l’aide de roues à aubes qui génèrent un courant de 11-12 cm/s typique de l’interface substrat-eau dans les rivières. Des cages d’émergence d’insectes sont installées dans chaque bassin, et les tables humides sont abritées sous une toile qui réduit l’intensité lumineuse d’environ 60 % pour mieux simuler l’intensité de lumière que reçoit le substrat dans le cours d’eau.
Les systèmes de bassins artificiels sont conçus pour simuler les communautés d’eau courante typiques des zones de référence. Les réseaux trophiques benthiques sont établis dans tous les traitements et toutes les répétitions en ajoutant dans chaque bassin du substrat prélevé dans une zone de référence non exposée aux effluents. Le substrat est manipulé avec soin de manière à ne pas perturber les microorganismes et les algues qu’il contient. Cette technique permet ainsi d’obtenir dans chaque bassin une croissance algale suffisante pour permettre l’ensemencement des invertébrés en moins de sept jours. Des communautés d’invertébrés benthiques semblables sont établies dans tous les mésocosmes par ensemencement de chaque bassin avec des biotes provenant de la zone de référence située en amont. La superficie échantillonnée permet d’établir dans les mésocosmes des densités initiales d’invertébrés correspondant à environ 1,2 à 1,4 fois les densités naturelles, afin de compenser pour une possible mortalité initiale due à la manipulation. Il faut laisser les communautés d’invertébrés s’acclimater aux conditions expérimentales pendant 24 heures avant d’injecter l’effluent.
9.2.7.2.3 Entretien et surveillance
Système de mésocosmes sur remorque : L’entretien et la surveillance se font conformément au protocole défini pour le poisson à la section 9.2.6.2.3.
Système de mésocosmes modulaire : L’entretien quotidien du système comprend l’étalonnage régulier de toutes les pompes et systèmes d’approvisionnement afin d’assurer un réglage adéquat du débit et du courant. Il convient également de nettoyer fréquemment les grilles des drains et d’éliminer les algues qui poussent sur les parois des bassins pour éviter l’encrassement.
Chaque semaine, des échantillons d’effluent, d’eau de référence et d’eau de traitement sont prélevés aux fins des dosages des substances chimiques, des nutriants et des métaux. Les insectes adultes sont recueillis chaque jour dans les cages d’émergence à l’aide d’un aspirateur et conservés dans une solution d’éthanol à 80 % en prévision d’une identification ultérieure à la famille.
9.2.7.3 Échantillonnage et analyse des invertébrés benthiques
Pour le prélèvement des invertébrés benthiques, les bassins sont également échantillonnés de façon aléatoire pour réduire au minimum les différences dues à la période d’échantillonnage entre les différents bassins répétés d’un même traitement.
Système de mésocosmes sur remorque : Le prélèvement des échantillons d’invertébrés se fait en soulevant les sacs d’échantillonnage déposés au fond de chaque bassin, ce qui résulte en cinq sous-échantillons par bassin. Les sous-échantillons sont ensuite lavés dans un tamis à maille de 500 mm. Le tamisage sur le terrain doit se faire immédiatement après le prélèvement de l’échantillon et avant sa conservation. La taille recommandée du tamis ou des mailles pour toutes les applications du système de mésocosmes en eau douce est de 500 mm. En eau douce, les macroinvertébrés se définissent comme ceux retenus par des mailles de 200 à 500 µm (Slack et al., 1973; Weber, 1973; Wiederholm, 1980; Suess, 1982), bien que les organismes immatures de certains taxons puissent être plus petits et que certains puissent être plus gros au stade adulte. À noter que ce maillage s’applique à l’ensemble du matériel utilisé sur le terrain et en laboratoire (c.-à-d. filet de Nitex des échantillonneurs et série de tamis). Dans certaines circonstances propres au milieu, il peut être souhaitable d’utiliser un tamis de plus petit calibre pour recueillir des organismes plus petits. Voici quelques cas où l’utilisation d’un maillage plus petit (moins de 500 mm) pourrait être indiquée :
- pour établir des comparaisons, si des tamis de maillage plus petit ont été utilisés dans le cadre d’études antérieures sur les invertébrés benthiques du système à l’étude;
- si, pour des raisons d’ordre pratique, l’échantillonnage doit être fait à une période de l’année où les organismes sont très petits. Rees (1984) et Barber et Kevern (1974) fournissent plus de précisions sur les variations saisonnières de l’efficacité du tamisage.
Dans les cas précités, il est fortement recommandé d’utiliser une série de tamis superposés dont le maillage satisfait tout au moins au calibre obligatoire et d’utiliser tout autre maillage plus petit, s’il y a lieu. De cette façon, on tient compte non seulement des enjeux particuliers au milieu, mais aussi des objectifs du Programme d’ESEE, car l’utilisation de tamis de maillage normalisé permet d’effectuer des comparaisons nationales ou régionales.
Système modulaire de mésocosmes : Les invertébrés benthiques sont récupérés à la fin de l’expérience par rinçage du contenu entier de chaque bassin dans un tamis à mailles de 250 mm, et les échantillons sont conservés dans une solution de formol à 10 %. Au laboratoire, les invertébrés benthiques sont triés sous grossissement 12X, identifiés à la famille et comptés.
Toutes les statistiques sommaires et mesures descriptives doivent être calculées et présentées au niveau de la famille, en vue de la production des rapports d’interprétation exigés aux fins du Programme d’ESEE (voir section 4.6.2 du chapitre 4). Les organismes qui ne peuvent être identifiés au niveau taxonomique voulu sont classés dans une catégorie distincte, dans l’ensemble de données de base. Il est recommandé que les chercheurs utilisent les clés taxonomiques qui conviennent à la région géographique à l’étude; une liste détaillée des références taxonomiques pour les divers groupes d’organismes dulcicoles est présentée au chapitre 4.
9.2.7.4 Évaluation et interprétation des données
L’étude en mésocosmes utilisée comme méthode de suivi de rechange pour l’évaluation des effets d’un effluent sur la communauté d’invertébrés benthiques suit essentiellement le protocole défini dans le chapitre 8 pour l’évaluation et l’interprétation des données obtenues lors des études sur le terrain, puisque les critères d’effets sont les mêmes. La seule différence au niveau de l’évaluation des données a trait au nombre de répétitions par traitement : pour les études en mésocosmes, n = 8 selon le protocole contrôle-impact, alors que n = 5 pour les études sur le terrain.
Durant l’évaluation des effets, toute différence significative entre la zone de référence et la zone d’exposition, en regard de l’un ou l’autre des critères d’effets suivants, doit être interprétée comme un effet sur la communauté d’invertébrés benthiques : densité totale des invertébrés benthiques, richesse des taxons, indice de régularité et indice de similarité (REMM, Annexe 5, article 1).
La diversité, la densité, la proportion ou la présence ou l’absence des taxons sont recommandées pour appuyer l’interprétation des résultats. Le calcul de ces paramètres est décrit en détail dans le chapitre 4 portant sur l’étude des communautés d’invertébrés benthiques. Les analyses statistiques, les méthodes d’AQ/CQ des données et les exigences en matière de production de rapports sont les mêmes que pour les études sur le terrain, l’hypothèse étant qu’un traitement en mésocosmes équivaut à une zone exposée, tandis que chaque bassin artificiel répété correspond à une station répétée sur le terrain.
9.2.8 Mesures complémentaires
9.2.8.1 Paramètres physicochimiques de l’eau
Dans les études en mésocosmes, il est essentiel de réduire au minimum les différences de paramètres physiques et chimiques de l’eau entre les bassins, afin que les effets attribués à l’effluent ne soient pas dus à des facteurs de confusion. La température, le taux d’oxygène dissous, le pH et le débit d’entrée de l’eau et de l’effluent sont donc vérifiés tous les jours. Il faut aussi mesurer la vitesse du courant au début et à la fin de chaque étude, en particulier dans les études sur les invertébrés benthiques. La distribution de la vitesse du courant entre les bassins est caractérisée en utilisant une des nombreuses marques de courantomètres. Lors d’études précédentes, la vitesse moyenne dans les mésocosmes (au-dessus du substrat rocailleux) (x = 0,26 ± 0,01 m/s, n = 150) a été réglée de manière à être similaire à la vitesse du courant mesurée au-dessus des pierres, à une profondeur similaire sur le terrain (vitesse du courant : x = 0,26 ± 0,01 m/s; profondeur de l’eau : x = 24,8 ± 0,72 cm, n = 30) durant la période pendant laquelle l’étude a été effectuée (Podemski, 1999).
La température de l’eau peut être mesurée avec un enregistreur de données en continu. Pour ce faire, on place des enregistreurs dans un bassin et dans le réservoir de tête, la température dans le réservoir de tête correspondant à la température de l’eau puisée de la rivière. Selon les données recueillies à l’aide de thermographes placés à ces deux endroits lors d’études précédentes, un temps de séjour de deux heures dans les bassins provoque un léger refroidissement ou réchauffement de l’eau, selon les températures de l’air ambiant (Culp et Podemski, 1996). Par exemple, sur une période de trois jours, l’eau dans les bassins était plus froide la nuit et plus chaude le jour que l’eau de la rivière, l’écart maximal instantané entre la température de l’eau dans la rivière et les bassins étant < 5 °C.
9.2.8.2 Paramètres complémentaires de la qualité de l’eau
En plus d’évaluer les variations quotidiennes des paramètres physiques et chimiques de l’eau entre tous les bassins, il faut prélever d’autres échantillons d’eau – bien qu’à une fréquence moindre – pour l’analyse des paramètres chimiques généraux. Il est recommandé de prélever des échantillons du réservoir de tête qui contient l’eau de référence, de l’effluent non dilué et de chaque mésocosme, une fois à la fin de l’étude. Les échantillons devraient être analysés pour les paramètres définis dans le chapitre 5. Cette information s’avère souvent d’une valeur inestimable pour confirmer la dilution de l’effluent dans les systèmes de traitement. Par exemple, dans des systèmes d’eau douce exposés à des effluents de fabriques de pâtes et papiers, le sodium est un ion relativement persistant qui est présent en fortes concentrations. En comparant les concentrations de Na+ dans les bassins de référence et les bassins d’exposition, il est possible de vérifier la concentration de l’effluent dans les systèmes de bassins artificiels.
9.3 Utilisation de bivalves en cage comme méthode de suivi de rechange
9.3.1 Introduction
La présente section décrit les méthodes utilisées au cours des études de bivalves en cage et fournit des renseignements détaillés sur les éléments suivants :
- contexte et approche générale des études de bivalves en cage;
- choix de l’espèce;
- plan d’étude;
- variables à mesurer;
- méthodes de mise en œuvre de l’étude;
- analyses des données;
- concentrations dans les tissus;
- exigences en matière de rapports.
9.3.2 Contexte
En octobre 2000, le Comité scientifique national des études de suivi des effets sur l’environnement (ESEE) a recommandé le recours à des études de bivalves en cage comme méthode de suivi biologique de rechange scientifiquement valable, lorsqu’il n’est ni pratique ni techniquement possible de mener des études de poissons sur le terrain. Le Sous-groupe sur les poissons pour le secteur des mines de métaux a également recommandé l’utilisation de bivalves en cage comme méthode de remplacement durant le processus de consultation multilatérale sur les ESEE des mines de métaux. Pour en savoir plus, voir Courtenay et al. (1998), Andrews et Parker (1999) et Applied Biomonitoring (2000).
En novembre 2000, l’American Society for Testing and Materials (ASTM) a approuvé une méthode pour la conduite d’études environnementales utilisant des bivalves en cage (Salazar et Salazar, 2000). Le présent guide repose sur cette méthode. D’autres études utilisant des bivalves sauvages et en cage ont également été prises en considération au moment d’élaborer ce guide, qui vise à appliquer cette approche dans le cadre du Programme d’ESEE. Le format du guide suit celui qui est utilisé pour les études de poissons. Les bivalves, comme les huîtres et les moules, sont utilisés depuis le milieu des années 1970 dans le cadre de programmes de surveillance des moules, lesquels visent à suivre les tendances de la contamination chimique et à évaluer les effets des activités humaines sur les zones côtières et estuariennes. Ces programmes ont vu le jour aux États-Unis (Goldberg et al., 1978) et ont depuis acquis une portée internationale (Jernelov, 1996). Voici certaines des raisons pour lesquelles les bivalves constituent des espèces d’essai propices :
- ils sont relativement immobiles, de sorte que l’exposition aux contaminants est assurée et représentative de la zone d’exposition;
- ils sont abondants dans bon nombre de milieux marins, estuariens et dulcicoles, et il est relativement facile de les manipuler et de les échantillonner tout au long de l’année;
- la biologie de bon nombre de mollusques et de crustacés est bien connue, et un nombre considérable de recherches ont été menées sur les effets de l’exposition à différents facteurs d’agression environnementale anthropiques et naturels sur ces organismes;
- on a montré que plusieurs espèces de bivalves accumulent facilement bon nombre de produits chimiques par différentes voies (eau, sédiments, nourriture) et présentent des effets sublétaux associés à l’exposition;
- la croissance des bivalves est relativement facile à mesurer et s’est révélée aussi sensible, sinon plus, que la mortalité chez des espèces d’essai standards comme Daphnia, le Méné à grosse tête et la Truite arc-en-ciel (voir Salazar et Salazar, 2000);
- les bivalves sont une ressource halieutique importante, et les régions de l’Atlantique et du Pacifique soutiennent toutes deux une industrie conchylicole qui présente un intérêt commercial; on y pratique aussi la récolte de mollusques et de crustacés à des fins commerciales et récréatives.
9.3.3 Approche
L’approche des bivalves en cage offre un certain nombre d’avantages au chercheur qui mène une étude de suivi, notamment le contrôle et le réalisme expérimentaux, l’utilisation d’organismes naturellement présents dans le milieu d’étude et la connaissance de la période d’exposition (Crane et al., 2007). En utilisant des bivalves en cage plutôt que des populations résidantes, il est possible de réduire la variabilité des mesures biologiques en choisissant des individus de taille similaire qui possèdent la même histoire environnementale, ce qui augmente le pouvoir discriminant du test (Crane et al., 2007; Salazar et Salazar, 1995). Un nombre considérable d’études utilisant des bivalves en cage ont été menées au Canada, aux États-Unis et dans d’autres pays (voir Salazar, dans Stewart et Malley, 1997; St-Jean et al., 2003, 2005; Crane et al., 2007).
Les indicateurs d’effets d’ESEE utilisant des bivalves en cage sont la survie, la croissance, la condition, la reproduction et le stockage d’énergie. Une analyse des tissus (teneurs en mercure) peut être nécessaire, et des bivalves en cage peuvent être utilisés à cette fin. Il est également possible d’évaluer la bioaccumulation d’autres produits chimiques ou métaux pour faciliter l’interprétation des résultats ou pour la recherche de causes.
Une des difficultés posées par les essais d’exposition des bivalves en cage réalisés aux fins du Programme d’ESEE tient aux problèmes de comparaison des réponses obtenues avec celles des études de poissons adultes. La difficulté réside dans les hypothèses suivantes :
- Les bivalves utilisés pour les études de bivalves en cage proviennent de milieux sains ou de sites de référence, tandis que les poissons utilisés dans les études de poissons adultes sont en général des résidants de longue date, ce qui fait qu’il ne faut pas s’attendre qu’ils réagissent de la même façon.
- Dans la plupart des sites au Canada, le cycle reproducteur des moules (Moules bleues [Mytilus edulis]) dure au minimum neuf mois, tandis que les gamètes produits au printemps sont dérivés d’une énergie (principalement le glycogène) accumulée au cours de l’automne. Il sera donc difficile de mettre en lumière les effets de l’effluent sur l’effort de reproduction à l’aide d’un essai d’exposition de 60 ou 90 jours effectué au printemps.
- Chez les bivalves, le stockage de l’énergie et la reproduction sont assurés par le même organe. En automne, le manteau (figure 9-10) est principalement composé de glycogène (énergie) qui servira à assurer le développement des œufs au printemps. La figure 9-11 montre le rapport qui existe entre l’énergie stockée et le développement des œufs dans une population de Moules bleues de Colombie-Britannique.

Figure 9-10 : Moule avec lobe du manteau à maturité.
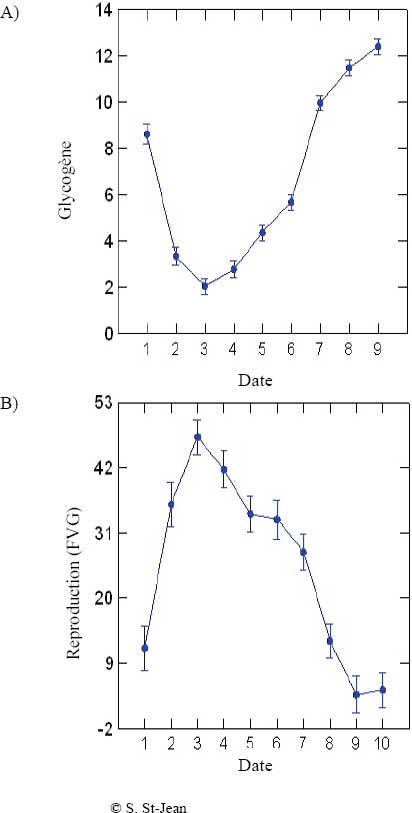
Figure 9-11 : Cycle reproducteur de la Moule bleue de Colombie-Britannique : A) stockage de l’énergie dans le manteau en automne; B) teneur en matériel de reproduction au printemps.
Notes : Les chiffres en abscisse représentent les mois de l’année de février (1) à novembre (10); A) teneur en glycogène exprimée en mg/g; B) reproduction exprimée en fractions volumétriques de gamètes (FVG).
Par conséquent, pour maximiser les résultats de l’étude de bivalves en cage ainsi que leur comparabilité avec les résultats de l’étude des poissons adultes et pour faciliter l’interprétation des résultats de reproduction et d’énergie, il convient d’exposer les bivalves adultes à partir du début de la période d’accumulation d’énergie, en automne, jusqu’à la libération des gamètes au printemps.
9.3.4 Choix de l’espèce
Bon nombre d’espèces de bivalves ont été utilisées pour évaluer la biodisponibilité ou les effets de produits chimiques dans des milieux marins, estuariens et dulcicoles. Idéalement, une espèce qui présente une distribution géographique étendue devrait être utilisée, afin de comparer les résultats des essais entre les études. Il convient ainsi de choisir soigneusement l’espèce à utiliser dans les études de bivalves en cage et de tenir compte de sa biologie et des conditions locales :
- Les zones d’exposition et de référence présentent-elles des conditions similaires à celles de l’habitat naturel de l’espèce en ce qui concerne les limites de tolérance pour des facteurs naturels tels que la température, la salinité, la teneur en oxygène dissous et le pH? L’espèce est-elle naturellement présente dans la zone d’étude?
- Existe-t-il de la documentation indiquant que l’espèce peut accumuler le contaminant en question ou être sensible à celui-ci?
- Le cycle vital de l’espèce est-il bien connu en ce qui a trait à son cycle de reproduction et ses besoins aux différents stades?
- L’espèce est-elle menacée ou en voie de disparition?
- Dispose-t-on de stocks abondants facilement accessibles?
- L’espèce est-elle facile à manipuler sur le terrain?
Dans le cas de chaque bivalve individuel, il faut prendre soin de vérifier :
- si la coquille est anormalement épaisse;
- si la coquille indique la présence de vers (souvent révélée par des trous);
- si la coquille est fendillée;
- si le réflexe de fermeture des valves est lent.
9.3.4.1 Taxons utilisés le plus fréquemment
Les espèces utilisées le plus fréquemment dans les essais de toxicité sur le terrain en eaux canadiennes et considérées comme pertinentes pour les ESEE sont décrites ci-dessous et présentées dans le tableau 9-4. En outre, le tableau indique les limites de tolérance de chaque espèce à la température et à la salinité et fournit des données sur l’âge à la maturité, les périodes de fraie et la répartition générale au Canada. D’autres espèces, telles que les myes (Mya arenaria, Macoma balthica) et les pétoncles peuvent également être utilisées pour certaines applications. Il faut toutefois établir les conditions environnementales nécessaires et la sensibilité de ces autres espèces d’essai avant de les utiliser dans les ESEE. En ce qui concerne les besoins particuliers des diverses espèces, Salazar et Salazar (2000) décrivent les besoins en matière de salinité et de température ainsi que la répartition de plusieurs espèces de bivalves du Canada.
| Espèces et références | Plage de températures (°C) | Plage de salinité (parties par millier) | Données sur la reproduction | Répartition générale au Canada |
|---|---|---|---|---|
| Bivalves marins et estuariens | ||||
| Mytilus edulis (Moule bleue) (Freeman et al., 1994; Grout et Levings, 2000; Mucklow, 1996; Stewart, 1994; Salazar et Salazar, 2000; Newell, 1989; Toro et al., 2002). | –1,5 à 25 | 5 à 33 | La plus grande partie de l’énergie est utilisée pour la fraie à une longueur supérieure à 3,5 cm, environ entre 2,5 et 4 ans. Généralement, une fraie brusquesur la côte Est : pas plus de trois semaines, entre le milieu de juin et le milieu de juillet, mais la fraie peut varier d’une population à l’autre. Elle peut être faible pendant toute l’année, surtout dans les zones d’influence anthropique ou dans le cas de reproducteurs à fraies répétées; la première a lieu au début de l’été, et la deuxième, à l’automne, surtout sur la côte Ouest. | Côte de l’Atlantique |
| Mytilus trossulus (Moule bleue du Pacifique ou foolish mussel) (Freeman et al., 1994; Salazar et Salazar, 2000; Skidmore et Chew, 1985; Toro et al., 2002). | 0 à 29 | 4 à 33 | La plus grande partie de l’énergie est utilisée pour la fraie à une longueur supérieure à 3,5 cm. La fraie dure généralement de12 à 13 semaines, de juin à septembre. | Côtes de l’Atlantique et du Pacifique |
| Crassostrea gigas (Huître creuse du Pacifique) (Virginia Tech, 2000; Waldock et al., 1996). | 4 à 24 | 25 à 35 | Fraie de juillet à août. | Côte du Pacifique |
| Bivalves dulcicoles | ||||
| Elliptio complanata (Elliptio maigre de l’Est) (Beckvar et al., 2000; Day et al., 1990; Hinch et al., 1989; McMahon, 1991; Metaclfe-Smith et al., 1996). | 0 à 30 | 0 à 3 | Maturité entre 6 et 12 ans. Fraie essentiellement en juin et juillet; parfois de mai à septembre. | Est du Canada |
| Pyganodon (Anodonta) grandis (Anodonte commune) (Clarke, 1973; Couillard et al., 1995a, 1995b; Malley et al., 1996). | 0 à 30 | 0 à 3 | Fraie essentiellement en avril et mai; parfois jusqu’en août. | Intérieur et Est du Canada |
| Anodonta kennerlyi (Anodonte de l’Ouest) (Clarke, 1981; Stewart et Malley, 1997; Williams et al., 1993). | 0 à 30 | Eau douce | Début de la fraie en août. | Alberta et Colombie-Britannique |
| Sphaeriidés (p. ex., Musculium securis, Sphaerium rhomboideum, S. striatinum) (Hornbach et al., 1982; Mackie, 1978a, 1978b; Mackie et Flippance, 1983; Mackie et al., 1974; Stephenson et Mackie, 1981). | 10 à 25 (plage optimale pour la croissance) | Eau douce | Cycle de vie généralement inférieur à un an; le cycle biologique de bon nombre d’espèces est bien documenté; l’effort de reproduction peut être quantifié. | Répartition étendue au Canada |
Source : Format modifié de Salazar et Salazar, 2000.
9.3.4.2 Bivalves marins et estuariens
L’Huitre creuse du Pacifique est une espèce d’huître qui a été utilisée dans des études de transplantation en milieux marins et estuariens (Waldock et al., 1996). Sa coquille est habituellement plus difficile à mesurer en raison de sa forme irrégulière et de ses protubérances.
Le genre Mytilus a beaucoup été utilisé dans le cadre de l’International Mussel Watch Project, qui vise à suivre les tendances de la contamination chimique et à évaluer les effets des activités humaines sur les zones côtières et estuariennes d’Amérique du Nord et d’ailleurs dans le monde (O’Connor, 1992; Jernelov, 1996). On trouve la Moule bleue (M. edulis) et la Moule bleue du Pacifique (M. trossulus) sur la côte Atlantique du Canada, mais cette dernièrese trouveen majoritésur la côte Ouest. Ces deux espèces peuvent facilement être confondues dans les zones de la côte Atlantique, étant donné qu’elles y coexistent (Freeman et al., 1994; Mucklow, 1996). Comme leur biologie et leur cycle reproducteur diffèrent, il est essentiel d’en faire une identification à l’espèce. Le groupe Mytilus spp., auquel on donne souvent le nom de « complexe M. edulis » afin de tenir compte des différences biochimiques (Varvio et al., 1988) peut comprendre les espèces M. edulis, M. galloprovincialis et M. trossulus. Plusieurs différences fondamentales ont été observées entre M. edulis et M. trossulus, y compris une incompatibilité des gamètes (Rawson et al., 2003), la séparation temporelle et la durée de la fraie chez les populations de l’Atlantique (Toro et al., 2002) ainsi que la production totale et la taille des œufs (Toro et al., 2002). À ce titre, M. trossulus pond des œufs plus petits, présente une période de fraie plus longue et produit moins de gamètes que M. edulis, qui en revanche affiche un taux de croissance plus rapide que M. trossulus sur la côte Est canadienne (Penny et al., 2002). Les travaux effectués sur les côtes du Pacifique et de l’Atlantique avec des bivalves en cage ont confirmé les différences du taux de croissance et du cycle reproducteur entre ces deux espèces : M. trossulus est plus sensible, plus petit, et ses œufs sont plus petits et moins nombreux (Metro Vancouver, données inédites). Le tableau 9-5 présente plusieurs des différences observées entre ces deux espèces au cours de cinq années d’analyses.
| Mytilus edulis | Mytilus trossulus |
|---|---|
| Croissance plus rapide | Croissance plus lente |
| Taux de survie plus élevé | Taux de survie plus faible |
| Œufs plus nombreux et plus gros | Œufs moins nombreux et moins gros |
| Reproduction durant 2 à 3 semaines | Reproduction durant 9 à 14 semaines |
| Séparation plus claire entre la production d’œufs et le stockage d’énergie | Séparation moins claire entre la production d’œufs et le stockage d’énergie |
| Moins sensible à la leucémie | Plus sensible à la leucémie |
| Globalement plus utile pour les essais | Globalement moins utile pour les essais |
| Pas toujours présent (côte Ouest) | Coexiste parfois avec M. edulis (côte Est) |
9.3.4.3 Bivalves dulcicoles
Les bivalves d’eau douce de la famille des unionidés ont été utilisés dans plusieurs études de bivalves en cage pour examiner l’exposition dans la colonne d’eau et dans les sédiments. Certains de ces bivalves (p. ex., Elliptio complanata, Anodonta kennerlyi et Pyganodon grandis [anciennement Anodonta grandis]) ou certains sphaeriidés peuvent être considérés utiles pour l’évaluation des différences dans la survie, la croissance, la condition et le taux de reproduction des bivalves dans les milieux récepteurs dulcicoles. Les chercheurs suivants ont examiné les cycles vitaux de ces espèces : Mackie (1978b), Sandusky et Sparks (1979), Stephenson et Mackie (1981), Stewart et Malley (1997). Les bivalves d’eau douce sont des bivalves appartenant à la superfamille des Unionoidea et font partie d’un des groupes d’organismes les plus menacés de disparition en Amérique du Nord (Wolfe et al., 2009). Les unionidés se distinguent par le fait que leurs glochidies (larves) ont besoin d’une période d’incubation dans un hôte vertébré pour survivre jusqu’au stade adulte. C’est ainsi que les glochidies parasites libérées dans l’eau par les bivalves adultes se fixent aux poissons qui leur servent d’hôte. Elles y demeurent jusqu’à la fin de leur métamorphose, dont la durée varie en fonction de la température de l’eau. En outre, les glochidies de genres différents sont libérées dans le milieu ambiant à des périodes différentes de l’année (Bauer, 1994). Les taxons du genre Pisidium (famille des sphaeriidés) peuvent s’avérer difficiles à manipuler en raison de leur petite taille et poser par surcroît des problèmes de taxonomie aux non-spécialistes. Par ailleurs, d’autres recherches pourraient être nécessaires pour démontrer l’utilité des bivalves de la famille des sphaeriidés pour l’ESEE. Contrairement aux bivalves marines, les bivalves dulcicoles possèdent des gonades distinctes et non fusionnées. En outre, ils présentent des cycles saisonniers distincts de la teneur biochimique des tissus qui sont principalement liés au cycle reproducteur. Comme chez les bivalves marins et estuariens, les concentrations de protéines, de glycogène et de lipides atteignent un sommet pendant le développement des gonades et la gamétogenèse et sont minimales à l’époque de la libération des glochidies. Comme chez les bivalves marins, c’est la teneur en glycogène qui présente la plus grande variabilité (Jadhav et Lomte, 1982). Le tableau 9-6 présente les différences entre les unionidés et les sphaeriidés.
| Unionidés | Sphaeriidés |
|---|---|
| Croissance rapide jusqu’à la maturité, puis plus lente | Croissance plus lente; ces bivalves peuvent être très petits |
| Durée de vie : < 6 à > 100 ans | Durée de vie : 1 à 4 ans |
| Fécondité : 200 000 à 17 000 000 œufs par femelle; petits œufs | 3 à 24 œufs par femelle; gros œufs |
| Reproduction : une fois l’an | Reproduction : 3 fois l’an, parfois en continu |
| Séparation plus claire entre la production d’œufs et le stockage d’énergie | Séparation moins claire entre la production d’œufs et le stockage d’énergie |
| Gonochoristique | Hermaphrodite |
| Maturité entre 6 et 12 ans | Maturité entre 0,2 et 1 an |
| Moins propices aux études : gonochoristiques, vivant longtemps, itéropares, souvent rares, difficiles à prélever, à cycle vital complexe (stade parasite) | Plus propices aux études : plus abondants, plus faciles à prélever, faciles à élever, à cycle vital relativement simple, à durée de vie plus courte |
9.3.4.4 Provenance des bivalves
Le choix d’utiliser des bivalves d’élevage ou des bivalves indigènes locaux constituera une question importante. Selon le paramètre mesuré, les deux sources présentent chacune des avantages et des inconvénients, et le choix devrait être fait en fonction des circonstances décrites ci-après.
Il convient d’obtenir les bivalves d’un fournisseur commercial lorsque le paramètre à mesurer est le taux de croissance ou l’accumulation de substances chimiques. S’il s’agit d’évaluer la reproduction ou le stockage de l’énergie, il faudrait choisir des bivalves indigènes en utilisant autant que possible un gradient naturel ou un plan contrôle-impact lorsque la période d’exposition est courte, ou des bivalves commerciaux lorsque la période d’exposition est plus longue. La croissance devrait être mesurée à l’aide de juvéniles obtenus d’un aquaculteur. Les bivalves obtenus dans une installation commerciale possèdent une histoire environnementale bien connue, et il y a de meilleures garanties d’absence de contaminants que dans le cas des spécimens sauvages. Toute étude devrait confirmer une forme quelconque d’identification des espèces, puisque les résultats peuvent varier largement d’une espèce à l’autre, comme le montre le tableau 9-6. Tous les sujets utilisés dans une étude de bivalves en cage pour la mesure d’un paramètre donné doivent provenir de la même population. Si les populations sauvages constituent la seule source d’approvisionnement possible, les spécimens doivent être prélevés dans une zone non contaminée. Il convient de retirer doucement à la main ou à l’aide d’une brosse à poils doux ou d’un racloir tous les organismes épiphytes des coquilles des bivalves. Pêches et Océans Canada exige la possession d’un permis pour la récolte de spécimens sur le terrain ou leur transplantation, et certains organismes locaux ou provinciaux pourraient avoir la même exigence. De plus, si les cages risquent de faire obstacle à la navigation, il pourrait être nécessaire d’obtenir un permis de la Garde côtière canadienne et de publier un avis aux navigateurs. Le processus d’obtention de permis doit être considéré dès les premières étapes de la planification de l’étude. Le traitement des demandes peut prendre de plusieurs semaines à quelques mois, et il pourrait également devenir nécessaire de faire une évaluation environnementale, comme l’exige l’Agence canadienne d’évaluation environnementale.
9.3.4.5 Identification des espèces
Deux méthodes sont envisageables pour l’identification des bivalves : l’analyse d’alloenzymes et la morphométrie combinée à l’analyse statistique (McDonald et al., 1991; Mallet et Carver, 1995). Aux fins des mesures morphométriques, des coquilles vides sont nettoyées et laissées à sécher pendant quatre à cinq heures (60 °C). Les mesures doivent porter au minimum sur cinq caractéristiques (présentées ci-dessous) et devraient être réalisées à l’aide d’un stéréomicroscope (6,4 X) :
- longueur de l’impression du muscle adducteur antérieur;
- longueur de la charnière;
- distance entre le bord antérieur de l’impression du muscle adducteur postérieur et le bord de la coquille;
- distance entre le bord ventral de l’impression du muscle adducteur postérieur et le bord ventral de la coquille;
- distance entre la ligne palléale et le bord ventral de la coquille, à mi-distance de la longueur de la coquille (figure 9-12).
Trois dimensions supplémentaires devraient également être mesurées à l’aide d’un pied à coulisse :
- longueur de la coquille;
- largeur de la coquille;
- hauteur de la coquille.
Chaque caractéristique devrait être normalisée par conversion log10 et divisée par le log10 de la longueur de la coquille. Ces variables morphométriques (log-transformées et normalisées en fonction de la longueur, le cas échéant) doivent ensuite être multipliées par leurs coefficients canoniques bruts et additionnées pour produire, pour chaque individu, une variable canonique (Mallet et Carver, 1995). M. edulis présente d’ordinaire une impression du muscle adducteur antérieur plus longue, une charnière plus longue et une coquille plus haute que M. trossulus,ce qui conduit à des valeurs positives des coefficients canoniques normalisés.
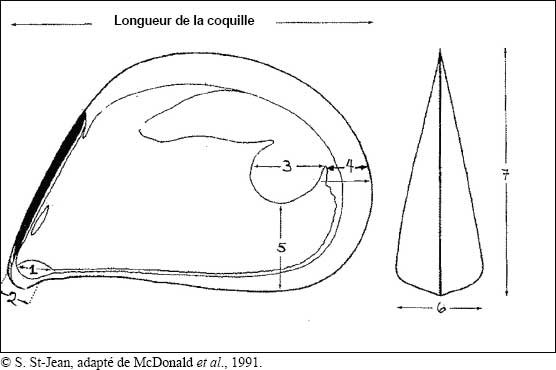
Figure 9-12 : Impressions musculaires dans une coquille de Mytilus spp.
Notes : 1) longueur de l’impression du muscle adducteur antérieur; 2) longueur de la charnière; 3) longueur de l’impression du muscle adducteur postérieur; 4) distance entre le bord postérieur de l’impression du muscle adducteur postérieur et le bord postérieur de la coquille; 5) distance entre le bord ventral de l’impression du muscle adducteur postérieur et le bord ventral de la coquille; 6) largeur de la coquille; 7) hauteur de la coquille.
9.3.4.6 Taille et âge
Tous les sujets utilisés dans une étude de bivalves en cage devraient être de même classe d’âge, et leur taille devrait être aussi uniforme que possible. D’ordinaire, les juvéniles destinés à la mesure de la croissance ne devraient pas montrer une différence de longueur de plus de 5 mm au début de la période d’exposition. C’est ainsi qu’on peut limiter le nombre de sujets requis pour obtenir la puissance statistique nécessaire. Les juvéniles constituent les meilleurs candidats pour la mesure de ce paramètre, puisque la plus grande partie de leur énergie sert à la croissance. Chez les bivalves -- et les moules en particulier -- il y a un rapport inverse entre l’énergie utilisée pour la croissance et l’énergie utilisée pour la reproduction. Cela provient du fait que les moules juvéniles consacrent la plus grande partie de leur énergie à la croissance, mais à mesure qu’elles vieillissent, elles consacrent de plus en plus d’énergie à la reproduction, et le rapport s’inverse chez les adultes. Les moules commencent généralement à produire des gamètes dès l’âge d’un an. À trois ou quatre ans, elles consacrent la majeure partie de leur énergie à la reproduction, et leur taux de croissance devient beaucoup plus faible. Il est donc recommandé d’utiliser des moules de plus de trois ans (dont la longueur atteint en règle générale au moins 4 cm) pour l’étude de l’utilisation d’énergie pour la reproduction et des juvéniles (de 2,0 à 2,5 cm) pour l’étude de l’utilisation d’énergie pour la croissance.
L’âge des bivalves peut être déterminé à l’aide d’une combinaison des techniques décrites par Ramon et Richardson (1992) et par Sejr et al. (2002). La technique fondée sur les stries de croissance annuelles a été validée à l’aide d’études de marquage et de recapture (Sejr et al., 2002). Cette tâche devrait être confiée à un biologiste d’expérience.
9.3.4.7 Nombre d’organismes
Une analyse de puissance (analyse exponentielle) devrait être effectuée pour déterminer le nombre minimal de bivalves nécessaires pour détecter un effet d’une ampleur donnée. Il est recommandé d’élaborer le plan d’étude de façon à détecter une différence de 20 % dans la croissance. Il est possible de se procurer des ensembles de données destinés à faciliter la prévision du nombre d’organismes nécessaires auprès d’Environnement Canada. Toutefois, lorsque les longueurs des bivalves se situent à l’intérieur d’une gamme étroite de tailles (en moyenne, écart de 5 mm), 100 bivalves suffiront pour obtenir la puissance statistique voulue et pour assurer qu’un nombre adéquat de bivalves survivent à l’exposition.
Pour la mesure de la croissance, le nombre d’animaux requis par cage est fonction du plan d’étude (p. ex., nombre de cages par station; cette question est traitée plus en détail dans les sections suivantes), de l’espèce utilisée, de l’âge des animaux ainsi que de la variabilité des réponses et des conditions de croissance à la station. Le nombre de bivalves nécessaires pour remplir les cages est fonction du plan d’étude, notamment :
- du nombre de zones (zone d’exposition et zones de référence);
- du nombre de stations par zone;
- du nombre de cages par point d’ancrage (si l’étude vise à déterminer l’exposition à différentes profondeurs dans la colonne d’eau);
- du nombre recommandé de bivalves par cage.
En outre, si des échantillons tissulaires sont requis à des fins d’analyse, il faut déterminer le nombre de sujets requis pour obtenir un échantillon suffisant pour les analyses chimiques.
9.3.4.8 Conditions de manipulation et de conservation
On trouvera ci-après un résumé des renseignements détaillés que donnent Salazar et Salazar (2000) sur les conditions de manipulation et de conservation des bivalves. Les organismes d’essai devraient être manipulés le moins possible et déployés le plus rapidement possible après leur collecte. Lorsque la manipulation est nécessaire, elle devrait être faite avec soin, doucement et rapidement de façon que les bivalves ne subissent pas de stress inutile. Les animaux devraient être conservés dans une eau courante, propre et bien aérée aussi longtemps que possible entre la collecte, le tri et le déploiement. S’il faut les transporter sur une grande distance, il importe de les garder humides et au frais en les plaçant dans une glacière avec des cryosacs ou de la glace humide (au fond de la glacière). Utiliser du varech ou des serviettes pour isoler les bivalves des cryosacs ou de la glace; il faut éviter le papier journal puisque l’encre qu’il contient peut être toxique pour les bivalves.
9.3.5 Plan d’étude
Il est essentiel d’élaborer un plan d’étude approprié si l’on veut que les résultats soient probants. La méthodologie des études de bivalves en cage comprend un certain nombre d’éléments :
- plan d’échantillonnage;
- sélection des zones et des stations;
- répétition des stations et des cages à une même station;
- moment et durée de l’étude;
- facteurs de confusion ou de modification;
- mesures supplémentaires;
- configuration des cages;
- systèmes d’ancrage.
9.3.5.1 Plan d’échantillonnage
Six principaux plans d’échantillonnage sont recommandés pour les évaluations dans les milieux marins et dulcicoles :
- plan contrôle-impact (C-I);
- plan contrôle-impact multiple (C-IM);
- plan par gradient linéaire (GL);
- plan par gradient radial (GR);
- plan par gradients multiples (GM);
- plan contrôle-gradient linéaire (C-GL).
Les plans C-I et C-IM permettent de déterminer l’ampleur de la différence entre des zones homogènes exposées et non exposées, tandis que les plans GL, GR et GM permettent d’examiner les modifications d’un effet le long d’un gradient de concentration d’effluent. Les plans C-I et C-IM sont utilisés lorsqu’il y a peu de degrés d’exposition différents sur le plan qualitatif. Il est recommandé d’utiliser plusieurs zones de référence plutôt que d’augmenter la taille des échantillons dans une seule zone. Les plans GL, GR et GM peuvent être utilisés lorsqu’il y a plusieurs degrés d’exposition quantitativement différents (Paine, 2000); ils peuvent également être utiles pour distinguer les effets provenant d’autres sources qu’une mine. Des conseils pour le choix du plan d’échantillonnage approprié sont présentés aux chapitres 2 et 4.
Par exemple, dans les estuaires caractérisés par des régimes de marées et de courants complexes, l’approche C-IM pourrait être la plus appropriée. Une approche par gradient linéaire (GL) pourrait s’appliquer à un milieu récepteur fluvial, où l’écoulement est unidirectionnel.
Les plans C-I, C-GL et C-IM nécessitent un certain degré de répétition dans les zones de référence et d’exposition. Le plan C-GL combine les plans C-I et GL. Ce qui peut parfois être utile lorsqu’on souhaite utiliser plus d’un site de référence. Dans ce cas, un contrôle -- ou zone de référence -- est ajouté à un gradient linéaire, d’ordinaire lorsque le site très peu exposé à l’effluent (site très éloigné) ne présente pas de conditions semblables à celles de la zone exposée quant à la profondeur ou à d’autres facteurs biotiques importants. Pour les plans par gradient, il n’est pas nécessaire d’effectuer une répétition à chaque station, mais il importe d’établir un nombre approprié de stations pour distinguer les configurations spatiales associées au rejet d’effluents et les autres configurations spatiales dans l’environnement. La section 9.3.5.2 traite de la répétition plus en détail. En bout de ligne, il incombe aux chercheurs d’élaborer des plans d’étude qui conviennent au site et qui soient scientifiquement valables, robustes et suffisamment sensibles.
9.3.5.1.1 Choix des zones et des stations
Le chapitre 2 fournit des conseils pour le choix de zones de référence multiples dans divers milieux récepteurs, qui peuvent s’appliquer aux études faisant appel à des bivalves en cage. Les zones de référence doivent être aussi similaires que possible aux zones d’étude en ce qui concerne les éléments suivants :
- la profondeur;
- les conditions hydrodynamiques;
- la température;
- la salinité;
- la teneur en oxygène dissous;
- la disponibilité et la qualité de la nourriture.
L’utilisation de zones de référence multiples peut faciliter la reconnaissance des différences et de la variabilité naturelles entre des zones non contaminées. Une combinaison d’un gradient linéaire et de zones de contrôle multiples -- par exemple, C-GL -- permet souvent une étude plus robuste.
La zone d’exposition est définie par les caractéristiques du panache d’effluent. Le profil du panache, comme le décrit le chapitre 2, devrait fournir suffisamment de données pour permettre la modélisation des concentrations moyennes d’effluents en fonction de la distance par rapport à la source, et la détermination du degré de mélange vertical dans la colonne d’eau. Cette information facilitera le choix des stations et de la profondeur du déploiement dans la colonne d’eau. Les sections qui suivent offrent plus d’information à ce sujet.
9.3.5.2 Répétition
9.3.5.2.1 Nombre de stations
L’emplacement des stations et les profondeurs auxquelles sont déployées les cages dans la zone exposée doivent être choisis de façon qu'un gradient d’exposition au panache d’effluent soit représenté. Au moment de choisir les stations, il faut considérer avec attention un certain nombre de facteurs d’interférence potentiels, dont les suivants :
- Dans les milieux marins et estuariens, le panache peut être flottant, de sorte qu’une mince couche d’effluent non salé surmonte une couche d’eau salée plus dense.
- Dans les zones soumises à l’action des marées, le mélange de l’effluent aux masses d’eaux peut obéir à des mécanismes assez complexes, et on ne peut être certain des concentrations moyennes auxquelles les bivalves sont exposés. Dans ces situations, il faut envisager de répartir les stations dans la zone d’exposition à la fois en amont et en aval du point de rejet.
- Dans l’embouchure des cours d’eau, le panache d’effluent peut être assez long et étroit, de sorte qu’il est difficile d’obtenir une répétition valable des stations à l’intérieur du panache (c.-à-d. dans sa section transversale).
Pour ces raisons et pour d’autres, il peut être préférable d’élaborer les études de bivalves en cage en tenant compte simplement de la distance par rapport au point de rejet plutôt que des concentrations d’effluent. Cette approche demeure conforme à l’un des objectifs de l’ESEE qui est d’évaluer l’ampleur et l’étendue géographique des effets qui peuvent être associés au rejet d’effluents.
Le nombre de stations répétées doit être déterminé en fonction du plan d’échantillonnage et des objectifs de l’ESEE. Ce nombre, et le nombre de sous-échantillons dans ces stations, seront déterminés par une analyse de puissance. La répartition et la distribution des stations répétées sont tributaires du plan d’échantillonnage. Le chapitre 8 contient des renseignements sur l’utilisation de l’analyse de puissance. Les lecteurs devraient faire en sorte d’éviter la pseudorépétition et de planifier plutôt une véritable répétition. Hurlbert (1984) fournit de plus amples informations sur le sujet.
9.3.5.2.2 Application de la répétition au plan d’étude
Il est suggéré de mesurer plusieurs paramètres dans les études de bivalves en cage : la survie, la croissance (modification de la longueur ou du poids humide), le poids frais des tissus mous, la condition, la reproduction et le stockage d’énergie. Afin de mesurer ces paramètres sur une série de sujets déployés à différents endroits sur le terrain, plusieurs configurations différentes de cages et de bivalves peuvent être utilisées. Pour l’ESEE, il peut être avantageux de déployer des cages répétées contenant plusieurs bivalves à chaque station et de considérer seulement le rendement moyen à l’intérieur de chaque cage. Cette approche permet en outre de compenser la perte éventuelle d’une ou de plusieurs cages et peut simplifier la construction et le déploiement des cages. Tant que la portée du test de l’hypothèse statistique demeure limitée à la vérification de différences significatives entre les zones (sans attribuer uniquement les effets à l’exposition à l’effluent), la répétition et l’analyse statistique sont valides.
Il est suggéré, en règle générale, de déployer des cages contenant 20 sujets pour mesurer la survie et au moins cinq cages par station pour mesurer la croissance. Il convient d’utiliser une seule cage, et non cinq, par point d’ancrage, car celui-ci constitue l’unité de répétition statistique la plus appropriée. Il faut toutefois que les intervenants explorent la puissance et la robustesse des plans d’étude potentiels en utilisant des données de synthèse (ou des données empiriques lorsqu’elles sont disponibles) comme partie intégrante du processus de planification de l’étude afin de déterminer le nombre minimal de sujets nécessaires.
9.3.5.3 Moment et durée de l’étude
Le moment choisi pour effectuer les études doit répondre aux caractéristiques suivantes :
- Il coïncide avec une période de forte croissance dans les populations naturelles, de sorte que la croissance soit maximale et que les différences du taux de croissance observées entre les traitements soient plus faciles à mesurer.
- Il ne coïncide pas avec une période de fraie si les bivalves d’essai sont des adultes.
Pour la mesure de la croissance, de la survie et de l’accumulation de substances chimiques, la durée d’exposition devrait être de 60 à 90 jours (voir ce point dans Salazar et Salazar, 2000). Cette durée devrait être suffisante pour que les effets sur la survie et la croissance puissent se manifester. Toutefois, il pourrait devenir nécessaire d’utiliser une période minimale de neuf mois pour mesurer l’énergie ou la reproduction. Sur la côte Est, il faudrait d’ordinaire déployer les cages en été pour s’assurer que l’énergie accumulée à l’automne (celle mesurée) provient des sites étudiés et que la production d’œufs reflète bien les effets potentiels de l’effluent. Même s’il faut procéder à trois échantillonnages (déploiement, énergie et reproduction), le coût n’est généralement pas prohibitif puisqu’il n’est pas nécessaire de procéder à des mesures avant le déploiement comme c’est le cas pour la croissance et la survie.
9.3.5.4 Facteurs de confusion ou de modification et mesures supplémentaires
Les résultats des études de bivalves en cage seront tributaires, au moins en partie, de facteurs naturels comme la température, la disponibilité de la nourriture, d’autres propriétés physiques et chimiques du milieu d’essai, l’espèce choisie, la condition des organismes d’essai, la méthode d’exposition et les manipulations subies par ces organismes. Les zones d’exposition et de référence devraient être aussi similaires que possible en ce qui concerne les facteurs énumérés ci-après pour réduire le plus possible les différences portant à confusion. Il peut être utile de mesurer certains des facteurs pour faciliter l’interprétation des résultats. Ces facteurs peuvent inclure le cycle vital, le comportement, la température, le manque d’acclimatation, la disponibilité de la nourriture, la vitesse des courants, la salinité, l’encrassement, et la concentration chimique. Ces questions sont examinées plus en détails par Salazar et Salazar (2000).
9.3.6 Configuration des cages
Pour les études sur la croissance et la survie, il est suggéré d’utiliser des cages munies de compartiments individuels pour pouvoir suivre chacun des bivalves tout au long de l’étude. La largeur de maille devrait être aussi grande que possible pour permettre une circulation maximale de l’eau, mais suffisamment petite pour contenir les animaux d’essai. Les sujets sont placés dans des compartiments de façon qu’il soit possible de suivre la survie, la croissance et la condition de chacun. Les organismes d’essai seront placés dans des filets et séparés à l’aide d’attaches de plastique ou de tout autre matériau approprié. Il faudrait laisser suffisamment d’espace dans chaque compartiment pour permettre aux sujets de croître durant la période d’exposition.
Pour les mesures de la reproduction et de l’énergie, il n’est pas nécessaire de mesurer les bivalves au préalable, les compartiments individuels sont donc inutiles. Toutefois, les bivalves devraient être exposés à des conditions relativement uniformes, et il est recommandé de les disposer en boudins de trois ou quatre individus chacun (figure 9-13). Cette configuration des cages réduit sensiblement le niveau d’effort requis.
Salazar et Salazar (2000) décrivent diverses configurations de cages. Il est suggéré d’utiliser des cages plates (c.-à-d. à deux dimensions), comme l’illustre la figure 9-13, car elles présentent un certain nombre d’avantages pratiques. Les tubes en PVC conviennent bien pour la fabrication des cages. À cet égard, le PVC devrait être de très bonne qualité et utilisable dans l’eau, et les tubes devraient être trempés dans l’eau courante, douce ou salée, pendant au moins 24 heures avant leur utilisation pour retirer les produits chimiques volatils ou solubles dans l’eau qui pourraient être présents. D’autres matériaux sont décrits dans Salazar et Salazar (2000; section 9).
Les dimensions finales des cages sont tributaires de la taille des organismes d’essai et du nombre de bivalves par cage. Habituellement, les boudins destinées aux espèces comme les moules et les myes mesurent de 10 à 15 cm de diamètre, avec une largeur de maille de 5 mm. Chaque sac en filet devrait être suffisamment long pour contenir le nombre désiré de bivalves et pour permettre la fixation au cadre de PVC. Pour les déploiements de bivalves d’eau douce, les chercheurs ont utilisé une grande variété de configurations de cages. Il incombe au responsable de l’étude de s’assurer que la configuration des cages convient à l’espèce choisie et au milieu récepteur.
9.3.6.1 Systèmes d’ancrage
Pour suspendre les cages dans la colonne d’eau, il est possible de les attacher à des lignes munies d’ancres ou de poids à l’extrémité inférieure (p. ex., des maillons de chaîne en fer) et de bouées de surface ou de subsurface à l’extrémité supérieure (figures 9-14 et 9-15). Salazar et Salazar (2000) traitent des facteurs dont il convient de tenir compte pour le déploiement des cages.

Figure 9-13 : Cadre utilisé pour les essais d’exposition des bivalves.
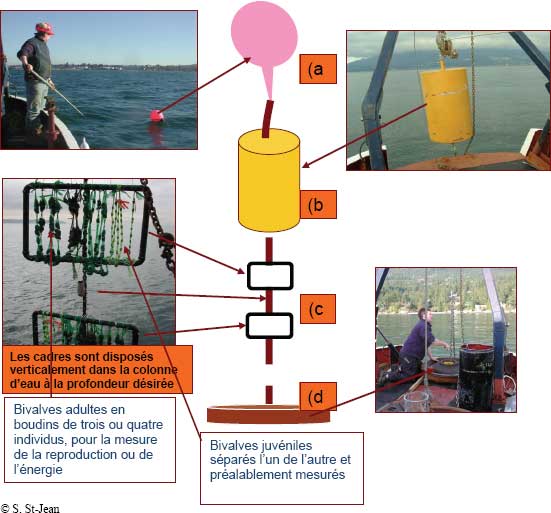
Figure 9-14 : Éléments du système modulaire de mésocosmes.
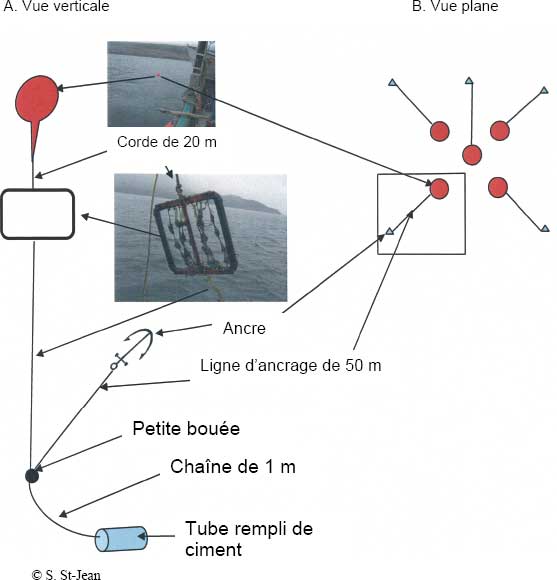
Figure 9-15 : Schéma d’assemblage du système modulaire de mésocosmes.
9.3.7 Méthodes pour débuter l’essai, déployer et récupérer les cages et terminer l’essai
9.3.7.1 Début de l’essai
La première étape consiste à trier les bivalves en fonction des gammes de tailles désirées. En choisissant des sujets à l’intérieur d’une gamme étroite de tailles ou d’âges, les chercheurs peuvent être relativement confiants que ceux-ci présenteront un potentiel de croissance similaire. La détermination de l’âge de spécimens prélevés dans la nature peut s’avérer difficile, voire impossible, pour certaines espèces. Il faut donc avoir recours à la longueur pour choisir des bivalves qui présentent un taux de croissance similaire. Les conchyliculteurs commerciaux peuvent souvent fournir des bivalves d’un âge connu. La gamme de tailles retenue pour les organismes d’essai est fonction de l’espèce choisie, des stocks disponibles pour l’approvisionnement en animaux et de l’âge ciblé. Il faudrait choisir des organismes d’essai à l’intérieur d’une gamme étroite de tailles. Il importe de conserver les organismes d’essai frais et humides au cours du tri pour éviter le stress, les dommages et les mortalités (voir la section 9.3.4.8). Pour les études de croissance et de survie, il faut noter la longueur, la hauteur et la largeur de la coquille et le poids humide de l’animal entier (PHAE) de chaque individu qui devra être placé dans un contenant de stockage temporaire (p. ex., un plateau à glaçons), étiqueté en fonction de l’emplacement particulier qu’il occupera dans la cage. Cette procédure permet la répétition de la prise de mesure de chacun des spécimens à la fin de l’essai. Enfin, il faudra mesurer la longueur des coquilles, le PHAE, le poids des tissus et le poids des coquilles d’un sous-échantillon d’organismes d’essai sacrifiés (composé d’un nombre d’animaux approprié du point de vue statistique). Pour les autres paramètres, il n’est pas nécessaire de mesurer les bivalves de taille similaire, il suffit de les placer en boudins de trois à quatre individus, ce qui reproduit leur comportement naturel dans la nature et réduit leur stress.
Aux fins du contrôle de la qualité, environ 20 % des mesures devraient être répétées et enregistrées par un chercheur différent. Il est préférable d’utiliser un tableur électronique pour l’enregistrement des mesures afin de réduire les erreurs de transcription. Il est également possible de brancher des instruments de mesure (p. ex., un pied à coulisse et une balance de précision) au tableur électronique pour un contrôle de qualité plus poussé.
Tous les organismes d’essai nécessaires pour remplir les cages, ainsi qu’un sous-échantillon sacrifié destiné à la pesée des tissus mous, devraient être triés et mesurés avant le déploiement. Les organismes d’essai sont alors répartis en boudins, avant d’être attachés aux cages. Salazar et Salazar (2000; section 11) fournissent un exemple de plan d’étiquetage et de répartition.
9.3.7.2 Déploiement des cages
Il faudrait s’assurer de disposer d’un bateau approprié pour transporter et déployer toutes les cages, leurs lignes d’ancrage et leurs bouées en toute sécurité. Les lignes d’ancrage et les bouées peuvent être attachées aux cages à bord, durant le transport vers le site. Une fois sur place, il faudrait repérer l’emplacement des cages à l’aide d’un système GPS ou de toute autre méthode fiable (p. ex., en utilisant des repères sur la rive à proximité). Des inspections régulières peuvent être effectuées durant la période d’exposition (p. ex., par des plongeurs) pour vérifier la présence des cages, leur condition et leur propreté.
9.3.7.3 Récupération des cages et fin de l’essai
Pour récupérer les cages, divers outils de repérage peuvent être utilisés (p. ex., des systèmes GPS ou des sondeurs) et un grappin, si elles ont été munies d’une ligne de récupération.
Salazar et Salazar (2000; section 11) fournissent des détails sur la fin de l’essai, qui sont résumés ici. Une fois les cages récupérées, tous les bivalves devront être mesurés. Pour les mesures de la croissance et de la survie, il est essentiel de conserver l’ordre et l’orientation de chaque bivalve durant la prise des mesures de fin d’essai. Les sujets peuvent être retirés des boudins et placés dans des contenants étiquetés (p. ex., des plateaux à glaçons) pour faciliter la prise des mesures.
Cinq ou dix minutes avant la mesure des longueurs et des poids, il faut placer les plateaux dans un bac rempli d’eau propre. Si les animaux flottent, cela indique la présence d’air entre les valves des coquilles. Lorsque tous les animaux dans les plateaux ont légèrement ouvert leurs valves et ne flottent plus (après cinq à dix minutes), on peut débuter la prise des mesures. La mesure du PHAE et de la longueur des coquilles se fait en premier, puis il faut décoquiller soigneusement chaque individu et enlever l’excédent d’eau à l’aide d’un papier buvard avant de procéder à la mesure des poids frais. Il convient de noter que si l’on prévoit d’analyser les tissus pour déceler la présence de produits chimiques, il faut prendre garde de ne pas introduire de contaminants provenant du papier buvard. Le protocole du programme de surveillance des moules (Gulf of Maine Council, 1997) est le plus approprié pour la dissection effectuée aux fins de l’analyse chimique.
9.3.8 Indicateurs d’effets
Les indicateurs d’effets devant être mesurés au cours des études de bivalves en cage menées dans le cadre de l’ESEE sont la survie, la croissance, la reproduction et la condition. Le tableau 9-7 présente les critères d’effets et d’appui pour une étude de bivalves en cage. Les méthode statistiques sont également répertoriées et sont décrites de manière plus explicite à la section 9.3.10. Enfin, un modèle de rapport pour l’enregistrement des données brutes et des résultats relatifs à la survie et à la croissance figure au tableau 9-8.
| Indicateurs d’effets | Critères d’effets et d’appui | Tests statistiques |
|---|---|---|
| Croissance |
| ANOVA (analyse de régression pour les plans d’étude le long d’un gradient) |
| Reproduction |
| ANOVA ou ANCOVA |
| Condition |
| ANOVA ou ANCOVA |
| Survie |
| ANOVA |
*Critères d’effets utilisés pour déterminer les effets lors d’études de bivalves en cage. Les autres critères d’appui peuvent être utilisés pour étayer les analyses.
† Présentement, seuls des conseils concernant l’indice somatique du manteau (similaire à l’indice gonadosomatique) sont fournis (voir la section 9.3.8.5).
9.3.8.1 Survie
La survie n’est pas un indicateur particulièrement sensible des effets sur les bivalves en cage, mais elle constitue un paramètre important à surveiller. Elle peut facilement être déterminée et quantifiée, bien qu’il soit possible que certains spécimens soient manquants à la fin de l’essai en raison de la décomposition des coquilles. Les coquilles des bivalves morts sont grandes ouvertes et ne se ferment pas en réaction au toucher ou au tapotement. La survie s’exprime en pourcentage de sujets vivants par cage à la fin de la période d’exposition.
9.3.8.2 Croissance
La croissance est une mesure d’utilisation d’énergie et constitue un indicateur sensible des effets facile à mesurer. Il faut effectuer plusieurs types de mesures de la croissance; se limiter à une seule pourrait produire des résultats trompeurs. Les mesures de la croissance, accompagnées d’une indication du degré prévu d’exactitude, doivent être prises au début et à la fin de l’essai comme ci-dessous :
La croissance peut s’exprimer de plusieurs manières :
- croissance absolue : changement de valeur en termes absolus entre le début et la fin de l’essai;
- taux de croissance : changement de valeur en termes absolus par unité de temps (habituellement, des intervalles d’une semaine sont utilisés);
- croissance relative : (poids final – poids initial)/poids initial; on peut utiliser la croissance relative lorsqu’il existe une différence significative entre les poids initiaux des sujets dans plusieurs cages. La croissance relative est exprimée comme une proportion, de sorte qu’il peut être approprié de procéder à une transformation des valeurs en racine carrée de l’arc-sinus avant d’effectuer les tests statistiques. Green (1979) fournit des conseils utiles sur cette transformation en faisant remarquer que celle-ci n’est habituellement pas nécessaire pour les données de proportions qui se situent entre 0,3 et 0,7, et que si elle n’est pas toujours utile, elle ne nuit probablement pas non plus aux résultats.
Il convient d’utiliser l’expression de la croissance la plus appropriée en fonction du plan d’étude et des caractéristiques propres à chaque site.
9.3.8.3 Condition
La condition est une mesure de la façon dont l’animal stocke son énergie; elle peut être mesurée chez les adultes ou chez les juvéniles. Il existe plus d’une option pour calculer la condition. Il convient de noter que certaines de ces méthodes nécessitent la mesure de variables additionnelles à celles qui ont été énumérées à la section 9.3.8.2. Le choix de la méthode la plus appropriée pour calculer la condition est laissé à la discrétion des chercheurs.
Poids (poids sec de l’animal entier, poids de la coquille sèche ou poids des tissus mous) par rapport à la longueur de la coquille – Ce rapport est analogue à l’indice de condition de Fulton (Ricker, 1975; Anderson et Neumann, 1996) utilisé en biologie des pêches. Il peut être caractérisé selon la formule classique d’une ligne droite (p. ex., dans Mackie et Flippance, 1983) avec une pente (C) et une ordonnée à l’origine (b) :
log poids = b + (C × log longueur)
Les valeurs élevées de C signifient que le bivalve en cause possède un poids tissulaire relativement important pour une longueur donnée, tandis que les valeurs basses peuvent indiquer que le sujet n’obtient pas suffisamment de nourriture ou a été soumis à des conditions de stress chronique qui l’ont empêché de se développer. Cette méthode de caractérisation convient à l’évaluation de la condition des bivalves sauvages, chez lesquels la longueur des coquilles peut présenter des variations assez importantes. Elle n’est toutefois pas fiable dans le cas des bivalves en cage, car les animaux ont été triés au début de l’essai pour l’obtention d’une longueur uniforme. Elle peut également ne pas convenir dans le cas des bivalves, car plusieurs facteurs environnementaux influent sur la longueur des coquilles et le poids des tissus (M. Salazar, comm. pers.).
Poids des tissus mous par rapport au poids de la coquille – Cette méthode de caractérisation utilise le poids des tissus mous et le poids de la coquille. On peut effectuer une analyse de variance ou, plus simplement, diviser le poids des tissus mous par le poids de la coquille. Grout et Levings (2000) ont mesuré la condition de Moules bleues en calculant le ratio entre le poids des tissus et le poids de la coquille. Leurs résultats indiquent que la condition permet de distinguer des moules en cage situées dans une zone caractérisée par un taux de survie élevé (indice de condition variant de 1,1 à 1,42) de moules en cage situées dans une zone marquée par un faible taux de survie (indice de condition variant de 0,82 à 0,96).
Poids des tissus mous par rapport au volume de la coquille – Mucklow (1996; d’après Seed, 1968) a utilisé cette méthode pour calculer la condition en divisant le poids sec des tissus mous par le volume de la coquille, lequel est le produit de la longueur, de la largeur et de la hauteur. Dans une étude de populations de Moules bleues sauvages, il a conclu que les variations saisonnières de l’indice de condition fluctuent et sont tributaires d’un certain nombre de facteurs naturels, notamment la disponibilité de la nourriture et les besoins physiologiques en énergie (Mucklow, 1996).
9.3.8.4 Mesure de l’énergie
Comme l’indique la figure 9-11, l’énergie peut également s’accumuler dans le manteau et obéit à un cycle annuel. En règle générale, les Moules bleues atteignent leur teneur maximale en énergie à la fin de l’automne. À ce stade, le poids du manteau correspond principalement au glycogène stocké qui servira plus tard à la reproduction. Avant de procéder à la dissection, il convient de mesurer le poids humide de l’animal entier (PHAE) et les dimensions de la coquille (longueur, poids, hauteur et impressions musculaires). Les lobes du manteau doivent être séparés du corps et pesés (poids humide du manteau), et le poids du reste du corps est ensuite ajouté pour déterminer le poids total du corps. Les échantillons doivent être séchés à 55 oC jusqu’à ce que leur poids devienne constant (environ deux à trois jours). Le poids sec du manteau et le poids sec du corps doivent tous deux être mesurés pour servir au calcul d’indices comme l’IHS, qui correspond chez les bivalves au ratio du poids sec du manteau par rapport au poids sec de l’animal entier.

Figure 9-16 : A) Échantillon de manteau avec les instruments nécessaires pour son prélèvement; B) échantillon de manteau homogénéisé et prêt à l’analyse.
9.3.8.5 Effort de reproduction
Des recherches récentes ont permis de constater que l’indice somatique du manteau (ISM) des bivalves est semblable à l’indice gonadosomatique (IGS) des poissons et peut servir à déterminer l’investissement reproductif. La plupart des gamètes produits par le bivalve se trouvent dans les lobes du manteau. Voici un résumé des étapes à suivre pour déterminer l’indice somatique du manteau des bivalves :
- Mesurer la longueur, la largeur, la hauteur et le poids de l’animal entier.
- Disséquer chaque bivalve.
- Déterminer le sexe.
- Enlever et peser chaque lobe du manteau et déterminer la masse corporelle de chaque individu.
- Dans le cas d’une femelle, un lobe du manteau devrait servir à calculer le poids sec et l’IGS(le rapport entre la masse corporelle [moins la gonade] et la gonade); dans le cas d’un mâle, les deux lobes sont utilisés, et le calcul pour la femelle devrait être extrapolé pour les deux lobes.
- Le deuxième lobe devrait servir à évaluer l’effort de reproduction en mesurant et en comptant les œufs.
- Calculer l’indice somatique du manteau (le rapport entre la masse corporelle [moins la gonade] et la gonade).
L’indice somatique du manteau devrait être calculé lorsque 90 % du lobe du manteau contiennent des gonades. De nombreux facteurs à prendre en compte influent sur la période de la fraie : la profondeur de l’eau, la température saisonnière, les systèmes de réponses et la prévalence des différentes espèces. Boudreau et al. (en préparation) et St-Jean et al. (2008) ont effectué des études faisant appel à l’indice somatique du manteau sur les côtes canadiennes de l’Atlantique et du Pacifique en utilisant diverses espèces. Ils ont constaté que, dans le cas de Mytilus trossulus (côte du Pacifique), la production de gamètes précédant la fraie ne présentait pas le pic caractéristique observé chez Mytilus edulis (côte de l’Atlantique). Boudreau et al., (en préparation) ont aussi évalué l’effort de reproduction en comptant et en pesant les œufs contenus dans chaque manteau.
Pour en savoir plus sur l’indice somatique du manteau, consulter St-Jean (2003) ou contacter le coordonnateur régional du Programme d’ESEE pour plus de renseignements et les descriptions complètes des techniques.
En résumé, la technique supplémentaire (figure 9-16) comprend les étapes suivantes :
- Mesure du poids du lobe de la gonade sur une balance de précision.
- Extraction d’un échantillon de tissu à l’aide des pailles fournies.
- Mesure du poids de l’échantillon de tissu.
- Homogénéisation de l’échantillon de tissu.
- À l’aide d’un micromètre oculaire à grossissement 400X, mesure de 20 œufs (mesurer l’œuf entier et le noyau).
- Dénombrement des sous-échantillons représentatifs dans une cellule à numération.
- Répétition de l’étape 6 deux autres fois pour arriver à un total de trois dénombrements.
| Site Station Biologiste Observations : | Date de réception Date de traitement Analyses chimiques requises? Date d’expédition Poids de l’échant. (chimie) | Entreposage À : | ||||||
| Animal No | Lon- gueur (L) (mm) | Hau- teur (H) (mm) | Lar- geur (W) (mm) | Poids humide de l’ani- mal entier (g) | Man- teau (poids humide) (g) | Poids sec de l'animal entier (g) | Man- teau (poids sec) (g) | Poids sec de la coquille (g) |
|---|---|---|---|---|---|---|---|---|
| 1 | ||||||||
| 2 | ||||||||
| 3 | ||||||||
| 4 | ||||||||
| 5 | ||||||||
| 6 | ||||||||
| 7 | ||||||||
| 8 | ||||||||
| 9 | ||||||||
| 10 | ||||||||
| 11 | ||||||||
| 12 | ||||||||
| 13 | ||||||||
| 14 | ||||||||
| 15 | ||||||||
| 16 | ||||||||
| 17 | ||||||||
| 18 | ||||||||
| 19 | ||||||||
| 20 | ||||||||
| QA/QC | ||||||||
Nombre de mollusques vivants à la fin de l’essai _________
Taux de survie en % _________
| Date | Heure | Température (°C ) | Concentration d’oxygène dissous (mg/L) | Salinité (‰) | Vitesse du courant (cm/s) | Direction du courant (degrés) |
|---|---|---|---|---|---|---|
Travail exécuté par : _____________________________________________
Notes :
* Fiche de terrain fournie par SSJ Environmental Limited.
9.3.9 Assurance de la qualité et contrôle de la qualité
Tout le travail devrait être confié à des personnes compétentes (biologistes et techniciens). Les entrepreneurs devraient être choisis en fonction de leur expertise. Tout le travail sur le terrain devrait être effectué conformément aux modes opératoires normalisés pour assurer la cohérence globale et faire en sorte que les méthodes appropriées sont utilisées. Toutes les mesures effectuées sur le terrain ou en laboratoire devraient être faites à l’aide d’instruments correctement étalonnés. Toutes les données de terrain devraient être consignées sur des formulaires normalisés pour faire en sorte que toutes les données requises soient recueillies dans un format reproductible et standard.
Vingt pour cent de toutes les mesures prises devraient être reprises pour assurer l’exactitude et la reproductibilité des mesures prises sur le terrain et des résultats des analyses en laboratoire. Pour les bivalves en boudins, reprendre les mesures sur au moins deux bivalves par boudin.
La première étape de l’analyse des données consiste à éliminer les valeurs aberrantes. Un moyen rapide consiste à établir des diagrammes de dispersion de paires de variables et d’y superposer des ellipses correspondant à l’intervalle de confiance de 95 %. Les valeurs aberrantes potentielles sont celles qui se trouvent à l’extérieur de l’ellipse. Ces valeurs peuvent être dues à diverses causes, y compris les erreurs de saisie ou de transcription. Lorsque des valeurs aberrantes sont détectées, il convient d’examiner l’ensemble des données pour tenter d’en déceler la source et, si possible, de la supprimer. Lorsque cela n’est pas possible, l’analyse devrait être effectuée avec et sans les valeurs aberrantes afin d’évaluer l’incidence de ces dernières sur les résultats de l’analyse.
Les données statistiques doivent être examinées pour évaluer dans quelle mesure elles sont conformes aux hypothèses sous-jacentes (p. ex., normalité et homogénéité des variances ou égalité des pentes dans l’analyse de covariance). Le cas échéant, des transformations pourraient être requises pour réduire les écarts par rapport aux hypothèses de base.
9.3.10 Analyses des données
Les analyses des données et l’interprétation des résultats devraient être adaptées au plan d’étude. Les études de bivalves en cage menées dans le cadre de l’ESEE visent à déterminer s’il existe des effets significatifs sur le biote à proximité des points de rejet des effluents. Il est possible d’atteindre ce but en utilisant un plan contrôle-impact (référence – exposition) ou encore un plan par gradient (régression). Les méthodes statistiques appropriées pour chaque indicateur d’effet (c.-à-d. la survie, la croissance, la condition, la reproduction et l’énergie) sont résumées dans le tableau 9-7.
Il convient de procéder à une ANCOVA pour tester l’IGS (poids sec de la gonade) et la condition (poids corporel sec) avec des covariables, pour enlever les influences, dont le poids corporel sec pour l’IGS et la longueur de la coquille pour la condition. Lorsqu’une interaction entre le traitement et la covariable interdit l’utilisation d’une ANCOVA, comparer les sous-ensembles stratifiés de la covariable à l’aide d’une ANOVA à un facteur. Lorsque les groupes témoins ne sont pas significativement différents, ils devraient être combinés aux fins des analyses. Toutefois, si on observe une différence significative entre les groupes, tous les témoins devraient être pris en compte dans les analyses. Un test de comparaisons multiples de Tukey peut être utilisé lorsque des différences significatives sont constatées entres les groupes. Les cas de non-normalité (graphique de probabilité) ou d’hétéroscédasticité (test Fmax) qui ne peuvent être résolus par des méthodes appropriées de transformation des données devraient faire l’objet d’une analyse non paramétrique (test de Kruskal-Wallis), suivie d’un test de comparaisons multiples de Noether (Scherrer, 1984; Zar, 1999). Une analyse par la méthode des probits peut être utilisée pour la survie. Le seuil de signification devrait être p < 0,05, et les moyennes rétrotransformées devraient s’accompagner de leur intervalle de confiance à 95 %.
La première étape consiste à produire des statistiques sommaires pour chaque paramètre (c.-à-d. le PHAE, la longueur des coquilles, le poids frais des tissus mous), pour chaque cage et chaque station.
La deuxième étape vise à déterminer s’il existe des différences significatives entre les cages répétées pour chacun des paramètres mesurés avant le déploiement (s’ils n’ont pas été mesurés après la répartition et avant le déploiement). Pour ce faire, on évalue la normalité des données et l’homogénéité des variances.
La dernière étape consiste à appliquer le test statistique approprié au plan d’étude. En général, des ANOVA et des tests de comparaisons multiples servent à vérifier l’hypothèse et à effectuer des comparaisons entre les stations. Pour les plans d’échantillonnage C-I et C-IM auxquels sont associées respectivement des ANOVA et des ANCOVA, des indications détaillées sont présentées au chapitre 8 du présent guide. S’il existe une différence statistiquement significative, un test de comparaisons multiples, ou son équivalent pour des données non paramétriques, peut être employé pour déterminer quelles stations sont différentes des autres. En général, les analyses de régression linéaire et multiple (en effectuant la régression des variables en fonction de la distance) servent à établir les relations entre les variables le long du gradient d’exposition. Pour les analyses de covariance de la condition, les covariables seront fonction de la formule de calcul de la condition choisie.
9.3.11 Mercure
Si une mine doit mesurer les concentrations de mercure dans les tissus des poissons, il est possible de le faire chez des bivalves en cage. Cette approche nécessite toutefois certaines précautions, notamment :
- Établir la durée d’exposition de sorte que le mercure puisse s’accumuler dans les tissus des bivalves à des concentrations décelables.
- Tenir compte de la récolte éventuelle (commerciale ou récréative) de bivalves pour la consommation humaine dans la zone en question.
- S’assurer d’inclure, dans le plan d’étude, un nombre suffisant de bivalves pour obtenir la quantité de tissus nécessaire aux analyses.
Il est possible que, pour certaines mines, l’utilisation de bivalves en cage pour mesurer l’assimilation de mercure ne soit pas appropriée. Toute proposition visant à utiliser cette méthode pour la mesure des concentrations de mercure devrait recevoir l’approbation de l’agent régional d’autorisation.
9.3.12 Rapports
Les exigences relatives à l’AQ/CQ pour les études de bivalves en cage sont les mêmes que celles exposées dans le chapitre 3 du présent guide traitant des études des poissons. Les mesures d’AQ/CQ s’appliquent aux composantes suivantes des études de bivalves en cage :
- plan d’étude;
- échantillonnage sur le terrain;
- traitement des échantillons et analyses en laboratoire;
- analyses des données;
- rapports.
9.4 Références
Anderson, R.O., et R.M. Neumann. 1996. « Length, weight, and associated structural indices », dans B.R. Murphy et D.W. Willis (éd.), Fisheries Techniques. 2nd Edition. Bethesda (MD), American Fisheries Society. Pp. 447-482.
Andrews, S., et R. Parker. 1999. Draft Report (II). An Environmental Quality Evaluation of Pictou Harbour, Nova Scotia, Using Caged Bivalves, Mytilus edulis. Darthmout (N.-É.), Environnement Canada, Direction de la protection de l’environnement, pour The Pictou Harbour Environmental Protection Project, New Glasgow (N.-É.).
Ankley, G.T., K.M. Jensen, M.D. Kahl, J.J. Korte et E.A. Makynen. 2001. « Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas) », Environmental Toxicology and Chemistry, 20 : 1276-1290.
Ankley, GT, K.M. Jensen, E.A. Makynen, M.D. Kahl, J.J. Korte, M.W. Hornung, T.R. Henry, J.S. Denny, R.L. Leino, V.S. Wilson, M.C. Cardon, P.C. Hartig et L.E. Gray. 2003. « Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow », Environmental Toxicology and Chemistry, 22 : 1350-1360.
Applied Biomonitoring. 2000. Caged Mussel Pilot Study, Port Alice Mill, Vancouver Island. Programme d’ESEE, Environnement Canada, Direction de la protection de l’environnement, Région du Pacifique et du Yukon. Rapport manuscrit régional MS 00-01.
Atz, J.W. 1986. « Fundulus heteroclitus in the laboratory: A history », American Zoologist, 26 :111-120.
Barber, W.E., et N.R. Kevern. 1974. « Seasonal variation of sieving efficiency in a lotic habitat », Freshwater Biology, 4 : 293-300.
Bauer G. 1994. « The adaptive value of offspring size among freshwater mussels (Bivalvia; Unionoidea) », Journal of Animal Ecology, 63 : 933–944.
Beckvar, N., S. Salazar, M. Salazar et K. Finkelstein. 2000. « An in situ assessment of mercury contamination in the Sudbury River, Massachusetts, using transplanted freshwater mussels (Elliptio complanata) », Canadian Journal of Fishery and Aquatic Sciences, 57 : 1103-1112.
Bothwell, M.L. 1985. « Phosphorus limitation of lotic periphyton growth rates: An intersite comparison using continuous-flow troughs (Thompson River system, British Columbia) », Limnology and Oceanography, 30 : 527-542.
Bothwell, M.L., et R.J. Daley. 1981. Determination of Phosphorus Sufficiency and Growth Rates of Benthic Algae in the Thompson River, BC, Using Experimental Flowing Troughs. Vancouver (C.-B.), Environnement Canada, Direction générale des eaux intérieures. IWD Regional Report.
Bothwell, M.L., G. Derksen, R.N. Nordin et J.M. Culp. 1992. « Nutrient and grazer control of algal biomass in the Thompson River, British Columbia: A case history of water quality management » dans R.D. Robarts et M.L. Bothwell (éd.), Aquatic Ecosystems in Semi-arid Regions: Implications for Resource Management. Saskatoon (Sask.), Environnement Canada, Institut national de recherche en hydrologie. National Hydrology Research Institute Symposium Series 7, pp. 253-266.
Bothwell, M.L., et J.M. Culp. 1993. Sensitivity of the Thompson River to Phosphorus: Studies on Trophic Dynamics. Saskatoon (Sask.), Environnement Canada, Institut national de recherche en hydrologie. NHRI Contribution No. 93006.
Burt, A., D.L. Kramer, K. Nakasuru et C. Spry. 1988. « The tempo of reproduction in Hyphessobrycon pulchripinnis (Characidae), with a discussion on the biology of "multiple spawning" », Environmental Biology of Fish, 22 : 15-27.
Carlisle, D.M. 2000. « Bioenergetic food webs as a means of linking toxicological effects across scales of ecological organization ». Journal of Aquatic Ecosystem Stress and Recovery, 7 : 155‑165.
Cash, K.J., J.M. Culp, M.G. Dubé, R.B. Lowell, N.E. Glozier et R.B. Brua. 2003. « Integrating mesocosm experiments with field and laboratory studies to generate weight-of-evidence risk assessments for ecosystem health », Aquatic Ecosystem Health and Management. 6: 177-183.
Chen, C.Y., R.S. Stemberger, B. Klaue, J.D. Blum, P.C. Pickhardt et C.L. Folt. 2000. « Accumulation of heavy metals in food web components across a gradient of lakes », Limnology and Oceanography. 45, 1525-1536.
Clarke, A. 1973. « The freshwater molluscs of the Canadian Interior Basin », Malacologia, 13 : 1‑509.
Clarke, A. 1981. Les mollusques d’eau douce du Canada. Ottawa (Ont.), Musée national des sciences naturelles/Musées nationaux du Canada. 447 pages.
Coad, B.W. 1995. Encyclopedia of Canadian Fishes. Waterdown (Ont.), Canada Museum of Nature and Canadian Sportfishing Productions Inc. 928 pages.
Couillard Y., P.G.C. Campbell, A. Tessier, J. Pellerin-Massicotte et J.C. Auclair. 1995 a. « Field transplantation of a freshwater bivalve, Pyganodon grandis, across a metal contamination gradient. I. Temporal changes in metallothionein and metal (Cd, Cu, and Zn) concentrations in soft tissues », Canadian Journal of Fisheries and Aquatic Sciences, 52 : 690-702.
Couillard Y., P.G.C. Campbell, A. Tessier, J. Pellerin-Massicotte et J.C. Auclair. 1995b. « Field transplantation of a freshwater bivalve, Pyganodon grandis, across a metal contamination gradient. II. Metallothionein response to Cd and Zn exposure, evidence for cytotoxicity, and links to effects at higher levels of biological organization », Canadian Journal of Fisheries and Aquatic Sciences, 52 : 703-715.
Courtenay, S.C., W.R. Parker et G.P. Rawn. 1998. Proceedings of a Workshop to Assess Alternatives to the Fish Survey Component of the Environmental Effects Monitoring Program for Canadian Pulp and Paper Mills. Canadian Technical Report of Fisheries and Aquatic Sciences No. 2233, viii + 108 pages.
Crane, M., G.A. Burton, J.M. Culp, M.S. Greenberg, K.R. Munkittrick, R. Ribeiro, M. Salazar et S. St-Jean. 2007. « In situ approaches for stressor and effect diagnosis », Integrated Environmental Assessment and Managment, 3 : 234-245.
Culp, J.M., et K.J. Cash. 1995. Potential Impacts of Effluent on the Thompson and Upper Fraser Rivers. Vancouver (C.-B.), Environnement Canada, Direction de la conservation de l’environnement, Plan d’action du fleuve Fraser. DOE FRAP 1995-10.
Culp, J.M., et R.B. Lowell. 1998. « Pulp mill effluent impacts on benthic communities and selected fish species in the Fraser River Basin », dans C. Gray et T. Tuominen (éd.), Health of the Fraser River Aquatic Ecosystem, Vol. II. Ottawa (Ont.), Environnement Canada. DOE FRAP 1998-11, pp.13-34.
Culp, J.M., et C.L. Podemski. 1996. « Design and application of a novel stream microcosm system for assessing effluent impacts to large rivers », dans M.R. Servos, K.R. Munkittrick, J.H. Carey et G.J. Van Der Kraak (éd.), Environmental Fate and Effects of Pulp and Paper Mill Effluents. Delray Beach (FL), St. Lucie Press. Pp. 549-555.
Culp, J.M., C.L. Podemski, K.J. Cash et R.B. Lowell. 1996. « Utility of field-based artificial streams for assessing effluent effects on riverine ecosystems »,Journal of Aquatic Ecosystem Health, 5 : 117-124.
Culp, J.M., R.B. Lowell et K.J. Cash. 2000a. « Integrating mesocosm experiments with field and laboratory studies to generate weight-of-evidence risk assessments for large rivers », Environmental Toxicology and Chemistry, 19 : 1167-1173.
Culp, J.M., C.L. Podemski, K.J. Cash et R.B. Lowell. 2000b. « A research strategy for using stream microcosms in ecotoxicology: Integrating experiments at different levels of biological organization with field data », Journal of Aquatic Ecosystem Stress and Recovery, 7 : 167-176.
Culp, J.M., C.L. Podemski et K.J. Cash. 2001. « Interactive effects of nutrients and contaminates from pulp mill effluents on riverine benthos », Journal of Aquatic Ecosystem Stress and Recovery, 8 (1) : 67-75.
Culp, J.M., N.E. Glozier, K.J. Cash, M.G. Dubé, M. Waiser, D.L. MacLatchy, B. Brua, B. Firth et G. Wilson. 2004. « Cumulative effects investigation of pulp mill and sewage effluent impacts on benthic food webs: A mesocosm example », dans D.L. Borton, T.J. Hall, R.P. Fisher et J.F. Thomas, Pulp and Paper Mill Effluent Environmental Fate and Effects. Lancaster (PA), DEStech Publications. Proceedings of the Fifth International Conference on Fate and Effects of Pulp and Paper Mill Effluents, June 1-4, 2003, Seattle, Washington, USA. Pp. 464-472.
Day, K.E., J.L. Metcalfe et S.P. Batchelor. 1990. « Changes in intracellular free amino acids in tissues of the caged mussel (Elliptio complanata), exposed to contaminated environments », Archives of Environmental Contamination and Toxicology, 19 : 816-827.
Drake, J.A., G.R. Huxel et C.L. Hewitt. 1996. « Microcosms as models for generating and testing community theory », Ecology, 77 : 670-677.
Dubé, M.G. 1995. « Effects of bleached kraft pulp mill effluent on periphyton and chironomid abundance in the Thompson River, British Columbia ». , Saskatoon (Sask.), Université de la Saskatchewan. Mémoire de maîtrise en sciences, 129 pages.
Dubé, M.G. 2000. « Sources of contaminants in the bleached kraft pulping process and their effect on the mummichog (Fundulus heteroclitus). Saint John (N.-B.), Université du Nouveau-Brunswick. Mémoire.
Dubé, M.G., et J.M. Culp. 1996. « Growth responses of periphyton and chironomids exposed to biologically treated bleached kraft pulp mill effluent », Environmental Toxicology and Chemistry, 15 : 2019-2027.
Dubé, M.G., et D.L. MacLatchy. 2000a. « Endocrine responses of an estuarine fish Fundulus heteroclitus to final effluent from a bleached kraft pulp mill before and after installation of reverse osmosis treatment of a waste stream ». Environmental Toxicology and Chemistry, 19 :2788-2796.
Dubé, M.G., et D.L. MacLatchy. 2000b. « Reverse osmosis treatment of condensates from a bleached kraft pulp mill: Effects on acute and chronic toxicity of process streams and final effluent », dans M.Ruoppa, J. Paasivirta, K.-J. Lehtinen et S. Ruonala (éd.), Proceedings of the Fourth International Conference on Environmental Impacts of the Pulp and Paper Industry. Helsinki, Finlande. Pp. 270-276.
Dubé, M.G., et D.L. MacLatchy. 2001. « Identification and treatment of a waste stream at a bleached kraft pulp mill that depresses a sex steroid in the mummichog (Fundulus heteroclitus) », Environmental Toxicology and Chemistry, 20 : 985-995.
Dubé, M.G., J.M. Culp et G.J. Scrimgeour. 1997. « Nutrient limitation and herbivory: Processes influenced by bleached kraft pulp mill effluent », Canadian Journal of Fisheries and Aquatic Sciences, 54 : 2584-2595.
Dubé,M.G., J.M. Culp, K.J. Cash, N.E. Glozier, D.L. MacLatchy, C.L. Podemski et R.B. Lowell. 2001. « Artificial streams for environmental effects monitoring (EEM): Development and application in Canada over the past decade », Water Quality Research Journal of Canada, 37 (1) : 155-180.
Dubé, M.G., J.M. Culp, D.L. MacLatchy, G. Gillis, R. Parker, S. Courtenay et C. Gilman. 2002. « Utility of mobile, field-based artificial streams for assessing effects of pulp mill effluents on fish in the Canadian Environmental Effects Monitoring (EEM) program », Journal of Aquatic Ecosystem Stress and Recovery, 9 : 85-102.
Dubé M.G., D.L. MacLatchy, B.K. Firth, J.M. Culp, N.E. Glozier et K.J. Cash. 2004. « Using mesocosms to explore confounding factors influencing longnose dace (Rhinichthys cataractae) responses to kraft mill effluent on the Wapiti River, AB, Canada », dans D.L. Borton, T.J. Hall, R.P. Fisher et J.F. Thomas (éd.), Pulp and Paper Mill Effluent Environmental Fate and Effects. Proceedings of the Fifth International Conference on Fate and Effects of Pulp and Paper Mill Effluents, June 1-4, 2003, Seattle, Washington, USA. Lancaster, (PA), DEStech Publications, pp. 481-490.
Dubé M.G., D.L. MacLatchy, J.D. Kieffer, N.E. Glozier, J.M. Culp et K.J. Cash. 2005. « Effects of metal mining effluent on Atlantic salmon (Salmo salar) and slimy sculpin (Cottus cognatus): Using mesocosms to assess existing effects and predict future consequences », Science of the Total Environment, 343 : 135-154.
Dubé M.G., D.L. MacLatchy, K.A. Hruska et N.E. Glozier. 2006. « Assessing the responses of creek chub (Semotilus atromaculatus) and pearl dace (Semotilus margarita) to metal mine effluents using in situ artificial streams in Sudbury, Ontario, Canada ». Environmental Toxicology and Chemistry, 25 (1) : 18-28.
Environment Canada. 1997. Fish Survey Working Group Final Report. Recommendations from Cycle 1 Review. Ottawa (ON): National EEM Office, Science Policy and Environmental Quality Branch, Environment Canada. EEM/1997/6.
Federal-Provincial Thompson River Task Force. 1976. Sources and Effects of Algal Growth, Colour, Foaming and Fish Tainting in the Thompson River System. Victoria (C.-B.), British Columbia Ministry of Environment, Lands and Parks, Environmental Protection Division.
Freeman, K.R., K.L. Perry, T.G. DiBacco et D.J. Scarratt. 1994. Observations on Two Mytilid Species from a Nova Scotian Mussel Rarm. Rapport technique canadien des sciences halieutiques et aquatiques, no 1969.
Fritz, E.S., W.H. Meredith et V.A. Lotrich. 1975. « Fall and winter movements and activity level of the mummichog Fundulus heteroclitus, in a tidal creek », Chesapeake Science, 16 : 211-215.
Gibbons, W.N., K.R. Munkittrick et W.D. Taylor. 1998a « Suitability of small fish species for monitoring the effects of pulp mill effluent on fish. 1. Response of spoonhead sculpin exposed to bleached kraft mill effluent », Environmental Toxicology and Chemistry, 17 (11) : 2227-2237.
Gibbons, W.N., K.R. Munkittrick, M.E. McMaster et W.D. Taylor. 1998b. « Suitability of small fish species for monitoring the effects of pulp mill effluent on fish. 2. Comparison of trout perch responses to white sucker exposed to bleached kraft mill effluent », Environmental Toxicology and Chemistry, 17 (11) : 2238-2245.
Goldberg, E.D., V.T. Bowen, J.W. Farrington, G. Harvey, J.H. Martin, P.L. Parker, R.W. Risebrough, W. Robertson, E. Schneider et E. Gamble. 1978. « The Mussel Watch », Environmental Conservation, 5 (2) : 101-125.
Gray, C., et T. Tuominen. 1998. Health of the Fraser River Aquatic Ecosystem. Vancouver (C.‑B.), Environnement Canada. DOE FRAP 1998-11, vol. I.
Green, R.H. 1979. Sampling Design and Statistical Methods for Environmental Biologists. Toronto (Ont.), John Wiley & Sons. 257 pages.
Grout, J.A., et C.D. Levings. 2000. « Effects of acid mine drainage from an abandoned copper mine, Britannia Mines, Howe Sound, British Columbia, Canada, on transplanted blue mussels (Mytilus edulis) », Marine Environmental Research, 51 (3) : 265-288.
Gulf of Maine Counccil on the Marine Environment. 1997. Gulfwatch Project: Standard Procedures – Filed and Laboratory. Gulfwatch Implementation Period 1993-2001. 115 pages.
Harries, J.E., T. Runnals, E. Hill, C.A. Harris, S. Maddix, J.P. Sumpter et C.R. Tyler. 2000. « Development of a reproductive performance test for endocrine disrupting chemicals using pair breeding fathead minnows (Pimephales promelas) », Environmental Science & Technology,34 : 3003-3011.
Heins, D.C., et F.G. Rabito Jr. 1986. « Spawning performance in North American minnows: Direct evidence of the occurrence of multiple clutches in the genus Notropis », Journal of Fish Biology, 28 : 343-357.
Hinch, S.G., L.J. Kelly et R.H. Green.1989. « Morphological variation of Elliptio complanata (Bivalvia: Unionidae) in differing substrata of soft-water lakes exposed to acidic deposition », Canadian Journal of Zoology, 67 :1895-1899.
Hornbach, D.J., T.H. Wissing et A.J. Burky. 1982. « Life-history characteristics of a stream population of the freshwater clam Sphaerium striatinum Lamarck (Bivalvia: Pisidiidae) », Canadian Journal of Zoology, 60 : 249‑260.
Hruska, K., et M.G. Dubé. 2004. « Using artificial streams to assess the effects of metal-mining effluent on the life-cycle of the freshwater midge (Chironomus tentans) in situ », Environmental Toxicology and Chemistry, 23 (11) : 2709-2718.
Hruska, K., et M.G. Dubé. 2005. « Comparison of a partial life cycle bioassay in artificial streams to a standard beaker bioassay to assess effects of metal mine effluent on Chironomus tentans », Environmental Toxicology and Chemistry, 24 (9) : 2325-2335.
Hurlbert, S.H. 1984. « Pseudoreplication and the design of ecological field experiments », Ecological Monographs, 54 : 187-211.
Jadhav, M.L., et V.S. Lomte. 1982. « Seasonal variation in biochemical composition of the freshwater bivalve, Lamellidens corrianus ». Rivista di Idrobiologia, 21 : 1-7.
Jenkins, R.E., et N.M. Burkhead. 1993. Freshwater Fishes of Virginia. Bethesda (ML), American Fisheries Society. 1079 pages.
Jensen, K.M., J.J. Korte, M.D. Kahl, M.S. Pasha et G.T. Ankley. 2001. « Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas) », Comparative Biochemistry and Physiology – Part C, 128 : 127-141.
Jensen, K.M., M.D. Kahl, E.A. Makynen, J.J. Korte, R.L. Leino, B.C. Butterworth et G.T. Ankley. 2004. « Characterization of responses to the antiandrogen flutamide in a short-term reproduction assay with the fathead minnow », Aquatic Toxicology, 70 : 99-110.
Jernelov, A. 1996. « The International Mussel Watch: A global assessment of environmental levels of chemical contaminants », Science of the Total Environment, 188 (Suppl. 1) : 37-44.
Kneib, R.T. 1986. « The role of Fundulus heteroclitus in salt marsh trophic dynamics », American Zoologist,26 : 259-269.
Kneib, R.T., et A.E. Stiven. 1978. « Growth, reproduction, and feeding of Fundulus heteroclitus (L.) on a North Carolina salt marsh », Journal of Experimental Marine Biology and Ecology,31 : 121-140.
Leblanc, J., et C.M. Couillard. 1995. Description de la période de reproduction d'un poisson sentinelle : le choquemort (Fundulus heteroclitus) de l'estuaire de la Miramichi. Rapport technique canadien des sciences halieutiques et aquatiques, no 2057, vii + 32 pages.
Lowell, R.B., J.M. Culp et F.J. Wrona. 1995. « Stimulation of increased short-term growth and development of mayflies by pulp mill effluent », Environmental Toxicology and Chemistry, 14 : 1529-1541.
Lowell, R.B., J.M. Culp, F.J. Wrona et M.L. Bothwell. 1996. « Effects of pulp mill effluent on benthic freshwater invertebrates: Food availability and stimulation of increased growth and development », dans M.R. Servos, K.R. Munkittrick, J.H. Carey et G.J. Van Der Kraak (éd.), Environmental Fate and Effects of Pulp and Paper Mill Effluents. Delay Beach (FL),St. Lucie Press. Pp.525-532.
Lowell, R.B., J.M. Culp et M.G. Dubé. 2000. « A weight-of-evidence approach for northern river risk assessment: integrating the effects of multiple stressors », Environmental Toxicology and Chemistry, 19 : 1182-1190.
Mackie, G.L. 1978a. « Shell structure in freshwater Sphaeriaceae. (Bivalvia: Heterondonta) ». Canadian Journal of Zoology, 56 : 1-6.
Mackie, G.L. 1978b. « Are sphaeriid clams ovoviviparous or viviparous? », The Nautilus, 92 : 145-147.
Mackie, G.L., et L.A. Flippance. 1983. « Growth dynamics in Sphaerium rhomboideum (Bivalvia: Pisidiidae) », Canadian Journal of Zoology, 61 : 868-873.
Mackie, G.L., S.U. Quadri et A.H. Clarke. 1974. « Development of brood sacs in Musculium securis Bivalvia: Sphaeriidae », Nautilus, 88 : 109-111.
Mallet, A.L., et C.E. Carver. 1995. « Comparative growth and survival patterns of Mytilus trossulus and Mytilus edulis in Atlantic Canada », Journal canadien des sciences halieutiques et aquatiques, 52 : 1873-1880.
Malley, D.F., A.R. Stewart et B.D. Hall. 1996. « Uptake of methyl mercury by the floater mussel, Pyganodon grandis (Bivalvia, Unionidae), caged in a flooded wetland », Environmental Toxicology and Chemistry, 15 : 928-936.
Martel, P., T. Kovacs et R. Voss. 2003. « Survey of pulp and paper mill effluents for their potential to affect fish reproduction ». Proceedings of the Fifth International Conference on the Fate and Effects of Pulp and Paper Mill Effluents, Seattle, Washington, USA, June 1-4. Pp. 78‑91.
Mason, R.P., J.M. Laporte et S. Andres. 2000. « Factors controlling the bioaccumulation of mercury, methylmercury, arsenic, selenium and cadmium by freshwater invertebrates and fish ». Archives of Environmental Contamination and Toxicology, 38 : 283-297.
McDonald, J.H., R. Seed et R.K. Koehn. 1991. « Allozymes and morphometric characteristics of three species of Mytilus in the northern and southern hemispheres », Marine Biology, 11 : 323‑333.
McGreer, E.R., et W. Belzer. 1998. « Contaminant sources », dans C. Gray et T. Tuominen (éd.), Health of the Fraser River Aquatic Ecosystem. Ottawa (Ont.), Environnement Canada. Vol. I. DOE FRAP 1998-11, vol. I, pp. 7-22.
McMahon, R.F. 1991. « Mollusca: Bivalvia », dans J.H. Thorp et A.P. Covich (éd.), Ecology and Classification of North American Freshwater Invertebrates. San Diego (CA), Academic Press. Pp. 315-399.
Metcalfe-Smith, J.L., R.H. Green et L.C. Grapentine. 1996. « Influence of biological factors on concentrations of metals in the tissues of freshwater mussels (Elliptio complanata and Lampsilis radiata radiata) from the St. Lawrence River », Journal canadien des sciences halieutiques et aquatiques, 53 : 205-219.
Mucklow, L.C. 1996. « Effects of season and species on physiological condition and contaminant burdens in mussels (Mytilus edulis L. and Mytilus trossulus G.): Implications for mussel watch programs ». Halifax (N.-É.), Université de Dalhousie, School for Resource and Environmental Studies. Mémoire de maîtrise.
Nelson, J.S., et M.J. Paetz. 1992. The Fishes of Alberta. Calgary (Alb.), The University of Calgary Press.
Newell, R.I.E. 1989. Species Profile of the Blue Mussel, Mytilus edulis. U.S. Fish and Wildlife Service Biological Report 82(11), 40 pages.
Ni, I.H., W.X. Wang et Y.K. Tam. 2000. « Transfer of Cd, Cr and Zn from zooplankton prey to mudskipper Periophthalmus cantonensis and glassy Ambassis urotaenia fishes », Marine Ecology Progress Series,194 : 203-210
O’Connor, T.P. 1992. Recent Trends in Coastal Environmental Quality: Results from the First Five Years of the NOAA Mussel Watch Project. Washington, DC. U.S. Department of Commerce, National Oceanic and Atmospheric Administration (NOAA), National Ocean Service.
OCDE – Organisation de coopération et de développement économiques. 2001. Detailed Review Paper: Appraisal of Test Methods for Sex Hormone Disrupting Chemicals. OECD Series on Testing and Assessment No. 21. ENV/JM/MONO(2002)8.
OCDE – Organisation de coopération et de développement économiques . 2006. Report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances (Phase 1B). OECD Series on Testing and Assessment No. 61:ENV/JM/MONO(2006)29.
Paine, M.D. 1990. « Life history tactics of darters (Percidae: Etheostomatiini) and their relationship with body size, reproductive behaviour, latitude and rarity », Journal of Fish Biology, 37 : 473-488.
Paine, M.D. 2000. « EEM Design ». Bref cours présenté au 27th Annual Aquatic Toxicity Workshop, du 1er au 4 octobre, St. John’s, Terre-Neuve.
Panter, G.H., T.H. Hutchinson, R. Lange, C.M. Lye, J.P. Sumpter, M. Zerulla et C.R. Tyler. 2002. « Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances », Environmental Toxicology and Chemistry, 21 (2) : 319-326.
Parker, R., et N. Smith. 1997. « A synopsis of the results of environmental effects monitoring studies at 19 pulp and paper mills in Atlantic Canada », Proceedings of the Third International Conference on Environmental Effects of Pulp and Paper Mill Effluents. Rotorua, Nouvelle-Zélande. Pp. 432-441.
Parrott, J.L. 2005. « Overview of methodology and endpoints in fathead minnow lifecycle tests assessing pulp and paper mill effluents », Water Quality Research Journal of Canada, 40 : 334‑346.
Parrott, J.L., et C.S. Wood. 2001. « Fathead minnow lifecycle tests for detection of endocrine disrupting substances in effluents », Water Quality Research Journal of Canada,37 : 651-667.
Penney, R.W., M.J. Hart et N. Templeman. 2002. « Comparative growth of cultured blue mussels, Mytilus edulis, M. trossulus and their hybrids, in naturally occurring mixed-species stocks », Aquaculture Research, 33 : 693-702.
Podemski, C.L. 1999. « Ecological effects of a bleached kraft pulp mill effluent on benthic biota of the Athabasca River ». Saskatoon (Sask.), Université de Saskatchewan. Thèse de doctorat, 292 pages.
Podemski C.L., et J.M. Culp. 1996. « Nutrient and contaminant effects of bleached kraft mill effluent on benthic algae and insects of the Athabasca River »dans M.R. Servos, K.R. Munkittrick, J.H. Carey et G.J. Van Der Kraak (éd.), Environmental Fate and Effects of Pulp and Paper Mill Effluents. Delay Beach (FL), St. Lucie Press. Pp. 571-580.
Pollock, M.S., S.E. Fisher, A.J. Squires, R.J. Pollock, D.P. Chivers et M.G. Dubé. 2008. « Relative body size influences breeding propensity in fathead minnows: Implication for ecotoxicology testing procedures », Water Quality Research Journal of Canada, 43 (4) : 257‑264.
Pollock, M.S., M.G. Dubé, J. LaPorte, L. Clarke et R. Schryer. 2009. « Investigating the link between pulp mill effluent and endocrine disruption: Attempts to explain the presence of male and female hermaphrodites in the Wabigoon River, Ontario », Environmental Toxicology and Chemistry, 29 (4) : 952-965.
Portt, C.B., G.A. Coker, D.L. Ming et R.G. Randall. 2006. A Review of Fish Sampling Methods Commonly Used in Canadian Freshwater Habitats. Rapport technique canadien des sciences halieutiques et aquatiques no 2604. Ottawa (Ont.), Pêches et Océans Canada. Cat. no Fs97-6/2604E.
Ramón, M., et C.A. Richardson. 1992. « Age determination and shell growth of Chamelea gallina (Bivalvia: Veneridae) in the western Mediterranean », Marine Ecology Progress Series, 89 : 15‑23.
Rawson, P.D., C. Slaughter et P.O. Yund. 2003. « Patterns of gamete incompatibility between the blue mussels Mytilus edulis and M. trossulus », Marine Biology, 143 : 317-325.
Rees, H.L. 1984. « A note on mesh selection and sampling efficiency in benthic studies », Marine Pollution Bulletin, 15 : 225-229.
Resh, V.H., et E.P. McElravy. 1993. « Contemporary quantitative approaches to biomonitoring using benthic macroinvertebrates », dans D.M. Rosenberg et V.H. Resh (éd.), Freshwater Biomonitoring and Benthic Invertebrates. New York (NY), Chapman & Hall. Pp.159-194.
Ricker, W.E. 1980. Calcul et interprétation des statistiques biologiques des populations de poissons. Bulletin 191F. Ottawa (Ont.), Ministère des Pêches et des Océans, Office des recherches sur les pêcheries du Canada.
Rickwood, C.J., M.D. Dubé, L.M. Hewitt, T. Kovacs, J.L. Parrott et D.L. MacLatchy. 2006a. « Use of paired fathead minnow (Pimephales promelas) reproductive test: Part I. Assessing biological effects of final bleached kraft pulp mill effluent using a mobile bioassay trailer system », Environmental Toxicology and Chemistry, 25 : 191-201.
Rickwood, C.J., M.D. Dubé, L.M. Hewitt, T. Kovacs, J.L. Parrott et D.L. MacLatchy. 2006b. « Use of paired fathead minnow (Pimephales promelas) reproductive test: Part II. Source identification of biological effects at a bleached kraft pulp mill », Environmental Toxicology and Chemistry, 25 : 202-211.
Rickwood, C.J., M.D. Dubé, L.P. Weber, K. Driedger et D.M. Janz. 2006c. « Assessing effects of metal mining effluent on fathead minnow (Pimephales promelas) reproduction in a trophic-transfer system », Environmental Science & Technology, 40 : 6489-6497.
Rickwood, C.J., M.D. Dubé, L.P. Weber, S. Lux et D.M. Janz. 2007. « Assessing effects of a mining and municipal sewage effluent mixture on fathead minnow (Pimephales promelas) reproduction using a novel, field-based trophic-transfer artificial stream », Aquatic Toxicology, 86 (2) : 272-286.
Roberts, W.E. 1988. « The sculpins of Alberta », Alberta Naturalist, 18 : 121-127.
Salazar, M.H., et S.M. Salazar. 1995. « In situ bioassays using transplanted mussels: I. Estimating chemical exposure and bioeffects with bioaccumulation and growth », dans J.S. Hughes, G.R. Biddinger et E. Mones (éd.), Environmental Toxicology and Risk Assessment – Third Volume. Philadephia (PA), American Society for Testing and Materials (ASTM). Pp. 216‑241.
Salazar, M.H., et S.M. Salazar. 2000. Standard Guide for Conducting In-Situ Field Bioassays with Caged Marine, Estuarine and Freshwater Bivalves. Philadephia (PA), American Society for Testing and Materials (ASTM).
Sandusky, M.J., et R.E. Sparks. 1979. « Investigations of declines in fingernail clam (Musculium transversum) populations in the Illinois River and Pool 19 of the Mississippi River », Bulletin of the American Malacological Union Inc., 1979 : 11-16.
Scherrer, B. 1984. Biostatistique. Québec (Qué.), Gaëtan Morin.
Scott, W.B. 1967. Freshwater Fishes of Eastern Canada. Toronto (Ont.), University of Toronto Press. 137 pages.
Scott, W.B., et E.J. Crossman. 1974. Les poissons d’eau douce du Canada. Ottawa (Ont.), Environnement Canada, Service des pêches et des sciences de la mer. Bulletin de l’Office des recherches sur les pêcheries du Canada, no 184, 966 pages.
Scott, W.B., et M.G. Scott. 1988. « Atlantic fishes of Canada », Bulletin canadien des sciences halieutiques et aquatiques, 219 : 314-316.
Scrimgeour, G.J., J.M. Culp et N.E. Glozier. 1993. « An improved technique for sampling lotic invertebrates », Hydrobiologia, 254 : 65-71.
Seed, R. 1968. « Factors influencing shell shape in Mytilus edulis L. », Journal of the Marine Biological Association of the United Kingdom, 48 : 561-584
Sejr, M., K.T. Jensen et S. Rysgaard. 2002. « Annual growth bands in the bivalve Hiatella arctica validated by a mark-recapture study in NE Greenland », Polar Biology, 25 : 794-796.
Shaw, J.L., S.J. Maund, S.J. Marshall et I.R. Hill. 1995a. « Fathead Minnow (Pimephales promelas) reproduction in outdoor microcosms: an assessment of the ecological effects of fish density », Environmental Toxicology and Chemistry, 14 (10) : 1763-1772.
Shaw, J.L., S.J. Maund et I.R. Hill. 1995b. « Fathead Minnow reproduction in outdoor microcosms: A comparison to bluegill sunfish reproduction in large mesocosms », Environmental Toxicology and Chemistry, 14 (10) : 1753-1762.
Skidmore, D.A., et K.K. Chew. 1985. Mussel Aquaculture in Puget Sound. Seattle (WA), Washington Sea Grant Report. WSG 85-4.
Slack, K.V., R.C. Averett, P.E. Geeson et R.G. Lipscomb. 1973. « Methods for collection and analysis of aquatic biological and microbiological samples », Techniques of Water-resources Investigations of the United States Geological Survey. Washington (DC), U.S. Department of the Interior, Geological Survey. Chapter 4A, Book 5, pp. 1-165.
Sohoni, P., C.R. Typer, K. Hurd, J. Caunter, M. Hetheridge, T. Williams, M. Evans, R. Toy, M. Gargas et J.P. Sumpter. 2001. « Reproductive effects of long-term exposure to bisphenol a in the fathead minnow (Pimephales promelas) », Environmental Science & Technology,35 : 2917‑2925.
Stephenson, M., et G.L. Mackie. 1981. « Effects of 2, 4-D treatment on growth and survival of fingernail clams (Bivalvia: Pisidiidae) in artificial pond ecosystems », American Malacological Union Bulletin, 1981 : 19-22.
Stewart, P. L. 1994. Environmental requirements of the Blue Mussel (Mytilus edulis) in eastern Canada and its response to human impacts. Canadian Technical Report of Fisheries and Aquatic Science, 2004.
Stewart, R., et D.F. Malley. 1997. Technical Evaluation of Molluscs as a Biomonitoring Tool for the Canadian Mining Industry. Aquatic Effects Technology Evaluation (AETE) Program Project 2.3.1. Subventionné par le Centre canadien de la technologie des minéraux et de l’énergie (CANMET) et l’Association minière du Canada (AMC).
St-Jean, S.D. 2003. Supplemental Techniques for Cage Bivalve. Contribution No. 03‑422. Burlington (Ont.), Environnement Canada, Institut national de recherche sur les eaux.
St-Jean, S.D., S.C. Courtenay et R.W. Parker. 2003. « Immunomodulation in blue mussels (Mytilus edulis) exposed to a pulp and paper mill effluent in Eastern Canada », Water Quality Research Journal of Canada, 38 (4) : 647-666.
St-Jean, S.D., R.E. Stephens, S.C. Courtenay et C.L. Reinisch. 2005. « Detecting p53 family proteins in hemocytic leukemia cells of Mytilus edulis from Pictou Harbour, Nova Scotia », Journal canadien des sciences halieutiques et aquatiques, 62 : 2055-2066.
St-Jean, S.D., S.C. Courtenay, C. Coomber et F. Bishay. 2008. « Responses to environmental stressors of wild vs. caged mussels », EEM Science Symposium, Gatineau, Quebec, 29-30 April, 2008.
Suess, M.J. 1982. Examination of Water for Pollution Control. A Reference Handbook. Vol. 3. Biological, Bacteriological and Virological Examination. Oxford, Angleterre, Permagon Press.
Toro, J.E., R.J. Thompson et D.J. Innes. 2002. « Reproductive isolation and reproductive output in two sympatric mussels species (Mytilus edulis, M. trossulus) and their hybrids from Newfoundland », Marine Biology, 141 : 897-909.
U.S.EPA – United States Environmental Protection Agency. 1982. User’s Guide for Conducting Life-cycle Chronic Toxicity Tests with Fathead Minnows (Pimephales promelas). Duluth (MN), Environmental Research Laboratory. EPA/600/8-81/011.
U.S.EPA – United States Environmental Protection Agency. 1996. Prehatching Development of the Fathead Minnow Pimephales promelas. Washington (DC). EPA/600/R-96/079.
U.S.EPA – United States Environmental Protection Agency. 1999. Screening Level Reproduction Assay with the Fathead Minnow (Pimephales promelas). Duluth (MN), Environmental Research Laboratory. EPA-NEERL-DUL 3544.
U.S.EPA – United States Environmental Protection Agency. 2002. Comparative Evaluation of Fathead Minnow Assays for Detecting Endocrine Disrupting Chemicals. Washington (DC), Endocrine Disruptor Screening Program. EPA/68/W-01/023.
U.S.EPA – United States Environmental Protection Agency. 2007. Short Term Test Method for Assessing the Reproductive Toxicity of Endrocrine-Disrupting Chemicals Using the Fathead Minnow (Pimephales promelas). Report No. 600R01067.
Varvio S.-L., R.K. Koehn et R. Vkinola. 1988. « Evolutionary genetics of the Mytilus edulis complex in the North Atlantic region », Marine Biology, 98 : 51-60.
Waldock, M.J., J.E. Thain et M.E. Waite. 1996. « An assessment of the value of shell thickening in Crassostrea gigas as an indicator of exposure to tributyltin », dans M.A. Champ et P.F. Seligman (éd.), Tributyltin: Environmental Fate and Effects. Londres, Angleterre, Chapman and Hall. Pp. 219-237.
Weber, C.I. 1973. Biological Field and Laboratory Methods for Measuring the Quality of Surface Waters and Effluents. Cincinnati (OH), United States Environmental Protection Agency. EPA-670/4-73-001.
Wiederholm, T. 1980. « Use of benthos in lake monitoring », Journal Water Pollution Control Federation, 52 : 537-547.
Williams, J.D., M.L. Warren Jr, K.S. Cummings, J.L.Harris et R.J. Neves. 1993. « Conservation status of freshwater mussels of the United States and Canada ». Fisheries, 18 (9) : 6-22.
Wolfe, B.A., M.J. Burkhard, S. Leavell, R.B. Weiss, K. Kuehnl, H. Valentine et G.T. Watters. 2009. « Health and stress assessment in freshwater mussels following translocation to a captive setting », Proceedings of the International Symposium of the Freshwater Mollusk Conservation Society, 19-24 April 2009, Baltimore, Maryland. p. 37.
Wrona, F.J.,J.M. Culp et R.W. Davies. 1982. « Macroinvertebrate subsampling: A simplified apparatus and approach », Journal canadien des sciences halieutiques et aquatiques, 39 : 1051‑1054.
Xu, Y., et W.X. Wang. 2002. « Exposure and potential food chain transfer factor of Cd, Se and Zn in marine fish Lutjanus argentimaculatus », Marine Ecology Progress Series, 238 : 173-186.
Zar, J.H. 1999. Biostatistical Analysis. Fourth Edition. Upper Saddle River (NJ), Prentice Hall.
Figures et tableaux
Le tableau 9-1 présente un sommaire des applications de systèmes de bassins artificiels ayant servi à l’évaluation des effets des effluents des fabriques de pâtes et papiers et des effluents miniers sur les écosystèmes aquatiques, conformément au programme canadien de suivi des effets sur l’environnement. Le sommaire comprend des renseignements sur l’année, le programme, le type d’effluent, l’objectif de la recherche, le lieu, le système de bassins artificiels et les références.
La figure 9-1 est une série de trois photographies. L’image A illustre un grand système de mésocosmes à bassins artificiels installés sur des tables (modèle I), utilisé pour l’étude sur la rivière Athabasca (Alberta). L’image B présente un grand système mobile de mésocosmes à bassins artificiels montés sur deux remorques (modèle II), utilisé pour les études sur le fleuve Fraser (Colombie-Britannique), le fleuve Saint-Jean (Nouveau-Brunswick) et le port de Saint John (Nouveau-Brunswick). L’image C présente un grand système mobile de mésocosmes à bassins artificiels montés sur une seule remorque (modèle III), utilisé pour les études sur les rivières Miramichi et Little (Nouveau-Brunswick), la rivière Wapiti (Alberta) et le ruisseau Junction (Ontario).
La figure 9-2 comporte deux séries de photographies. L’image A illustre un petit système de microcosmes à bassins artificiels installés sur des tables surplombant les réservoirs de mélange, utilisé pour l’étude sur la rivière Thompson (Colombie-Britannique). L’image B présente un système de mésocosmes modulaire à bassins artificiels installés sur des tables surplombant les réservoirs de mélange, utilisé pour les études sur la rivière Little (Nouveau-Brunswick), le ruisseau Junction (Ontario), la rivière Wabigoon (Ontario) et à Key Lake (Saskatchewan).
La figure 9-3 est une représentation schématique d’un grand système de mésocosmes sur remorque.
La figure 9-4 est une photographie de l’installation d’un mésocosme modulaire.
La figure 9-5 représente le schéma de circulation d’un mésocosme modulaire.
La figure 9-6 est une photographie d’un bioessai multitrophique de la reproduction du Méné à grosse tête. Une barrière d’alimentation permet aux cultures d’invertébrés benthiques de se développer dans des conditions expérimentales, tout en contrôlant l’accès des poissons qui se trouvent au-dessus.
La figure 9-7 est une série de trois photographies qui illustrent l’installation sur le terrain de mésocosmes modulaires.
La figure 9-8 est un modèle conceptuel composé de deux images (images A et B). L’image A présente le protocole expérimental factoriel visant à examiner l’importance relative du milieu aquatique et du régime alimentaire en ce qui a trait aux réactions du Méné à grosse tête aux effluents miniers dans des mésocosmes modulaires. L’image B présente le protocole expérimental servant à examiner l’incidence du pH et des matières organiques naturelles (MON) sur les réactions du Méné à grosse tête exposé à un mélange d’effluents miniers et à un seul métal dans des mésocosmes multitrophiques modulaires.
La figure 9-9 est un modèle conceptuel illustrant un protocole expérimental factoriel visant à étudier les effets d’un effluent minier et de la contamination historique des sédiments séparément ou en combinaison sur le Méné à grosse tête dans des mésocosmes modulaires.
Le tableau 9-2 présente les indicateurs et les critères d’effets des études de poissons en mésocosmes, ainsi que les tests statistiques associés. Les principaux indicateurs d’effets comprennent la croissance, la reproduction, la condition et la survie.
Le tableau 9-3 présente les variables réponses recommandées, les informations complémentaires utiles et les analyses statistiques suggérées pour les systèmes à mésocosmes modulaires utilisant le Méné à grosse tête. Les principaux renseignements présentés comprennent le type de réponse, la variable réponse, la variable dépendante, la variable indépendante, la covariable, la méthode statistique à un facteur et la méthode statistique à deux facteurs.
La figure 9-10 est une photographie d’une moule présentant un lobe du manteau à maturité.
La figure 9-11 présente deux graphiques illustrant le cycle reproducteur de la Moule bleue de Colombie-Britannique (graphiques A et B). Le graphique A montre la teneur en glycogène (en mg/g) pour illustrer le stockage de l’énergie dans le manteau, en fonction de la date (de février à octobre). Le graphique B présente les fractions volumétriques de gamètes comme mesure de la teneur en matériel de reproduction, en fonction de la date (de février à novembre).
Le tableau 9-4 présente les taxons suggérés pour les études de bivalves en cage menées dans le cadre des études de suivi des effets sur l’environnement. Les principaux renseignements présentés comprennent les espèces et les références, la plage de températures (en Celsius), la plage de salinité (en parties par millier), les données sur la reproduction et la répartition générale au Canada.
Le tableau 9-5 présente les différences observées entre deux espèces de moules au cours d’une étude de cinq ans menées dans l’inlet Burrard, à Vancouver (Colombie-Britannique). Les principaux renseignements indiqués comprennent les différences en lien avec la croissance, la survie, la fécondité, la reproduction, la relation entre la production d’œufs et le stockage d’énergie, la vulnérabilité à la leucémie et l’utilité dans les essais.
Le tableau 9-6 présente les différences observées entre les unionidés et les sphaeriidés. Les principaux renseignements présentés comprennent les différences en lien avec la croissance, la durée de vie, la fécondité, la reproduction, la relation entre la production d’œufs et le stockage d’énergie, l’âge à maturité et l’utilité dans les études.
La figure 9-12 illustre les impressions musculaires dans une coquille de Mytilus spp. Les marques sont identifiées par des chiffres. Le chiffre 1 représente la longueur de l’impression du muscle adducteur antérieur, le chiffre 2 représente la longueur de la charnière, le chiffre 3 représente la longueur de l’impression du muscle adducteur postérieur, le chiffre 4 représente la distance entre le bord postérieur de l’impression du muscle adducteur postérieur et le bord postérieur de la coquille, le chiffre 5 représente la distance entre le bord ventral de l’impression du muscle adducteur postérieur et le bord ventral de la coquille, le chiffre 6 représente la largeur de la coquille et le chiffre 7 représente la hauteur de la coquille.
La figure 9-13 est une photographie d’un cadre utilisé pour les essais d’exposition des bivalves. Le cadre en PVC, le cadre d’aluminium en « H » et un groupe de bivalves disposés en boudins sont identifiés sur l’image.
La figure 9-14 est un diagramme des éléments du système modulaire de mésocosmes.
La figure 9-15 représente le schéma d’assemblage du système modulaire de mésocosmes. L’image présente une vue verticale et une vue plane de l’assemblage.
Le tableau 9-7 présente les indicateurs et les critères d’effets pour les études de bivalves en cage et les tests statistiques associés. Les principaux indicateurs d’effets comprennent la croissance, la reproduction, la condition et la survie.
La figure 9-16 comporte deux photographies. La photographie A présente un échantillon de manteau et les outils nécessaires pour son prélèvement, alors que la photographie B présente l’échantillon de manteau homogénéisé et prêt à l’analyse.
Le tableau 9-8 présente un exemple de fiche de données de terrain pour consigner les données brutes sur la survie et la croissance. Les renseignements requis comprennent le numéro de l’animal, la longueur, la hauteur, la largeur, le poids humide de l’animal entier, le poids humide du manteau, le poids sec de l’animal entier, le poids sec du manteau et le poids sec de la coquille.
- Date de modification :