Guide technique pour l'étude de suivi des effets sur l’environnement des mines de métaux
Chapitre 5
5. Caractérisation de l’effluent et suivi de la qualité de l’eau
5.2 Fréquence d’échantillonnage
5.4 Emplacement de l’échantillonnage
5.6 Caractérisation de l’effluent
- 5.6.1 Méthodes d’échantillonnage et analyses en laboratoire
- 5.6.2 Modification de la limite de détection de la méthode pour le mercure
- 5.6.3 Méthodes de dosage des thiosels
5.7 Suivi de la qualité de l’eau
- 5.7.1 Préparation en vue des travaux sur le terrain
- 5.7.2 Mesure sur le terrain des paramètres de la qualité de l’eau
- 5.7.3 Prélèvement d’échantillons d’eau destinés aux analyses en laboratoire
- 5.7.4 Manipulation, entreposage et analyse des échantillons pour le suivi de la qualité de l’eau
- 5.7.5 Comparaison des données sur la qualité de l’eau dans la zone exposée et dans la zone de référence
- 5.7.6 Estimation de l’étendue de la zone de concentrations élevées
5.8 Assurance et contrôle de la qualité pour le suivi de la qualité de l’eau
- 5.8.1 Contrôle de la qualité sur le terrain
- 5.8.2 Assurance de la qualité sur le terrain
- 5.8.3 Assurance de la qualité durant la manipulation, le transport et l’entreposage des échantillons
- 5.8.4 Utilisation de blancs et de duplicata d’échantillons
- 5.8.5 Contrôle de la qualité en laboratoire
- 5.8.5.1 Précisions sur les aspects du contrôle de la qualité des analyses en laboratoire
- 5.8.5.2 Bonnes pratiques de laboratoire
- 5.8.5.3 Contrôle de l’étalonnage
- 5.8.5.4 Précision
- 5.8.5.5 Exactitude et biais
- 5.8.5.6 Récupération
- 5.8.5.7 Limites de détection
- 5.8.5.8 Conventions relatives à la présentation des données
- 5.8.5.9 Précision et exactitude des analyses
- 5.8.6 Assurance de la qualité en laboratoire
- 5.8.7 Compilation et présentation des données d’AQ/CQ
Liste des tableaux
- Tableau 5-1 : Paramètres mesurés pour la caractérisation de l’effluent et le suivi de la qualité de l’eau
- Tableau 5-2 : Sommaire des utilisations recommandées des blancs et des duplicata sur le terrain et en laboratoire
5. Caractérisation de l’effluent et suivi de la qualité de l’eau
5.1 Aperçu
La caractérisation de l’effluent et le suivi de la qualité de l’eau ont pour but de fournir des éléments de réponse à la question suivante : « Quelle est l’ampleur estimée du changement dans les concentrations de contaminants causé par l’activité minière au sein de la zone exposée? ». Les données recueillies lors de la caractérisation de l’effluent et du suivi de la qualité de l’eau seront utilisées aux fins suivantes :
- surveiller les modifications de la qualité de l’eau et les conditions environnementales dans le milieu récepteur;
- fournir des informations sur la variabilité de la qualité de l’effluent et des tendances temporelles ou saisonnières;
- fournir des mesures de variables environnementales pour faciliter l’interprétation des résultats du suivi biologique (études des poissons et de la communauté d’invertébrés benthiques) et des évaluations de la toxicité sublétale.
La caractérisation de l’effluent s’effectue par l’analyse d’un échantillon d’effluent afin de fournir de l’information sur les concentrations de contaminants potentiels.
Le suivi de la qualité de l’eau est réalisé en prélevant des échantillons d’eau à chaque point de rejet de l’effluent dans la zone exposée et dans les zones de référence appropriées, et en analysant ces échantillons. De plus, des échantillons d’eau sont prélevés dans les zones d’échantillonnage des milieux récepteurs où la surveillance biologique est achevée, puis analysés (article 7 de l’annexe 5 du Règlement sur les effluents des mines de métaux [REMM]).
5.2 Fréquence d’échantillonnage
La caractérisation de l’effluent et le suivi de la qualité de l’eau doivent être réalisés quatre fois par année civile, les prélèvements d’échantillons d’effluent et d’eau étant réalisés avec un intervalle d’au moins un mois pendant les périodes où la mine rejette des effluents (article 7 de l’annexe 5 du REMM). Il est recommandé, dans la mesure du possible, de prélever les échantillons destinés à la caractérisation de l’effluent et au suivi de la qualité de l’eau une fois par trimestre civil. Il est également recommandé de prélever les échantillons destinés à ces deux fins le même jour.
Il convient de tenir compte des facteurs suivants pour décider du moment auquel les aliquotes d’échantillons d’effluent seront prélevés pour la caractérisation des effluents :
- la variabilité saisonnière de la composition et du débit de l’effluent;
- le temps de l’année où le prélèvement des échantillons d’effluent a été effectué antérieurement;
- le temps de l’année où l’échantillonnage est réalisé aux fins du suivi de la qualité de l’eau;
- le temps de l’année où il est attendu que les concentrations des substances nocives réglementées soient maximales dans la zone exposée.
Aux fins du suivi de la qualité de l’eau, les facteurs suivants devraient être pris en considération pour décider du moment où les échantillons d’eau seront prélevés dans le milieu récepteur :
- la variabilité saisonnière de la qualité et du débit de l’eau dans la zone exposée;
- le temps de l’année où il est attendu que les concentrations des substances nocives réglementées soient maximales dans la zone exposée;
- le temps de l’année où des échantillons d’eau ont été prélevés antérieurement aux fins du suivi de la qualité de l’eau;
- le temps de l’année où l’échantillonnage est réalisé aux fins de la caractérisation de l’effluent;
- le temps de l’année où la surveillance biologique est réalisée.
5.3 Variables mesurées
La caractérisation de l’effluent et le suivi de la qualité de l’eau sont assurés par l’analyse des paramètres présentés au tableau 5.1. Si une mine n’utilise pas de cyanure comme réactif de procédé dans la zone d’exploitation, il n’est pas nécessaire de l’enregistrer (alinéa 7(1)d) de l’annexe 5 du REMM). En outre, si la concentration de mercure total est inférieure à 0,10 mg/L dans 12 échantillons consécutifs, l’enregistrement de cette concentration peut être arrêté (paragraphe 4(3) de l’annexe 5 du REMM).Environnement Canada que la mine satisfait à l’exigence susmentionnée. Aussi, le tableau 5.1 comprend des paramètres optionnels qui sont recommandés en fonction des caractéristiques du site. Afin de procéder à une caractérisation chimique plus approfondie, le propriétaire ou l’exploitant de la mine peut enregistrer les mesures de ces paramètres. En plus des paramètres requis présentés dans le tableau qui suit, la mesure de certains paramètres de l’effluent, telles la conductivité et les concentrations de sulfates ou de chlorures, peut être utile. En effet, ces substances pourraient servir de traceurs afin de délimiter la zone de mélange de l’effluent dans la zone exposée. En outre, les concentrations de calcium, de magnésium, de chlorures, de potassium, de sodium, de sulfates et de carbone organique dissous peuvent servir à estimer la toxicité potentielle de certains métaux en utilisant l’approche du modèle de ligand biotique (p. ex., U.S. EPA, 2007; Reiley, 2007). Enfin, la justification des paramètres utilisés pour la caractérisation de l’effluent et le suivi de la qualité de l’eau figure dans l’annexe 1.
| Paramètres de la qualité de l’effluent1 (article 4 de l’annexe 5 du REMM) | Paramètres de la qualité de l’eau1 (article 7 de l’annexe 5 du REMM) | Paramètres particuliers au site3 (exigence non réglementaire) |
|---|---|---|
| Aluminium | Aluminium | Fluorures |
| Cadmium | Cadmium | Manganèse |
| Fer | Fer | Uranium |
| Mercure4 | Mercure4 | Phosphore total |
| Molybdène | Molybdène | Calcium |
| Ammoniac | Ammoniac | Chlorures |
| Nitrates | Nitrates | Magnésium |
| Dureté | Dureté6,7 | Potassium |
| Alcalinité | Alcalinité6,7 | Sodium |
| Sélénium | Arsenic | Sulfates |
| Conductivité électrique2,10 | Cuivre | Thallium |
| Température2 | Plomb | Thiosels totaux |
| Nickel | Profondeur de l’eau2 | |
| Zinc | Profondeur optique ou transparence2 | |
| Radium 2269 | Carbone organique dissous | |
| Cyanures5 | Carbone organique total | |
| Matières totales en suspension | Débit d’eau | |
| Concentration d’oxygène dissous2 | ||
| Température2 | ||
| pH2,6,7 | ||
| Salinité2,7,8 | ||
| Sélénium | ||
| Conductivité électrique10 |
1 Toutes les concentrations sont des valeurs totales; les concentrations dissoutes peuvent également être déclarées; les charges de l’effluent (article 20 du REMM) doivent également être calculées et déclarées.
2 Paramètres mesurés in situ.
3 Ces paramètres additionnels sont des contaminants potentiels ou des variables environnementales complémentaires; les analyses permettant d’en déterminer la valeur sont facultatives et peuvent être effectuées si des données historiques de surveillance propres au site ou des données géochimiques attestent de leur utilité.
4 L’enregistrement de la concentration de mercure total dans l’effluent peut être arrêté si la concentration mesurée est inférieure à 0,10 mg/L dans 12 échantillons consécutifs (paragraphe 4(3) de l’annexe 5 du REMM).
5 Il n’est pas nécessaire de mesurer les cyanures si on n’en utilise pas comme réactifs de procédé dans la zone d’exploitation (alinéa 7d) de l’annexe 5 du REMM).
6 Dans le cas d’un effluent rejeté dans de l’eau douce, enregistrer le pH, la dureté et l’alcalinité des échantillons d’eau.
7 Dans le cas d’un effluent rejeté dans de l’eau estuarienne, enregistrer le pH, la dureté, l’alcalinité et la salinité des échantillons d’eau.
8 Dans le cas d’un effluent rejeté dans de l’eau de mer, enregistrer la salinité des échantillons d’eau.
9 Il n’est pas nécessaire de mesurer les concentrations de radium 226 si les conditions mentionnées au paragraphe 13(2) de REMM sont remplies.
10 Veuillez vous référer au document d’Environnement Canada : Document d’orientation pour l’échantillonnage et l’analyse des effluents de mines de métaux (SPE 2/MM/5) pour les références aux méthodes de mesure. La calibration de la température et la procédure de compensation de la température lors d’une mesure de conductivité doivent être faites selon les indications du fabriquant de l’appareil de mesure.
5.3.1 Calcul des charges
En vertu de l’article 20 du REMM, le propriétaire ou l’exploitant de la mine est tenu d’enregistrer les charges totales mensuelles des substances nocives réglementées par le REMM. Dans le cadre de la caractérisation de l’effluent, la mine devrait également signaler les charges des autres contaminants mesurées aux fins de la caractérisation de l’effluent. Le calcul des charges peut être effectué en multipliant la concentration moyenne mensuelle de chaque substance nocive dans l’effluent par le volume mensuel total d’effluent rejeté durant la période de temps considérée (habituellement un an pour la caractérisation de l’effluent).
5.4 Emplacement de l’échantillonnage
Les échantillons destinés à la caractérisation de l’effluent doivent être prélevés à chaque point de rejet final déterminé par le propriétaire ou l’exploitant de la mine, conformément au REMM(paragraphe 4(2) de l’annexe 5).
De plus amples renseignements sur la façon de choisir les zones d’échantillonnage pour la caractérisation de l’effluent sont présentés dans le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001). Ce document traite principalement des méthodes permettant le prélèvement d’échantillons d’effluent à partir de sources ponctuelles (à la sortie de l’émissaire). S’il est envisagé de prélever des échantillons à partir de sources diffuses, il convient d’examiner la pertinence des zones et des méthodes de prélèvement projetées avec l’agent d’autorisation.
Le suivi de la qualité de l’eau est réalisé en prélevant des échantillons d’eau dans la zone exposée entourant le point d’entrée de l’effluent dans l’eau à partir de chaque point de rejet final ainsi qu’à partir des zones de référence connexes (paragraphe 7(1) de l’annexe 5 du REMM). Selon toute vraisemblance, ces points de prélèvement ne seront pas les mêmes que ceux servant au suivi biologique. Lors du choix des points de prélèvement dans la zone exposée, le propriétaire ou l’exploitant d’une mine devrait tenir compte de l’endroit où la concentration de l’effluent est la plus élevée.
En plus des éléments susmentionnés, le propriétaire ou l’exploitant d’une mine doit prélever des échantillons d’eau dans les zones de prélèvement retenues pour les études sur les populations et les tissus de poissons ainsi que pour celles sur les communautés d’invertébrés benthiques. Le suivi de la qualité de l’eau est donc réalisé en même temps que les études de suivi biologique, si la mine doit réaliser de telles études (sous-alinéa 7(1)a(ii) de l’annexe 5 du REMM). Pour ce faire, les paramètres de surveillance de la qualité de l’eau présentés dans le tableau 5.1 sont mesurés dans ces échantillons d’eau.
Il est recommandé de prélever au moins trois échantillons d’eau à chaque station d’échantillonnage afin d’obtenir une estimation de la variabilité et de déterminer si les concentrations des contaminants sont homogènes à l’intérieur de la station. Toutefois, cette façon de faire pourrait ne pas être suffisamment robuste pour permettre une analyse statistique des données. La sélection de stations additionnelles à l’intérieur de chaque zone de prélèvement pourrait permettre de mieux caractériser la répartition des concentrations des contaminants dans la zone exposée. Au moins un échantillon composite constitué de quelques sous-échantillons prélevés en divers endroits de la station devrait être produit.
Lorsque les zones de prélèvement des invertébrés benthiques et/ou des poissons sont relativement éloignées des stations d’échantillonnage pour le suivi de la qualité de l’eau, il est fortement recommandé de prélever concurremment des échantillons d’eau aux stations d’échantillonnage pour le suivi routinier de la qualité de l’eau. De cette façon, les résultats des analyses des échantillons d’eau prélevés dans les zones de prélèvement des invertébrés benthiques et/ou des poissons pourront être comparés à ceux des analyses des échantillons prélevés dans les stations de suivi de la qualité de l’eau.
5.5 Déclaration des résultats
Les résultats des analyses effectuées pour la caractérisation de l’effluent et le suivi de la qualité de l’eau doivent être présentés à l’agent d’autorisation dans le rapport des études de suivi de l’effluent et de la qualité de l’eau (article 8 de l’annexe 5 du REMM). Plus particulièrement, ce rapport réalisé au cours d’une année civile doit être présenté à l’agent d’autorisation au plus tard le 31 mars de l’année suivante. Veuillez consulter le chapitre 10 pour en savoir plus sur la présentation électronique des données sur la caractérisation de l’effluent et le suivi de la qualité de l’eau. Par ailleurs, ce rapport annuel devrait comprendre les renseignements décrits ci-après.
(Veuillez noter que dans la liste qui suit, les exigences réglementaires (selon l’article 8 de l’annexe 5 du REMM) sont écrites en italique et sont suivies de recommandations et de descriptions supplémentaires).
a) Les dates de prélèvement des échantillons pour la caractérisation de l’effluent, les essais de toxicité sublétale et le suivi de la qualité de l’eau, notamment :
- dates pour la caractérisation de l’effluent, à raison de quatre fois par année civile et à au moins un mois d’intervalle (paragraphe 7(2) de l’annexe 5 du REMM), lorsque la mine rejette un effluent;
- dates pour le suivi de la qualité de l’eau, à raison de quatre fois par année civile et à au moins un mois d’intervalle (paragraphe 7(2) de l’annexe 5 du REMM), lorsque la mine rejette un effluent;
- dates pour les essais de toxicité sublétale, à raison de deux fois par année civile pendant les trois premières années et une fois par année après cela, le premier essai se faisant sur un échantillon d’effluent prélevé au plus tard six mois après la date à laquelle la mine est assujettie à l’article 7 du présent règlement(article 6 de l’annexe 5 du REMM). Les dates des essais de toxicité sublétale devraient correspondre à celles de la caractérisation de l’effluent, compte tenu que les échantillons pour les essais de toxicité sublétale doivent être constitués par une portion aliquote d’échantillons prélevés pour la caractérisation de l’effluent;
- si le nombre d’essais requis n’a pas été effectué, en préciser la raison (c.-à-d. le nombre de jours de rejet de cet effluent ou les conditions de l’habitat qui ont empêché le prélèvement d’échantillons pour la caractérisation de l’effluent et/ou le suivi de la qualité de l’eau).
b) L’emplacement des points de rejet final où les échantillons ont été prélevés pour la caractérisation de l’effluent, en prenant soin de noter que la caractérisation de l’effluent doit être réalisée à TOUS les points de rejet final établis.
c) L’emplacement du point de rejet final où les échantillons ont été prélevés pour les essais de toxicité sublétale et les données qui ont servi à le sélectionner conformément au paragraphe 5(2) du REMM :
- indiquer à quel point de rejet final les échantillons d’effluent ont été prélevés pour les essais de toxicité sublétale;
- indiquer pourquoi ce point de rejet final a été choisi, s’il y a plus d’un point de rejet sur le site minier (p. ex., effluent rejeté dans un milieu récepteur sensible, effluent ayant la charge massique la plus élevée, etc.).
d) La latitude et la longitude des zones d’échantillonnage utilisées pour le suivi de la qualité de l’eau, exprimées en degrés, minutes et secondes, et une description qui permet de reconnaître l’emplacement de ces zones :
- si des données autres que la latitude et la longitude sont utilisées (p. ex., UTM) pour l’emplacement de la station de prélèvement, Ressources naturelles Canada fournit des outils sur le Web qui permettent de faire la conversion;
- une description des stations de prélèvement (avec des cartes si possible) permettant de localiser l’emplacement des zones de prélèvement; par exemple, « échantillon d’eau recueilli sous le premier pont ». Cette description doit faciliter le prélèvement d’autres échantillons aux mêmes stations.
e) Les résultats de la caractérisation de l'effluent, des essais de toxicité sublétale et du suivi de la qualité de l'eau, notamment :
- les résultats de toutes les analyses physicochimiques effectuées sur les échantillons de l’effluent, des essais de toxicité sublétale et du suivi de la qualité de l’eau;
- les résultats obtenus pour tous les paramètres requis ainsi que pour les paramètres optionnels propres au site (voir le tableau 5.1);
- les rapports de laboratoire sur les essais de toxicité sublétale doivent être joints au rapport annuel.
f) Les méthodes utilisées pour la caractérisation de l'effluent et le suivi de la qualité de l'eau, ainsi que les limites de détection de ces méthodes :
- certaines méthodes de prélèvement des échantillons sont décrites dans le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001); version électronique disponible à : http://dsp-psd.communication.gc.ca/Collection/En49-24-1-39F.pdf;
- préciser la méthode utilisée pour la caractérisation de l’effluent et le suivi de la qualité de l’eau (spectrométrie de masse à plasma induit par haute fréquence [SM-PIHF], spectrométrie d'absorption atomique à four en graphite [SAA-FG]);
- indiquer les limites de la méthode de détection utilisée (pour les substances délétères du REMM, les limites de détection données à l’annexe 3 devraient être respectées); voir la section 5.6.2 pour la limite de détection qui s’applique au mercure; veuillez aussi noter que les recommandations pour la qualité de l’eau pour la protection de la vie aquatique du Conseil canadien des ministres de l’environnement (CCME) ou d’autres recommandations provinciales pour la qualité de l’eau devraient aussi être prises en considération;
- indiquer si les recommandations pour la qualité de l’eau pour la protection de la vie aquatique du CCME sont respectées.
g) Les précisions voulues sur les mesures d’assurance de la qualité et de contrôle de la qualité qui ont été prises ainsi que les données associées à leur mise en œuvre :
- fournir une brève description des mesures d’AQ/CQ qui ont été prises et les résultats concernant le prélèvement d’échantillons d’effluent et d’eau, leur expédition et leur conservation;
- pour de plus amples renseignements, veuillez consulter les sections 7.3 à 7.5 du Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001) à l’adresse : http://dsp-psd.communication.gc.ca/Collection/En49-24-1-39F.pdf ainsi que la section 5.8 du présent document.
Puisque les échantillons pour la caractérisation de l’effluent sont des portions aliquotes d’échantillons prélevés pour le suivi de la conformité de l’effluent, les mesures du pH et des concentrations des substances nocives (arsenic, cuivre, cyanures totaux, plomb, nickel, zinc, radium 226 et matières totales en suspension) devraient être indiquées dans les rapports sur la caractérisation de l’effluent et le suivi de la qualité de l’eau de chaque mine.
5.6 Caractérisation de l’effluent
5.6.1 Méthodes d’échantillonnage et analyses en laboratoire
Comme les échantillons d’effluent utilisés aux fins de la caractérisation sont des portions aliquotes des échantillons prélevés aux fins du suivi de la conformité de l’effluent, comme le stipule le REMM, les spécifications et recommandations relatives aux méthodes d’échantillonnage et d’analyse chimique présentées dans le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001) s’appliquent également à la caractérisation de l’effluent réalisée dans le cadre du programme d’ESEE. Le volume d’effluent prélevé devrait être suffisant pour permettre toutes les analyses et tous les essais et la constitution d’échantillons connexes à des fins de contrôle de la qualité (p. ex., échantillons de terrain et de laboratoire en double et échantillons validés par ajout connu).
5.6.2 Modification de la limite de détection de la méthode pour le mercure
La limite de détection de la méthode pour le mercure dans l’effluent a été modifiée et fixée à 0,01 µg/L (0,000 01 mg/L) de manière à ce que la concentration de 0,1 µg/L stipulée au paragraphe 9c) de l’annexe 5 du Règlement sur les effluents des mines de métaux puisse être détectée avec confiance. Voici des méthodes d’analyse qui permettent d’atteindre ce niveau de détection : la spectrométrie d’absorption atomique à vapeur froide (SSAVF), la spectrométrie de fluorescence atomique à vapeur froide (SFAVF) et la spectrométrie de masse avec plasma induit par haute fréquence (SM-PIHF).
5.6.3 Méthodes de dosage des thiosels
Les thiosels totaux sont un paramètre optionnel propre au site qui peut être mesuré dans l’effluent de la mine; toutefois, les méthodes d’échantillonnage ou d’analyse ne sont pas dans le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001). Les thiosels sont des composés ioniques renfermant du soufre et de l’oxygène solubles qui résultent de l’oxydation incomplète de minéraux sulfurés. Ils peuvent être produits lorsque les minéraux sulfurés entrent en contact avec de l’oxygène, mais en pratique, ils se forment habituellement durant le traitement des minerais contenant de tels minéraux. Si des thiosels se retrouvent dans un effluent, leur oxydation sera complète lors du rejet de ce dernier, produisant de l’acide sulfurique et réduisant le pH dans la zone exposée. Une telle modification du pH dans les eaux réceptrices pourrait aussi être reliée à de faibles concentrations de thiosels et à la spéciation des thiosels, qui ne peut pas être entièrement abordée au moyen des techniques analytiques courantes (Vigneault et al., 2002). À une concentration de 10 ppm, la dégradation des thiosels peut encore potentiellement faire baisser le pH à 3,7 dans une eau réceptrice non tamponnée (Vigneault et al., 2002). Des renseignements sur la spéciation des thiosels peuvent être requis afin de prévoir la chute du pH, puisque les différents types de thiosels peuvent produire des quantités différentes d’acidité et sont stables dans des conditions nettement différentes.
Malgré la capacité des thiosels à altérer le pH des eaux réceptrices, la toxicité due aux thiosels dans les effluents de mines est limitée à quelques sites. Cela peut être dû à la faible toxicité des thiosels pour les animaux. Les thiosels ne sont pas considérés comme ayant une létalité aiguë dans les effluents des mines. C’est pourquoi la concentration létale pour la Truite arc-en-ciel est supérieure à 800 mg/L (Schwartz et al., 2006). Des essais de toxicité sublétale suggèrent en outre que la sensibilité des espèces aquatiques aux thiosels et la toxicité des différents anions composant les thiosels varient d’un ordre de grandeur. Schwartz et al. (2006) ont d’ailleurs signalé que Ceriodaphnia dubia était l’espèce la plus sensible des espèces utilisées lors des essais dans le cadre des ESEE. La concentration inhibitrice 25 % était équivalente à 60 mg/L pour le thiosulfate, tandis que les tétrathionates se sont avérés beaucoup moins toxiques. Au Canada, peu de mines ont des problèmes connus liés aux thiosels, mais le potentiel d’en générer existe sur de nombreux sites miniers. Dans le Programme d’ESEE, le dosage des thiosels totaux aux fins de la caractérisation des effluents et du suivi de la qualité de l’eau est facultatif.
La concentration totale de thiosels est habituellement déterminée au moyen d’une méthode de titrage ayant une limite de détection d’environ 10 ppm (exprimée en thiosulfates) (Makhija et Hitchen, 1979). Le thiosulfate est stable à un pH neutre et instable à un faible pH, alors que l’inverse est vrai pour les polythionates. Pour déterminer la concentration des différentes espèces de thiosels en solution dans la gamme des parties par milliard, on peut se servir de la chromatographie par échange d’ions. Cependant, cette technique est difficile à appliquer à des échantillons de terrain en raison de l’instabilité des thiosels. Afin de mieux prévoir les impacts environnementaux des thiosels et la dégradation de ces derniers, plus de renseignements sur la spéciation in situ et des méthodes de mesure ayant des limites de détection plus basses sont nécessaires.
Le principal inconvénient soulevé au sujet de cette méthode est qu’il faut analyser les échantillons dans les 24 heures suivant leur prélèvement. Étant donné que toute méthode de conservation existante a ses limites, il n’y a en fait rien qui puisse remplacer une analyse immédiate (O'Reilly et al., 2001). Par conséquent, le dosage des thiosels totaux devrait idéalement être effectué sur le terrain, et selon toute probabilité, aux seuls endroits où des problèmes liés à ces substances ont été décelés. Une autre option est de congeler les échantillons immédiatement après leur prélèvement en vue de les analyser dans les sept jours qui suivent. Dans ce cas, il importe de préciser que la stabilité des thiosels peut être compromise si les échantillons congelés sont conservés plus longtemps. Autrement, une résine échangeuse d’ions peut être utilisée pour préconcentrer et conserver les thiosels (Drushel et al., 2003; Vigneault et al., 2002).
5.7 Suivi de la qualité de l’eau
5.7.1 Préparation en vue des travaux sur le terrain
La manipulation des produits chimiques utilisés pour le nettoyage, le fonctionnement et l’étalonnage de l’équipement, le prélèvement, la conservation ou le traitement des échantillons devrait être confiée uniquement à des personnes qualifiées, et les informations appropriées sur la santé et la sécurité (p. ex., fiches signalétiques) devraient être disponibles.
Des protocoles et modes opératoires normalisés (MON) écrits (énonçant notamment les exigences en matière d’assurance et de contrôle de la qualité [AQ/CQ]) devraient être accessibles en tout temps, de façon à ce que l’utilisation de l’équipement se fasse de façon appropriée et sécuritaire. Il est également recommandé de préparer des formulaires de données et des carnets de manière à ce que les notes et les données puissent être consignées rapidement et efficacement sur le terrain. Il importe également de prévoir des formulaires supplémentaires en cas d’erreur ou de perte. Ces formulaires et carnets de terrain devraient être résistants à l’eau et aux déchirures. Dans certaines circonstances, l’enregistrement de bandes audio ou vidéo peut se révéler utile.
Tout le matériel utilisé pour le prélèvement et la manipulation des échantillons devrait être nettoyé, et toutes leurs composantes, inspectées avant chaque sortie sur le terrain, afin de s’assurer qu’elles fonctionnent bien (p. ex., assemblage sur place, fonctionnement). Les principaux instruments ou dispositifs devraient être munis d’une trousse de réparation afin de ne pas être pris au dépourvu en cas de panne ou de perte de pièces amovibles. Enfin, de l’équipement, des piles et des dispositifs d’échantillonnage de réserve devraient être disponibles. Les appareils utilisés pour les mesures sur le terrain des paramètres de la qualité de l’eau devrait être correctement étalonnés, conformément aux recommandations du fabricant.
Tous les récipients à échantillons et agents de conservation requis devraient être fournis par le laboratoire chargé par contrat d’effectuer les analyses. De préférence, les bouteilles devraient être neuves, inutilisées et certifiées propres. S’il s’agit de bouteilles déjà utilisées, il faut les nettoyer en employant une méthode reconnue et utiliser un système de contrôle de numéros de lot et confirmer leur état de propreté à l’aide de blancs (Fowlie et al., 2001).
Avant chaque sortie sur le terrain, tous les récipients destinés à l’entreposage, au transport et au prélèvement des échantillons, y compris les récipients de réserve en cas de perte ou de bris, devraient être nettoyés et étiquetés correctement (c.-à-d. étiquettes adhésives imperméables permettant l’inscription de données à l’aide d’un stylo à encre indélébile efficace sur des surfaces mouillées). Ces récipients devraient être pourvus de couvercles hermétiques; les couvercles avec revêtement appropriés devraient être utilisés pour prévenir la contamination (p. ex., doublés d’un matériau inerte comme le téflon, et non en papier ou en carton). La liste des échantillons à prélever et le registre de suivi des échantillons devraient être préparés avant chaque échantillonnage. La tenue de ce registre devrait être confiée à une personne chargée d’assurer la surveillance des échantillons depuis leur prélèvement jusqu’à leur analyse et leur élimination ou leur archivage.
5.7.2 Mesure sur le terrain des paramètres de la qualité de l’eau
Les paramètres de la qualité de l’eau couramment mesurés in situ sont la concentration d’oxygène dissous, le pH, la conductivité, la température et, pour les milieux marins seulement, la salinité. La profondeur de l’eau dans la zone d’échantillonnage et celle à laquelle l’échantillon d’eau a été prélevé devraient être notées, de même que la profondeur optique ou transparence. Le débit devrait également être mesuré dans les milieux lotiques. Les mesures des paramètres courants de la qualité de l’eau peuvent être prises in situ ou à partir d’un échantillon d’eau, dans l’embarcation ou sur la rive, immédiatement après le prélèvement de l’échantillon du moment que le prélèvement a été fait à la profondeur requise. Si l’oxygène dissous est mesuré une fois sur le rivage, il faut faire particulièrement attention de ne pas laisser d’air s’introduire dans l’échantillon d’eau.
Dans les plans d’eau peu profonds (≤ 2 m), les paramètres courants de la qualité de l’eau peuvent être mesurés au milieu de la colonne d’eau. Si la profondeur du plan d’eau est de 2 à 4 m, les mesures devraient être prises à deux profondeurs, soit à environ 25 cm du fond et à 25 cm sous la surface. Dans les plans d’eau plus profonds, les paramètres courants sont mesurés sur toute la colonne d’eau. Les mesures de la conductivité, du pH, de la dureté, de l’alcalinité, de la salinité, de la température et de la teneur en oxygène dissous devraient être prises près du fond et dans la colonne d’eau, à des intervalles de un à cinq mètres selon la profondeur totale. Par exemple, si la profondeur est de 5 m, ces paramètres devraient être mesurés à chaque mètre. À une profondeur de 25 m, les mesures devraient être prises à tous les cinq mètres.
En eau profonde, on doit utiliser un échantillonneur péristaltique muni de tubes en téflon d’une longueur adéquate de préférence à tout autre type de pompes. Si d’autres types d’échantillonneurs sont utilisés, ils doivent être pourvus d’un revêtement en téflon et non métallique. L’échantillonnage doit se faire en partant de la station la moins contaminée à la plus contaminée, et il faut procéder à un rinçage avec de l’acide nitrique dilué et de l’eau distillée entre les stations. Les résidus de rinçage doivent être recueillis et retournés au laboratoire afin d’être éliminés de façon appropriée. Des échantillons témoins (blancs) devraient être employés avant et après l’utilisation de l’échantillonneur afin de vérifier s’il n’y a pas eu une contamination des échantillons (Fowlie et al., 2001).
La réalisation des profils verticaux est facilitée par l’emploi d’un enregistreur de données (ou d’un instrument équivalent) équipé d’une sonde d’oxygène dissous et d’un agitateur, ainsi que de sondes de pH, de conductivité, de profondeur et de température qui évaluent la qualité de l’eau simultanément dans toute la colonne d’eau. Un enregistreur de données est particulièrement utile dans les plans d’eau profonds (> 50 m). Durant la réalisation du profil, l’utilisateur est en mesure d’observer les données recueillies et de noter les zones présentant un intérêt particulier pendant la descente et la remontée de l’appareil (hausses soudaines de la conductivité, thermocline, valeurs inhabituelles, etc.). Les données sont notées manuellement ou stockées directement dans l’enregistreur. Afin de compléter les données informatisées, il importe de consigner les mesures à la main, sur des formulaires de données, à intervalles de 2 ou 5 m selon la profondeur totale du profil.
Dans les plans d’eau peu profonds, l’utilisation d’instruments portatifs est souvent la façon la plus pratique de mesurer les paramètres de la qualité de l’eau in situ, car ils sont légers et il en existe plusieurs modèles. Leur emploi est toutefois limité, car les sondes et les câbles qui les relient à l’unité portative n’atteignent généralement que des profondeurs de 2 à 5 m. En outre, ces instruments nécessitent habituellement un entretien et un étalonnage plus réguliers; ils demandent donc des soins particuliers pour assurer leur bon état de fonctionnement. Il est aussi recommandé de tenir des registres d’étalonnage et d’entretien.
La profondeur de l’eau peut être mesurée indirectement à l’aide d’un sonar de pêche ou directement au moyen d’un ruban étalonné, d’un câble ou d’une perche de sondage étalonné. Divers niveaux de précision sont requis selon la profondeur de l’eau :
- Profondeur de l’eau moins de 2 m : niveau de précision recommandé ± 25 cm
- Profondeur de l’eau 2 à 10 m : niveau de précision recommandé ± 50 cm
- Profondeur de l’eau Plus de 10 m : niveau de précision recommandé ± 1 m
La profondeur optique est une mesure de la transparence de l’eau qui est mesurée à l’aide d’un turbidimètre sur le terrain ou en laboratoire. On peut également se servir d’un disque de Secchi. Ce dispositif est un disque de 20 cm de diamètre dont deux quartiers opposés sont peints en blanc, les deux autres en noir. Le disque est attaché à un ruban étalonné. Pour mesurer la profondeur optique, le disque est mouillé dans un secteur ombragé et il est descendu jusqu’à ce qu’il disparaisse de vue. Le disque est ensuite remonté vers la surface et la profondeur à laquelle il réapparaît est notée. Au moins deux mesures devraient être prises à chaque station d’échantillonnage, et l’estimation de la profondeur optique est fondée sur la valeur médiane de ces mesures. Les mesures devraient être prises au milieu de journée sans porter des lunettes de soleil (Nielsen et Johnson, 1983).
Un examen sommaire des données de qualité de l’eau devrait être fait pendant l’échantillonnage afin de vérifier qu’aucune erreur de mesure ou d’enregistrement n’a été commise. En cas d’erreur due à l’instrument ou d’erreur d’échantillonnage, ceci permet de remplacer l’instrument défectueux ou d’en vérifier le fonctionnement. Il est recommandé d’inspecter quotidiennement tous les dispositifs d’échantillonnage et de mesure afin de s’assurer de leur bon fonctionnement et, au besoin, de les étalonner.
Il est recommandé de consigner les mesures et les observations additionnelles suivantes sur le terrain :
- numéros de l’échantillon, des réplicats et identification du site (p. ex., nom);
- date et heure du prélèvement;
- conditions météorologiques et autres facteurs au moment de l’échantillonnage (p. ex., vitesse et direction du vent, action des vagues, courant, marée, intensité du trafic maritime, température de l’air et de l’eau, épaisseur de la glace [le cas échéant]);
- emplacement de la station (p. ex., coordonnées de positionnement) et des points de prélèvement des réplicats d’échantillons;
- type de plate-forme ou d’embarcation utilisée pour l’échantillonnage (p. ex., dimensions, puissance, type de moteur);
- nom des personnes participant à l’échantillonnage;
- informations concernant tout incident imprévu survenu durant la manipulation de l’échantillonneur (p. ex., contamination des échantillons, défectuosité ou bris d’équipement, aspect inhabituel, maîtrise du dispositif d’échantillonnage durant sa descente);
- écarts par rapport aux modes opératoires normalisés.
5.7.3 Prélèvement d’échantillons d’eau destinés aux analyses en laboratoire
Le programme de suivi de la qualité de l’eau consiste principalement à prélever des échantillons d’eau sur le terrain et à les expédier à un laboratoire pour analyse et comporte la mesure des concentrations de métaux, de nutriants, des principaux anions et cations et de plusieurs autres paramètres généraux de la qualité de l’eau.
L’analyse des métaux totaux (valeurs totales) est requise (article 4 de l’annexe 5 du REMM) pendant le suivi de la qualité de l’eau, les études ayant souvent montré qu’il n’y a aucune différence entre les « métaux totaux » et les « métaux dissous » (ESG, 1999). Cependant, des différences importantes entre ces deux concentrations peuvent être trouvées dans certains cas, et l’analyse des métaux dissous et des métaux totaux pourrait s’avérer utile sur un site en particulier dans le contexte de la recherche de causes.
En général, les échantillons d’eau devraient être prélevés à deux profondeurs, soit sous la surface (épilimnion) et près du fond (hypolimnion) pour obtenir des échantillons des deux zones de la colonne d’eau (au-dessus et au-dessous de la thermocline). Si la profondeur de l’eau est égale ou inférieure à 2 m, un prélèvement réalisé au milieu de la colonne d’eau ou à au moins 15 cm sous la surface de l’eau suffit. Les échantillons prélevés sous la surface peuvent être recueillis à la main directement dans la bouteille d’échantillonnage.a
L’utilisation d’échantillonneurs non métalliques Van Dorn d’une capacité de 2 à 16 L ou Kemmerer d’une capacité de 0,5 à 8 L (ou d’un autre type, comme l’échantillonneur Niskin) permet le prélèvement d’échantillons à des profondeurs précises. Dans les cours d’eau, il est possible d’utiliser un échantillonneur intégrateur de profondeur qui fournit des échantillons représentatifs des matières en suspension et des substances connexes. Ces échantillonneurs peuvent être utilisés à partir d’une embarcation, d’un pont ou d’une couche de glace. Pour des raisons de sécurité, ils doivent habituellement être manipulés par deux personnes. Si l’échantillonnage se déroule à de très grandes profondeurs, il est préférable d’utiliser un échantillonneur péristaltique. Sinon, on choisira un échantillonneur avec revêtement de téflon.
Entre chaque prélèvement, l’échantillonneur devrait être soumis à un triple rinçage avec de l’eau de la station d’échantillonnage. En outre, il est recommandé d’échantillonner d’abord la zone de référence afin d’éviter la contamination de l’échantillonneur avec de l’eau provenant de la zone exposée. Entre les zones d’échantillonnage, l’échantillonneur devrait être rincé deux fois à l’acide nitrique dilué de qualité réactif, surtout lorsqu’il est impossible de terminer l’échantillonnage dans la zone de référence d’abord. Les résidus de rinçage au solvant doivent être recueillis et retournés au laboratoire afin d’être éliminés de façon appropriée. Il faut vérifier que l’échantillonneur ne contamine pas les échantillons en faisant passer des blancs de laboratoire avant et après utilisation.
Au moment du prélèvement, il est important de se conformer le plus possible aux méthodes d’analyse d’ultratraces et aux protocoles d’échantillonnage de l’eau appropriés suivants :
- effectuer l’échantillonnage en progressant de la station la moins contaminée à la plus contaminée;
- rincer trois fois les bouteilles et les bouchons avant chaque prélèvement;
- ne pas introduire d’agents de conservation dans les bouteilles avant les prélèvements;
- durant le prélèvement, orienter l’ouverture de la bouteille face au courant, de façon à ce que l’échantillon n’entre pas en contact avec la main qui tient la bouteille;
- ne jamais toucher l’intérieur du récipient ou de son couvercle, ou le goulot de la bouteille, même si l’on porte des gants jetables;
- porter des gants en latex exempt de talc ou en nitryle non doublés afin d’éviter la contamination de l’échantillon;
- étiqueter immédiatement tous les échantillons clairement et employer les techniques de conservation appropriées. Consigner immédiatement toutes les données d’échantillonnage dans le carnet de terrain;
- durant le prélèvement, tenir le bouchon de la bouteille vers le bas;
- consigner l’emplacement des points d’échantillonnage.
5.7.4 Manipulation, entreposage et analyse des échantillons pour le suivi de la qualité de l’eau
5.7.4.1 Manipulation et conservation des échantillons
Le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001) renferme des recommandations sur la manipulation des échantillons ayant trait aux récipients, aux agents de conservation et aux temps de conservation pour des paramètres précis. Au besoin, des agents de conservation devraient être ajoutés dans la bouteille dès que l’échantillon a été prélevé. Le nombre d’échantillons à prélever peut varier selon les besoins du laboratoire.
Il est possible de réduire le nombre d’échantillons prélevés en utilisant le contenu d’une bouteille d’échantillonnage pour l’analyse de plusieurs substances. Avant d’entreprendre l’échantillonnage, la liste des paramètres à mesurer devrait être examinée avec les responsables du laboratoire afin de déterminer le nombre et le type de bouteilles requis.
Lors de l’échantillonnage, il est utile de se munir d’une liste de contrôle où sont indiqués, pour chaque bouteille, les substances à analyser et les agents de conservation ajoutés, le cas échéant. Chaque fois qu’un échantillon est prélevé, il devrait être coché sur la liste. Dans certaines situations, il peut être difficile de respecter la période de rétention maximale prescrite de sept à dix jours (cations et anions majeurs, nitrates-nitrites, carbone organique dissous). Si l’expédition des échantillons d’eau d’une mine est retardée, mais que l’intégrité des échantillons est préservée, l’agent d’autorisation devrait être avisé sans délai.
5.7.4.2 Expédition et entreposage des échantillons
Il est recommandé de maintenir les échantillons à une température de 4 °C durant le prélèvement et de les entreposer à la même température pendant leur expédition afin de prévenir leur dégradation. Les échantillons devraient être réfrigérés et les glacières équipées de blocs réfrigérants ou de glace en sac pour conserver les échantillons au froid.
Les échantillons devraient être expédiés au laboratoire le plus rapidement possible (dans les 24 à 48 heures au maximum). Les analyses devraient être effectuées dans les délais d’entreposage approuvés, qui sont fonction du paramètre. Le délai d’entreposage désigne l’intervalle de temps entre la fin de l’échantillonnage et le début des analyses. Les échantillons devraient être entreposés le moins longtemps possible et dans des conditions prévenant le plus possible leur dégradation. Ils devraient être conservés à une température supérieure à leur point de congélation, mais inférieure à 10 °C, et protégés le plus possible de la lumière. Les échantillons ayant subi une digestion en prévision du dosage des métaux peuvent être conservés dans un récipient scellé et analysés dans les 30 jours qui suivent. Pour de plus amples renseignements, veuillez consulter le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001).
5.7.4.3 Analyses des échantillons en laboratoire
Les analyses devraient être confiées à un laboratoire accrédité et exécutées par du personnel spécialisé, dans des conditions faisant l’objet d’un contrôle de qualité et conformément à des modes opératoires normalisés. Les laboratoires dont les mines retiennent les servicesdevraient être accrédités selon la norme ISO/IEC 17025:2005 de l’Organisation internationale de normalisation intitulée Exigences générales concernant la compétence des laboratoires d'étalonnages et d'essais, avec ses modifications successives. Les méthodes d’analyse choisies devraient être généralement acceptées et couramment utilisées dans les laboratoires au Canada. Le principe général de la méthode devrait avoir fait l’objet d’un examen par des pairs et d’une large diffusion, afin de pouvoir facilement la trouver si des précisions sont nécessaires.
Les méthodes d’analyse choisies devraient satisfaire aux critères mentionnés dans le présent document et à tout autre objectif fixé par la mine (ou par des personnes agissant au nom de la mine) ou par Environnement Canada. Le directeur de projet et le laboratoire doivent confirmer quels paramètres d’intérêt seront mesurés et que les délais de conservation seront respectés. Le laboratoire et les méthodes d’analyse devraient être choisis avant que les échantillons ne soient prélevés de manière à garantir que les exigences du laboratoire en matière d’échantillonnage soient satisfaites.
Les méthodes retenues devraient permettre d’atteindre de manière fiable les limites de détection stipulées pour les substances délétères dans l’annexe 3 du REMM (p. ex., toute concentration supérieure d’environ un dixième à la concentration maximale autorisée (Fowlie et al., 2001). Les méthodes normalement acceptées et leurs limites de détection ainsi que les objectifs de précision et d’exactitude pour les effluents des mines de métaux sont traités dans le Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final (Fowlie et al., 2001). Pour les autres paramètres de qualité de l’eau requis ou propres à un site, pour lesquels il n’y a pas de limite de détection précisée, si le Conseil canadien des ministres de l’environnement a publié une recommandation pour la qualité des eaux (CCME, 1999) concernant la variable mesurée, la limite de détection de la méthode choisie devrait être assez basse pour que l’on puisse déterminer si les paramètres mesurés dépassent cette recommandation. Les recommandations du CCME peuvent être consultées à l’adresse http://ceqg-rcqe.ccme.ca/?lang=fr. Plusieurs provinces ont également élaboré des recommandations pour la qualité de l’eau. Lorsque des recommandations pour un paramètre en particulier ont été faites par le CCME et une province, la recommandation provinciale a la préséance. Toutefois, les deux recommandations devraient être rapportées.
5.7.5 Comparaison des données sur la qualité de l’eau dans la zone exposée et dans la zone de référence
Il est recommandé que le rapport d’interprétation biologique inclue une comparaison des données sur la qualité de l’eau dans les zones d’exposition et de référence. Cette comparaison devrait porter sur tous les paramètres mesurés aux fins du suivi de la qualité de l’eau, en particulier ceux pour lesquels des différences supérieures à un facteur de deux ont été relevées entre la zone exposée et la zone de référence. Cette comparaison a pour but de faciliter l’interprétation des données biologiques du rapport susmentionné.
Le choix d’un facteur de deux pour la mesure du dépassement des concentrations par rapport à la zone de référence a pour but de souligner les véritables différences entre les concentrations des zones exposées et des zones de référence, et non simplement des différences qui pourraient être attribuées à des facteurs comme de faibles concentrations de contaminants ciblés, la variabilité analytique, la taille minimale des échantillons (n = 4) et la variabilité saisonnière. Quand la zone de référence se trouve dans un plan d’eau ou un bassin hydrographique différent de celui de la zone exposée, il se peut que le facteur de deux ne puisse s’appliquer.
Pour déterminer si les concentrations diffèrent entre la zone exposée et la zone de référence, il faut examiner la valeur médiane d’au moins quatre échantillons prélevés sur une période de 12 mois aux mêmes endroits dans la zone exposée et dans la zone de référence. La valeur médiane d’un ensemble de n mesures y1, y2, y3, … yn est définie comme la valeur de y occupant la position centrale de la distribution lorsque les mesures sont classées par ordre de grandeur. Si le nombre de mesures est un chiffre pair, la médiane est la valeur correspondant à la moitié de y se trouvant entre les deux valeurs centrales. Si le nombre de données est plus élevé (n >> 4), on peut utiliser un test statistique (p. ex., moyenne ou médiane supérieure à l’intervalle de confiance de 95 % ou à deux écarts-types) pour déterminer si les concentrations dans la zone exposée sont supérieures à celles mesurées dans la zone de référence. Si, pour la zone exposée, il y a suffisamment de données sur la qualité de l’eau avant l’exploitation minière, celles-ci peuvent servir de base de comparaison.
Lorsque le rapport entre les concentrations dans la zone exposée et dans la zone de référence est supérieur à un facteur de deux, il est conseillé aux responsables de la mine d’estimer et de signaler la portée géographique de ces différences en se basant sur le suivi élargi de la qualité de l’eau ou en recourant à la modélisation. Toutefois, avant d’estimer sur quelle superficie ces différences se manifestent, il importe de prendre les facteurs suivants en considération :
- Objectifs de qualité de l’eau propres au site. Si un objectif de qualité de l’eau propre au site existe pour un paramètre particulier et que cet objectif est dépassé dans la zone exposée, la superficie sur laquelle ce dépassement est observé devrait être déterminée, quelle que soit la concentration dans la zone de référence.
- Recommandations pour la qualité de l’eau. S’il existe des recommandations pour la qualité de l’eau pour un paramètre particulier et que la valeur mesurée pour ce paramètre dans la zone exposée est plus de deux fois supérieure aux concentrations mesurées dans la zone de référence ainsi qu’aux recommandations pour la qualité de l’eau, la superficie sur laquelle ce dépassement est observé devrait être déterminée.
Les recommandations du CCME pour les paramètres de suivi de la qualité de l’eau (CCME, 1999) peuvent être consultées sur le site Web suivant : http://ceqg-rcqe.ccme.ca/?lang=fr. Plusieurs provinces ont formulé des recommandations similaires. Dans les cas où des recommandations provinciales ont aussi été établies pour la qualité de l’eau, la préséance leur est accordée, mais les écarts par rapport aux recommandations du CCME devraient également être signalés. - Limites de détection. Lorsque la limite de détection de la méthode (LDM) se situe près de la recommandation pour la qualité de l’eau (RQE) et que les concentrations du paramètre dans la zone d’étude sont près de celles-ci, il se peut qu’une différence équivalant à un facteur de deux ne soit pas significative, à cause du plus fort degré d’incertitude de l’analyse lorsque la mesure se situe près de la LDM. En pareilles circonstances, il convient de consulter l’agent d’autorisation. McQuaker (1999) a d’ailleurs présenté une comparaison des limites de détection réalisables lorsqu’il existe des recommandations pour la qualité de l’eau. Pour la plupart des paramètres, il existe des limites de détection considérablement inférieures (c.-à-d. un rapport LDM/RQE d’au moins 1/10). Toutefois, McQuaker a conclu que pour certains paramètres (arsenic, cadmium, mercure, sélénium, argent et cyanure), il n’existe pas de LDM réalisable dix fois inférieure aux RQE. Au fur et à mesure que le rapport LDM/RQE diminue, l’incertitude des mesures augmente. Au-delà d’un rapport de 1/2, les résultats obtenus ne sont pas considérés statistiquement significatifs.
- pH. Dans le cas du pH, un rapport de deux peut être particulièrement important puisque l’échelle du pH est logarithmique. Si une recommandation relative au pH existe pour un site particulier et que la valeur du pH mesurée dans la zone exposée se situe à l’extérieur de l’intervalle précisé dans la recommandation; l’étendue géographique où cette valeur est mesurée devrait être déterminée. Également, s’il n’y a pas de recommandation au sujet du pH et que la valeur mesurée dans la zone d’exposition est supérieure à 0,5 unité de la valeur mesurée dans la zone de référence et qu’elle se situe à l’extérieur de l’intervalle précisé dans les recommandations sur la qualité de l’eau (p. ex., intervalle de 6,5 à 9,0 émis par le CCME); l’étendue géographique de la zone exposée, où le pH est supérieur à 0,5 unité, devrait être déterminée. Selon les recommandations canadiennes pour la qualité de l’environnement (CCME, 1999), les activités anthropiques ne devraient pas modifier le pH par plus de 0,2 unité dans les milieux marins ou estuariens.
- Emplacement de la zone de référence. Dans les sites où la zone de référence se trouve dans un plan d’eau ou un bassin hydrographique différent de celui de la zone exposée, une différence équivalant à un facteur deux peut se révéler inapplicable. S’il est estimé que c’est le cas, il est recommandé de consulter l’agent d’autorisation.
5.7.6 Estimation de l’étendue de la zone de concentrations élevées
L’un ou l’autre des deux méthodes suivantes peut servir à estimer la superficie de la zone où les concentrations sont élevées :
- mesure directe;
- modélisation.
1) Mesure directe
Pour utiliser la méthode de mesure directe, un plus grand nombre de stations de prélèvement au sein de la zone exposée est nécessaire afin de déterminer à partir de quel point les concentrations du ou des contaminants préoccupants cessent d’être trop élevées. Le nombre de stations additionnelles requises à cette fin est normalement établi en fonction de caractéristiques propres au site, mais en général, au moins trois stations seraient requises, soit :
- la station utilisée dans la zone exposée pour le suivi de la qualité de l’eau;
- au moins deux autres stations plus éloignées situées au bord de la zone exposée où l’on s’attend à ce que les concentrations du ou des contaminants préoccupants cessent d’être trop élevées.
2) Modélisation
Si les fluctuations saisonnières des concentrations du contaminant préoccupant sont bien connues dans l’effluent et la zone exposée ainsi que celles des débits de l’effluent et du milieu récepteur; il est alors possible de prévoir l’endroit dans la zone d’exposition où les concentrations sont estimées ne plus être trop élevées.
5.8 Assurance et contrôle de la qualité pour le suivi de la qualité de l’eau
Les aspects généraux de l’assurance de la qualité et du contrôle de la qualité sont traités dans le Plan d’étude (Chapitre 2).
5.8.1 Contrôle de la qualité sur le terrain
Le contrôle de la qualité (CQ) des programmes d’échantillonnage sur le terrain englobe les aspects généraux suivants :
- toutes les personnes participant à l’échantillonnage sur le terrain devraient avoir l’éducation et la formation appropriées;
- les méthodes d’échantillonnage devraient être utilisées de façon uniforme dans tous les sites et tout au long de l’étude;
- l’échantillonnage devrait se dérouler selon des modes opératoires normalisés accessibles au personnel durant toute la durée des travaux sur le terrain;
- le dispositif d’échantillonnage devrait convenir à l’habitat étudié, être nettoyé correctement et accompagné de la documentation appropriée (c.-à-d. manuel d’utilisation, calendrier d’étalonnage et d’entretien);
- tous les échantillons devraient être identifiés au moyen d’une étiquette indiquant la date et le lieu du prélèvement, le type et le numéro d’échantillon et le nom de la personne qui a fait le prélèvement;
- les échantillons devraient être placés dans les récipients appropriés, avec l’agent de conservation ou le fixatif approprié s’il y a lieu;
- les techniciens de terrain devraient prendre des notes détaillées avec des stylos à encre indélébile et des carnets imperméables;
- le personnel devrait utiliser des formulaires de chaîne de possession et de soumission d’échantillons ainsi que des sceaux pour les échantillons contenant des contaminants;
- le personnel devrait employer les méthodes d’expédition et d’entreposage appropriées;
- des formulaires de terrain normalisés devraient être utilisés durant les travaux sur le terrain.
5.8.2 Assurance de la qualité sur le terrain
Lors d’un suivi de la qualité de l’eau, l’assurance de la qualité (AQ) sur le terrain se fait à l’aide de diverses méthodes, notamment : lectures en double, comparaison des lectures avec des étalons connus, prélèvement d’échantillons de profils pour évaluer les analyses et évaluation des paramètres à l’aide d’autres équipements (instrument de mesure de la conductivité, de la température et de la profondeur Hanna, thermomètre, etc.).
De nombreux facteurs peuvent compromettre la qualité des données. Parmi les plus fréquents, mentionnons les erreurs dues à l’étiquetage ou à l’interversion des bouteilles, la non-utilisation d’un agent de conservation approprié, les conditions inappropriées d’entreposage des échantillons, la contamination des échantillons par l’équipement d’échantillonnage et le dépassement des durées de conservation maximales. Chaque échantillon devrait être identifié à l’aide d’une étiquette permettant de le distinguer des autres échantillons. Les informations requises devraient être inscrites à l’encre indélébile sur des étiquettes posées sur les récipients de manière qu’elles ne tombent pas si elles sont mouillées ou durant le transport.
Le carnet de terrain fait partie intégrante du programme d’échantillonnage et forme la base du rapport d’échantillonnage. Son contenu est souvent très utile pour l’interprétation des données de laboratoire. Toutes les modifications apportées au plan d’échantillonnage et toutes autres observations pertinentes concernant les échantillons ou les lieux d’échantillonnage devraient y être notées. Les lacunes courantes dans les carnets de terrain incluent l’absence de notes de planification, le manque de notes prises au moment même où les événements se produisent, les entrées non signées ou datées et l’inscription de notes illisibles.
5.8.3 Assurance de la qualité durant la manipulation, le transport et l’entreposage des échantillons
L’Association canadienne des laboratoires d’analyse environnementale (ACLAE) (maintenant l’association canadienne pour l’accréditation des laboratoires [Canadian Association for Laboratory Accreditation; CALA]) a formulé les recommandations suivantes concernant l’assurance de la qualité durant la manipulation, le transport et l’entreposage des échantillons (CALA, 1991).
- Chaîne de possession des échantillons. Des formulaires de chaîne de possession devraient être utilisés pour le transport des échantillons, particulièrement dans les cas où de nombreuses personnes ou entreprises participent à l’échantillonnage, à l’expédition et à l’analyse des échantillons.
- Inspection des échantillons. L’état de chaque échantillon devrait être consigné lors de la réception. Toute divergence entre l’état exigé et l’état observé des échantillons devrait être inscrite dans un carnet ou dans un fichier d’ordinateur. Il est préférable de préserver les échantillons sur le terrain sans tarder. Toutefois, si cela n’a pas été fait sur le terrain, il faut ajouter un agent de conservation dès la réception des échantillons et noter la méthode de conservation.
- Suivi des échantillons. Un numéro ou un code unique devrait être attribué à chaque échantillon pour l’identifier dans un système de suivi des échantillons. Ce système devrait identifier l’échantillon, indiquer sa provenance, la date de réception, les analyses, la date d’échéance pour les résultats ainsi que toute autre information pertinente. Il est recommandé d’avoir recours à un système de gestion de l’information de laboratoire pour effectuer le suivi des échantillons dans les laboratoires où un grand nombre d’échantillons sont traités pour différents clients.
- Entreposage des échantillons. Les échantillons devraient être entreposés dans un endroit déterminé à l’intérieur d’un réfrigérateur ou dans une aire d’entreposage accessible seulement au personnel autorisé. Les échantillons devraient être réfrigérés à 4 °C et n’être retirés du réfrigérateur qu’à des fins d’inspection, de consignation de données et d’analyse. La température du réfrigérateur devrait être mesurée et inscrite quotidiennement.
5.8.4 Utilisation de blancs et de duplicata d’échantillons
L’utilisation de blancs et de duplicata d’échantillons sur le terrain et en laboratoire est un élément important de tout programme de contrôle de la qualité (CQ).
Il est essentiel d’utiliser des blancs et des duplicata tout au long de l’exécution de travaux sur le terrain comportant le prélèvement d’échantillons d’eau. Les échantillons de CQ de terrain permettent de vérifier si des erreurs ont été commises durant l’échantillonnage et, le cas échéant, d’apporter les correctifs qui s’imposent. Ils se distinguent des échantillons de CQ utilisés en laboratoire en ce qu’ils permettent de mesurer les effets de l’échantillonnage plutôt que les effets des procédures de laboratoire.
Les blancs de terrain ont pour objet de vérifier si les échantillons ont été contaminés par une des nombreuses sources potentielles de contamination : récipients à échantillon, bouchons, agents de conservation, équipement, papier filtre (dans le cas des échantillons qui doivent être filtrés), air ambiant, techniques d’échantillonnage et analyse. Ces blancs, constitués d’eau désionisée fournie par le laboratoire responsable des analyses, sont transportés sur le terrain et soumis aux mêmes procédures de prélèvement, de manipulation et de traitement que les échantillons destinés aux analyses (p. ex., transfert dans un récipient à échantillon, conservation et exposition à l’environnement). Ils sont ensuite transportés, entreposés et analysés selon les mêmes méthodes que les échantillons de terrain destinés aux analyses (McQuaker, 1999).
Des duplicata d’échantillons devraient être prélevés pour vérifier les résultats des analyses et la fiabilité de l’équipement. Les duplicata de terrain permettent d’évaluer l’homogénéité du site d’échantillonnage et la constance de l’équipement d’échantillonnage. Ce sont des échantillons entièrement distincts, et non les produits de la division d’un échantillon dans deux récipients. Les duplicata de terrain devraient être traités comme s’il s’agissait d’échantillons en aveugle et ne sont pas identifiés comme tels au laboratoire.
Le dernier type d’échantillon utilisé à des fins de CQ est le blanc de transport. Ce type de blanc sert à vérifier la présence d’une contamination éventuelle par les récipients à échantillon, les bouchons et les agents de conservation durant le transport, l’entreposage et l’analyse. Un blanc de transport consiste en un récipient rempli d’eau désionisée en laboratoire et qui est soumis au même traitement de conservation que les échantillons destinés à l’analyse (Fowlie et al., 2001). Les blancs de transport sont transportés sur le terrain avec les autres récipients à échantillon puis retournés sans avoir été ouverts au laboratoire avec les échantillons prélevés. Au laboratoire, ils sont ouverts, et leur contenu est soumis aux mêmes analyses que les échantillons de terrain (McQuaker, 1999).
Les blancs de terrain et de transport ainsi que les duplicata de terrain devraient représenter 5 à 10 % du nombre total d’échantillons. Par exemple, si des prélèvements sont effectués à 10 zones de suivi de la qualité de l’eau, un seul de chaque type d’échantillon de CQ serait requis par station. Cette proportion peut être augmentée au besoin pour évaluer les erreurs attribuables à l’échantillonnage et l’homogénéité de la matrice d’échantillonnage. Si l’on n’utilise pas de blancs de transport et de terrain aux fins du CQ, toute inexactitude due à l’échantillonnage passera inaperçue ou sera imputée à tort au laboratoire chargé des analyses. De plus amples renseignements sur l’utilisation de blancs et de duplicata en laboratoire sont présentés à la section 5.8.5. Le tableau 5-2 résume les utilisations recommandées des blancs et des duplicata sur le terrain et en laboratoire dans le cadre des programmes d’échantillonnage de plus grande envergure. Pour les programmes d’échantillonnage courants prévoyant le prélèvement d’échantillons dans deux stations, l’une dans la zone exposée et l’autre dans la zone de référence, il est recommandé de soumettre un seul blanc de terrain avec les échantillons à analyser. Dans ce cas, le laboratoire va analyser les échantillons par lots, en même temps que les échantillons soumis par d’autres clients. Le laboratoire va alors assurer le CQ interne nécessaire pour l’ensemble du lot analysé.
| Paramètre | Nbre d’échan-tillons | CQ - interne ou terrain | Limites de contrôle | Description |
|---|---|---|---|---|
| Blanc de terrain | 1 | Terrain | Vérifier si les échantillons ont été contaminés pendant leur manipulation. Un blanc par jour par matrice. | |
| Blanc de transport | 1 | Terrain | Vérifier la validité de la conservation et des conditions d’entreposage des échantillons. Un blanc par jour par matrice. | |
| Duplicata de terrain | 1 | Terrain | Évaluer l’homogénéité du site d’échantillonnage et la constance de la méthode et de l’équipement d’échantillonnage. | |
| Blanc de méthode | 1 | Interne | < limite de détection (LD) ou < 0,1 % de la concentration dans l’échantillon | Vérifier si les échantillons ont été contaminés par les réactifs et les procéduresa. |
| Duplicata de laboratoire | 1 | Interne | Vérifier la précision de l’échantillonnage. Un blanc par jour par type de matricea. | |
| Verrerie | 1 | Interne | < LD ou < 0,1 % de la concentration dans l’échantillon | Vérifier si la verrerie de laboratoire utilisée durant les analyses a été contaminéea. |
| Matériau de référence étalon (MRE) | 1 | Interne | Vérifier l’exactitude de la méthodea. | |
| Matrice enrichie | 1 | Interne | 75 à 125 % | Peut remplacer le MREb. |
| Contrôle de l’étalonnage : | ||||
| à l’intérieur d’une série d’analyses (blanc et étalon de concentration intermédiaire) | 1 | Interne | Dérive maximale de 10 % | Le contrôle statistique de l’étalonnage peut être assuré entre les séries d’analyses au moyen de deux étalons de contrôle, A et B, et à l’intérieur d’une série d’analyses au moyen de blancs et d’étalons de concentration intermédiaire (King, 1976). |
| entre les séries d’analyses (à 20 % et à 80 % de la plage des concentrations) | 2 par série | Interne | ± 5 % de la valeur cible |
Remarque – Les valeurs indiquées sont fondées sur un lot de 20 échantillons.
a Intrinsèque à chaque lot de 20 échantillons.
b Peut être utilisé en remplacement du MRE si ce dernier n’est pas disponible.
5.8.5 Contrôle de la qualité en laboratoire
Le contrôle de la qualité des analyses en laboratoire comporte les éléments généraux suivants :
- les données devraient être vérifiées et validées par des vérifications de la transcription; les données chimiques seront vérifiées par rapport aux rapports d’AQ du laboratoire accompagnant les données;
- les analyses des données seront répétables, robustes et feront l’objet de contre-vérifications par rapport aux objectifs de qualité des données;
- les analyses des données seront rigoureuses et valides, et devraient inclure une justification de toutes les analyses statistiques et les transformations de données.
5.8.5.1 Précisions sur les aspects du contrôle de la qualité des analyses en laboratoire
Les procédures de contrôle de la qualité des analyses sont conçues pour assurer le contrôle statistique de l’étalonnage, de la précision, de l’exactitude et du biais ainsi que de la récupération (ACLAE [maintenant CALA], 1991).
Le contrôle statistique de ces paramètres peut être assuré à l’aide d’échantillons de contrôle d’une qualité prédéterminée durant chaque série d’analyses. Les résultats de l’analyse de ces échantillons de CQ sont comparés statistiquement à des intervalles de confiance établis à partir de données historiques. Ces intervalles de confiance, ou limites de contrôle, correspondent généralement à trois écarts-types par rapport à la moyenne de la variable contrôlée. Les limites d’avertissement sont couramment fixées à deux écarts types par rapport à cette moyenne. Les indicateurs de résultats excédant les limites de contrôle sont les suivants :
- deux résultats successifs de blancs de méthodes, de duplicata de laboratoire, de matériaux de référence étalons, de blancs enrichis, d’échantillons de contrôle de l’étalonnage ou taux de récupération des analogues organiques;
- un de ces résultats excédant les limites de contrôle.
Les données de CQ peuvent être reportées sur des diagrammes de contrôle. Ce sont des représentations graphiques des données de CQ en fonction du temps ou en fonction du numéro des séries d’analyses consécutives. Ces diagrammes font ressortir les tendances temporelles, le cas échéant, et fournissent une indication graphique du contrôle statistique à long terme de l’analyse. Les limites de contrôle et les diagrammes de contrôle sont décrits en détail dans le manuel de l’ASTM (1986).
5.8.5.2 Bonnes pratiques de laboratoire
Toutes les procédures de laboratoire devraient se dérouler dans le respect de bonnes pratiques de laboratoire (BPL) bien établies. Une liste succincte des pratiques recommandées est présentée ci-dessous. On trouvera une description détaillée des BPL dans ELAP (1988).
- Les données relatives à la préparation des réactifs devraient être consignées dans un registre. Les récipients des réactifs préparés devraient porter des étiquettes indiquant le nom du réactif, la date de préparation, la date d’expiration et le nom de la personne qui en est responsable.
- Les appareils devraient être entretenus ou inspectés régulièrement. Les données d’entretien devraient elles aussi être consignées dans un registre.
- Il faudrait disposer d’instructions écrites pour tous les appareils.
- Des méthodes normalisées pour le nettoyage de la verrerie et des récipients devraient être suivies.
- Il faudrait vérifier régulièrement la pureté de l’eau distillée et consigner les résultats obtenus. L’eau distillée ou désionisée devrait être vérifiée au moins une fois par jour à l’aide d’un conductivimètre.
- Les réactifs chimiques devraient être conformes aux exigences de pureté fixées pour chaque méthode d’analyse.
- Les réactifs et les solvants devraient être stockés conformément aux instructions du fabricant.
- Il faudrait vérifier les étalons de travail et les solutions mères afin de déceler tout changement de concentration.
- Les réactifs devraient être préparés et étalonnés avec des étalons de référence primaires.
- La température de tous les réfrigérateurs et incubateurs devrait être vérifiée quotidiennement et les écarts de température devraient être consignés.
- Chaque four devrait avoir son propre thermomètre, et la température devrait y être vérifiée avant et après utilisation.
- Il faudrait utiliser la verrerie volumétrique appropriée.
- La verrerie devrait être nettoyée selon les spécifications de la méthode.
- Les bouteilles de gaz devraient être remplacées à 700-1 400 kilopascals.
- Le personnel de laboratoire devrait avoir une formation adéquate en méthodes d’analyse de laboratoire, en particulier à propos de celles dont il est responsable.
5.8.5.3 Contrôle de l’étalonnage
Le contrôle statistique de l’étalonnage peut être confirmé, entre les séries, au moyen de deux étalons de contrôle A et B, et à l’intérieur d’une même série, grâce à des blancs et à des étalons de concentration intermédiaire (au milieu de la plage des concentrations).
- Contrôle de l’étalonnage entre les séries : Deux étalons de contrôle A et B peuvent être utilisés pour analyser et contrôler les changements dans l’étalonnage entre les séries; ceci se fait une fois au début de chaque série analytique. Ces étalons sont préparés et conservés indépendamment des solutions étalons; ils sont généralement choisis de façon à représenter respectivement 80 % et 20 % environ de la plage complète des concentrations. Les résultats sont réunis pour un grand nombre de séries et les sommes (A + B) et différences (A – B) sont portées sur des graphiques de contrôle. À l’intérieur d’une série donnée, un changement significatif de la somme (A + B), par rapport à la moyenne historique, laisse supposer qu’un changement significatif de l’ordonnée à l’origine s’est produit, les autres facteurs demeurant constants. Un changement significatif de la différence (A – B) laisse supposer un changement significatif de la pente, les autres facteurs demeurant constants. Les limites de contrôle (LC) et d’avertissement (LA) pour (A – B) sont calculées pour la moyenne (X) et l’écart-type (ET) de la population des différences de la façon suivante:
- Limites supérieure et inférieure d’avertissement
(LSA, LIA) = XA-B ± 2 ETA-B - Limites supérieure et inférieure de contrôle
(LSC, LIC) = XA-B ± 3 ETA-B
- LSA/LIA = XA+B ± 2 ETA-B
- LSC/LIC = XA+B ± 3 ETA-B
- Limites supérieure et inférieure d’avertissement
- Contrôle de l’étalonnage à l’intérieur d’une même série (analyses inorganiques) : Les changements de l’étalonnage à l’intérieur d’une même série, attribuables à la dérive de la pente et de la ligne de base, devraient être vérifiés à intervalles réguliers. Cela peut être fait au moyen d’un étalon de concentration intermédiaire et d’un blanc de réactifs passés après chaque groupe de 20 échantillons. Chaque laboratoire devrait établir des limites de contrôle pour chaque méthode. La dérive ne devrait pas dépasser 10 %. Si on décèle une dérive plus grande, il faudrait interrompre l’analyse, réétalonner l’appareil et réanalyser les échantillons qui sont passés après le dernier échantillon de vérification et le dernier blanc acceptables.
- Contrôle de l’étalonnage à l’intérieur d’une même série (analyses organiques) : Dans les analyses organiques par chromatographie en phase gazeuse (CPG), les changements de l’étalonnage à l’intérieur d’une même série devraient être vérifiés par injection d’un étalon de vérification de concentration intermédiaire à une fréquence de 5 % ou toutes les 12 heures. On compare le résultat de cette injection à l’étalonnage initial en calculant l’écart en pourcentage entre le facteur de réponse de chaque substance à analyser dans l’étalon de vérification et le facteur de réponse moyen déterminé au cours de l’étalonnage initial. Si la différence relative exprimée en pourcentage est supérieure à 25 %, la vérification de l’étalonnage devrait être répétée. Si cette vérification donne encore un écart relatif supérieur à 25 %, il est recommandé d’apporter des corrections.
5.8.5.4 Précision
La précision est le degré de variation entre les différentes mesures d’une même variable obtenues à l’aide d’une méthode d’analyse particulière; elle est habituellement exprimée par l’écart-type des réplicats (U.S. EPA, 1990). Le contrôle statistique de la précision analytique est assuré par l’analyse de duplicata à l’intérieur d’une série à une fréquence d’au moins 10 %. Les duplicata de laboratoire sont des portions aliquotes d’un échantillon divisé en laboratoire.
La différence absolue entre les duplicata à l’intérieur d’une série d’analyses est comparée à une limite de contrôle établie à partir de données historiques. Pour obtenir ces limites de contrôle, les résultats des analyses des duplicata sont réunis pour un grand nombre de séries d’analyses et sont triés selon des intervalles de concentration.
Ces intervalles sont souvent fixés de 0 à 20 %, de 20 à 50 % et de 50 à 100 % de la plage complète des concentrations (King, 1976). À l’intérieur de chaque intervalle de concentration, les limites de contrôle pour la différence absolue entre les duplicata à l’intérieur d’une série d’analyses se calculent selon la formule suivante :
LSC = D4 × R
où D4 est un facteur statistique (3,267) et R, la différence moyenne entre les duplicata (ASTM, 1986; Taylor, 1987).
Si la différence entre les résultats des analyses des duplicata de laboratoire dépasse la limite de contrôle supérieure, la situation devrait être évaluée afin de choisir la mesure correctrice qui s’impose.
5.8.5.5 Exactitude et biais
L’exactitude est le degré de concordance entre une valeur mesurée et la vraie valeur déterminée par l’analyse d’un matériau de référence accepté (U.S. EPA, 1990). L’inverse de l’exactitude est le degré d’erreur systématique inhérent à l’analyse, ou biais. L’exactitude se vérifie au moyen de blancs de méthode et de matériaux de référence certifiés. Des renseignements sur le contrôle de la qualité recommandé pour les analyses de composés inorganiques peuvent être trouvés dans le document de l’ACLAE (CALA, 1991).
- Blancs de méthode : Un blanc de méthode est une portion aliquote d’eau contenant un réactif dont le volume est équivalent à celui des échantillons traités, et qui est analysé exactement de la même manière que ces échantillons. Il permet de quantifier le degré de contamination survenue durant le traitement et l’analyse des échantillons. Le nombre de blancs de méthode correspond à 10 % du nombre d’échantillons à analyser ou à un blanc par série d’analyses. Les résultats de leur analyse devraient être reportés sur des diagrammes et les limites d’avertissement devraient être fixées à ± 2 écarts-types et les limites de contrôle, à ± 3 écarts-types. Si un blanc de méthode dépasse la limite de contrôle et est jugé contaminé, les échantillons analysés en même temps que ce blanc et dont les valeurs dépassent la limite de détection devraient être analysés à nouveau pour la ou les variables en cause. En règle générale, on considère que le blanc de méthode est exempt de contamination si les résultats sont inférieurs à la limite de détection ou à 0,1 fois le niveau de contamination décelé dans tous les échantillons avec lesquels il a été analysé (ACLAE [maintenant CALA], 1991).
- Matériaux de référence étalons : Les matériaux de référence étalons sont des échantillons disponibles dans différentes matrices qui ont été soumis à de nombreuses analyses par plusieurs laboratoires et dont les concentrations sont certifiées par des organismes de normalisation, comme le National Institute of Science and Technology, l’Environmental Protection Agency des États-Unis, l’Institut national de recherche sur les eaux d’Environnement Canada et le Conseil national de recherches. Le matériau de référence étalon, lorsqu’on peut se le procurer, devrait représenter 5 % du nombre d’échantillons analysés ou être analysé à raison d’un par série d’analyses (ACLAE [maintenant CALA], 1991; King, 1976). La matrice et la concentration du matériau de référence étalon devraient être les plus proches possible de celles des échantillons à analyser. Les résultats des analyses des matériaux de référence étalons devraient être accumulés et les limites de contrôle et d’avertissement fixées à ± 3 écarts-types et à ± 2 écarts-types, respectivement.
5.8.5.6 Récupération
Le taux de récupération d’une substance à analyser au cours de l’ensemble du processus d’analyse est déterminé à partir d’échantillons de matrice et de blancs enrichis avec des concentrations connues de la substance à analyser et d’analogues.
- Échantillons de matrice enrichis : Un échantillon de matrice enrichi est une portion aliquote d’un échantillon choisi au hasard, à laquelle est ajoutée une quantité connue de toutes les substances à analyser avant le traitement de l’échantillon. L’analyse d’un échantillon ainsi enrichi permet d’évaluer le taux de récupération obtenu pour la matrice propre à cet échantillon. L’échantillon devrait être enrichi avec toutes les substances à analyser, à une concentration aussi proche que possible de la concentration donnant une réponse égale à celle de l’étalon de concentration intermédiaire. La solution d’enrichissement devrait être préparée à partir d’une solution mère distincte de celle utilisée pour l’étalonnage. La fréquence recommandée pour les matrices ainsi enrichies est de 10 % ou de une par série. La récupération est calculée comme suit :
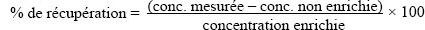
Les résultats obtenus avec les matrices enrichies devraient être portés sur des diagrammes de contrôle distincts pour chaque matrice. Les limites internes devraient être fixées à ± 3 ET pour un minimum de 10 points de données. Lors d’analyses à paramètres multiples, au moins 90 % des substances à analyser devraient présenter un taux de récupération se situant à l’intérieur des limites fixées. Le taux de récupération pour les substances inorganiques devrait se situer entre 75 et 125 %. La récupération pour les variables organiques devrait se situer à l’intérieur des limites précisées au tableau 4 de ACLAE [maintenant CALA] (CALA, 1991). Si une matrice enrichie ne respecte pas ces critères, il faut répéter l’enrichissement et l’analyse de la matrice. Si le taux de récupération ne respecte toujours pas les critères lors de la prochaine analyse et que celle-ci ne semble présenter aucun autre problème, il faudrait signaler l’existence d’un effet dû à la matrice. - Blanc de méthode enrichi : Un blanc de méthode enrichi est une fraction de la même eau que celle utilisée pour le blanc de méthode à laquelle on ajoute la substance à analyser à une concentration aussi proche que possible de celle de l’étalon de concentration intermédiaire. Le blanc ainsi enrichi donne une idée de la fiabilité de la méthode sans les effets de la matrice des échantillons réels. Le blanc enrichi doit être analysé avec les autres échantillons et de la même façon. Comme dans le cas de la matrice enrichie, la solution d’enrichissement doit être préparée à partir d’une solution mère différente de celle utilisée pour l’étalonnage.
Les limites de récupération internes devraient être calculées pour le blanc de méthode enrichi en prenant comme base ± 3 ET et un minimum de 10 points de données. Les taux de récupération pour les analyses inorganiques devraient se situer entre 75 % et 125 % et, pour les variables organiques, entre 70 % et 120 %. Si le taux de récupération pour un blanc fortifié ne respecte pas ces critères, il faudrait recommencer l’enrichissement et l’analyse du blanc. Si le blanc fortifié ne présente toujours pas une récupération satisfaisante, les échantillons associés à ce blanc devraient être réanalysés. S’il ne reste pas assez d’échantillon pour répéter l’analyse, les résultats seront consignés tels quels et annotés comme étant suspects avec une explication. - Étalons internes (analyses organiques) : Toutes les analyses utilisant la chromatographie en phase gazeuse (CPG) devraient être effectuées à l’aide d’étalons internes ou avec des méthodes correctement validées faisant appel à des étalons externes. Un étalon interne est une substance qui se comporte de la même façon dans un système analytique que les substances ciblées, mais dont la présence est peu probable dans l’échantillon. Des étalons internes sont ajoutés à la même concentration à tous les échantillons, étalons et échantillons de contrôle avant d’effectuer les mesures, mais après la préparation des échantillons. Tous les résultats obtenus pour les substances à analyser devraient être normalisés en fonction de la valeur obtenue pour l’étalon interne, de façon à tenir compte de la variabilité instrumentale attribuable à des facteurs comme les variations dans les volumes d’injection, les fluctuations de température et le volume final d’extraction. La valeur de l’étalon interne lors de l’analyse de l’échantillon devrait se situer à moins de 20 % de la réponse interne d’un étalon analysé à l’intérieur de la même période de 12 heures. Si ce critère n’est pas respecté, l’échantillon devrait être réanalysé. Si le critère n’est toujours pas respecté après la nouvelle analyse, les résultats obtenus pour l’échantillon ne devraient pas être corrigés en fonction du résultat de l’échantillon interne et devraient être annotés avec une explication.
- Échantillons avec ajout d’un analogue (analyses organiques) : Un étalon analogue est une substance dont la présence est peu probable dans l’échantillon et qui se comporte de la même façon que les substances à analyser lors de la préparation et de l’analyse de l’échantillon. Les analogues devraient être ajoutés, le cas échéant, à tous les échantillons (y compris les échantillons de CQ) avant leur préparation, de façon à déterminer le rendement de la méthode et l’effet de la matrice des échantillons. Les analyses effectuées par chromatographie en phase gazeuse couplée à la spectrométrie de masse (CPG-SM) devraient comporter au moins deux analogues et celles qui font appel à la CPG seule devraient en compter au moins un. La quantité d’analogue ajoutée à chacun des échantillons devrait être la même que celle ajoutée aux solutions d’étalonnage. Les limites de contrôle internes pour les taux de récupération des analogues sont basées sur une valeur de ± 3 ET pour un minimum de 10 points de données. Les limites de contrôle internes pour les taux de récupération des analogues devraient se situer entre 60 % et 120 %. Si l’un des analogues se situe à l’extérieur de la plage de récupération prévue, l’échantillon devrait être réanalysé. Si, après une nouvelle analyse, le taux de récupération de l’analogue se situe toujours à l’extérieur de la plage permise, les résultats devraient alors être annotés et accompagnés d’une explication.
5.8.5.7 Limites de détection
La limite de détection doit être consignée en tant que limite de détection de la méthode (LDM), conformément à la description de l’U.S. EPA (1984). La LDM est définie comme étant la quantité minimale d’une substance à analyser qui devrait être décelée pour pouvoir conclure à sa présence, avec un risque précisé (généralement 5 % ou 1 %) de détection erronnée.
La LDM est calculée à partir de l’écart-type de l’analyse pour l’intervalle des concentrations les plus faibles :
LDM = t0,05, n–1 × S
où : t0,05, n–1 est la valeur du t de Student (test unilatéral) pour un risque de détection erronée de 5 %, à n – 1 degrés de liberté, et S est l’écart-type.
Idéalement, l’écart type est calculé à partir d’une analyse de réplicats de faibles concentrations avec des échantillons réels dont la matrice est identique ou similaire à celle des échantillons considérés. On peut calculer cet écart-type à partir d’un minimum de sept réplicats dans la même série d’analyses en utilisant la formule statistique standard (U.S. EPA, 1984). Toutefois, il est préférable de le calculer à partir de paires de réplicats accumulées sur un grand nombre de séries d’analyses différentes.
L’écart-type de paires de réplicats de faibles concentrations accumulées sur un grand nombre de séries d’analyses se calcule selon l’équation suivante :
![]()
où D est la différence entre les réplicats, et n, le nombre de paires de réplicats. Il est recommandé d’utiliser au moins 40 paires de réplicats (MEO, 1988). Ensuite, on peut introduire dans l’équation de la LDM la valeur de l’écart-type obtenu selon l’une ou l’autre de ces approches.
Les valeurs en dessous de la limite de détection devraient être consignées comme étant « < LDM » avec la LDM pour l’échantillon en question (Fowlie et al., 2001). Il y a habituellement trois façon d’attribuer une valeur aux résultats qui sont « < LDM » au moment de l’analyse des données : établir qu’elle est égale à la LDM, égale à la moitié de la LDM ou égale à 0. Aux fins du Programme d’ESEE, une valeur égale à la moitié de la LDM est utilisée pour l’analyse et l’interprétation des données. Pour de plus amples renseignement sur l’interprétation des données relatives aux concentrations non détectables, se reporter à Helsel (2005a, 2005b) et à Shumway et al. (2002).
5.8.5.8 Conventions relatives à la présentation des données
Des protocoles établis devraient être suivis pour l’arrondissement des résultats des analyses. Si un trop grand nombre de chiffres sont arrondis avant l’analyse des données, il s’ensuit une perte d’information, et des différences réelles de concentrations entre des échantillons provenant de différents sites ou prélevés à différents moments peuvent être masquées. En outre, la précision du contrôle de la qualité peut être inférieure au niveau souhaitable ou nécessaire, et les valeurs de la moyenne, de l’écart type ou d’autres paramètres statistiques se rapportant à un ensemble de résultats peuvent être biaisées. À l’inverse, quand un trop grand nombre de chiffres significatifs sont conservés, des différences relativement faibles et sans signification statistique peuvent sembler plus importantes qu’elles ne le sont en réalité (Hunt et Wilson, 1986).
L’écart type est le critère à utiliser de préférence pour déterminer le nombre de chiffres significatifs (King, 1989). L’arrondissement devrait se faire au chiffre occupant la même position après la virgule que le chiffre le plus significatif de l’écart type calculé. Par exemple, si l’analyse donne un résultat de 12,345 et que l’écart-type calculé d’après l’analyse de réplicats au sein d’une série à cette concentration est de 0,32, il faut arrondir la valeur à 12,3.
5.8.5.9 Précision et exactitude des analyses
La précision est le degré de concordance entre les résultats de l’analyse des réplicats d’un échantillon. Elle est habituelleme nt exprimée sous la forme d’un écart-type. La reproductibilité est l’étroitesse de l’accord entre les résultats de la mesure d’un paramètre obtenus dans différentes conditions de mesure. Elle correspond à l’écart type associé aux mesures d’un échantillon donné obtenues dans différentes séries d’analyses et est appelée précision entre les séries. La précision entre les séries intègre la variabilité due à l’étalonnage effectué en des temps différents, la dérive due à l’instrument et nombre d’autres facteurs.
Les erreurs aléatoires ont une incidence sur la précision, laquelle est un paramètre mesurable et contrôlable. La précision de toutes les analyses devrait être estimée en soumettant des portions aliquotes distinctes à l’ensemble du processus analytique. Les laboratoires devraient vérifier la précision de leurs analyses et pouvoir en rendre compte en se fondant sur des données recueillies sur plusieurs jours. Pour la plupart des paramètres, la précision devrait correspondre à un écart maximal de 10 %. Pour les matières en suspension totales, elle devrait correspondre à un écart maximal de 15 % à des concentrations de plus de 10 fois la LDM. Dans le cas du pH, la précision devrait correspondre à ± 0,1 unité (annexe 3 du REMM).
L’exactitude intègre les biais et la précision d’une méthode d’analyse et reflète la qualité de l’accord entre la valeur mesurée et la vraie valeur d’un paramètre d’un échantillon. Le biais est une erreur systématique occasionnée par une composante du système de mesure qui entraîne une surestimation ou une sous-estimation des valeurs. Divers facteurs peuvent entraîner un biais, dont la contamination de l’échantillon, les pertes mécaniques, les blancs, l’interférence spectrale, les erreurs d’étalonnage ou l’influence des divers utilisateurs. L’exactitude est exprimée sous la forme d’un taux de récupération de concentrations connues, comme des matériaux de référence certifiés, des échantillons enrichis ou des échantillons de référence préparés et analysés par le laboratoire dans les mêmes conditions que les autres échantillons.
Le degré d’exactitude requis dépend de l’utilisation finale à laquelle les données sont destinées. Le laboratoire devrait vérifier l’exactitude des données et pouvoir en rendre compte en se fondant sur des ensembles de données recueillis sur plusieurs jours. L’exactitude devrait correspondre à un écart maximal de 10% dans le cas des métaux et de la plupart des autres paramètres, tandis que l’écart maximal dans le cas des matières totales en suspension devrait être en dedans de 15 %, à des concentrations supérieures à 10 fois la LDM. Enfin, l’exactitude devrait concorder à ± 0,1 unité dans le cas du pH (annexe 3 du REMM).
5.8.6 Assurance de la qualité en laboratoire
L’assurance de la qualité (AQ) englobe de nombreuses activités de gestion et de pratiques techniques internes et externes visant à garantir l’obtention de données de qualité connue convenant à l’utilisation à laquelle elles sont destinées.
Les activités externes d’AQ comprennent la participation à des comparaisons interlaboratoire pertinentes et l’exécution de vérifications par des organismes externes. Ces vérifications peuvent porter sur le rendement des analyses de matériaux de référence étalons ou reposer sur un examen général des pratiques fondé sur la documentation traitant de l’échantillonnage, des méthodes d’analyse et d’AQ/CQ, des résultats des essais et des données justificatives.
5.8.7 Compilation et présentation des données d’AQ/CQ
5.8.7.1 Documentation
Il est recommandé de documenter tous les aspects des analyses afin de confirmer la qualité et la fiabilité des résultats. Le propriétaire ou l’exploitant d’une mine doit conserver tous les registres ou autres documents requis par le Règlement sur les effluents des mines de métaux sur le site de la mine pendant au moins cinq ans (article 27 du REMM). Enfin, pour chaque échantillon ou lot d’échantillons, il est recommandé de conserver les informations suivantes :
- Limites de détection de la méthode (LDM). Toutes divergences entre les LDM et les LDM établies par le laboratoire (en raison d’interférences, de dilutions, etc.) devraient être notées.
- Dates se rattachant aux échantillons. Des registres des dates de prélèvement, de réception, de préparation et d’analyse des échantillons devraient être conservés. Ces renseignements font partie du processus de suivi des échantillons.
- Performance et entretien des instruments. Il convient de tenir un registre de suivi de la performance, ainsi que des réglages et des réponses, des instruments de laboratoire. Les dossiers d’entretien de chaque instrument devraient être conservés.
- Échantillons destinés au contrôle de la qualité. Les registres des résultats d’analyse des duplicata et des blancs, des taux de récupération des blancs enrichis, des analogues et des matrices enrichies et des résultats d’analyse de matériaux de référence certifiés ainsi que les registres de l’étalonnage et de la vérification de l’étalonnage devraient être conservés.
- Réception, préparation et analyse des échantillons. Toutes les anomalies détectées durant la livraison, l’entreposage, la préparation et l’analyse des échantillons, y compris les modifications apportées aux modes opératoires normalisés, devraient être notées.
5.8.7.2 Présentation des données d’AQ/CQ
Les résultats des analyses sont présentés sous la forme d’un rapport d’essais ou d’analyses incluant toutes les informations pertinentes nécessaires pour évaluer la validité des données, y compris les données d’AQ/CQ. Le rapport devrait être exact, clair, non ambigu et objectif, et présenter les informations suivantes :
- titre (p. ex., rapport d’essais, rapport d’analyses, rapport sur la qualité des données);
- nom et adresse du laboratoire ayant effectué les analyses;
- numéro d’identification unique (p. ex., numéro de série ou de groupe) facilitant sa recherche;
- nom et adresse du client;
- identification ou description de l’échantillon analysé;
- état des échantillons (sans agent de conservation, bouteille qui fuit, etc.) lorsque nécessaire;
- date de réception des échantillons et date de publication du rapport;
- méthode(s) d’analyse employée(s) et, s’il y a lieu, description des essais non normalisés réalisés;
- date et méthode de prélèvement des échantillons (échantillons instantanés, échantillons composites prélevés à divers moments, etc.);
- modifications apportées à la méthode d’analyse habituelle (filtration, rectification du pH, ajout d’un étalon, etc.);
- résultats des analyses, et unités clairement indiquées;
- énoncé indiquant si les résultats ont fait l’objet d’une correction en fonction de blancs;
- données de contrôle de la qualité;
- qualité des résultats (p. ex., résultats n’ayant pas passé le CQ, taille insuffisante des échantillons);
- signature de la personne responsable et date d’autorisation du rapport;
- nom du technicien qui a effectué l’essai;
- noms des sous-traitants clairement indiqués;
- mises à jour ou corrections aux rapports clairement indiquées;
- le laboratoire devrait aviser les clients si de nouvelles données invalident les rapports déjà publiés.
Les données inférieures à la limite de détection analytique devraient être clairement consignées en tant que telles ainsi que la LDM applicable pour cet échantillon.
5.9 Références
AQUAMIN. 1996. Évaluation des effets de l’exploitation minière sur le milieu aquatique au Canada. Rapport final. Préparé par les Groupes de travail 7 et 8 d’AQUAMIN pour le Groupe directeur d’AQUAMIN.
ASTM – American Society for Testing and Materials. 1986. Manual on Presentation of Data and Control Chart Analysis. Philadelphia (PA), American Society for Testing and Materials. Committee E-11 on Statistical Methods, ASTM Special Technical Publication 15D.
CALA – Canadian Association for Laboratory Accreditation. 1991. Code of Practice and QA Manual for Laboratory Analysis of Sewage Treatment Effluent in Support of the MISA Program. Rapport préliminaire préparé pour CAEAL et le ministère de l’Environnement de l’Ontario par Zenon Environmental Laboratories.
CCME – Conseil canadien des ministres de l’environnement. 1999. Recommandations canadiennes pour la qualité des eaux : protection de la vie aquatique.
Druschel, G.K., M.A.A Schoonen, D.K. Nordstorm, J.W. Ball, Y. Xu et C.A. Cohn. 2003. « Sulfur geochemistry of hydrothermal waters in Yellowstone National Park, Wyoming, USA. III. An anion-exchange resin technique for sampling and preservation of sulfoxyanions in natural waters », Geochemical Transactions, 4 : 12-19.
ELAP – Environmental Laboratory Approval Program. 1988. Environmental Laboratory Approval Program Certification Manual. New York State Department of Health.
ESG – Ecological Services Group. 1999. AETE Synthesis Report of Selected Technologies for Cost-Effective Environmental Monitoring of Mine Effluent Impacts in Canada. Ottawa (Ontario), Ressources naturelles Canada, CANMET. Rapport préparé pour le programme ETIMA, projet no 4.1.4.
Fowlie, P., D.R. Hart et R. Turle. 2001. Document d’orientation pour l’échantillonnage et l’analyse des effluents des mines de métaux : rapport final. Ottawa (Ontario), Environnement Canada, Service de protection de l’environnement, Division des minéraux et des métaux. Rapport SPE 2/MM/5, ix + 34 pages. Sur le Web : http://dsp-psd.communication.gc.ca/Collection/En49-24-1-39F.pdf.
Helsel, D.R. 2005a. Nondetects and Data Analysis: Statistics for Censored Environmental Data. Hoboken (NJ), Wiley-Interscience. 250 pages.
Helsel, D.R. 2005b. « More than obvious: better methods for interpreting nondetect data », Environmental Science & Technology, 39(20) : 419A-423A.
Hunt, D.T.E., et A.L. Wilson. 1986. The Chemical Analysis of Water; General Principles and Techniques, 2nd edition. London (GB), The Royal Society of Chemistry.
ISO/CEI – Organisation internationale de normalisation/Commission électrotechnique internationale. 2005. Exigences générales concernant la compétence des laboratoires d'étalonnages et d'essais. Norme ISO/IEC 17025:2005.
King, D.E. 1976. Quality Control and Data Evaluation Procedures. Section I. Analytical Responsibility. Rapport spécial pour la Direction des services de laboratoire, Ministère de l’Environnement de l’Ontario.
King, D.E. 1989. Code of Practice for Environmental Laboratories. Rapport spécial pour le ministère de l’Environnement de l’Ontario, ISBN 0-7729-5874-2.
Makhija, R., et A. Hitchen. 1979. « The titrimetric determination of sulphate, thiosulphate and polythionates in mining effluents », Analytica Chimica Acta, 105 (1) : 375-382.
McQuaker, N.R. 1999. Technical Evaluation on Water Quality Design and Analysis Draft. Ottawa (Ont.), Ressources Naturelles Canada, CANMET. Rapport pour le Programme ETIMA, projet no 3.1.1.
MEO – Ministère de l’Environment de l’Ontario. 1988. Estimation of Analytical Detection Limits (MDL). Rapport du Ministère de l’Environment de l’Ontario, ISBN-0-7729-4117-3.
MEEO – Ministère de l’Environnement et de l’Énergie de l’Ontario. 1993. MISA (Municipal/Industrial Strategy for Abatement) Draft Development Document for the Effluent Limits Regulation for the Metal Mining Sector. Toronto (Ontario), Imprimeur de la reine pour l’Ontario.
Nielsen, L.A., et D.L. Johnson (éd.). 1983. Fisheries Techniques. Blacksburg (VA), The American Fisheries Society, Southern Printing Company. 468 pages.
O’Reilly, J.W., G.W. Dicinoski, M.J. Shaw et P.R. Haddad. 2001. « Chromatographic and electrophoretic separation of inorganic sulfur and sulfur–oxygen species », Analytica Chimica Acta, 432 (2) :165-192.
Reiley, M. 2007. « Science, policy, and trends of metals risk assessment at EPA: How understanding metals bioavailability has changed metals risk assessment at U.S. EPA », Aquatic Toxicology, 84 (2) : 292-298.
Schwartz, M., B. Vigneault et J. McGeer. 2006. « Assessing the potential toxicity of thiosalts in the context of the Metal Mining Effluent Regulation ». Présentation faite au 33rd Aquatic Toxicity Workshop, Jasper (Alberta).
Shumway, R.H., R.S. Azari et M. Kayhanian. 2002. « Statistical approaches to estimating mean water quality concentrations with detection limits », Environmental Science & Technology, 36 (15) : 3345-3353.
Taylor, J.K. 1987. Quality Assurance of Chemical Measurements. Chelsea (MI), Lewis Publishers Inc.
U.S. EPA – United States Environmental Protection Agency. 1984. Definition and Procedure for the Determination of the Method Detection Limit - Revision 1.11; Appendix B to Part 136. Federal Register Vol. 49, No. 209, Oct. 26,1984, Part VI, 40 CFR Part 136.
U.S. EPA – United States Environmental Protection Agency. 1990. Proposed Glossary of Quality Assurance Related Terms. QAMS RD-680. Rapport préliminaire.
U.S. EPA – United States Environmental Protection Agency. 2007. Aquatic Life Ambient Freshwater Quality Criteria--Copper 2007 Revision. EPA-822-F-07-001.
Vigneault, B., J. Holdner et J. Bélanger. 2002. Validation of an Anion Exchange Method for the Preservation and Analysis of Thiosalt Speciation in Mining Waste Waters. ; Ottawa (Ontario), Laboratoires des mines et des sciences minérales CANMET. Projet LMSM no 602507.
Annexe 1 : Justifications du choix des paramètres à mesurer aux fins de la caractérisation de l'effluent et du suivi de la qualité de l'eau
Arsenic
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que l'arsenic soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation de l'effluent.
- L'arsenic peut être présent dans les effluents de plusieurs types de mines, notamment les mines d'or, de métaux communs et d'uranium, et ce, dans tout le Canada.
- Selon le document préparatoire de la SMID1 (MEEO, 1993), 26 % des effluents de mines de métaux échantillonnés contenaient de l'arsenic à une concentration moyenne de 0,036 mg/L.
- L'arsenic est bioaccumulable chez le poisson et est reconnu comme toxique pour les organismes aquatiques.
- Selon les Recommandations canadiennes pour la qualité de l'environnement (RCQE)2, la concentration maximale d'arsenic pour la protection des organismes dulcicoles est de 0,005 mg/L (0,0125 mg/L pour les organismes marins).
Cuivre
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le cuivre soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le cuivre peut être présent dans les effluents de plusieurs types de mines, en particulier les mines d'or et de métaux communs, et ce, dans tout le Canada.
- Le document préparatoire de la SMID (MEEO, 1993), révèle que 39 effluents échantillonnés sur une période de 12 mois en Ontario renfermaient du cuivre à une concentration moyenne de 0,07 mg/L.
- Le cuivre est reconnu comme toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de cuivre pour la protection des organismes dulcicoles varie de 0,002 à 0,004 mg/L, selon la dureté de l'eau.
Plomb
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le plomb soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le plomb peut être présent dans les effluents de plusieurs types de mines, en particulier les mines de métaux communs, et ce, dans tout le Canada.
- Selon le document préparatoire de la SMID (MEEO, 1993), 20 % des effluents de mines de métaux échantillonnés contenaient du plomb à une concentration moyenne de 0,02 mg/L.
- Le plomb est reconnu comme toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de plomb pour la protection des organismes dulcicoles varie de 0,001 à 0,007 mg/L, selon la dureté de l'eau.
Nickel
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le nickel soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le nickel peut être présent dans les effluents d'un large éventail de types de mines, en particulier les mines de métaux communs et d'uranium, et ce, dans toutes les régions du Canada.
- Selon le document préparatoire de la SMID (MEEO, 1993), 68 % des effluents de mines de métaux échantillonnés renfermaient du nickel, dont la concentration moyenne était de 0,14 mg/L.
- Le nickel est reconnu comme toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de nickel pour la protection des organismes dulcicoles doit se situer entre 0,025 et 0,150 mg/L, selon la dureté de l'eau.
pH
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le pH soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Les effluents rejetés par un grand nombre de mines de différents types peuvent présenter un pH trop élevé ou trop faible, et ce, dans l'ensemble du Canada.
- Comme le pH détermine souvent la solubilité des espèces métalliques, il est lié à la toxicité des effluents.
- Les eaux dont le pH est excessivement élevé ou excessivement faible sont reconnues comme toxiques pour les organismes aquatiques.
- Selon les RCQE, l'intervalle de pH pour la protection des organismes dulcicoles oscille entre 6,5 et 9,0 (7,0 à 8,7 en milieu marin ou estuarien).
Radium 226
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le radium 226 soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le radium 226 est présent principalement dans les effluents des mines d'uranium. Par conséquent, il ne se retrouve pas partout au Canada.
- Les RCQE,ne font pas mention du radium 226.
Cyanures totaux
- Le cyanure est utilisé comme réactif dans la plupart des mines d'or et dans certaines mines de métaux communs.
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que les exploitations qui se servent de cyanure comme réactif incluent le cyanure dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Selon le document préparatoire de la SMID (MEEO, 1993), 54 % des effluents de mines de métaux échantillonnés contenaient du cyanure à une concentration moyenne de 0,084 mg/L (mines d'or) ou de 0,006 mg/L (mines de métaux communs).
- Le cyanure est reconnu comme toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de cyanures libres pour la protection des organismes dulcicoles est de 0,005 mg/L.
Matières totales en suspension
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que les matières totales en suspension soient inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Des matières en suspension peuvent être présentes dans les effluents de tous les types de mine, et ce, partout au Canada;
- Selon le document préparatoire de la SMID (MEEO, 1993), 80 % des effluents de mines de métaux échantillonnés contenaient des matières en suspension à une concentration moyenne de 7 mg/L.
- Les matières en suspension peuvent non seulement tuer directement les poissons en obstruant leurs branchies, mais aussi altérer l'habitat du poisson en étouffant ces habitats, en contaminant les sédiments ou en entravant la pénétration de la lumière dans les eaux réceptrices.
Zinc
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le zinc soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le zinc peut être présent dans les effluents d'un large éventail de types de mines, en particulier les mines de métaux communs, et il est vraisemblablement répandu dans tout le Canada.
- Selon le document préparatoire de la SMID (MEEO, 1993), 76 % des effluents des mines de métaux échantillonnés contenaient du zinc à la concentration moyenne de 0,07 mg/L.
- Le zinc est reconnu comme toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de zinc pour la protection des organismes dulcicoles est de 0,030 mg/L.
Alcalinité
- L'alcalinité renseigne sur la capacité tampon de l'eau et donne une indication de la sensibilité de l'eau aux variations du pH.
- L'alcalinité influe sur le devenir et la biodisponibilité des métaux.
Aluminium
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que l'aluminium soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- L'aluminium est présent dans un certain nombre d'importants minéraux lithogénétiques; les effluents des bassins de décantation et de stockage des résidus de différents types de mines peuvent également contenir des ions d'aluminium dissous ainsi que de l'aluminium lié chimiquement sous forme d'argile ou d'autres particules minérales silico‑alumineuses.
- Selon le document préparatoire de la SMID (MEEO, 1993), 70 % des effluents des mines de métaux échantillonnés en Ontario contenaient de l'aluminium à une concentration moyenne de 0,20 mg/L.
- Ce document indiquait également que l'aluminium dissous n'est pas une composante importante de la plupart des effluents de mines de métaux.
- Selon les RCQE, la concentration maximale d'aluminium pour la protection des organismes dulcicoles varie de 0,005 à 0,100 mg/L, selon la dureté de l'eau.
- L'aluminium est reconnu comme toxique pour les organismes aquatiques, et sa toxicité varie en fonction du pH de l'eau.
- Les données sur l'aluminium peuvent aider à interpréter les impacts potentiels des métaux et d'autres paramètres.
Cadmium
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le cadmium soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le cadmium est présent dans relativement peu de types de minerai, par contre il est probable qu'il soit présent dans les effluents miniers à l'échelle du Canada.
- Selon le document préparatoire de la SMID (MEEO, 1993), 12 % des effluents de mines de métaux échantillonnés contenaient du cadmium à une concentration moyenne de 0,003 mg/L.
- Le cadmium est reconnu comme toxique pour les organismes aquatiques et comme bioaccumulable.
- Selon les RCQE, la concentration maximale de cadmium pour la protection des organismes dulcicoles est de 0,000017 mg/L. Veuillez noter que la formule permettant d'ajuster la recommandation en fonction de la dureté de l'eau est comme suit : recommandation pour le cadmium = 10{0,86[log(dureté)]-3,2} (0,12 µg/L en milieu marin)
Fer
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le fer soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le fer est présent dans pratiquement tous les types de minerais et se rencontre dans les secteurs miniers à l'échelle du Canada.
- Selon le document préparatoire de la SMID (MEEO, 1993), 100 % des effluents de mines de métaux échantillonnés renfermaient du fer à une concentration moyenne de 0,45 mg/L.
- Le fer est toxique pour les organismes aquatiques, et les précipités d'hydroxyde de fer peuvent avoir des effets nocifs sur l'habitat du poisson.
- Selon les RCQE, la concentration maximale de fer pour la protection des organismes dulcicoles est de 0,30 mg/L.
- Le fer peut également avoir une incidence déterminante sur le devenir d'autres contaminants.
- Les données sur le fer peuvent aider à l'interprétation des impacts potentiels des métaux ou d'autres paramètres.
Composés azotés (ammoniac et nitrates)
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que l'ammoniac total soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Les explosifs utilisés dans la plupart des mines contiennent des composés azotés, et des résidus de ces explosifs peuvent se retrouver dans les effluents. La dégradation du cyanure peut également entraîner la formation de composés azotés dans les effluents.
- Pendant l'élaboration de la SMID, en Ontario, les concentrations d'ammoniac et d'ammonium, d'azote total Kjeldahl et de nitrates et nitrites ont été mesurées dans des effluents.
- 100 % des effluents de mines de métaux échantillonnés (50) contenaient de l'ammoniac + ammonium aux concentrations moyennes de 1,4 mg/L (mines de métaux communs) et de 6,3 mg/L (mines d'or).
- 96 % des effluents de mines de métaux échantillonnés contenaient de l'azote total Kjeldahl à une concentration moyenne de 8 mg/L.
- 90 % des effluents de mines de métaux échantillonnés contenaient des nitrates et nitrites à une concentration moyenne de 8,8 mg/L.
- Les composés azotés peuvent être toxiques pour les organismes aquatiques. En outre, comme ils sont des éléments nutritifs, ils peuvent stimuler de façon excessive la croissance des végétaux. Une telle croissance peut entraîner un appauvrissement en oxygène suffisamment important pour causer la mort des poissons.
- Selon les RCQE, la concentration d'ammoniac total maximale pour la protection des organismes dulcicoles varie de 1,370 à 2,200 mg/L, selon la température et le pH de l'eau.
- La valeur provisoire proposée au titre de ces mêmes recommandations pour la concentration des nitrates est de 13 mg/L en eau douce (16 mg/L en milieu marin).
- Selon ces mêmes recommandations, la concentration maximale de nitrites pour la protection des organismes dulcicoles est de 0,060 mg/L.
Mercure
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le mercure soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le mercure est présent dans différents types de roche. Il se rencontre dans les mines d'or et d'argent et, moins fréquemment, dans les mines de métaux communs, et ce, partout au Canada.
- Le mercure provient de diverses sources, notamment de sources éloignées d'où il est transporté par voie atmosphérique, ainsi que de sources naturelles et d'effluents miniers. Par conséquent, les groupes de travail d'AQUAMIN estiment qu'il est souvent difficile de déterminer la source d'une contamination par le mercure dans un milieu aquatique. C'est sur cette base qu'ils ont recommandé que le mercure soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le document préparatoire de la SMID (MEEO, 1993) indique que 14 % des effluents de mines de métaux échantillonnés contenaient du mercure à une concentration moyenne de 0,0002 mg/L.
- Le mercure est toxique pour les organismes aquatiques, et sa bioamplification à travers les chaînes alimentaires représente un problème important.
- Selon les RCQE, la concentration maximale de mercure pour la protection des organismes dulcicoles est de 0,026 μg/L pour le mercure inorganique et de 0,004 μg/L pour le méthylmercure; elle est de 0,016 μg/L pour le mercure inorganique en milieu marin.
Molybdène
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le molybdène soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Ce métal se rencontre principalement dans les minerais d'uranium, mais aussi dans les minerais de métaux communs et dans un petit nombre de minerais d'or; il n'est cependant pas répandu à l'échelle du Canada.
- Le molybdène peut être toxique pour les organismes aquatiques, mais sa toxicité est mal connue.
- Il peut également réduire la qualité de l'eau potable et causer la molybdénose chez les bovins d'élevage.
- Selon les RCQE, la concentration maximale de molybdène pour la protection des organismes dulcicoles est de 0,073 mg/L.
Dureté
- La dureté correspond à la quantité de cations, principalement bivalents, dissous dans l'eau.
- Le calcium et le magnésium étant les principaux facteurs responsables de la dureté de l'eau, les concentrations de ces ions peuvent servir de base au calcul de ce paramètre.
- La dureté a une incidence déterminante sur le devenir, la biodisponibilité et la toxicité des métaux.
Sélénium
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont jugé de ne pas inclure le sélénium dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Selon le document préparatoire de la SMID (MEEO, 1993), 10 % des effluents de mines de métaux échantillonnés contenaient du sélénium à une concentration moyenne de 0,007 mg/L.
- Le sélénium se rencontre le plus souvent en association avec le soufre, mais il est rarement présent dans les effluents miniers.
- Le sélénium est toxique pour les organismes aquatiques.
- Selon les RCQE, la concentration maximale de sélénium pour la protection des organismes dulcicoles est de 0,001 mg/L.
Conduc-
tivité électrique
- La conductivité est une mesure de la capacité de l'eau à conduire un courant électrique.
- La conductivité peut être mesurée sur le terrain ou en laboratoire.
- La conductivité fournit une mesure approximative des matières totales en suspension et peut faciliter la localisation des panaches de l'effluent en eau douce.
Oxygène dissous
- La teneur en oxygène dissous peut être mesurée sur le terrain ou en laboratoire.
- La teneur en oxygène dissous influe sur le devenir et la biodisponibilité des métaux.
Température
- Les variations de température peuvent modifier les propriétés limnologiques des lacs et avoir des effets néfastes pour les organismes aquatiques.
- Selon les RCQE, pour la protection des organismes d'eau douce, les hausses de température ne devraient pas altérer la stratification thermique ou les dates de renversement des eaux ni entraîner un dépassement des températures hebdomadaires maximales moyennes et des températures maximales sur de courtes périodes.
Calcium
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que le calcium soit inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le calcium est un important cation présent dans les écosystèmes aquatiques, et il peut également être présent dans les effluents miniers en cas d'utilisation de chaux pour la neutralisation d'acides.
- Le calcium rejeté par les mines peut avoir des effets sur l'habitat du poisson.
- La connaissance des concentrations de calcium est essentielle pour le calcul de la dureté de l'eau.
- Le calcium influe sur la toxicité des métaux et/ou d'autres paramètres des effluents miniers.
- Les données sur le calcium peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
Chlorures
- Selon le document préparatoire de la SMID (MEEO, 1993), 80 % des effluents de mines de métaux échantillonnés contenaient des chlorures à une concentration moyenne de 83 mg/L.
- Les chlorures peuvent influer sur la toxicité des métaux et/ou d'autres paramètres des effluents miniers.
- Les données sur les chlorures peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
Fluorures
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que les fluorures soient inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents dans le cas des exploitations où leur présence est probable.
- Les fluorures sont présents dans un nombre limité de types de minerai, et ils ne sont vraisemblablement pas présents partout au Canada.
- Il se bioaccumulent dans les squelettes des poissons, mais leurs effets sur les organismes aquatiques demeurent méconnus.
- Les fluorures ont des effets létaux sur les poissons à des concentrations de 10 à 200 mg/L.
- Les fluorures ont été déclarés toxiques à la suite d'une évaluation des substances contenues dans la première liste des substances d'intérêt prioritaire, du fait qu'ils peuvent avoir, immédiatement ou à long terme, un effet nocif sur l'environnement.
Magnésium
- Le magnésium est un important cation dans les écosystèmes aquatiques; la connaissance des concentrations de magnésium est essentielle pour le calcul de la dureté de l'eau.
- Le magnésium influe sur la toxicité des métaux et/ou d'autres paramètres des effluents miniers.
- Les données sur le magnésium peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
Manganèse
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont jugé de ne pas inclure le manganèse dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Le manganèse est présent dans de nombreux types de minerai, et ce, dans toutes les régions du Canada, étant donné que ce métal constitue 0,1 % de la croûte terrestre.
- Les RCQE concernant la protection des organismes dulcicoles ne font pas mention du manganèse.
- Le manganèse peut exercer une grande influence sur le devenir d'autres contaminants, spécialement sur la disponibilité d'autres métaux.
- Ce métal est toxique pour les organismes aquatiques, mais les facteurs qui déterminent sa toxicité demeurent méconnus.
Potassium
- Le potassium influe sur la toxicité des métaux et/ou d'autres paramètres des effluents miniers.
- Les données sur le potassium peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
Sodium
- Le sodium influe sur la toxicité des métaux et/ou d'autres paramètres des effluents miniers.
- Les données sur le sodium peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
Sulfates
- Les sulfates sont des anions importants dans l'eau.
- Les effluents des mines contenant du minerai sulfuré peuvent être d'importantes sources de sulfates.
- Les données sur les sulfates peuvent faciliter l'interprétation des effets potentiels des métaux et d'autres paramètres.
- Selon le document préparatoire de la SMID, 86 % des effluents de mines de métaux échantillonnés contenaient des sulfates à une concentration moyenne de 644 mg/L.
Phosphore total
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) n'ont pas inclus le phosphore total dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- Selon le document préparatoire de la SMID (MEEO, 1993), 24 % des effluents de mines de métaux échantillonnés contenaient du phosphore total à une concentration moyenne de 0,1 mg/L.
- Le phosphore total se rencontre dans les effluents miniers à l'état dissous ou particulaire.
- Le phosphore total étant un élément nutritif, il peut stimuler la croissance des végétaux de façon excessive.
Uranium
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) n'ont pas inclus l'uranium dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents.
- L'uranium est présent en petite quantité dans de nombreux types de roches au Canada, mais il se rencontre essentiellement dans les effluents des mines d'uranium.
- Selon le document préparatoire de la SMID (MEEO, 1993), 22 % des effluents de mines de métaux échantillonnés renfermaient de l'uranium à une concentration moyenne de 0,06 mg/L.
- Il a été démontré que l'uranium est bioaccumulable chez les poissons.
Thiosels totaux
- Les groupes de travail 7 et 8 d'AQUAMIN (1996) ont recommandé que les thiosels totaux soient inclus dans la liste des paramètres à mesurer aux fins de la caractérisation des effluents (les thiosels totaux sont mentionnés au tableau 4.1 du rapport d'AQUAMIN, mais de manière non explicite dans le texte du rapport) et que leur impact fasse l'objet d'un suivi dans le cadre de l'ESEE.
- Les thiosels constituent un groupe d'anions oxysulfurés métastables formés par oxydation partielle des minéraux sulfurés pendant le traitement.
- Les thiosels sont relativement peu toxiques, mais leur oxydation dans les milieux aquatiques peut abaisser fortement le pH de l'eau.
- Les thiosels ont été associés à la diminution de populations de poissons et d'organismes benthiques.
- Des thiosels peuvent se former dans les exploitations minières qui ont recours à la flottation pour la séparation des minéraux sulfurés, mais seulement quelques mines au Canada ont signalé des problèmes causés par les thiosels.
Carbone organique dissous et carbone organique total
- Les teneurs en carbone organique dissous et en carbone organique total ont une incidence déterminante sur le devenir et la biodisponibilité des métaux.
Salinité
- La salinité est un important paramètre dans les milieux marins et peut être une source de contamination dans certaines mines d'uranium.
Profondeur optique ou transparence
- Mesurée sur le terrain, la profondeur optique est une mesure du degré de pénétration de la lumière dans l'eau et dépend de la couleur (matières dissoutes) et de la turbidité (matières en suspension) de l'eau.
- La profondeur optique se mesure à l'aide d'un disque de Secchi ou d'un turbidimètre.
- Un faible degré de pénétration de la lumière peut réduire la productivité primaire dans l'eau et la capacité des prédateurs à trouver des proies.
Profondeur de l'eau
- La profondeur peut agir sur la température et la teneur en oxygène dissous de l'eau et sur le degré de dilution des effluents, autant de paramètres qui influent sur la toxicité des effluents.
Thallium
- Les mines de métaux peuvent être une source de thallium dans les environnements aquatiques.
- La recommandation du CCME pour la qualité de l'eau pour la protection de la vie aquatique est de 0,0008 mg/L.
1 Dans le document préparatoire de la Stratégie municipale et industrielle de dépollution (SMID) du MEEO (1993), cité tout au long de cette annexe, sont résumés les résultats de travaux poussés de caractérisation d'effluents de mines de toutes les régions de l'Ontario, effectués au début des années 1990. Ces résultats ne sont pas représentatifs du niveau de qualité actuel des effluents miniers à l'échelle du Canada.
2 Les Recommandations canadiennes pour la qualité de l'environnement (RCQE) sont citées tout au long de cette annexe dans le but de fournir une évaluation préliminaire des concentrations dans les effluents quant à leur importance sur le plan écologique et à leurs effets potentiels sur les milieux récepteurs (CCME, 1999) en ligne à http://ceqg-rcqe.ccme.ca/?lang=fr.
Tableaux
Le tableau 5-1 présente les paramètres mesurés pour la caractérisation de l’effluent et le suivi de la qualité de l’eau. Les paramètres de la qualité de l’effluent sont associés aux paramètres de la qualité de l’eau et aux paramètres particuliers du site.
Le tableau 5-2 présente un sommaire des utilisations recommandées des blancs et des duplicata sur le terrain et en laboratoire. Le nombre d’échantillons, le type de contrôle de la qualité (interne ou sur le terrain), les limites de contrôle, ainsi qu’une description sont indiqués pour chaque paramètre.
Le tableau de l’annexe 1 du chapitre 5 décrit les justifications du choix des paramètres à mesurer aux fins de la caractérisation de l’effluent et du suivi de la qualité de l’eau. Les différentes sections comprennent les substances nocives et le pH selon l’annexe 3 du REMM, les paramètres inscrits à l’annexe 5 du REMM aux fins de la caractérisation des effluents et du suivi de la qualité de l’eau, les paramètres prescrits aux fins du suivi de la qualité de l’eau seulement, les autres paramètres propres au site dont la mesure est recommandée aux fins de la caractérisation des effluents et du suivi de la qualité de l’eau, les paramètres dont la mesure est recommandée aux fins de la caractérisation des effluents seulement et les paramètres propres au site dont la mesure est recommandée aux fins du suivi de la qualité de l’eau seulement.
- Date de modification :